-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaTebentafusp
Autoři: S. Vokurka
Působiště autorů: Onkologická a radioterapeutická klinika LF v Plzni UK a FN Plzeň
Vyšlo v časopise: Klin Onkol 2022; 35(6): 502-507
Kategorie: Lékový profil
Úvod
Uveální melanom, i když je nejčastější nitrooční malignitou u dospělých, je celkově vzácným novotvarem s výskytem 5 případů na 1 mil. obyvatel a s rizikem rozvoje metastatického onemocnění u 20–30 % pacientů do 5 let od diagnózy a u 50 % pacientů do 15 let [1–3]. S ohledem na biologické charakteristiky uveálního melanomu, např. nízkou mutační nálož, nepřináší léčba metastatických onemocnění s využitím imunoterapie inhibitorů kontrolních bodů srovnatelně dobré výsledky známé u melanomu kožního, nehledě na omezení úhrad z veřejného zdravotního pojištění [4–6]. Naprosto zásadní molekulou se tak pro tuto diagnózu a vybrané pacienty stává tebentafusp.
Tebentafusp
Tebentafusp je bispecifický fúzní protein, který má doménu charakteru receptoru TCR zacíleného na vazbu s antigenem gp100 prezentovaným v rámci komplexu lidských leukocytárních antigenů (human leukocyte antigens – HLA) HLA-A*02 : 01 na povrchu nádorové buňky melanomu, a který má současně efektorovou část charakteru anti-CD3 s možností vazby a aktivace cirkulujícího cytotoxického T–lymfocytu s uvolněním cytokinů a navozením následné smrti nádorové buňky (obr. 1).
Obr. 1. Mechanizmus účinku molekuly tebentafuspu – bispecifického proteinu ze skupiny ImmTAC (immune mobilizing monoclonal T-cell receptors against cancer). 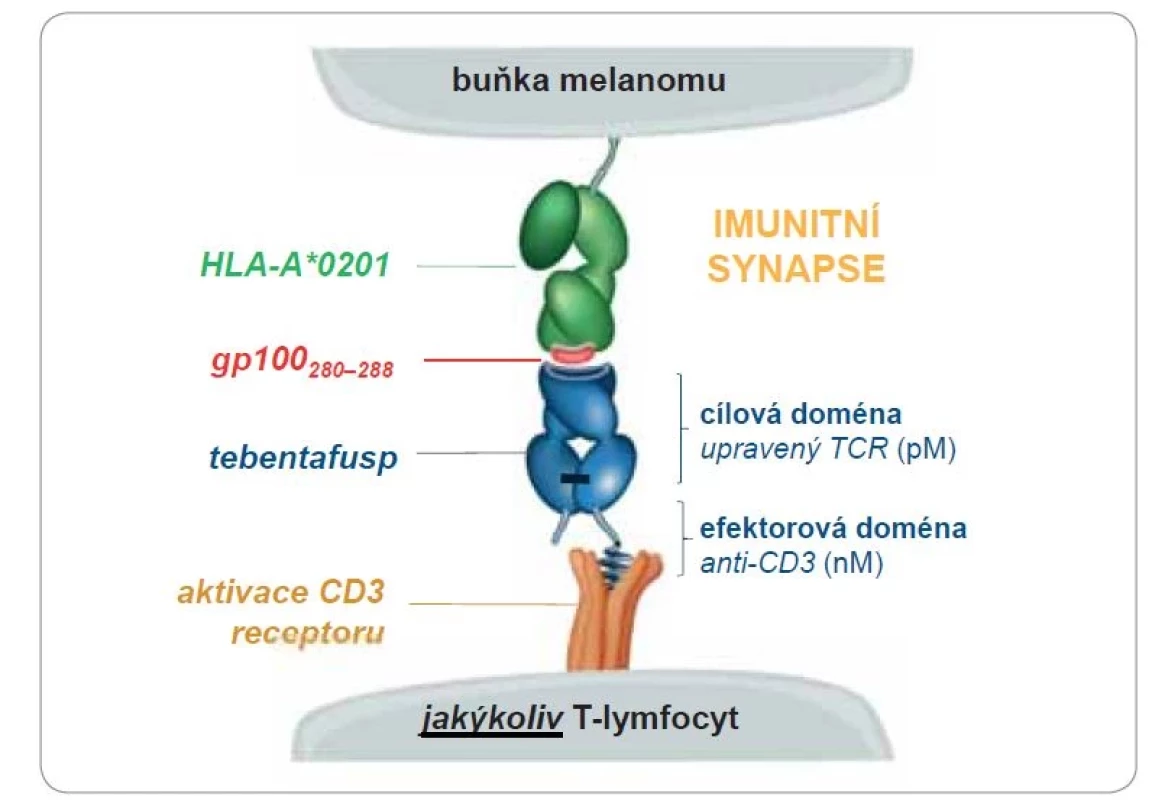
Část molekuly léčiva s doménou TCR (cílová doména) se váže a vytváří synapsi s komplexem HLA a prezentovaným antigenem gp100 asociovaným s nádorovou buňkou. Část léčiva s fragmentem anti-CD3 (efektorová doména) se následně váže na CD3 antigen cirkulujících T-lymfocytů a spouští proces smrti nádorových buněk [7]. Převzato z [19].
HLA – lidské keukocytární antigeny, nM – nanomol, pM – pikomol, TCR – receptor T-lymfocytůTebentafusp je prvním zástupcem této třídy bispecifických „přesměrovačů“ T-lymfocytů označovaných jako ImmTAC (immune mobilizing monoclonal T-cell receptors against cancer) [7,8]. Vazba tebentafuspu je závislá na HLA, respektive komplexu HLA s prezentovaným cílovým peptidovým antigenem (komplex peptid-HLA). Tkáňový diferenciační antigen gp100 je vysoce exprimovaný u melanomů s trvale vyšší expresí u melanomu uveálního oproti kožnímu, současně je slabě exprimovaný v normálních melanocytech a minimálně pak v nemelanocytárních buňkách [9]. Tebentafusp nebyl aktivní proti gp100 negativním buňkám a stupeň účinnosti léčiva koreloval se zvýšenou expresí gp100 a HLA-A2 [10]. Silná afinita tebentafuspu ke komplexu gp100 a HLA-A*02 : 01 z něj činí atraktivní cíl pro léčbu uveálního melanomu, nicméně limitací je současně exkluzivita vazby v kontextu HLA-A*02 : 01, když tento podtyp HLA je vyjádřen přibližně u poloviny lidí europoidní rasy. Pozorovaná aktivace také podskupiny CD4+ lymfocytů naznačuje, že tebentafusp může zapojit tyto paměťové T-lymfocyty a indukovat setrvalou imunitně zprostředkovanou protinádorovou aktivitu [7,11].
Účinnost, klinické výsledky
Ve studii IMCgp100-102 fáze II bylo zařazeno 127 pacientů s pozitivitou HLA-A*02 : 01, mediánem věku 61 let a většinou se se špatnými prognostickými charakteristikami, vč. zvýšené hladiny laktátdehydrogenázy (58 %) a s průměrem jaterních metastáz ≥ 3 cm (54 %). Jedna třetina pacientů podstoupila již dvě nebo více předchozích linií léčby, 73 % bylo předléčeno kombinovanou imunoterapií. Léčebné odpovědi dosáhlo 5 % pacientů (všichni parciální remise), stabilní onemocnění bylo u 45 % pacientů. Přes takto nízké zastoupení odpovědí byl medián OS 16,8 měsíce (95% CI 12,9–21,3 měsíce) a přežití 1 rok 62 % (95% CI 53–70 %) [12].
Recentní studie fáze III IMCgp100-202 [13] randomizovala 378 doposud neléčených a HLA-A*02 : 01 pozitivních pacientů s pokročilým uveálním melanomem v poměru 2 : 1 do léčby s tebentafuspem (n = 252) nebo dle volby zkoušejících do léčby s dakarbazinem, ipilimumabem nebo pembrolizumabem (n = 126). Do studie mohli být zařazeni pacienti, kteří v minulosti podstoupili chirurgickou resekci nebo byli předtím léčeni adjuvantní a neoadjuvantní léčbou pro nemetastatické onemocnění. Klíčové klinické charakteristiky, včetně laktátdehydrogenázy, alkalické fosfatázy, výkonnostního stavu dle Eastern Cooperative Oncology Group (ECOG), věku a pohlaví byly podobné mezi porovnávanými skupinami. Při mediánu sledování 14,1 měsíce naplnila studie svůj primární cíl a potvrdila dosažení celkového přežití (overall survival – OS) s hodnotou HR o 0,51 (95% CI 0,37–0,71). Jednoleté OS ve skupině léčené tebentafuspem oproti skupině kontrolní bylo 73 % vs. 59 % a medián OS byl 21,7 vs. 16,0 měsíce (p < 0,0001) (graf 1). Po 6 měsících léčby bylo přežití bez progrese u 31 % pacientů léčených tebentafuspem oproti 19 % v kontrolní skupině (HR 0,73; 95% CI 0,58–0,94; p = 0,01) a do dne 100 se progrese jako nejlepší celková léčebná odpověď objevila u 52 % (130/252) vs. 60 % (76/126) pacientů. Tyto údaje, spolu se slibnými údaji o přežití ze studie fáze II [12] navzdory nízké míře léčebných odpovědí naznačují, že i přes progresivní onemocnění na základě radiografického hodnocení mohou mít pacienti nadále klinický prospěch z léčby tebentafuspem v podobě zlepšeného OS. Zatímco tedy u jiných malignit koreluje celková léčebná odpověď založená na radiografickém hodnocení podle kritérií RECIST s celkovým přežitím, v případě tebentafuspu tomu tak zcela není. Hypotézy pro vysvětlení tohoto pozorování zahrnují úvahy o infiltraci T-lymfocytů do tumoru s rozvojem obrazu pseudoprogrese, možnost opožděného nástupu imunitních odpovědí, případně terapií navozené změny v kinetice růstu nádoru. Tradiční hodnocení léčebné odpovědi zde tedy nemusí dostatečně odrážet odpověď nádoru na léčbu, když rozvoj klinického účinku může vyžadovat více času [14,15].
Graf 1. Celkové přežití pacientů ve skupině léčené tebentafuspem oproti skupině kontrolní s volbou dle volby zkoušejících (dakarbazin, ipilimumab, pembrolizumab) [13]. Převzato z [20]. ![Celkové přežití pacientů ve skupině léčené tebentafuspem oproti skupině kontrolní s volbou dle volby zkoušejících (dakarbazin,
ipilimumab, pembrolizumab) [13]. Převzato z [20].](https://pl-master.mdcdn.cz/media/image_pdf/c2fe07dc6facbf7b2e1e017fce691e59.jpg?version=1670588195)
Celkové přežití bylo statisticky významné ve prospěch tebentafuspu ve srovnání s léčbou zvolenou zkoušejícím (kontrolní skupina) s HR 0,51 (0,36–0,71); p < 0,0001. Časná a pokračující separace Kaplan-Meierových křivek při mediánu délky následného sledování 14,1 měsíce ukazuje prodloužení mediánu celkového přežití u tebentafuspu o 6 měsíců. Jednoleté relativní přežití dosáhlo ve skupině léčené tebentafuspem 73,2 % a v kontrolní skupině (volba léčby zkoušejícím) 58,5 %
CI – interval spolehlivosti, HR – poměr rizik, OS – celkové přežitíBezpečností profil
Nejčastější nežádoucí účinky spojené s léčbou tebentafuspem zahrnují především reakce zprostředkované cytokiny a kožní nežádoucí účinky. Nežádoucí účinky vázané na reakce z uvolnění cytokinů zahrnovaly ve studii fáze II horečku (80 %), zimnici (64 %), nevolnost (59 %), hypotenzi (41 %) a hypoxii (4 %) [16]. V post-hoc recenzi s využitím kritérií Americké společnosti pro transplantaci a buněčnou terapii (ASTCT) [17] prodělalo 109/127 (86 %) léčených pacientů jakýkoli stupeň syndromu z uvolnění cytokinů (cytokine release syndrome – CRS), přičemž většina měla reakci stupně 1 (33 %) nebo 2 (49 %) a méně pak stupeň 3 (3,1 %) a jednou stupeň 4 (0,8 %). Případy CRS byly omezené na aplikaci první nebo druhé dávky tebentafuspu s nástupem rozvoje do 24 hodin od aplikace a obvykle vymizením během dvou dní. Pacienti byli běžně přijímáni k hospitalizaci k aplikaci léčby a na 24 hodin k pozorování se zajištěním nitrožilní tekutinové hydratace během prvních tří dávek tebentafuspu s následně pak již léčbou obvykle v ambulantním režimu. Pouze 2 ze 127 pacientů ukončili léčbu z důvodu CRS.
Dermatologické nežádoucí účinky, u kterých se předpokládá souvislost s cílením tebentafuspu i na populaci kožních melanocytů rovněž exprimujících gp100, zahrnují akutní projevy jako svědění a vyrážka, a opožděnější toxicity pak v podobě vitiliga a depigmentace vlasů, řas, a obočí. Ve studii fáze III [13] se u 245 pacientů léčených tebentafuspem objevovala vyrážka (82 %), svědění (68 %), pigmentové změny na kůži nebo vlasech (45 %) a erytém (28 %). Zatímco se vyrážka, erytém a svědění obvykle objevila v prvních 4 týdnech, ke změnám pigmentace kůže nebo vlasů došlo po mediánu 2,7 měsíce. Pacienti léčení tebentafuspem, u kterých se rozvinula vyrážka v 1. týdnu, měli výrazně delší přežití ve srovnání s kontrolní skupinou (HR 0,35; 95% CI 0,23–0,53; p < 0,0001) nicméně vyrážka nebyla hodnocena jako nezávislý prediktor v multivariantní analýze a přežití bylo vyšší i u pacientů na tebentafuspu bez rozvoje vyrážky do 3. týdne oproti pacientům v kontrolní skupině.
Aplikace léčby
Podání léčiva za hospitalizace je doporučeno alespoň pro první tři dávky s dobou sledování příznaků rozvoje CRS po dobu alespoň 16 hodin. Doporučená dávka přípravku je 20 µg v den 1, dále 30 µg v den 8, dále 68 µg v den 15 a poté 68 µg každý týden, dokud je klinický přínos a není nepřijatelná toxicita. Podání léčiva je intravenózní s doporučenou dobou infuze 15 až 20 minut. Pro minimalizaci rizika hypotenze spojené se syndromem uvolnění cytokinů lze s ohledem na stav pacienta doporučit intravenózně aplikaci tekutin před zahájením infuze tebentafuspu. U pacientů s již existující nedostatečností nadledvin na udržovacích systémových kortikosteroidech by měla být zvážena úprava dávky kortikosteroidů pro zvládnutí rizika hypotenze. Pokud je dávka 68 µg tebentafuspu tolerována, mohou být další aplikace podávány ambulantně se sledováním po dobu minimálně 60 minut po každé infuzi a po 3 měsících ambulantní léčby bez přerušení déle než 2 týdny může být doba sledování minimálně 30 minut [18].
Závěry
U tebetanfuspu jako u vůbec prvního léčiva byl v rámci randomizované studie prokázán jasný přínos v podobě celkového přežití u pacientů s metastatickým uveálním melanomem. Současně představuje první terapeutikum na bázi T-buněčných receptorů (TCR), které prokázalo přínos pro přežití při léčbě solidních malignit. Nežádoucí účinky související s imunitní reakcí a uvolněním cytokinů a kožní toxicita se vyskytovaly často, ale většina případů byla nízkého stupně. Lékové agentury FDA a EMA udělily v roce 2021 registraci tebentafuspu, který je indikován jako monoterapie pro léčbu dospělých pacientů s neresekovatelným nebo metastatickým uveálním melanomem s pozitivním lidským leukocytárním antigenem (HLA) -A*02 : 01 [18]. Do budoucna jsou dalšími výzvami např. otázky potřeby trvalé aplikace v týdenním intervalu, účinnost tebentafuspu v adjuvanci, možnosti kombinace nebo spíše sekvenčního podávání s imunoterapií, nebo vývoj molekul cílených na gp100 ve vazbě na jiné subtypy HLA [15].
Zdroje
1. Jager MJ, Shields CL, Cebulla CM et al. Uveal melanoma. Nat Rev Dis Primers 2020; 6 (1): 24. doi: 10.1038/s41572-020-0158-0.
2. Singh AD, Turell ME, Topham AK. Uveal melanoma: trends in incidence, treatment, and survival. Ophthalmology 2011; 118 (9): 1881–1885. doi: 10.1016/j.ophtha.2011.01.040.
3. Kujala E, Mäkitie T, Kivelä T. Very long-term prognosis of patients with malignant uveal melanoma. Invest Ophthalmol Vis Sci 2003; 44 (11): 4651–4659. doi: 10.1167/iovs.03-0538.
4. Pelster MS, Gruschkus SK, Bassett R et al. Nivolumab and ipilimumab in metastatic uveal melanoma: results from a single-arm phase II study. J Clin Oncol 2021; 39 (6): 599–607. doi: 10.1200/JCO.20.00605.
5. Khan S, Carvajal RD. Dual immunological checkpoint blockade for uveal melanoma. J Clin Oncol 2021; 39 (6): 554–556. doi: 10.1200/JCO.20.03274.
6. Furney SJ, Pedersen M, Gentien D et al. SF3B1 mutations are associated with alternative splicing in uveal melanoma. Cancer Discov 2013; 3 (10): 1122–1129. doi: 10.1158/2159-8290.CD-13-0330.
7. Damato BE, Dukes J, Goodall H et al. Tebentafusp: T cell redirection for the treatment of metastatic uveal melanoma. Cancers (Basel) 2019; 11 (7): 971. doi: 10.3390/cancers11070971.
8. Liddy N, Molloy PE, Bennett AD et al. Production of a soluble disulfide bond-linked TCR in the cytoplasm of Escherichia coli trxB gor mutants. Mol Biotechnol 2010; 45 (2): 140–149. doi: 10.1007/s12033-010-9 250-0.
9. Crabb JW, Hu B, Crabb JS et al. iTRAQ quantitative proteomic comparison of metastatic and non-metastatic uveal melanoma tumors. PLoS One 2015; 10 (8): e0135543. doi: 10.1371/journal.pone.0135543.
10. Harper J, Adams KJ, Bossi G et al. An approved in vitro approach to preclinical safety and efficacy evaluation of engineered T cell receptor anti-CD3 bispecific (ImmTAC) molecules. PLoS One 2018; 13 (10): e0205491. doi: 10.1371/journal.pone.0205491.
11. Hu H-M, Winter H, Urba WJ et al. Divergent roles for CD4 + T cells in the priming and effector/memory phases of adoptive immunotherapy. J Immunol 2000; 165 (8): 4246–4253. doi: 10.4049/jimmunol.165.8. 4246.
12. Sacco JJ, Carvajal R, Butler MO et al. 64MO A phase (ph) II, multi-center study of the safety and efficacy of tebentafusp (tebe) (IMCgp100) in patients (pts) with metastatic uveal melanoma (mUM). Ann Oncol 2020; 31 (Suppl 7): S1441–S1451. doi: 10.1016/annonc/annonc 392.
13. Piperno-Neumann S, Hassel J, Rutkowski P et al. Abstract CT002: phase 3 randomized trial comparing tebentafusp with investigator’s choice in first line metastatic uveal melanoma. Cancer Res 2021; 81 (Suppl 13): CT002. doi: 10.1158/1538-7445.AM2021-CT002.
14. Nathan P, Hassel JC, Rutkowski P et al. Overall survival benefit with tebentafusp in metastatic uveal melanoma. N Engl J Med 2021; 385 (13): 1196–1206. doi: 10.1056/NEJMoa2103485.
15. Liu A, Wei A, Ashray B et al. Tebentafusp in advanced uveal melanoma: proof of principle for the efficacy of T-cell receptor therapeutics and bispecifics in solid tumors. Expert Opin Biol Ther 2022; 22 (8): 997–1004. doi: 10.1080/14712598.2022.2031970.
16. Carvajal R, Sato T, Butler M et al. Characterization of cytokine release syndrome (CRS) following treatment with tebentafusp in patients (pts) with previously treated (2L+) metastatic uveal melanoma (mUM). J Clin Oncol 2021; 39 (Suppl 15): 9531. doi: 10.1200/JCO.2021.39.15_SUPPL.9531.
17. Lee DW, Santomasso BD, Locke FL et al. ASTCT consensus grading for cytokine release syndrome and neurologic toxicity associated with immune effector cells. Biol Blood Marrow Transplant 2019; 25 (4): 625–638. doi: 10.1016/j.bbmt.2018.12.758.
18. Státní ústav pro kontrolu léčiv Česká republika a Evropské léková agentura EMA. Souhrn údajů o přípravku Kimmtrak. [online]. Dostupné z: https: //www.ema.europa.eu/en/documents/product-information/kimmtrak-epar-product-information_cs.pdf.
19. Sacco J, Carvajal R., Butler MO et al. 64MO – a phase (ph) II, multi-center study of the safety and efficacy of tebentafusp (tebe) (IMCgp100) in patients (pts) with metastatic uveal melanoma (mUM). [online]. Available from: https: //www.annalsofoncology.org/article/S0923-7534 (20) 43065-0/fulltext.
20. Piperno-Neumann S, Hassel JC, Rutkowski P et al. AACR 2021. Abstract CT002. Phase 3 randomized trial comparing tebentafusp with investigator‘s choice in first line metastatic uveal melanoma. [online]. Available from: https: / / ascopost.com/ issues/ may-10-2021/ tebentafusp-shows-overall-survival-benefit-in-first-line-treatment-of-metastatic-uveal-melanoma/
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2022 Číslo 6- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Editorial
- Fekální mikrobiální transplantace – nová možnost ovlivnění výsledků terapie onkologických pacientů
- Prognostické a prediktivní faktory meningeomů mozku
- Informace z České onkologické společnosti
- Porovnání účinnosti aferézy periferních kmenových buněk na separátorech krevních buněk
- Kardiovaskulárne komplikácie u pacientov po alogénnej transplantácii krvotvorných buniek – úloha kardiomarkerov
- Rekonstrukce a analýza sítě circRNA-miRNA-mRNA v patologii karcinomu plic
- Výhody a omezení 3D organoidů a ex vivo kultivace nádorových tkání v personalizované medicíně pro karcinom prostaty
- Benigní lymfoidní hyperplazie imitující oligometastázu nemalobuněčného karcinomu plic po stereotaktické ablační radioterapii
- Fatální myokarditida po první dávce nivolumabu
- Aktuality z odborného tisku
- Souhra klinické onkologie, radiační onkologie a chirurgie v léčbě pacientů s nádory GIT
- Tebentafusp
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Prognostické a prediktivní faktory meningeomů mozku
- Výhody a omezení 3D organoidů a ex vivo kultivace nádorových tkání v personalizované medicíně pro karcinom prostaty
- Fekální mikrobiální transplantace – nová možnost ovlivnění výsledků terapie onkologických pacientů
- Fatální myokarditida po první dávce nivolumabu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



