-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
HPV 16 v patogenéze nádorov horného aerodigestívneho traktu
HPV 16 in Pathogenesis of Upper Aerodigestive Tract Tumors
Introduction: Human papillomavirus (HPV) is the world’s most widely sexually transmitted disease. HPV infection play also an important role in the etiopathogenesis of head and neck cancers, especially oropharynx.
Material and methods: In a prospective study of 236 patients with squamous cell carcinoma (SCC) of the upper aerodigestive tract (oral cavity, oropharynx, hypopharynx, and larynx), the incidence of p16 positivity in tumor tissue and its relationship to tumor localization, occurrence of risk factors (smoking, alcohol, and sexual behavior), histopathological findings, and stage of disease were analyzed.
Results: Smoking and alcohol abuse were observed in 72% of patients with SCC of the upper aerodigestive tract. Risky sexual behavior was present only in the group of patients with orofaryngeal SCC (42%). Immunohistochemical staining revealed that p16 was present in 20% tumors of upper aerodigestive tract, most frequently in the oropharynx (30%). Patients with p16 positive orofaryngeal SCC were younger, and 94% of these pateints admitted risky sexual behavior. Smoking and regular alcohol consumption were more common in patients with p16 negative SCC of the oropharynx (90%).
Conclusion: HPV 16 infection plays a role in the etiopathogenesis of oropharyngeal carcinoma. In other locations of the upper aerodigestive tract, smoking and alcohol abuse are major risk factors. Determination of HPV status in oropharyngeal SCC is an integral part of histopathological examinations. Immunohistochemical detection of p16 protein expression in tumor tissue is considered sufficient to stratify patients into HPV positive/negative groups of oropharyngeal carcinoma.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Keywords:
risk factors – head and neck cancer – oropharyngeal carcinoma – etiopathogenesis – HPV infection
Autoři: Barbora Uhliarová 1; Michal Smitka 2
Působiště autorů: Oddelenie otorinolaryngológie, Fakultná nemocnica s poliklinikou F. D. Roosevelta, Banská Bystrica, Slovenská republika 2 Martinské bioptické centrum, s. r. o., Banská Bystrica, Slovenská republika 1
Vyšlo v časopise: Klin Onkol 2020; 33(2): 132-137
Kategorie: Původní práce
doi: https://doi.org/10.14735/amko2020132Souhrn
Úvod: Ľudský papilomavírus (human papillomavirus – HPV) je celosvetovo najrozšírenejšie pohlavne prenosné ochorenie. V etiopatogenéze karcinómov hlavy a krku, predovšetkým orofaryngu, sa v posledných rokoch pripisuje významná úloha aj HPV infekcii.
Materiál a metodika: Prospektívna štúdia 236 pacientov so skvamocelulárnym karcinómom (squamous cell carcinoma – SCC) horného aerodigestívneho traktu (dutina ústna, orofarynx, hypofarynx, larynx). Sledovali sme výskyt p16 pozitivity v nádorovom tkanive a súvislosť k lokalizácii, výskytu rizikových faktorov (fajčenie, alkohol, sexuálne správanie), histopatologickému nálezu a štádiu ochorenia.
Výsledky: Fajčenie a pravidelnú konzumáciu alkoholu sme zaznamenali u 72 % pacientov so SCC horného aerodigestívneho traktu. Rizikové sexuálne správanie bolo prítomné iba v skupine pacientov s SCC orofaryngu (42 %). Na základe imunohistochemického vyšetrenia sme p16 detegovali v 20 % nádorov horného aerodigestívneho traktu, najčastejšie v resekátoch z orofaryngu (30 %). Pacienti s p16 pozitívnym SCC orofaryngu boli mladší, rizikové sexuálne správanie priznalo 94 % z nich. Fajčenie a pravidelná konzumácia alkoholu sa častejšie vyskytovali u pacientov s p16 negatívnym SCC orofaryngu (90 %).
Záver: Infekcia HPV 16 má vplyv prioritne na vznik karcinómu orofaryngu. V ostatných lokalizáciách horného aerodigestívneho traktu je hlavným rizikovým faktorom fajčenie a nadmerné užívanie alkoholu. Stanovenie HPV v nádorovom tkanive z orofaryngu je neoddeliteľnou súčasťou histopatologického vyšetrenia. Imunohistochemické vyšetrenie expresie proteínu p16 v nádorovom tkanive predstavuje dostačujúcu metódu na stratifikáciu pacientov do HPV pozitívnej/negatívnej skupiny karcinómov orofaryngu.
Klíčová slova:
karcinómy hlavy a krku – orofaryngeálny karcinóm – etiopatogenéza – HPV infekcia – rizikové faktory
Úvod
Infekcia ľudským papilomavírusom (human papillomavirus – HPV) je celosvetovo najrozšírenejšie pohlavne prenosné ochorenie. HPV sú malé DNA vírusy, ktoré postihujú obe pohlavia. Doteraz bolo identifikovaných približne 120 genotypov. Podľa onkogénneho potenciálu sa HPV delia na dve skupiny – vysoko rizikové (high-risk – HR) a nízko rizikové (low-risk – LR). Z HR HPV ide predovšetkým o HPV 16 a 18, ktoré spôsobujú malígne nádory urogenitálnej oblasti (krčok maternice, vulva, vagína, konečník, penis). Z LR HPV sa najčastejšie identifikuje typ 6 a 11, ktorý spôsobuje kožné a genitálne bradavice ako aj papilómy slizníc. V hornom aerodigestívnom trakte sa uplatňujú podobné typy HPV ako v urogenitálnej oblasti [1,2].
HPV spolu s Helicobacter pylori a vírusmi hepatitídy B a C patria k najčastejším infekčným príčinám malignít. Odhaduje sa, že v dôsledku HPV infekcie vzniká celosvetovo asi 5 % malignít. Z celkového množstva 12,8 miliónov nových karcinómov na svete v roku 2008 asi 700 000 vzniklo v lokalizáciách, ktoré sú spájané s HPV asociovanými karcinómami a 610 000 ich skutočne vzniklo v dôsledku HPV infekcie [2].
Aj keď ide o tumory s blízkou anatomickou lokalizáciou, nádory hlavy a krku predstavujú heterogénnu skupinu nádorov. V klinickej praxi, vrátane klinických štúdií, termín „nádory hlavy a krku“ označuje nádory horného aerodigestívneho traktu, tj. pery a dutiny ústnej, orofaryngu, hypofaryngu a laryngu. Histologicky vo > 90 % prípadov ide o skvamocelulárne karcinómy (squamous cell carcinoma – SCC). Osobitne sa vyčleňujú nádory nosohltana, nosovej dutiny, prinosových dutín a slinných žliaz, ktoré sa svojou incidenciou zaraďujú medzi zriedkavé nádory tejto oblasti. Etiológia, histopatológia aj liečba týchto nádorov sa odlišujú od „klasickej skupiny nádorov hlavy a krku“.
SCC horného aerodigestívneho traktu tvoria 4 % novodiagnostikovaných malignít ročne. Ide o siedmu najčastejšiu malignitu u mužov a trinástu u žien [3]. V etiopatogenéze nádorov horného aerodigestívneho traktu zohráva dôležitú úlohu fajčenie a pravidelná nadmerná konzumácia alkoholu. Z ďalších rizikových faktorov je to žuvanie tabaku, malnutrícia, avitaminóza, zlá hygiena ústnej dutiny a extraezofageálny reflux. U väčšiny pacientov sa rizikové faktory kombinujú. V posledných rokoch sa významná úloha pripisuje aj HPV infekcii, predovšetkým HR HPV 16, ktorý je zodpovedný za celosvetový nárast incidencie karcinómu orofaryngu [3,4]. Výskyt HPV pozitívneho karcinómu orofaryngu je okolo 50 % v Severnej Amerike, Japonsku a Austrálii, o niečo nižší (38 %) je v severnej, západnej a východnej Európe. V južnej Európe sa udáva podiel HPV pozitívnych orofaryngeálnych karcinómov iba v 17 % [2,3].
Materiál a metodika
Dizajn štúdie
Do prospektívnej štúdie bolo zaradených 236 pacientov, ktorým bol na oddelení otorinolaryngológie (ORL) Fakultnej nemocnice s poliklinikou (FNsP) F. D. Roosevelta v Banskej Bystrici v rokoch 2016–2018 diagnostikovaný SCC horného aerodigestívneho traktu (dutina ústna, oropharynx, hypopharynx, larynx).
Zo súboru boli vyradení pacienti:
- s iným histopatologickým typom nádoru horného aerodigestívneho traktu;
- so zriedkavými nádormi hlavy a krku (tj. nosohltan, nosová dutina, prinosové dutiny, ušné nádory, slinné žľazy);
- s metastázou (MTS) do lymfatických uzlín krku pri neznámom primárnom tumore, MTS do lymfatických uzlín krku pri tumore mimo ORL oblasť;
- s kožnými nádormi, nádormi štítnej žľazy a lymfoproliferatívnym ochorením;
- bez úplnej dokumentácie.
V sledovanom súbore sme sledovali výskyt rizikových faktorov, histopatologický nález a štádium ochorenia.
Všetci pacienti boli informovaní o charaktere štúdie a podpísali informovaný súhlas. Štúdia bola schválená etickou komisiou FNsP F. D. Roosevelta v Banskej Bystrici.
Rizikové faktory
Z rizikových faktorov sme sa zamerali na fajčenie, konzumáciu alkoholu a sexuálne správanie. Rizikové faktory sme zisťovali pomocou dotazníka.
Za fajčiara bol považovaný jedinec, ktorý fajčí 20 cigariet denne najmenej 10 rokov.
Za nadmernú konzumáciu alkoholu sme považovali u žien konzumáciu > 3 nápojov denne alebo 7 nápojov týždenne, a u mužov > 4 nápoje denne alebo 14 nápojov týždenne. Jeden alkoholický nápoj (1 drink) predstavuje 12–15 g alkoholu, tj. 0,5 l piva, 0,2 l vína alebo 0,05 l destilátu.
Zo sexuálnej anamnézy sme zisťovali vek koitarché (zahájenie sexuálneho života) a počet sexuálnych partnerov. Za rizikové sme považovali počet sexuálnych partnerov > 15.
Rozsah ochorenia
Všetkým pacientom bolo realizované endoskopické vyšetrenie v celkovej anestézii, pri ktorom sme určili lokálny rozsah ochorenia a odobrali vzorku nádorového tkaniva na histopatologické vyšetrenie. Všetkým pacientom bolo doplnené vyšetrenie krku a hrudníka výpočtovou tomografiou a vyšetrenie brucha výpočtovou tomografiou/ultrasonografiou. Podľa výsledkov vyšetrení sme následne určili rozsah ochorenia. Štádium choroby sme stanovili na základe platnej TNM (tumor-nodes-metastasis) klasifikácie (7. vydanie pre nádory diagnostikované do 31. 12. 2017 a 8. vydanie pre nádory diagnostikované od 1. 1. 2018).
Histopatologické vyšetrenie
Vzorky nádorového tkaniva odobratého počas endoskopického vyšetrenia v celkovej anestézii boli ihneď fixované roztokom 10% formaldehydu a zaliate parafínom. Z každej vzorky boli pripravené 4–5 μm hrubé rezy. Všetky rezy boli kontrastne zafarbené Weigertovým hematoxylínom (Bamed).
Stupeň diferenciácie SCC sme stanovili na základe klasifikácie Svetovej zdravotníckej organizácie tumorov hlavy a krku z roku 2017 [5]: grade I (GI, dobre diferencovaný); grade II (GII, stredne diferencovaný); grade III (GIII, zle diferencovaný).
Proteín 16 v tkanive nádoru sme určovali imunohistochemicky. Na imunohistochemické stanovovanie p16 sme použili myšiu monoklonálnu protilátku, klon E6H4®, namierená proti ľudskému p16INK4a proteínu (Roche). Výsledok sme kvantifikovali percentuálne na základe pozitivity imunohistochemického vyšetrenia pre p16 v bunkách nádoru.
Štatistická analýza
Charakteristiku súboru pacientov a sledované dáta sme vyhodnotili pomocou frekvenčnej sumarizácie a deskriptívnej štatistiky (priemer, medián, smerodajná odchýlka, kvartil minima a maxima). Rozdiely medzi sledovanými parametrami sme vyhodnotili použitím testov – Pearsonov χ2-test s Yatesovou koreláciou, Mann-Whitneyho U test, Kruskal-Wallisov test a dvojfaktorová ANOVA s post hoc Duncan testom. Za štatisticky významné sme v rámci všetkých použitých testov považovali hodnoty hladiny významnosti p < 0,05. Na štatistickú analýzu sme použili program STATISTICA Cz 10.
Výsledky
Do súboru bolo zaradených 236 pacientov, ktorým bol novodiagnostikovaný SCC horného aerodigestívneho traktu na ORL oddelení FNsP F. D. Roosevelta v Banskej Bystrici v období 1/2016–12/2018. V súbore bolo 208 (88 %) mužov, vek 62 ± 8 rokov a 28 (12 %) žien, vek 60 ± 9 rokov. SCC ústnej dutiny sa zistil v 4 %, orofaryngu v 51 %, hypofaryngu v 11 % a hrtana v 34 %. Charakteristika primárneho tumoru horného aerodigestívneho traktu je uvedená v tab. 1.
Tab. 1. Charakteristika primárneho tumoru – horný aerodigestívny trakt. 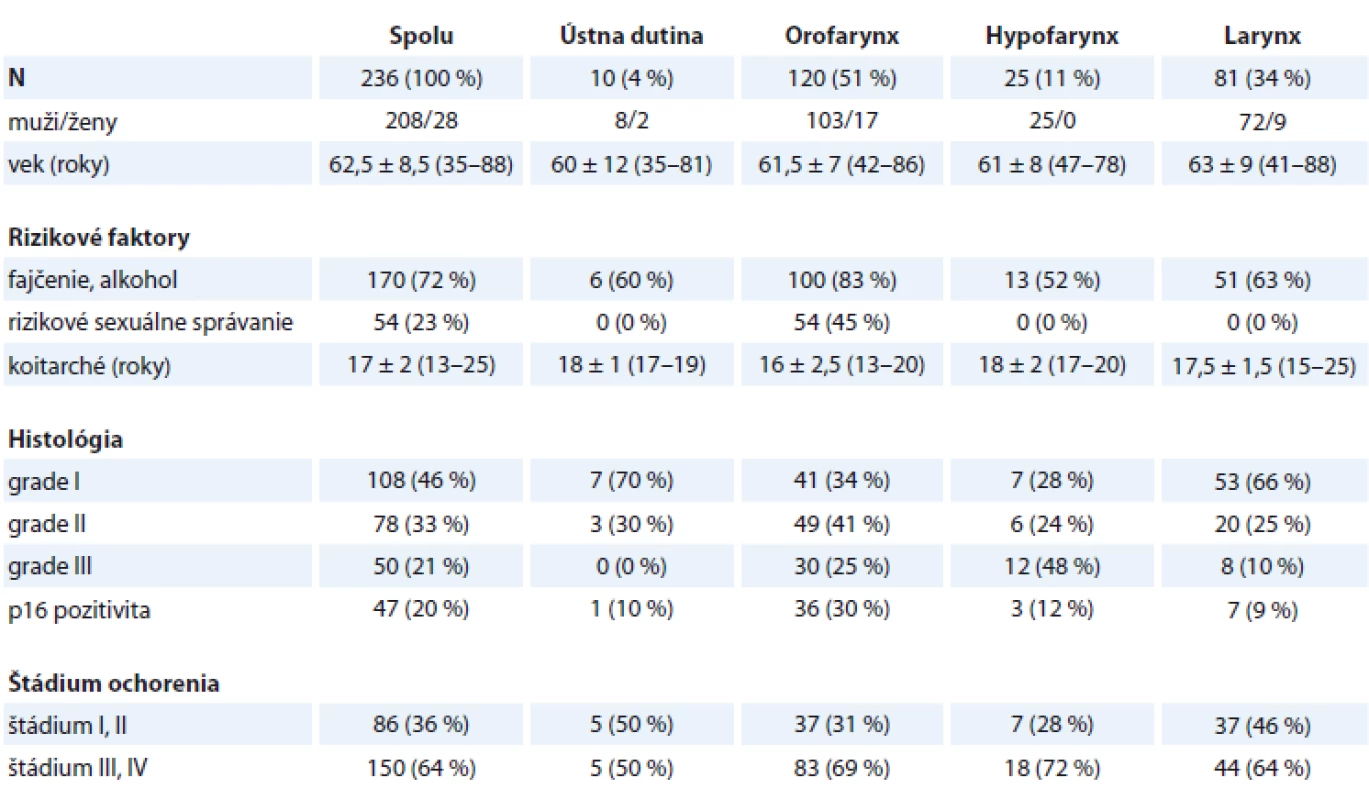
Typické rizikové faktory – fajčenie a pravidelná nadmerná konzumácia alkoholu – boli prítomné u 72 % pacientov, rizikové sexuálne správanie sa vyskytovalo u 23 %. Rizikové faktory boli častejšie prítomné u pacientov s orofaryngeálnym karcinómom (fajčenie, alkohol p = 0,007, resp. rizikové sexuálne správanie p < 0,0001). Vek zahájenia sexuálneho debutu bol 17 ± 2 roky, bez významnejších rozdielov medzi lokalizáciou primárneho tumoru (p = 0,266) (tab. 1).
Nádory horného aerodigestívneho traktu sa diagnostikovali v pokročilom štádiu ochorenia (štádium III a IV) u 149 (63 %) pacientov, bez významnejších rozdielov medzi jednotlivými lokalitami (p = 0,081) (tab. 1).
Histopatologickým vyšetrením sa častejšie diagnostikovali dobre a stredne diferencované SCC (GI a GII; 46 a 33 %; p = 0,003 a p = 0,005). Zle diferencovaný SCC (GIII) sa častejšie detegoval v nádoroch lokalizovaných v hypofaryngu (48 %; p = 0,008) a orofaryngu (25 %; p = 0,031) (tab. 1).
Na základe imunohistochemického vyšetrenia sme p16 detegovali v 20 % nádorov horného aerodigestívneho traktu, najčastejšie v resekátoch z orofaryngu (30 %; p = 0,018) (tab. 1, obr. 1).
Obr. 1. Imunohistochemický dôkaz p16 pozitivity v nádorovom tkanive tonzilárneho SCC (zväčšenie 200×; p16 pozitívne nádorové bunky sa imunohistochemicky farbia nahnedo). Zdroj: archív Martinského bioptického centra, s.r.o., prevádzka Banská Bystrica.
A. P16 pozitívny orofaryngeálny SCC. B. P16 negatívny orofaryngeálny SCC. SCC – skvamocelulárny karcinóm
Vzhľadom na nízky počet p16 pozitívnych nádorov v ostatných lokalitách ako aj negatívne rizikové sexuálne správanie sme ďalej sledovali rozdiely medzi p16 pozitívnymi a p16 negatívnymi nádormi iba pre orofaryngeálne SCC (tj. 120 pacientov, p16 pozitivita u 36). V obidvoch skupinách sa orofaryngeálny SCC vyskytoval častejšie u mužov, avšak v prípade p16 pozitívnych nádorov bol pomer muži: ženy nižší (graf 1). Pacienti s p16 pozitívnym karcinómom boli mladší (p16 pozitívny: 54 ± 9 rokov; p16 negatívny: 62 ± 8 rokov) (graf 2). Rizikové sexuálne správanie priznalo až 94 % pacientov, ktorým bol diagnostikovaný p16 pozitívny orofaryngeálny SCC (p < 0,0001). Fajčenie a pravidelná nadmerná konzumácia alkoholu sa zase častejšie vyskytovali u pacientov s p16 negatívnym SCC orofaryngu (90 %; p < 0,0001) (graf 3). P16 pozitívne nádory boli častejšie zle diferencované SCC (GIII) (69%; p = 0,004) (graf 4). Rozdiely v štádiách ochorenia sme nedetegovali (p = 0,733) (graf 5).
Graf 1. Skvamocelulárny karcinóm orofaryngu – rozdiely medzi p16 pozivitou a pohlavím. 
Graf 2. Skvamocelulárny karcinóm orofaryngu – rozdiely medzi p16 pozivitou a vekom 
Graf 3. Skvamocelulárny karcinóm orofaryngu – rozdiely medzi p16 pozivitou a rizikovými faktormi 
Graf 4. Skvamocelulárny karcinóm orofaryngu – rozdiely medzi p16 pozivitou a stupňom diferenciácie karcinómu. 
Graf 5. Skvamocelulárny karcinóm orofaryngu – rozdiely medzi p16 pozivitou a štádiom ochorenia. 
Diskusia
Epidemiológia nádorov horného aerodigestívneho traktu sa v posledných rokoch zmenila. Tieto nádory sú častejšie u mužov, pomer mužov a žien je viac než 3 : 1, ale za posledné desaťročia incidencia všetkých oblastí rakoviny hlavy a krku u žien stúpa, čo úzko súvisí so zvyšujúcou sa konzumáciou tabaku a alkoholu u žien [3]. Aj v našom súbore sa signifikantne častejšie vyskytovali muži (88 %).
Doteraz bol typický ORL onkologický pacient muž vo veku 60 rokov, dlhoročný fajčiar, pravidelný konzument alkoholu, nižšieho vzdelania, často nezamestnaný, slobodný alebo rozvedený [6]. V poslednom období však narastá počet pacientov nefajčiarov, nepravidelných konzumentov alkoholu, vyššieho vzdelania a spoločenského postavenia, ktorým bol diagnostikovaný malígny nádor hlavy a krku. Vznik karcinómu sa tu pripisuje HPV infekcii. V etiopatogenéze HPV pozitívnych karcinómov hlavy a krku sa uplatňuje predovšetkým typ HPV 16, ktorý sa deteguje u 90–95 % HPV pozitívnych karcinómov horného aerodigestívneho traktu [3,4,6].
V oblasti hlavy a krku je výskyt HPV asociovaných nádorov najvyšší v orofaryngu, predovšetkým v podnebných mandliach a koreni jazyka. Metaanalýzou štúdií týkajúcich sa európskych krajín (roky 2002–2012) sa zistila celková prevalencia HPV v karcinómoch hlavy a krku 40 %, pričom najvyššia prevalencia bola v karcinómoch tonzily (66,4 %) a bázy jazyka (47,2 %) [7]. Táto skutočnosť sa dáva do súvisu s perzistenciou infekcie v tonzilárnych kryptách, ktoré predstavujú vhodné miesto na replikáciu vírusu. HPV infekcia sa deteguje aj u malého počtu karcinómov dutiny ústnej, hypofaryngu a laryngu, avšak na rozdiel od karcinómov orofaryngu je v neaktívnej forme, preto sa na kancerogenéze pravdepodobne nepodieľa [6,8,9]. Aj v našom súbore sme v porovnaní s ostatnými lokalizáciami horného aerodigestívneho traktu p16 pozitivitu detegovali signifikantne najčastejšie v nádorovom tkanive z orofaryngu (30 %).
HPV asociovaný karcinóm orofaryngu nie je spájaný s fajčením či abúzom alkoholu, ale s rizikovým sexuálnym správaním. Štatisticky významne vyššia incidencia orofaryngeálneho karcinómu bola zistená u osôb s vyšším počtom sexuálnych partnerov (> 26), orálnych sexuálnych partnerov (> 6), ak bol prvý pohlavný styk vo veku < 18 rokov. Sexuálne správanie je teda významný rizikový faktor, no HPV asociovaný karcinóm sa tiež vyskytuje aj u ľudí s konzervatívnejším sexuálnym správaním. Vyšší počet tonzilárneho karcinómu bol zistený napr. u manželov žien s karcinómom krčka maternice [3,4,9].
V sledovanom súbore sme zaznamenali typické rizikové faktory – fajčenie a pravidelnú nadmernú konzumáciu alkoholu u 72 % pacientov so SCC horného aerodigestívneho traktu. Rizikové sexuálne správanie (počet sexuálnych partnerov >15) bolo prítomné iba v skupine pacientov s karcinómom orofaryngu (42 %). Rozdiely vo veku koitarché a lokalizáciou primárneho tumoru sme nezistili.
HPV 16 asociovaný SCC orofaryngu bol častejší u mužov, avšak pomer muži: ženy bol v porovnaní s p16 negatívnym orofaryngeálnym SCC ako aj ostatnými SCC horného aerodigestívneho traktu nižší. Pacienti s p16 pozitívnym SCC orofaryngu boli tiež signifikantne mladší, rizikové sexuálne správanie priznalo až 94 % z nich. Fajčenie a pravidelná konzumácia alkoholu sa častejšie vyskytovali u pacientov s p16 negatívnym SCC orofaryngu (90 %).
Rozdiely sú aj v histopatologickom náleze – HPV pozitívne SCC sú typicky nízkodiferencované, nekeratinizujúce, často bazaloidného typu. Okrem toho sa u pacientov s HPV pozitívnym SCC často stretávame s objemnou, cystickou MTS na krku a malým primárnym nádorom, kdežto pri HPV negatívnych karcinómoch väčšinou koreluje T a N štádium ochorenia [3].
Aj v našej štúdii boli p16 pozitívne orofaryngeálne SCC častejšie zle diferencované (GIII). Rozdiely v štádiách ochorenia sme nedetegovali.
Detekcia HPV v nádore
Od 1. 1. 2018 je HPV status potrebný na určenie TNM štádia orofaryngeálnych karcinómov, preto je v súčasnosti stanovenie HPV v nádorovom tkanive neoddeliteľnou súčasťou histopatologického vyšetrenia [10]. Okrem toho poskytuje dôležitú prognostickú informáciu a je pravdepodobné, že v blízkej budúcnosti bude rozhodovať aj o spôsobe liečby, napr. o použití deintenzifikovanej chemo/rádioterapie. Určenie HPV statusu sa odporúča aj v rámci manažmentu pacientov s MTS SCC z neznámeho origa do lymfatických uzlín krku. Dôkaz HPV môže efektívne nasmerovať diagnostiku a cielenú liečbu na oblasť orofaryngu. Aj keď je s HPV infekciou asociovaná aj časť non-orofaryngeálnych SCC hlavy a krku, rutinné HPV testovanie týchto nádorov nie je vzhľadom na nedostatok dôkazov o prognostickom význame vyšetrenia v súčasnosti odporúčané [11].
Napriek zjavnému významu a dôležitosti HPV testovania neexistuje všeobecný konsenzus, akú stratégiu a ktoré z viacerých dostupných metód na dôkaz HPV treba použiť. Výber metodiky by mal vychádzať zo zistení, že klinicky dobrá prognóza HPV pozitívnych orofaryngeálnych SCC je limitovaná iba na nádory s transkripčne aktívnou HPV infekciou [11–13]. Ideálny test by mal mať vysokú senzitivitu a špecificitu, primeranú cenu a mal by byť dostatočne jednoduchý na rutinné použitie. Jedným z najpraktickejších a najpoužívanejších spôsobov je screeningové imunohistochemické vyšetrenie expresie proteínu p16 [11]. Túto metodiku sme zvolili aj v našej štúdii. V súčasnosti sa táto metóda považuje za dostačujúcu na stratifikáciu pacientov do HPV pozitívnej/negatívnej skupiny karcinómov orofaryngu. Za pozitívny výsledok sa považuje jadrová a cytoplazmatická expresia ≥ 70 % nádorových buniek [11,14]. Na druhej strane nemožno zabúdať ani na nevýhody imunohistochemickej detekcie p16, predovšetkým nižšiu citlivosť a neschopnosť rozlíšiť jednotlivé kmene HPV. Samotná imunohistochemická expresia p16 sa môže považovať za marker aktívnej HPV infekcie iba v prípade, ak má karcinóm charakteristickú histopatologickú morfológiu. V prípade, že sa jedná o p16 pozitívny karcinóm s variantnou morfológiou alebo v prípade imunohistochemickej negativity v nekeratinizujúcom SCC orofaryngu, je nutné doplniť HPV špecifický test [11].
HPV infekciu v nádorovom tkanive je možné detegovať na základe dôkazu E6/E7 mRNA metódou reverznej transkripcie a polymerázovej reťazovej reakcie. Vysoko senzitívnym vyšetrením je detekcia HPV DNA vyšetrením polymerázovej reťazovej reakcie, stanovenia HPV DNA in situ hybridizáciou a najnovšie aj HPV RNA in situ hybridizáciou. Ide však o technicky, časovo aj finančne náročnejšie vyšetrenia [11].
Záver
V súlade s výsledkami iných štúdií aj v našej práci sme dokázali, že infekcia HPV 16, ktorý patrí medzi tzv. high-risk HPV, má vplyv prioritne na vznik karcinómu orofaryngu. V ostatných lokalizáciách horného aerodigestívneho traktu nemá HPV infekcia vplyv na vznik nádoru a v týchto lokalizáciách je hlavným rizikovým faktorom fajčenie a nadmerné užívanie alkoholu. HPV asociovaný karcinóm orofaryngu nie je spájaný s fajčením ani abúzom alkoholu, ale s rizikovým sexuálnym správaním.
HPV asociované karcinómy orofaryngu predstavujú novú skupinu nádorov, čo odzrkadľuje aj nová TNM klasifikácia (8. vydanie, platná od 1. 1. 2018). Stanovenie HPV v nádorovom tkanive z orofaryngu je neoddeliteľnou súčasťou histopatologického vyšetrenia. Imunohistochemické vyšetrenie expresie proteínu p16 v nádorovom tkanive sa v súčasnosti považuje za dostačujúcu metódu na stratifikáciu pacientov do HPV pozitívnej/negatívnej skupiny karcinómov orofaryngu.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Barbora Uhliarova, Ph.D.
Oddelenie otorinolaryngológie
Fakultná nemocnica s poliklinikou
F. D. Roosevelta
Nám. L. Svobodu 1
974 01 Banská Bystrica
Slovenská republika
e-mail:b.uhliarova@gmail.com
Obdržané: 19. 6. 2019
Prijaté: 31. 12. 2019
Zdroje
1. Sehnal B, Podlešák T, Kmoníčková E et al. Anogenitální HPV infekce jako potenciální rizikový faktor orofaryngeálního karcinomu. Klin Onkol 2018; 31 (2): 103–109. doi: 10.14735/amko2018103.
2. Sehnal B, Rozsypal H, Nipčová M et al. Prevalence, incidence, perzistence a možnosti prenosu infekce lidským papilomavirem (HPV). Epidemiol Mikrobiol Imunol 2017; 66 (4): 198–209.
3. Štefanička P. Ľudským papilomavírusom asociovaný karcinóm orofaryngu. Onkologia (Bratisl.) 2015; 10 (3): 189–192.
4. Young D, Xiao CC, Murphy B et al. Increase in head and neck cancer in younger patients due to human papillomavirus (HPV). Oral Oncol 2015; 51 (8): 727–730. doi: 10.1016/j.oraloncology.2015.03.015.
5. El-Naggar AK, Chan JK, Grandis JR et al. WHO classification of head and neck tumours. 4th ed. Lyon: WHO Press 2017.
6. Binková H, Horáková Z, Kostřica R et al. Narůstající incidence HPV pozitivních orofaryngeálních karcinomů. Otorinolaryng a Foniat (Prague) 2015; 64 (4): 205–212.
7. Abogunrin S, Di Tanna GL, Keeping S et al. Prevalence of human papillomavirus in head and neck cancers in European populations: a meta-analysis. BMC Cancer 2014; 14 : 968. doi: 10.1186/1471-2407-14-968.
8. Syrjänen S. HPV infections and tonsillar carcinoma. J Clin Pathol 2004; 57 (5): 449–455. doi: 10.1136/jcp.2003.008656.
9. Partlová S, Bouček J, Kloudová K et al. Imunitní systém u pacientů s nádory hlavy a krku. Klin Onkol 2015; 28 (Suppl 4): 86–94. doi: 10.14735/amko20154S86.
10. Brierley JD, Gospodarowicz MK, Wittekind CH et al. TNM classification of malignant tumours. 8th ed. Oxford: Wiley Blackwell 2017.
11. Švajdler M, Laco J, Ondič O et al. HPV-asociované karcinómy hlavy a krku: Aktualizácia poznatkov a odporúčania pre prax. Cesk Patol 2016; 52 (3): 130–138.
12. Kašpírková J, Ondič O, Černá K et al. Možnosti průkazu biologicky relevantní papilomavirové infekce u maligních nádorů hlavy a krku v diagnostické patologii. Cesk Patol 2013; 49 (1): 29–34.
13. Bishop JA, Lewis JS Jr, Rocco JW et al. HPV-related squamous cell carcinoma of the head and neck: An update on testing in routine pathology practice. Semin Diagn Pathol 2015; 32 (5): 344–351. doi: 10.1053/j.semdp.2015.02. 013.
14. Grøn øj Larsen C, Gyldenløve M, Jensen DH et al. Correlation between human papillomavirus and p16 overexpression in oropharyngeal tumours: a systematic review. Br J Cancer 2014; 110 (6): 1587–1594. doi: 10.1038/bjc.2014.42.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek Karcinom děložního hrdlaČlánek Aktuality z odborného tisku
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2020 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Nejasný stín na plicích – kazuistika
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Pohybová liečba ako prevencia a podporná liečba onkologických ochorení
- Metformin v onkologii – jak daleko jsme od jeho etablování coby protinádorového léku?
- Využití extrakraniální stereotaktické radioterapie při oligometastatickém postižení lymfatických uzlin
- Léčba karcinomu hrdla děložního s postižením paraaortálních uzlin – retrospektivní hodnocení vlastního souboru
- HPV 16 v patogenéze nádorov horného aerodigestívneho traktu
- Invazívna rino-orbito-cerebrálna forma mukormykózy u detskej pacientky s akútnou leukémiou
- Využití indocyaninové zeleně k peroperační diagnostice zdroje chylózního ascitu a autologního tkáňového lepidla (Vivostatu) k jeho ošetření
- Protirakovinný účinek melatoninu s radioprotektivní a radiosenzitivní vlastností
- Aktuality z odborného tisku
- Vzpomínka na prof. RNDr. M. Lokajíčka, DrSc.
- Účinek kapecitabinu v léčbě triple negativního karcinomu prsu
- Karcinom děložního hrdla
- Asociace polymorfizmu NAD (P) H chininové oxidoreduktázy 1 rs1800566 s karcinomem močového měchýře a prostaty – systematický přehled a metaanalýza
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Karcinom děložního hrdla
- Pohybová liečba ako prevencia a podporná liečba onkologických ochorení
- HPV 16 v patogenéze nádorov horného aerodigestívneho traktu
- Metformin v onkologii – jak daleko jsme od jeho etablování coby protinádorového léku?
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



