-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Využití extrakraniální stereotaktické radioterapie při oligometastatickém postižení lymfatických uzlin
Stereotactic Body Radiotherapy of Lymph Node Oligometastases
Background: The aim of this retrospective study is to evaluate the efficacy and toxicity of extracranial stereotactic radiotherapy for the treatment of oligometastatic lymph node involvement in the mediastinum, retroperitoneum, and pelvis in a consecutive group of patients from real clinical practice.
Material and methods: Of a total of 50 patients treated between 2011 and 2017, 29 were men and 21 were women, and the mean age was 62 years (median 66 years, range 25–81 years). Patients were most often irradiated in five fractions; the dose was selected according to dose-volume histograms of organs-at-risk in proximity to the planning target volume. The primary objectives were local control (LC), progression-free survival (PFS), time to multiple dissemination not allowing the use of local treatment methods (freedom from widepread dissemination – FFWD), and overall survival (OS). Acute and delayed toxicity were evaluated as well.
Results: The median dose equivalent at α/β = 10 (BED10) was 54 Gy (range 48–80 Gy). The median follow-up period was 40.4 months. LC after irradiation was 90% in 1 year and 75% in 3 years. Median time to local progression was not achieved. Patients irradiated with a high dose had significantly better LC than patients irradiated with a low dose; the cut-off was the median of the applied dose (ie BED10 = 54 Gy). Pathological node localization had no significant effect on LC. The median PFS was 8.2 months (95% CI 7.4–11.6 months). PFS in 1 year was 38.5% and 17% in 3 years. The median OS was 37.3 months (95% CI 23.2–51.4 months). One-year OS was 83% and 3-year OS was 51%. The median FFWD was 13.6 months (range 8.7–18.5 months). The one-year FFWD was 55% and the 3-year FFWD was 24%. None of these parameters (PFS, OS, FFWD) was dose or localization dependent. No grade III or IV toxicity was reported.
Conclusion: Our study shows that targeted stereotactic radiotherapy is a very effective low toxic treatment for oligometastatic lymph node involvement. It can delay cytotoxic chemotherapy and thus improve/maintain the quality of life of patients. Approximately one fifth of patients treated with extracranial stereotactic radiotherapy for oligometastatic lymph node involvement survived without signs of disease for prolonged periods. Future studies should aim at identifying patients who would benefit most from this treatment, adjusting the timing of extracranial stereotactic radiotherapy depending on the treatment strategy, and optimizing the dose prescription.
This work was supported by grant of the Ministry of Health of the Czech Republic AZV 19-00354 and by grant of the Ministry of Health of the Czech Republic – Conceptual development of a research organization (MMCI 00209805).
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Keywords:
radiotherapy – metastases – stereotactic body radiotherapy – lymph node metastases – oligometastases – local therapy
Autoři: Petr Burkoň 1,2; Sabina Oberreiterová 1; Tomáš Kazda 1,2; Marek Slávik 1,2; Lukáš Bobek 1; Libor Komínek 1; Tomáš Procházka 1,2; Miroslav Vrzal 1,2; Pavel Šlampa 1,2
Působiště autorů: Klinika radiační onkologie, Masarykův onkologický ústav, Brno 2 Klinika radiační onkologie, LF MU, Brno 1
Vyšlo v časopise: Klin Onkol 2020; 33(2): 114-122
Kategorie: Původní práce
doi: https://doi.org/10.14735/amko2020114Souhrn
Východiska: Cílem této retrospektivní studie je zhodnotit na neselektované skupině pacientů z reálné klinické praxe efektivitu a toxicitu extrakraniální stereotaktické radioterapie v léčbě oligometastatického postižení lymfatických uzlin lokalizovaných v mediastinu, retroperitoneu a pánvi.
Materiál a metody: Z celkového počtu 50 pacientů léčených v letech 2011–2017 bylo 29 mužů a 21 žen, průměrný věk byl 62 let (medián 66 let, rozmezí 25–81 let). Pacienti byli ozařováni nejčastěji v pěti frakcích; dávka byla volena podle dávkově-objemových histogramů rizikových orgánů v okolí plánovacího cílového objemu. Primárním cílem bylo zhodnocení lokální kontroly (local control – LC), doby bez progrese onemocnění (progression-free survival – PFS), doby do vícečetné diseminace neumožňující využití lokálních metod léčby (freedom from widepread dissemination – FFWD) a celkového přežití (overall survival – OS). Rovněž byla zhodnocena akutní a pozdní toxicita léčby.
Výsledky: Medián biologického ekvivalentu dávky při / = 10 (BED10) byl 54 Gy (rozmezí 48–80 Gy). Medián doby sledování byl 40,4 měsíce. LC v 1 roce od ozáření byla 90 %, 3letá 75 %. Mediánu doby do lokální progrese nebylo zatím dosaženo. Pacienti ozáření vyšší dávkou měli signifikantně lepší LC onemocnění než pacienti ozáření dávkou nižší; hranicí byl medián aplikovaných dávek (tj. BED10 = 54 Gy). Lokalizace patologických uzlin na LC signifikantní vliv neměla. Medián PFS byl 8,2 měsíce (95% CI 7,4–11,6 měsíce). Jednoleté PFS bylo 38,5 % a 3leté 17 %. Medián OS byl 37,3 měsíce (95% CI 23,2–51,4 měsíce). Jednoleté OS bylo 83 % a 3leté OS bylo 51 %. Medián FFWD byl 13,6 měsíce (s rozmezím 8,7–18,5 měsíce). Jednoletá FFWD byla 55 % a 3letá FFWD 24 %. Žádný z těchto parametrů (PFS, OS, FFWD) nebyl závislý na aplikované dávce ani na lokalizaci metastáz. Nebyla zaznamenána žádná toxicita III. a IV. stupně.
Závěr: Naše studie prokázala, že cílená stereotaktická radioterapie je v případě oligometastatického postižení lymfatických uzlin minimálně toxickou a vysoce efektivní lokální metodou léčby. Je schopna s minimálním úsilím pacienta oddálit indikaci cytotoxické chemoterapie a tím event. zlepšit kvalitu života pacientů. Necelá pětina takto léčených pacientů přežívá bez známek onemocnění dlouhodobě. Identifikace pacientů, kteří mají z této léčby největší prospěch, správné načasování extrakraniální stereotaktické radioterapie v léčebné strategii, popř. velikost dávky by se měly stát předmětem dalších studií.
Klíčová slova:
extrakraniální stereotaktická radioterapie – lymfatické metastázy – oligometastázy – lokální terapie – radioterapie – metastázy
Úvod
Oligometastatické onemocnění je definováno jako přítomnost pěti či méně metastatických ložisek lokalizovaných v omezeném počtu orgánů. Tento pojem se poprvé objevil v roce 1995 v práci Hellmana a Weichselbauma, kteří jej popisují jako mezistupeň mezi lokalizovaným a diseminovaným nádorovým onemocněním [1,2]. Při terapii diseminovaného nádorového onemocnění, u kterého jsou metastázy takto omezeny početně i rozsahem postižených orgánů, mohou být úspěšné lokální léčebné metody – chirurgie, radiofrekvenční ablace (RFA), kryoablace nebo cílená radioterapie (RT). Lze předpokládat, že pokud se nádorové onemocnění nachází ve fázi, kdy ještě nedošlo k mutačním změnám, které podporují vícečetné metastazování, může lokální léčba takového postižení v řadě případů vést k dlouhodobému bezpříznakovému období, popř. k vyléčení [1–3]. Rovněž možnost oddálení podání potenciálně toxické systémové terapie výrazně ovlivní kvalitu života onkologických pacientů [4]. Skutečná incidence oligometastatického postižení není známa, ale častější využití pozitronové emisní tomografie / výpočetní tomografie (PET/CT) a dalších pokročilých diagnostických metod umožňuje častěji diagnostikovat a včas zahájit léčbu asymptomatických ložisek.
Extrakraniální stereotaktická radioterapie (stereotactic body radiotherapy – SBRT) je způsob léčby lokalizovaných nádorových lézí aplikací vysokých dávek ionizujícího záření v malém počtu frakcí. To je možné pomocí speciálně vybavených lineárních urychlovačů a s využitím moderních imobilizačních pomůcek a zobrazovacích metod. Pro pacienty je důležité, že se jedná o velmi dobře tolerovanou, neinvazivní krátkodobou léčbu, která nevyžaduje hospitalizaci ani žádnou složitou speciální přípravu. Oproti standardním RT technikám umožňuje díky své přesnosti aplikovat výrazně vyšší dávky za menšího poškození okolních zdravých tkání [5].
Vynikající lokální kontrola (local control – LC), zlepšení parametru celkového přežití (overall survival – OS) a minimální vedlejší účinky zařadily SBRT mezi standardní metody léčby lokalizovaných nemalobuněčných karcinomů plic a oligometastatického postižení různých lokalizací a různých primárních nádorů [6–8]. Většina údajů o využití SBRT při léčbě oligometastáz se týká zejména metastáz lokalizovaných v játrech a v plicích. V provedených studiích byla 2letá LC přibližně 80 %, 2–3letá doba bez známek choroby byla přibližně 20 % a 2–3leté OS 25–40 % [9–11].
V současné době je k dispozici pouze omezené množství literárních údajů týkajících se využití SBRT v léčbě uzlinových metastáz. Počet frakcí a dávka na frakci se odvíjí od lokalizace, velikosti a počtu postižených uzlin. Výše dávky během ozařování je samozřejmě limitována citlivostí okolních struktur. Svojí lokalizací bývají aplikované dávky při stereotaktickém ozařování postižených lymfatických uzlin nižší, než je tomu při SBRT ložisek v plicích nebo játrech. SBRT navíc bývá často používána u jednoho pacienta opakovaně.
Cílem této retrospektivní studie je zhodnotit na neselektované skupině pacientů z reálné klinické praxe efektivitu a toxicitu SBRT v léčbě oligometastatického postižení lymfatických uzlin lokalizovaných v mediastinu, retroperitoneu a pánvi.
Pacienti a metody
Pacienti
Do analýzy byli zahrnuti pacienti léčení v Masarykově onkologickém ústavu v letech 2011–2017 SBRT pro oligometastatické postižení lymfatických uzlin lokalizovaných v retroperitoneu, mediastinu nebo pánvi. Vstupní kritéria pro zařazení zahrnovala věk ≥ 18 let, Karnofského index ≥ 70 % a na CT patrné oligometastatické postižení uzlin v uvedených lokalitách. Před zařazením pacienta byl rozsah postižení potvrzen PET/CT vyšetřením. V případě nálezu vícečetných metastáz byla indikace SBRT přehodnocena a pacient byl referován ke klinickému onkologovi k zahájení systémové léčby. Pacienti, u kterých došlo ke zjištění nové metastázy v průběhu sledování po primární SBRT oligometastáz, již nebyli znovu do analýzy zahrnuti, pokud byla tato nová metastáza indikována k další SBRT. V takovém případě pouze pokračovalo sledování LC původní SBRT, doby do indikace systémové léčby a OS.
Technika radioterapie
Stabilní, reprodukovatelná a zároveň pohodlná poloha pacienta v průběhu ozařování byla zajištěna pomocí tvarovatelných vakuových matrací položených na ozařovacím stole volně či v kombinaci s pevným rámem [12]. Do konce roku 2015 bylo k zamezení rotačních posunů na ozařovacím stole využíváno kombinace vakuových matrací s pevným stereotaktickým rámem firmy Elekta [13]. Od ledna 2016 byla využívána bezrámová fixace společnosti Orfit Industries a CIVCO Medical Solutions v kombinaci s pohybovou korekcí polohy pacienta v šesti rovinách pomocí ozařovacího stolu 6D Perfect Pitch firmy Varian.
Při plánování RT a následném ozáření bylo využíváno čtyřdimenzionální CT a dechové navigace během každé frakce ozáření pomocí lineárního urychlovače s integrovanými zobrazovacími systémy a systémem pro kontrolu dechových pohybů pacienta [14]. Nádorový objem (gross tumor volume – GTV) byl zakreslován do 2–3mm CT skenů jako léze viditelná na CT či CT/MRI či CT/PET fúzi, a to ve všech dechových sadách skenů. Tato jednotlivá GTV z různých dechových fází se následně fúzovala za vytvoření ITV (internal target volume), který zahrnoval všechny polohy ložiska při dýchání. V případě výrazných dechových pohybů bylo využito možnosti ozáření v maximálním nádechu. GTV byl v takovém případě zakreslen pouze v této fázi. K vytvoření plánovacího cílového objemu (planning target volume – PTV) bylo GTV expandováno o 3–5 mm všemi směry (3mm lem u velmi dobře lokalizovatelných ložisek, event. u ložisek, kde byly malé pohyby v důsledku dýchání nebo jiných pohybů těla). Předepsaná dávka byla následně optimalizována do tohoto PTV [15].
K předpisu a kalkulaci dávky byl používán tzv. „risk-adaptive concept“, kdy je dávka na frakci a celková dávka přizpůsobena dávkově-objemovému histogramu rizikových struktur v okolí PTV [16,17]. Z důvodu velmi těsné prostorové blízkosti struktur gastrointestinálního traktu, které mají nízké tolerance k záření a není u nich možné zajistit prostorovou stálost při každé frakci záření (to platí zejména pro tenké střevo), byla nejčastěji předepisována dávka 5 × 6 Gy a medián biologického ekvivalentu BED10 byl 54 Gy (v rozmezí 48–80 Gy).
Výpočet dávky probíhal v plánovacím systému Eclipse firmy Varian s výpočetním algoritmem AAA (analytical anisotropic algorithm) s korekcí na heterogenity. Adekvátního pokrytí cílového objemu bylo dosaženo, když bylo 98–100 % PTV pokryto 95–100 % předepsané dávky. Spád dávky záření do okolí byl posuzován podle poměru objemu izodózy, na kterou je dávka předepisována, a objemu PTV podle poměru objemu 50% izodózy a objemu PTV a podle maximální dávky ve vzdálenosti 2 cm od PTV ve všech směrech. Předepsaná dávka byla aplikována lineárními urychlovači Varian Clinac iX a Varian TrueBeam STX v. 2.5 vybavenými technologií terapie kyvem (volumetric arc therapy – VMAT) [18] a svazky záření bez homogenizačních filtrů (flattening filter free beams – FFF). Korekce polohy pacienta před léčbou byla prováděna online přímo na ozařovacím stole pomocí výpočetní tomografie s konickým svazkem záření (cone-beam computed tomography – CBCT), které je nedílnou součástí těchto lineárních urychlovačů [19]. Pro zajištění bezpečnosti pacientů byl každý RT plán dozimetricky ověřen pomocí gama-analýzy jako součást standardního procesu zajišťování kvality RT.
Follow-up, hodnocení efektivity a toxicity léčby
Sledování pacientů v průběhu léčby a po ní probíhalo na základě zavedených standardů Masarykova onkologického ústavu. Kontroly sestávající z diagnostického CT či PET/CT, klinického vyšetření, základních odběrů a doplňkových vyšetření podle ozářené lokality byly prováděny v prvních 2 letech po 3–4 měsících, v dalších 3 letech po půl roce a dále pak 1× za rok. Lokální recidiva byla definována jako nová nádorová léze v ozářené oblasti nebo jako zvýšení velikosti nádoru o > 20 % s odpovídající aviditou na PET/CT vyšetření. Nejasné nálezy vedly k indikaci časné PET/CT kontroly, biopsii či chirurgickému zákroku. Hodnocení akutních i pozdních postradiačních změn bylo prováděno na základě CTCAE škály (National Cancer Institute’s Common Toxicity Criteria for Adverse Events scale). Akutní toxicita vzniká během léčby, event. do 90 dní po jejím ukončení. Později se jedná o toxicitu chronickou, pozdní. Hodnocení toxicity bylo založeno na klinickém vyšetření a laboratorních či zobrazovacích datech.
Statistická analýza
Primárním cílem bylo zhodnocení LC, doby bez progrese onemocnění (progression-free survival – PFS), doby do vícečetné diseminace neumožňující využití lokálních metod léčby (freedom from widepread dissemination – FFWD) a OS. Rovněž byla zhodnocena akutní a pozdní toxicita léčby.
K vyhodnocení základní popisné charakteristiky souboru pacientů byly použity statistické funkce editoru Microsoft Excel. Na výpočty doby přežití byl použit software IBM SPPS s Kaplan-Meierovou metodikou odhadu přežití. LC byla počítána od data ukončení RT do data CT vyšetření (nebo PET/CT) prokazujícího progresi v ozařovaném místě. Pacienti bez popsané progrese byli cenzorováni k datu posledního CT (nebo PET/CT) vyšetření neprokazujícího progresi. PFS bylo počítáno od data ukončení RT do data vyšetření prokazujícího progresi onemocnění (vč. distální progrese mimo oblast SBRT). Pacienti bez popsané progrese byli cenzorováni k datu posledního vyšetření neprokazujícího progresi. Vícečetná diseminace byla definována jako progrese onemocnění, kterou nebylo možné léčit některou z lokálních terapeutických metod (opakovaná SBRT, RFA, embolizace či chirurgie). FFWD byla počítána od data ukončení RT do data vyšetření prokazujícího takovouto progresi onemocnění. Pacienti bez takovéto progrese byli cenzorováni k datu posledního vyšetření neprokazujícího takovouto progresi. OS bylo počítáno od data ukončení RT do data úmrtí pacienta. Žijící pacienti byli cenzorováni k datu poslední návštěvy u lékaře v naší nemocnici.
Výsledky
Charakteristika pacientů
Základní charakteristiky pacientů, parametry léčby a toxicitu shrnuje tab. 1. Z celkového počtu 50 pacientů bylo 29 mužů a 21 žen, průměrný věk byl 62 let (medián 66 let, rozmezí 25–81 let). Všichni pacienti indikovaní k SBRT byli v dobrém celkovém stavu, Karnofsky index ≥ 70 %.
Tab. 1. Charakteristika souboru pacientů a jejich léčby 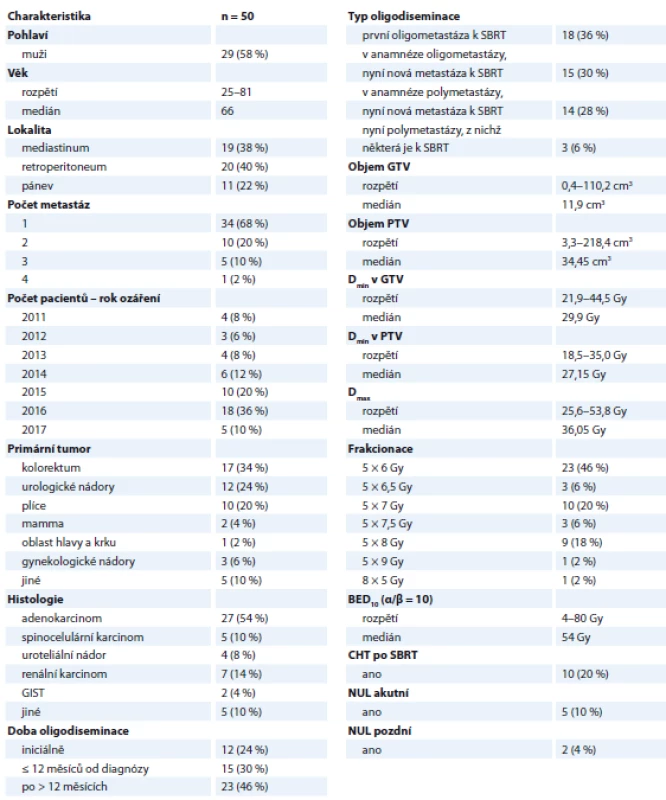
GIST – gastrointestinální stromální tumor, SBRT – extrakraniální stereotaktická radioterapie, GTV – nádorový cílový objem, PTV – plánovací cílový objem, Gy – Gray, Dmin – minimální dávka, Dmax – maximální dávka, BED – biologický ekvivalent dávky, CHT – chemoterapie, NUL – nežádoucí účinky léčby Nejčastějšími primárními nádory byly kolorektální karcinomy (17 pacientů, 34 %). Metastaticky postižené lymfatické uzliny byly nejčastěji lokalizovány v retroperitoneu (20 pacientů, 40 %) a mediastinu (19 pacientů, 38 %). Nejčastěji byla ozařována jedna metastatická uzlina (34 pacientů, 68 %), méně často dvě (10 pacientů, 20 %) a tři ložiska (5 pacientů, 10 %). Z anamnézy pacientů bylo zjištěno, že téměř u poloviny z nich došlo k diseminaci za > 12 měsíců od ukončení primární onkologické léčby (23 pacientů, 46 %). Dříve, tedy do 1 roku od ukončení primární onkologické terapie, došlo k diseminaci u 15 pacientů (30 %). Pouze u 12 nemocných byla oligometastatická diseminace zjištěna současně s primární diagnózou (12 pacientů, 24 %). Medián doby do diseminace byl 10,5 měsíce (rozmezí 0–216 měsíců).
Charakteristika léčby
Devět pacientů (9/50; 18 %) bylo před SBRT pro oligometastatické onemocnění léčeno systémově (chemoterapií, cílenou léčbou či jejich kombinací). Pět z těchto pacientů (5/9; 56 %) obdrželo ≥ 2 linie systémové léčby a poté byli referováni k SBRT. U těch pacientů, kteří byli již před indikací SBRT léčeni pro jiné metastázy (29/50; 58 %) byl medián doby bez systémové léčby 6 měsíců (s rozmezím 0–60 měsíců). Žádný pacient v našem souboru nebyl léčen SBRT současně s chemoterapií (konkomitantně), cílená léčba byla vždy min. 1 týden před a 1 týden po SBRT vysazena.
Medián velikosti GTV byl 11,9 cm3 (rozmezí 0,4–110,2 cm3). Velikosti nádorového ložiska odpovídala velikost PTV – medián 34,45 cm3 v rozmezí 3,3–218,4 cm3. Pacienti byli ozařováni nejčastěji v pěti frakcích; dávka byla volena podle dávkově-objemových histogramů rizikových orgánů v okolí cílového objemu PTV. Téměř polovina pacientů byla ozářena dávkou 5 × 6 Gy (23/50; 46 %). Dalších 10 pacientů bylo ozářeno dávkou 5 × 7 Gy (10/50; 20 %) a 9 pacientů dávkou 5 × 8 Gy (9/50; 18 %). Medián biologického ekvivalentu dávky (při / = 10) byl 54 Gy (rozmezí 48–80 Gy). Pouze 10 pacientů (10/50; 20 %) bylo po ukončení SBRT indikováno ihned k systémové léčbě.
Toxicita
Nebyla zaznamenána žádná toxicita III. a IV. stupně. Nejčastějším vedlejším účinkem byla mírná únava stupně I, často spojená s nutností dojíždění na terapii ze vzdálenějšího místa bydliště. Další akutní nežádoucí účinky stupně I–II se objevily u 5 pacientů (5/50; 10 %) – nauzea a bolesti bederní oblasti (SBRT retroperitonea), polykací potíže, nechutenství a zvýšená produkce hlenů (SBRT mediastina) a proktitida (SBRT pánve, pararektálně uložené tumory). Pozdní nežádoucí účinky byly pozorovány pouze u 2 pacientů. U 1 pacienta se po SBRT infiltrátu v levém plicním hilu objevila postradiační pneumonitis doprovázená kašlem. U druhého pacienta po SBRT dvou uzlin v mediastinu došlo v již dříve ozářeném terénu prevertebrálně k poúrazové fraktuře obratle.
Výsledky léčby (time to event data)
Medián doby sledování byl 40,4 měsíce. LC v 1 roce od ozáření byla 90 %, 3letá 75 %. Mediánu doby do lokální progrese nebylo dosaženo. Pacienti byli rozděleni na dvě skupiny podle výše aplikované dávky. Hranicí byl medián aplikovaných dávek (tj. BED10 = 54 Gy). Pacientů, kteří byli ozářeni dávkou BED10 > 54 Gy, bylo 24 (24/50; 48 %). U 95,8 % z nich (23/24) nedošlo v místě ozáření k progresi onemocnění; 26 pacientů (26/50; 52 %) bylo ozářeno dávkou nižší. U těchto pacientů nedošlo k lokální progresi pouze u 61,5 % (16/26) pacientů. Rozdíl mezi oběma skupinami pacientů byl statisticky významný (medián doby do lokální progrese 36,8 měsíce u BED10 < 54 Gy vs. medián nebyl dosažen u dávky BED10 > 54 Gy; p = 0,021) (obr. 1). Pacienti byli rovněž rozděleni do tří skupin podle lokalizace patologických uzlin (mediastinum, retroperitoneum a pánev). Rozdíl v LC onemocnění podle lokality nebyl statisticky významný (p = 0,732).
Obr. 1. Vybrané Kaplan-Meierovy křivky jednotlivých parametrů přežití.
A. Lokální kontrola. Medián doby do lokální progrese 36,8 měsíce u BED < 54 Gy vs. medián nebyl dosažen u dávky BED > 54 Gy; p = 0,021. B. Přežití bez progrese onemocnění. C. Celkové přežití. D. Přežití bez mnohočetné diseminace znemožňující použití dalších lokálních metod léčby. mS – medián přežití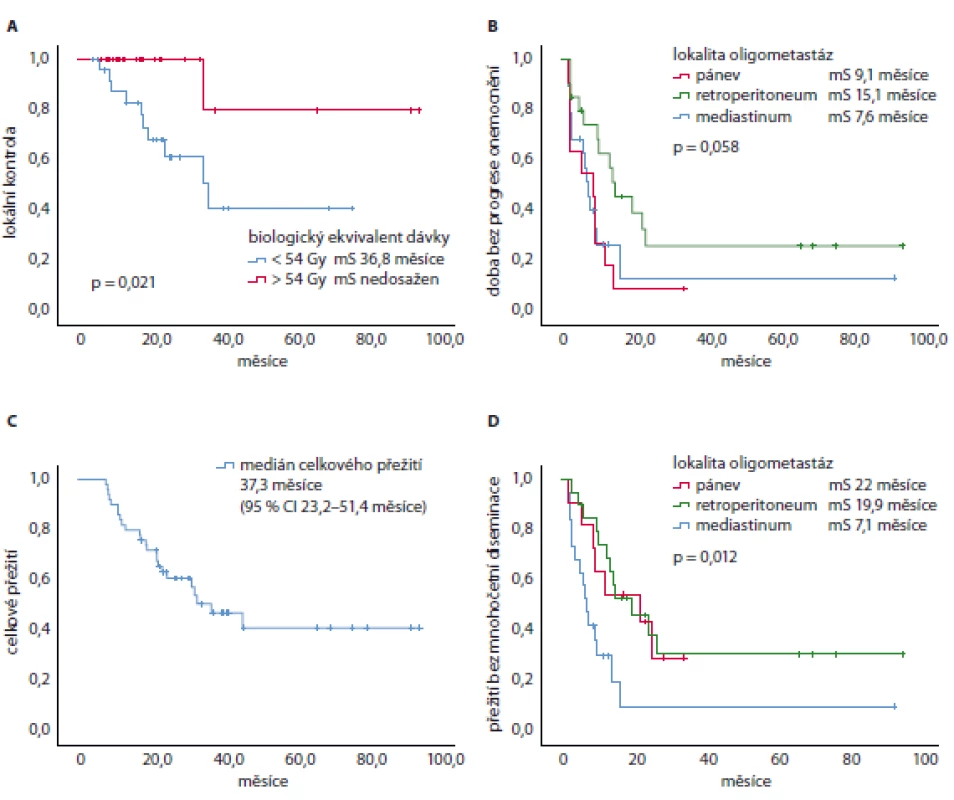
Medián PFS byl 8,2 měsíce (95% CI 7,4–11,6 měsíce). Jednoleté PFS bylo 38,5 % a 3leté 17 %. Podobně jako při výpočtu LC byli pacienti rozděleni podle výše aplikované dávky a lokality postižení. Pozorované rozdíly v PFS nebyly statisticky signifikantní (p = 0,823; resp. p = 0,058, hraniční ve prospěch uzlin retroperitonea).
Medián OS byl 37,3 měsíce (95% CI 23,2–51,4 měsíce). Jednoleté OS bylo 83 % a 3leté OS bylo 51 %. Tak jako u lokální a celkové kontroly onemocnění jsme zjišťovali vliv výše dávky a lokality postižení na OS. Rozdíl nebyl v jednotlivých parametrech statisticky významný (p = 0,086; resp. p = 0,45).
Medián FFWD byl 13,6 měsíce (s rozmezím 8,7–18,5 měsíce). Jednoletá FFWD byl 55 % a 3letá FFWD 24 %. Ani tento parametr nebyl závislý na výši dávky (p = 0,62), nicméně byl signifikantně horší u pacientů s původně mediastinálním oligometastatickým onemocněním (medián FFWD u pacientů po SBRT mediastinálních uzlinových oligometastáz 7,1 měsíce vs. po SBRT pánve 22 měsíců vs. po SBRT retroperitonea 19,9 měsíce; p = 0,012) (obr. 1).
V době analýzy (k 1. 3. 2019) žilo 26 pacientů (26/50; 52 %), 11 pacientů (11/50; 22 %) bylo bez známek onemocnění a bez chemoterapie či biologické léčby (4 pacientky medikují hormonální preparát). Celkem 24 pacientů (24/50; 48 %) zemřelo, 22 pacientů (22/50; 44 %) mělo progresi základního onemocnění a 4 pacienti (4/50; 8 %) zemřeli z jiné příčiny. K lokální recidivě v místě ozáření došlo v 11 případech, vždy došlo současně i k vzdálené diseminaci. Tito pacienti byli referováni k systémové léčbě, popř. při zhoršeném celkovém stavu k léčbě symptomatické.
Diskuze
Oligometastatické postižení lymfatických uzlin po léčbě primárního tumoru závisí na lokalizaci a histologii původního nádoru a je popisováno v 15–20 % případů [20,21]. Několik studií prokázalo zlepšení přežití pacientů po kompletní resekci retroperitoneálních, intraabdominálních a paraaortálních lymfatických recidiv [22]. Chirurgická resekce takového postižení však bývá technicky náročná a R0 resekce obtížně dosažitelná [23]. Rovněž předchozí léčba zvyšuje riziko operačních komplikací. Takoví pacienti jsou často indikováni k systémové léčbě – chemoterapii, cílené terapii či jejich kombinaci. SBRT se svými potenciálně ablativními dávkami záření nabízí chirurgii účinnou alternativu v léčbě oligometastatického postižení lymfatických uzlin. V naší studii hodnotící SBRT u 50 konsekutivních pacientů, kteří byli léčeni pro oligometastatické postižení lymfatických uzlin lokalizovaných v mediastinu, retroperitoneu nebo pánvi, jsme popsali v 1 roce a 3 letech LC 90 a 75 %, PFS 38,5 a 17 % a OS 83 a 51 %.
Jereczek-Fossa et al [24] v roce 2014 publikovali práci, ve které celkem 69 pacientů podstoupilo léčbu SBRT pro oligometastázy v lymfatických uzlinách. Autoři uvádějí jednoletou LC 81,6 % a 3letou LC 64,3 %. Medián PFS uvádějí 8,27 měsíce a 3leté PFS 11,7 %. Medián OS byl 35,4 měsíce. Další studii zabývající se touto problematikou publikovali Yeung et al [25]. Do svého výzkumu zahrnuli celkem 18 pacientů. Autoři uvedli jednoletou LC 94 %, nicméně 2letá LC byla jen 47 %. Dále uvedli jednoleté PFS 39 %, 2leté PFS 17 %, jednoleté OS 89 % a 2leté OS 74 %. Nižší LC mohla být i přes aplikaci vysokých dávek (medián BED10 = 59,5 Gy) způsobena vysokým zastoupením nádorů gastrointestinálního traktu, zejména kolorekta, které jsou považovány za méně senzitivní k RT. Recentní studii publikovali Loi et al [26], kteří retrospektivně vyhodnotili 87 pacientů. Jejich 4letá LC a OS byly vysoké, 79 a 43 %. Přehled těchto studií shrnuje tab. 2.
Tab. 2. Vybrané recentní studie SBRT hodnotící léčbu oligometastáz lymfatických uzlin. 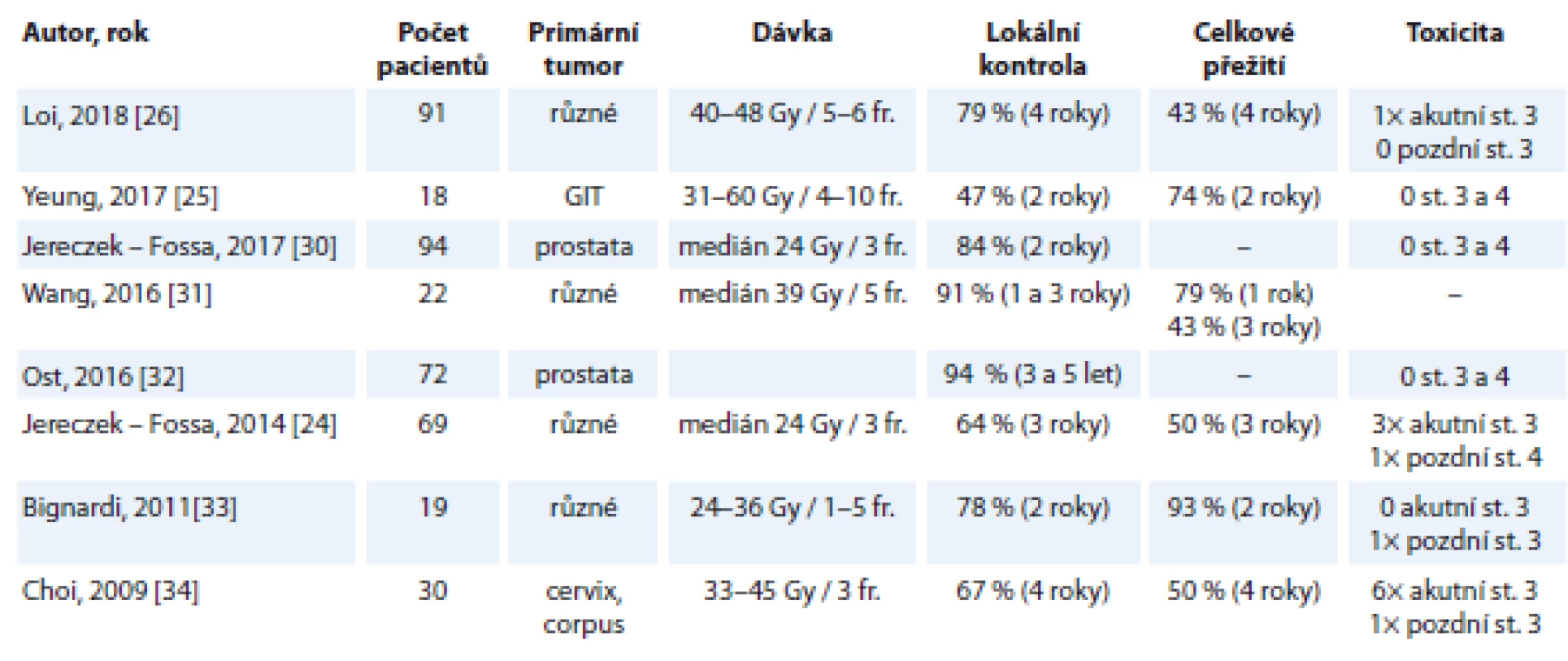
SBRT – extrakraniální stereotaktická radioterapie, GIT – gastrointestinální, Gy – Gray, fr. – frakce, st. – stupeň LC byla v našem souboru pacientů srovnatelná s dříve publikovanými studiemi. Yeung et al uvedli nižší 3letou LC (47 %), což vysvětlili vyšším počtem kolorektálních karcinomů a aplikací SBRT samostatně, bez konkomitantní systémové léčby, což je stejný postup jako v další studii od Jereczek-Fossa et al s podobnými výsledky [24,25]. V naší studii byla LC velmi dobrá (90 a 75 % v 1 roce a 3 letech) i přes vysoký počet kolorektálních karcinomů (34 %) a ozáření bez souběžné systémové léčby. Navíc jsme jednoznačně prokázali, že výše aplikované dávky má signifikantní vliv na LC. Ve skupině pacientů ozářených dávkou vyšší než BED10 > 54 Gy (medián aplikovaných dávek) byla LC signifikantně lepší než u pacientů ozářených dávkou nižší (95,8 vs. 61,5 %). Lokalita postižení (mediastinum, paraaortální oblast či pánev) na LC léčby v našem souboru vliv neměla.
Na rozdíl od velmi dobré LC je jednoleté a 3leté PFS poměrně nízké (38,5 a 17 %), což potvrzuje obecně lokální léčebný potenciál RT. Nicméně i tyto hodnoty odpovídají publikovaným datům; Yeung et al popsali 17% PFS ve 2 letech a Jereczek-Fossa et al 12% PFS ve 3 letech [24,25]. Většina našich pacientů progredovala pouze mimo ozářenou oblast, pokud došlo k lokální progresi v místě ozáření, bylo to vždy spojené s vícečetnou diseminací i mimo ozářený objem.
Hodnoty PFS by mohly vést k úvaze o nutnosti aplikace systémové léčby ihned po zjištění solitární lymfatické metastázy, popřípadě SBRT neindikovat a léčit systémově ihned. Na druhou stranu je nutné si uvědomit, že téměř pětina pacientů byla po netoxické SBRT celé 3 roky bez známek onemocnění a bez nutnosti podání jakékoliv další onkologické léčby. Toto číslo odpovídá i publikovaným datům po SBRT oligometastáz jiných lokalizací (jater, plic atd.) [5,27]. Přibližně pětina oligometastatických pacientů je po lokální léčbě dlouhodobě bez známek onemocnění a nutnosti zařadit do léčby systémovou terapií. Budoucí biomarkerové studie by měly identifikovat podmnožinu pacientů, kteří na tuto léčbu reagují dlouhodobě a mohou tak těžit z maximálního lokálního přístupu, a odlišit je od pacientů, u kterých by tato léčba znamenala víceméně overtreatment, nebo dokonce oddálení potřebné systémové léčby.
Celkem 21 pacientů (21/50; 42 %) z našeho souboru v průběhu sledování progredovalo po provedené SBRT mimo ozářený objem opět pouze oligometastázami, které mohly být znovu indikovány k lokální terapii (SBRT, RFA atd.). To umožnilo dále odložit cytotoxickou chemoterapii nebo jiný typ systémové léčby. Součástí naší analýzy bylo také hodnocení doby do vícečetné progrese, která již použití FFWD neumožňuje. Odložení chemoterapie oddálí vznik vedlejších účinků s ní spojených, a tím zlepší kvalitu života pacientů (u pacientů bez nežádoucích účinků systémové léčby alespoň sníží stupeň jejich předléčenosti).
Regionální recidiva či vzdálené oligometastázy v průběhu sledování po SBRT by se neměly stát důvodem ke kontraindikaci dalších lokálních metod léčby; naopak, všude, kde je to možné, by měly být lokální metody léčby indikovány, aby se interval do systémové léčby dále prodloužil. Většina pacientů systémovou léčbu dříve či později potřebuje. V souladu s tím, že se u všech pacientů jedná de facto o paliativní léčbu, je snaha, aby k indikaci systémové terapie došlo co možná nejpozději, pokud v dané klinické situaci není jednoznačná evidence pro dřívější podání chemoterapie, resp. jiného typu systémové léčby. Bude nutné vyčkat dalších studií, které by měly naznačit optimální načasování SBRT v léčbě těchto pacientů.
OS pacientů se v naší studii výrazněji nelišilo od publikovaných údajů. I přes další diseminaci bylo OS těchto pacientů velmi dobré. Jednalo se o neselektovanou skupinu pacientů z běžné klinické praxe. Taková práce může pomoci zvýšit „level of evidence“ této metody a její využití v běžné klinické praxi.
Řada publikovaných studií prokázala lepší efektivitu ablativních dávek záření (kdy biologický ekvivalent aplikované dávky přesáhne BED10 ≥ 100 Gy) oproti dávkám nižším [28]. Nicméně dávky aplikované do patologických uzlin (především v oblasti pánve) musejí být téměř vždy významně nižší. Je to z důvodu velmi těsné prostorové blízkosti struktur gastrointestinálního traktu, které mají nízké tolerance k záření a není u nich možné zajistit prostorovou stálost při každé frakci záření. Z těchto důvodů byla v našem souboru nejčastěji předepisována dávka 5 × 6 Gy a medián biologického ekvivalentu BED10 byl 54 Gy (v rozmezí 48–80 Gy). Toxicita naší léčby byla při velmi dobré LC minimální. SBRT tak znamená krátkou, většinou ambulantní výborně tolerovanou léčbu nevyžadující od pacientů žádnou speciální přípravu či významnější omezení kvality života.
Jsme si vědomi limitů naší studie; především je nutné upozornit na retrospektivní charakter sledování, omezené množství pacientů a z tohoto důvodu v současné době nemožnost statistického vyhodnocení efektivity na základě typu nádoru, histologie či dalších údajů. Heterogenita léčby také neumožňuje identifikovat optimální léčebnou strategii, zejména u pacientů s nádory s vyšším rizikem lokálního selhání nebo včasného vzdáleného šíření. Limitací hodnocení OS je samozřejmě heterogenita další léčby po SBRT. Přesto však je pro aplikující odborníky ukazatel OS důležitou popisnou charakteristikou pacientů před jejich event. indikací k této sofistikované metodě RT [29].
Závěr
Naše studie prokázala, že cílená stereotaktická radioterapie, SBRT, je v případě oligometastatického postižení lymfatických uzlin minimálně toxickou a velmi efektivní lokální metodou léčby. Je schopna s minimálním úsilím pacienta oddálit použití cytotoxické chemoterapie, a tím zlepšit kvalitu života pacientů. Necelá pětina takto léčených pacientů přežívá bez známek onemocnění dlouhodobě. Identifikace pacientů, kteří mají z této léčby největší prospěch, správné načasování SBRT v léčebné strategii, popř. velikost dávky by se měly stát předmětem dalších studií.
Tato práce byla částečně podpořena Ministerstvem zdravotnictví České republiky – program Koncepční rozvoj výzkumné organizace (MMCI 00209805). Práce byla vypracována s grantovou podporou Ministerstva zdravotnictví České republiky, grant č. 19-00354.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
MUDr. Petr Burkoň, Ph.D.
Klinika radiační onkologie
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: burkon@mou.cz
Obdrženo: 19. 8. 2019
Přijato: 26. 8. 2019
Zdroje
1. Hellman S, Weichselbaum RR. Oligometastases. J Clin Oncol 1995; 13 (1): 8–10. doi: 10.1200/JCO.1995.13.1.8.
2. Weichselbaum RR, Hellman S. Oligometastases revisited. Nat Rev Clin Oncol 2011; 8 (6): 378–382. doi: 10.1038/nrclinonc.2011.44.
3. Niibe Y, Hayakawa K. Oligometastases and oligo-recurrence: the new era of cancer therapy. Jpn J Clin Oncol 2010; 40 (2): 107–111. doi: 10.1093/jjco/hyp167.
4. Bignardi M, Navarria P, Mancosu P et al. Clinical outcome of hypofractionated stereotactic radiotherapy for abdominal lymph node metastases. Int J Radiat Oncol Biol Phys 2011; 81 (3): 831–838. doi: 10.1016/j.ijrobp.2010.05. 032.
5. Burkoň P, Slávik M, Kazda T et al. Extrakraniální stereotaktická radioterapie – přehled současných indikací. Klin Onkol 2019; 32 (1): 10–24. doi: 10.14735/amko201910.
6. Ettinger DS, Wood DE, Aisner DL et al. NCCN Guidelines insights: non-small cell lung cancer, version 5.2018. J Natl Compr Canc Netw 2018; 16 (7): 807–821. doi: 10.6004/ jnccn.2018.0062.
7. Postmus PE, Kerr KM, Oudkerk M et al. Early and locally advanced non-small-cell lung cancer (NSCLC): ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2017; 28 (Suppl 4): 1–21. doi: 10.1093/annonc/mdx222.
8. Videtic GM, Donington J, Giuliani M et al. Stereotactic body radiation therapy for early-stage non-small cell lung cancer: Executive Summary of an ASTRO EvidenceBased Guideline. Pract Radiat Oncol 2017; 7 (5): 295–301. doi: 10.1016/j.prro.2017.04.014.
9. Tree AC, Khoo VS, Eeles RA et al. Stereotactic body radiotherapy for oligometastases. Lancet Oncol 2013; 14 (1): 28–37. doi: 10.1016/S1470-2045 (12) 70510-7.
10. Corbin KS, Hellman S, Weichselbaum RR. Extracranial oligometastases: a subset of metastases curable with stereotactic radiotherapy. J Clin Oncol 2013; 31 (11): 1384–1390. doi: 10.1200/JCO.2012.45.9651.
11. Palma DA, Olson RA, Harrow S et al. Stereotactic ablative radiation therapy for the comprehensive treatment of oligometastatic tumors (SABR-COMET): results of a randomized trial. Int J Radiat Oncol Biol Phys 2018; 102 (3): S3–S4. doi: 10.1016/j.ijrobp.2018.06.105.
12. Burkoň P, Šlampa P, Kazda T et al. Stereotactic body radiation therapy for colorectal cancer liver metastases; early results. Klin Onkol 2012; 25 (Suppl 2): 2S93–2S97. doi: 10.14735/amko20122S93.
13. Nagata Y, Takayama K, Matsuo Y et al. Clinical outcomes of a phase I/II study of 48 Gy of stereotactic body radiotherapy in 4 fractions for primary lung cancer using a stereotactic body frame. Int J Radiat Oncol Biol Phys 2005; 63 (5): 1427–1431. doi: 10.1016/j.ijrobp.2005.05.034.
14. Heinzerling JH, Anderson JF, Papiez L et al. Four-dimensional computed tomography scan analysis of tumor and organ motion at varying levels of abdominal compression during stereotactic treatment of lung and liver. Int J Radiat Oncol Biol Phys 2008; 70 (5): 1571 – 1578. doi: 10.1016/j.ijrobp.2007.12.023.
15. Nagata Y, Wulf J, Lax I, et al. Stereotactic radiotherapy of primary lung cancer and other targets: results of consultant meeting of the International Atomic Energy Agency. Int J Radiat Oncol Biol Phys 2011; 79 : 660–669. doi: 10.1016/j.ijrobp.2010.10.004.
16. Lagerwaard FJ, Haasbeek CJ, Smit EF et al. Outcomes of risk-adapted fractionated stereotactic radiotherapy for stage I non-small-cell lung cancer. Int J Radiat Oncol Biol Phys 2008; 70 (3): 685–692. doi: 10.1016/j.ijrobp.2007.10.053.
17. Benedict SH, Yenice KM, Followill D et al. Stereotactic body radiation therapy: the report of AAPM Task Group 101. Med Phys 2010; 37 (8): 4078–4101. doi: 10.1118/1.3438081.
18. Ong CL, Verbakel WFAR, Cuijpers JP, et al. Stereotactic radiotherapy for peripheral lung tumors: a comparison of volumetric modulated arc therapy with 3 other delivery techniques. Radiother Oncol 2010; 97 (3): 437–442. doi: 10.1016/j.radonc.2010.09.027.
19. Purdie TG, Bissonnette JP, Franks K, et al. Cone-beam computed tomography for on-line image guidance of lung stereotactic radiotherapy: localization, verifcation, and intrafraction tumor position. Int J Radiat Oncol Biol Phys 2007; 68 (1): 243–252. doi: 10.1016/ j.ijrobp.2006.12.022.
20. van Gestel YR, de Hingh IH, van Herk-Sukel MP et al. Patterns of metachronous metastases after curative treatment of colorectal cancer. Cancer Epidemiol 2014; 38 (4): 448–454. doi: 10.1016/j.canep.2014.04.004.
21. Todo Y, Kato H, Minobe S et al. Initial failure site according to primary treatment with or without para-aortic lymphadenectomy in endometrial cancer. Gynecol Oncol 2011; 121 (2): 314–318. doi: 10.1016/j.ygyno.2011.01.019.
22. Shibata D, Paty PB, Guillem JG, et al. Surgical management of isolated retroperitoneal recurrences of colorectal carcinoma. Dis Colon Rectum 2002; 45 (6): 795–801. doi: 10.1007/s10350-004-6300-3.
23. Jereczek-Fossa BA, Ronchi S, Orecchia R. Is stereotactic body radiotherapy (SBRT) in lymph node oligometastatic patients feasible and effective? Rep Pract Oncol Radiother 2015; 20 (6): 472–483. doi: 10.1016/j.rpor.2014.10.004.
24. Jereczek-Fossa BA, Ronchi S, Piperno G et al. Linac-based stereotactic body radiotherapy for oligometastatic patients with single abdominal lymph node recurrent cancer. Am J Clin Oncol 2014; 37 (3): 227–233. doi: 10.1097/COC.0b013e3182610878.
25. Yeung R, Hamm J, Liu M et al. Institutional analysis of stereotactic body radiotherapy (SBRT) for oligometastatic lymph node metastases. Radiat Oncol 2017; 12 (1): 105. doi: 10.1186/s13014-017-0820-1.
26. Loi M, Frelinghuysen M, Klass ND et al. Locoregional control and survival after lymph node SBRT in oligometastatic disease. Clin Exp Metastasis 2018; 35 (7): 625–633. doi: 10.1007/s10585-018-9922-x.
27. Burkon P, Kazda T, Pospisil P et al. Ablative dose stereotactic body radiation therapy for oligometastatic disease: a prospective single institution study. Neoplasma 2019; 66 (2): 315–325. doi: 10.4149/neo_2018_180731N558.
28. Onishi H, Shirato H, Nagata Y et al. Stereotactic body radiotherapy (SBRT) for operable stage I non-small-cell lung cancer: can SBRT be comparable to surgery? Int J Radiat Oncol Biol Phys 2011; 81 (5): 1352–1358. doi: 10.1016/j.ijrobp.2009.07.1751.
29. Winkel D, Bol GH, Werensteijn-Honingh AM et al. Evaluation of plan adaptation strategies for stereotactic radiotherapy of lymph node oligometastases using online magnetic resonance image guidance. Phys Imaging Radiat Oncol 2019; 9 : 58–64. doi: 10.1016/j.phro.2019.02.003.
30. Jereczek-Fossa BA, Fanetti G, Fodor C et al. Salvage stereotactitc body radiotherapy for isolated lymph node recurrent prostate cancer: single institution series of 94 consecutive patients and 124 lymph nodes. Clin Genitourin Cancer 2017; 15 (4): 623–632. doi: 10.1016/ j.clgc.2017.01.004.
31.Wang Z, Wang J, Zhuang H et al. Stereotactic body radiation therapy induces fast tumor control and symptom relief in patients with iliac lymph node metastasis. Sci Rep 2016; 29 (6): 37987. doi: 10.1038/srep 37987.
32. Ost P, Jereczek-Fossa BA, Van As N et al. Pattern of progression after stereotactic body radiotherapy for oligometastatic prostate cancer nodal recurrences. Clin Oncol (R Coll Radiol) 2016; 28 (9): 115–120. doi: 10.1016/ j.clon.2016.04.040.
33. Bignardi M, Navarria P, Mancosu P et al. Clinical outcome of hypofractionated stereotactic radiotherapy for abdominal lymph nodemetastases. Int J Radiat Oncol Biol Phys 2011; 81 (3): 831–838. doi: 10.1016/ j.ijrobp.2010.05.032.
34. Choi CW, Cho CK, Yoo SY et al. Image-guided stereotactic body radiation therapy in patients with isolated para-aortic lymph nodemetastases from uterine cervical and corpus cancer. Int J Radiat Oncol Biol Phys 2009; 74 (1): 147–153. doi: 10.1016/j.ijrobp.2008.07.020.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek Karcinom děložního hrdlaČlánek Aktuality z odborného tisku
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2020 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Nejasný stín na plicích – kazuistika
- Jak souvisí postcovidový syndrom s poškozením mozku?
-
Všechny články tohoto čísla
- Pohybová liečba ako prevencia a podporná liečba onkologických ochorení
- Metformin v onkologii – jak daleko jsme od jeho etablování coby protinádorového léku?
- Využití extrakraniální stereotaktické radioterapie při oligometastatickém postižení lymfatických uzlin
- Léčba karcinomu hrdla děložního s postižením paraaortálních uzlin – retrospektivní hodnocení vlastního souboru
- HPV 16 v patogenéze nádorov horného aerodigestívneho traktu
- Invazívna rino-orbito-cerebrálna forma mukormykózy u detskej pacientky s akútnou leukémiou
- Využití indocyaninové zeleně k peroperační diagnostice zdroje chylózního ascitu a autologního tkáňového lepidla (Vivostatu) k jeho ošetření
- Protirakovinný účinek melatoninu s radioprotektivní a radiosenzitivní vlastností
- Aktuality z odborného tisku
- Vzpomínka na prof. RNDr. M. Lokajíčka, DrSc.
- Účinek kapecitabinu v léčbě triple negativního karcinomu prsu
- Karcinom děložního hrdla
- Asociace polymorfizmu NAD (P) H chininové oxidoreduktázy 1 rs1800566 s karcinomem močového měchýře a prostaty – systematický přehled a metaanalýza
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Karcinom děložního hrdla
- Pohybová liečba ako prevencia a podporná liečba onkologických ochorení
- HPV 16 v patogenéze nádorov horného aerodigestívneho traktu
- Metformin v onkologii – jak daleko jsme od jeho etablování coby protinádorového léku?
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



