-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Malígne nádory štítnej žľazy
Malignant Tumors of Thyroid Gland
Aim:
The incidence of thyroid cancer has been increasing. The aim of this work was to determine risk factors, diagnostic methods and extent of surgical treatment of malignant goiter.Material and Methods:
The authors retrospectively analyzed patients who were surgically treated for thyroid disease at the Department of Otorhinolaryngology, Head and Neck Surgery, Comenius University, Jessenius Faculty of Medicine, Teaching Hospital in Martin, Slovakia, from the January 1st, 2006 to December 31st, 2013, for thyroid disease. The incidence, risk factors of malignant thyroid tumors, indication for surgery and its complications were evaluated.Results:
A total of 1,620 adult patients were surgically treated for thyroid disease at the Department of ENT, Head and Neck Surgery, CU JMF, UH in Martin, Slovakia, between 2006 – 2013. Malignant tumors were identified in 238 patients (15%). Microcarcinoma (incidentally detected malignant tumor ≤ 1 cm) occurred in 78 cases (5%). Malignant thyroid tumor was more common in younger patients (p = 0.002). Newly created and larger nodules positively correlated with the occurrence of malignancy (p = 0.003, p = 0.041, resp.). Gender, family history of thyroid disorder, previous radiation therapy, and previous malignancy did not affect the incidence of malignant tumor of thyroid gland. High sensitivity and specificity in the diagnosis of malignant thyroid nodule was observed using aspiration cytology (75%, 97%, resp.) and intraoperative histopathological examination (88%, 100%, resp.).Conclusion:
Malignant tumor of thyroid gland is more common in younger patients with newly developed nodule. The risk factors of malignancy increase with the size of the thyroid nodule. Aspiration cytology and peroperative histopathology have high sensitivity and specificity in the diagnosis of malignant thyroid tumor; therefore, they should be a standard method in the diagnosis of nodular goiter. The method of choice in the treatment of thyroid malignancy is total thyroidectomy.Key words:
neoplasm – thyroid gland – risk factors – aspiration cytology – intraoperative histology – thyroidectomy
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Submitted:
1. 12. 2014Accepted:
20. 1. 2015
Autoři: B. Uhliarová 1,2; G. Bugová 1; A. Hajtman 1
Působiště autorů: Klinika otorinolaryngológie a chirurgie hlavy a krku JLF UK a UN Martin, Slovenská republika 1; Otorinolaryngologické oddelenie, FNsP F. D. Roosevelta Banská Bystrica, Slovenská republika 2
Vyšlo v časopise: Klin Onkol 2015; 28(2): 121-129
Kategorie: Původní práce
doi: https://doi.org/10.14735/amko2015121Souhrn
Úvod:
Incidencia zhubných nádorov štítnej žľazy má stúpajúcu tendenciu. Cieľom práce bolo stanoviť rizikové faktory vzniku malígneho nádoru štítnej žľazy, diagnostické metódy a rozsah chirurgickej liečby malígnej strumy.Materiál a metódy:
V práci autori retrospektívne analyzovali pacientov, ktorí boli chirurgicky liečení na Klinike otorinolaryngológie a chirurgie hlavy a krku JLF UK a UN v Martine v rokoch 2006 – 2013 pre ochorenie štítnej žľazy. Sledovali incidenciu, rizikové faktory vzniku malígneho nádoru štítnej žľazy, indikácie na chirurgickú liečbu a jej komplikácie.Výsledky:
Na Klinike otorinolaryngológie a chirurgie hlavy a krku JLF UK a UN v Martine bolo v rokoch 2006 – 2013 operovaných 1 620 pacientov v dospelom veku pre ochorenie štítnej žľazy. Malígny nádor diagnostikovali u 238 pacientov (15 %). Incidentálny mikrokarcinóm (náhodne detegovaný zhubný nádor veľkosti ≤ 1 cm) sa vyskytoval u 78 pacientov (5 %). Zhubný nádor bol častejší u mladších (p = 0,002). Novovzniknutý uzol a veľkosť uzla korelovali s výskytom malignity (p = 0,003, resp. p = 0,041). Pohlavie, rodinná anamnéza, rádioterapia, predchádzajúci výskyt malignity nemali vplyv na výskyt malígneho nádoru štítnej žľazy. V diagnostike malígneho uzla sme zaznamenali vysokú senzitivitu a špecifitu aspiračnej cytológie (75 %, resp. 97 %) a peroperačného histopatologického vyšetrenia (88 %, resp. 100 %). Všetci pacienti boli liečení chirurgicky v zmysle totálnej tyreoidektómie, ktorá bola doplnená o terapeutickú lymfadenektómiu u 12 %. Z pooperačných komplikácií sme zaznamenali tranzitórnu hypokalciémiu u 10 %, tranzitórnu jednostrannú parézu návratného nervu u 3 % a trvalú léziu návratného nervu u 1 % pacientov. Trvalá hypoparatyreóza, obojstranná lézia návratného nervu (tranzitórna/ permanentná) sa nevyskytovala.Záver:
Malígny nádor štítnej žľazy je častejší u mladších pacientov s novovzniknutým uzlom štítnej žľazy. Riziko stúpa s veľkosťou uzla. Aspiračná cytológia a peroperačné histopatologické vyšetrenie majú vysokú senzitivitu a špecifitu v diagnostike malígneho nádoru štítnej žľazy, preto by mali tvoriť štandardnú súčasť diferenciálnej diagnostiky uzlovej strumy. Metódou voľby v liečbe zhubného nádoru štítnej žľazy je totálna tyreoidektómia.Kľúčové slová:
malígny nádor – štítna žľaza – rizikové faktory – aspiračná cytológia – peroperačná histológia – tyreoidektómiaÚvod
Ochorenia štítnej žľazy sa vyskytujú u 4 – 7 % dospelej populácie, malignita sa diagnostikuje u 5 – 10 % tyreopatií. Najčastejším histopatologickým typom je papilárny karcinóm (80 % všetkých malignít štítnej žľazy). K rizikovým faktorom vzniku zhubnej choroby štítnej žľazy patrí už existujúce ochorenie štítnej žľazy, predchádzajúce ožarovanie oblasti hlavy, krku a mediastina a pozitívna rodinná anamnéza tyreopatie [1,2].
Incidencia karcinómu štítnej žľazy za posledné tri dekády značne stúpla vo svete aj na Slovensku. Na vzostupe výskytu karcinómu štítnej žľazy sa môže podieľať rádioaktívny odpad vznikajúci pri testovaní atómových bômb a pri haváriách jadrových reaktorov, znečisťovanie životného prostredia, ale aj zlepšená diagnostika, čo sa odráža najmä vo zvýšení záchytu malých karcinómov. Stabilný podiel úmrtí napriek zvýšenému výskytu karcinómu podporuje skôr druhé vysvetlenie [3,4].
Materiál a metodika
V práci autori retrospektívne analyzovali pacientov v dospelom veku, ktorí boli chirurgicky liečení na Klinike otorinolaryngológie a chirurgie hlavy a krku JLF UK a UN v Martine (Klinika ORL a ChHaK JLF UK a UN v Martine) v rokoch 2006 – 2013 pre ochorenie štítnej žľazy. V sledovanom súbore sme sledovali incidenciu malígneho ochorenia, indikácie na chirurgickú liečbu a jej komplikácie. Zamerali sme sa na rizikové faktory vzniku malígneho ochorenia – vek, pohlavie, charakter ochorenia štítnej žľazy, veľkosť uzla štítnej žľazy, výskyt malignity, predchádzajúce ožarovanie oblasti hlavy, krku a mediastina a pozitívna rodinná anamnéza v zmysle tyreopatie u prvostupňových príbuzných (rodičia, súrodenci, deti).
Charakter ochorenia štítnej žľazy a indikácie na chirurgickú liečbu
Všetci pacienti boli vyšetrení endokrinológom, ktorý indikoval chirurgickú liečbu. Všetci pacienti mali vyšetrený funkčný (TSH, T3, T4, protilátky) aj morfologický (ultrasonografia) stav štítnej žľazy.
Typ ochorenia štítnej žľazy sme stanovili na základe histopatologického vyšetrenia. Pacientov sme rozdelili do troch skupín: A. benígne ochorenie, B. malígny nádor štítnej žľazy, C. incidentálny mikrokarcinóm štítnej žľazy, čiže zhubný nádor veľkosti ≤ 1 cm detegovaný náhodne u pacientov operovaných pre benígnu patológiu štítnej žľazy na základe definitívneho histopatologického vyšetrenia.
Pri uzlovej degenerácii sme stanovovali veľkosť uzla štítnej žľazy v milimetroch, a to jeho meraním v resekáte štítnej žľazy. Za de novo patológiu štítnej žľazy sme považovali ochorenie, ktoré bolo endokrinológom indikované na chirurgickú liečbu bez predchádzajúcej konzervatívnej terapie.
V diagnostike malígneho ochorenia štítnej žľazy sme sledovali indikácie a úspešnosť tenkoihlovej aspiračnej cytológie (fine-needle aspiration cytology –FNAC) a peroperačného histopatologického vyšetrenia (POH). Pri viacuzlovej degenerácii parenchýmu bola vzorka na FNAC a POH odobratá z dominantého uzla a/ alebo uzla suspektného z malignity. Výsledok cytologického vyšetrenia bol hodnotený podľa Bethesda klasifikácie z roku 2010 [5]: I. nediagnostikovateľná/ nedostačujúca vzorka, II. benígne, III. atypie neistého významu alebo folikulárne lézie neistého významu, IV. folikulárna neoplázia alebo podozrenie z folikulárnej neoplázie, V. podozrenie z malignity, VI. malignita. Výsledok FNAC sme rozdelili do troch skupín: A. skupina II., B. skupina III. a IV., C. skupina V. a VI. Záver POH sme podobne ako cytológiu rozdelili do troch skupín: A. benígny nález, bez štruktúr konvenčného papilárného karcinómu, B. folikulárna lézia, atypie, nález suspektný z malignity, ale s odkazom na definitívne histopatologické vyšetrenie, C. nález vysoko suspektný z malignity, jednoznačná malignita.
Chirurgická liečba
Všetci pacienti v sledovanom súbore boli liečení chirurgicky. Sledovali sme rozsah chirurgickej liečby u pacientov s malígnym ochorením štítnej žľazy. Z komplikácií sme sa zamerali na výskyt hypokalciémie (hodnota celkového kalcia < 2,2 mmol/ l a ionizovaného kalcia < 1,13 mmol/ l) a lézie nervus laryngeus recurrens (NLR). Za trvalý sme považovali nález, ktorý pretrvával viac ako šesť mesiacov.
Štatistická analýza
Charakteristiku súboru pacientov a sledované dáta sme vyhodnotili pomocou frekvenčnej sumarizácie a deskriptívnej štatistiky – priemer, medián, smerodajná odchýlka, medián, kvartil minima a maxima. Rozdiely medzi sledovanými parametrami sme vyhodnotili štandardnými neparametrickými testami. Neparametrické metódy sme zvolili preto, že nebol splnený predpoklad parametrických testov, normalita dát.
Pri hodnotení vzťahu kategoriálnych premenných pre dve kategórie binárneho charakteru (áno/ nie) sme použili Pearsonov χ2 - test s Yatesovou koreláciou. Rozdiely sledovaných parametrov medzi sledovanými skupinami pacientov sme vyhodnotili pomocou Mann‑Whitney U testu (dve nezávislé kategórie) a Kruskal ‑ Wallis testu (tri nezávislé kategórie). Na analýzu rozptylu sledovanej hodnoty s prítomnosťou viacerých faktorov sme použili dvojfaktorovú ANOVA s post hoc Duncan testom.
Za štatisticky významné sme v rámci všetkých použitých testov považovali hodnoty hladiny významnosti p < 0,05. Na štatistickú analýzu sme použili program STATISTICA CZ 10.
Výsledky
Charakteristika súboru pacientov
Na Klinike ORL a ChHaK JLF UK a UN v Martine bolo v rokoch 2006– 2013 operovaných 1 745 pacientov pre ochorenie štítnej žľazy, 1 620 chorých (93 %) bolo v dospelom veku. V súbore bolo 295 mužov (18 %), priemerný vek 54,2 ± 13,2 rokov (v rozmedzí 24 – 81 rokov) a 1 325 žien (82 %), priemerný vek 52,8 ± 13,4 rokov (v rozmedzí 19 – 84 rokov).
Malígny nádor sme diagnostikovali u 238 pacientov (15 %). Histopatologické typy zhubného tumoru štítnej žľazy sú uvedené v tab. 1. Incidentálny mikrokarcinóm, čiže zhubný nádor veľkosti ≤ 1 cm detegovaný náhodne u pacientov operovaných pre benígnu patológiu štítnej žľazy, sme diagnostikovali u 78 pacientov (5 %).
Tab. 1. Histopatologické typy malígnych nádorov štítnej žľazy. 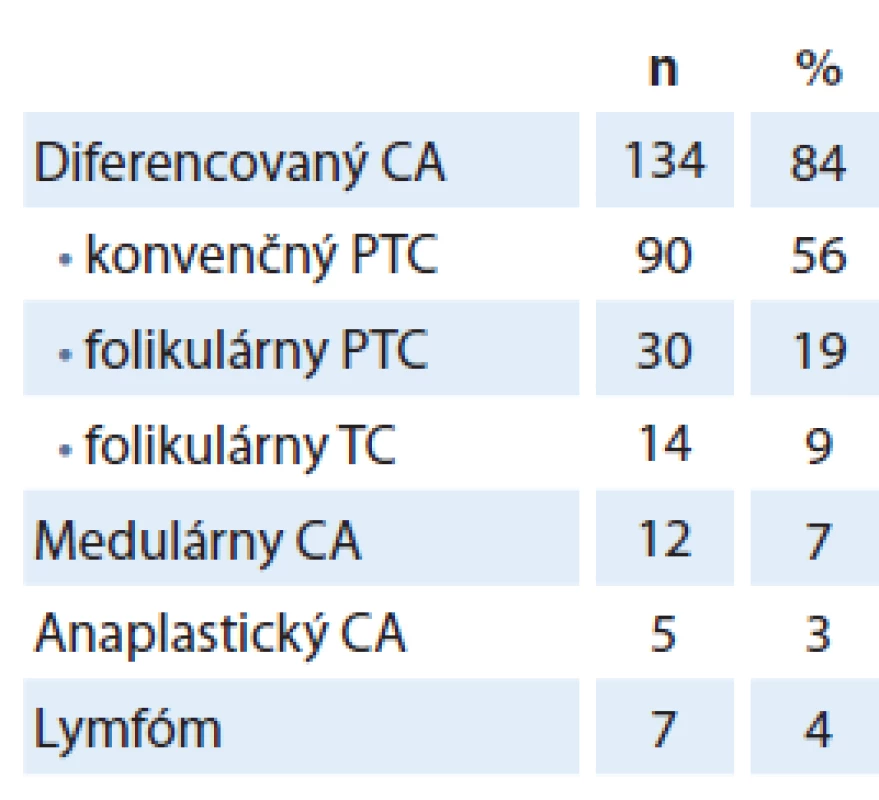
CA – karcinóm, PTC – papilárny karcinóm štítnej žľazy, TC – karcinóm štítnej žľazy, n – počet pacientov Rozdiel vo výskyte malignity medzi pohlaviami sme nezaznamenali (p = 0,189). Pacienti operovaní pre malígne ochorenie boli v mladšom veku (priemerný vek 44 ± 12 rokov, v rozmedzí 21 – 76 rokov), v porovnaní s pacientmi operovanými pre benígne ochorenie (priemerný vek 53,78 ± 13,97 rokov; v rozmedzí 19 – 84 rokov; p = 0,0019) alebo náhodne diagnostikovaným mikrokarcinómom štítnej žľazy (priemerný vek 57,04 ± 15,8 rokov, v rozmedzí 24 – 84 rokov; p = 0,0021) (graf 1).
Graf 1. Výskyt malígneho nádoru štítnej žľazy. 
*p < 0,05, údaje sú uvedené ako medián ± SD Pozitívna rodinná anamnéza v zmysle tyreopatie bola u 23 % chorých s benígnym, 18 % s malígnym ochorením a 17 % pacientov, ktorí mali mikrokarcinóm štítnej žľazy (p = 0,741). Výskyt predchádzajúceho malígneho ochorenia sa nelíšil medzi sledovanými skupinami pacientov (benígne vs. malígne vs. mikrokarcinóm; p = 0,856). Predchádzajúce ožarovanie oblasti hlavy, krku a mediastina bolo u troch pacientov operovaných pre polynodóznu strumu. U jedného sa detegoval papilárny mikrokarcinóm v teréne multinodóznej prestavby parenchýmu štítnej žľazy (graf 2).
Graf 2. Rizikové faktory vzniku malígneho nádoru štítnej žľazy. 
CA – karcinóm, ERT – rádioterapia, údaje sú uvedené ako medián ± SD Indikácie na chirurgickú liečbu ochorenia štítnej žľazy
Najčastejšou indikáciou na chirurgickú liečbu boli polynodózna struma (36 %) a solitárny uzol štítnej žľazy (28 %), ktoré boli podmienené malignitou u 5 %, resp. 16 % pacientov (tab. 2). Medián veľkosti uzla bol 20 ± 9 mm (4 – 50 mm) u pacientov s polynodóznou strumou a 27 ± 15 mm (6 – 90 mm) v skupine so solitárnym uzlom (p = 0,024). Signifikantné rozdiely vo veľkosti uzla v prípade malignity u pacientov s polynodóznou strumou sme nezaznamenali (p = 0,893). U pacientov so solitárnym uzlom štítnej žľazy sme detegovali súvislosť medzi veľkosťou uzla a incidenciou malignity (p = 0,041) (graf 3).
Tab. 2. Indikácie na chirurgickú liečbu a výskyt malígneho nádoru štítnej žľazy. 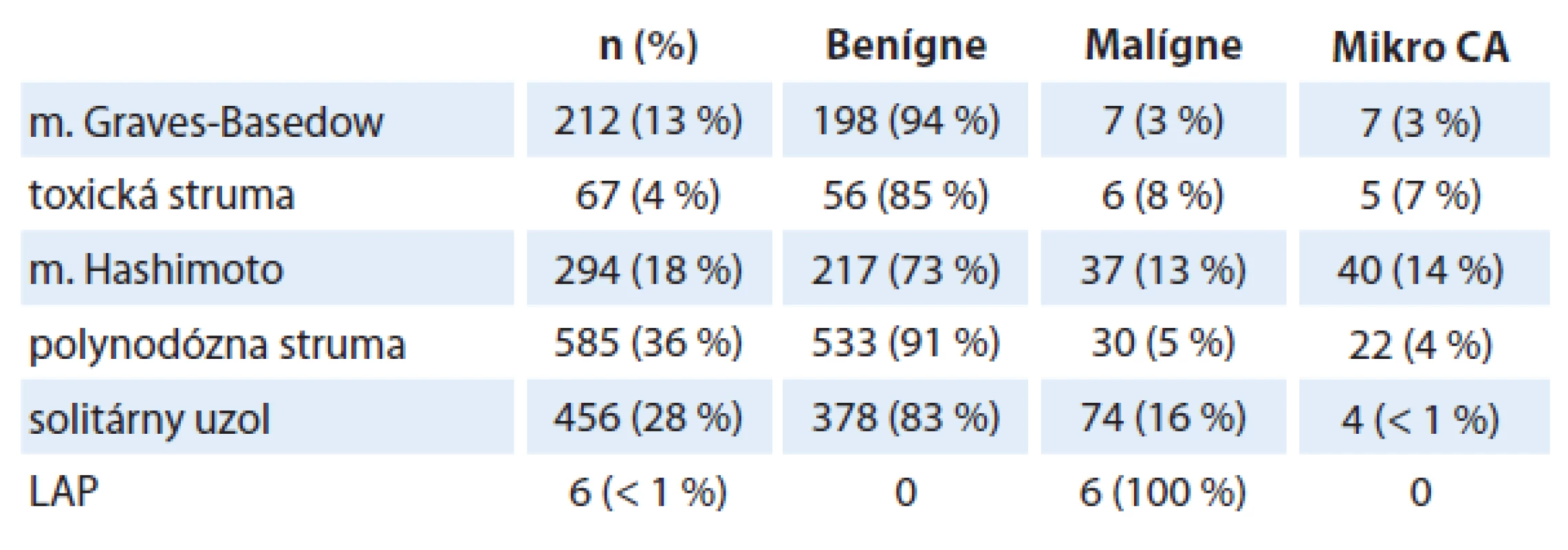
n – počet pacientov, CA – karcinóm, LAP – lymfonodopátia Graf 3. Veľkosť uzla štítnej žľazy a malignita. 
*p < 0,05, údaje sú uvedené ako medián ± SD Incidentálny mikrokarcinóm sa signifikantne častejšie diagnostikoval u pacientov operovaných pre Hashimotovu tyreoiditídu (p = 0,0013) a polynodóznu strumu (p = 0,034) (graf 4). Medián veľkosti mikrokarcinómu bol 5,7 mm ± 3,25 mm (2 – 10 mm).
Graf 4. Výskyt incidentálneho mikrokarcinómu štítnej žľazy. 
*p < 0,05, **p < 0,005 údaje sú uvedené ako medián ± SD Multifokálny mikrokarcinóm sme diagnostikovali u 20 pacientov (26 %), z toho u 14 (18 %) sa detegoval v obidvoch lalokoch štítnej žľazy. U chorých operovaných pre malígny nádor sa viacero ložísk zhubného nádoru diagnostikovalo u 24 (15 %) pacientov, obojstranné postihnutie lalokov štítnej žľazy u 15 z nich (9 %).
Indikáciu na chirurgickú liečbu pre de novo ochorenie štítnej žľazy sme detegovali u 372 (23 %) chorých. Malignita sa vyskytovala až u 43 % z nich (p = 0,003) (graf 5A). Rozdiely v dĺžke trvania choroby štítnej žľazy medzi skupinami pacientov sme nezaznamenali (p = 0,659) (graf 5B).
Graf 5. Dĺžka trvania choroby štítnej žľazy a výskyt jej malígneho nádoru. 
A. Výskyt de novo ochorenia štítnej žľazy v jednotlivých chorobách. B. Vzťah medzi dĺžkou trvania choroby štítnej žľazy a výskytu zhubného nádoru štítnej žľazy. mikro CA – mikrokarcinóm, *p < 0,05, údaje sú uvedené ako medián ± SD Tenkoihlová aspiračná cytológia a peroperačné histopatologické vyšetrenie
V diferenciálnej diagnostike uzlovej prestavby parenchýmu štítnej žľazy bola FNAC realizovaná u 55 % a POH u 60 % pacientov. Najčastejšou indikáciou FNAC aj POH bol solitárny uzol (graf 6A). Senzitivita a špecifita FNAC v diagnostike malígneho ochorenia štítnej žľazy bola 75 %, resp. 97 %. Senzitivita a špecifita POH v diagnostike malígneho ochorenia štítnej žľazy bola 88 %, resp. 100 % (graf 6B).
Graf 6. FNAC a POH v diagnostike uzlov štítnej žľazy. 
Indikácie (A) a úspešnosť (B) FNAC a POH v diferenciálnej diagnostike uzlov štítnej žľazy. FNAC – tenkoihlová aspiračná cytológia, POH – peroperačné histopatologické vyšetrenie skupina A – benígny nález, bez štruktúr konvenčného papilárneho karcinómu skupina B – folikulárna lézia, atypie, nález suspektný z malignity, ale s odkazom na definitívne histopatologické vyšetrenie skupina C – nález vysoko suspektný z malignity, jednoznačná malignita údaje sú uvedené ako medián ± SD Rozsah chirurgickej liečby a jej komplikácie
Všetci pacienti v sledovanom súbore pacientov boli liečení chirurgicky. Hemityreoidektómia ako primárny chirurgický výkon bola realizovaná u 23 % pacientov s epitelovým malígnym ochorením štítnej žľazy (skupina B a C). Všetci podstúpili dokončenie tyreoidektómie a revíziu lymfatických uzlín centrálneho kompartmentu. Medián následnej operácie bol 19 ± 8 dní, v rozmedzí 6 – 32 dní po prvotnej chirurgickej liečbe. U ostatných pacientov s epitelovým nádorom bola vykonaná totálna tyreoidektómia (TTE) ako primárny chirurgický výkon, a to u 12 % aj s resekciou lymfatických uzlín centrálneho a laterálneho (level II. – V.) kompartmentu.
U 24 pacientov (10 %) s malígnym ochorením štítnej žľazy sme v pooperačnom období zaznamenali hypokalciémiu. Jednostranná tranzitórna paréza NLR, ktorá bola riešená konzervatívne, sa zistila u siedmich (3 %). Trvalé komplikácie chirurgickej liečby štítnej žľazy pre zhubný nádor štítnej žľazy sme detegovali u troch pacientov (1 %). Išlo o jednostrannú léziu NLR. Obojstrannú léziu (tranzitórnu/ trvalú) návratného nervu sme v sledovanom súbore pacientov nezaznamenali. Trvalá hypokalciémia sa tiež nevyskytla.
Diskusia
Karcinóm štítnej žľazy tvorí približne 1,1– 1,9 % malígnych nádorov. Je však najčastejším karcinómom endokrinného systému (viac ako 90 %). Ženy sú postihnuté trikrát častejšie ako muži. Má dobrú prognózu, na čom sa podieľa najmä epidemiologicky najvýznamnejší diferencovaný karcinóm. Zomiera naň asi 6 % pacientov, pričom rozdiely medzi pohlaviami sa vyrovnávajú. Pri včasnej diagnostike a správnej liečbe diferencovaného karcinómu je celková mortalita ešte nižšia [3,4].
Etiopatogenéza
Etiológia malígnych nádorov štítnej žľazy je podobne ako pri väčšine malignít multifaktoriálna. Genetická predispozícia je dokázaná u medulárneho karcinómu, ktorý je súčasťou syndrómu mnohopočetnej endokrinnej neoplázie (MEN II) [6]. Jedným z dokázaných exogénnych rizikových faktorov spôsobujúcich malígny zvrat tyreoidálnej bunky je rádioaktívne žiarenie [7,8]. Aj chemoterapia môže pôsobiť na tyreocyty karcinogénne [9].
V našom súbore sme rozdiely vo výskyte malignity medzi pohlaviami nezaznamenali. Z analýzy vyplýva, že mladší pacienti sú postihnutí častejšie. Zo sledovaných rizikových faktorov (rodinná anamnéza, rádioterapia, predchádzajúci výskyt malignity) sme nezaznamenali rozdiely v ich výskyte u chorých s benígnym alebo malígnym ochorením štítnej žľazy.
Diagnostika
Karcinóm štítnej žľazy sa najčastejšie prejavuje ako uzlová struma (uzol v štítnej žľaze). Klinicky manifestné tyreo-idálne uzly sú pomerne časté, palpačným vyšetrením sa zistia u 4 – 8 % dospelých, sonograficky až u 40 – 60 % [2,10]. Riziko malignity v solitárnej uzlovej strume je 5 – 10 %. Donedávna rozšírený názor, že v multinodóznej strume je oveľa nižšia pravdepodobnosť výskytu zhubného nádoru ako v solitárnom uzle, neplatí. Pacienti s viacuzlovou strumou majú rovnaké riziko malignity ako pacienti so solitárnym uzlom [11]. Rovnaké výsledky sme zaznamenali aj v našom súbore pacientov. Malignitu sme diagnostikovali u 16 % pacientov so solitárnym uzlom a u 18 % operovaných pre polynodóznu prestavbu štítnej žľazy.
Väčšina uzlov, či už malígnej alebo benígnej povahy, je asymptomatická. Aj keď sú známe faktory, ktoré zvyšujú riziko malignity v uzle (rodinná anamnéza rakoviny štítnej žľazy, radiačná liečba, tvrdý uzol, novovzniknutý uzol u osoby < 20 a > 60 rokov, uzol a lymfonodopátia, paréza NLR), zhubný nádor sa dlho klinicky ničím nelíši od benígnej uzlovej strumy [2,12,13]. Krčná lymfadenopátia ako prvý príznak malignity sa vyskytuje približne u 5 % [14]. V sledovanom súbore u šiestich pacientov (< 1 %) bolo prvým príznakom malígneho nádoru štítnej žľazy zväčšenie lymfatických uzlín na krku, čo svedčí o dobrom manažmente pacientov s uzlovou strumou a tým aj skorej diagnostike zhubnej nádorovej choroby.
Okrem rýchleho rastu niektorí autori potvrdili koreláciu medzi veľkosťou uzla a výskytom malignity. V uzle s priemerom nad 4 cm je vyššia pravdepodobnosť malignity v porovnaní s menšími uzlami [15,16]. V našej práci sme detegovali signifikantne častejší výskyt malignity vo väčšom uzle v solitárnej strume. Veľkosť uzla ako predisponujúceho faktora malígnej choroby v prípade polynodóznej prestavby parenchýmu štítnej žľazy sme však nezaznamenali. V sledovanom súbore sme nezaznamenali koreláciu medzi dĺžkou trvania choroby a výskytom malignity u pacientov pravidelne sledovaných endokrinológom. Avšak de novo ochorenie štítnej žľazy bolo až u 43 % spôsobené malígnym nádorom. Podobné výsledky zistili aj iní autori [1,17,18].
V morfologickej diagnostike tyreopatií má nezastupiteľné miesto ultrasonografické (USG) vyšetrenie. Napriek tomu, že existujú určité USG charakteristiky, ktoré poukazujú na možnosť malignity uzla (solídny, obyčajne hypoechogénny uzol s nehomogénnou echoštruktúrou, neostré zvlnené okraje, chýbanie „halo“ lemu, existencia psamómov, centrálne prekrvenie pri dopplerovskom vyšetrení), ich chýbanie však nevylučuje malignitu [19 – 21].
Dôležitým vyšetrením v diferenciálnej diagnostike uzlovej strumy je aspiračná cytodiagnostika. Pri viacuzlovej strume treba vyšetriť viacero dostupných uzlov. Donedávna sa kládol dôraz na vykonanie biopsie z dominantného uzla (uzlov). V súčasnosti sa pri výbere uzla na biopsiu uprednostňujú skôr USG kritériá – hypoechogenita a nehomogénna echoštruktúra uzla [22 – 24]. Výsledok vyšetrenia sa podľa Bethesda klasifikácie z roku 2010 [5] odporúča deliť do šiestich kategórií: I. nedostatočný (nereprezentatívny), II. benígny, III. atypie neistého významu alebo folikulárna lézia neistého významu, IV. folikulárna neoplázia alebo podozrenie z folikulárnej neoplázie, V. suspektný, VI. malignita. Väčšina cytológov však naďalej triedi výsledok do piatich kategórií, ktorá neodlišuje skupinu III. a IV.: I. nedostatočný, II. benígny, III. atypický alebo neurčitý (neurčiteľný), IV. suspektný, V. malígny. Pri nedostatočnom odbere materiálu na cytologické vyšetrenie je potrebné vyšetrenie zopakovať pod sonografickou kontrolou. Ak je cytologický nález benígny, odporúča sa FNAC opakovať o 3 – 6 mesiacov. Pri potvrdení benígnej lézie sa zvyčajne postupuje konzervatívne. Ďalšie kategórie vyžadujú operačné riešenie a histologické určenie diagnózy [2,3,25].
Úspešnosť FNAC v predoperačnej diagnostike uzlov štítnej žľazy je podľa literárnych údajov 75 – 95 % [26,27]. Aj v našom súbore sme zaznamenali vysokú senzitivitu a špecifitu FNAC v diagnostike malígnych nádorov. Falošne negatívny výsledok sme detegovali u 3 % a falošne pozitívny u 2 % pacientov. Dôležitou otázkou však ostáva, či je FNAC naozaj najdôležitejšou metódou v detekcii malignity. Cytologické vyšetrenie má vysokú pozitívnu prediktívnu hodnotu v diagnostike papilárneho karcinómu. Podobne je to aj u medulárneho karcinómu s pomerne typickým cytologickým obrazom. Slabinou cytológie je, že sa často nedá rozlíšiť folikulárny adenóm od folikulárneho karcinómu a folikulárneho variantu papilárneho karcinómu. Presné odlíšenie umožní až histologické vyšetrenie. Dôkazom karcinómu sú kapsulárna a vaskulárna invázia. Problematické je aj hodnotenie pseudocysticky degenerovaných uzlov [4,5,23].
V manažmente uzlovej strumy na našom pracovisku je štandardom POH. Ak endokrinológ indikuje výkon v rozsahu hemityreoidektómie a pacientovi FNAC nepotvrdila benígnu léziu (Bethesda II.), event. mu FNAC vykonaná nebola, vykonávame POH. Ak sa peroperačne potvrdí malignita, tak sa vykoná totálna tyreoidektómia. Ak sa malignita potvrdí až definitívnym histologickým vyšetrením, vykoná sa lobektómia na druhej strane (dokončenie tyreoidektómie, tzv. dvojfázová tyreo-idektómia). V sledovanom súbore sme falošne pozitívny výsledok POH nezaznamenali, falošne negatívny výsledok bol zistený u 7 % vyšetrení. Aj keď je POH nádorov štítnej žľazy problematické, napriek tomu by sa malo robiť určite na pracoviskách, kde sa koncentruje operatíva pacientov s uzlovou strumou. Toto vyšetrenie často zjednoduší a zefektívni operačný postup. Zníži sa najmä počet reoperácií a tým aj výskyt možných operačných komplikácií. Zdôrazňujeme, že definitívne slovo v diferenciálnej diagnostike uzlovej strumy má až štandardné histopatologické vyšetrenie.
Liečba
Liečba chorého s malígnym nádorom štítnej žľazy vo všeobecnosti spočíva na troch pilieroch. Sú to – operačný výkon, liečba rádiojódom (u jód akumulujúcich epitelových nádorov) alebo rádiochemoterapia, a dlhodobá supresívna a substitučná liečba tyreoidálnymi hormónmi.
Terapia diferencovaného karcinómu je spojená s viacerými kontroverziami. Vzhľadom na celkovo dobrú prognózu ochorenia sa diskutuje predovšetkým radikálnosť liečby. Pokiaľ ide o chirurgický výkon na samotnej žľaze, štandardne sa vykonáva totálna tyreoidektómia (TTE). Niektorí autori v snahe čo najmenej ohroziť NLR však preferujú subtotálnu strumektómiu alebo „near total“ tyreoidektómiu, pričom argumentujú nižším výskytom lézie NLR pri týchto operáciách v porovnaní s TTE [28]. Väčšina autorov však odporúča ako metódu voľby v liečbe malígneho nádoru štítnej žľazy totálnu tyreoidektómiu. Ide o bezpečnú operáciu u dospelých pacientov aj u detí, ktorá keď sa vykonáva na pracoviskách s dostatočnými skúsenosťami s chirurgickou liečbou chorôb štítnej žľazy, nie je zaťažená vyšším výskytom komplikácií v porovnaní s parciálnymi chirurgickými výkonmi [29 – 31].
Výnimka je unilaterálny papilárny mikrokarcinóm, čiže uzol menší ako 1 cm, ktorý je jediným uzlom v celej štítnej žľaze, neprerastá cez kapsulu, nejedná sa o agresívny subtyp a predoperačne a peroperačne nie sú zistené zväčšené lymfatické uzliny. V tomto prípade sa za dostatočný výkon väčšinou považuje lobektómia na strane uzla, a liečba rádiojódom nie je potrebná. Niektorí autori však aj tak vykonávajú TTE [32 – 34]. Na druhej strane japonskí autori z obavy pred možnými komplikáciami chirurgickej liečby a pri všeobecne dobrej prognóze choroby odporúčajú u pacientov s mikrokarcinómom bez lymfadenopatie len observáciu a operáciu indikujú, až keď choroba progreduje [35].
Na Klinike ORL a ChHaK JLF UK a UN v Martine chorým s malígnym nádorom štítnej žľazy vykonávame vždy totálnu tyreoidektómiu (jedno ‑ alebo dvojfázovo), a to aj u pacientov s papilárnym mikrokarcinómom. Argumenty pre TTE sú nasledovné:
- Papilárny karcinóm býva často multifokálny a až 54 % pacientov má ložisko aj v kontralaterálnom laloku. V sledovanom súbore sme obojstranný výskyt karcinómu detegovali u 26 %, a to u 18 % mikrokarcinómu.
- Znižuje výskyt recidív a znižuje mortalitu.
- Umožňuje efektívnu liečbu rádiojódom a zvyšuje šancu na jej úspech.
- Umožňuje využiť stanovenie hladiny tyreoglubulínu v dlhodobom sledovaní pacientov.
- Substitučná liečba tyreoidálnymi hormónmi je potrebná u väčšiny pacientov po hemityreoidektómii (jeden lalok u nich nedokáže udržať eutyrózu).
- Redukujú sa pacientove obavy z hroziacej recidívy ochorenia v ponechanom laloku štítnej žľazy.
- Dokončenie tyreoidektómie (tzv. dvojfázový výkon) skúseným chirurgom nezvyšuje výskyt komplikácií.
Názory na terapeutickú lymfadenektómiu sú celkom jednotné. Ak sa predoperačnými a/ alebo peroperačnými vyšetreniami dokážu evidentne zväčšené lymfatické uzliny (8 mm a viac v najväčšom rozmere uzliny) v centrálnom kompartmente, vykonáva sa terapeutická lymfadenektómia (odstránenie lymfatických uzlin spolu s tukovo ‑ fibróznym tkanivom) tejto oblasti (pretracheálne, prelaryngeálne, paratracheálne a paraezofageálne lymfatické uzliny). Pokiaľ sa dokážu zväčšené lymfatické uzliny aj v laterálnych kompartmentoch (pozdĺž v. jugularis interna), vykonáva sa aj ich resekcia [25,36].
Názory na profylaktickú centrálnu lymfadenektómiu (PCLE) – situácia, že pacient nemá zväčšené lymfatické uzliny, sú aj v súčasnosti rozdielne. Mikrometastázy sa dokážu asi u 60 % pacientov s malígnym nádorom štítnej žľazy (výskyt kolíše medzi 20 a 90 %). Význam mikrometastáz v lymfatických uzlinách je už desaťročia predmetom diskusií a ich vplyv na prežívanie zostáva naďalej otázkou. Nepripisuje sa im taký význam ako uzlinovým metastázam akéhokoľvek iného malígneho nádoru v ľudskom tele. Najčastejšie sú postihnuté lymfatické uzliny v centrálnom krčnom kompartmente, menej často v laterálnych kompartmentoch. Vo vzdialenejších oddieloch krku sú metastázy zhubného nádoru štítnej žľazy v lymfatických uzlinách zriedkavé [37,38]. Zástancovia profylaktickej centrálnej lymfadenektómie u každého chorého s papilárnym karcinómom (výnimka sú pacienti s mikrokarcinómom) tvrdia, že takto sa znižuje riziko lokálnej recidívy, odstraňujú sa jej potenciálne zdroje, zvyšuje sa presnosť „stagingu“, uľahčuje sa rozhodovanie o liečbe rádiojódom, znižuje sa pravdepodobnosť rizikovejšej reoperácie a presnejšie sa deteguje prípadná lokálna recidíva alebo metastáza na základe sledovania hodnôt stimulovaného tyreoglobulínu [25,36,37]. Napriek týmto dôvodom mnoho autorov vo svojich referenciách publikovaných v ostatných piatich rokoch rutinnú PCLE pri diferencovanom karcinóme štítnej žľazy odmieta, pričom argumentujú viacerými faktami. PCLE so sebou prináša vyššie riziko komplikácií ako samotná tyreoidektómia. Paréza NLR stúpa z 2 na 10 %. Vyššia je aj incidencia trvalej hypoparatyreózy, po PCLE sa podľa literárnych údajov pohybuje v rozmedzí 0 – 14,3 % [25,39]. PCLE výrazne neredukuje výskyt lokálnej recidívy. Okrem toho, doteraz nie je dokázané, že PCLE zlepšuje dlhodobé karcinóm ‑ špecifické prežívanie. Autori odmietajúci PCLE poukazujú tiež na skutočnosť, že na elimináciu mikrometastáz sa s úspechom využíva rádiojód [39,40].
Na našom pracovisku vykonávame revíziu lymfatických uzlin centrálneho kompartmentu v priebehu tyreoidektómie a lymfadenektómiu (centrálneho/ laterálneho kompartmentu) iba pri náleze patologicky zväčšených lymfatických uzlin. Výnimku tvoria pacienti, ktorým bola vykonaná TTE pre pôvodne benígne ochorenie a malígny nádor sa dokázal až definitívnym histopatologickým vyšetrením. Ak sonografické vyšetrenie nedokáže zväčšené lymfatické uzliny, štandardne neindikujeme reoperáciu v zmysle revízie lymfatických uzlin centrálneho a laterálneho kompartmentu. Výskyt komplikácií v našom súbore sa nelíšil medzi jednotlivými typmi operácií (TTE vs. TTE+lymfadenektómia centrálneho kompartmentu vs. TTE + lymfadenektómia centrálneho kompartmentu + laterálneho kompartmentu).
Záver
Malígny nádor štítnej žľazy je častejší u mladších pacientov s novovzniknutým uzlom štítnej žľazy. Riziko, že uzol je zhubný, stúpa s jeho veľkosťou. FNAC a POH majú vysokú senzitivitu a špecifitu v diagnostike malígneho nádoru štítnej žľazy. Preto by mali tvoriť štandardnú súčasť diferenciálnej diagnostiky uzlovej strumy.
Metódou voľby v liečbe malignity štítnej žľazy je totálna tyreoidektómia. Ide o bezpečnú operáciu s nízkou incidenciou komplikácií. Ak sú metastaticky postihnuté lymfatické uzliny krku, je indikovaná príslušná krčná bloková disekcia.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Obdržané: 1. 12. 2014
Prijaté: 20. 1. 2015
MUDr. Barbora Uhliarova, PhD.
Klinika otorinolaryngológie a chirurgie hlavy a krku
JLF UK a UN Martin
Kollárova 2
036 59 Martin
Slovenská republika
e-mail: b.uhliarova@gmail.com
Zdroje
1. Dean DS, Gharib H. Epidemiology of thyroid nodules. Best Pract Res Clin Endocrinol Metab 2008; 22(6): 901 – 911. doi: 10.1016/ j.beem.2008.09.019.
2. Eng ChY, Quraishi MS, Bradley PJ. Management of thyroid nodules in adult patients. Head Neck Oncology 2010; 2 : 11. doi: 10.1186/ 1758 ‑ 3284 ‑ 2 ‑ 11.
3. McDougall IR (ed.). Management of thyroid cancer and related nodular disease. London: Springer – Verlag 2006 : 397.
4. Wartofsky L, Van Nostrand D (eds). Thyroid Cancer. A comprehensive guide to clinical management. Totowa: Humana Press 2006 : 709.
5. Dušková J. Nový systém pro sjednocené hodnocení tenkojehlových aspiračních biopsií štítné žlázy – Bethesda2010. Cesk Patol 2011; 47(1): 8 – 14.
6. Jackson MB, Guttenberg M, Hedrick H et al. Multiple endocrine neoplasia type 2A in a kindred with C634Y mutation. Pediatrics 2005; 116(3): 468 – 671.
7. Grigsby PW, Gal ‑ or A, Michalski JM et al. Childhood and adolescent thyroid carcinoma. Cancer 2002; 95(4): 724 – 729.
8. Pacini F, Vorontsova T, Demidchik EP et al. Post‑Chernobyl thyroid carcinoma in Belarus children and adolescents: comparison with naturally occurring thyroid carcinoma in Italy and France. J Clin Endocrinol Metab 1997; 82(11): 3563 – 3569.
9. Cohen A, Rovelli A, Merlo DF et al. Risk for secondary thyroid carcinoma after hematopoietic stem ‑ cell transplantation: an EBMT Late Effects Working Party Study. J Clin Oncol 2007; 25(17): 2449 – 2454.
10. Yeung MJ, Serpell JW. Management of the solitary thyroid nodule. Oncologist 2008; 13(2): 105 – 112. doi: 10.1634/ theoncologist.2007 ‑ 0212.
11. Fuhrer D, Bockish A, Schmid KW. Euthyroid goiter with and without nodules – diagnosis and treatment. Dtsch Arztebl Int 2012; 109(29 – 30): 506 – 515.
12. Castro MR, Gharib H. Continuing controversies in the management of thyroid nodules. Ann Intern Med 2005; 142(11): 926 – 931.
13. Mehanna HM, Jain A, Morton RP et al. Investigating the thyroid nodule. BMJ 2009; 338 : 705 – 709. doi: 10.1136/ bmj.b733.
14. Mazzaferri EL. Current concepts: management of a solitary thyroid nodule. N Engl J Med 1993; 328(8): 553 – 559.
15. Kamran SC, Marqusee E, Kim MI et al. Thyroid nodule size and prediction of cancer. J Clin Endocrinol Metab 2013; 98(2): 564 – 570. doi: 10.1210/ jc.2012 ‑ 2968.
16. Mehta RS, Carty SE, Ohori NP et al. Nodule size is an independent predictor of malignancy in mutation ‑ negative nodules with follicular lesion of undetermined significance cytology. Surgery 2013; 154(4): 730 – 736. doi: 10.1016/ j.surg.2013.05.015.
17. Sands NB, Karls S, Amir A et al. Thyroid nodule size (MTNS): „rating the risk“, a novel predictive scheme for cancer risk determination. J Otolaryngol Head Neck Surg 2011; 40 (Suppl 1): S1 – S13.
18. Bauer AJ. Thyroid nodules and differentiated thyroid cancer. Endocr Dev 2014; 26 : 183 – 201. doi: 10.1159/ 000363164.
19. Papini E, Guglielmi R, Bianchini A et al. Risk of malignancy in nonpalpable thyroid nodules: predictive value of ultrasound and color ‑ doppler features. J Clin Endocrinol Metab 2002; 87(5): 1941 – 1946.
20. Campanella P, Ianni F, Rota CA et al. Quantification of cancer risk of each clinical and ultrasonographic suspicious feature of thyroid nodules: a systematic review and metaanalysis. End J Endocrinol 2014; 170(5): R203 – R211. doi: 10.1530/ EJE ‑ 13 ‑ 0995.
21. Batawil N, Alkordy T. Ultrasonographic features associated with malignancy in cytologically indeterminate thyroid nodules. Eur J Surg Oncol 2014; 40(2): 182 – 186. doi: 10.1016/ j.ejso.2013.11.015.
22. Leenhardt L, Hejblum G, Franc B et al. Indications and limits of ultrasound ‑ guided cytology in the management on nonpalpable thyroid nodules. J Clin Endocrinol Metab 1999; 84(1): 24 – 28.
23. Čáp J, Ryška A. Aspirační cytologie štítne žlazy. Odolena Voda: Nukleus HK 2003 : 178.
24. Raab SS, Vrbin CM, Grzybicki DM et al. Errors in thyroid gland fine ‑ needle apiration. Am J Clin Pathol 2006; 125(6): 873 – 882.
25. Podoba J, Králik R, Borovičová F et al. Štandardné postupy v manažmente karcinómu štítnej žľazy v Onkologickom ústave sv. Alžbety v Bratislave. Onkológia (Bratisl.) 2008; 3(3): 152 – 163.
26. Lin JD, Chao TC, Huang BY et al. Thyroid cancer in the thyroid nodules evaluated by ultrasonography and fine ‑ needle asporation cytology. Thyroid 2005; 15(7): 708 – 717.
27. Peli M, Capalbo E, Lovisatti M et al. Ultrasound guided fine ‑ needle aspiration biopsy of thyroid nodules: guidelines and recommendations vs clinical practice; a 12 - month study of 89 patients. J Ultrasound 2012; 15(2): 102 – 107. doi: 10.1016/ j.jus.2011.12.004.
28. Sugitani I, Fujimoto Y. Management of low ‑ risk papillary thyroid carcinoma:Unique conventional policy in Japan and our efforts to improve the level of evidence. Surg Today 2010; 40(3): 199 – 215. doi: 10.1007/ s00595 ‑ 009 ‑ 4034 ‑ 5.
29. Famakinwa OM, Roman SA, Wang TS et al. ATA practice guidelines for the treatment of differentiated thyroid cancer: were they followed in the United States? Am J Surg 2010; 199(2): 189 – 198. doi: 10.1016/ j.amjsurg.2009.04.022.
30. Cisco RM, Shen WT, Gosnell JE. Extent of surgery for papillary thyroid cancer: Preoperative imaging and role of prophylactic and therapeutic neck dissection. Curr Treat Options Oncology 2012; 13(1): 1 – 10. doi: 10.1007/ s11864 ‑ 011 ‑ 0175 ‑ z.
31. Brychta I. Papilárny karcinóm štítnej žľazy – kontroverzie pokračujú. Slov Chir 2012; 9(3): 98 – 101.
32. Hirsch D, Levy S, Tsvetov G et al. Total versus hemithyroidectomy for small unilateral papillary thyroid carcinoma. Oncology Letters 2014; 7(3): 849 – 853.
33. Marchesi M, Biffoni M, Faloci C et al. High rate of recurrence after lobectomy for solitary thyroid nodule. Eur J Surg 2002; 168(7): 397 – 400.
34. Esnaola NF, Cantor SB, Sherman SI et al. Optimal treatment strategy in patients with papillary thyroid cancer: a decision analysis. Surgery 2001; 130(6): 921 – 930.
35. Ito Y, Miyauchi A, Inoue H et al. An observational trial for papillary thyroid microcarcinoma in Japanese patients. Worl J Surg 2010; 34(1): 28 – 35. doi: 10.1007/ s00268 ‑ 009 ‑ 0303 ‑ 0.
36. Králik R, Straka V, Marek V et al. Centrálna krčná disekcia lymfatických uzlín v liečbe diferencovaného karcinómu štítnej žľazy – naše skúsenosti. Rozhl Chir 2008; 87(3): 149 – 153.
37. Moo TA, McGill J, Allendorf J et al. Impact of prophylactic central neck lymph node dissection on early recurrence in papillary thyroid carcinoma. World J Surg 2010; 34(6): 1187 – 1191. doi: 10.1007/ s00268 ‑ 010 ‑ 0418 ‑ 3.
38. Caglia P, Zappula E, Costa S et al. Differentiated thyroid cancer: role of the lymph node dissection. G Chir 2010; 31(6 – 7): 293 – 295.
39. Carling T, Carty SE, Ciarleglio MM et al. American thyroid association design and feasibility of a prospective randomized controlled trial of prophylactic central lymph node dissection for papillary thyroid carcinoma. Thyroid 2012; 22(3): 237 – 244. doi: 10.1089/ thy.2011.0317.
40. Forest VI, Clark JR, Ebrahimi A et al. Central compartment dissection in thyroid papillary carcinoma. Ann Surg 2011; 253(1): 123 – 130. doi: 10.1097/ SLA.0b013e3181fc9644.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2015 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Nejasný stín na plicích – kazuistika
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Možný klinický přínos terapeutického monitorování hladin imatinibu v onkologii
- Kontroverzie v manažmente neseminomatóznych germinatívnych nádorov testis v I. klinickom štádiu
- Využití Narrow Band Imaging v diagnostice časných karcinomů hrtanu
- Malígne nádory štítnej žľazy
- Glomus tumor prsta ruky – kazuistika
- Informace z České onkologické společnosti
- Současné dvě EGFR mutace u plicního adenokarcinomu – kazuistika
- SOUTĚŽ NA PODPORU AUTORSKÝCH TÝMŮ PUBLIKUJÍCÍCH V ZAHRANIČNÍCH ODBORNÝCH TITULECH
-
Domácí parenterální výživa v onkologii
Díl 2 – Kdy indikovat domácí paliativní parenterální výživu - FDA schválil první biosimilární přípravek v USA
- Rozmanitost 18F- FDG PET obrazů pacientů s maligním melanomem
- Zamyšlení nad osmdesátinami Masarykova onkologického ústavu
- SOUTĚŽ O NEJLEPŠÍ PRÁCI
- Možný klinický přínos terapeutického monitorování hladin imatinibu v onkologii
- Význam časné nádorové regrese a hloubky léčebné odpovědi při hodnocení účinnosti systémové léčby metastazujícího kolorektálního karcinomu
- Management chronické a akutní bolesti u pacientů s nádorovými chorobami
- Vitamin D při léčbě nádorového onemocnění
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Malígne nádory štítnej žľazy
- Vitamin D při léčbě nádorového onemocnění
- Glomus tumor prsta ruky – kazuistika
- Význam časné nádorové regrese a hloubky léčebné odpovědi při hodnocení účinnosti systémové léčby metastazujícího kolorektálního karcinomu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



