-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Sledování změn invazivních onemocnění způsobených Haemophilus influenzae v České republice v letech 1999–2020
Monitoring changes in invasive disease caused by Haemophilus influenzae in the Czech Republic between 1999 and 2020
Aim: To assess the trends and changes in the incidence of invasive disease caused by Haemophilus influenzae in the Czech Republic (CR) between 1999 and 2020 with regard to the introduction of childhood vaccination against H. influenzae serotype b (Hib) in 2001. Characterization of strains by multilocus sequence typing (MLST) and search for correlations between serotypes, sequence types, and patient groups or clinical manifestations of the disease.
Material and methods: A total of 623 invasive H. influenzae strains from surveillance of invasive Haemophilus disease in the Czech Republic were analysed. All strains were biotyped based on phenotypic characteristics and serotyped using slide agglutination with specific a-f antisera. Three hundred and eighty-three strains from the collection of the National Reference Laboratory for Haemophilus Infections (NRL HEM) originating from surveillance in the CR were analysed by MLST and assigned to sequence types (ST). For analyses, the dataset was supplemented with five strains from the PubMLST database of serotypes rarely or not at all found in the CR. Similarity calculations based on MLST and strain (serotype, biotype, ST) and patient (diagnosis, sex, age) data were performed in BioNumerics 7.6.
Results: After the introduction of Hib vaccination in 2001, a dramatic decline of more than 90% was observed in invasive Hib disease over the following years. Between 1999 and 2020, a total of 623 cases of invasive disease caused by H. influenzae were recorded in the CR, with about 20 cases reported annually in recent years. At present, the dominant agents causing Haemophilus invasive disease in the CR are non-enveloped strains (HiNT) followed by strains of Hif and Hie serotypes. The most common manifestation of Haemophilus invasive disease in the pre-vaccination era was meningitis, while now it is sepsis. Sequence types of 383 strains from the NRL HEM collection originating from surveillance in the CR were analysed. The results showed high clonality of the encapsulated strains and diversity of HiNT strains, which is consistent with the results of others. Strain similarity analysis showed no demonstrable relationships between patient age or clinical manifestation and serotype and ST.
Conclusion: In invasive Haemophilus disease, there has been a dramatic change as a result of Hib vaccination after 2001, with a reduction of cases caused by Hib from tens to units annually. In the last decade, the situation in the CR has been stable with no significant changes in the number of cases or in the representation of causative serotypes and is in line with the reports from other EU countries. In order to monitor further developments, it is desirable that the NRL HEM should continue the surveillance of invasive disease caused by H. influenzae, including molecular biological characteristics of strains. MLST allows the characterisation of strains based on allelic variants of selected housekeeping genes, but it does not allow the association of specific H. influenzae sequence types with patient age, sex or clinical manifestations. In the future, whole genome sequencing could be a useful tool for determining the correlation between the disease and specific strains.
Keywords:
surveillance – MLST – Epidemiology – Haemophilus influenzae – invasive disease – serotyping – biotyping
Autoři: J. Vlach 1; V. Lebedová 2; M. Musílek 1
; J. Kozáková 1
Působiště autorů: SZÚ, CEM, Oddělení bakteriálních vzdušných nákaz 1; SZÚ, CEM, Oddělení bakteriálních vzdušných nákaz, NRL pro hemofilové nákazy 2
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 71, 2022, č. 2, s. 67-77
Kategorie: Původní práce
Souhrn
Cíl práce: Zhodnocení stavu a změny trendů ve výskytu invazivních onemocnění způsobených Haemophilus influenzae v České republice (ČR) v letech 1999–2020 s ohledem na zavedení očkování dětí proti H. influenzae sérotypu b (Hib) v roce 2001. Charakterizace kmenů multilokusovou sekvenční typizací (MLST) a hledání korelací mezi sérotypy, sekvenčními typy a skupinami pacientů či klinickými projevy onemocnění.
Materiál a metody: Analyzováno bylo 623 invazivních kmenů H. influenzae zachycených v rámci surveillance invazivního hemofilového onemocnění v ČR. Pro všechny kmeny byly určeny biotypy na základě fenotypového projevu a sérotypy pomocí sklíčkové aglutinace se specifickými antiséry a-f. U 383 kmenů ze sbírky Národní referenční laboratoře pro hemofilové nákazy (NRL HEM) získaných v rámci surveillance v ČR byla provedena MLST s určením sekvenčních typů (ST). Pro analýzy byl dataset doplněn z databáze PubMLST 5 kmeny sérotypů vyskytujících se v ČR výjimečně nebo vůbec. Kalkulace podobnosti kmenů na základě MLST a dat o kmenu (sérotyp, biotyp, ST) a pacientovi (diagnóza, pohlaví, věk) byla provedena v programu BioNumerics 7.6.
Výsledky: Po zavedení očkování proti Hib v roce 2001 došlo v následujících letech k dramatickému poklesu invazivních Hib onemocnění o více než 90 %. V letech 1999-2020 bylo v ČR zaznamenáno celkem 623 invazivních onemocnění způsobených H. influenzae, v posledních letech se jednalo o cca 20 invazivních onemocnění ročně. V současnosti jsou v ČR dominantní skupinou kmenů způsobující hemofilové invazivní onemocnění neopouzdřené kmeny (HiNT) následované kmeny sérotypů Hif a Hie. Nejběžnější manifestací hemofilového invazivního onemocnění byla před zavedením očkování meningitida, nyní je to sepse. Analyzovány byly sekvenční typy 383 kmenů ze sbírky NRL HEM získaných v rámci surveillance v ČR. Výsledky ukázaly vysokou klonálnost opouzdřených kmenů a diverzitu HiNT, což odpovídá i výsledkům jiných studií. Analýza podobnosti kmenů neukázala žádné prokazatelné vztahy mezi věkem pacientů či klinickou manifestací a sérotypy a konkrétními ST.
Závěr: Z hlediska invazivních hemofilových onemocnění došlo k dramatické změně v důsledku očkování proti Hib po roce 2001, kdy došlo ke snížení onemocnění způsobených Hib z desítek na jednotky případů ročně. V posledních 10 letech je situace v ČR stabilní bez výrazných změn v počtech případů či v zastoupení sérotypů a odpovídá situaci v ostatních zemích Evropské unie. Pro sledování dalšího vývoje je žádoucí pokračovat v NRL HEM v surveillance invazivních onemocnění způsobených H. influenzae včetně molekulárně-biologické charakterizace kmenů. MLST je metoda umožňující charakterizaci kmenů na základě alelických variant vybraných housekeeping genů, avšak neumožňuje spojit konkrétní sekvenční typy H. influenzae se skupinami pacientů na základě věku, pohlaví či klinických projevů. V budoucnu by mohlo být možné identifikovat závislost onemocnění na konkrétních skupinách kmenů pomocí celogenomové sekvenace.
Klíčová slova:
epidemiologie – surveillance – MLST – Haemophilus influenzae – invazivní onemocnění – sérotypizace – biotypizace
ÚVOD
Haemophilus influenzae je gramnegativní, fakultativně anaerobní pleomorfní kokobacil, nepohyblivý a nesporulující. Pro svůj růst vyžaduje faktor X (hemin) a faktor V (nikotinamidadenindinukleotid, NAD, nebo nikotinamidadenindinukleotid fosfát, NADP). Při kultivaci na krevním agaru roste satelitně podél stafylokoků nebo mikrokoků, které produkují NAD. Bakterie mohou být opouzdřené či neopouzdřené, na základě polysacharidového pouzdra se dělí na šest sérotypů označovaných písmeny a-f [1]. Neopouzdřené kmeny jsou označovány jako netypovatelné (HiNT).
H. influenzae je striktně lidský patogen vyskytující se jako součást běžné mikroflóry u 20-80 % zdravých lidí, přičemž může způsobovat i onemocnění, především v respiračním traktu [2]. Šíří se vzdušnou cestou kapénkami a může způsobovat jak méně závažné infekce (otitida, sinusitida), tak závažnější (pneumonie, septikémie, epiglotitida, meningitida). Vyšší invazivita je typická hlavně pro opouzdřené kmeny. Nejzávažnější infekce s fatálními následky, především u dětí do 1 roku věku, způsobuje H. influenzae sérotyp b (Hib) – epiglotitidy u dětí ve věku 2-5 let, hnisavá respirační onemocnění a meningitidy především u dětí mladších 2 let [1, 2]. Infekce vykazuje sezónní charakter s minimem případů v letních měsících (červenec–srpen) a maximem na přelomu roku (prosinec–leden) [3].
Z důvodů sledování šíření infekčních nemocí byl pro infekční onemocnění způsobená vybranými agens zaveden systém epidemiologické bdělosti (surveillance), na jehož základě je monitorován i výskyt invazivního onemocnění způsobeného H. influenzae b [4]. Na surveillance invazivních hemofilových onemocnění, tj. dle definice závažných infekcí, kdy je bakterie prokázána v běžně sterilním klinickém materiálu, jako je krev nebo likvor, se podílí Národní referenční laboratoř pro hemofilové nákazy (NRL HEM) Státního zdravotního ústavu. Do roku 1999 byly sledovány pouze meningitidy způsobené H. influenzae, od roku 1999 pak byla zavedena surveillance invazivních onemocnění způsobených Hib. Invazivní onemocnění způsobená všemi typy sérotypů a neopouzdřenými kmeny jsou sledována od roku 2009 až do současnosti [5]. Zákon č. 258/2000 Sb. a vyhláška č. 473/2008 Sb. ukládají povinnost hlásit invazivní onemocnění způsobené Hib i Hi non-b a zasílat kmeny k další typizaci, přičemž z klinických pracovišť do NRL HEM je ročně zasláno cca 80 % izolátů z hlášených onemocnění v ČR.
MATERIÁL A METODY
Sběr vzorků
Kmeny H. influenzae byly dle platné legislativy do NRL HEM zasílány z mikrobiologických laboratoří a dalších pracovišť v ČR na transportních médiích (Amies) nebo čokoládovém agaru. Do studie byly zařazeny kmeny z invazivních onemocnění, tedy kultivované z běžně sterilního materiálu (krev, likvor, punktát). V případě epiglotitid byly výjimečně zařazeny i kmeny pocházející z horních cest dýchacích. Celkem bylo v NRL HEM v letech 1999–2020 zpracováno 623 invazivních kmenů H. influenzae.
Kultivace a uchování kmenů
Kmeny byly kultivovány na čokoládovém agaru (ČA, Oxoid), krevním agaru (KA, Oxoid) nebo Levinthalově agaru přes noc při 35–37 °C v atmosféře s 5–10 % CO2. Dlouhodobě byly kmeny skladovány v kryozkumavkách ITEST KRYOBANKA B (ITEST plus s.r.o.) při -70 °C.
Růstové podmínky
Byla testována závislost na růstových faktorech X (hemin) a V (NAD nebo NADP). Při růstu na KA byl sledován satelitismus, tj. růst podél stafylokokové čáry jako důkaz závislosti na faktorech X a V. Též byla sledována přítomnost hemolýzy. Dále byla sledována morfologie kolonií na plotnách. Kmeny tvořící pouzdro se vyznačovaly mukózními koloniemi. U opouzdřených kmenů byla na Levinthalově agaru pozorována iridiscence.
Pro průkaz závislosti na faktoru X byl proveden porfyrinový test. Suspenze kultury z ČA byla přenesena kličkou (5μl) do zkumavky s médiem obsahujícím kyselinu delta-aminolevulanovou. Po kultivaci bylo přidáno Kovacsovo činidlo a sledována barevná změna ve spodní části zkumavky v případě nezávislosti na faktoru X.
Fenotypový projev kmenů – biotypizace
H. influenzae se vyskytuje v 8 biotypech dle fenotypového projevu, viz tabulka 1. Kultivace probíhala po přidání plné kličky (5μl) kultury z ČA buď do tekutého média, či vpichy do agaru (test na ureasu a H2S). Testována byla produkce indolu po přidání Ehrlichova činidla, ornithin dekarboxylasová aktivita a ureázová aktivita. Dodatkově k odlišení od dalších druhů rodu Haemophilus byla testována schopnost utilizace glukózy, laktózy, manózy, sacharózy a produkce sirovodíku. Všechna testovací média a roztoky byly připraveny na varně SZÚ.
Tab. 1. Biotypy H. influenzae a fenotypové vlastnosti vybraných blízkých druhů
Table 1. H. influenzae biotypes and phenotypic characteristics of selected closely related species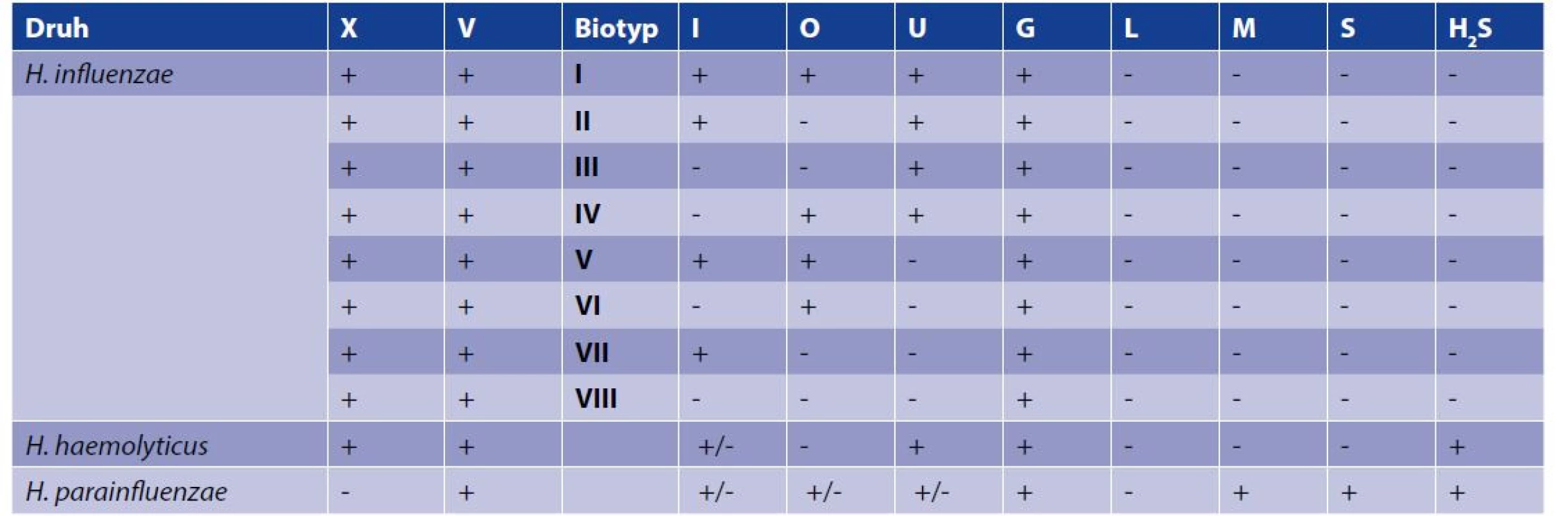
X – závislost na faktoru X, V – závislost na faktoru V, I – produkce indolu, O – ornithin dekarboxylasová aktivita; U – ureasová aktivita; G – utilizace glukózy, L – utilizace laktózy, M – utilizace manózy, S – utilizace sacharózy, H2S – produkce sirovodíku
X – X-factor dependence, V – V-factor dependence, I – indole production, O – ornithine decarboxylase activity; U – urease activity; G – glucose utilization, L – lactose utilization, M – mannose utilization, S – sucrose utilization, H2S – hydrogen sulphide productionSklíčková aglutinace
Sérotypy kmenů byly odlišovány pomocí sklíčkové aglutinace kapsulárního antigenu se specifickou protilátkou (Haemophilus influenzae Agglutinating Sera, Remel Europe Ltd., Velká Británie). Na sklíčku byl v kapce fyziologického roztoku rozetřen kličkou (5μl) vzorek kultury z ČA až do vytvoření suspenze a poté bylo přidáno specifické antisérum a-f. Pozitivní reakcí bylo vytvoření shluků antigen-protilátka za vyčeření okolního roztoku. HiNT kmeny nemusí reagovat s žádným sérem, mohou ale reagovat s více séry současně (polyaglutinabilní kmeny), případně spontánně aglutinovat ve fyziologickém roztoku (spontánně aglutinabilní).
Multilokusová sekvenční typizace
Multilokusová sekvenční typizace (MLST) je metoda poskytující data o alelických variantách housekeeping genů H. influenzae – adk (adenylátkináza), atpG (γ podjednotka F0F1 ATP synthasy), frdB (B podjednotka fumarát reduktázy), fucK (L-fukulokináza), mdh (malát dehydrogenáza), pgi (glukóza-6-fosfát izomeráza) a recA (rekombináza RecA). Použité primery, protokol a teplotní cyklus polymerázové řetězové reakce (PCR) byly převzaty z publikace [6].
Pro izolaci DNA z kultury narostlé na ČA byla použita souprava QIAamp DNA Mini Kit (Qiagen). PCR amplikony byly přečistěny kitem Wizard 96 SV (Promega) dle protokolu výrobce. Sekvenační amplifikace byly provedeny v reakčních směsích pomocí mastermix BigDye Terminator v3.1 Cycle Sequencing Kit (Thermo Fisher Scientific) dle protokolu výrobce. Produkty byly přečistěny srážením 70% ethanolem s 8 mM obsahem octanu draselného a po usušení suspendovány ve formamidu. Přečistěné reakční směsi byly analyzovány v genetickém analyzátoru 3130xl (Thermo Fisher Scientific). K hodnocení MLST dat byl použit software DNASTAR Lasergene 12 Core Suite (DNASTAR) a PubMLST databáze [7].
Z celkového počtu 623 invazivních kmenů H. influenzae byla MLST provedena u 383 kmenů. Od roku 2001 byly touto metodou charakterizovány pouze vybrané kmeny Hib s důrazem na izoláty z likvoru, teprve od roku 2005 byla MLST používána i pro kmeny ostatních sérotypů a HiNT.
Tvorba dendrogramů a kalkulace podobnosti kmenů
Analýza dat byla provedena pomocí software Bio - Numerics 7.6 (Applied Maths). MLST sekvenční typy (ST) byly nahrány jako spojené sekvence 7 alel genů MLST schématu pro H. influenzae stažené z PubMLST databáze [7]. Data o kmenech byla nahrána v binární formě v případě informací o druhu (a-f, HiNT), biotypu (I-VIII), a informací o pacientovi, tedy diagnóze (sepse / meningitida / pneumonie / artritida / epiglotitida), pohlaví (muž / žena) a věku (<1 rok, 1-4, 5-9, 10-14, 15-19, 20-24, 25-34, 35-44, 45-54, 55-64, 65+ let). Analyzováno bylo celkem 383 kmenů H. influenzae ze sbírky NRL HEM získaných v rámci surveillance v ČR, pro které byla provedena MLST analýza. Soubor byl obohacen o 5 kmenů z databáze PubMLST, které patřily sérotypům vyskytujícím se v ČR výjimečně nebo vůbec – 90695476 a 33631158 (Hia), Hi88 a Hi85 (Hic), 03-3135 (Hid) [7].
Kalkulace podobnosti ST byla provedena na základě genových sekvencí jednotlivých testovaných kmenů s využitím Euklidovské vzdálenosti. Koeficient podobnosti byl kategorický na základě jednonukleotidových polymorfismů (SNPs) se škálovacím faktorem 10. Klastrováno bylo metodou UPGMA (Unweighted Pair Group Method with Aritmetic mean).
Pro analýzu vztahů ST kmenů s klinickými projevy a pacienty byla použita kalkulace v Euklidovském prostoru. Pro každý dataset (např. druh) byla provedena separátní kalkulace. Data v binární formě měla koeficient podobnosti Cosine, MLST data pak Multiple alignment based. Celkový koeficient podobnosti byl průměr jednotlivých datasetů (experimentů) a klastrováno bylo metodou UPGMA se stejnou vahou pro všechny datasety.
VÝSLEDKY A DISKUSE
H. influenzae b
H. influenzae sérotypu b patří mezi opouzdřené kmeny. Polysacharidové pouzdro Hib tvořené polyribosylribitolfosfátem patří mezi nejúčinnější pouzdra umožňující odolávat imunitnímu systému, především se vyhnout fagocytóze [1]. Invazivní hemofilová onemocnění se vyskytují především u dětí, se zvyšujícím se věkem se zvyšuje i protilátková odpověď a systémová onemocnění u dospělých jsou vzácná [2] (obr. 1 a 2). U seniorů se vnímavost k infekci zvyšuje, především nad hranicí 65 let.
Obr. 1. Invazivní onemocnění způsobená Hib v ČR v letech 1999–2020 podle věku a pohlaví, surveillance data
Figure 1. Invasive disease caused by Hib in the Czech Republic in 1999–2020, age and sex distribution, surveillance data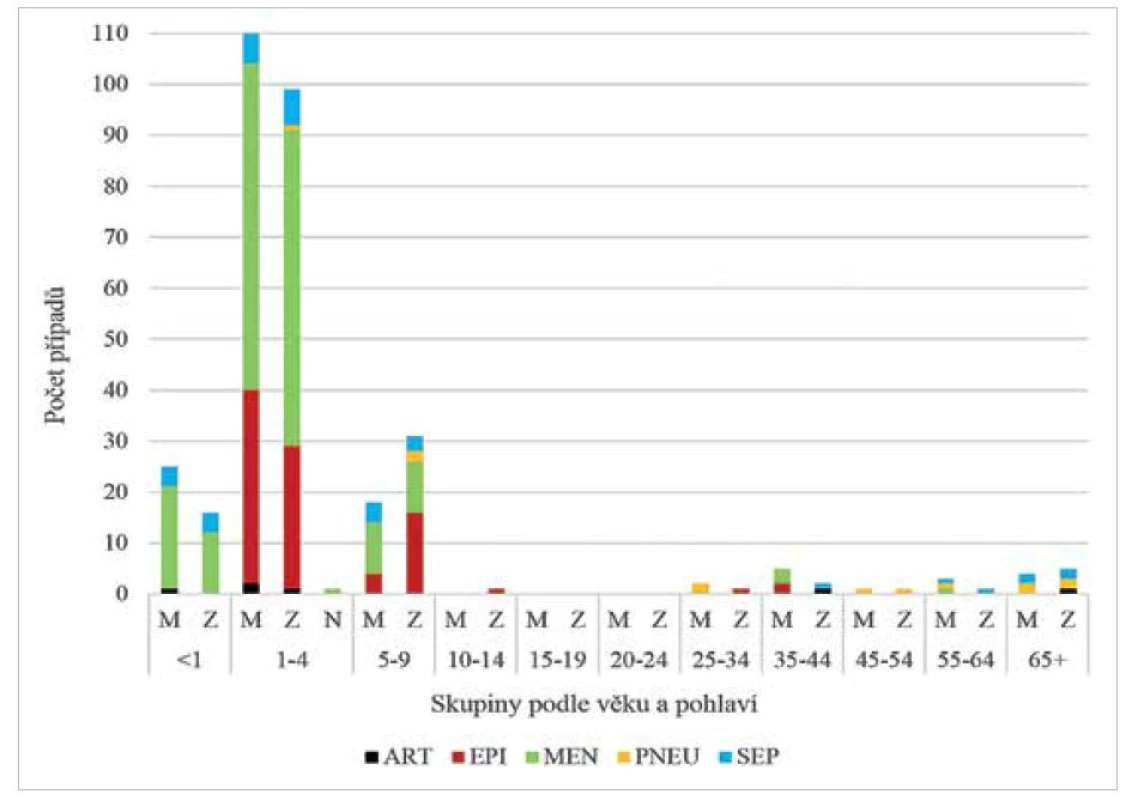
Analyzováno bylo 326 Hib kmenů. Barevně jsou uvedeny klinické formy: ART – artritida, EPI – epiglotitida, MEN – meningitida, PNEU – pneumonie, SEP – sepse, M – muž, Z – žena, N – pohlaví neurčeno
326 Hib strains analysed. Clinical forms are shown in colour: ART – arthritis, EPI – epiglottitis, MEN – meningitis, PNEU – pneumonia, SEP – sepsis, M – male, F – female, N – sex not determinedObr. 2. Invazivní onemocnění způsobená různými sérotypy H. influenzae v ČR v letech 1999–2020, dělení podle věku a pohlaví, surveillance data
Figure 2. Invasive disease caused by different serotypes of H. influenzae in the Czech Republic in 1999–2020, age and sex distribution, surveillance data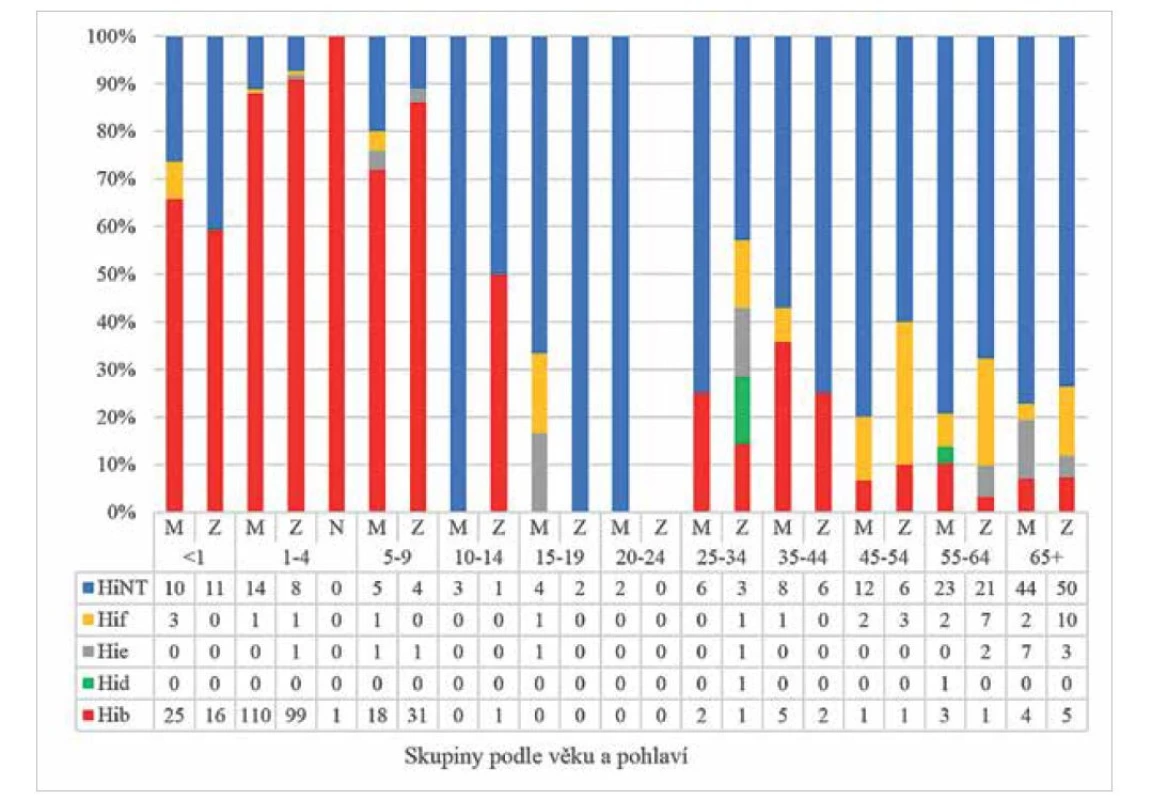
Analyzováno bylo 623 kmenů H. influenzae.
623 H. influenzae strains analysed.Z hlediska klinické manifestace u Hib v letech 1999-2020 v ČR převažovaly meningitidy (56,1 %) následované epiglotitidami (27,6 %). Výrazně méně byly zastoupeny sepse (10,7 %), pneumonie (3,7 %) a artritidy (1,8 %). Tento trend se postupně měnil s klesající incidencí Hib. Meningitida způsobená Hib byla v ČR zaznamenána naposledy v roce 2016. V roce 2019 byly zaznamenány dva případy invazivního onemocnění Hib, oba sepse, v roce 2020 pak jeden případ epiglotitidy. Studie [8] uvádí, že po prodělané virové infekci horních nebo dolních cest dýchacích jsou lidé náchylnější ke kolonizaci opouzdřenými i neopouzdřenými kmeny H. influenzae. Druhou nejčastější predispozicí invazivního hemofilového onemocnění je otitida uváděná u 36 % pacientů s Hib (a pouze u 8 % s HiNT).
Jelikož Hib může způsobovat závažné infekce s fatálními následky, především u dětí pod 1 rok věku, je ve většině vyspělých zemí zavedena vakcinace v prvních měsících života. V České republice bylo očkování proti Hib zavedeno v roce 2001 jako součást tetravalentní vakcíny, od roku 2006 je součástí hexavalentní vakcíny. Děti do 1 roku věku byly očkovány od roku 2001 do roku 2018 v dávkovacím schématu 3+1, od roku 2018 v uspořádání 2+1 [9]. V roce 2019 bylo v ČR naočkováno 3 dávkami vakcíny proti Hib 97 % dětí pod 1 rok věku [10], v rámci EU 79 % [11]. Ve všech zemích, které rutinně zavedly očkování proti Hib, byl pozorován výrazný pokles incidence invazivního onemocnění Hib [8, 12, 13, 14, 15, 16]. Snížení incidence o více než 90 % původního stavu je též označováno jako jeden z největších úspěchů v historii očkování [2]. Krom tohoto poklesu dosud nebyl zaznamenán replacement sérotypů, tj. zvýšení počtu onemocnění způsobených jinými sérotypy či HiNT [2, 3, 13], jak je vidět na grafu (obr. 3). Od roku 2009 nepřesáhla celková nemocnost Hib invazivním onemocněním v ČR hodnotu 0,02/100 000 obyvatel (celková nemocnost H. influenzae pak nepřesáhla hodnotu 0,28/100 tis. obyvatel) [17].
Obr. 3. Absolutní počty invazivních onemocnění způsobených H. influenzae v ČR v letech 1999-2020, surveillance data
Figure 3. Absolute numbers of cases of invasive diseases caused by H. influenzae in the Czech Republic in 1999-2020, surveillance data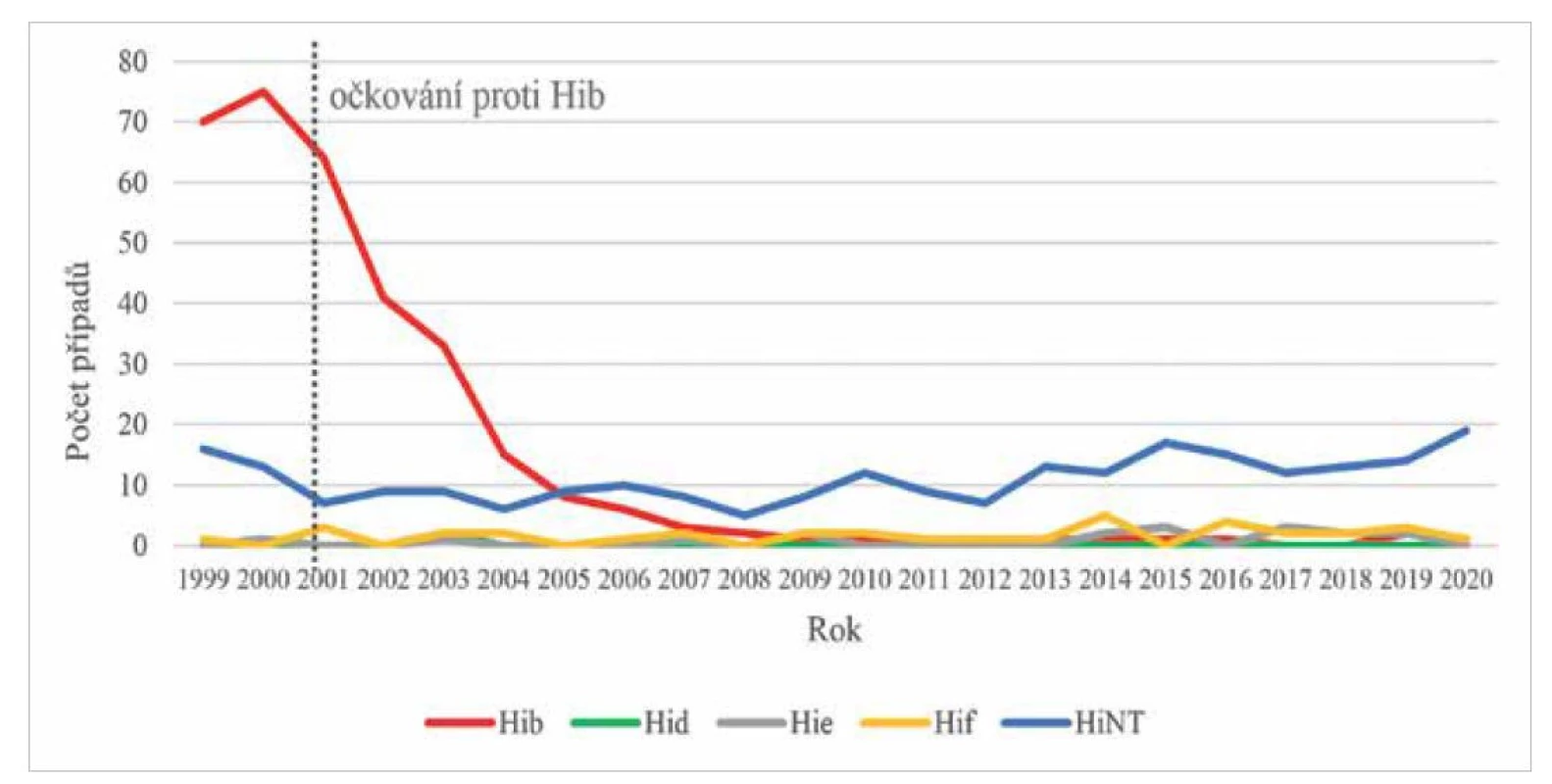
Analyzováno bylo 623 kmenů H. influenzae.
623 H. influenzae strains analysed.Pokud se na kmeny Hib podíváme z hlediska populačního, zjistíme, že se stejně jako ostatní opouzdřené kmeny vyznačují poměrně nízkou diverzitou a z genetického hlediska omezeným množstvím klonálních populací [18]. Fenotypová charakterizace 326 kmenů Hib ukázala, že 97,2 % kmenů patřilo k biotypu I, pouze 1,5 % k biotypu II a 1,2 % k biotypu IV.
H. influenzae – ostatní opouzdřené kmeny
Kromě Hib se rozlišuje dalších 5 sérotypů H. influenzae, přičemž výskyt jimi způsobených infekcí se lokálně liší. Situace v ČR se výrazně neliší od zbytku Evropy. Ve státech EU v současnosti dominuje z opouzdřených kmenů Hif. V roce 2018 byl v EU Hif původcem 9 % invazivních hemofilových onemocnění, následován byl Hib (7 %), Hie (3 %) a 2,6 % případů připadalo na Hia, Hic, Hid a non-b; pro 43 % hlášených onemocnění invazivním hemofilem však nebyl sérotyp znám [3].
Opouzdřené kmeny patřící k sérotypu Hia, stejně tak Hic, nebyly na našem území za posledních 20 let zaznamenány. Hia, který se klinicky projevuje velmi podobně jako Hib, je např. na Islandu třetím nejčastějším sérotypem (po HiNT a Hif ) [8] a je dominantním sérotypem působícím invazivní onemocnění u dětí pod 5 let věku v Utahu (USA) [19]. V Kanadě sérotyp Hia dominuje u původních obyvatel Ontaria (91 % hemofilových infekcí způsobuje Hia) [15], v Britské Kolumbii pak u dětí pod 1 rok věku (celkově je Hia třetí nejčastější po HiNT a Hib) [20]. Případy invazivního onemocnění Hi sérotypu c jsou velmi vzácné.
Sérotyp Hid byl v ČR v letech 1999-2020 zaznamenán pouze dvakrát (viz obr. 2), a to v roce 2003. Jednalo se o případ meningitidy u 25leté ženy a artritidy u 56letého muže. Oba kmeny patřily k biotypu III. Obecně jde o minimálně se vyskytující sérotyp.
Kmeny sérotypu Hie byly v ČR v letech 1999-2020 zaznamenány jako původci invazivního onemocnění v 17 případech (viz obr. 2 a obr. 3). Fenotypově patřilo 31 % kmenů Hie ze sbírky NRL HEM získaných v rámci surveillance k biotypu I a 69 % kmenů k biotypu IV. U jednoho vzorku nebylo možno biotyp určit, jelikož do NRL HEM byla doručena DNA kmene izolovaná z likvoru.
V ČR byly kmeny Hif v letech 1999-2020 původci invazivních onemocnění ve 35 případech (viz obr. 2 a obr. 3). Opět se jedná o velmi konzervativní skupinu kmenů. Všechny kmeny, s výjimkou jednoho s biotypem III, patřily k biotypu I.
Klinické projevy onemocnění způsobených kmeny těchto sérotypů jsou shrnuty v tabulce 2, přičemž nejběžnější byla sepse.
Tab. 2. Invazivní onemocnění způsobená sérotypy Hid, Hie a Hif v ČR v letech 1999–2020 podle klinických projevů, věku a pohlaví; surveillance data
Table 2 Invasive disease caused by Hid, Hie and Hif serotypes in the Czech Republic in 1999–2020, clinical manifestation, age, and sex distribution; surveillance data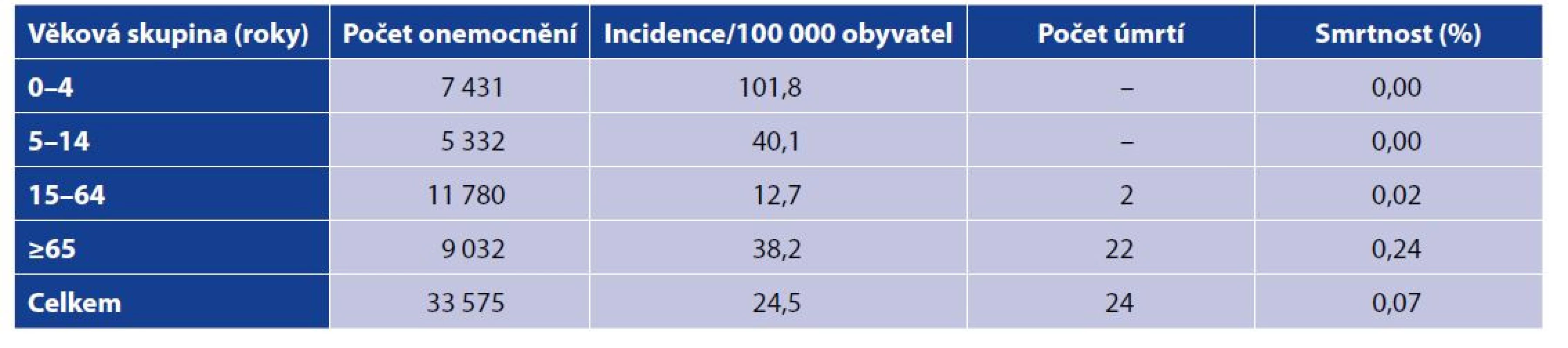
Věk je uváděn v rocích.
ART – artritida, EPI – epiglotitida, MEN – meningitida, PNEU – pneumonie, SEP – sepse, M – muž, Z – žena.
Age is given in years.
ART – arthritis, EPI – epiglottitis, MEN – meningitis, PNEU – pneumonia, SEP – sepsis, M – male, F – femaleH. influenzae – neopouzdřené kmeny
Neopouzdřené kmeny (HiNT) jsou v současnosti dominantní skupinou H. influenzae způsobující invazivní onemocnění, zároveň jsou však součástí běžné mikroflóry. Jelikož netvoří polysacharidové pouzdro, je jejich hlavním faktorem virulence a zároveň antigenem lipooligosacharid (LOS) [21]. Fenotypově za ně mohou být zaměněny kmeny obsahující geny pro syntézu pouzdra, které ztratily část genu pro transport pouzdra na povrch bakterie a de facto pouzdro netvoří [22]. Od zavedení očkování proti Hib jsou HiNT nejběžnějšími původci hemofilových invazivních onemocnění, přičemž četnost těchto onemocnění je za posledních 21 let relativně konstantní (viz obr. 3). V rámci EU je tento trend totožný [3]. Hlášení těchto onemocnění je povinné až od roku 2009. Od roku 2006 sice lze v ČR pozorovat mírný nárůst počtu invazivních onemocnění způsobených HiNT, nicméně se jedná o jednotky případů a nelze jej považovat za replacement sérotypů.
Infekce neinvazivního charakteru horních i dolních cest dýchacích jsou spojeny téměř výhradně s HiNT, přičemž obecně je H. influenzae nejčastěji izolován z otitid a sinusitid [23]. Z hlediska invazivních onemocnění byla v rámci této studie klinická manifestace následující: 54,7 % případů byly sepse, 21,8 % meningitidy, 20,6 % pneumonie, 2,1 % epiglotitidy a 0,8 % artritidy. Nejvíce invazivních onemocnění bylo zaznamenáno u dětí mladších 4 let a u seniorů nad 55 let (obr. 4).
Obr. 4. Invazivní onemocnění způsobená HiNT v ČR v letech 1999–2020 podle věku a pohlaví, surveillance data
Figure 4. Invasive disease caused by HiNT in the Czech Republic in 1999–2020, age and sex distribution, surveillance data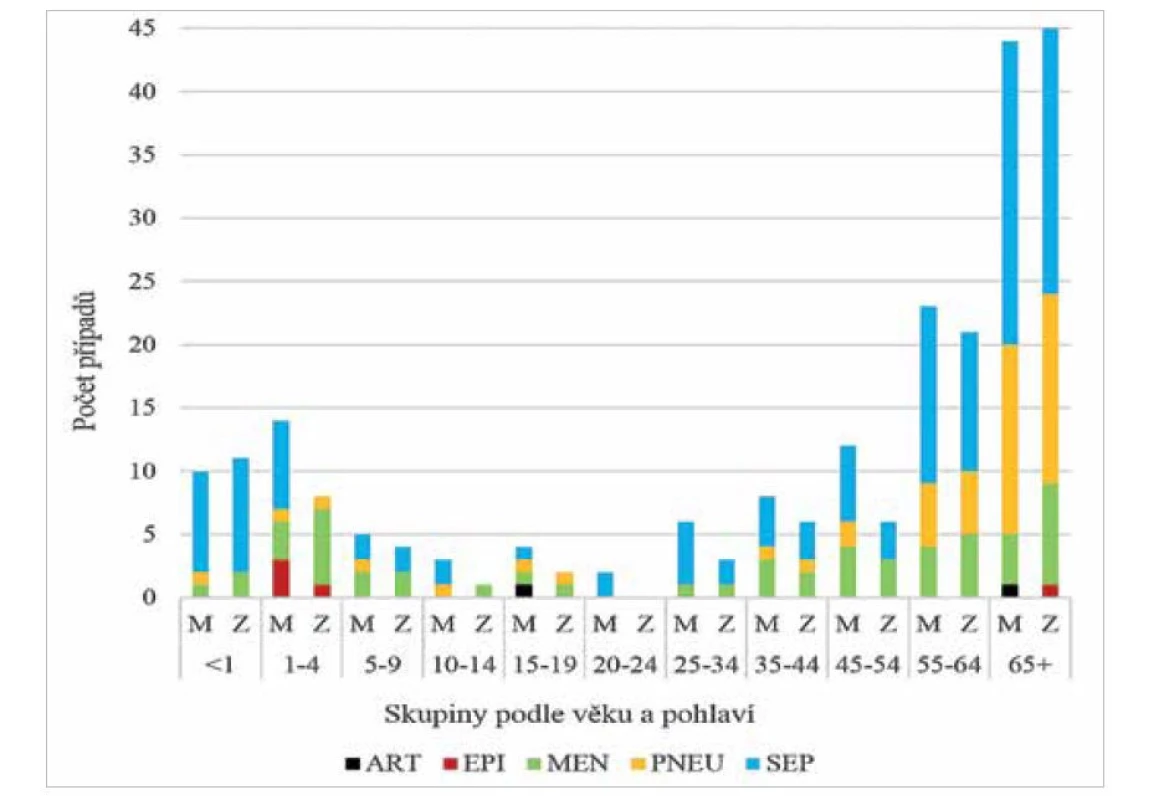
Analyzováno bylo 243 kmenů HiNT. Barevně jsou uvedeny klinické formy: ART – artritida, EPI – epiglotitida, MEN – meningitida, PNEU – pneumonie, SEP – sepse, M – muž, Z – žena
243 HiNT strains analysed. Clinical forms are shown in colour: ART – arthritis, EPI – epiglottitis, MEN – meningitis, PNEU – pneumonia, SEP – sepsis, M – male, F – femaleHiNT jsou nejvíce heterogenní skupinou H. influenzae. Fenotypově byly zastoupeny všechny biotypy kromě biotypu VIII (obr. 5). Geneticky jsou HiNT velmi rozmanité, více v části Genetická variabilita.
Obr. 5. Biotypy testovaných neopouzdřených kmenů (HiNT)
Figure 5. Biotypes of the non-encapsulated strains tested (HiNT)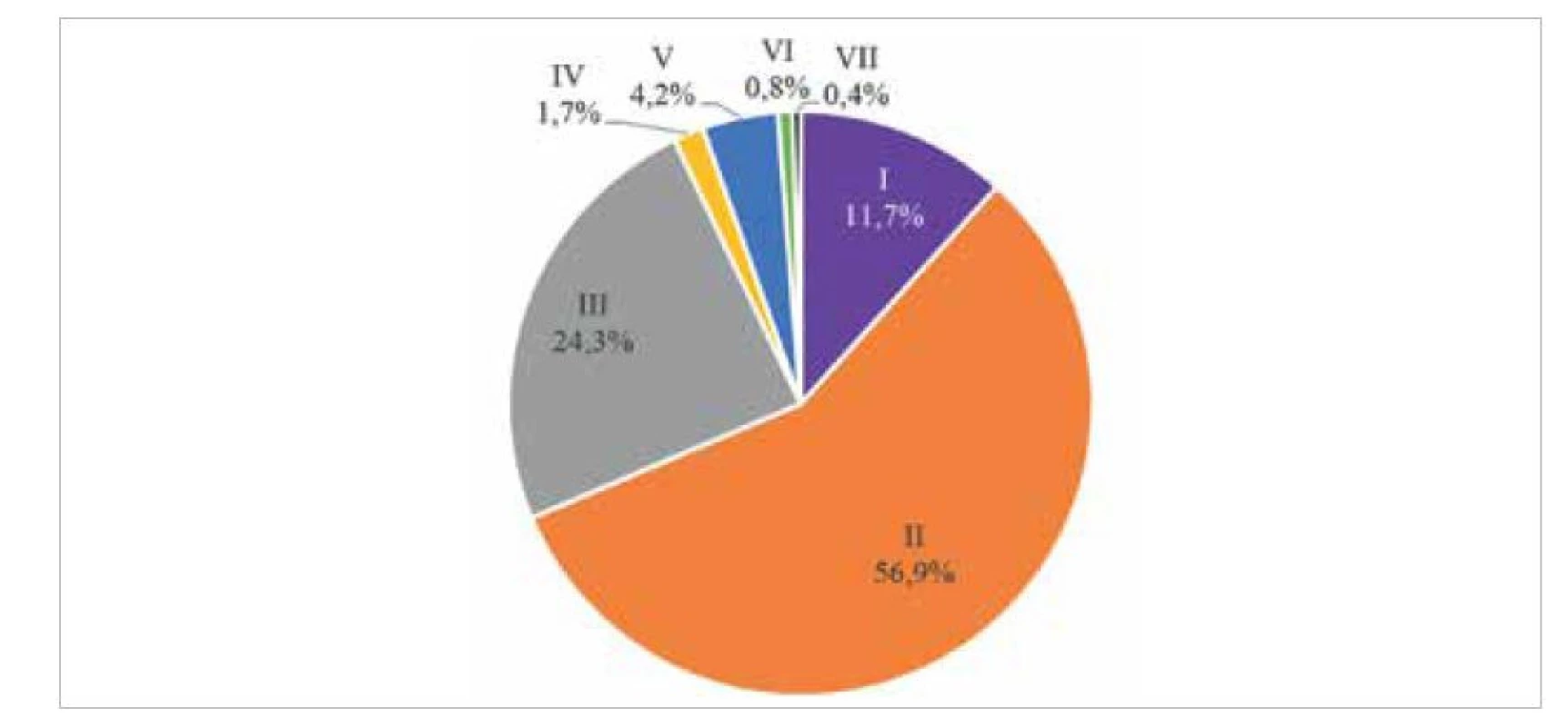
Testováno bylo 239 kmenů, 4 kmeny nebyly zahrnuty, neboť příchozím materiálem byla izolovaná DNA.
239 strains were tested, 4 strains were not included since only DNA isolates were available.Ač jsou HiNT součástí běžné mikroflóry a jedinec může být osídlen i více kmeny HiNT zároveň bez jakýchkoliv klinických projevů, jsou tyto kmeny též původci závažných infekcí. Již několik let se proto řeší možnosti očkování proti této skupině bakterií. Jako rizikové skupiny se uvádí novorozenci z hlediska vážných invazivních onemocnění, kojenci a děti kvůli akutním otitidám, pacienti s cystickou fibrózou a chronickou obstrukční plicní nemocí (CHOPN) kvůli riziku rozvoje a zhoršení stavu onemocnění [23].
Genetická variabilita
H. influenzae se vyznačuje relativně menším genomem, typicky o velikosti kolem 1,85 milionu párů bazí. Toto omezuje H. influenzae co do schopnosti přežít mimo hostitele, zároveň však umožňuje rychlejší množení a snižuje nároky na množství nutrientů potřebných k růstu a dělení buněk. Pro genetickou analýzu kmenů H. influenzae to představuje výhodu vzhledem k omezenému množství genů a tedy jednodušší práci při hledání rozdílů mezi bakteriálními subtypy.
MLST je jedna z metod charakterizace kmenů využívající mutací v sedmi housekeeping genech k rozlišení tzv. sekvenčních typů (ST). Bodová mutace zkoumané části genu znamená odlišnou alelickou variantu, odlišná kombinace alel pak odlišný ST. ST lišící se 1-3 alelami genů jsou dále spojovány do klonálních komplexů (CC, clonal complex).
Byla provedena analýza ST u 388 invazivních kmenůH. influenzae. Výsledky jsou zobrazeny na dendrogramu (obr. 6). Hib kmeny vykazovaly blízkou příbuznost, jelikož všech 166 kmenů patřilo do klonálního komplexu CC6 v 17 různých sekvenčních typech, z toho 69,7 % náleželo k sekvenčnímu typu ST6. Ze 14 kmenů Hie patřily všechny do CC18 ve třech různých ST variantách a všechny kmeny Hif (27 kmenů) patřily k ST124. Tyto výsledky korespondují s obecně nízkou genetickou diverzitou opouzdřených kmenů [18], přičemž je vidět odlišnost Hie a Hif od ostatních sérotypů. K nim nejpodobnější sekvence měly dva kmeny HiNT patřící do ST1465 a ST2137. Geneticky nejrozmanitější skupinou byly HiNT. U 176 kmenů bylo identifikováno 87 různých sekvenčních typů.
Obr. 6. MLST analýza 388 kmenů H. influenzae
Figure 6. MLST analysis of 388 H. influenzae strains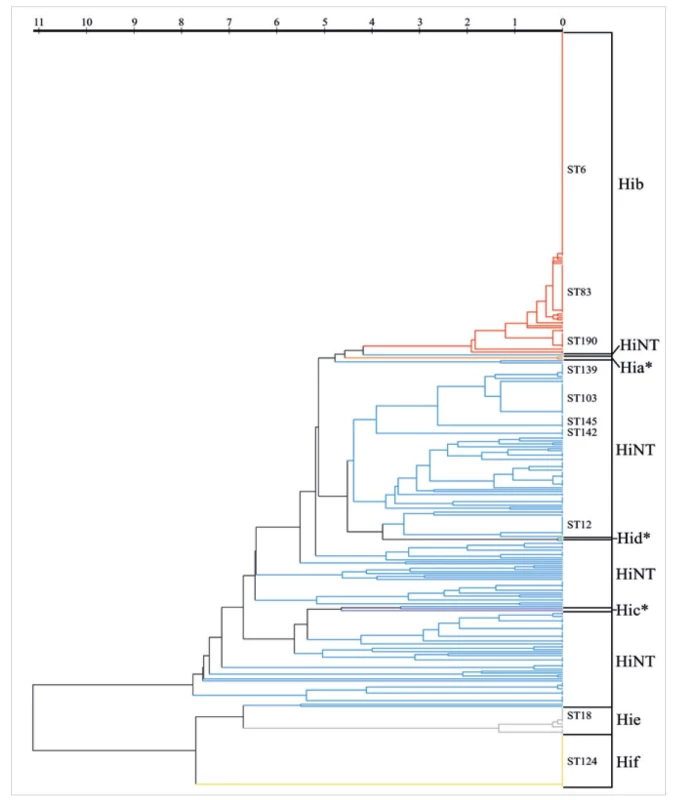
Dendrogram byl vytvořen v programu BioNumerics 7.6 s použitím spojených sekvencí pro 7 genů MLST schématu. Barevně jsou označeny jednotlivé sérotypy a označeny jsou početně více zastoupené ST.
*sekvence sbírkových kmenů z databáze PubMLST
The dendrogram was generated in BioNumerics 7.6 using concatenated sequences for the seven genes of the MLST scheme. Different serotypes are colour coded, and the more abundant STs are indicated.
*sequence of collection strains from the PubMLST databaseZatímco opouzdřené kmeny jsou poměrně homogenní, HiNT jsou považovány za velmi heterogenní skupinu kmenů. Přesto však některé studie prezentují dělení kmenů HiNT do skupin a analýza MLST alelických sekvencí podle nich umožňuje rozklíčování populační struktury HiNT na další úrovni [24, 25].
Srovnání invazivních kmenů ze sbírky NRL HEM získaných v rámci surveillance v ČR, 1999–2020
MLST se celosvětově používá jako standard charakterizace patogenů. U jiných patogenních mikroorganismů již byla prokázána spojitost konkrétních ST s infekcemi cílových skupin, žádoucí tak bylo ověření podobných závislostí v případě H. influenzae zachycených na území ČR.
Byly analyzovány kmeny zahrnující sérotypy zastoupené na území ČR (Hib, Hie a Hif ) a HiNT, u kterých byla provedena MLST a u nichž byly známy další údaje o vlastnostech kmene a o pacientovi. Pro větší komplexnost analýzy a možnost srovnání se sérotypy, které se na našem území nevyskytují, bylo doplněno z databáze PubMLST [7] též několik kmenů zastupujících sérotypy Hia (2 kmeny), Hic (2 kmeny) a Hid (1 kmen), u kterých byly známy potřebné údaje. Kromě MLST sekvencí byly pro každý kmen uvedeny ve formě binárních dat informace o sérotypu, biotypu, věku a pohlaví pacienta a klinickém projevu onemocnění (artritida/ pneumonie/sepse/meningitida/epiglotitida). Cílem bylo zjistit, zda bude možné určit souvislosti mezi ST a typem onemocnění či skupinou pacientů.
Výsledky analýzy ukázaly, že nelze určit žádnou jednoznačnou souvislost mezi konkrétními ST a klinickou manifestací, věkem či pohlavím. Důvodem byla vysoká klonálnost opouzdřených kmenů a zároveň vysoká diverzita HiNT spolu s omezeným množstvím kmenů stejného ST. Následuje několik příkladů. Ačkoliv 27 analyzovaných kmenů Hif patřilo do stejného ST (ST124), způsobovaly artritidu, epiglotitidu, meningitidu, pneumonii i sepsi bez ohledu na věk či pohlaví. Z 10 kmenů HiNT ST12 jich 6 způsobilo sepsi, u 3 žen starších 65 let, ale též u 3 dětí mladších 4 let (2 chlapci, 1 dívka). Ze 7 kmenů HiNT ST142 způsobily 4 sepsi u pacientů starších 65 let (2 muži, 2 ženy), zbylé 3 pak meningitidy. Nejpočetněji zastoupený ST u HiNT byl ST103, přičemž z 16 kmenů jich 13 způsobilo sepse (10 dospělých a 3 děti), 2 pneumonie a 1 meningitidu. Většina ST u HiNT je však zastoupena pouze jednou a i u častěji zachycených ST jde o statisticky obtížně prokazatelné trendy.
Rozklíčování populační struktury HiNT včetně korelací s vyvolaným onemocněním a dalšími ukazateli tedy určení MLST sekvenčních typů neumožňuje – zejména u opouzdřených kmenů lze nalézt totožný ST u různých klinických manifestací. Na základě celogenomové sekvenace (WGS, whole genome sequencing) a srovnání distribuce vybraných genů se uvádí 6 skupin (clades) HiNT, které sice nekorelují s onemocněními, nicméně je lze spojit se známými faktory virulence, otitidou, CHOPN a asymptomatickým nosičstvím [26]. Typy infekce podle nich závisí spíše na faktorech na straně lidského hostitele. Stejné rozdělení do 6 skupin uvádí i další studie, která na základě analýzy 243 genomů HiNT uvádí 17 genů vhodných k rozlišení mezi těmito skupinami; jde o geny mimo základní genom společný pro H. influenzae [18]. Housekeeping geny MLST schématu tedy nejsou spojeny s odlišnými projevy onemocnění, zásadní podle všeho budou ostatní geny a vliv charakteristik hostitele. V budoucnu budou dle současného technologického vývoje zásadní rutinní WGS data.
Vývoj hemofilových onemocnění v budoucích letech bude též významně ovlivněn aktuálně probíhající pandemií koronaviru SARS-CoV-2 a zavedenými plošnými protiepidemickými opatřeními. Studie z roku 2020, do které se NRL HEM zapojila, prokázala významný pokles respiračně přenosných infekčních agens Streptococcus pneumoniae, Neisseria meningitidis a H. influenzae [27] během pandemie. Proto je důležitá surveillance invazivních onemocnění způsobených H. influenzae a včasné zachycení případných nových trendů.
ZÁVĚR
Současným trendem v ČR po zavedení očkování v roce 2001 je výskyt onemocnění vyvolaných Hib pouze v jednotkách případů za rok, infekcí vyvolaných celkově všemi typy pak cca 20 invazivních onemocnění ročně s převahou HiNT. Celková nemocnost invazivním onemocněním H. influenzae se v posledních 11 letech setrvale pohybuje pod hodnotou 0,28/100 000 obyvatel.
Souhrnně bylo v ČR v letech 1999–2020 zaznamenáno 623 invazivních onemocnění způsobených H. influenzae. Stabilně se objevují sérotypy Hib, Hie, Hif a neopouzdřené kmeny HiNT, zatímco sérotyp Hid zcela výjimečně a sérotypy Hia a Hic nebyly v ČR dosud zaznamenány. Obecně lze konstatovat, že Hib vyvolávaly častěji onemocnění u dětí, Hie a Hif u dospělých nad 55 let. V posledních letech byly nejběžnějšími původci onemocnění HiNT následované kmeny Hif. Nejčastější diagnózou již není meningitida, ale sepse. Invazivní kmeny byly též analyzovány pomocí MLST a dalších epidemiologických charakteristik, signifikantní vztahy mezi sekvenčními typy a onemocněními či vazby na věk pacientů nebyly prokázány. Do budoucna v tomto ohledu nabízí větší možnosti celogenomová sekvenace. Je důležité v surveillance invazivních onemocnění způsobených H. influenzae nadále pokračovat a sledovat, zda nedochází ke změnám současných trendů.
Poděkování
Autoři touto cestou děkují všem epidemiologům, mikrobiologům a klinickým lékařům, kteří se v ČR aktivně podílejí na zajišťování programu surveillance invazivního onemocnění způsobeného H. influenzae.
Podpořeno MZ ČR – RVO („Státní zdravotní ústav – SZU, 75010330“).
Do redakce došlo dne 20. 5. 2021.
Adresa pro korespondenci:
MUDr. Jana Kozáková CEM
Oddělení bakteriálních vzdušných nákaz S
tátní zdravotní ústav
Šrobárova 49/48
100 00 Praha 10
e-mail: jana.kozakova@szu.cz
Zdroje
1. Růžička F. Rod Haemophilus. In: Votava M, et al. Lékařská mikrobiologie speciální. Brno: NEPTUN, 2003. ISBN 80-902896-6-5.
2. Ryan KJ, Ray CG, et al. Sherris Medical Microbiology, Fifth Edition. USA, McGraw-Hill Companies, 2010. ISBN 978-0-07-160402-4.
3. European Centre for Disease Prevention and Control. Haemophilus influenzae. In: ECDC. Annual epidemiological report for 2018. Stockholm: ECDC, 2020. Dostupný na www:< https:// www.ecdc.europa.eu/en/publications-data/haemophilus-influenzae - annual-epidemiological-report-2018>.
4. Zákon č. 258/2000 Sb., o ochraně veřejného zdraví, ve znění pozdějších předpisů, § 75a [online]. 2015-09-16 [cit. 2020-10-18]. Dostupné na www: <https://www.zakony.cz/zakon-SB2015267>.
5. Vyhláška č. 473/2008 Sb., o systému epidemiologické bdělosti pro vybrané infekce, ve znění pozdějších předpisů [online]. 2008-12-30 [cit. 2020-10-18]. Dostupné na www: <https://www.zakonyprolidi.cz/cs/2008-473>.
6. Meats E, Feil EJ, Stringer S, et al. Characterization of encapsulated and noncapsulated Haemophilus influenzae and determination of phylogenetic relationships by multilocus sequence typing. Journal of Clinical Microbiology, 2003;41(4):1623–1636.
7. Jolley KA, Bray JE, Maien MCJ. Open-access bacterial population genomics: BIGSdb software, the PubMLST.org website and their applications. Wellcome Open Research, 2018, 3(124). Dostupné na www: <https://wellcomeopenresearch.org/articles/3-124/v1>.
8. Berndsen MR, Erlendsdóttir H, Gottfredsson M. Evolving epidemiology of invasive Haemophilus infections in the post-vaccination era: results from a long-term population-based study. Clinical Microbiology and Infection, 2012;18(9):918–923.
9. Vyhláška č. 355/2017 Sb. kterou se mění vyhláška č. 537/2006 Sb., o očkování proti infekčním nemocem, ve znění pozdějších předpisů [online]. 2017-10-30 [cit. 2020-10-18]. Dostupné na www: <https://www.zakonyprolidi.cz/cs/2017-355>.
10. World Health Organization, The Global Health Observatory. Hib (Hib3) immunization coverage among one-year-olds (%) [online]. 2020-07-20 [cit. 2020-11-30]. Dostupné na www: <https://www.who.int/data/gho/data/indicators/indicator-details/GHO/hib-(hib3)-immunization-coverage-among-1-year-olds-(-)>.
11. World Health Organization, Regional Office for Europe. Routine immunization summary, WHO European Region, 2019 – Data as of 18 August 2020 [online]. [cit. 2020-11-30]. Dostupné na www: <https://www.euro.who.int/en/health-topics/disease-prevention/vaccines-and-immunization/data-and-statistics/routine-immunization-regional-and-country-profiles/data-for-2019/routine-immunization-summary,-who-european-region,-2019-data-as-of-18-august-2020>.
12. Pedersen TI, Howitz M, Østergaard C. Clinical characteristics of Haemophilus influenzae meningitis in Denmark in the post-vaccination era. Clinical Microbiology and Infection, 2010;16(5):439–446.
13. Giufrè M, Cardines R, Caporali MG, et al. Ten years of Hib vaccination in Italy: Prevalence of non-encapsulated Haemophilus influenzae among invasive isolates and the possible impact on antibiotic resistence. Vaccine, 2011;29(22):3857–3862.
14. Bajanca-Lavado MP, Simões AS, Betencourt CR, et al. Characteristics of Haemophilus influenzae invasive isolates from Portugal following routine childhood vaccination against H. influenzae serotype b (2002–2010). European Journal of Clinical Microbiology and Infectious Diseases, 2014;33(4):603–610.
15. Eton V, Schroeter A, Kelly L, et al. Epidemiology of invasive pneumococcal and Haemophilus influenzae diseases in Northwestern Ontario, Canada, 2010–2015. International Journal of Infectious Diseases, 2017;65 : 27–33.
16. Fitzwater SP, Ramachandran P, Kahn GD, et al. Impact of the introduction of the Haemophilus influenzae type b conjugate vaccine in an urban setting in southern India. Vaccine, 2019;37(12):1608–1613.
17. Lebedová V, Šebestová H, Musílek M, et al. Závažná onemocnění způsobená Haemophilus influenzae v České republice v období 2009–2020. Zprávy Centra epidemiologie a mikrobiologie (SZÚ Praha), 2021;30(5):149–156.
18. Pinto M, González-Díaz A, Machado MP, et al. Insights into the population structure and pan-genome of Haemophilus influenzae. Infection, Genetics and Evolution, 2019;67 : 126–135.
19. Bender JM, Cox CM, Mottice S, et al. Invasive Haemophilus influenzae disease in Utah children: an 11-year population-based study in the era of conjugate vaccine. Clinical Infectious Diseases, 2010;50:e41–e46. Dostupné na www: <https://pubmed.ncbi.nlm.nih.gov/20178414/>.
20. Shuel M, Hoang L, Law DKS, et al. Invasive Haemophilus influenzae in British Columbia: non-Hib and non-typeable strains causing disease in children and adults. International Journal of Infectious Diseases, 2011;15:e167–e173. Dostupné na www: <https://pubmed.ncbi.nlm.nih.gov/21134777/>.
21. Wong SM, Akerley BJ. Environmental and genetic regulation of the phosphorylcholine epitope of Haemophilus influenzae lipooligosaccharide. Molecular Microbiology, 2005;55(3):724–738.
22. Satola SW, Schirmer PL, Farley MM. Complete sequence of the cap locus of Haemophilus influenzae serotype b and nonencapsulated b capsule-negative variants. Infection and Immunity, 2003;71(6):3639–3644.
23. Cerquetti M, Giufrè M. Why we need a vaccine for nontypeable Haemophilus influenzae. Human Vaccines and Immunotherapeutics, 2016;12(9):2357–2361.
24. LaCross NC, Marrs CF, Gilsdorf JR. Population structure in nontypeable Haemophilus influenzae. Infection, Genetics and Evolution, 2013;14 : 125–136.
25. Erwin AL, Sandstedt SA, Bonthuis PJ, et al. Analysis of genetic relatedness of Haemophilus influenzae isolates by multilocus sequence typing. Journal of Bacteriology, 2008;190(4):1473–1483.
26. De Chiara M, Hood D, Muzzi A, et al. Genome sequencing of disease and carriage isolates of nontypeable Haemophilus influenzae identifies discrete population structure. Proceedings of the National Academy of Sciences, 2014;111(14):5439–5444.
27. Brueggemann AB, Jansen van Rensburg MJ, Shaw D, et al. Changes in the incidence of invasive disease due to Streptococcus pneumoniae, Haemophilus influenzae, and Neisseria meningitidis during the COVID-19 pandemic in 26 countries and territories in the Invasive Respiratory Infection Surveillance Initiative: a prospective analysis of surveillance data. The Lancet Digital Health, 2021;3(6):E360–E370.
Štítky
Hygiena a epidemiologie Infekční lékařství Mikrobiologie
Článek vyšel v časopiseEpidemiologie, mikrobiologie, imunologie
Nejčtenější tento týden
2022 Číslo 2- Stillova choroba: vzácné a závažné systémové onemocnění
- Jak souvisí postcovidový syndrom s poškozením mozku?
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
-
Všechny články tohoto čísla
- Genetická rozmanitost humánních kmenů Listeria monocytogenes v České republice v letech 2016–2020
- První zhodnocení úplnosti dat a senzitivity systému surveillance u spalniček v České republice, 1. leden 2018 až 30. červen 2019
- Candida glabrata – základná charakteristika, virulencia, terapia a rezistencia
- Sledování změn invazivních onemocnění způsobených Haemophilus influenzae v České republice v letech 1999–2020
- Norovirové infekce v České republice v letech 2008–2020
- Colistin resistance and heteroresistance in Klebsiella pneumoniae & Escherichia coli clinical isolates from intensive care units
- Výskyt tuberkulózy u HIV pozitivních v České republice v letech 2000–2020
- Epidemiologie, mikrobiologie, imunologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Candida glabrata – základná charakteristika, virulencia, terapia a rezistencia
- Výskyt tuberkulózy u HIV pozitivních v České republice v letech 2000–2020
- Norovirové infekce v České republice v letech 2008–2020
- Sledování změn invazivních onemocnění způsobených Haemophilus influenzae v České republice v letech 1999–2020
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



