-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Přínos stanovení protilátek IgA pro laboratorní diagnostiku příušnic ve vysoce proočkované populaci
Contribution of the detection of IgA antibodies to the laboratory diagnosis of mumps in the population with a high vaccination coverage
Study objective:
Serological diagnosis of epidemic mumps can be difficult in vaccinated persons, particularly due to the absence of specific IgM antibodies. The aim was to find whether adding the detection of IgA antibodies to the currently used routine serological diagnosis of mumps (detection of IgM and IgG antibodies in an acute serum sample) would make the serological diagnosis of mumps more effective in a population with a high vaccination coverage. At the same time, ELISA kits for the detection of early IgA and IgM antibodies against the mumps virus were compared and statistical analysis of the results was performed.Material and methods:
Sixty-four acute sera from patients with laboratory confirmed diagnosis of mumps were included in the study. Clinical specimens were collected at the onset of clinical symptoms. To test the sera, the MASTAZYME ELISA Mumps IgA kit (MAST DIAGNOSTICA, Germany) with the MASTSORB sorbent (RF and IgG) and Enzygnost Anti-Parotitis-Virus/IgM kit (Siemens, Germany) were used. A panel of 121 acute sera with no epidemiological link to mumps virus served as specificity controls for the IgA assay. The epidemiological data were derived from the EPIDAT system. The level of agreement was assessed using the McNemara test and Cohen's coefficient kappa. The Stata 9.2 software (Stata Corp LP, College Station, USA) was used for statistical analysis.Results:
The detection of IgA and IgM antibodies against the mumps virus yielded concordant results in 50/64 acute sera, 32 positive and 18 negative, i.e. an agreement of 78.12 %. Of the remaining 14 samples, 13 were only IgA positive and one was only IgM positive. The controls showed non-specific IgA positivity in 5/121 samples which indicates a 96% specificity.Conclusion:
The absence of specific IgM antibodies against mumps virus is relatively often seen in vaccinated indivi-duals; nevertheless, the test is routinely used in patients with suspected active infection. The test for IgA antibodies, which is not routinely performed, significantly increased the detection rate of the disease. Based on the results of the present study, it can be concluded that the combination of the anti-mumps IgM and IgA assays increased the effectiveness of the serological diagnosis at the onset of clinical symptoms from less than 52% to nearly 72%.KEYWORDS:
mumps virus – laboratory diagnosis – detection of IgA and IgM antibodies – epidemiology
Autoři: R. Limberková 1
; D. Smíšková 2; M. Havlíčková 1; K. Herrmannová 2; P. Lexová 1; M. Malý 1
Působiště autorů: Státní zdravotní ústav, Centrum epidemiologie a mikrobiologie, Praha 1; Klinika infekčních, parazitárních a tropických nemocí, Nemocnice Na Bulovce, Praha 2
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 64, 2015, č. 1, s. 16-19
Kategorie: Souhrnná sdělení, původní práce, kazuistiky
Souhrn
Cíl práce:
Sérologický průkaz epidemické parotitidy může být u vakcinovaných osob mnohdy obtížný, zejména pro absenci specifických IgM protilátek. Cílem práce bylo zjistit, zda rozšíření současné rutinní sérologické diagnostiky příušnic (stanovení protilátek IgM a IgG v akutním vzorku séra) o průkaz protilátek IgA povede k zefektivnění sérologické diagnostiky příušnic u vysoce proočkované populace. Současně bylo provedeno porovnání ELISA metod na stanovení časných protilátek proti viru příušnic – ELISA IgA a IgM a statistické vyhodnocení tohoto porovnání.Materiál a metody:
Do studie bylo zahrnuto 64 akutních sér od pacientů, u nichž bylo laboratorně potvrzeno onemocnění příušnicemi. Klinické materiály byly odebrány v počátku klinické manifestace. Séra byla vyšetřena soupravou MASTAZYME ELISA Mumps IgA (MAST DIAGNOSTICA, Německo) s použitím absorbentu MASTSORB (RF a IgG) Absorbens a Enzygnost Anti-Parotitis-Virus/IgM (Siemens, Německo). Jako kontrolní skupina specificity testu na stanovení IgA protilátek byl vyšetřen soubor 121 akutních sér, která neměla etiologickou souvislost s virem příušnic. Jako zdroj epidemiologických údajů byl využit systém EPIDAT. Pro statistické hodnocení byl použit McNemarův test a Cohenův koeficient kappa. Pro analýzu byl použit statistický software Stata, verze 9.2 (Stata Corp LP, College Station, USA).Výsledky:
Stanovení IgA a IgM protilátek proti viru příušnic prokázalo shodu výsledků u 50/64 akutních sér, 32 pozitivních a 18 negativních, tj. 78,12 %. U zbývajících 14 vzorků byla ve 13 případech zjištěna pozitivita pouze IgA protilátek a v jednom případě pozitivita jen protilátek IgM. V kontrolní skupině byla prokázána nespecifická pozitivita IgA protilátek u 5/121 vzorků, což odpovídá 96% specificitě.Závěr:
Nepřítomnost IgM specifických protilátek proti parotitidě je u očkovaných osob relativně častá, přesto je při podezření na aktivní infekci standardně indikováno právě toto vyšetření. Stanovení protilátek IgA, které se běžně neprovádí, významně podpořilo záchytnost. Podle výsledků předkládané studie kombinace vyšetření IgM a IgA protilátek zvýšila efektivnost sérologického průkazu v prvních dnech klinické manifestace z necelých 52 % na téměř 72 %.
KLÍČOVÁ SLOVA virus parotitidy – laboratorní diagnostika – stanovení IgA a IgM protilátek – epidemiologieÚVOD
Příušnice jsou akutní virové onemocnění převážně dětského věku a představují celosvětově závažný zdravotní problém. Zahájením pravidelného očkování v roce 1987 se výskyt epidemické parotitidy v ČR významně snížil. Od roku 1997 se u nás příušnice vyskytovaly pouze sporadicky nebo v menších lokálních epidemiích. V posledních letech je však pozorován zvýšený počet onemocnění, a to i v očkované populaci. Nejvyšší počet případů byl zaznamenán v letech 2006 a 2012 (graf 1).
Graf 1. Incidence příušnic v ČR od roku 1994 Fig. 1. Incidence of mumps in the Czech Republic since 1994 
Virus příušnic se na vnímavého hostitele přenáší kapénkovou infekcí. Inkubační doba je obvykle 16–18 dní od expozice. Po pomnožení viru v nosohltanu a regionálních lymfatických uzlinách dochází k primární virémii, při níž se virus šíří do slinných žláz. Během sekundární virémie pomnožený virus atakuje další orgány (centrální nervový systém, pankreas, varlata, ovaria). Čtvrtina až třetina případů probíhá inaparentně, klinicky manifestní případy pak pod obrazem horečnatého onemocnění s jedno - nebo oboustranným bolestivým zduřením příušní slinné žlázy. Nejčastějšími komplikacemi jsou aseptická meningitida a orchitida, vzácnější je encefalitida, ooforitida a pankreatitida. Se stoupajícím věkem nemocných stoupá i riziko komplikovaného průběhu. Onemocnění v prvním trimestru gravidity může vést k intrauterinní infekci a úmrtí plodu; ke spontánnímu potratu pak dochází do 2 týdnů od začátku infekce [1].
Virus příušnic patří do čeledi Paramyxoviridae, podčeledi Paramyxovirinae, rodu Rubulavirus. Genom je složený ze 7 transkripčních jednotek (genů) kódujících strukturálně a funkčně odlišné proteiny. Dva povrchové glykoproteiny, hemaglutinin-neuraminidáza (HN) a fúzní protein (F), odpovídají nejen za virové pohlcování a splynutí virionu s hostitelskou buněčnou membránou, ale také za virovou rekonstrukci a uvolnění z hostitelské buňky. Oba proteiny jsou schopny stimulovat tvorbu neutralizačních protilátek, snižujících až eliminujících nakažlivost viru. Zbývajících pět strukturálních proteinů není imunogenně významných [2].
MATERIÁL A METODY
Sběr klinických vzorků probíhal v období od ledna 2013 do srpna 2014. Většina vzorků byla zaslána z Kliniky infekčních, parazitárních a tropických nemocí Nemocnice Na Bulovce, další z FN Brno, FN Motol a z ordinací praktických lékařů.
Pro účely této studie byl vybrán soubor 64 akutních vzorků sér od pacientů s laboratorně prokázaným onemocněním příušnicemi. Všechna séra byla odebrána do sedmého dne od počátku klinické manifestace onemocnění, téměř polovina z nich do čtvrtého dne, kdy sérologické vyšetření ještě často nedokáže IgM protilátky prokázat.
Infekce virem příušnic byla laboratorně prokázána u 64/64 případů, výčet metod a počty jimi prokázaných výsledků jsou uvedeny v tabulce 1.
Tab. 1. Výčet použitých metod a dosažených výsledků Table 1. List of the methods used and results obtained 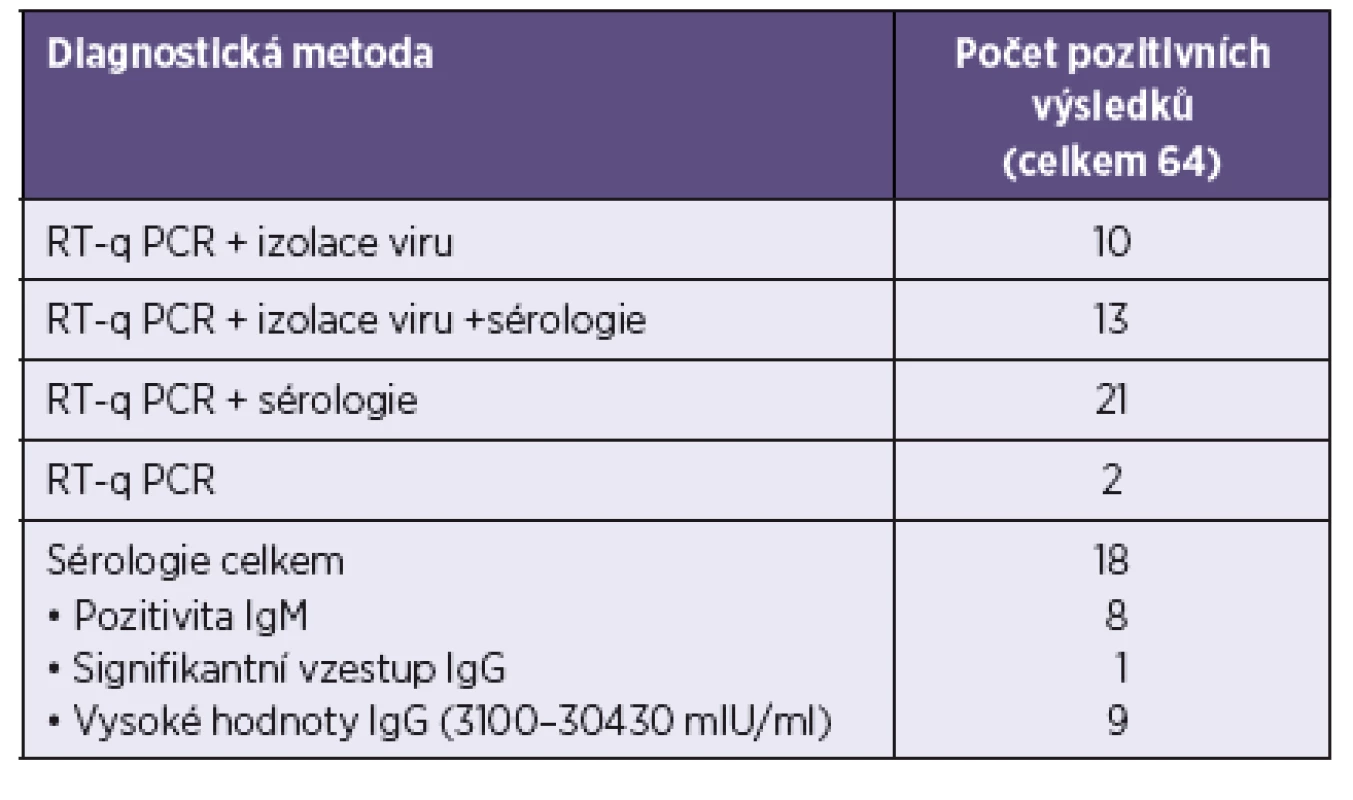
Pro vyšetření byly použity soupravy ELISA Enzygnost Anti--Parotitis-Virus/IgM (SIEMENS, Německo) a MASTAZYME MUMPS/ IgA (MAST DIAGNOSTICA, Německo). Při vyšetřování bylo postupováno podle pokynů výrobců diagnostik. Všechna séra před testováním na přítomnost protilátek IgA byla opracována pomocí absorbentu MASTSORB (MAST DIAGNOSTICA, Německo). Ačkoli je tento postup výrobcem pouze doporučen, jeví se jako nezbytný krok pro dosažení specifických výsledků, neboť přítomnost specifických IgG a revmatoidních faktorů třídy IgM v ELISA interferuje a vede k falešně pozitivním nálezům. Souprava pro stanovení IgM protilátek obsahuje RF absorbent jako nedílnou součást diagnostika, jeho použití je součástí pracovního postupu a výrobce deklaruje citlivost a specificitu testu 95%, respektive 99,8%.
Opakovaně hraniční výsledky stanovení IgM a IgA protilátek byly pro zjednodušení vyhodnocení této studie považovány za pozitivní. Sloučení pozitivních a hraničních výsledků do jedné skupiny umožnila skutečnost, že vyšetřovaný soubor byl tvořen vzorky akutních sér od laboratorně potvrzených případů, kde hraniční hodnota byla již projevem počínajícího vzestupu protilátek. To potvrdily i výsledky vyšetření několika párových vzorků sér, u nichž byly v prvním vzorku IgA i IgM protilátky negativní či hraniční a v druhém vzorku již byly hodnoty pozitivní.
Pro otestování specificity testu na stanovení IgA protilátek byla zvolena kontrolní skupina 121 sér, u kterých se předpokládaly negativní hodnoty IgA protilátek. S ohledem na možnou zkříženou reaktivitu byla do souboru zařazena rovněž séra od pacientů s laboratorně potvrzeným onemocněním vyvolaným virem spalniček (14/121), virem parainfluenzy (11/121), parvovirem B19 (8/121), virem chřipky typu A (11/121), virem chřipky typu B (5/121) a adenovirem (2/121). Kontrolní skupinu tedy tvořilo 28 sér od zdravých osob, 42 akutních sér od pacientů s respiračním onemocněním bez laboratorně prokázané etiologie a 51 vzorků od pacientů s výše zmíněnými laboratorně potvrzenými infekcemi.
Pro statistické hodnocení byl použit McNemarův test a Cohenův koeficient kappa. Testy byly provedeny na hladině významnosti 0,05. Pro analýzu byl použit statistický software Stata, verze 9.2 (Stata Corp LP, College Station, USA).
VÝSLEDKY
Metodou ELISA bylo na přítomnost specifických IgM a IgA protilátek proti příušnicím vyšetřeno 64 akutních sér od pacientů s laboratorně prokázaným onemocněním příušnicemi.
Vakcinováno bylo 25 z nich, polovina vakcinovaných patřila do věkové skupiny 10–19, následovala věková skupina 20–24letých. 48 pacientů bylo léčeno ambulantně, v 16 případech byla nutná hospitalizace. Komplikovaný průběh mělo 18 (28 %) pacientů (12krát orchitida, 5krát meningitida, 1krát bakteriální superinfekce).
Vyšetření souboru sér pacientů s parotitidou ukázalo pozitivitu časných IgA i IgM protilátek u 32/64pacientů, u 1/64 byla zjištěna pozitivita pouze protilátek IgM a u dalších 13/64 pozitivita jen IgA protilátek. Celkem byl zjištěn IgM pozitivní výsledek u 33/64 (51,6%) sér a protilátky IgA byly pozitivní u 45/64 (70,3%) sér. Celkově bylo IgM nebo IgA pozitivních 46/64 (71,9%) pacientů (tab. 2).
Tab. 2. Srovnání výsledků průkazů IgM a IgA protilátek Table 2. Comparison of the detection of IgM and IgA antibodies 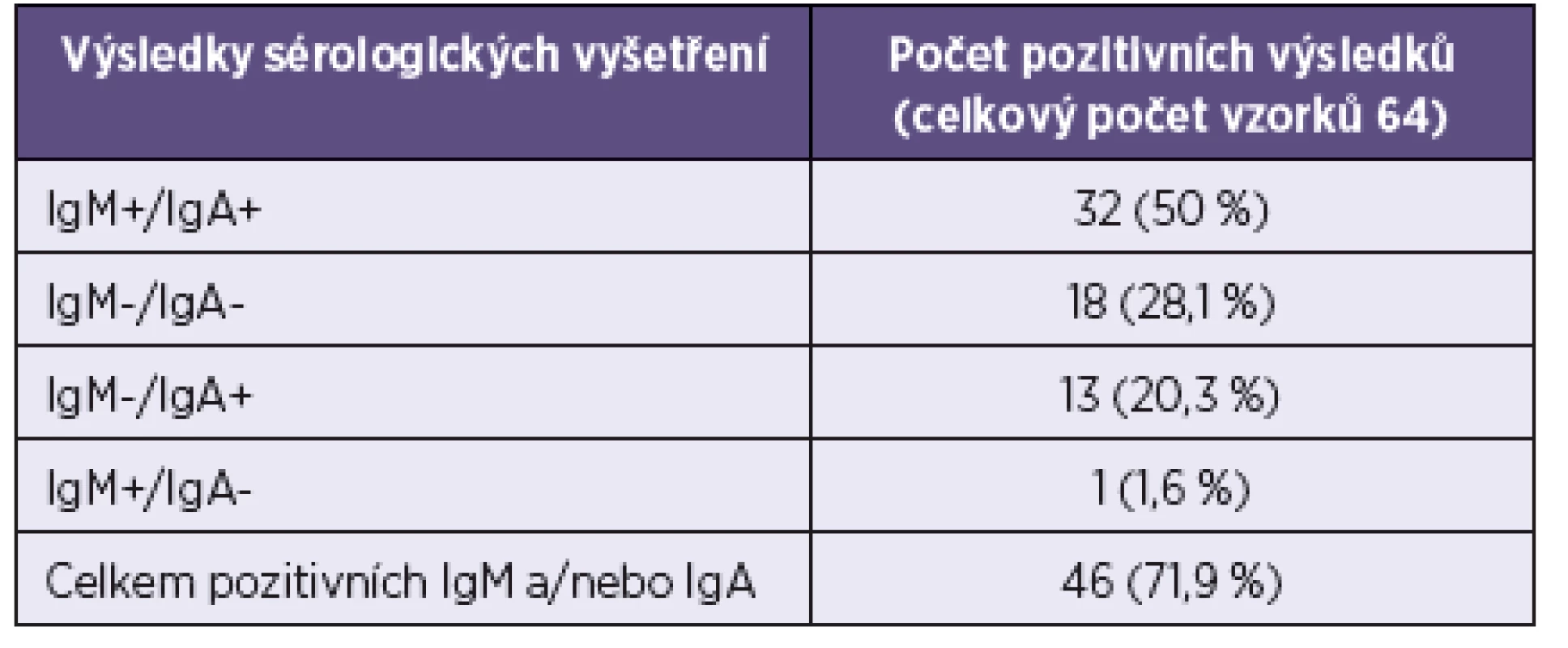
V kontrolní skupině (121 vzorků specifikovaných výše) bylo pět vzorků pozitivních (3 ze skupiny zdravých osob a 2 u laboratorně potvrzených spalniček). Na základě těchto výsledků byla vypočtena 96% specificita testu na stanovení IgA protilátek. Testováním první kontrolní skupiny 28 sér od zdravých osob bez použití RF absorbentu byla prokázána pozitivita IgA protilátek u 8/28 sér, použitím absorbentu se počet nespecificky pozitivních IgA snížil na 3/28. Na základě této zkušenosti byla již všechna ostatní séra testována až po použití RF absorbentu.
Porovnává-li se míra shody mezi testem na stanovení protilátek IgA a testem na stanovení protilátek IgM, pak hodnota Cohenova koeficientu kappa jako míry shody mezi hodnoceními prostřednictvím IgA a IgM je zde 0,557. Obecně je kappa číslo mezi 0–1 a platí pro něj, že čím je větší, tím větší je shoda. Tady se potvrzuje to, že obě metody se do určité míry shodují, nejsou zcela protichůdné, nicméně jedna (IgA) dává mnohem více pozitivních výsledků než druhá. Hodnocením obou metod podle McNemarova testu byla prokázána jejich statisticky významná odlišnost. Výsledky shrnuje tabulka 3.
Tab. 3. Srovnání metody na stanovení IgM a IgA protilátek pomocí McNemarova testu Table 3. Comparison of the methods for the detection of IgM and IgA antibodies by McNemara’s test 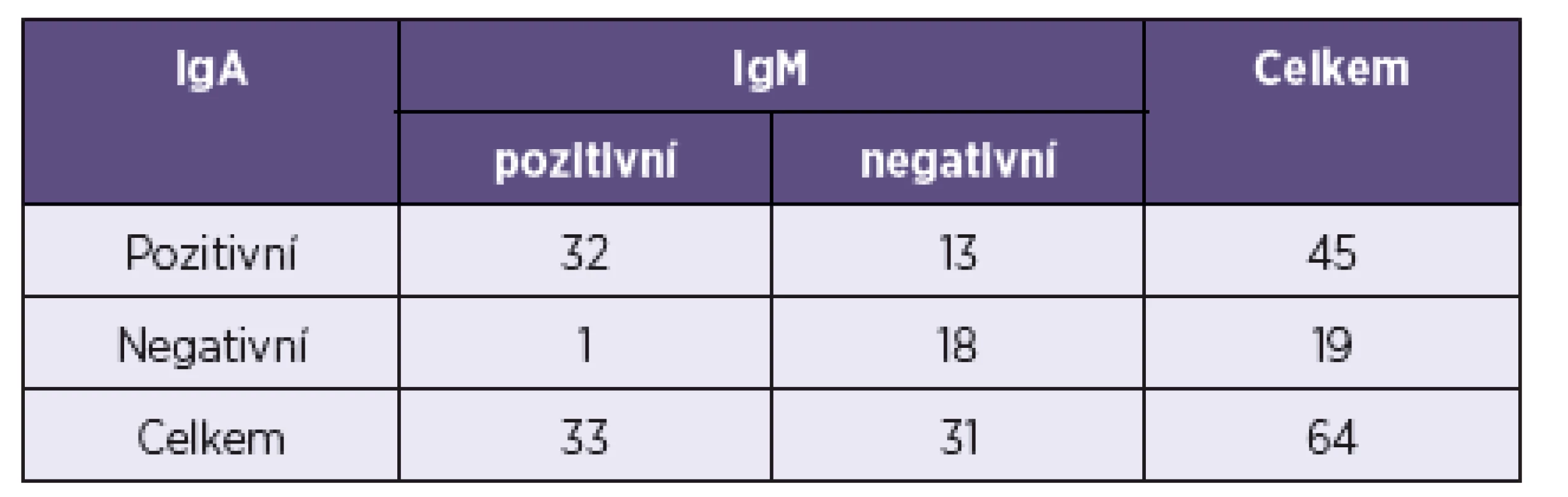
Hodnocení pomocí McNemarova testu dává p-hodnotu p = 0,0018, která je menší než hladina významnosti 0,05, a proto prokazuje signifikantní rozdíly mezi pravděpodobnostmi situací IgA poz/IgM neg a IgA neg/IgM poz.
When applied, the McNemar test yielded a p-value of p = 0.0018 which is lower than the significance level of 0.05, thus showing a significant difference between the probabilities of the outcomes IgA pos/IgM neg and IgA neg/IgM pos occuring. It means that the diagnostic methods tested statistically significantly differ from each other.DISKUSE
V posledních letech je v České republice pozorován nárůst onemocnění příušnicemi u neočkovaných i očkovaných osob. Hlavní příčinou současného zvýšeného výskytu příušnic je nízká kolektivní imunita, která není dostatečná pro přerušení epidemického šíření viru v populaci. Na nižší kolektivní imunitu proti příušnicím ve srovnání s imunitou proti spalničkám a zarděnkám bylo poukázáno již v roce 2001 po provedení posledních imunologických přehledů. Byl zjištěn nesoulad mezi proočkovaností, která se pohybovala mezi 97–100 %, a zjištěnými hodnotami prevalujících protilátek, které se pohybovaly mezi 70–86 %. Pro účely sérologických přehledů se séra vyšetřují metodou ELISA, která neměří jen protilátky neutralizační (proti HN, F), ale protilátky všechny, a proto vykazuje vyšší titry, než jsou neutralizační. Problémem tady zůstává interpretovatelnost ELISA naměřených hodnot v kontextu se získanou imunitou vůči příušnicím, protože na rozdíl od spalniček nebo zarděnek pro příušnice neexistuje mezinárodní standard, který by stanovoval protektivní titr protilátek. Podle prací některých autorů je protektivní hladina protilátek po očkování definována jako titr 1 : 2 v neutralizačním testu provedeným s laboratorním nebo divokým kmenem [4], podle jiných jsou osoby, které mají v jakémkoli sérologickém testu specifické protilátky považovány za imunní [5]. Rov-něž je nutné vzít v úvahu, že imunita je časově limitovaná – ochrana se předpokládá po dobu 10–15 let a že omezená cirkulace divokého viru příušnic snížila možnost booster efektu. Takto může vznikat diskrepance mezi deklarovaným desetiletým přetrváváním protilátek a současným stavem ve výskytu příušnic.
Laboratorními kritérii pro konfirmaci klinického případu příušnic jsou podle doporučení Centra pro kontrolu nemocí (CDC) v Atlantě z roku 2008 izolace viru příušnic z klinického materiálu nebo průkaz virové RNA, dále detekce specifických IgM protilátek či specifická protilátková odpověď – sérokonverze nebo signifikantní vzestup protilátek [6]. Podle české legislativy patří mezi laboratorní kritéria také ještě detekce nevakcinálního kmene pomocí monoklonálních protilátek [7]. Tato kritéria ovšem platí pouze pro primoinfikované osoby. Dosavadní strategie laboratorního vyšetřování příušnic v České republice je založena na stanovení IgM a IgG protilátek metodou ELISA v akutním vzorku séra. Tyto metody často neumožňují vyslovit jednoznačný laboratorní závěr. Do třetího dne od klinické manifestace se IgM protilátky nemusí vytvořit ani u primoinfikovaných pacientů. U vakcinovaných osob, které přesto onemocněly, se IgM protilátky často nevytvoří vůbec [8]. Situaci v sérologické diagnostice vakcinovaných osob navíc komplikuje fakt, že u nich velmi brzy po expozici dochází k rychlému vzestupu preexistujících IgG protilátek; vyšetřením párového vzorku séra proto nezískáme vždy obraz očekávaného signifikantního vzestupu titru protilátek či sérokonverze [8]. Jako vhodnější pro laboratorní diagnostiku příušnic zejména v prvních třech dnech onemocnění se jeví doplnit stávající sérologii o metody přímého průkazu virové RNA či izolace viru na tkáňových kulturách z bukálních stěrů a slin. Přínosem tohoto postupu je nejen rychlý a jednoznačný diagnostický závěr, ale také možnost získání vhodného materiálu pro studium antigenní diverzity cirkulujících kmenů. Výtěžnost testu PCR je při správném načasování a správné technice odběru vzorku až 70% [9]. S ohledem na to, že současná laboratorní diagnostika se stále spíše opírá o vyšetření akutního séra než o přímý průkaz infekčního agens, bylo naším cílem rutinní sérologickou diagnostiku zefektivnit. Jako vhodné řešení se jeví doplnění klasického sérologického vyšetřovacího schématu (ELISA IgM a IgG) o vyšetření slizničních protilátek IgA s použitím RF absorbentu. Protilátky IgA mohou být detekovány v počátku klinické manifestace onemocnění, neboť jsou produkovány B-lymfocyty, které se vyskytují ve slizničních vrstvách. V séru je jejich koncentrace 1,5 g/l, ovšem celkově v těle jsou to nejzastoupenější protilátky. Jejich biologický poločas je asi 1 týden [10].
ZÁVĚR
Na zvýšeném výskytu příušnic se pravděpodobně podílí několik faktorů. V první řadě je to postupné slábnutí ochranného účinku vakcinace, které je navíc ovlivněno méně častým kontaktem s přirozeně cirkulujícím virem v období mezi epidemiemi, což snižuje žádoucí booster efekt. Podle posledních sérologických přehledů z roku 2001 mělo protilátky proti příušnicím pouze 72–86 % dětí ve věku 2–15 let a 76–93 % osob od 16 do 39 let [3], přitom pro zajištění dostatečné kolektivní imunity je stanovena séropozitivita alespoň 95 %. Rovněž nelze vyloučit primární selhávání vakcinace v důsledku genotypové neshody mezi vakcinačním a cirkulujícím virem, i když zatím neexistují jednoznačné důkazy o tom, že by tato neshoda k selhávání vakcinace vedla či že by byla epidemiologicky významná [11, 12, 13, 14].
Specifika laboratorní diagnostiky vakcinovaných osob vedou k nutnosti zefektivnění rutinní sérologické diagnostiky. Jako vhodný kandidát se jeví vyšetřování IgA protilátek metodou ELISA. Ve sledovaném souboru 64 akutních sér od laboratorně potvrzených případů příušnic se díky vyšetření protilátek IgA zvýšil počet sérologicky prokázaných případů z 33/64 (51,56%), které byly prokázány pozitivním nálezem IgM protilátek, na 46/64 (71,9 %), což představuje navýšení o téměř 20 %. Přínos vyšetření IgA protilátek je významný obzvláště proto, že sérologie je nejčastěji prováděným vyšetřením, přestože během prvních tří dnů klinické manifestace je pravděpodobnost detekce IgM protilátek jen poměrně nízká. Kombinace těchto dvou metod může významně zefektivnit výpovědní hodnotu sérologického vyšetření v počátku klinické manifestace onemocnění.
Poděkování
Podpořeno grantem IGA MZČR NT 14059-3/2013.
Do redakce došlo dne 8. 12. 2014.
Adresa pro korespondenci:
MUDr. Radomíra Limberková
Státní zdravotní ústav
Šrobárova 48
100 42 Praha 10
e-mail: limberkova@szu.cz
Zdroje
1. Liebert UG. Viruses and pregnancy. Intervirology, 1998;41 : 145–148.
2. Petráš M, Lesná IK. Manuál očkování 2010. 3. vyd., Praha 2010;202–217 s. ISBN:978-80-254-5419-0.
3. Mrázová M, Smelhausová M, Sestáková Z, Svandová E, Benes C. The 2001 serological survey in the Czech Republic-mumps. Cent Eur J Public Health, 2003;11 Suppl.:S50–53.
4. Mauldin J, Carbone K, Hsu H, Yolken R, Rubin S. Mumps Virus--Specific Antibody Titers from Pre-vaccine era Sera: Comparison of the plaque Reduction Neutralization Assay and Enzyme Immunoassays. J Clin Microbio, 2005, p. 4847–4851, doi:10.1128/JCM.43.9.4847-4851.2005
5. MMWR May 22, 1998/47 (RR-8);s.1–57.
6. Decision No 2008/426/EC amending Decision No 2002/253/EC laying down case definitions for reporting communicable diseases to Community network under Decision No 2119/98/EC of European Parliament and of the Council.
7. Vyhláška č. 473/2008 Sb., o systému epidemiologické bdělosti pro vybrané infekce, ve znění pozdějších předpisů.
8. Laboratory testing for mumps infection. Dostupný na www: http://www.cdc.gov/mumps/lab/index.html.
9. Rota JS, Rosen JB, Doll MK et al. Comparison of the Sensitivity of Laboratory Diagnostic Methods from a Well-Characterized Outbreak of Mumps in New York City in 2009. Clin Vaccine Immunol, 2013;20(3):391–396.
10. Hořejší V, Bartůňková J. Základy imunologie. 3. vydání, Praha: Triton, 2008. 280 s. ISBN 80-7254-686-4.
11. Mühlemann K. The molecular epidemiology of mumps virus. Infect Genet Evol, 2004;4 : 215–219.
12. Briss PA, Fehrs LJ, Parker RA et al. Sustained transmission of mumps in a highly vaccinated population: assesment of primary vaccine failure and waning vaccine-induced imunity. J Infect Dis, 1994;169 : 77–82.
13. Kaaijk P, Zeijst BA, Boog MC, Hoitink CW. Increased mumps incidence in the Netherlands: Review on the possible role of vaccine strain and genotype. Euro Surveill, 2008;13(26):pii=18914. Dostupný na www: http://www.eurosurveillance.org/ViewArticle.aspx?ArticleId=18914.
14. Rubin SA, Qi L, Audet SA, Sullivan B et al. Antibody induced by immunization with the Jeryl Lynn mumps vaccine strain effectively neutralizes a heterologous wild-type mumps virus associated with a large outbreak. J Infect Dis, 2008;198(4):508–515. doi: 10.1086/590115
Štítky
Hygiena a epidemiologie Infekční lékařství Mikrobiologie
Článek Úvodník
Článek vyšel v časopiseEpidemiologie, mikrobiologie, imunologie
Nejčtenější tento týden
2015 Číslo 1- Stillova choroba: vzácné a závažné systémové onemocnění
- Diagnostika virových hepatitid v kostce – zorientujte se (nejen) v sérologii
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Jak souvisí postcovidový syndrom s poškozením mozku?
-
Všechny články tohoto čísla
- Minimální inhibiční koncentrace erytromycinu a dalších antibiotik u českých kmenů Bordetella pertussis
- Přínos stanovení protilátek IgA pro laboratorní diagnostiku příušnic ve vysoce proočkované populaci
- Případ tuberkulózní meningitidy provázené perzistujícím snížením CD4+ T lymfocytů
- Vliv klimatických změn na výskyt onemocnění klíšťovou encefalitidou v letech 1982–2011 v České republice
- Úvodník
- Multifaktorová epidemiologická analýza rizikových faktorů karcinomu pankreatu u žen
- Rezistence původce syfilis, Treponema pallidum subsp. pallidum, k makrolidovým antibiotikům v České republice a ve světě
- Přístup populace ke screeningu kolorektálního karcinomu v České republice
- Prevalence vybraných vrozených vad v České republice – vývojové vady centrálního nervového systému a zažívacího traktu
- Prof. MUDr. Jan Šejda, DrSc. – malé připomenutí životního jubilea
- XXIV. Tomáškovy dny mladých mikrobiologů
-
Procházka Bohumír
STRUČNÁ BIOSTATISTIKA PRO LÉKA
- Epidemiologie, mikrobiologie, imunologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Rezistence původce syfilis, Treponema pallidum subsp. pallidum, k makrolidovým antibiotikům v České republice a ve světě
- Přínos stanovení protilátek IgA pro laboratorní diagnostiku příušnic ve vysoce proočkované populaci
- Minimální inhibiční koncentrace erytromycinu a dalších antibiotik u českých kmenů Bordetella pertussis
- Případ tuberkulózní meningitidy provázené perzistujícím snížením CD4+ T lymfocytů
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



