-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Anémie u dětí s nespecifickými střevními záněty
Anemia in children with inflammatory bowel diseases
Anemia is the most common extraintestinal complication of inflammatory bowel disease. Iron deficiency anemia and anemia of chronic disease are the most frequent types. Iron deficiency and chronic inflammation are often combined in patients with inflammatory bowel diseases: total iron body stores are sufficient, but are not available for erytropoiesis (so called “functional” iron deficiency). Hepcidin (interaction of hepcidin-ferroportin) is a key regulator of iron metabolism and also marker of systemic inflammation. Hepcidin binds to ferroportin and blocks its function.
The diagnosis and treatment of anemia are guided by available recommendations and the current serum level of hepcidin, in addition to other markers, may contribute to the decision of adequate form of iron supplementation (parenteral versus oral).
Keywords:
anemia – inflammatory bowel disease – hepcidin – ferroportin
Autoři: E. Karásková 1; D. Pospíšilová 1; M. Horváthová 2; M. Velgáňová-Véghová 1; M. Špenerová 1; M. Geryk 1; J. Volejníková 1
Působiště autorů: Dětská klinika, FN a LF Univerzity Palackého, Olomouc 1; Ústav biologie FN a LF Univerzity Palackého, Olomouc 2
Vyšlo v časopise: Čes-slov Pediat 2020; 75 (5): 278-283.
Kategorie: Přehledový článek
Souhrn
Anémie, zejména sideropenická anémie a anémie chronických chorob, jsou nejčastější extraintestinální systémovou komplikací nespecifických střevních zánětů. U těchto pacientů se často kombinuje relativní deficit železa a chronická zánětlivá aktivita, kdy i přes dostatečné celkové zásoby železa v organismu není železo dostupné pro erytropoézu (tzv. „funkční“ deficit železa). Klíčovým regulátorem metabolismu železa je hepcidin a jeho interakce s transmembránovým přenašečem železa feroportinem.
Diagnostika a léčba anémie se řídí platnými doporučeními. A aktuální sérová hladina hepcidinu může, vedle ostatních markerů, přispět k rozhodnutí o správné strategii léčby železem (parenterální versus perorální forma).
Klíčová slova:
anémie – nespecifický střevní zánět – hepcidin – feroportin
ÚVOD
Crohnova choroba (CD) a ulcerózní kolitida (UC) jsou chronická zánětlivá střevní onemocnění (inflammatory bowel diseases, IBD) postihující trávicí trakt. Výskyt IBD celosvětově stoupá jak u dospělých, tak i u dětí. Podle studií provedených v ČR došlo k nárůstu incidence IBD v dětském věku od roku 1990 (nulová incidence) do roku 2001 až na 2,69/100 000/rok u CD a 1,84/100 000//rok u UC [1], dále pak do roku 2015 na 6,2 u CD resp. 2,8/100 000/rok u UC [2].
Onemocnění vznikne přibližně u 25 % pacientů již během dětství [3] a je pak často provázeno závažnějším průběhem, extenzivnějším postižením střeva a častějšími komplikacemi. Anémie představuje nejčastější extraintestinální systémovou komplikaci IBD. Postihuje 6‒74 % dospělých hospitalizovaných pacientů a 19‒21 % pacientů sledovaných v ambulancích [4]. U dětí s IBD je výskyt anémie také velmi častý a odhaduje se v rozmezí 41‒75 % [5]. Přítomnost anémie zhoršuje kvalitu života, fyzické, emoční a kognitivní funkce IBD pacientů, a to zejména z důvodů akcentovaného únavového syndromu [4, 6].
Etiologie anémie je u IBD multifaktoriální. Nejčastěji se kombinuje anémie z nedostatku železa (iron deficiency anemia, IDA) a anémie chronických chorob (anemia of chronic disease, ACD). Mezi další, méně časté typy patří anémie z deficitu vitaminu B12, nejčastěji po resekci terminálního ilea. Anémie z nedostatku kyseliny listové může nastat u malnutričních dětí nebo jako nežádoucí účinek léčby metotrexátem nebo sulfasalazinem. Dalšími léky, které mohou přispívat ke vzniku anémie, jsou azathioprin a 6-merkaptopurin. Jejich podání může u disponovaných pacientů, kteří mají sníženou aktivitu enzymu thiopurin-methyl-transferázy, vést k leukopenii, trombocytopenii, anémii a v extrémním případě až k aplazii kostní dřeně [4]. Všechny typy anémie u IBD bez deficitu železa jsou někdy řazeny do skupiny tzv. non-iron deficiency anemia (NIDA) [7].
Příčinou vzniku IDA jsou krevní ztráty do trávicího traktu, snížený příjem železa ve výživě a snížená absorpce železa po resekčních výkonech na tenkém střevu. Na vzniku ACD se podílí především zánětlivými cytokiny indukovaná produkce hepcidinu v játrech s následnou poruchou vstřebávání železa z enterocytů a sníženým uvolňováním železa z retikuloendotelového systému. Bývá také snížená sekrece erytropoetinu, zvýšená rezistence receptorů erytroidních buněk k erytropoetinu, snížená proliferace a maturace erytroidních prekurzorů a snížené přežívání erytrocytů při akcentované erytrofagocytóze [4].
Hepcidin je malý peptidický hormon regulující metabolismus železa. Je syntetizován v játrech a odtud také pochází počátek jeho jména „hep-”. Koncovku pak tvoří „-cidin”, protože původně byl objeven jako peptid s baktericidní aktivitou [8]. Dříve byl proto také nazýván zkratkou HAMP (hepcidin antimicrobial peptide) [9]. Jeho syntézu kóduje HAMP1 gen lokalizovaný na 19. chromosomu. Hepcidin je centrálním regulátorem metabolismu železa (interakce hepcidinu s feroportinem) a současně se uplatňuje jako marker systémového zánětu [10].
Syntézu a produkci hepcidinu ovlivňují tři základní faktory: stav celotělových zásob železa, aktivita erytropoézy a systémová zánětlivá aktivita. Tvorba hepcidinu je suprimována při nadbytku železa a stimulované erytropoéze. Naopak se syntéza hepcidinu zvyšuje při systémové zánětlivé aktivitě nebo při nadbytku železa. Hepcidin přímo působí na transmembránový přenašeč železa feroportin. Mezi buňky s vysokou expresí feroportinu patří bazolaterální membrána epiteliálních buněk střevní sliznice (především duodena), makrofágy retikuloendoteliálního systému a sinusoidální povrch hepatocytů. Při systémové zánětlivé reakci dochází k indukci syntézy hepcidinu zejména prostřednictvím interleukinu-6. Hepcidin se váže na feroportin, dochází k inaktivaci feroportinu, následné endocytóze a degradaci komplexu hepcidin-feroportin [11]. Tento proces vede k inhibici transportu železa přes bazolaterální membránu enterocytů do krevního oběhu a inhibici uvolňování železa z hepatocytů a makrofágů. V tomto případě mohou být celotělové zásoby železa normální, a přesto železo není dostupné pro siderodependentní metabolické reakce. Tento stav se nazývá „funkční deficit železa” nebo také „iron restricted erytropoiesis” [12]. Naproti tomu, syntézu hepcidinu suprimují stavy vyžadující zvýšený přísun železa, při IDA, hypoxii nebo zvýšené erytropoéze [13]. V tomto případě není feroportin blokován a železo se z enterocytů aktivně resorbuje do krevního oběhu a uvolňuje z hepatocytů a makrofágů pro potřeby erytropoézy (obr. 1).
Obr. 1. Zjednodušené schéma syntézy hepcidinu a jeho působení na feroportin během zánětu a při deficitu železa. 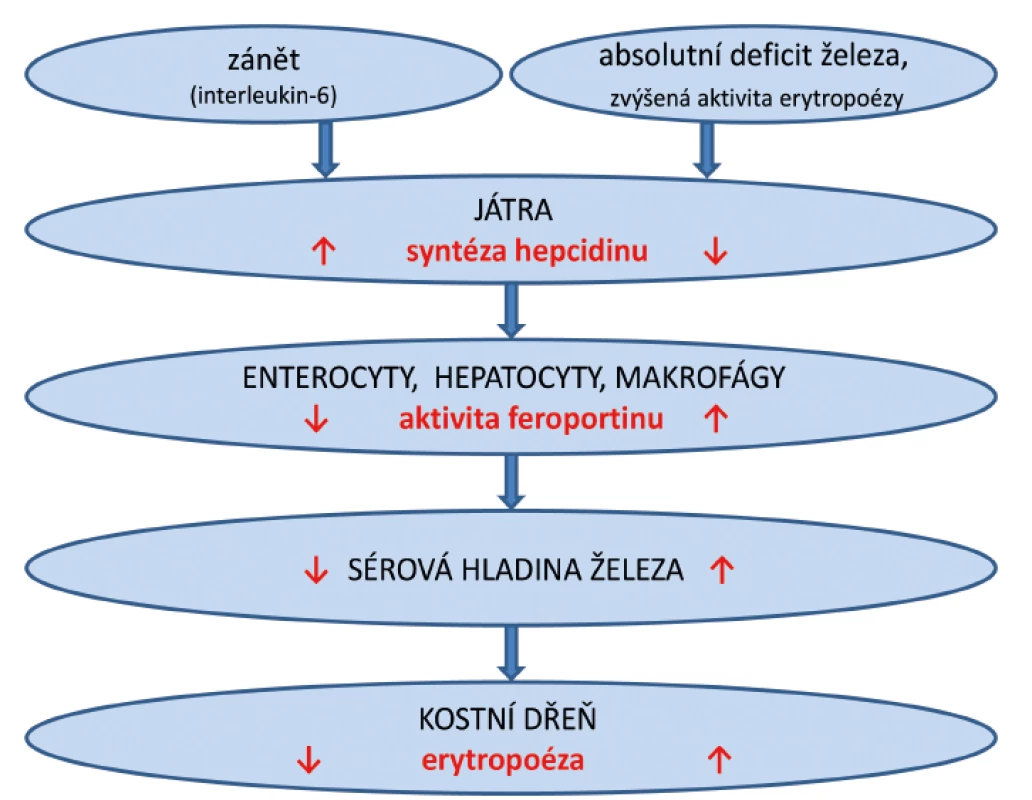
DIAGNOSTIKA ANÉMIE
Přestože je anémie u IBD častá, zůstává někdy nediagnostikovaná a neléčená. Nedávná studie v USA zjistila, že asi třetina anemických pacientů s UC nebyla vůbec na parametry metabolismu železa testována [14].
Anémii definuje snížená hladina hemoglobinu. Tento parametr se mění v průběhu života a ovlivňují ho různé faktory (např. věk, etnikum, gravidita, nadmořská výška apod.). Normální hladiny hemoglobinu u dětí a dospělých podle WHO kriterií jsou uvedeny v tabulce 1 a platí i pro IBD pacienty [7].
Tab. 1. Cut-off hladiny hemoglobinu a hematokritu používané k definování anémie. Převzato a upraveno podle [7]. ![Cut-off hladiny hemoglobinu a hematokritu používané k definování anémie. Převzato a upraveno podle [7].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/130d4446cd7ff4150c11edc7b9bac9f1.png)
Podle doporučení Evropské společnosti pro Crohnovu chorobu a ulcerózní kolitidu (ECCO) mají být na přítomnost anémie pravidelně testováni všichni nemocní s IBD. ECCO doporučuje ke screeningu anémie vyšetřovat kompletní krevní obraz, sérový feritin a C-reaktivní protein. U pacientů v remisi má být screening prováděn jednou za 6‒12 měsíců, u pacientů s aktivním onemocněním nejméně jednou za 3 měsíce. Pokud je anémie diagnostikována, pak je třeba doplnit další parametry: šíře distribuce erytrocytů (RDW, red cell distribution width), střední objem erytrocytů (MCV, mean cell volume), počet retikolocytů, procento hypochromních erytrocytů (%HYPO) a koncentrace hemoglobinu v retikulocytech (RetHb, reticulocyte hemoglobin concentration). K rozšířenému panelu vyšetření dále patří diferenciální rozpočet leukocytů, solubilní transferinové receptory (sTfR), případně index sTfR/log feritin, saturace transferinu (TSAT), hladina vitaminu B12, folátu, haptoglobinu, laktátdehydrogenázy, urey a kreatininu. U pacientů po resekci terminálního ilea je třeba hladinu vitaminu B12 (ev. homocysteinu a methylmalonátu v moči) monitorovat minimálně jednou ročně [4, 7].
Diferenciální diagnostika anémií u IBD zahrnuje nejčastěji tři varianty: IDA (bez přítomnosti známek zánětu), ACD a kombinaci IDA+ACD. Z pohledu metabolismu železa se u IDA jedná o absolutní deficit železa, při ACD o funkční deficit železa a při IDA+ACD se oba mechanismy v různé míře kombinují (tab. 2).
Tab. 2. Diagnostika deficitu železa. Převzato a upraveno podle [12]. ![Diagnostika deficitu železa. Převzato a upraveno podle [12].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/3dcffd6839d5706b175f0b4fde404fc9.png)
TSAT – saturace transferinu, RetHb – koncentrace hemoglobinu v retikulocytech, %HYPO – procento hypochromních erytrocytů, sTfR – solubilní transferinové receptory, CRP – C-reaktivní protein PARAMETRY METABOLISMU ŽELEZA
Procento hypochromních erytrocytů (%HYPO) je považováno za časný indikátor deficitu železa. Pro deficit železa svědčí hodnota nad 6 % [12].
Koncetrace hemoglobinu v retikulocytech (RetHb) poukazuje na aktuální (3‒4 dny) dostupnost železa k syntéze hemoglobinu. Nízká hodnota (<28 pg) svědčí pro deficit železa při erytropoéze [12].
Sérová hladina železa bývá snížena u IDA i ACD. Její vyšetření, bez doplnění dalších parametrů, je ale pro hodnocení deficitu železa zavádějící. Hladina diurnálně kolísá, a proto by měl být odběr proveden ráno, na lačno, aby se minimalizovala variabilita tohoto markeru [15].
Saturace transferinu (TSAT) se vypočítává jako poměr sérového železa a celkové vazebné kapacity pro železo [15]. Pro deficit železa svědčí TSAT <20 % [12].
Sérový feritin za fyziologických okolností odráží tělesné zásoby železa. Při zánětu se ale chová jako reaktant akutní fáze zánětu, takže v tomto případě jeho zvýšená hladina deficit železa nevylučuje [12]. Pokud byly sérové hladiny feritinu měřeny několik dnů po sobě, tak se individuálně lišily až o 15 % u mužů, o 27 % u žen a v dlouhodobém sledování dokonce o 62 % [16, 17]. Cut-off hodnota feritinu svědčící pro deficit železa je u pacientů bez zánětlivé aktivity méně než 30 μg/l (92% senzitivita, 98% specificita). Při zánětu ukazuje na deficit železa hladina feritinu pod 100 μg/l. Pokud se koncetrace feritinu pohybuje mezi 100‒300 μg/l, pak je vhodné kombinovat toto vyšetření s měřením TSAT. Pro deficit železa pak svědčí TSAT <20 %. Pokud ani tako kombinace neurčí přesně deficit železa, je třeba doplnit ostatní parametry (tab. 2) [12].
Solubilní transferinové receptory (sTfR) jsou jednoduché polypeptidy (85 kDa), které se uvolňují do séra z transmebránových transferinových receptorů (190 kDa) exprimovaných na povrchu erytroidních buněk. Plazmatická koncentrace sTfR odráží denzitu receptorů na povrchu buněk, tedy přímo ukazuje aktivitu erytropoézy a inverzně dostupnost železa pro erytropoézu [18, 19]. Na rozdíl od feritinu a transferinu není jejich hodnota ovlivněna zánětem [4]. Nárůst sTfR registrujeme při deficitu železa nebo zmnožení erytroidních elementů v kostní dřeni, které může být důsledkem hemolýzy nebo neefektivní erytropoézy. Jeho stanovení může pomoci v diferenciální diagnostice IDA a ACD.
Index sTfR/log feritin je vhodným vyšetřením, které má výhodu recipročního vztahu mezi dvěma proměnnými, což zvýrazňuje rozdíl mezi nimi a zlepšuje tak diferenciální diagnostiku mezi IDA, ACD a IDA + ACD. Hodnota indexu nad 1,4 ukazuje na deficit železa [4].
Sérová hladina hepcidinu může přispět k diferenciální diagnostice anémií (ACD vs. IDA). Normální hladiny se liší podle věku a pohlaví. Hladina hepcidinu má cirkadiární rytmus, takže je vhodné měření ráno na lačno. Výsledná hodnota má být hodnocena v kontextu s klinickým stavem pacienta a laboratorními parametry (funkce ledvin a jater, zánětlivá aktivita: C-reaktivní protein) [20]. Hladiny hepcidinu je možné měřit jednak metodou ELISA nebo přesnější metodou hmotnostní spektrometrie [21]. Referenční hodnoty byly stanoveny u dospělých [22, 23] a také u dětí [24‒26]. Nicméně publikované normy hladin hepcidinu se u jednotlivých metod liší, a proto bude nutná jejich standardizace a unifikace. Všeobecně však platí, že čím větší je deficit železa, tím více klesá hladina hepcidinu. Naopak při zánětu jeho koncentrace stoupá. Stanovení hladin hepcidinu prozatím nepatří mezi rutinně prováděné vyšetření.
LÉČBA ANÉMIE
Léčba anémie u IBD spočívá jednak v substituci železa a současně v potlačení systémové zánětlivé aktivity vlastního onemocnění (kortikoidy, imunomodulancia, biologická léčba). Správná volba léčebného postupu je zásadní pro dosažení efektu při současné eliminaci nežádoucích účinků léčby.
Mezi cíle léčby anémie patří odstranění klinických symptomů, zlepšení kvality života, normalizace hemoglobinu a doplnění zásob železa. Vzestup hladiny hemoglobinu alespoň o 20 g/l za čtyři týdny považuje ECCO za akceptovatelnou odpověď na léčbu [7]. Opakovaně bylo v literatuře diskutováno, zda je u pacientů s IBD bezpečná perorální forma železa. Na animálních modelech vedlo perorální podávání k toxickému efektu železa na sliznici tlustého střeva a vzestupu produkce zánětlivých cytokinů (interleukin-1α, interleukin-6, interferon-γ, TNF-α) [20, 27, 28]. Po léčbě perorálním železem byly popsány i změny střevního mikrobiomu. Došlo k signifikantnímu zvýšení množství enterobakterií a snížení počtu lactobacilů. Zvýšené hladiny fekálního kalprotektinu svědčí o aktivaci zánětu v trávicím traktu [29]. Jiná studie u IBD pacientů zjistila po léčbě perorálním (ve srovnání s parenterálním) železem snížení diverzity střevní mikroflóry (snížení množství Faecalibacterium prausnitzii, Ruminococcus bromii, Dorea species a Collinsella aerofaciens) [30]. Efekt perorální a intravenózní aplikace železa na úpravu anémie byl porovnáván v randomizované prospektivní multicentrické studii u 46 IBD pacientů. V obou skupinách došlo ke srovnatelnému vzestupu hemoglobinu, ale pouze ve skupině s parenterální aplikací byl dokumentován i vzestup feritinu. Ve skupině s perorálně podávaným železem muselo pět pacientů (20,8 %) přerušit léčbu pro gastrointestinální potíže, zatímco ve skupině s intravenózní aplikací byl zaznamenán nežádoucí účinek pouze u jednoho pacienta (4,5 %) [31]. V metaanalýze, která zahrnula 333 pacientů s IBD, byly po intravenózní (versus perorální) léčbě železem zjištěny vyšší hladiny hemoglobinu a feritinu [32]. Také v další práci zahrnující 694 IBD pacientů se hladiny hemoglobinu více zvýšily ve skupině, kde bylo železo podáváno parenterálně [33]. U dětí s IBD byl potvrzen dobrý bezpečnostní profil intravenózně podávaného železa (Fe-karboxymaltózy) a efektivita léčby ve studii Laasse et al. [34].
Intravenózní substituce železa má být podle ECCO doporučení zvážena jako léčba první linie u pacientů s klinicky aktivním IBD a u pacientů s předchozí intolerancí perorálního železa, pokud jejich hladina hemoglobinu klesne pod 100 g/l. Parenterální substituce vede u těchto pacientů k rychlejšímu nástupu účinku, je efektivnější a lépe tolerovaná než léčba perorální. Efekt léčby lze sledovat podle hladin hemoglobinu, feritinu a saturace transferinu. Hodnoty feritinu nad 800 μg/l a saturace transferinu nad 50 % už svědčí pro přetížení železem. Riziko přetížení železem při léčbě je ale u pacientů s IBD většinou nízké pro chronické ztráty železa do trávicího traktu [7].
Perorální substituce železa, obvyklá u jiných diagnóz, je u aktivní formy IBD limitována a indikujeme ji pouze v případě lehké anémie u pacientů v remisi [7]. Studie Morettiho na malém souboru pacientů ukazuje, že podávání perorálního železa denně vede k rychlé elevaci hladiny hepcidinu s následným snížením resorpce železa. Naproti tomu alternativní podávání železa obden (48 hodin) „dává čas“ hepcidinu vrátit se na normální hladinu a nesuprimovat resorpci železa [35]. Studie Schaapa et al. ale tyto poznatky nepotvrdila. Podle ní má na hladiny hepcidinu větší vliv jeho diurnální kolísání než perorální substituce železa [36].
K rozhodnutí o perorální vs. parenterální léčbě železem může přispět znalost sérové hladiny hepcidinu. Při vysokých hladinách hepcidinu je perorální léčba železem neúčinná. Naopak nízké nebo až nedetekovatelné hladiny hepcidinu ukazují, že perorální léčba železem by měla být efektivní [20]. Studie Bregmana et al. sledovala pacienty s IDA neodpovídající na perorální léčbu železem. Hladiny hepcidinu byly u nonrespondérů signifikantně vyšší: 38,4 ng/ml (SD 66,7) než u respondérů: 11,3 ng/ml (SD 19,0) [37]. V naší studii u nově diagnostikovaných dětských pacientů s IBD jsme zjistili statisticky významně vyšší sérové hladiny hepcidinu u dětí s CD než UC (22,6 ng//ml vs. 6,5 ng/ml, p <0,05). Hepcidin pozitivně koreloval se zánětlivými ukazateli (CRP a feritinem). Kombinace ACD/IDA byla častější u dětí s CD, IDA dominovala ve skupině s UC (obr. 2a, 2b) [38].
Obr. 2a. Frekvence a typ anémie u dětí s nově diagnostikovanou CD. Převzato z [38]. ![Obr. 2a. Frekvence a typ anémie u dětí s nově diagnostikovanou CD. Převzato z [38].](https://pl-master.mdcdn.cz/media/image_pdf/4c731de4a0cacd57415d06976b0126f4.png?version=1599815683)
Obr. 2b. Frekvence a typ anémie u dětí s nově diagnostikovanou UC. Převzato z [38]. ![Obr. 2b. Frekvence a typ anémie u dětí s nově diagnostikovanou UC. Převzato z [38].](https://pl-master.mdcdn.cz/media/image_pdf/3febba7edebb74f481329eefe1d4965a.png?version=1599815701)
PREVENCE DEFICITU ŽELEZA U IBD PACIENTŮ
Po efektivní intravenózní léčbě recidivuje do 10 měsíců anémie až u 50 % IBD pacientů, proto je podle ECCO doporučení dnes preferován proaktivní přístup. Po úspěšné léčbě anémie má být léčba obnovena, pokud klesne sérový feritin pod 100 μg/l nebo hemoglobin pod 120 g/l [Dignass 2015].
Léčba anémie bez deficitu železa (NIDA) spočívá v léčbě příčiny. Nejčastěji jde o parenterální substituci vitaminu B12 (u stavů po resekci terminálního ilea) nebo substituci folátu. V případě toxického působení azathioprinu nebo aminosalicylátů je pak nutné snížit dávku nebo lék vysadit.
Pokud není u IBD pacienta s optimalizovanou protizánětlivou léčbou efektivní parenterální aplikace železa, může být zvážena léčba pomocí erytropoézu stimulujících látek (erytropoiesis stimulating agents, ESA). Transfuze erytrocytární masy má být u IBD pacientů podána při poklesu hemoglobinu pod 70 g/l, při akutním vzniku anémie, hemodynamické nestabilitě nebo selhání ostatních léčebných metod. Po transfuzi následuje intravenózní léčba železem [7].
ZÁVĚR
Všichni pacienti s IBD mají být na přítomnost anémie vyšetřováni a řádně léčeni. Screening anémie má být u pacientů v remisi prováděn jednou za 6‒12 měsíců, při aktivním onemocnění nejméně jednou za 3 měsíce. Vyšetření spočívá ve vyhodnocení kompletního krevního obrazu, sérového feritinu a C-reaktivního proteinu. Při diagnóze anémie je pak potřeba doplnit další parametry k rozlišení etiopatogeneze anémie. U pacientů s nespecifickým střevním zánětem se nejčastěji vyskytuje sideropenická anémie, anémie chronických chorob, nebo jejich kombinace. Naše výsledky v souboru dětí s nově diagnostikovanou UC ukázaly nejčastěji sideropenickou anémii, zatímco u dětí s CD dominovala kombinace sideropenické anémie s anémií chronických chorob. Při zvýšené systémové zánětlivé aktivitě má přednost parenterální aplikace železa před perorální formou terapie.
Hepcidin je slibným markerem, jehož aktuální hladina může, společně s ostatními měřenými parametry, přispět k porozumění reakce organismu na depleci železa při současně probíhajícím zánětlivém procesu. Stanovení sérové hladiny hepcidinu může napomoci k rozhodnutí o typu suplementace železa (perorální versus parenterální).
Práce byla podpořena grantem IGA LF UP 2017_13 a grantem MZ ČR RVO (FNOl, 00098892).
Došlo: 30. 11. 2018
Přijato: 12. 12. 2018
MUDr. Eva Karásková, Ph.D.
Dětská klinika FN
a LF UP Olomouc
I. P. Pavlova 6
779 00 Olomouc
e-mail: eva.karaskova@fnol.cz
Zdroje
1. Kolek A, Janout V, Tichý M, et al. The incidence of inflammatory bowel disease is increasing among children 15 years old and younger in the Czech Republic. J Pediatr Gastroenterol Nutr 2004 Mar; 38 (3): 362–363.
2. Schwarz J, Sýkora J, Cvalínová D, et al. Inflammatory bowel disease incidence in Czech children: A regional prospective study, 2000–2015. World J Gastroenterol 2017 Jun 14; 23 (22): 4090–4101.
3. Bousvaros A. Use of immunomodulators and biologic therapies in children with inflammatory bowel disease. Expert Rev Clin Immunol 2010; 6 : 659–666.
4. Patel D, Trivedi C, Khan N. Management of anemia in patients with inflammatory bowel disease (IBD). Curr Treat Options Gastroenterol 2018 Mar; 16 (1): 112–128.
5. Wiskin AE, Fleming BJ, Wootton SA, et al. Anaemia and iron deficiency in children with inflammatory bowel disease. J Crohns Colitis 2012; 6 : 687–691.
6. Wells CW, Lewis S, Barton JR, et al. Effects of changes in haemoglobin level on quality of life and cognitive function in inflammatory bowel disease patients. Inflamm Bowel Dis 2006; 12 : 123–130.
7. Dignass AU, Gasche C, Bettenworth D, et al. European Crohn’s and Colitis Organisation [ECCO]. European consensus on the diagnosis and management of iron deficiency and anaemia in inflammatory bowel diseases. J Crohns Colitis 2015; 9 : 211–222.
8. Park CH, Valore EV, Waring AJ, et al. Hepcidin, a urinary antimicrobial peptide synthesized in the liver. J Biol Chem 2001 Mar 16; 276 (11): 7806–7810.
9. Casu C, Nemeth E, Rivella S. Hepcidin agonists as therapeutic tools. Blood 2018 Apr 19; 131 (16): 1790–1794.
10. Krawiec P, Mroczkowska-Juchkiewicz A, Pac-Kożuchowska E. Serum hepcidin in children with inflammatory bowel disease. Inflamm Bowel Dis 2017; 23 : 2165–2171.
11. Ganz T. Hepcidin and iron regulation, 10 years later. Blood 2011 Apr 28; 117 (17): 4425–4433.
12. Dignass A, Farrag K, Stein J. Limitations of serum ferritin in diagnosing iron deficiency in inflammatory conditions. Int J Chronic Dis 2018 Mar 18; 2018 : 9394060.
13. Bergamaschi G, Di Sabatino A, Albertini R, et al. Serum hepcidin in inflammatory bowel diseases: biological and clinical significance. Inflamm Bowel Dis 2013; 19 : 2166–2172.
14. Khan N, Patel D, Shah Y, et al. Factors predicting testing and treatment of iron deficiency in a nationwide cohort of anemic UC patients. Inflamm Bowel Dis 2016 Dec; 22 (12): 2894–2901.
15. Auerbach M, Adamson JW. How we diagnose and treat iron deficiency anemia. Am J Hematol 2016 Jan; 91 (1): 31–38.
16. Borel MJ, Smith SM, Derr J, et al. Day-to-day variation in iron-status indices in healthy men and women. Am J Clin Nutr 1991 Oct; 54 (4): 729–735.
17. Ford BA, Coyne DW, Eby CS, et al. Variability of ferritin measurements in chronic kidney disease; implications for iron management. Kidney Int 2009 Jan; 75 (1): 104–110.
18. Kaitha S, Bashir M, Ali T. Iron deficiency anemia in inflammatory bowel disease. World J Gastrointest Pathophysiol 2015; 6 : 62–72.
19. Infusino I, Braga F, Dolci A, et al. Soluble transferrin receptor (sTfR) and sTfR/log ferritin index for the diagnosis of iron-deficiency anemia. A meta-analysis. Am J Clin Pathol 2012 Nov; 138 (5): 642–649.
20. Camaschella C. New insights into iron deficiency and iron deficiency anemia. Blood Rev 2017 Jul; 31 (4): 225–233.
21. van der Vorm LN, Hendriks JC, Laarakkers CM, et al. Toward worldwide hepcidin assay harmonization: Identification of a commutable secondary reference material. Clin Chem 2016; 62 : 993–1001.
22. Wolff F, Deleers M, Melot C, et al. Hepcidin-25: Measurement by LC-MS/MS in serum and urine, reference ranges and urinary fractional excretion. Clin Chim Acta 2013; 423 : 99–104.
23. Galesloot TE, Vermeulen SH, Geurts-Moespot AJ, et al. Serum hepcidin: reference ranges and biochemical correlates in the general population. Blood 2011; 117: e218–225.
24. Sdogou T, Tsentidis C, Gourgiotis D, et al. Immunoassay-based serum hepcidin reference range measurements in healthy children: differences among age groups. J Clin Lab Anal 2015; 29 : 10–14.
25. Uijterschout L, Swinkels DW, Domellöf M, et al. Serum hepcidin measured by immunochemical and mass-spectrometric methods and their correlation with iron status indicators in healthy children aged 0.5–3 y. Pediatr Res 2014; 76 : 409–414.
26. Cangemi G, Pistorio A, Miano M, et al. Diagnostic potential of hepcidin testing in pediatrics. Eur J Haematol 2013; 90 : 323–330.
27. Reifen R, Matas Z, Zeidel L, et al. Iron supplementation may aggravate inflammatory status of colitis in a rat model. Dig Dis Sci 2000 Feb; 45 (2): 394–397.
28. Carrier J, Aghdassi E, Platt I, et al. Effect of oral iron supplementation on oxidative stress and colonic inflammation in rats with induced colitis. Aliment Pharmacol Ther 2001 Dec; 15 (12): 1989–1999.
29. Zimmermann MB, Chassard C, Rohner F, et al. The effects of iron fortification on the gut microbiota in African children: a randomized controlled trial in Cote d‘Ivoire. Am J Clin Nutr 2010 Dec; 92 (6): 1406–1415.
30. Lee T, Clavel T, Smirnov K, et al. Oral versus intravenous iron replacement therapy distinctly alters the gut microbiota and metabolome in patients with IBD. Gut 2017 May; 66 (5): 863–871.
31. Schröder O, Mickisch O, Seidler U, et al. Intravenous iron sucrose versus oral iron supplementation for the treatment of iron deficiency anemia in patients with inflammatory bowel disease – a randomized, controlled, open-label, multicenter study. Am J Gastroenterol 2005 Nov; 100 (11): 2503–2509.
32. Lee TW, Kolber MR, Fedorak RN, et al. Iron replacement therapy in inflammatory bowel disease patients with iron deficiency anemia: a systematic review and meta-analysis. J Crohns Colitis 2012 Apr; 6 (3): 267–275.
33. Bonovas S, Fiorino G, Allocca M, et al. Intravenous versus oral iron for the treatment of anemia in inflammatory bowel disease: A systematic review and meta-analysis of randomized controlled trials. Medicine (Baltimore) 2016 Jan; 95 (2): e2308.
34. Laass MW, Straub S, Chainey S, et al. Effectiveness and safety of ferric carboxymaltose treatment in children and adolescents with inflammatory bowel disease and other gastrointestinal diseases. BMC Gastroenterol 2014 Oct 17; 14 : 184.
35. Moretti D, Goede JS, Zeder C, et al. Oral iron supplements increase hepcidin and decrease iron absorption from daily or twice-daily doses in iron-depleted young women. Blood 2015 Oct 22; 126 (17): 1981–1989.
36. Schaap CC, Hendriks JC, Kortman GA, et al. Diurnal rhythm rather than dietary iron mediates daily hepcidin variations. Clin Chem 2013 Mar; 59 (3): 527–535.
37. Bregman DB, Morris D, Koch TA, et al. Hepcidin levels predict nonresponsiveness to oral iron therapy in patients with iron deficiency anemia. Am J Hematol 2013 Feb; 88 (2): 97–101.
38. Karaskova E, Volejnikova J, Holub D, et al. Hepcidin in newly diagnosed inflammatory bowel disease in children. J Paediatr Child Health 2018 Jun 20. doi: 10.1111/jpc.14093.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek Zprávy
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2020 Číslo 5- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Pandemie COVID-19 z pohledu dětské kliniky krajské nemocnice
- Bolesti břicha způsobené retrokaválním ureterem
- Anémie u dětí s nespecifickými střevními záněty
- Péče o děti s infantilním hemangiomem léčené systémově propranololem
- Inhibitory angiotenzin konvertujícího enzymu u dětských kardiologických pacientů – současné zkušenosti a praxe
- Doporučení pro diagnostiku a léčbu uveitidy asociované s juvenilní idiopatickou artritidou: Česko-slovenská adaptace evropských doporučení SHARE
- Prof. MUDr. Jiří ZEMAN, DrSc. – jubileum
- Zprávy
- Lucia Časnocha Lúčanová: Infekcie novorodencov
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Prof. MUDr. Jiří ZEMAN, DrSc. – jubileum
- Pandemie COVID-19 z pohledu dětské kliniky krajské nemocnice
- Anémie u dětí s nespecifickými střevními záněty
- Bolesti břicha způsobené retrokaválním ureterem
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



