-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Včasná antibiotická terapia a riziko renálneho jazvenia u detí s prvou nekomplikovanou infekciou močových ciest
Early antibiotic therapy and risk of renal scarring in children with a first uncomplicated urinary tract infection
Urinary tract infections are the second most common bacterial diseases in infants and children. Acute infectious tubulointerstitial nephritis (AITIN) arises as an ascending infection from the lower urinary tract and is associated with an increased risk of permanent kidney damage.
The aim of the study was to investigate the effects of febrile period before and after the initiation of antibiotics to the extent of post-inflammatory kidney damage in children with first uncomplicated AITIN.Methods:
The cohort was composed of 221 patients aged 1 month to 18 years with first uncomplicated AITIN. In all patients the febrile interval length before and after initiation of antibiotic therapy was experienced. Renal scintigraphy was performed in 105 children after a 6-months period from overcoming the infection. The authors used the semi-quantitative analysis of the morphology scan to quantitate the extent of post-inflammatory kidney damage.Results:
The semi-quantitative analysis revealed parenchymal defects in 113/210 kidneys, the extent of which depended on the duration of febrile period before the initiation of antibiotics (p=0.029). In 42.1% of patients the febrile interval length was longer than 48 hours. Delayed antibiotic treatment in 21.3% of children was due to the fact that the urine was not examined during the first medical examination.Conclusion:
Our results show the importance of early antibiotic treatment in children with AITIN. They also emphasize that in a fifth of children in spite of the rapid urine test methods for outpatient clinics the urine has not been examined during the first examination for fever.Key words:
delayed antibiotic treatment, renal scars, febrile period
Autoři: V. Jankó; L. Kovács
Působiště autorů: Bratislava ; Detská klinika Lekárskej fakulty Univerzity Komenského a Detskej fakultnej nemocnice s poliklinikou
Vyšlo v časopise: Čes-slov Pediat 2017; 72 (1): 15-19.
Kategorie: Původní práce
Souhrn
Infekcia močových ciest je druhým najčastejším bakteriálnym ochorením po respiračných infekciách. Akútna infekčná tubulointersticiálna nefritída (AITIN) vzniká pri ascendentnom zápale dolných močových ciest a je spojená so zvýšeným rizikom vzniku trvalého poškodenia obličiek.
Cieľom danej práce bolo zistiť vplyv febrilného intervalu pred a po nasadení antibiotík na rozsah pozápalového poškodenia obličiek u detí s prvou nekomplikovanou AITIN.Metódy:
Do súboru bolo zaradených 221 pacientov vo veku od 1 mesiaca života do veku 18 rokov s prvou nekomplikovanou AITIN. U všetkých pacientov bola zaznamenaná dĺžka febrilného intervalu pred a po nasadení antibiotickej liečby. Statická scintigrafia obličiek bola vykonaná u 105 detí so 6-mesačným odstupom od prekonania infekcie. Autori používali semikvantitatívnu analýzu statickej scintigrafie na kvantifikáciu rozsahu pozápalového poškodenia obličiek.Výsledky:
Nami používaná semikvantitatívna analýza zistila na 113/210 obličkách parenchýmové defekty, ktorých rozsah závisol od dĺžky febrilného intervalu pred nasadením antibiotík (p = 0,029). U 42,1 % pacientov bola dĺžka febrilného intervalu dlhšia ako 48 hodín. Oneskorene nasadená antibiotická liečba bola u 21,3 % detí spôsobená tým, že nebol vyšetrený moč počas prvého lekárskeho ošetrenia.Záver:
Naše výsledky poukazujú na dôležitosť včasnej antibiotickej liečby u detí s AITIN a zároveň zdôrazňujú, že pätina detí napriek dostupnej rýchlej metódy vyšetrenia moču na ambulanciách prvého kontaktu nemá vyšetrený moč počas prvého lekárskeho ošetrenia pre výstup telesnej teploty.KĽÚČOVÉ SLOVÁ:
oneskorená antibiotická liečba, jazva na obličke, febrilný intervalÚVOD
Infekcia močových ciest (IMC) je druhá najčastejšia bakteriálna infekcia diagnostikovaná v pediatrických ambulanciách a na detských oddeleniach nemocníc, do siedmeho roku života ju prekoná 8 % dievčat a 2,8 % chlapcov [1]. Zvlášť závažný je zápal horného úseku močových ciest (akútna infekčná tubulointersticiálna nefritída, AITIN), ktorý je spojený s celkovou zápalovou odpoveďou organizmu s horúčkou a môže zapríčiniť jazvenie rastúcej obličky [2]. Progresia takto vytvorených jaziev je pomalý proces, približne u tretiny postihnutých pacientov môže po rokoch viesť k vzniku hypertenzie, preeklampsie a chronickej renálnej insuficiencie, obzvlášť pri obojstrannom postihnutí obličiek [2–5].
Pravdepodobnosť vzniku pozápalových jaziev je vyššia u detí mladších ako dva roky, hlavne u detí s veziko-ureterálnym refluxom vyššieho stupňa, závažnými obštrukčnými uropatiami a inými vrodenými anomáliami štruktúry a funkcie močových ciest [6–9]. Existujúce údaje týkajúce sa spojenia medzi oneskoreným začatím antimikrobiálnej terapie a vývojom obličkového zjazvenia sú nekonzistentné. Cieľom danej práce bolo preto zistiť vzťah medzi febrilným intervalom pred a po nasadení antibiotík a rozsahom pozápalového poškodenia obličiek u detí s prvou nekomplikovanou AITIN.
PACIENTI A METÓDY
Do štúdie bolo zaradených 221 detí s priemerným vekom 5,1 roka (medián 2,1 rokov), z nich bolo 122 detí mladších ako 2 roky. Pacienti boli odoslaní na kliniku v Bratislave medzi augustom 2008 a augustom 2012 pre prvú nekomplikovanú akútnu infekčnú tubulointersticiálnu nefritídu, ktorá bola diagnostikovaná na základe klinických (teplota nad 38 °C) a laboratórnych kritérií (FW nad 25 mm/h, CRP nad 20 mg/l, leukocytúria, signifikantna bakteriúria spôsobená patogénom jedného druhu v počte viac ako 105 kolónií formujúcich jednotiek v 1 ml moču).
U každého pacienta sa odobrala vzorka krvi na stanovenie počtu leukocytov a koncentrácie CRP v priebehu prvej hodiny od prijatia na kliniku.
Antibiotická liečba bola začatá po prijatí ihneď po ukončení odberu vzorky moču na mikrobiologické vyšetrenie. Podávala sa 14-dňová sekvenčná antibiotická liečba, ktorá bola modifikovaná podľa veku dieťaťa. Deti mladšie ako 6 mesiacov dostávali 7 dní parenterálnu antibiotickú terapiu cefalosporínom 2. generácie (cefuroxím v dávke 60 mg/kg/deň v troch dávkach) a následne ďalších 7 dní bol perorálne podávaný cefalosporín 2. generácie (cefuroxím axetil 20 mg/kg/deň v dvoch dávkach). Pacienti vo veku 6–12 mesiacov dostávali parenterálne cefalosporín 3. generácie (ceftizoxím v dávke 100 mg/kg/deň v dvoch dávkach) na dobu 5 dní s následným podávaním perorálneho cefalosporínu 3. generácie (cefixím 8 mg/kg/deň v dvoch dávkach) na dobu nasledujúcich 9 dní. Nakoniec, pacienti starší ako 1 rok dostávali tri dni parenterálny cefalosporín 3. generácie (ceftizoxím v dávke 100 mg/kg/deň v dvoch dávkach, maximálne 2 x 1 g) a liečba pokračovala 11-dňovým perorálnym podávaním cefixímu (8 mg/kg/deň v dvoch dávkach). V prípadoch, kedy sa zistila rezistencia vykultivovaných mikroorganizmov na uvedené antibiotiká, bola indikovaná ich zmena podľa výsledkov vyšetrenia antibiotickej citlivosti in vitro.
Febrilný interval pred a po nasadení antibiotík sa zaznamenal v hodinách u každého pacienta a súčasne bolo poznamenané, či sa uskutočnilo vyšetrenie moču počas prvého lekárskeho ošetrenia daného febrilného stavu.
Statická scintigrafia obličiek sa vykonávala aspoň 6 mesiacov po prekonaní akútnej infekčnej tubulointersticiálnej nefritídy u 105 pacientov/210 obličiek (priemerný vek 4,9 rokov, medián 1,9 rokov). Výsledky sa hodnotili „štandardným spôsobom“ a pomocou „semikvantitatívnej analýzy“. Pri „štandardnom hodnotení“ sa jazva hodnotila ako klinovitý výpadok vychytávania rádiofarmaka v parenchýme obličky sprevádzaný aspoň 5% poklesom celkovej rádioaktivity [10]. Pri „semikvantitatívnej analýze“ podľa Hitzela a spol. [11] sa parenchým každej obličky virtuálne rozdelil na tri alikvotne veľké časti. Každá z nich sa hodnotila na štvorstupňovej škále (0–3), podľa homogénnosti vychytávania rádiofarmaka, pričom maximálny počet bodov 3 sa pridelil len pri úplne jednoliatom vychytaní rádiofarmaka. Podľa súčtu bodov (DMSA skóre) z jednotlivých častí sa následne stanovil rozsah poškodenia parenchýmu. Oblička, ktorá mala menej ako 7 bodov z celkového súčtu 9 bodov, sa považovala za „zjazvenú“. „Parenchýmový defekt“ sa definoval počtom 7 a 8 bodov z celkového súčtu 9 bodov [11].
Získané výsledky sa hodnotili pomocou štatistického programu Sigma Stat 3.5 (Systat Software Inc). Lineárna závislosť medzi spojitými kvantitatívnymi premennými bola hodnotená pomocou Personovho korelačného testu a Mann-Whitney U testu. Za štatisticky významné sa považovali výsledky s hodnotou p <0,05.
VÝSLEDKY
V skupine detí mladších ako 2 roky trval febrilný interval pred nasadením antibiotík v priemere 2,47 dni (medián 2 dni, CI 95% 2,24–2,7 dni). Nepozoroval sa štatisticky významný rozdiel (p = 0,56) v dĺžke febrilného intervalu pred diagnostikou AITIN medzi skupinami detí mladších ako 12 mesiacov (priemer 2,43 dni, medián 2 dni, CI 95% 2,18–2,77 dni) resp. starších ako 12 mesiacov (priemer 2,56 dni, medián 2 dni, CI 95% 2,17–2,94). U 24 z 122 detí (19,7 %) mladších ako 2 roky bola diagnóza stanovená až po 72–144 hodinách trvania febrilného stavu. U desiatich z nich nebol moč vyšetrený počas prvého lekárskeho vyšetrenia a k jeho vyšetreniu sa pristúpilo až po opakovanom kontakte pacienta s lekárom, kým u ostatných 14 detí bola diagnostika AITIN oneskorená pre neskoré privezenie pacientov na lekárske ošetrenie (teda až po 72 hodinách trvania teplôt) (tab. 1).
Tab. 1. Vyšetrenie moču počas lekárskeho ošetrenia u 122 detí mladších ako 2 roky s akútnou infekčnou tubulointersticiálnou nefritídou. 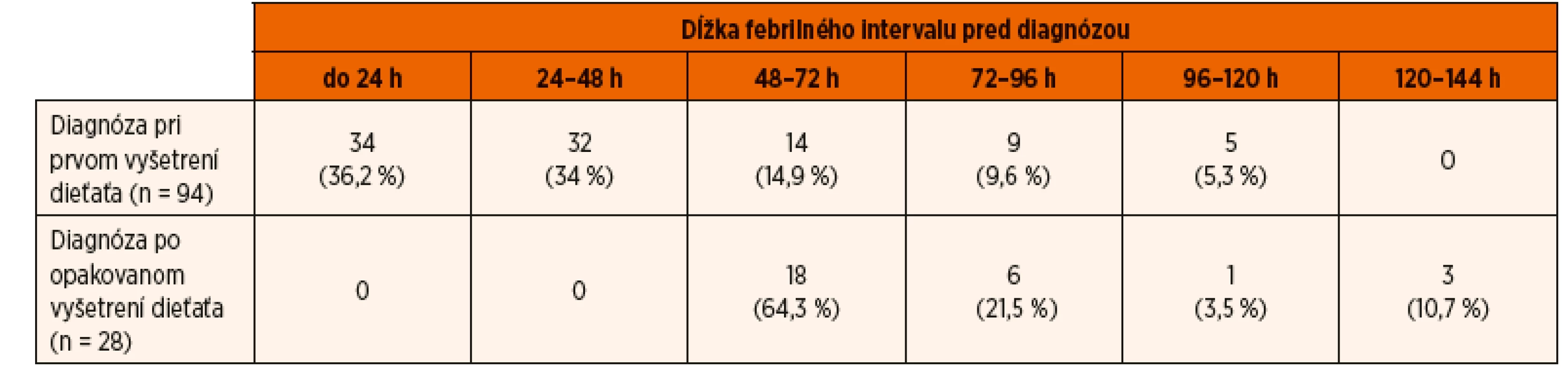
V skupine detí starších ako 2 roky bola AITIN v 75 % prípadov diagnostikovaná počas prvých 72 hodín trvania febrilného stavu. Febrility trvali pred nasadením antibiotík v priemere 2,54 dni (medián 2 dni, CI 95% 2,23–2,86 dni). AITIN bola diagnostikovaná u 75,7 % (75/99) 3–18-ročných pacientov do 72 hodín od prvého vzostupu telesnej teploty. Oneskorená diagnostika zistená v 24,2 % (24/99) prípadov bola podmienená u 14/99 (14,1 %) pacientov chýbaním vyšetrenia moču pri prvom lekárskom vyšetrení a v ostatných 10/99 (10,1 %) prípadoch oneskoreným príchodom pacienta na prvé lekárske vyšetrenie (tab. 2).
Tab. 2. Vyšetrenie moču počas lekárskeho ošetrenia u 99 detí starších ako 2 roky s akútnou infekčnou tubulointersticiálnou nefritídou. 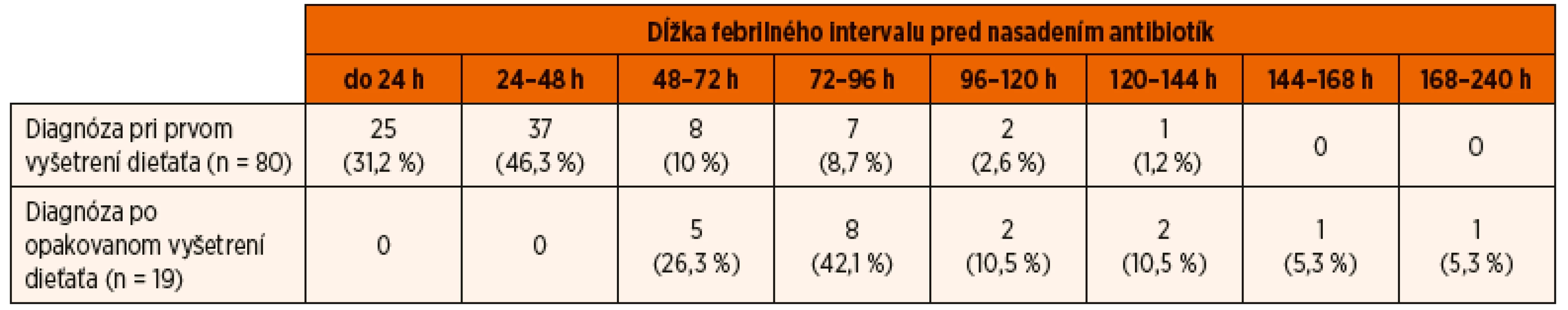
Nami zvolená empirická antibiotická liečba bola účinná u 208 z 221 detí (94,1 %). Iba u 13/221 pacientov trval febrilný interval po nasadení antibiotík dlhšie ako 72 hodín. U každého z nich bol dokázaný etiologický agens Enterococcus sp. po 72 hodinách liečby a bola zmenená antibiotická terapia podľa citlivosti (na ampicilín resp. na ciprofloxacín). Teploty u každého z nich poklesli do 48 hodín po zmene liečby.
Z laboratórnych ukazovateľov leukocytóza (p = 0,6) ani koncentrácia CRP (p = 0,58) nevykázali štatisticky významný rozdiel medzi dvoma vekovými skupinami detí. Leukocytóza bola u detí mladších ako 2 roky v priemere 19,1 x 109/l (medián 18,4 x 109/l, 95% CI 16,6–21,6 x 109/l) a u detí starších ako 2 roky v priemere 18,4 x 109/l (medián 15,9 x 109/l, 95% CI 16,9–19,9 x 109/l). Koncentrácia CRP sa pohybovala v celom súbore od 22,9 mg/l do 341 mg/l (priemer 104 mg/l, medián 78,1 mg/l, 95% CI 89,3–118,3 mg/l).
Statická scintigrafia obličiek sa vykonávala aspoň 6 mesiacov po prekonaní akútnej infekčnej tubulointersticiálnej nefritídy u 105 pacientov (210 obličiek). Podľa štandardného hodnotenia výsledkov statickej scintigrafie obličiek bol u 12/210 (5,7 %; 95% CI 3,1–8,3 %) obličiek prítomný 5% rozdiel v percentuálnom vychytávaní rádiofarmaka medzi kontralaterálnymi obličkami. U 4/210 (1,9 %; 95% CI 0,1–3,7 %) obličiek bol tento 5% rozdiel v distribúcii rádiofarmaka následkom veľkostnej asymetrie orgánov. U 8/210 (3,8 %; 95% CI 1,2–6,4 %) z nich sa našiel klinovitý výpadok v distribúcii rádiofarmaka v obličke, ktorý svedčil o prítomnosti jaziev. Semikvantitatívna analýza výsledkov statickej scintigrafie obličiek odhalila parenchýmový defekt na 113/210 (53,8 %; 95% CI 47,1–60,5 %) obličkách. Výraznejšie postihnutie („jazva“ na obličkách) sa našla v 8/210 (3,8 %; 95% CI 1,2–6,4 %) prípadoch.
Febrilný interval pred nasadením antibiotík mal podľa lineárnej regresnej analýzy signifikantný vplyv na rozsah jaziev a parenchýmového defektu obličiek (p = 0,029; obr. 1), takáto súvislosť sa nepozorovala pri hodnotení dĺžky febrilného intervalu po nasadení antibiotík (p = 0,2).
Obr. 1. Vzťah dĺžky febrilného intervalu pred nasadením antibiotík k rozsahu jaziev a parenchýmových defektov obličiek 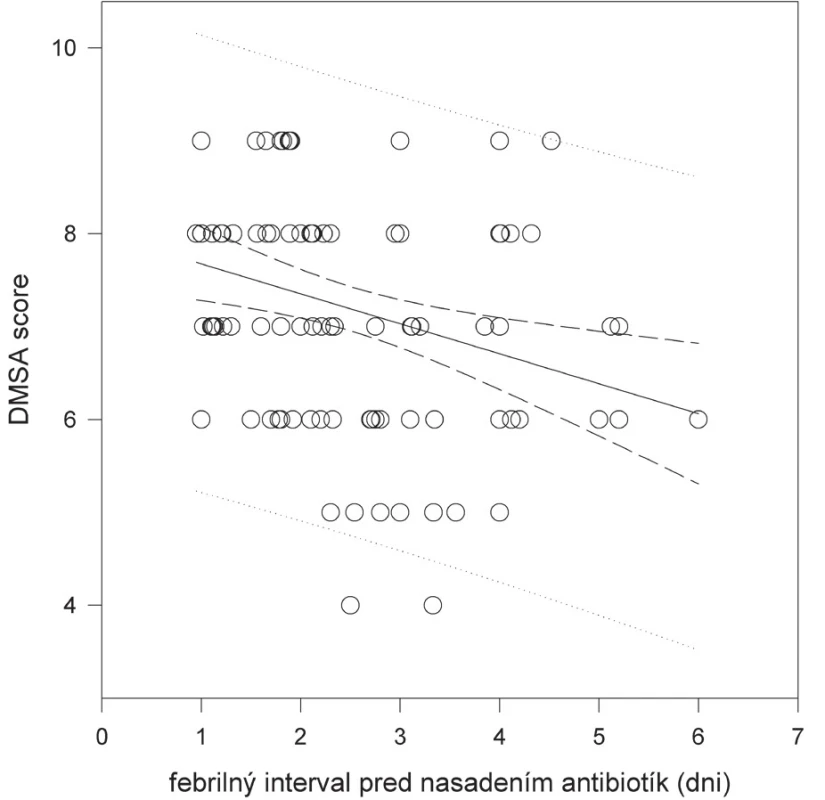
(DMSA skóre – počet bodov podľa semikvantitatívnej analýzy výsledkov statickej scintigrafie obličiek [11]). Zo sledovaných laboratórnych parametrov (leukocytóza a CRP) len leukocytóza v čase prijatia vykazovala štatistickú súvislosť s jazvami (p = 0,02).
DISKUSIA
Infekcia močových ciest patrí medzi problémy, ktoré riešia ambulantní aj nemocniční pediatri na dennom poriadku. Podľa všeobecne uvádzaného názoru sa má liečba začať najneskôr do 24 hodín od výstupu teploty a vzniku klinického podozrenia na IMC v záujme redukcie možnosti renálneho jazvenia, najmä u mladších pacientov. Mohlo by sa zdať, že vďaka širokej dostupnosti informácií o infekciách močových ciest v podobe štandardných diagnosticko-terapeutických postupov a osvetových materiálov ako aj vďaka ambulantne použiteľných diagnostických prúžkov sa v ostatnom čase už podarilo oneskorený začiatok liečby akútnej infekčnej tubulointersticiálnej nefritídy značne redukovať.
Ukazuje sa však, že situácia v praxi stále nie je optimálna a často nezodpovedá uvedeným očakávaniam. Potvrdzujú to aj uvedené výsledky v skupine 221 detí s prvou akútnou nekomplikovanou AITIN. Ako sa ukazuje, prevažná väčšina pacientov s teplotami prichádza na lekárske ošetrenie do 72 hodín od prvého výstupu teploty. Z druhej strany však u 24 z 122 detí mladších ako 2 roky (19,7 %) a u 24 z 99 detí starších ako 2 roky (24,2 %) bola diagnóza určená a terapia začatá až po 72–144 hodinách od začatia febrilného stavu. Pri súčasnej širokej dostupnosti jednoduchej diagnostiky pomocou testačných papierikov („dipstick“) mohlo byť takéto oneskorenie diagnostiky a začatia liečby následkom buď zanedbania vyšetrenia moču už pri prvom lekárskom vyšetrení febrilného dieťaťa, alebo oneskoreným príchodom pacienta (s rodičmi) na lekárske vyšetrenie. V skutočnosti k tomuto nelichotivému výsledku prispeli obe tieto možnosti v rovnakej miere – u 24 detí bola oneskorená diagnostika podmienená neskorým príchodom pacienta na lekárske vyšetrenie až po viac ako 72 hodinách trvania teplôt, kým u ďalších 24 z 221 detí (10,8 %) nebol moč vyšetrený počas prvého lekárskeho vyšetrenia (tab. 1, tab. 2).
Chýbanie vyšetrenia moču pri prvom lekárskom vyšetrení sa spomína aj v iných prácach. Napríklad, podľa súčasného dotazníkového prieskumu s účasťou 1129 pediatrov primárneho kontaktu z viacerých krajín Európskej únie vrátane Slovenska iba 62 % pediatrov uvažuje o možnosti infekcie močových ciest pri prvom vyšetrení novorodencov a dojčiat vo veku 1–36 mesiacov [12]. U malých pacientov hlavným diagnostickým problémom môže byť aj chýbanie špecifických klinických príznakov (okrem zvýšenej teploty), ktoré by priamo upozornili na možnosť akútnej infekčnej tubulointersticiálnej nefritídy, aj bez ďalších laboratórnych vyšetrení. Do istej miery je pritom paradoxné, že v najmladšej vekovej skupine bola mediánna hodnota času oneskorenia diagnózy nižšia, ako u starších detí (obr. 2). Podobné pozorovanie zaznamenali aj iní autori, ktorí túto skutočnosť vysvetľujú zvýšenou diagnostickou ostražitosťou primárnych pediatrov u mladších detí [13]. Dalo by sa tiež predpokladať, že rodičia skôr prinesú do ambulancie febrilné dieťa do dvoch rokov, kým u starších detí najprv sa pokúšajú situáciu zvládnuť doma (napr. podávaním antipyretík), a až po neúspechu tohto postupu sa obracajú na lekára.
Obr. 2. Dĺžka febrilného intervalu pred nasadením antibiotík u 221 detí s akútnou infekčnou tubulointersticiálnou nefritídou. 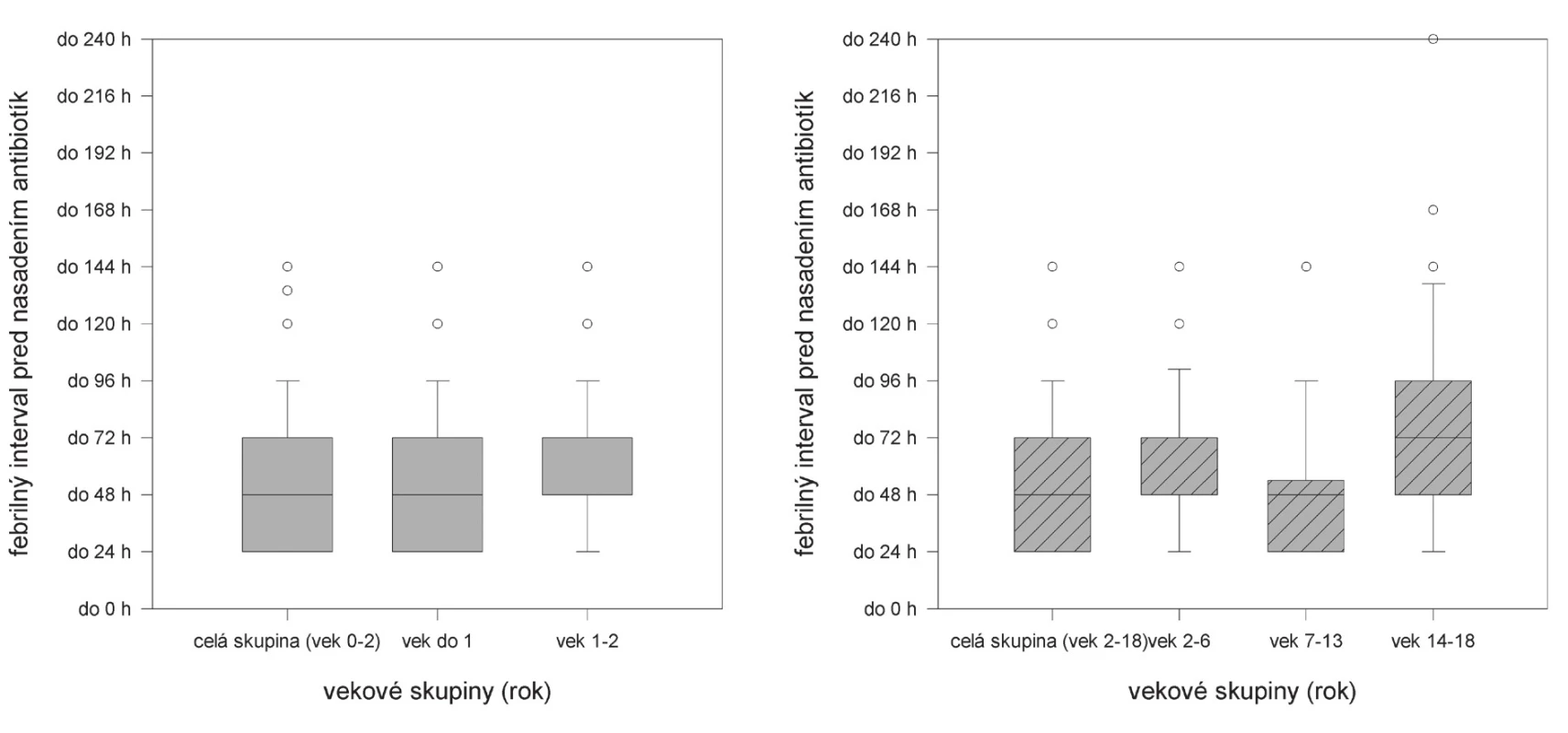
Na prvom grafe je znázornená dĺžka febrilného intervalu v dvoch vekových podskupinách u detí s AITIN mladších ako 2 roky. Druhý graf ukazuje dĺžku febrilného intervalu v jednotlivých vekových podskupinách u detí s AITIN starších ako 2 roky To, že nejde o ojedinelé pozorovanie, potvrdzujú v našej literatúre aj výsledky Červeňovej a spol. [13], Jandu a spol. [14] spolu s výsledkami iných, zahraničných autorov [15]. Ako pozitívny príklad by sa dali spomenúť pozorovania Hiraoka a spol., ktorých pacienti vo veku do dvoch rokov boli liečení pre AITIN už do 24 hodín od výstupu teploty. Autori rýchlu diagnostiku pripisujú špecifikám japonského systému zdravotnej starostlivosti (bezplatná zdravotná starostlivosť pre deti a zvýšená diagnostická ostražitosť lekárov čo sa týka infekcie močových ciest). Výpovednú hodnotu tejto práce však znižuje skutočnosť, že ide o selektívny súbor s malým počtom iba 26 pacientov [16].
Neprimerane predlžený pred-terapeutický febrílny interval zaťažuje organizmus dieťaťa a znižuje jeho celkové pohodlie. Aj preto by sa mal rozhodne skrátiť. Navyše, podľa existujúcich údajov sa zbytočným predlžením febrílneho intervalu zvyšuje aj riziko renálneho zjazvenia u detí s AITIN, najmä v mladších vekových skupinách [7–9, 17]. Viaceré štúdie sa zamerali na určenie akéhosi „bezpečného intervalu“ nasadenia liečby od začiatku AITIN, kedy je riziko trvalého jazvenia obličiek ešte nižšie. Oh a spol. [15] zistili priemerný čas oneskorenia diagnostiky 4,52 ± 2,00 dní u pacientov s rozvojom akútnych scintigrafických zmien na obličkách, pričom tento interval bol kratší s trvaním 2,65 ± 1,93 dní u detí bez renálneho poškodenia. Fernández-Menéndez a spol. [18] pozorovali v skupine detí so scintigraficky dokumentovaným akútnym renálnym poškodením 84,6 ± 53,3 hodinový interval oneskorenia diagnostiky. Závery týchto prác však boli kritizované, nakoľko sa opierali o hodnotenie nálezu na statickej scintigrafii obličiek (DMSA-sken) vykonanej po krátkom, niekoľkotýždňovom časovom odstupe od akútnej infekcie (tzv. „včasný DMSA-sken), kedy prevažne ide o dočasné scintigrafické defekty [19]. Z hľadiska trvalého zjazvenia renálneho parenchýmu sa za relevantnejšie považujú výsledky „neskorého DMSA-skenu“ vykonaného po aspoň 6-mesačnom odstupe od akútnej infekcie [19]. Keďže definitívne jazvenie na „neskorom DMSA-skene“ sa pozoruje práve v niektorých akútne postihnutých lokalitách obličky, dá sa predpokladať, že blokáda iniciálneho poškodenia môže viesť k prevencii trvalého jazvenia obličiek.
Výsledky danej práce potvrdzujú existenciu závislosti medzi včasnosťou diagnostiky a začatia liečby AITIN a výskytom a rozsahom parenchýmového poškodenia obličiek na „neskorom DMSA-skene“. Pri štandardnom hodnotení scintigrafického nálezu sa výrazný klinovitý výpadok v distribúcii rádiofarmaka zistil iba na 3,8 % hodnotených obličiek, taký nízky výskyt jazvenia obličiek pri prvej nekomplikovanej AITIN je v zhode s literárnymi údajmi [2, 3]. Citlivejšie, semikvantitatívne hodnotenie statickej scintigrafie obličiek podľa Hitzelovho postupu [11] však umožňuje odhaliť aj subtílnejšie, miernejšie defekty akumulácie rádiofarmaka, ktoré sa v danom súbore našli na 53,8 % hodnotených obličiek. Tento nález naznačuje, že infekcia močových ciest môže aj u detí s nízkym rizikom zjazvovania ponechať miernejšie, ale trvalé poškodenie renálneho parenchýmu. Zistili sme pritom signifikantnú negatívnu koreláciu medzi stupňom poškodenia parenchýmu a rýchlosťou diagnostiky a liečby infekcie močových ciest. Febrilný interval pred nasadením antibiotík mal podľa lineárnej regresnej analýzy signifikantný vplyv na rozsah jaziev a parenchýmového defektu obličiek (p = 0,029); podobná súvislosť však nebola zistená pri hodnotení dĺžky febrilného intervalu po nasadení antibiotík (p = 0,2). Zároveň sa ukázalo, že rozsah jazvenia je signifikantne vyšší v tých prípadoch, kedy sa liečba začala s viac ako 96-hodinovým odstupom od začatia horúčkovitej infekcie. Naše výsledky v súlade s dostupnými literárnymi údajmi podporujú názor, že oneskorením liečby AITIN sa riziko renálneho jazvenia zvyšuje.
MUDr. Viktor Jankó, PhD.
Detská klinika LFUK a DFNsP
Limbová 1
833 40 Bratislava
Slovenská republika
e-mail: jankoviktor@yahoo.com
Zdroje
1. Shaikh N, Morone NE, Bost JE, et al. Prevalence of urinary tract infection in childhood: a meta-analysis. Pediatr Infect Dis J 2008; 27 (4): 302–308.
2. Coulthard MG, Lambert HJ, Keir MJ. Occurrence of renal scars in children after their first referral for urinary tract infection. BMJ 1997; 315 (7113): 918–919.
3. Coulthard MG, Lambert HJ, Vernon SJ, et al. Does prompt treatment of urinary tract infection in preschool children prevent renal scarring: mixed retrospective and prospective audits. Arch Dis Child 2014; 99 (4): 342–347.
4. Jacobson SH, Eklof O, Lins LE, et al. Long-term prognosis of post-infectious renal scarring in relation to radiological findings in childhood –a 27-year follow-up. Pediatr Nephrol 1992; 6 (1): 19–24.
5. Mortazavi F, Rafiee A. Etiology of pediatric chronic kidney diseases in north-west of Iran. Pak J Biol Sci 2011; 13 (9): 456–459.
6. Ehsanipour F, Gharouni M, Rafati AH, et al. Risk factors of renal scars in children with acute pyelonephritis. Braz J Infect Dis 2012; 16 (1): 15–18.
7. Smellie JM, Poulton A, Prescod NP. Retrospective study of children with renal scarring associated with reflux and urinary infection. BMJ 1994; 308 (6938): 1193–1196.
8. Jakobsson B, Berg U, Svensson L. Renal scarring after acute pyelonephritis. Arch Dis Child 1994; 70 (2): 111–115.
9. Ozen S, Alikasifoglu M, Saatci U, et al. Implications of certain genetic polymorphisms in scarring in vesicoureteric reflux: importance of ACE polymorphism. Am J Kidney Dis 1999; 34 (1): 140–145.
10. Piepsz A, Colarinha P, Gordon I, et al. Guidelines for 99mTc-DMSA scintigraphy in children. Eur J Nucl Med 2001; 28 (3): BP37–41.
11. Hitzel A, Liard A, Dacher JN, et al. Quantitative analysis of 99mTc-DMSA during acute pyelonephritis for prediction of long-term renal scarring. J Nucl Med 2004; 45 (2): 285–289.
12. Hadjipanayis A, Grossman Z, Del Torso S, et al. Current primary care management of children aged 1-36 months with urinary tract infections in Europe: large scale survey of paediatric practice. Arch Dis Child 2015; 100 (4): 341–347.
13. Červeňová O. Včasnosť diagnostiky akútnej pyelonefritídy. Pediatr prax 2006; 5 : 262–263.
14. Janda J, Fencl F, Šmelhausová M, a spol. Diagnostika akutni pyelonefritidy u dětí na úrovni primárni péče. Čes-slov Pediat 2006; 61 : 279–280.
15. Oh MM, Kim JW, Park MG, et al. The impact of therapeutic delay time on acute scintigraphic lesion and ultimate scar formation in children with first febrile UTI. Eur J Pediatr 2012; 171 (3): 565–570.
16. Hiraoka M. Medical management of congenital anomalies of the kidney and urinary tract. Pediatr Int (Japan) 2003; 45 (5): 624–633.
17. Shaikh N, Mattoo TK, Keren R, et al. Early antibiotic treatment for pediatric febrile urinary tract infection and renal scarring. JAMA Pediatr 2016; 170 (9): 848–854.
18. Fernandez-Menendez JM, Malaga S, Matesanz JL, et al. Risk factors in the development of early technetium-99m dimercaptosuccinic acid renal scintigraphy lesions during first urinary tract infection in children. Acta Paediatr 2003; 92 (1): 21–26.
19. Shaikh N, Ewing AL, Bhatnagar S, et al. Risk of renal scarring in child-ren with a first urinary tract infection: a systematic review. Pediatrics 2010; 126 (6): 1084–1091.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek Editorial
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2017 Číslo 1- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Recidivující infekce močových cest – přínos diagnostiky a léčby dysfunkční mikce
- Včasná antibiotická terapia a riziko renálneho jazvenia u detí s prvou nekomplikovanou infekciou močových ciest
- Haemophilus diseases in ENT in children before and after the introduction of Haemophilus influenzae type b vaccine
- Kvalita spánku detí a adolescentov s diabetes mellitus 1. typu
- Editorial
- Funkcia štítnej žľazy u obéznych detí
- Nezvyčajná príčina hyperkalciémie u pacientky s primárne kortikorezistentným nefrotickým syndrómom – kazuistika
- Infekcia močových ciest – rúcanie starých dogiem
- Recidivující krvácení do trávicího ústrojí
- Jak vyšetřovat moč při podezření nebo již prokázané infekci močových cest
- General Movements – vyšetření nezralého nervového systému
- Získaná kardiovaskulární onemocnění u Turnerova syndromu
- Febrilní křeče: doporučený postup pro vyšetření dítěte s nekomplikovanými febrilními křečemi. Adaptovaný doporučený postup American Academy of Pediatrics
- Diagnostický a terapeutický postup u detských pacientov s prvou nekomplikovanou infekciou horných močových ciest
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Jak vyšetřovat moč při podezření nebo již prokázané infekci močových cest
- Haemophilus diseases in ENT in children before and after the introduction of Haemophilus influenzae type b vaccine
- Recidivující krvácení do trávicího ústrojí
- General Movements – vyšetření nezralého nervového systému
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



