-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Vyšetření sérové koncentrace prealbuminu a selenu ke sledování nutričního stavu pacientů s fenylketonurií a hyperfenylalaninemií
Determination of prealbumin and selenium in serum for monitoring the nutrition status of phenylketonuric and hyperphenylalaninemic patients
Objectives:
Phenylketonuria is an inherited disorder of metabolism of the amino acid phenylalanine caused by a deficit of the enzyme phenylalaninhydroxylase. It is treated with a low-protein diet containing a low content of phenylalanine to prevent mental affection of the patient. It is a highly restrictive therapeutic diet using a mixture of amino acids without phenylalanine (AAM) in combination with low-protein products and low amount of natural proteins. The objective of the present study was to assess the compliance of our phenylketonuric (PKU) and hyperphenylalaninemic (HPA) patients; to determine the concentration of serum pre-albumin and selenium to discover the potential correlation between the amount of proteins in food and their metabolic control.Material and methods:
The experimental group contained altogether 174 patients treated at the Department of Pediatrics of Medical Faculty of Masaryk University and University Hospital in Brno, of which 113 were children (age 1–18), 60 with PKU and 53 with HPA and 61 were adults (age 18–42), 51 with PKU and 10 with HPA. All PKU patients given a low-protein diet took AAM. HPA patients given a low-protein diet were divided into two groups; in the first group AAM was prescribed and in the other it was not.Results:
We did not prove a statistically significant difference in the concentration of serum pre-albumin among the respective groups. We approved statistically significant difference in serum selenium concentrations of adult PKU and HPA patients (p=0.006; Mann-Whitney U test).Conclusion:
The preparation of therapeutic restrictive diet for PKU and HPA patients is very difficult, and can cause nutritional deficiency. Patients’ adherence to the diet is not always good. To attend to adherence of the therapeutic restrictive diet and search new ways of treatment and monitoring of the nutrition status of phenylketonuric and hyperphenylalaninemic patients at the same time is necessarily.Key words:
hyperphenylalaninemia, phenylketonuria, pre-albumin, selenium
Autoři: D. Procházková 1; L. Kolbová 1; Jiří Jarkovský 2
; H. Vinohradská 3; P. Konečná 1; Z. Doležel 1
Působiště autorů: Pediatrická klinika, Lékařská fakulta Masarykovy univerzity Brno a Fakultní nemocnice Brno, přednosta prof. MUDr. Z. Doležel, CSc. 1; Institut biostatistiky a analýz, Lékařská a Přírodovědecká fakulta Masarykovy univerzity, Brno, vedoucí doc. RNDr. L. Dušek, Dr. 2; Oddělení klinické biochemie, Fakultní nemocnice Brno, prim. doc. MUDr. M. Dastych, CSc., MBA 3
Vyšlo v časopise: Čes-slov Pediat 2012; 67 (3): 170-177.
Kategorie: Původní práce
Souhrn
Účel studie:
Fenylketonurie je dědičná porucha metabolismu aminokyseliny fenylalaninu, způsobená deficitem enzymu fenylalaninhydroxylázy v játrech. K léčbě se používá nízkobílkovinná dieta s nízkým obsahem fenylalaninu s cílem zabránit mentálnímu postižení pacienta. Cílem naší studie bylo posoudit complianci pacientů s fenylketonurií a hyperfenylalaninemií, zjistit jejich hodnoty prealbuminu a selenu v séru a odhalit možný vztah mezi množstvím bílkovin ve stravě a jejich metabolickou kontrolou.Metoda:
Soubor tvořilo celkem 174 pacientů, kteří jsou léčeni na Pediatrické klinice LF MU a FN Brno. Jednalo se o 113 dětí (1–18 let), 60 s PKU (25 děvčat a 35 chlapců) a 53 s HPA (26 děvčat a 27 chlapců) a 61 dospělých (18–42 let), 51 s PKU ( 36 žen a 15 mužů) a 10 s HPA (7 žen a 3 muži). Všichni pacienti s PKU na nízkobílkovinné dietě používali v dietě směsi aminokyselin bez fenylalaninu (AAM). Pacienti s HPA na nízkobílkovinné dietě byli rozděleni na dvě skupiny, první s preskribcí AAM a druhou, bez preskribce AAM.Výsledky:
Nezjistili jsme statisticky významný rozdíl pro koncentrace prealbuminu v séru ve vyšetřovaných skupinách. Neprokázali jsme statisticky významný rozdíl pro koncentrace selenu v séru v jednotlivých skupinách v dětském věku. Potvrdili jsme statisticky významný rozdíl v koncentracích selenu v séru mezi pacienty s PKU a HPA v dospělosti (p = 0,006; Mannův-Whitneyův U test).Závěr:
Terapeutická restriktivní dieta při PKU a HPA je vysoce náročná na přípravu, a to i finančně. Zároveň vystavuje pacienta riziku nutričního deficitu. Adherence pacientů k dietě není vždy dobrá. Dbát na dodržování terapeutické restriktivní diety a současně hledat nové cesty k léčbě a monitorování nutričního stavu u pacientů s PKU a HPA je nezbytně nutné.Klíčová slova:
hyperfenylalaninemie, fenylketonurie, prealbumin, selenÚVOD
Fenylketonurie (PKU, OMIM 261600) je dědičná porucha metabolismu aminokyseliny fenylalaninu (Phe), způsobená deficitem enzymu fenylalaninhydroxylázy (12q24.1, EC 1.14.16.1) v játrech. K léčbě se používá nízkobílkovinná dieta s nízkým obsahem fenylalaninu s cílem zabránit mentálnímu postižení pacienta [1]. Jedná se o vysoce restriktivní terapeutickou dietu s použitím směsi aminokyselin bez fenylalaninu (AAM) v kombinaci s nízkobílkovinnými výrobky a malým množstvím přirozených bílkovin. Čím více pacient omezuje přirozené bílkoviny, tím více je závislý na dodávce směsí aminokyselin bez fenylalaninu, které však mají horší účinnost při utilizaci ve srovnání s přirozenými bílkovinami. Malé množství přirozených bílkovin je většinou nižší kvality, tj. převažují bílkoviny rostlinného původu nad bílkovinami živočišného původu. Navíc určité množství pacientů, zvláště adolescentů a dospělých, neužívá směsi aminokyselin bez fenylalaninu v předepsaném a doporučeném množství [2]. Z těchto důvodů jsou pacienti s PKU a hyperfenylalaninemií (HPA) v riziku vývoje nutričního deficitu, zvláště bílkovin [3, 4, 5], na bílkovinách závislých mikronutrientů – selen, zinek, železo [6, 7, 8, 9], vitaminu A [10] a B12 [11, 12, 13], esenciálních mastných kyselin [14] a karnitinu [15]. Mnoho pacientů s PKU má redukovanou kostní hustotu, a to dokonce i tehdy, když mají doporučené množství vápníku, fosforu, vitaminu D, hořčíku a bílkovin ve stravě [16, 17]. Proto je u těchto pacientů užitečné hledat biomarkery k posouzení proteinového nutričního stavu. Jedním z nich je prealbumin v séru vzhledem k jeho poločasu 48 hodin oproti albuminu v séru, jehož biologický poločas činí 20 dnů. Nízká hodnota prealbuminu v séru byla u pacientů s PKU popsána i v minulosti, a to zvláště u menších dětí, pravděpodobně jako výsledek zvýšených nároků na růst a vývoj [3, 4, 5].
Selen působí v lidském těle jako antioxidant, účastní se metabolismu hormonů štítné žlázy, v reprodukci a imunitních reakcích [18]. Hladina selenu v tkáních je závislá na dodávce ve stravě rostlinného původu (česnek, cibule, pažitka, pórek, ořechy, ovesné vločky, hnědá rýže). Deficit selenu je obecně řídký a zahrnuje dvě onemocnění vyskytující se endemicky v Číně v oblastech, kde je půda chudá na selen: Keshanovu chorobu (endemická kardiomyopatie u dětí, adolescentů a žen) a Kashinovu-Beckovu chorobu (endemická osteoartritida, postihující klouby a růst) [19]. Nízké hodnoty selenu v séru jsou spojeny s řadou chronických onemocnění, jako je astma, nádorová a kardiovaskulární onemocnění [20], febrilní křeče u dětí [21] a dědičné poruchy metabolismu spojené s terapeutickou restriktivní dietou [6, 7]. Doporučená denní dávka selenu kolísá mezi 20–50 µg [7].
Cílem naší studie bylo posoudit complianci našich pacientů s PKU a HPA, zjistit jejich hodnoty prealbuminu a selenu v séru a odhalit možný vztah mezi množstvím bílkovin ve stravě a jejich metabolickou kontrolou. Naše studie představuje nejvyšší počet dosud publikovaných pacientů s touto problematikou.
MATERIÁL A METODA
Prospektivní studii tvořilo celkem 174 pacientů, kteří jsou léčeni na Pediatrické klinice Lékařské fakulty Masarykovy univerzity a Fakultní nemocnice Brno. Studie probíhala od října 2010 do června 2011. Před záhájením studie podepsal pacient či jeho zákonný zástupce souhlas se zařazením do studie. Souhlas etické komise se studií nebyl vyžádán, protože se jednalo o rutinní vyšetření v rámci běžné péče o pacienty s PKU a HPA.
Do studie bylo zařazeno 113 dětí (1–18 let), 60 s PKU (25 děvčat a 35 chlapců) a 53 s HPA (26 děvčat a 27 chlapců) a 61 dospělých (18–42 let), 51 s PKU ( 36 žen a 15 mužů) a 10 s HPA (7 žen a 3 muži). Probandi byli rozděleni na skupiny PKU a HPA podle vstupní hodnoty fenylalaninu v krvi z novorozeneckého screeningu: HPA - Phe 4–10 mg/dl, tj. 240–600 µmol/l, mírná PKU - Phe 10–20 mg/dl, tj. 600–1200 µmol/l, a klasická PKU - Phe více než 20 mg/dl, tj. 1200 µmol/l. Pacienti s HPA trpí mírnější formou onemocnění.
V našem metabolickém centru doporučujeme použití směsí aminokyselin bez fenylalaninu po opakovaném naměření fenylalaninu v krvi od 4 až 6 mg/dl, tj. 240–360 µmol/l.
Všichni pacienti s PKU na nízkobílkovinné dietě používali AAM. Pacienti s HPA na nízkobílkovinné dietě byli rozděleni na dvě skupiny, první s preskribcí AAM a druhou, bez preskribce AAM. Všichni probandi používali směsi aminokyselin bez fenylalaninu firmy Nutricia, a.s., Česká republika. Pro děti od 1 do 8 let jsme používali klasické směsi aminokyselin bez fenylalaninu, bez příchuti PAM-2 plv., Milupa PKU 2 prima plv. a Milupa PKU 2 mix plv., které byly rozděleny do 3–5 denních dávek. Jedna denní dávka mohla být tvořena dávkovanou formou preparátu s příchutí v prášku, tj. Anamix ananas/vanilka por plv. či Anamix čokoláda por plv. Pro pacienty od 8 let byly použity klasické směsi aminokyselin bez příchuti Milupa PKU 2 secunda plv, Milupa PKU 3 advanta plv nebo P-AM 3 plv ve 3–5 denních dávkách. U pacientů od 9 let mohla být jedna denní dávka hrazena dávkovanou formou s příchutí v prášku, např. Lophlex – pomeranč por sol nebo tekutou formulí, tzv. ready to drink formulas, např. Lophlex LQ – lesní ovoce por sol. Všechny výše uvedené potraviny pro zvláštní lékařské účely jsou obohaceny vitaminy a stopovými prvky.
Každý z probandů dodržoval terapeutickou restriktivní dietu podle individuálního dietního rozpisu, který byl sestaven nutriční terapeutkou. Množství předepsané směsi aminokyselin bez fenylalaninu záviselo na věku, pohlaví, potřebě bílkovin a toleranci fenylalaninu ve stravě podle nutričních doporučení (viz tab. 1) [3, 22]. V našem metabolickém centru činila doporučená dávka přirozených bílkovin pro pacienty s PKU: děti od 1 roku do 6 let 5–6 g/den, 6–10 let 5–8 g/den, 10–15 let 5–16 g/den, u adolescentů a dospělých 9–16 g/den [23]. Množství přirozených bílkovin u probandů s HPA a AAM ve stravě činilo 12–16 g/den. Rozdíl mezi doporučeným množstvím AAM a požadavky probanda či rodičů na preskribci byl monitorován. Probandi s HPA bez preskribce AAM omezovali ve stravě celá vejce a maso. Měli v jídelníčku 2 porce vařeného masa za týden. Jedna porce masa: batole 40 g, předškolní věk 50–60 g, školní věk 70–80 g, dospělí 80–90 g [18]. Gravidní pacientky nebyly součástí studie. Žádný proband během studie nepoužíval lék či potravinový doplněk se stopovými prvky.
Tab. 1. Nutriční doporučení pro pacienty s PKU a HPA (adaptováno podle Rocha a Elsas, Acosta [3, 22]). ![Nutriční doporučení pro pacienty s PKU a HPA (adaptováno podle Rocha a Elsas, Acosta [3, 22]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/643810f0835157fbd8694cc359e5e645.png)
Metabolická kontrola pacienta byla definována jako medián koncentrací fenylalaninu v séru za 6 měsíců zpětně, měřeno ze suché krevní kapky metodou vysokoúčinné kapalinové chromatografie – HPLC. Současně byla měřena i hodnota tyrosinu. Množství vzorků suchých kapek u jednoho pacienta záviselo na věku, četnosti změn v terapeutické restriktivní dietě a compliance jednotlivého pacienta. Obvyklá frekvence zasílání suchých kapek byla jedenkrát za 2–4 týdny. Doporučené hodnoty fenylalaninu v krvi závisely na věku: 2–6 mg/dl (120–360 μmol/l) pro děti do 10 let, 2–10 mg/dl (120–600 μmol/l) pro děti >10 let a pro dospělé 2–15 mg/dl (120–900 μmol/l). Nezískali jsme vzorky suchých kapek od dospělých probandů bez AAM ve stravě.
Hodnota prealbuminu v krvi byla měřena ve stejné laboratoři za použití stejné metody – imunoturbidimetrie – pro všechny pacienty za 6 měsíců po zahájení monitorování suchých kapek stran hodnoty fenylalaninu v krvi. Referenční hodnoty prealbuminu naší laboratoře: děti 0,14–0,37 g/l, dospělí 0,2–0,4 g/l.
Selen v séru byl měřen metodou atomové absorpční spektrometrie stejný den s prealbuminem v séru u všech pacientů ve stejné laboratoři. Referenční hodnoty selenu naší laboratoře: děti 0,7–1,24 µmol/l, dospělí 0,7–1,24 µmol/l.
Statistická analýza: pro popis spojitých dat bylo použito mediánu a 5–95percentilového rozsahu, popřípadě průměru a směrodatné odchylky. Pro testování statistické významnosti mezi skupinami pacientů pro spojitá data byl použit Mannův-Whitneyův a Kruskalův-Wallisův test.
VÝSLEDKY
Průměrné hodnoty prealbuminu ± SD (směrodatná odchylka) v séru: děti PKU s AAM 0,22 ± 0,05 g/l, HPA 0,20 ± 0,05 g/l, HPA bez AAM 0,18 ± 0,05 g/l, HPA s AAM 0,21 ± 0,04 g/l.
Dospělí: PKU s AAM 0,28 ± 0,06 g/l, HPA 0,26 ± 0,06 g/l, HPA bez AAM 0,26 ± 0,06 g/l, HPA s AAM 0,27 ± 0,06 g/l.
Průměrné hodnoty selenu ± SD v séru v jednotlivých skupinách: děti PKU s AAM 0,58 ± 0,24 µmol/l, HPA 0,64 ± 0,18 µmol/l, HPA bez AAM 0,67 ± 0,15 µmol/l, HPA s AAM 0,63 ± 0,19 µmol/l. Dospělí: PKU s AAM 0,63 ± 0,24 µmol/l, HPA 0,90 ± 0,18 µmol/l, HPA bez AAM 0,95 ± 0,25 µmol/l, HPA s AAM 0,88 ± 0,17 µmol/l.
Srovnání koncentrací prealbuminu a selenu v séru a mediánu Phe v jednotlivých skupinách u dětí a u dospělých udávají tabulky 2 a 3.
Tab. 2. Srovnání koncentrací prealbuminu a selenu v séru v jednotlivých skupinách I. 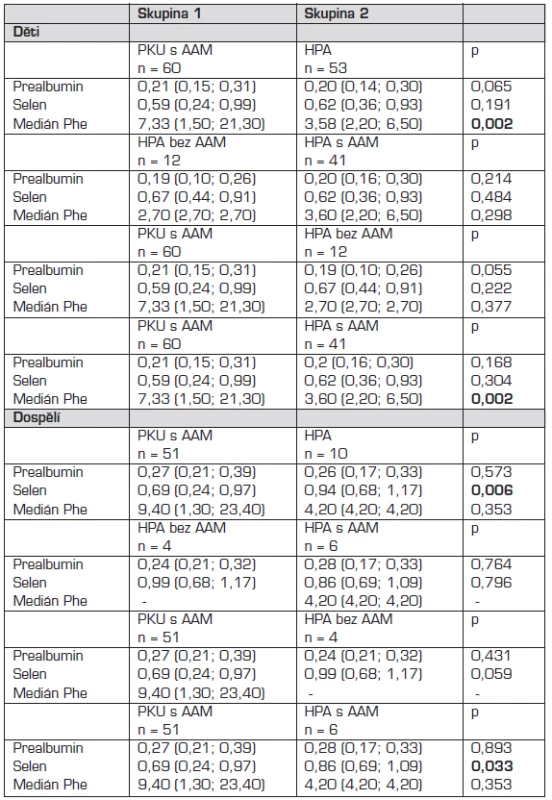
*Mannův-Whitneyův U test, medián (5.; 95. percentil) PKU – fenylketonurie, HPA – hyperfenylalaninemie, AAM – směs aminokyselin bez fenylalaninu, prealbumin g/l, selen μmol/l, Phe – fenylalanin mg/dl Tab. 3. Srovnání koncentrací prealbuminu a selenu v séru v jednotlivých skupinách II. 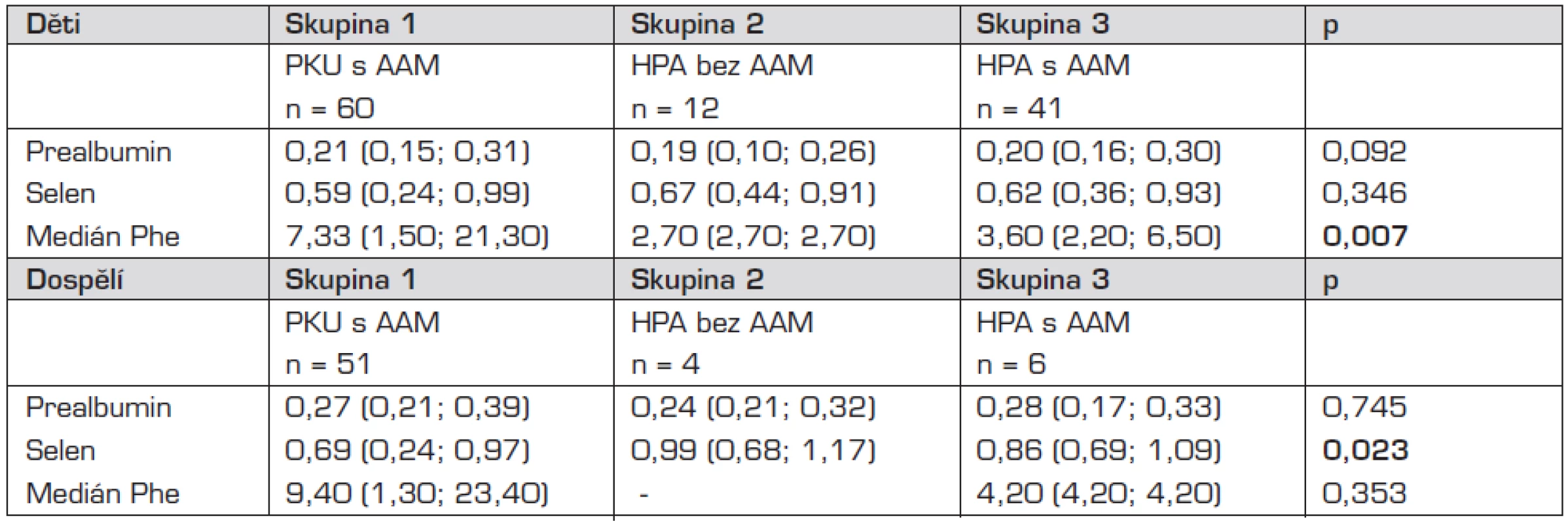
*Kruskalův-Wallisův test, medián (5.; 95. percentil) PKU – fenylketonurie, HPA – hyperfenylalaninemie, AAM – směs aminokyselin bez fenylalaninu, prealbumin g/l, selen μmol/l, Phe – fenylalanin mg/dl Při srovnání hodnot prealbuminu v séru v jednotlivých skupinách jsme neprokázali statisticky významný rozdíl.
Prokázali jsme statisticky významný rozdíl v hodnotách selenu v séru mezi pacienty s PKU a HPA v dospělosti (p = 0,006; Mannův-Whitneyův U test).
Nalezený statisticky významný rozdíl v hodnotách mediánu Phe v jednotlivých skupinách probandů s PKU a HPA vyplývá z tíže onemocnění PKU či HPA a compliance pacienta s PKU.
DISKUSE
Průměrné koncentrace prealbuminu v séru u dospělých s PKU a HPA byly vyšší ve srovnání s dětskou skupinou. Takové poměry nacházíme i ve zdravé populaci [3]. Výraznější bylo snížení u dětí, které při HPA nepoužívají AAM ve stravě. I když jsme neprokázali statisticky významný rozdíl pro hodnoty prealbuminu v séru v jednotlivých skupinách, je z výsledků zřejmé, že pacienti s PKU a HPA mají tendenci ke globální proteinové nedostatečnosti. V denní praxi je vyšší péče soustřeďována na pacienty s klasickou těžkou PKU. Výsledky naší práce však ukazují, že i pacienti s mírnou HPA jsou v riziku bílkovinného nutričního deficitu, a to především tehdy, když nepoužívají AAM ve stravě, omezují maso a vejce, jejich strava je bohatá jen na ovoce a zeleninu a připomíná stravu laktovegetariána či vegana. Podobně pak vypadá i strava dospělého pacienta s PKU, který nízkobílkovinnou dietu uvolní a přestane používat pravidelně AAM. V těchto případech předepsané množství směsi aminokyselin v ordinaci nereflektuje jejich skutečný příjem.
Dalším možným mechanismem, který vede ke snížené hladině prealbuminu v krvi u HPA a PKU pacientů, může být otázka biologické dostupnosti aminokyselin získaných ze směsí aminokyselin bez fenylalaninu [24].
Nízká hodnota prealbuminu v séru byla u pacientů s PKU popsána v minulosti, a to zvláště u menších dětí, pravděpodobně jako výsledek zvýšených nároků na růst a vývoj [3, 4, 5]. Rocha zpětně hodnotil skupinu 69 pacientů s PKU, 30 žen a 39 mužů ve věku od 1 do 27 let [3]. Čtrnáct pacientů mělo mírnou hyperfenylalaninemii, 32 mírnou PKU a 19 klasickou PKU. Při posuzovaní prealbuminu v krvi pomocí Z-skóre bylo zjištěno, že celkem 9 pacientů, tj. 13 %, mělo nedostatečný příjem bílkovin ve stravě. Všichni pacienti byli mladší 15 let. Nejčastěji byli nedostatečným příjmem bílkovin postižení pacienti s mírnou hyperfenylalaninemií. V největším riziku byli pacienti, kteří sice omezovali ve stravě maso a vejce, avšak nepoužívali AAM. Hodnoty prealbuminu v krvi byly vyšší u pacientů starších 15 let v souladu s naším pozorováním.
Možným nástrojem k hodnocení proteinového nutričního stavu u pacientů s HPA a PKU může být zhodnocení jídelníčku probanda nutriční terapeutkou. Jedná se o levnou a snadnou metodu. Avšak pouze za hospitalizace pacienta v nemocnici máme přesnou informaci o tom, jak jeho jídelníček skutečně vypadá. V reálném životě jsme odkázáni pouze na informace pacienta nebo jeho rodiny. Ve skutečnosti náš pacient compliantní být nemusí. Navíc pacienti používají různé tabulky s různým obsahem fenylalaninu ve stravě a složení potravin na obalech nemusí často odpovídat realitě. Rozpor mezi doporučeným množstvím směsi aminokyselin bez fenylalaninu v dietním rozpisu a sníženým požadavkem pacienta či rodičů na preskribci AAM by měl být prvním varovným signálem rizika možného proteinového deficitu.
Další možností vyhodnocení proteinového nutričního stavu je antropometrické měření: výška, hmotnost, BMI a obvod hlavy u dětí do 2 let. Tato vyšetření rutinně provádíme při každé ambulantní kontrole. Dvě děti v našem souboru měly BMI na 10. percentilu a jedno dítě pod 3. percentil. U jedné dospělé probandky byla hodnota BMI pod 18,5 (tj. 15,8). Obě probandky v pásmu podvýživy dosahovaly normálních hodnot prealbuminu v séru, hladina selenu v séru byla v obou případech snížena.
Biochemickými markery proteinové nedostatečnosti mohou být kromě hodnoty prealbuminu v krvi také poměr celková bílkovina/albumin, aminogram v séru, IGF-1 a retinol binding protein [18]. K zjištění tělesného složení lze využívat kostní denzitometrii či metody bioelektrické impendační analýzy [18]. Obě jmenované metody jsou ve FN Brno dostupné, ale dosud je rutinně u pacientů s PKU a HPA nevyužíváme.
V současné době neexistuje ve světě a v rámci Evropské unie konsensus o vstupní hodnotě fenylalaninu v krvi, od které má být pacient léčen nízkobílkovinnou dietou bez fenylalaninu. Názory se různí a kolísají mezi 4–10 mg/dl, tj. 240–600 µmol/l. Zahájení léčby závisí od zvyklosti jednotlivých metabolických center. Navíc v poslední době se čas od vyslovení podezření na HPA či PKU a potvrzením diagnózy výrazně zkracuje zavedením nových metod novorozeneckého screeningu. Hodnota fenylalaninu v krvi z novorozeneckého screeningu není nejvyšší možná hladina fenylalaninu v krvi u konkrétního postiženého jedince. V našem metabolickém centru doporučujeme použití směsí aminokyselin bez fenylalaninu od 4–6 mg/dl, tj. 240–360 µmol/l. Vycházíme ze skutečnosti, že doporučená hladina fenylalaninu v krvi při léčbě PKU u nejmenších dětí zahrnuje hodnoty 1–4, max. 6 mg/dl, tj. max. 240–360 µmol/l [23].
Neprokázali jsme statisticky významný rozdíl pro hodnoty selenu v séru v jednotlivých skupinách v dětském věku. Zjistili jsme statisticky významný rozdíl v hodnotách selenu v séru mezi pacienty s PKU a HPA v dospělosti (p = 0,006; Mannův-Whitneyův U test). Při podrobném rozboru však zjistíme, že statisticky významný rozdíl (p = 0,033; Mannův-Whitneyův U test) selenu v séru byl průkazný mezi pacienty s PKU a HPA používajících AAM ve stravě. Můžeme se domnívat, že výsledek byl opět ovlivněn uvolněním nízkobílkovinné diety v dospělosti, kdy doporučené a předepsané množství směsi aminokyselin obohacené o stopové prvky neodpovídá jejich skutečnému pravidelnému příjmu.
Na možný nedostatečný příjem AAM ve stravě lze usuzovat u pacientů s PKU a HPA i podle hodnoty tyrosinu v krvi [25]. Avšak z 68 dětí s prokázaným deficitem selenu v séru v naší studii byl medián hodnot tyrosinu v séru pod 0,8 mg/dl, tj. dolní hranicí normy naší laboratoře, zjištěn u 8 dětí. Z 24 dospělých probandů pak pouze u jednoho. Z tohoto úhlu pohledu se dá říci, že normální hladina tyrosinu v séru deficit selenu nevylučuje.
Deficit selenu v séru byl u pacientů s PKU v literatuře opakovaně popsán [6, 7, 26]. AAM se z tohoto důvodu selenem obohacují. Liší se i zdroje selenu v přirozené stravě u PKU pacientů a ve zdravé populaci. Hlavními zdroji selenu jsou při nízkobílkovinné dietě ovoce a zelenina, zatímco ve zdravé populaci cereálie, vejce, maso a mléčné výrobky [6, 13], které jsou při PKU dietě významně omezeny. Z dlouhodobých vlivů na hladinu selenu v séru se uplatňují věk, pohlaví a rasa. Existují i regionální rozdíly, dané koncentrací selenu v pitné vodě a lokálně produkovaných potravinách. Česká republika patří mezi oblasti s nedostatkem selenu v půdě a tedy i v potravě [27].
V dětském věku je hladina selenu v séru vyšší u starších dětí oproti dětem mladším jednoho roku [28]. Naše výsledky ukazují v souladu s literárními zdroji, že dlouhodobá terapeutická restriktivní dieta při PKU a HPA pak reflektuje neschopnost dosáhnout vyšších hladin selenu v séru se zvyšujícím se věkem pacienta [28]. U těhotných žen bývá hladina selenu v séru snížena, neboť plod selen kumuluje [18]. Tuto skutečnost musíme mít na paměti zvláště u gravidních pacientek s PKU.
Selen funguje jako kofaktor pro enzym glutathionperoxidázu a thyroxindeiodinazu. Měření aktivity glutathionperoxidázy a koncentrace selenu v erytrocytech je jistě přínosné k posouzení deficitu selenu v lidském těle, ale pro běžnou praxi velmi náročné [7]. Není známo, jaká je hodnota glutathionperoxidázy a selenu v buňkách a tkáních po zahájení podávání selenu při zjištěném deficitu. Neexistuje jednotný názor na optimální formu podávání selenu při prokázaném deficitu. Vzniká i riziko předávkování selenem při dlouhodobém podávání [7]. V našem souboru probandů jsme v případě prokázaného deficitu doporučili dbát na doporučené množství AAM v jídelníčku. Možným řešením jsou i potravinové doplňky obsahující selen. Získat takový preparát pro nejmenší věkové skupiny je obtížné. Potravinové doplňky často obsahují i další stopové prvky či vitaminy a nejsou hrazeny z prostředků veřejného zdravotního pojištění.
ZÁVĚR
Terapeutická restriktivní dieta při PKU a HPA je vysoce náročná na přípravu i finančně. Zároveň vystavuje pacienta riziku nutričního deficitu. Adherence pacientů k dietě není vždy dobrá. Dbát na dodržování terapeutické restriktivní diety a současně hledat nové cesty k léčbě a monitorování nutričního stavu u pacientů s PKU a HPA je nezbytně nutné. Pravidelné sledování tělesných ukazatelů (výška, hmotnost, BMI) a monitorování fenylalaninu a tyrosinu v séru je rutinou v péči o tyto pacienty.
Zavedení pravidelného monitorování prealbuminu (1krát za 3–6 měsíců) a selenu (1krát za 6–12 měsíců) do běžné denní praxe u pacientů s PKU a HPA považujeme na základě výsledků naší práce za velmi přínosné. Domníváme se, že by se mělo jednat vzhledem ke zvýšeným nárokům na růst a vývoj zejména o děti s PKU a HPA, které porušují dietu, a také o pacientky v přípravě na těhotenství a v graviditě. Nelze nezmínit, že oproti albuminu v séru se jedná v případě prealbuminu o vyšetření finančně náročnější. Selen v séru doporučujeme monitorovat také u dospělých probandů s PKU a HPA, kteří rozvolní nízkobílkovinnou dietu a množství AAM ve stravě neodpovídá množství doporučenému lékařem.
Poděkování patří všem pracovníkům Oddělení klinické biochemie, Fakultní nemocnice Brno za zpracování biologického materiálu našich pacientů a firmě Nutricia, a.s., Česká republika za finanční podporu při sběru a statistickém zpracování dat.
Došlo: 22. 1. 2012
Přijato: 22. 4. 2012
Doc. MUDr. Dagmar Procházková, Ph.D.
Pediatrická klinika LF MU a FN Brno
Černopolní 9
625 00 Brno
e-mail: prochazkovad@fnbrno.cz
Zdroje
1. Procházková D. Současné možnosti léčby hyperfenylalaninémie. Čes-slov Pediat 2010; 65 : 452–458.
2. Crone MR, van Sprosen FJ, Oudshoorn K, et al. Behavioral factors related to metabolic control in patients with phenylketonuria. J Inherit Metab Dis 2005; 28 : 627–637.
3. Rocha JC, Almeida MF, Carmona C, et al. The use od prealbumin concentrations as a biomarker of nutritional status in treated phenylketonuric patients. Ann Nutr Metab 2010; 56 : 207–211.
4. Arnold GI, Vladutiu CJ, Kirby RS, et al. Protein insuffiency and linear growth restriction in phenylketonuria. J Pediatr 2002; 141 : 243–246.
5. Dobbelaere D, Michaud L, Debrabander A, et al. Evaluation of nutritional status and pathophysiology of growth retardation in patients with phenylketonuria. J Inherit Metab Dis 2003; 26 : 1–11.
6. Reilly C, Barrett JE, Patterson CM, et al. Trace element nutrition status and dietary intake of children with phenylketonuria. Am J Clin Nutr 1990; 52 : 159–165.
7. Van Bakel MM, Printzen G, Wermuth B, et al. Antioxidant and thyroid status in selenium-deficient phenylketonuric and hyperphenylalaninemic patients. Am J Clin Nutr 2000; 72 : 976–981.
8. Miranda da Cruz BD, Seidler H, Widhalm K. Iron status and iron supplementation in children with classical phenylketonuria. J Am Coll Nutr 1993; 12 : 531–536.
9. Bodley JL, Austin VJ, Hanley WB, et al. Low iron status in infants and children with treated phenylketonuria: a population at risk for iron-deficiency anaemia and associated cognitive deficits. Eur J Pediatr 1993; 152 : 140–143.
10. Acosta PB. Nutrition studies in treated infants and children with phenylketonuria: vitamins, minerals, trace elements. Eur J Pediatr 1996; 155: S136–139.
11. Hvas AM, Nexo E, Nielsen JB. Vitamin B12 and vitamin B6 suplementation is needed among adults with phenylketonuria (PKU). J Inherit Metab Dis 2006; 29 : 47–53.
12. Robinson M, White FJ, Clary MA, et al. Increased risk of vitamin B12 deficiency in patients with phenylketonuria on an unrestricted or relaxed diet. J Pediatr 2000; 136 : 545–547.
13. Vugteveen I, Hoeksma M, Monsen ALB, et al. Serum vitamin B12 concentrations within reference values do not exclude functional vitamin B12 deficiency in PKU patients of various ages. Mol Genet Metabol 2011; 102 : 13–17.
14. Koletzko B, Sauerwald T, Demmelmair H, et al. Dietary long - chain polyunsaturated fatty acid supplementation in infants with phenylketonuria: a randomized controlled trial. J Inherit Metab Dis 2007; 30 : 326–332.
15. Vilaseca MA, Briopnes P, Ferrari I, et al. Controlled diet in phenylketonuria may cause serum carnitine deficiency. J Inherit Metab Dis 1993; 16 : 101–104.
16. Zeman J, Bayer M, Stepan J. Bone mineral density in patients with phenylketonuria. Acta Pediatr 1999; 88 : 1348–1351.
17. Modan-Moses D, Vered I, Schwarz G. Peak bone mass in patients with phenylketonuria. J Inherit Metab Dis 2007; 30 : 202–208.
18. Svačina S. Poruchy metabolismu a výživy. 1. vyd. Praha: Galén, 2010 : 61–71, 447.
19. Ge K, Yang G. The epidemiology of selenium deficiency in the etiological study of endemic diseases in China. Am J Clin Nutr 1993; 57 : 259S–263S.
20. Kohrle J, Brigelius-Flohe R, Bock A, et al. Selenium in biology: facts and medical perspectives. Biol Chem 2000; 381 : 849–864.
21. Mahyar A, Ayzi P, Falladi M, et al. Correlation between serum selenium level and fibrile seizures. Pediatr Neurol 2010; 43 : 331–334.
22. Shils ME, Olson JA, Shike M, et al. Modern Nutrition in Health and Disease. 9th ed. Baltimore: Williams and Wilkins, 1999 : 1003–1056.
23. Blau N, Hoffmann GF, Leonard J, Clarke JTR. Physician´s Guide to the Treatment and Follow –up of Metabolic Diseases. 1st ed. Berlin, Heidelberg: Springer-Verlag, 2006 : 28.
24. Gropper SS, Gropper DM, Acosta PB. Plasma amino acid response to ingestion of L-amino acids and whole protein. J Pediatr Gastroenterol Nutr 1993; 16 : 143–150.
25. Bross R, Ball RO, Clarke JTR, Pencharz PB. Tyrosine requirements in children with classical PKU determined by indicator amino acid oxidation. Am J Physiol Endocrinol Metab 2000; 278 : 195–201.
26. Barretto JR, Silva RL, Leite ME, et al. Poor zinc and selenium status in phenylketonuric children and adolescents in Brazil. Nutr Res 2008; 28 : 208–211.
27. Kvíčala J. Zvýšení příjmu mikronutrientu selenu – utopie, fikce, prozřetelnost či nutnost. II. část. Interní Med 2003; 6 : 295–300.
28. Muntau AC, Streiter M, Kappler M, et al. Age-related reference values for serum selenium concentrations in infants and children. Clin Chem 2002; 48 : 555–560.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek Čtení o logopedii – 1. částČlánek Nedonošený novorozenec
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2012 Číslo 3- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Incidence dyslipidemií v populaci dětí s obezitou
- Deficit pyruvátkinázy v dětském věku
- Neobvyklé manifestace infekce parvovirem B19 u dětí
- Vyšetření sérové koncentrace prealbuminu a selenu ke sledování nutričního stavu pacientů s fenylketonurií a hyperfenylalaninemií
- Variabilita klinické manifestace norovirové infekce u novorozence – od perakutní nekrotizující enterokolitidy po asymptomatický průběh
- Benigní infantilní křeče asociované s norovirovou gastroenteritidou
- Současné užití léků blokujících adrenergní receptory beta u dětí se srdečním selháním
- Čtení o logopedii – 1. část
- Nedonošený novorozenec
- Poruchy vnitřního prostředí novorozenců
- Vzpomínky na budoucnost: Nefrologie na II. dětské klinice FDL UK a na Dětské klinice FN Pod Petřínem v Praze
- Primář MUDr. Petr Tax šedesátiletý
- VI. Martinské neonatologické dni
- X. český pediatrický kongres s mezinárodní účastí
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Nedonošený novorozenec
- Neobvyklé manifestace infekce parvovirem B19 u dětí
- Poruchy vnitřního prostředí novorozenců
- Deficit pyruvátkinázy v dětském věku
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



