-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Folikulový lymfóm a lymfóm z plášťových buniek v biopsiách orgánov žalúdočno-črevnej oblasti
Follicular and mantle cell lymphoma diagnosed in biopsies of gastroenterocolic region
The authors present a retrospective analysis of follicular lymphomas (FL) and mantle cell lymphomas (MCL) diagnosed according to the WHO classification (2008) in consecutive biopsies of GI organs in a period of 11 years. The series includes 18 patients with FL verified in 22 biopsies and 44 patients with MCL diagnosed in 54 biopsies. FL represented always a solitary tumor, most often – up to ¾ of all the cases – of a small intestine, more often in its jejunoileal than duodenal parts. The biopsies were obtained almost equally by endoscopical approach, they were usually mucosal and rarely polypectomic, as well as by surgical resections (54,5 % and 45,5 % of the cases respectively). FL of grade 3 was identified in approximately 11 % of the cases, while majority of the patients showed FL of grade 1 or 2. Only 2 patients with duodenal FL relapsed and bioptically verified recidives did not show signs of a high grade transformation. Although it was difficult to identify a nodular growth pattern in more common small biopsies, a typical histomorphology and phenotype mostly allowed the FL diagnosis in the majority of the cases. The FL diagnosis had to be supported by detection of BCL2 translocation only in one case. MCL appeared most often in the stomach and large intestine, the small intestinal cases represented less than 23 %. In ¼ of the patients the lymphoma was multifocal and manifested as lymphomatoid polyposis affecting most often both large and small intestine. In a majority of the MCL patients, the diagnosis was done in mucosal and polypectomic endoscopic biopsies, surgical intervention and resection was recorded in less than 10 % of the cases. Most of the patients showed conventional „centrocytic“ MCL morphology and approximately ¼ of the cases showed blastoid MCL. The rebiopsies of 9 patients revealed a relaps of the disease which was locoidentical in 5 of them; in other 4 patients the biopsies documented a dissemination to other GI organs. The blastic transformation was recognized only in one of the relapsing patients. In contrast to FL, in 18 % of the biopsies the MCL diagnosis required a CCND1 gene rearrangement detection by FISH. In summary both of the studied GI lymphomas showed different and heterogenous incidence, clinical manifestation and necessity to support the biopsy diagnosis also by FISH examination. The correct FL and MCL diagnosis represents a conditio sine qua non for an indication of different therapeutical modalities as well as for the prognostic stratification of the patients.
Keywords:
extranodal non-Hodgkin lymphoma – gastrointestinal tract – follicular lymphoma – mantle cell lymphoma – marginal zone B-cell lymphoma of MALT-type – reactive lymphoid follicular hyperplasia
Autoři: Lukáš Plank 1,2; Tomáš Balhárek 1,2; Peter Szépe 1,2
Působiště autorů: Konzultačné centrum bioptickej diagnostiky ochorení krvotvorby v SR Ústav patologickej anatómie Jesseniovej lekárskej fakulty Univerzity Komenského a Univerzitnej nemocnice v Martine 1; Konzultačné centrum bioptickej diagnostiky ochorení krvotvorby v SR Martinské bioptické centrum, s. r. o. v Martine 2
Vyšlo v časopise: Čes.-slov. Patol., 52, 2016, No. 1, p. 31-39
Kategorie: Původní práce
Souhrn
V práci sa predkladá retrospektívna analýza prípadov folikulového lymfómu (FL) a lymfómu z plášťových buniek (MCL) diagnostikovaných podľa klasifikácie SZO (2008) v konzekutívnych biopsiách orgánov žalúdočnočrevnej oblasti počas 11 rokov. Celkove išlo o 18 pacientov s FL verifikovaným v 22 biopsiách a 44 pacientov s MCL diagnostikovaným v 54 biopsiách. FL bol vždy diagnostikovaný ako solitárny nádor, najčastejšie - až v ¾ prípadov - v tenkom čreve, častejšie v jejunoilickej než duodenálnej oblasti. Približne rovnako často išlo o biopsiu endoskopickú (54,5 %), obyčajne mukozálnu a zriedka polypektomickú, resp. resekčnú (45,5 % prípadov). Pri prevahe FL s nízkym stupňom malignity bol FL G3 identifikovaný v pribl. 11 % prípadov. 4 lokoidentické recidívy verifikované biopsiou sa vyskytli len u 2 pacientov s duodenálnym FL a nevykazovali známky blastickej transformácie. Napriek problémom s identifikáciou nodulárneho rastu v malých bioptických vzorkách morfologický obraz a typický fenotyp vyžadovali len v jednom prípade podporu diagnózy dôkazom prestavby BLC2 génu metódou FISH. MCL sa najčastejšie vyskytoval v žalúdku a hrubom čreve, v tenkom čreve v menej než v 23 % prípadov. Až u ¼ pacientov bol verifikovaný ako multifokálny nádor, s obrazom lymfomatoidnej polypózy postihujúcej najčastejšie súčasne hrubé a tenké črevo. Dominovali mukozálne alebo polypektomické endoskopické biopsie, chirurgická intervencia s resekciou bola potrebná v menej ako 10 % prípadov. Zatiaľčo v ¼ prípadov išlo o blastoidné varianty, tak častejší bol konvenčný MCL. Recidívy sa vyskytli až u 9 pacientov, 5x boli lokoidentické a 4x viedli k disseminácii do iných orgánov žalúdočnočrevnej oblasti, pričom blastická transformácia sa vyskytla len u jedného pacienta. Až v 18 % biopsií sme diagnózu MCL podporili aj dôkazom prestavby CCND1 génu FISH analýzou. Celkove možno konštatovať rozdielnosti výskytu a klinickej prezentácie FL a MCL v žalúdočnočrevnej oblasti a potrebu podporiť bioptickú histologickú a fenotypovú diagnostiku aj FISH analýzami, najmä v prípade MCL. Správna diagnostika tak FL, ako aj MCL je dôležitá tak pre pre indikáciu rozdielnych terapeutických modalít oboch ochorení, ako aj pre prognostickú stratifikáciu pacientov.
Kľúčové slová:
extranodálny non-Hodgkinov lymfóm – gastrointestinálny trakt – folikulový lymfóm – lymfóm z plášťových buniek – lymfóm z B-buniek marginálnej zóny MALT-typu – reaktívna lymfatická folikulová hyperplázia
Gastrointestinálny trakt (ďalej GIT) je najčastejším miestom výskytu extranodálnych malígnych lymfómov (ML; 1-3). Medzi v ňom primárne najčastejšie vznikajúce ML B-pôvodu aj našej populácie patrí (extranodálny) lymfóm z B-buniek marginálnej zóny MALT-typu (ďalej len „MZBL MALT-typu“) a obyčajne s jeho transformáciou súvisiaci difúzny veľkobunkový B-lymfóm (DLBCL; 1,2). Ďalšie ML B-pôvodu GITu, a to folikulový lymfóm (FL) a lymfóm z buniek plášťovej zóny (MCL) sú zriedkavejšie. Sú buď primárne alebo sekundárne, keď postihujú GIT v rámci diseminácie systémového ochorenia (4-5).
Kým rastové, cytologické a fenotypové črty DLBCL GITu zväčša nekomplikujú jeho typizáciu, tak bioptická diagnostika a vzájomná diferenciálna diagnostika FL a MCL je zložitejšia a zahŕňa aj ich odlíšenie od MZBL MALT-typu, reaktívnej lymfatickej folikulovej hyperplázie, niekedy aj od „blastických“ ML B-pôvodu. Z hľadiska klinickej praxe sa tak v prvom kroku vyžaduje odlíšenie nenádorovej od nádorovej lymfoproliferácie a v druhom kroku rozlíšenie medzi FL, MCL a MZBL MALT-typu. Tieto tri ML GITu predstavujú totiž biologicky a prognosticky rozdielne ochorenia vyžadujúce indikácie rozdielnych terapeutických modalít. Z hľadiska bioptickej praxe ich spájajú dve črty: nodulárny rastový vzor lymfoproliferácie prítomný prinajmenej v začiatočných fázach nádorového ochorenia a obyčajne prevládajúca malobunková morfológia. Naopak, niektoré typy MCL a FL grade 3 (G3) charakterizuje „blastická“ morfológia, čo niekedy, najmä v prípade MCL, môže viesť k nesprávnej diagnóze.
Kritériá bioptickej diagnostiky a diferenciálnej diagnostiky FL a MCL nielen gastroenterokolickej oblasti, rovnako ako MZBL MALT-typu podľa platnej klasifikácie ML (2) sú všeobecne známe. Prihliadajúc na relatívnu zriedkavosť FL a MCL GITu však ich diagnostika v rutínnej praxi na hematopatológiu nešpecializovaného patológa môže byť problematická. Navyše tieto nádory nie sú klinicky a ani morfologicky stacionárne, lebo v priebehu ochorenia – napr. progresii, recidíve a rovnako aj po liečbe vykazujú spektrum rôznych rastových a histocytologických čŕt. To isté platí aj pre biopsie odoberané s cieľom sledovania efektu ich liečby. Nami predložená práca nemá „akademické“ ambície dopĺňať vedecky overené a v dostupných celosvetovo akceptovaných textoch definujúce prvky klasifikácie MCL alebo FL (2-3). Naopak, v rámci analýzy v našom registri evidovaných nodulárne rastúcich ML B-pôvodu diagnostikovaných v žalúdočnočrevnej oblasti sme boli vedení snahou o sumarizáciu poznatkov použiteľných pri ich diagnostike v rutínnej bioptickej praxi aj v nešpecializovaných pracoviskách nášho odboru.
MATERIÁL A METODIKA
Všetky prípady tu retrospektívne analyzovanej kohorty pacientov s biopticky verifikovaným FL resp. MCL gastroenterokolickej oblasti boli vybrané z elektronického registra pracoviska. Kritériom selekcie boli morfologické kódy ICD-O klasifikácie pre FL a MCL a topografické kódy pre uvedené orgány (v rámci spektra topografického kódu T151-T154). Identifikované prípady boli diagnostikované v konzekutívnej sérii v období 01/2004 – 08/2015. V každej z biopsií bol k dispozícii štandardný panel histologických vyšetrení parafínových rezov (farbenie HE a podľa Giemsu, impregnácia podľa Gomoriho a PAS reakcia). Každá z uvedených diagnóz bola verifikovaná aktuálne v čase diagnózy platným imunohistochemickým diagnostickým a diferenciálno - diagnostickým panelom. Minimálny štandard v celom sledovanom období zahŕňal dôkaz CD20, CD3, CD5, CD10, bcl2, cyklínu D1 a ľahkých reťazcov c-Ig, tento základný panel bol postupne dopĺňaný o ďalšie štandardizované parametre (dôkaz bcl6, GCET, SOX11, CD23 a i.). Podľa potreby boli v aktuálnom čase diagnózy vyšetrené aj proliferačná aktivita určením Ki-67 indexu, resp. prestavba génov IgH, BCL2, BCL6 a CCND1 metódou i-FISH. Ďalej boli analyzované dostupné klinické údaje a ostatné vyšetrenia pacientov v našom bioptickom registri (vrátane stagingových biopsií kostnej drene) v snahe identifikovať, či išlo o primárny ML žalúdočnočrevnej oblasti, alebo o systémové generalizované ochorenie. Súčasne sme zaznamenali aj spôsob získania bioptického materiálu s rozdelením na endoskopické mukozálne resp. polypektomické a resekčné vzorky.
Zistené výsledky boli konfrontované s dvomi „kontrolnými skupinami“ - náhodne vybranými skupinami konzekutívnych biopsií pacientov z obdobia 2013 - 2014, a to:
- a) 10 pacientov s nami biopticky verifikovaným lymfómom z B-buniek marginálnej zóny MALT-typu ML žalúdočnočrevnej oblasti, ako aj
- b) 10 pacientov s nami biopticky diagnostikovanou reaktívnou lymfatickou folikulovou hyperpláziou v uvedených orgánoch.
Vo všetkých prípadoch boli vyhodnotené rastové vzory lymfoproliferácie, a to nodulárny (s typickou perinodulárnou kresbou retikulínových vlákien), pseudonodulárny (bez obkrúženia histologicky sugestívnych uzlovitých formácií nádoru), difúzny, alebo zmiešaný, rovnako aj histocytologické a fenotypové parametre lymfoidných buniek. Histocytologické črty zahŕňali grading FL, resp. rozdelenie MCL na typ konvenčný verzus blastoidný MCL (2).
VÝSLEDKY
Základná charakteristika súboru pacientov s FL resp. MCL podľa lokalizácie nádoru v čase prvej bioptickej diagnózy, resp. v čase rebiopsie a podľa spôsobu odberu materiálu na bioptické vyšetrenie je sumarizovaná v tabuľke č. 1 a 2. V celom súbore tvoria viac než 4/5 vyšetrení bioptické vyšetrenia „malých“ endoskopických biopsií (48/76; t.j. 63,2 %) a endoskopických polypektómií (13/76, t.j. 17,1 %), vyšetrenia resekčného materiálu predstavujú takmer 1/5 bioptických vyšetrení (15 z 76, t.j. 19,7 %,). V hodnotenom období sme diagnostikovali FL u 18 pacientov v 22 biopsiách, vždy s výskytom len v jednej lokalizácii žalúdočnočrevného komplexu, a MCL u 44 pacientov v celkove 54 biopsiách, pričom až 14x išlo (pri klinicky identifikovanom mnohopočetnom postihu GITu) o súčasný odber z viacerých úsekov žalúdočnočrevnej oblasti. V ďalšom uvádzame výsledky rozdelené podľa diagnóz.
Tab. 1. Rozdelenie prípadov podľa miesta odberu bioptickej vzorky. 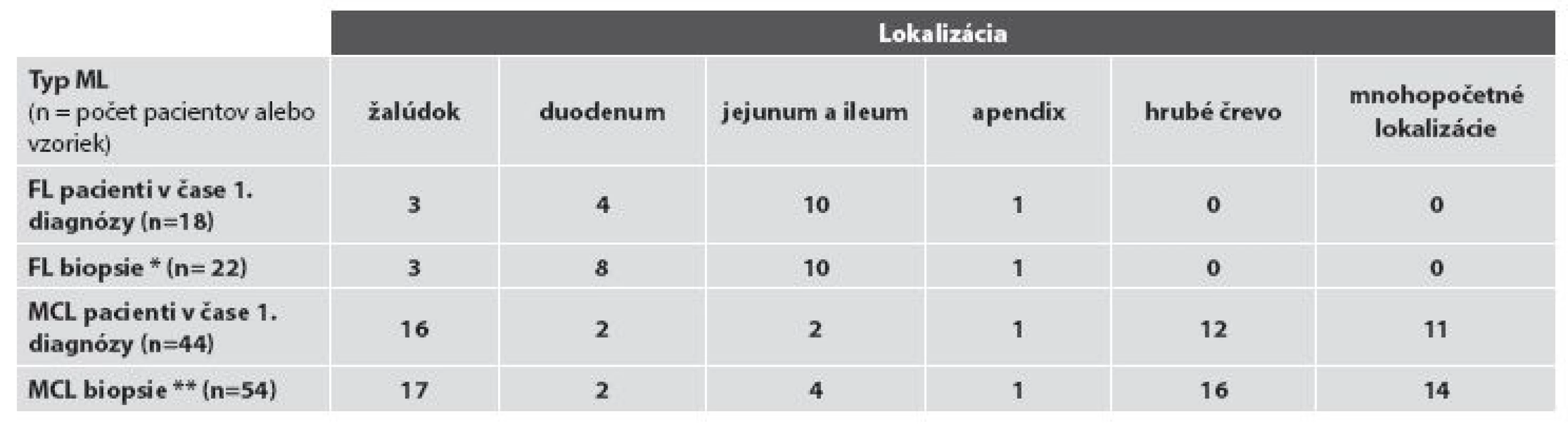
Vysvetlivky: * a ** všetky biopsie pacientov, t.j. celkový počet bioptických vyšetrení Tab. 2. Rozdelenie prípadov podľa spôsobu odberu bioptických vzoriek. 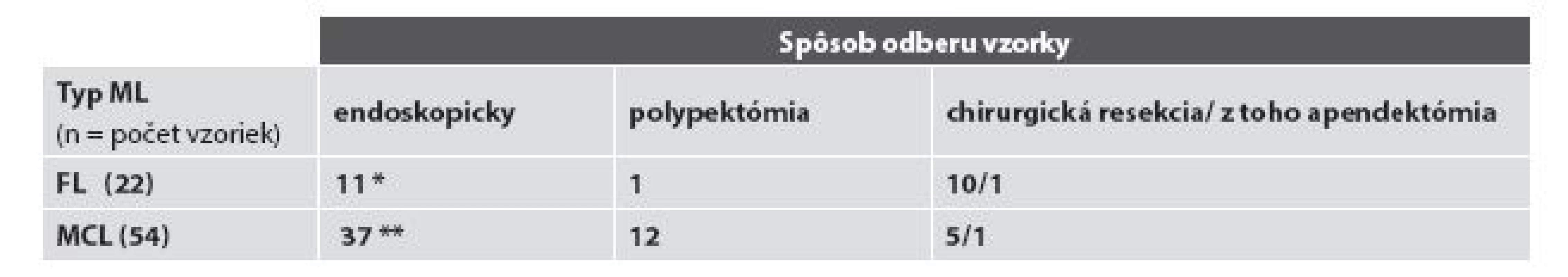
Vysvetlivky: * zahŕňa aj 4 rebiopsie dvoch pacientov a ** zahŕňa aj všetkých pacientov s mnohopočetnými lokalizáciami a súčasným odberom zo sliznice rôznych častí žalúdočnočrevnej oblasti (viď text) A/ FL žalúdočnočrevnej oblasti
Podľa dostupných klinických údajov a údajov nášho bioptického registra by u všetkých pacientov analyzovaného súboru malo ísť o primárny FL uvedenej oblasti. Ten bol v 1. biopsii diagnostikovaný najčastejšie, u 77,8 % (14/18) všetkých pacientov, v tenkom čreve, a to častejšie v jejunoilickej než duodenálnej oblasti – v 55,6 % verzus 22,2 % (10/18, verzus 4/18) pacientov. FL žalúdka bol diagnostikovaný u 13,6 % (3/18) pacientov, postih hrubého čreva zaznamenaný nebol. U oboch pacientov s rebioptickým vyšetrením GITu išlo o duodenálny FL s lokoidentickou recidívou: u jedného pacienta išlo o tri recidívy v časovom intervale troch rokov od prvej biopsie a u druhého o rebiopsiu po ôsmich mesiacoch. FL bol vždy lokalizovaný len v jednom orgáne, súčasná infiltrácia viacerých orgánov sledovanej oblasti zistená nebola. Z celkového počtu 22 biopsií bola diagnóza FL verifikovaná v endoskopickej biopsii v 54,5 % (12/22) a v chirurgickom resekčnom materiáli v 45,5 % (10/22) všetkých vzoriek. V biopsiách 88,9 % (16/18) pacientov bol diagnostikovaný nízkomalígny FL, a to 15x G1 a 1x G2, vysokomalígny (G3) FL sa vyskytol u 11,1 % (2/18) pacientov, a to vždy s s ložiskami DLBCL. U žiadneho z dvoch pacientov s registrovanou rebiopsiou nedošlo v rebiopsiách k progresii z pôvodného obrazu G1 FL. Zmeny typu tzv. lymfoepitelových lézií sme nepozorovali v žiadnom prípade (obr. 1A).
Vo všetkých resekčných materiáloch bol zreteľný dominujúci nodulárny rastový vzor (obr. 1B). V malých vzorkách bola nodularita zreteľná obyčajne len v časti nádorového infiltrátu, prípad ne v kombinácii s pseudonodularitou a súčasne boli identifikovateľné aj difúzne infiltráty bez zreteľnej nodularity (obr. 1C-D). Rozmery endoskopickej vzorky neumožnili spoľahlivé určenie pomeru difúznej a nodulárnej zložky podľa štandardov diagnostiky FL (SZO, 2008). V jednom prípade FL s CD20 pozitivitou nodulárnych štruktúr až súčasná detekcia expresie CD10 a bcl6 antigénov potvrdila morfologicky suspektnú marginálne zonálnu diferenciáciu na obvode nádorového uzla (bez expresie CD10, resp. bcl6 – obr. 1E-F). Diagnóza FL bola podporená „klasickým“ histologickým obrazom a fenotypom nádorových buniek, takže u väčšiny - až u 94,4 % (17/18) pacientov nevyžadovala molekulovo genetické analýzy. Len u jedného pacienta v endoskopickej biopsii duodena bola prítomná difúzna prevažne malobunková lymfoidná infiltrácia, s expresiou pozitivity CD20 aj bcl2 proteínu, v čase aktuálnej biopsie (r. 2005) bližšie netypizovateľná. Diagnóza FL bola vtedy verifikovaná dôkazom prestavby BCL2 génu, resp. fúzie BCL2/IGH génov FISH analýzou.
Obr. 1. Folikulové lymfómy žalúdočno-črevnej oblasti. 
A: Infiltrácia sliznice duodena bez prítomnosti lymfoepitelových lézií (IHC dôkaz CD20, obj. 20x), B: Nodularita FL v resekáte tenkého čreva (farb. podľa Giemsu, obj. 10x), C: Perinodulárna kresba retikulínu v duodenálnom infiltráte (impregnácia podľa Gömöriho, obj. 20x), D: Fokálna nodularita a prevaha difúznej komponenty v infiltráte terminálneho ilea (HE, obj. 4x), E: FL duodena s marginálne zonálnou diferenciáciou, ten istý prípad ako v A (IHC dôkaz bcl2 proteínu, obj. 20x), F: FL duodena s marginálne zonálnou diferenciáciou, ten istý prípad ako v A, resp. E (IHC dôkaz CD10, obj. 20x). B/ MCL žalúdočnočrevnej oblasti
Podľa dostupných údajov u 40,9 % (18/44) pacientov nášho súboru ide o primárny extranodálny MCL žalúdočnočrevnej oblasti a u 59,1 % (26/44) pacientov o sekundárny postih týchto orgánov GITu systémovým MCL.
V čase primodiagnózy, pri zohľadnení infiltrácie len jedného orgánu sledovanej oblasti, prevláda MCL žalúdka a resp. hrubého čreva - 36,4 % (16/44), resp. 27,3 % (12/44) všetkých pacientov. Primárny izolovaný MCL tenkého čreva bol zriedkavejší – vyskytol sa u 13,6 % (6/44) všetkých pacientov. V čase prvej diagnózy bola však častá disseminácia ochorenia v GITe verifikovaná súčasnou biopsiou viacerých lokalizácií, a to u 25 % (11/44) všetkých pacientov. Najčastejšie išlo o súčasnú infiltráciu rôznych častí hrubého čreva alebo hrubého aj tenkého čreva – u 13,6 % (6/44) pacientov. S prihliadnutím na sumáciu údajov podľa izolovaného a súčasného multifokálneho výskytu MCL je poradie postihu sledovaných orgánov v čase prvej diagnózy nasledovné: prevláda MCL žalúdka 47,8 % pacientov (36,4 % s izolovaným a 11,4 % pacientov s multifokálnym výskytom), nasleduje MCL hrubého čreva u 40,9 % pacientov (27,3 % pacientov s izolovaným a ďalších 13,6 % s multifokálnym výskytom) a postih tenkého čreva 22, 6 % pacientov (13,6 % v prípade izolovaného a 9 % pacientov s multifokálnym výskytom).
V skupine 9 pacientov s rebiopsiou u piatich z nich išlo o identický postih toho istého orgánu, resp. tých istých dvoch orgánov ako v čase primárnej diagnózy a u štyroch rebiopsia verifikovala disemináciu do inej časti žalúdočnočrevného systému. Najdlhší časový odstup od prvej biopsie do rebiopsie relapsu ochorenia bol 4 roky, okrem jediného prípadu žalúdočného relapsu ochorenia po 8-ročnej remisii primárne nodálneho MCL (biopsia nami verifikovaná pred aplikáciou elektronického registra sledovaného obdobia).
Diagnóza MCL bola verifikovaná najčastejšie endoskopickým odberom, resp. endoskopickou polypektómiou - v 68,5 % (37/54), resp. 22,2 % (12/54) a menej často v resekčnom chirurgickom materiáli - v 9,3 % (5/54).
Z hľadiska gradingu bol histocytologicky identifikovaný:
- a) v čase 1. biopsie 33 pacientov (75 % všetkých) konvenčný typ MCL (obr. 2A), z toho v 4 prípadoch išlo o diskordantnú morfológiu, keďže biopsia v iných lokalizách preukázala blastoidnú morfológiu,
- b) v biopsiách ďalších 11 (25 % všetkých) pacientov išlo o blastoidný typ MCL (obr. 2B), bez výskytu diskordantného nálezu,
- c) v prípade opakovanej jednej rebiopsie 7 pacientov a dvoch rebiopsií jedného pacienta bol vo všetkých vzorkách verifikovaný identický typ MCL. Len u jedného pacienta primárna biopsia vykazovala konvenčný typ MCL a následná rebiopsia v identickej rektálnej oblasti po približne 12 mesiacoch transformáciu do blastoidného typu MCL.
V 81,5 % (44/54) biopsiách pacientov s MCL bol identifikovaný difúzny rast nádoru (obr. 2C). V 9,25 % (5/54) bola zreteľná nodularita (obr. 2D) a v ďalších 9,25 % (5/54) pseudonodularita rastu nádoru, v týchto prípadoch boli v centre uzlovitých štruktúr nádoru morfologicky alebo imunohistochemicky verifikované reziduá zárodočných centier folikulov, prípadne CD23 pozitívne siete folikulárnych dendritických buniek. V žiadnom z prípadov MCL sme nepozorovali zmeny typu tzv. lymfoepitelových lézií. Zvláštnosťou bol nález minimálnej infiltrácie inak reaktívneho lymfatického folikulu jedného pacienta v rebioptickej vzorke po predošlej liečbe a dosiahnutí klinickej remisie (obr. 2E-F).
Obr. 2. Lymfómy z plášťových buniek žalúdočno-črevnej oblasti. 
A: Konvenčný „malobunkový“ MCL v sliznici hrubého čreva (HE, obj. 40x), B: Blastoidný MCL v sliznici hrubého čreva (HE, obj. 40x), C: Difúzny rast v polype hrubého čreva (IHC dôkaz CD5, obj. 4x), D: Parciálne nodulárny rast v polype rekta (impregnácia podľa Gömöriho, obj. 10x), E: Minimálna infiltrácia sliznice terminálneho ilea po liečbe (HE, obj. 4x), F: Ten istý obraz ako v E (IHC dôkaz cyklínu D1, obj. 4x) . Diagnóza MCL konvenčného (malobunkového) typu bola podporená „klasickým“ histocytologickým obrazom a fenotypom nádorových buniek (najmä súčasná pozitivita dôkazu CD20, CD5 a cyklínu D1), náročnejšia, aj z hľadiska diferenciálnej diagnózy, bola diagnóza blastoidného variantu MCL. V jednom prípade blastoidného MCL sme zistili atypický fenotyp buniek nádoru: pozitivitu dôkazu antigénov CD20, bcl2, cyklínu D1 a MUM1/IRF4 a slabú pozitivitu antigénu CD10, pri negativite dôkazu tak CD5, ako aj TdT. Súčasná i-FISH analýza dokázala prítomnosť translokácie t(11,14)(q13,32) v teréne spravidla troch kópií CCND1 génu, bez prestavby génov BCL2 a MYC. Celkove až u 18,2 % (8/44) pacientov bolo potrebné v čase 1. biopsie GITu podporiť diagnózu MCL aj dôkazom prestavby CCND1 génu i-FISH analýzou v nádorovom tkanive. Náročnosť diagnózy MCL súvisela aj s problémami s kvalitou resp. senzitivitou protilátok na detekciu CD5 resp. cyklínu D1 v parafínových rezoch v prvých rokoch sledovaného obdobia.
C/ V kontrolnom súbore pacientov s MZBL MALT-typu boli zastúpené tak endoskopické, ako aj resekčné biopsie žalúdka a tenkého čreva.
Dodržiavanie štandardov histologickej a imunohistochemickej diagnostiky MZBL, resp. iných ML (2) bolo základom postupov v čase reálnej diagnózy. Súčasne je však potrebné upozorniť na rôznorodé spektrum rastových vzorov MZBL MALT-typu, čo môže, v diagnostickej aj v postterapeutickej biopsii spôsobiť rozpaky. Podrobný popis týchto nálezov presahuje rámec tejto publikácie, preto sme uvedené poznatky sumarizovali do prehľadných schém rastových vzorov MZBL, FL a MCL (viď schémy 1-4). V každom prípade MZBL MALT-typu boli morfologicky viditeľné a imunohistochemickou analýzou verifikované črty infiltrácie slizničných epitelových štruktúr nazývané lymfoepitelové lézie.
D/ V kontrolnom súbore pacientov s reaktívnou lymfatickou folikulovou hyperpláziou orgánov žalúdočnočrevnej oblasti boli zastúpené tak endoskopické, polypektomické, ako aj resekčné biopsie rôznych lokalizácií od duodenálnej cez terminálne ilum až po rektum. Dodržanie štandardov histomorfologickej a imunohistochemickej analýzy (2) umožňuje odlíšiť reaktívnu lymfatickú folikulovú hyperpláziu od nádorovej proliferácie FL aj MCL (najmä poly - verzus monoklonalita buniek zárodočných centier a negativita verzus pozitivita expresie bcl2 proteínu, resp. expresia CD5 a cyklínu D1 pri nodulárnom rastovom vzore MCL – viď schéma). To isté platí pri vystupňovanej reaktívnej lymfatickej folikulovej hyperplázii rektálnej oblasti, v ktorej hyperplastické folikuly na seba niekedy výraznejšie naliehajú (obr. 3A). Medzi možné problémy možno zaradiť dve nasledovné situácie. Prvou z nich je regresívna transformácia folikulov v teréne typickej reaktívnej hyperplázie, ktorá vedie k nodulárnej akumulácii CD20 pozitívnych buniek marginálnej zóny, pričom zárodočné centrum folikulu je prítomné len reziduálne v centre uzla, prípadne zaniknuté (obr. 3B-C). Odlíšenie FL, resp. MCL vyžaduje dôkaz absencie fenotypových znakov týchto nádorov. Druhou je možná perifolikulárna akumulácia CD5+ T-buniek, ktorá pripomína rast MCL na spôsob plášťovej zóny. Tieto bunky však ležia v marginálnej a nie plášťovej zóne folikulu a ojedinele prenikajú aj do plášťovej zóny, resp. zárodočného centra folikulu (obr. 3E). To možno verifikovať morfologickou analýzou, prípadne dôkazom expresie IgD typicky lokalizovanej len v plášťovej zóne folikulu.
Schéma 1. Kruh vyznačuje zorné pole v objektíve - reaktívny lymfatický folikul v sliznici GIT-u. 
Skratky: ZC = zárodočné centrum lymfatického folikulu PZ = plášťová zóna folikulu (angl. „mantle zone“) OZ = okrajová zóna folikulu (angl. „marginal zone“) Schéma 2. A. MCL, rast na spôsob plášťovej zóny okolo zárodočných centier folikulov. B. MCL, rast na spôsob marginálnej zóny. C. MCL, nodulárny rast, možné (mikro-)reziduá centier folikulov. D. MCL, difúzny spôsob rastu, možné mikroreziduá pôvodných štruktúr. E. MCL, možná minimálna infiltrácia pri relapse (CD20+/PAX5+/CD5+/cyklín D1+). 
Schéma 3 A. FL, typický nodulárny rast, nádorové bunky prítomné aj v internodulárnych zónach. B. FL, zmiešaný nodulárny a difúzny rast. 
Schéma 4 A. MZBL MALT-typu, (obyčajne iniciálne) rast na spôsob okrajovej zóny. B. MZBL: tzv. kolonizácia lymfatických folikulov, obraz imituje folikulový lymfóm. C. MZBL MALT-typu, pokročilá kolonizácia lymfatických folikulov, obraz imituje folikulový lymfóm. D. MZBL MALT typu, splývanie ložísk infiltrácie a dojem difúzneho rastu. 
Obr. 3. Reaktívna lymfatická folikulová hyperplázia v sliznici orgánov žalúdočno-črevnej oblasti. 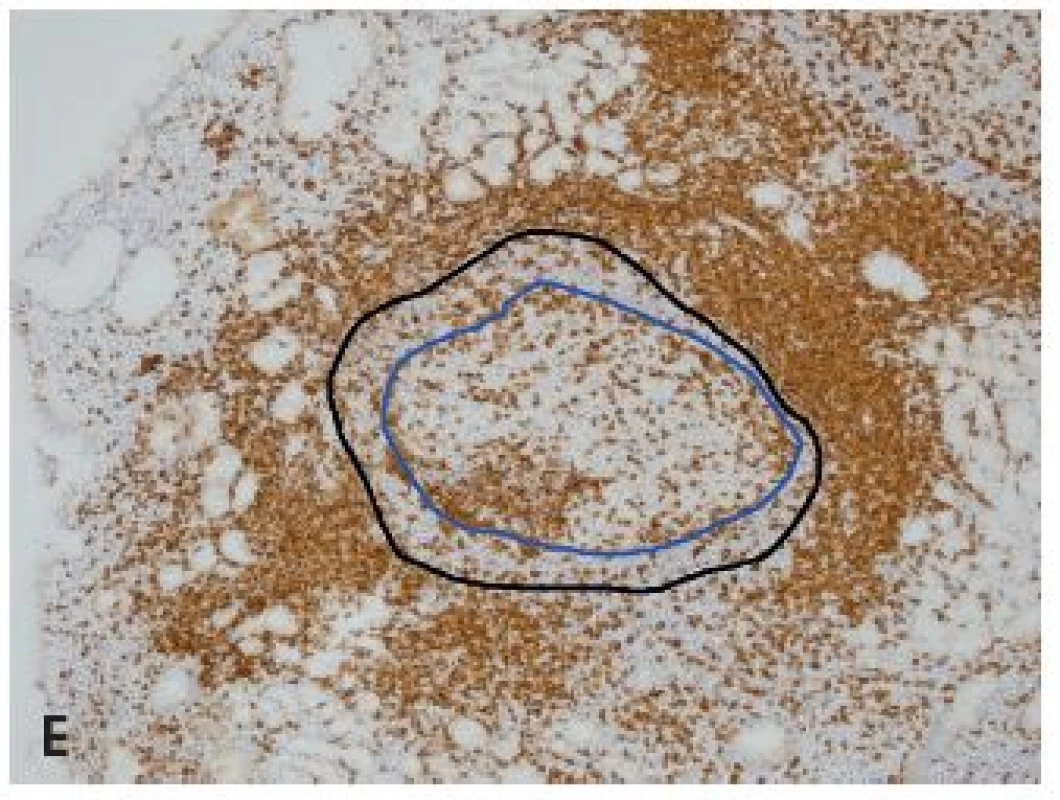
A: Vystupňovaná hyperplázia v sliznici rekta (farb. podľa Giemsu, obj. 4x), B: Folikulová hyperplázia v štádiu regresívnej transformáciev terminálnom ileu - označené folikuly so zánikom zárodočných centier (HE, obj. 10x), C: Ten istý prípad ako v B (IHC dôkaz bcl2, obj. 10x), D: Folikulová hyperplázia duodena s expanziou plášťovej aj marginálnej zóny (IHC dôkaz bcl2, obj. 10x), E: Ten istý prípad ako v D, modrá čiara obkolesuje zárodočné centrum a čierna plášťovú zónu folikulu (IHC dôkaz CD5, obj. 10x). DISKUSIA
Primárnym cieľom predloženej práce bolo retrospektívne zhodnotiť možnosti a hranice diagnózy MCL a FL v bioptických vzorkách orgánov žalúdočnočrevnej oblasti v rámci každodennej bioptickej praxe s využitím „len“ histologických a (na väčšine pracovísk nášho odboru aj rutínne používaných) prinajmenej základných imunohistochemických analýz. Ukazuje sa, že napriek limitom častých „malých“ (endoskopických) vzoriek je určenie diagnózy FL resp. MCL v biopsiách analyzovaných extranodálnych lokalizácií v prevažnej časti prípadov možné. Diagnózu umožňuje racionálna histologická a imunohistochemická analýza, aj v rámci tzv. druhého čítania, pričom diagnóza FL a MCL vyžadovala v tu analyzovaných extranodálnych lokalizáciách podporu špecializovanejšou FISH analýzou v menej ako 1/5 prípadov. Nemenej dôležitou môže byť aj dôkaz klonality B-bunkovej lymfoproliferácie (3). Správna diagnóza je tu dôležitá nielen z hľadiska prognostického, ale aj pre rozhodovanie o vhodnosti ďalšej liečby. Primárny MZBL MALT-typu vo včasných klinických štádiách je indikáciou k liečbe orientovanej na eradikáciu H. pylori. Keďže GIT je len zriedkavým miestom sekundárneho postihu primárne nodálnym FL (6), tak väčšina, ak nie všetky FL v GITe, v ňom zrejme aj vznikajú. Primárne FL duodena a rovnako aj hrubého čreva predstavujú obyčajne solitárne nádory v nízkom štádiu (obyčajne I.E-II.E) s indolentným klinickým priebehom (podobne ako primárne nodálne) a s 5-ročným prežívaním viac ako 62 % (1,3,7). V zmysle hesla „štádium určuje liečbu“ vtedy obyčajne vyžadujú len dispenzarizáciu pacienta a zriedkavo kontrolu rebiopsiou, resp. následnú endoskopickú polypektómiu (5,8,9), ako tomu bolo aj v dvoch prípadoch nášho súboru. Naproti tomu MCL predstavuje často multifokálne a klinicky sice heterogénne, ale najčastejšie agresívne ochorenie s potrebou intenzívnej systémovej liečby. Napriek liečbe býva prežívanie pacientov obyčajne obmedzené (10,11). Výnimkou je zriedkavejší indolentný MCL, verifikovaný klinickým priebehom aj u jedného pacienta nášho súboru.
Predložená analýza súčasne odhalila, s prihliadnutím k povahe vyšetrovaného materiálu a dostupným klinickým údajom, aj niektoré rozdielnosti klinických prejavov oboch sledovaných nádorov. V podskupine prípadov MCL bol pomer resekčného verzus endoskopického materiálu približne 1 : 10 a v podskupine FL takmer 1 : 1. Je zrejmé, že u pacientov s FL GITu dochádza častejšie než v prípade MCL k poruchám črevnej pasáže. Tieto stavy, obyčajne typu obštrukčného ileu a intusucepcie, vyžadujú chirugickú intervenciu, a to najmä pri lokalizácii FL v distálnejších častiach tenkého čreva (9). Z hľadiska diferenciálnej diagnózy možno pripomenúť, že podobná klinická manifestácia s potrebou chirurgického zákroku sa môže prejaviť aj pri reaktívnej lymfatickej folikulovej hyperplázii čreva. Jej najvýraznejšie prejavy typu tzv. florídnej lymfoidnej hyperplázie (3) môžu vzniknúť u imunodeficientných aj u imunokompetentných pacientov, najmä v dôsledku chronickej antigénovej stimulácie, napr. pri rôznych infekciách (HP, Giardiáze), malabsorpčných stavoch a pod. (12,13).
Naopak, u pacientov s MCL v GITe ileózny stav vzniká relatívne zriedka (14). MCL sa manifestuje ako izolovaná nádorová lézia pri endoskopickom obraze „normálnej“ sliznice, alebo s exulceráciou povrchových epitelových štruktúr, alebo vo forme malých polypóznych nádorov (15). MCL je v orgánoch žalúdočnočrevnej oblasti buď sekundárny pri diseminácii obyčajne primárne nodálneho ochorenia (takmer 60% pacientov nášho súboru), alebo vzniká ako primárny nádor tejto oblasti (3). Primárny MCL GITu sa často prejavuje zvláštnou tendenciou multifokálnej infiltrácie viacerých lokalizácií, ktorá v prípade tvorby polypoidných lézií sa označuje ako mnohopočetná (lymfoidná) polypóza. Tá je jedným z najčastejších primárnych manifestácií MCL v žalúdočno-črevnej oblasti a tvorí podľa rôznych údajov približne 2-10 % všetkých ML B-pôvodu v GITe (11,14,16). Endoskopicky a aj morfologicky podobné a viacpočetné polypózne lézie sa však nevyskytujú exkluzívne u pacientov s MCL a môžu vzniknúť, aj keď menej často, v slizniciach aj pacientov s FL alebo MZBL MALT-typu (5,7,15). Endoskopická polypektómia v našom súbore tvorila približne 22 % biopsií MCL a len 1 z 22 biopsií FL. Sekundárny postih GITu bol v minulosti uvádzaný jako prejav diseminácie ochorenia u približne 1/3 pacientov s MCL, je však zrejme ešte častejší. Pri tzv. slepých endoskopických odberoch ešte neliečených pacientov s MCL v čase prvej diagnózy sa totiž v cielených multifokálnych biopsiách endoskopicky normálnej a abnormálnej žalúdočnej a črevnej sliznice histologicky identifikoval až u 92 % všetkých vyšetrených pacientov mnohopočetný postih týchto štruktúr (4). Multifokalitu výskytu MCL sme pozorovali aj u približne ¼ pacientov našej série v momente endoskopického vyšetrenia pri prvej manifestácii ochorenia a tiež relatívne často aj pri rebiopsiách pre jeho recidívy.
Z hľadiska morfologického je dobré pamätať na rôznorodosť rastových vzorov týchto nádorov a neraz aj nekonzistenciu pozorovaných nálezov s „učebnicovými“ opismi. Napr. FL má vykazovať v 80 – 85 % prípadov nodulárny a menej často zmiešaný, prípadne ojedinele aj čisto difúzny rast (2). Tieto parametre vychádzajúce z údajov o nodálnych ML nemusia byť identické pri ich výskyte v extranodálnom mikroprostredí. V nami pozorovanom súbore bola napr. nodularita rastu FL prítomná okrem jednej vo všetkých vyšetrených biopsiách. Súčasne sa vyskytli aj známky nepravej nodularity (pseudonodularity) a časté rôzne rozsiahle difúzne úseky bez jednoznačnej nodularity, čo môže viesť diagnostické úvahy nesprávnym smerom. Tieto nálezy však určite súvisia aj s limitmi materiálu, keď len menšiu časť tvoril resekčný materiál s možnosťou rozsiahlejšieho štúdia rastového vzoru. Naša analýza ukázala, že viac než 4/5 všetkých vyšetrených biopsií súboru tvoria „malé“ endoskopické biopsie a endoskopické polypektómie. To, pochopiteľne okrem biologických faktorov rastu nádoru, môžu súvisieť aj s podobným nálezom prevahy difúzneho rastového vzoru vo viac ako 4/5 biopsií pacientov s MCL. V tejto podskupine pacientov bolo zastúpenie endoskopického materiálu ešte vyššie, ako v prípadoch FL. Tu na rozdiel od „učebnicových“ aj empirických poznatkov o nodálnych MCL bola pravá nodularita, resp. pseudonodularita s nálezom aspoň reziduí pôvodného zárodočného centra lymfatického folikulu málo častá - oba tieto rastové vzory MCL sa vyskytli v menej ako 10% biopsií súboru. Pre prax je užitočné myslieť na heterogenitu spôsobu rastu MCL, najmä vo vzťahu k diferenciálnej diagnostike, napr. aj nami pozorovaného FL s črtami marginálne zonálnej diferenciácie, resp. v schéme sumarizovaných rôznych rastových vzorov MZBL MALT-typu. K tomu možno dodať, že štruktúry typu tzv. lymfoepitelových lézií, považované za jeden z dôležitých znakov MZBL MALT-typu, u pacientov s FL a MCL v GIT-e (2) obyčajne absentujú.
Rastové črty sa však menia v priebehu ochorenia a vplyvom liečby. Najvypuklejším príkladom je záchyt minimálnej reziduálnej infiltrácie MCL v rebiopsii jedného pacienta po liečbe, v morfologicky nenápadnom „bežnom“ reaktívnom lymfatickom folikule. Klinicky ide o minimálnu reziduálnu chorobu, snáď aj preto niektorí (17) nazývajú tento nález „reziduálna in-situ MCL lézia“ analogicky k incipientnej lézii typu MCL in situ, považovanej za preneoplastickú léziu. Jej identifikácia je mimoriadne dôležitá z hľadiska ďalšieho terapeutického manažmentu pacienta (18).
Poznámky o heterogenite a premenlivosti rastu platia aj pre histocytologický obraz, t.j. pre grading MCL a FL, aj keď jeho určenie v malých vzorkách môže byť problematické (3). V skupine pacientov s FL pri prevahe nízkomalígnych (G1, resp. G2) foriem sa v čase prvej diagnózy vyskytol vysokomalígny FL (G3) zriedkavo - len v 11,1 % z nich. Väčšia heterogenita gradingu bola zrejmá v skupine pacientov s MCL, v ktorej až u 25 % pacientov v čase prvej diagnózy bol identifikovaný nemalobunkový blastoidný typ MCL. V rebiopsiách dvoch pacientov s FL a ôsmich s MCL pretrval nález malobunkovej morfológie, len u jedného pacienta s MCL sa v lokoidentickej rektálnej rebiopsii pri recidíve ochorenia dokázala transformácia do blastoidného typu MCL. Tieto nálezy zvádzajú ku konštatovaniu, že oba sledované nádory v žalúdočnočrevnej oblasti, na rozdiel od skúseností s MZBL MALT typu a primárne nodálnym MCL (19), vykazujú nízku tendenciu k vysokomalígnej (blastickej) transformácii (1). Pri identifikácii jedného, podľa klinických údajov o priebehu ochorenia indolentného MCL, sa tu otvárajú ďalšie otázky o potrebe doplnenia klinických údajov aj ďalších pacientov s recidívou ochorenia v GITe. Zložitosť celej problematiky dokresľuje údaj o 9 % pacientov s klinicky známym systémovým blastoidným typom (nami verifikovaným v predošlých biopsiách inej lokalizácie), u ktorých sme v rebiopsiách žalúdočnočrevnej oblasti verifikovali MCL konvenčného malobunkového typu podľa SZO klasifikácie (2). Fenomén malobunkového relapsu primárne blastického (vysokomalígneho) ML sa označuje anglicky aj ako „downgrading“ nádoru v danej lokalite (20) a dokresľuje biologickú vnútronádorovú heterogenitu.
Bioptická diagnostika sledovaných ML sa popri podrobnej histomorfologickej analýze opiera o imunohistochemické vyšetrenie fenotypu nádorových buniek. Tá vyžaduje štandardizáciu panelu používaných protilátok podľa klasifikácie SZO (2008) a preto ju nie je potrebné podrobnejšie rozoberať. Vhodné je snáď len pripomenúť potrebu zaradenia kombinovaného dôkazu CD3 a CD5 antigénov do základného diagnostického panelu, lebo pri izolovanom dôkaze CD3 antigénu v pozícii pan T-markera hrozí „prehliadnutie“ diagnózy CD5 aberantne pozitívnych B-ML, vrátane MCL. Platí to nielen v prípade konvenčného malobunkového, ale rovnako aj blastoidného variantu MCL s rizikom nesprávnej typizácie nádoru do skupiny DLBCL. Blastoidná morfológia MCL je pritom jedným z dôležitých parametrov asociovaných so zásadne agresívnejším priebehom nádorového ochorenia (17,18). Vzhľadom k možnosti existencie CD5 negatívneho fenotypu niektorých MCL (2,21,22) tu možno diskutovať aj o potrebe zaradenia detekcie cyklínu D1 do základných diagnostických panelov. Aberantné alebo atypické fenotypy MCL, aké sa vyskytli aj v jednom z našich prípadov MCL, patria medzi zriedkavé a sú spojené s rizikom mylnej diagnostiky (22). Najmä v takýchto prípadoch je žiadúce podporiť diagnózu aj ďalšími analýzami, buď PCR alebo FISH na dôkaz prestavby príslušných génov, ako tomu bolo v už spomenutých približne 15% všetkých pacientov súboru s FL, resp. MCL.
Záverom možno zopakovať, že kombinácia racionálnej algoritmicky konštruovanej histologickej a imunohistochemickej analýzy s podporou špecializovanejších FISH alebo PCR analýz umožňuje klinicky a pre pacienta relevantnú typizáciu analyzovaných lymfómov žalúdočnočrevnej oblasti. Súčasne, a to aj s prihliadnutím na relatívnu zriedkavosť týchto nádorov je žiadúce, nielen napr. podľa britských a iných odporúčaní (8), túto diagnostiku podrobiť procesu druhého čítania skúseným hematopatológom.
POĎAKOVANIE
Práca bola podporená Grantom Lymfómovej skupiny Slovenska a Projektom centra excelentnosti CEPV II (ITMS kód projektu 26220120036), ktorý je spolufinancovaný z prostriedkov EÚ.
PREHLASENIE
Autor práce prehlasuje, že v súvislosti s témou, vznikom a publikácií tohto článku nie v konflikte záujmov a vznik ani publikácia článku neboli podporené žiadnou farmaceutickou firmou. Toto prehlasenie sa týka i všetkých spoluautorov.
Adresa pre korešpondenciu:
Prof. MUDr. Lukáš Plank, CSc.
ÚPA JLF UK a UNM
Kollárova 2,
03659 Martin,
Slovensko tel.: +421-43-4133002 fax: +421-43-4203370
e-mail: plank@jfmed.uniba.sk
Zdroje
1. Shia J, Teruya-Feldstein J, Pan D, et al. Primary follicular lymphoma of the gastrointestinal tract: s clinical and pathologic ptudy of 26 cases. Am J Surg Pathol 2002; 26(2): 216-224.
2. Swerdlow SH, Campo E, Harris, NL, et al. WHO classification of tumours of heamatopoietic and lymphoid tissues (4th ed). Lyon: IARC; 2008, 439 s.
3. Burke JS. Lymphoproliferative disorders of the gastrointestinal tract. A review and pragmatic guide to diagnosis. Arch Pathol Lab Med 2011; 135(10): 1283–1297.
4. Salar A, Juanpere N, Bellosillo B, et al. Gastrointestinal involvement in mantle cell lymphoma: a prospective clinic, endoscopic, and pathologic study. Am J Surg Pathol 2006; 30(10): 1274-1280.
5. Jain VK, Bystricky B, Wotherspoon AC, Chau I, Cunningham D. Primary follicular lymphoma of the GI Tract: sn increasingly recognized entity. J Clin Oncol 2012; 30(36): e370-e372.
6. Bennani-Baiti N, Daw HA, Cotta C, et al. Low-grade follicular lymphoma of the small intestine: a challenge for management. Semin Oncol 2011; 6(38): 714–720.
7. Damaj G, Verkarre V, Delmer A, et al. Primary follicular lymphoma of the gastrointestinal tract: a study of 25 cases and a literature review. Ann Oncol 2003; 14(4): 623–629.
8. McNamara C, J Davies J, Dyer M, et al. Guidelines on the investigation and management of follicular lymphoma. Br J Hematol 2011; 156(4): 446–467.
9. Misdraji J, Harris NL, Hasserjian RP, Lauwers GY, Ferry JA. Primary follicular lymphoma of the gastrointestinal tract. Am J Surg Pathol 2011; 35(9): 1255-1263.
10. Rosenwald A, Wright G, Wiestner A, et al. The proliferation gene expression signature is a quantitative integrator of oncogenic events that predicts survival in mantle cell lymphoma. Cancer Cell 2003; 3(2): 185-197.
11. Ruskoné-Fourmestraux A, Audouin J. Primary gastrointestinal tract mantle cell lymphoma as multiple lymphomatous polyposis. Best Pract Res Clin Gastroenterol 2010; 24(1): 35-42.
12. Krauss E, Konturek P, Maiss J, et al. Clinical significance of lymphoid hyperplasia of the lower gastrointestinal tract. Endoscopy 2010; 42(4): 334-337.
13. Albuquerque A. Nodular lymphoid hyperplasia in the gastrointestinal tract in adult patients: A review. World J Gastroint Endoscopy 2014; 6(11): 534-540.
14. Kella VKN, Constantine R, Parikh NS, et al. Mantle cell lymphoma of the gastrointestinal tract presenting with multiple intussusceptions - - case report and review of literature. Word J Surg Oncol 2009; 7 : 60-66.
15. Michopoulos S., Petraki, K., Matsouka Ch, Kastritis E, Chrysanthopoulou H, Dimopoulos MA. Mantle-cell lymphoma (Multiple lymphomatous polyposis) of the entire GI tract. J Clin Oncol 2008; 26(9): 1555-1557.
16. Kim JH, Jung HW, Kang KJ et al. Endoscopic findings in mantle cell lymphoma with gastrointestinal tract involvement. Acta Haematol 2012; 127(3): 129–134.
17. Jares P, Colomer D, Campo E. Molecular pathogenesis of mantle cell lymphoma. J Clin Invest 2012; 122(10): 3416-3423.
18. Campo E, Rule S. Mantle cell lymphoma: evolving managment strategies. Blood 2015; 125 (1): 48-55.
19. Dreyling M, Geisler C, Hermine O, et al. Newly diagnosed and relapsed mantle cell lymphoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2014; 25(Suppl 3): 83-92.
20. Kerrigan DP, Foucar K, Dressler L. High-grade non-Hodgkin lymphoma relapsing as lowgrade follicular lymphoma: so-called downgraded lymphoma. Am J Hematol 1989; 30(1): 36-41.
21. Plank L. Význam detekcie cyklínu D1 (a CD5) v diagnostike malígnych lymfómov iných než je lymfóm z pláštových buniek. Cesk Patol 2011; 47(3): 96-100.
22. McKay P, Leach M, Jackson R, Cook G, Rule S; British Committee for Standards in Haematology. Guidelines for the investigation and management of mantle cell lymphoma. Br J Haematol 2012; 159(4): 405-426.
Štítky
Patologie Soudní lékařství Toxikologie
Článek Jaká je Vaše diagnóza?
Článek vyšel v časopiseČesko-slovenská patologie

2016 Číslo 1-
Všechny články tohoto čísla
- Serrated adenomy a karcinomy tlustého střeva
- Morfologie gastroezofageálního refluxu
- MONITOR aneb nemělo by vám uniknout, že
- Patologická diagnostika nerefluxních ezofagitid
- Zaostrené na gastrointestinálny trakt
- MONITOR aneb nemělo by vám uniknout, že
- Folikulový lymfóm a lymfóm z plášťových buniek v biopsiách orgánov žalúdočno-črevnej oblasti
- O teórii „tripolárneho života“
- Jaká je Vaše diagnóza?
- Hypoglykémie u solitárního fibrózního tumoru jater
- Jaká je Vaše diagnóza? Odpověď
- MONITOR aneb nemělo by vám uniknout, že
- Klinicko-patologická korelace imunoprofilu u difúzního velkobuněčného lymfomu, NOS - zkušenost z jednoho pracoviště
- MONITOR aneb nemělo by vám uniknout, že
- Kožná bunková reakcia po popálení medúzou
- MONITOR aneb nemělo by vám uniknout, že
- Postinfekční glomerulonefritida u dospělých: skrytá tvář dlouho známého onemocnění
- Česko-slovenská patologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Serrated adenomy a karcinomy tlustého střeva
- Morfologie gastroezofageálního refluxu
- Folikulový lymfóm a lymfóm z plášťových buniek v biopsiách orgánov žalúdočno-črevnej oblasti
- Kožná bunková reakcia po popálení medúzou
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání

















