-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Primární velkobuněčný neuroendokrinní karcinom močového měchýře
Primary large cell neuroendocrine carcinoma of the urinary bladder
Large cell neuroendocrine carcinoma of the urinary bladder is rare. In the last five years, we have had the opportunity to see this type of cancer in an 88-year-old and in a 66-year-old males. In both cases, transurethral resection of carcinoma of the bladder was carried out. In the first case, urothelial carcinoma was detected and deeper in the bladder wall, large cell neuroendocrine carcinoma structures were found. In the second case, the bladder was only infiltrated with large cell neuroendocrine carcinoma. Both tumors expressed NSE, CD56 and synaptophysin. Other markers, such as those against calcitonin, chromogranin, PP, VIP, serotonin, gastrin, glucagon and somatostatin did not react with the tumor.
In the first case, no tumor dissemination was found; in the second case, clinical methods confirmed dissemination into the liver, left adrenal gland, spleen and paracaval lymph nodes. Given his age, the first patient only received symptomatic therapy. The other patient underwent chemotherapy and his condition is stable. Paraneoplastic manifestations of the tumors were not clinically found.
Histogenetic origin of neuroendocrine tumors is not fully clarified. In some cases, tumor development is thought to be associated with Brunn’s nests, cystitis cystica and urothelial carcinoma stem cells.Keywords:
primary large cell neuroendocrine carcinoma – urinary bladder – immunohistochemistry
Autoři: Jirka Mačák 1; Pavel Dundr 2; Jana Dvořáčková 1,3; Petr Buzrla 1; David Němec 4
Působiště autorů: Ústav patologie, Lékařská fakulta Ostravské univerzity a Fakultní nemocnice Ostrava, Česká republika 1; Ústav patologie, 1. lékařská fakulta Karlovy univerzity v Praze a Všeobecná fakultní nemocnice v Praze Česká republika 2; CGB laboratoř a. s. Ostrava, Česká republika 3; Urologické oddělení, Fakultní nemocnice Ostrava, Česká republika 4
Vyšlo v časopise: Čes.-slov. Patol., 49, 2013, No. 2, p. 80-83
Kategorie: Původní práce
Souhrn
Neuroendokrinní karcinom z velkých buněk se v močovém měchýři vyskytuje vzácně. V posledních pěti letech jsme měli možnost pozorovat dva takové nádory u 88letého a 66letého muže. V obou případech byla provedena transuretrální resekce nádoru močového měchýře. V prvním případě byl zjištěný uroteliální karcinom a hlouběji ve stěně měchýře byly zjištěny struktury neuroendokrinního karcinomu z velkých buněk. Ve druhém případě byl močový měchýř infiltrovaný pouze neuroendokrinním karcinomem. Oba nádory exprimovaly NSE, CD56 a synaptofyzin. Další markery např. proti kalcitoninu, chromograninu, PP, VIP, serotoninu, gastrinu, glukagonu a somatostatinu s nádorem nereagovaly.
V prvním případě nebyla zjištěna diseminace nádoru, ve druhém případě byla klinickými metodami zjištěna diseminace do jater, levé nadledviny, sleziny a parakaválních lymfatických uzlin. V prvním případě byla vzhledem k věku léčba pouze symptomatická, ve druhém případě pacient prodělal chemoterapii a jeho stav je stacionární. Paraneoplastické projevy nádorů nebyly klinicky zjištěny.
Histogenetický původ neuroendokrinních nádorů není zcela jasný. V některých případech se vznik nádorů dává do vztahu s Brunnovýmí čepy, cystitis cystica a kmenovými buňkami uroteliálních karcinomů.Klíčová slova:
neuroendokrinní karcinom z velkých buněk – močový měchýř – imunohistologie
Neuroendokrinní nádory a karcinomy se mohou objevovat prakticky kdekoliv, kde epitel vystýlá vývodné cesty nebo duté orgány. V močovém měchýři se vzácně objevují všechny typy nádorů z neuroendokrinních buněk. Podle novější klasifikace jde o neuroendokrinní tumory G1 a G2 (karcinoidy a atypické karcinoidy) a neuroendokrinní karcinomy G3 (malobuněčné a velkobuněčné; dále jen NEC G3). Přitom četnost malobuněčných karcinomu je výrazně vyšší než ostatních nádorů z neuroendokrinních buněk. Řada těchto nádorů se objevuje ve spojitosti s uroteliálními karcinomy (1,2,3).
POPIS PŘÍPADŮ
V posledních pěti letech jsme v bioptickém archivu Ústavu patologie Lékařské fakulty Ostravské univerzity a Ústavu patologie 1. lékařské fakulty Karlovy univerzity zjistili dva případy velkobuněčného NEC G3.
Případ 1. 88letý muž přišel pro retenci moči a potíže při močení. Klinickým vyšetřením byl zjištěný tumor močového měchýře v oblasti ústí pravého ureteru a v oblasti boční stěny měchýře. Byla provedena transuretrální resekce infiltrujícího nádoru. Byla odstraněna změněná sliznice a také nádorové masy hluboko ve svalovině měchýře. Vzhledem k věku pacienta byla dále indikována pouze symptomatická terapie.
Případ 2. 66letý muž, který byl přijatý pro hematurii. Klinicky byl zjištěný široce nasedající invazivně rostoucí tumor umístěný ve vertexu močového měchýře. Vyšetření CT a PET-CT, ukázalo, že jde o generalizovaný nádor s metastázami v játrech (zde byla zjištěna tři ložiska velikosti 30 – 40 mm), levé nadledvině (metastáza velikosti 8 mm), ve slezině (velikost metastázy 6 mm) a v parakaválních a paraaortálních lymfatických uzlinách, které byly velikosti do 40 mm. Pacient podstoupil 6 cyklů chemoterapie (platina a etoposid). Ložiska byla dále stacionární.
MATERIÁL A METODIKA
Kromě zevrubného klinického vyšetření a stanovení rozsahu postižení močového měchýře, bylo ve všech případech provedeno bioptické vyšetření. Kromě standardního vyšetření HE, bylo provedeno imunohistologické vyšetření.
Imunohistologické vyšetření bylo provedeno metodou avidin-biotin komplex (ABC metoda). Přitom byly provedeny pozitivní a negativní kontroly. Pro vyšetření byly použity následující protilátky (v závorce je pracovní ředění): CK20 (cytokeratin 20), klon ks 20.8 (prediluted); CK7, klon OV-TL 12/13 (1 : 50); polyclonal rabitt anti-human gastrin (1 : 2000); polyclonal rabbit anti-somatostatin (1 : 1000); monoclonal mouse anti-human serotonin, klon 5HT-H209 (1 : 100); polyclonal rabbit anti-human glucagon (1 : 1000), monoclonal mouse anti-human Ki-67 antigen, klon MIB-1 (1 : 50); monoclonal mouse anti-synaptophysin, klon SY38 (1 : 100). Tyto protilátky jsou produkty firmy DAKO Glostrup, DK. Monoclonal mouse anti-CD56 (NCAM), klon IB6 (1 : 50), Novocastra, Newcastle-upon-Tyne, UK. Monoclonal mouse anti neuron specific enolase (NSE), klon MIG-N3 (prediluted); monoclonal rabbit anti calcitonin, klon SP17 (prediluted); monoclonal mouse anti-chromogranin A, klon DAK-A3 (1 : 100) Biogenex. Rabbit anti-Pancreatic Polypeptide, klon 18-0043 (1 : 100), produkt Invitrogen GmbH, Lofer, Rakousko; VIP (Vasoactive Intestinal Peptide) (1 : 100), Immunostar USA; monoclonal rabbit anti TTF-1, klon G21-G (1 : 100), DB Biotech.
VÝSLEDKY
Případ 1. V preparátech byly přítomny poměrně malé úseky povrchového epitelu. V některých z nich byly struktury uroteliálního karcinomu G3 s drobnými papilárními proliferacemi (obr. 1). Nádor výrazně proliferoval do podslizničního vaziva. Mitózy byly velmi četné. Vytvářela se kompaktní nádorová ložiska. Nádor ložiskovitě nekrotizoval. Relativně velké nádorové buňky přecházely v menší buňky s hyperchromními kulatými nebo oválnými jádry. V některých úsecích byly vidět pruhovité proliferace nediferencovaného karcinomu mezi snopci svaloviny stěny měchýře, který exprimoval neuroendokrinné markery. Tyto úseky obsahovaly četné crash artefakty. V malém rozsahu nádor tvořil i zřetelné tubulární formace. V preparátech s markerem proti cytokeratinu 7 bylo patrné, že nenádorový epitel sliznice měchýře s protilátkou nereagoval (obr. 2). V úsecích, kde epitel přecházel v uroteliální karcinom byla zjištěna pozitivita. Nádor se šířil do podslizničního vaziva a do hlubších částí stěny měchýře. Velké nádorové buňky (CK7 pozitivní) v ložiscích pod povrchovým epitelem vykazovaly membránovou pozitivitu s protilátkou proti synaptofyzinu (obr. 3). Malé nádorové buňky s touto protilátkou nereagovaly nebo byla reakce velmi slabá. Marker CD56 vykazoval membránovou pozitivitu ve velkých i malých buňkách karcinomu (obr. 4). Vyšetření s protilátkou proti chromograninu bylo negativní. Celkově tedy nádor sestával jednak z uroteliálního karcinomu G3 a jednak z NEC G3 z velkých buněk.
Obr. 1. Uroteliální karcinom vytváří mikropapilární struktury (případ č. 1) (HE, 200x). 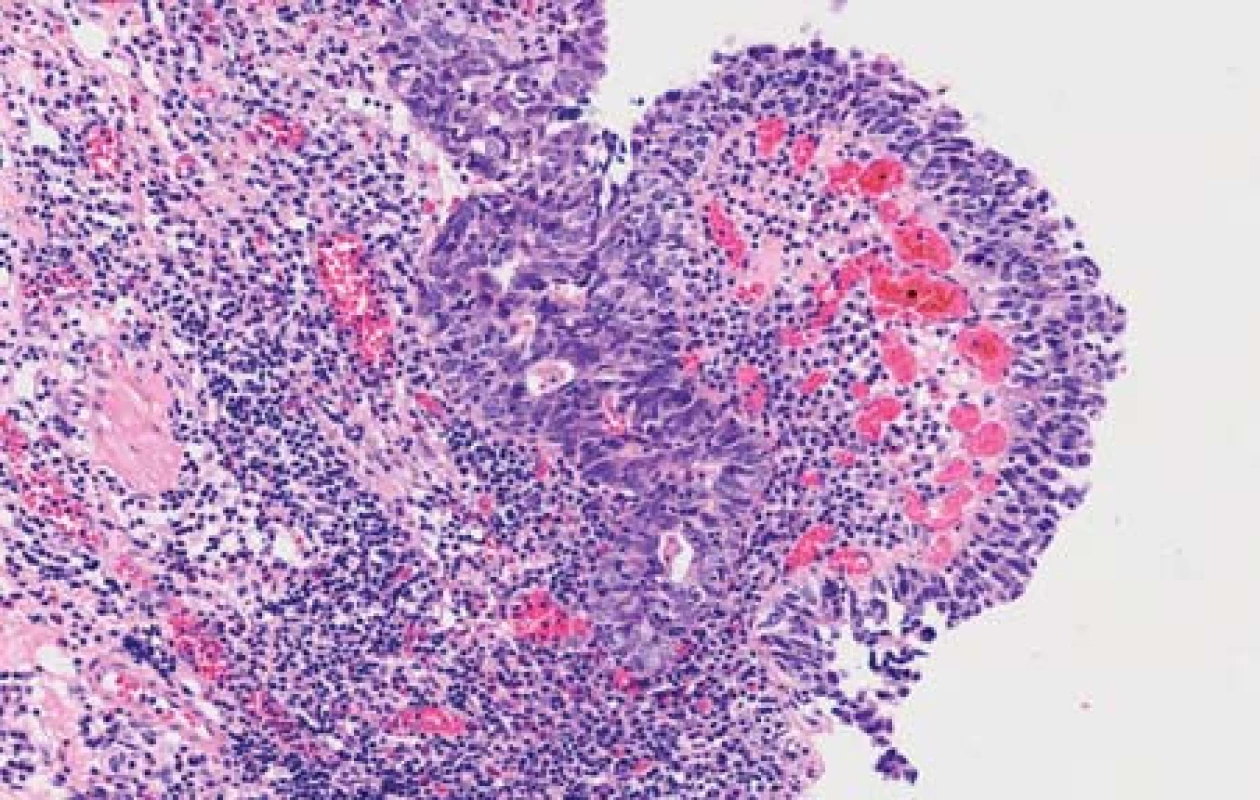
Obr. 2. Povrchový epitel močového měchýře reaguje negativně s protilátkou proti CK 7 (v pravé části obrázku) přechází do uroteliálního karcinomu, který je CK 7 pozitivní (imunohistologie, 200x). 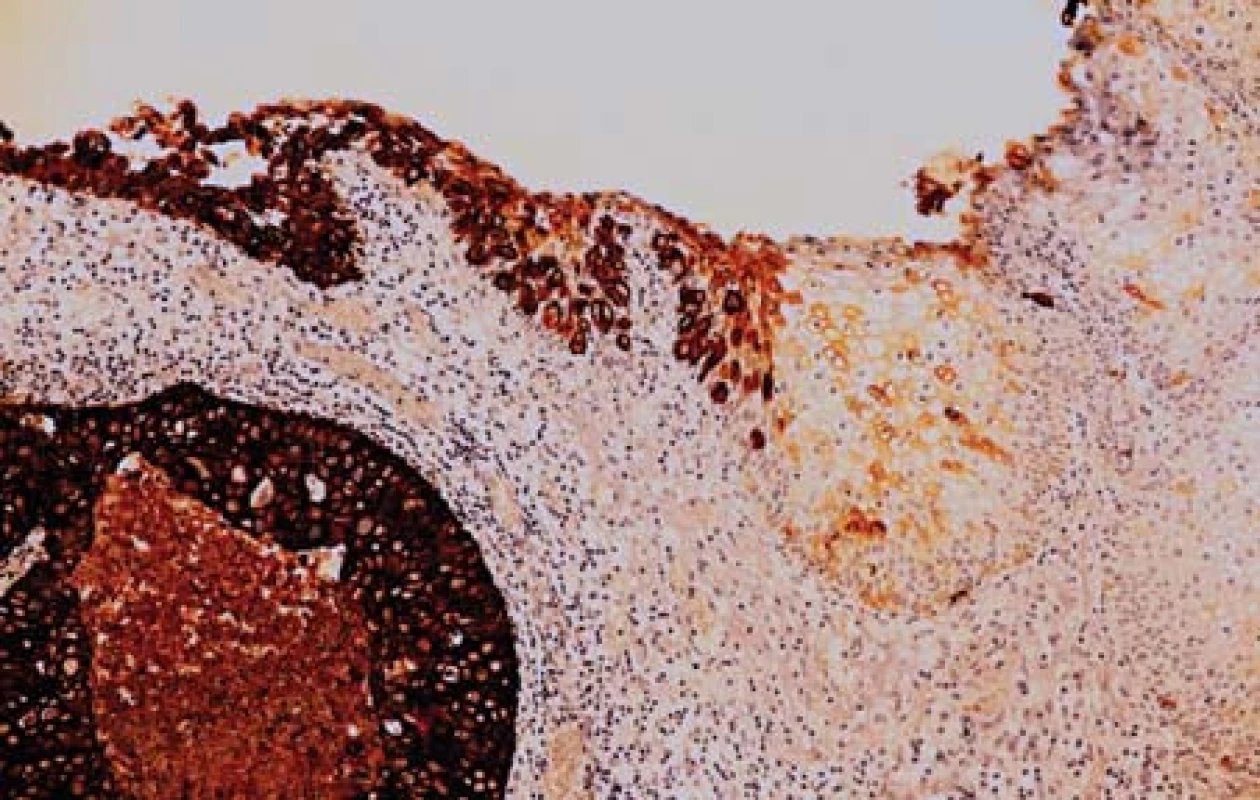
Obr. 3. Pozitivní nález s protilátkou proti synaptofyzinu (imunohistologie, 400x). 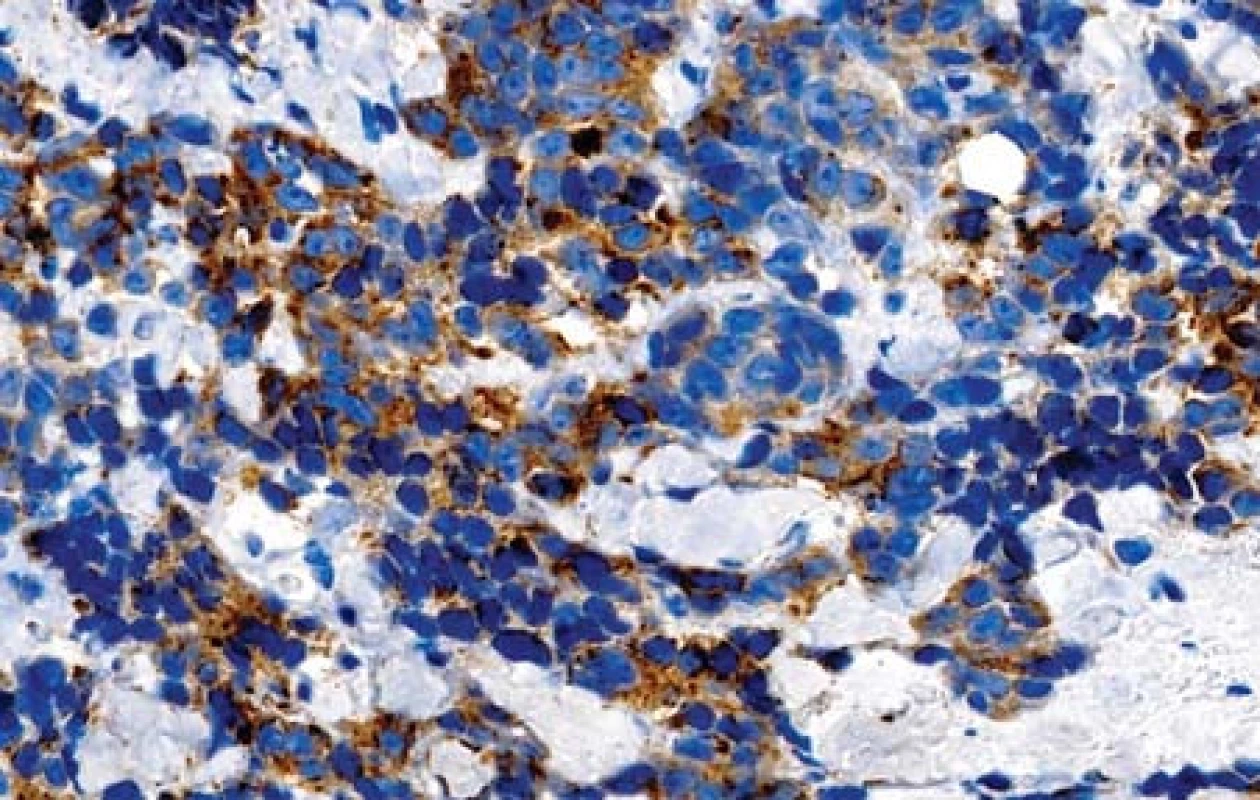
Obr. 4. Membránová pozitivita nádorových buněk s protilátkou proti CD 56 (imunohistologie, 400x). 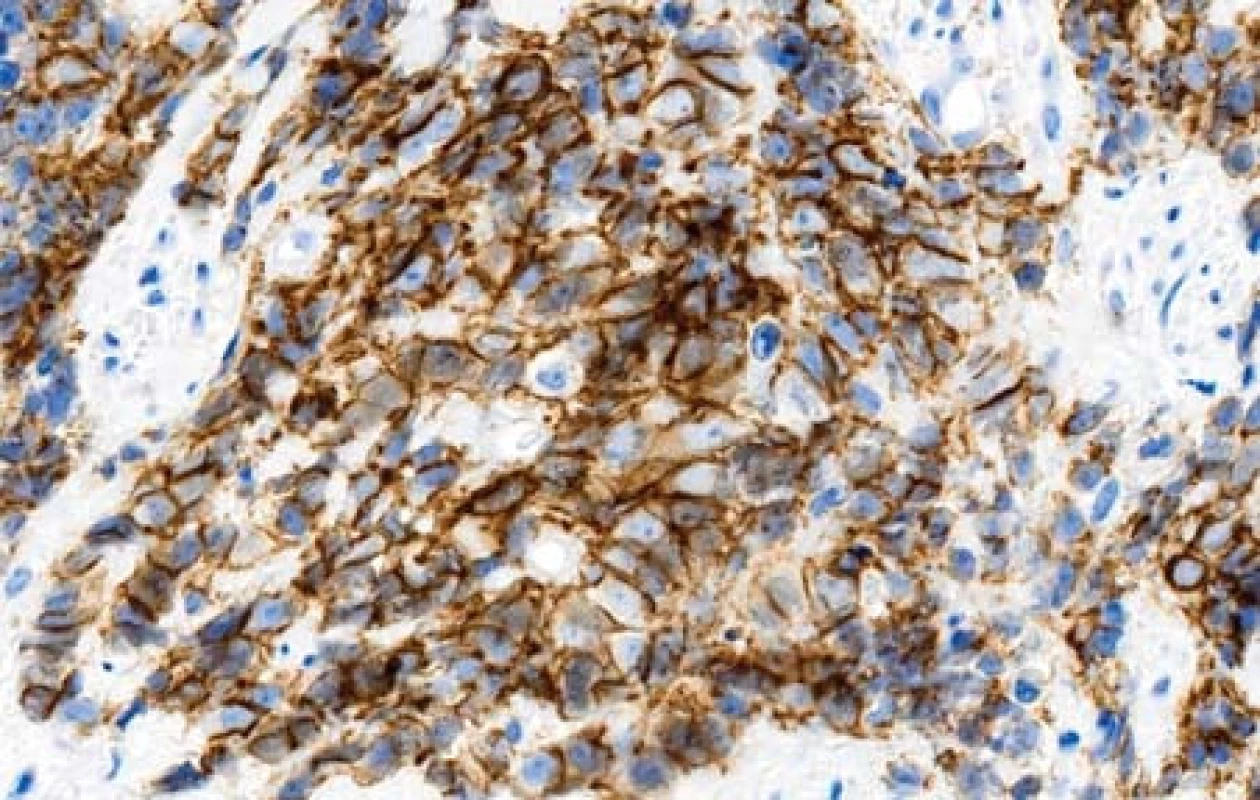
Případ 2. Povrchový epitel močového měchýře byl přiměřeného vzhledu. Pod epitelem byla rozsáhlá nádorová ložiska, která tvořila solidní uzly, v jiných úsecích měl nádor spíše trabekulární uspořádání (obr. 5). Nádorové buňky měly výrazně zvětšená jádra. Ta obsahovala jemné hrudky chromatinu. Jadérka byla nezřetelná. Ložiskovitě byl nádor nekrotický. Mitotická aktivita byla výrazná. Nádor ložiskovitě reagoval s protilátkou proti NSE. Všechny nádorové buňky vykazovaly pozitivní nález s protilátkou proti CD56 a úsekovitě slabou pozitivitu s protilátkou proti synaptofysinu. Nádor byl tvořený pouze strukturami NEC G3 z velkých buněk
Obr. 5. Trabekulární uspořádání nádorových buněk velkobuněčného NEC G3 (případ č. 2) (HE, 400x). 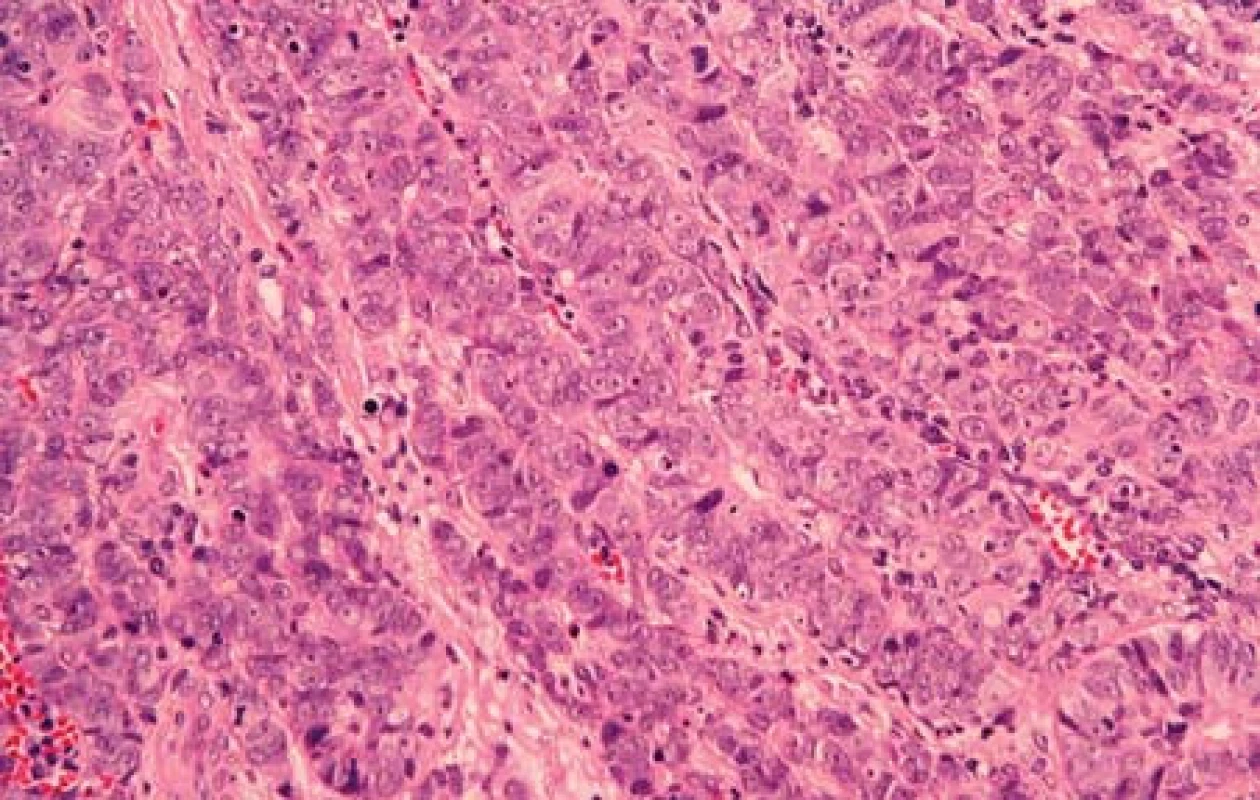
Výsledky imunohistologického vyšetření jsou uvedeny v tabulce č. 1.
Tab. 1. Výsledky imunohistologického vyšetření. 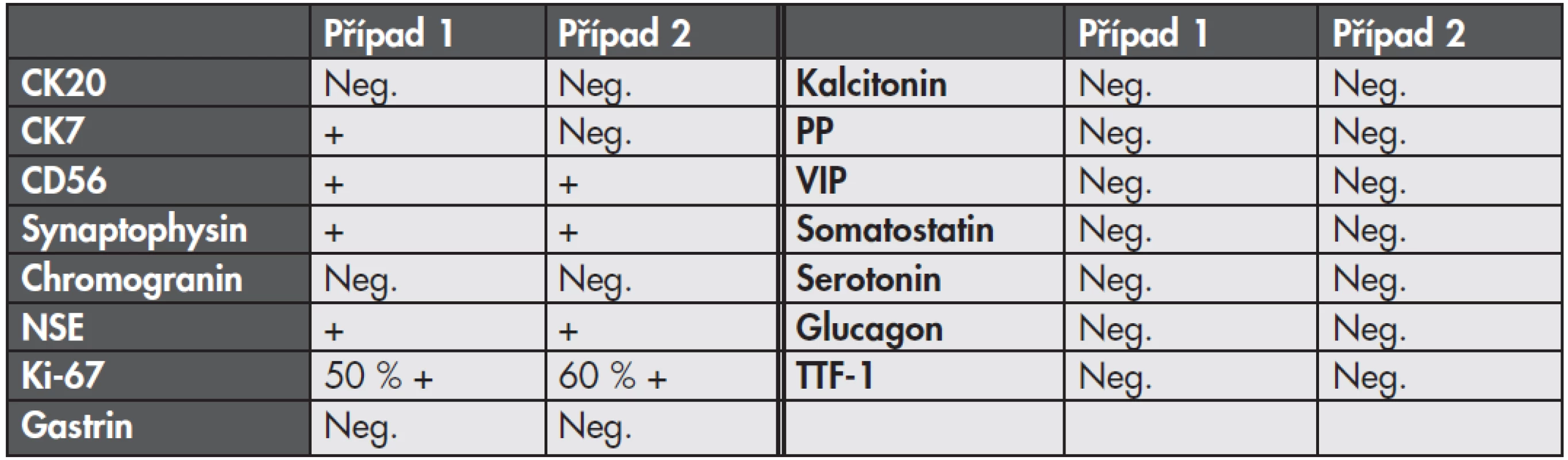
NSE – neuron specific enolase; TTF-1 – thyroid transcription factor 1; PP – pancreatic polypeptide; VIP – vasoactive intestinal polypeptide DISKUZE
Histogenetický původ neuroendokrinních nádorů močového měchýře není jednoznačný. Přítomnost cystitis glandularis nebo Brunnových čepů v bezprostředním okolí nádoru může ukazovat na původ neuroendokrinních buněk v těchto strukturách. Zatím neexistují přímé důkazy o přechodu a návaznosti těchto benigních epitelových změn na neuroendokrinní tumor G1 a G2 nebo NEC G3.
Neuroendokrinní tumory G1 a G2 se objevují poměrně často v gastrointestinálním nebo dýchacím traktu. V močovém měchýři se tyto nádory nacházejí vzácně. Sugihara a spol. (4) v práci publikované v r. 2003 uvádějí 16 případů a poslední údaje z r. 2012 (5) uvádějí 14 případů „čistých“ forem a 10 kombinovaných případů, u kterých byl současně diagnostikovaný uroteliální karcinom, adenokarcinom nebo malobuněčný karcinom močového měchýře. Přesné posouzení jednotlivých dosud publikovaných případů je obtížné, některé starší popisy neobsahují dostatečné množství relevantních údajů včetně histologických a imunohistologických nálezů. Mortignoni a spol. (6) kriticky hodnotili dříve publikované případy a podle fotografické dokumentace nálezy přehodnotili. Ve třech případech (ze čtyř) na NEC G3 a čtvrtý případ označili jako paragangliom.
Kombinované nádory se chovají agresivně, zatímco prognóza „čistých“ neuroendokrinních tumorů je velmi dobrá. Chen a spol. (2) u šesti případů, které byly klinicky sledovány v rozmezí 3 měsíců až 4 let (3 případy byly sledovány v delším intervalu než 4 roky), nezaznamenali recidivu nebo progresi onemocnění. Přesto mohou některé nádory metastazovat do okolních lymfatických uzlin nebo se objevují vzdálené metastázy (např. v játrech a mozku) a to až ve 25 % (2). V jednom případě neuroendokrinního nádoru G1 byl imunohistologicky prokázán pozitivní nález s protilátkou proti calcitoninu (7).
NEC G3 močového měchýře se vyskytují ve dvou morfologicky odlišných variantách: velkobuněčné a malobuněčné. Objevují se často současně spolu s uroteliálním karcinomem u starších pacientů (8). Velkobuněčná varianta NEC G3 je stejně vzácná jako neuroendokrinní tumory (G1 a G2) (3,8–12). Častěji se vyskytují malobuněčné NEC G3, kterých bylo popsáno více než 400 (1). V našem prvním případě byl rovněž zjištěný současný výskyt uroteliálního karcinomu a velkobuněčné varianty NEC G3. Ve druhém případě byl zjištěný pouze NEC G3 z velkých buněk.
NEC G3 se vyskytuje většinou v rozmezí 7. a 8. dekády, častěji u kuřáků. Průměrná doba přežívání je 19,6 měsíců (13). Histogeneze nádorů není jednoznačná. Vedle již zmíněné možnosti vzniku z buněk, které se objevují u cystitis glandularis nebo v Brunnových čepech, existují i další teorie, např. vznik z nediferencovaných nebo kmenových buněk sliznice močového měchýře. Nelze rovněž vyloučit ani jejich vznik z kmenových nádorových buněk uroteliálních karcinomů. Tuto posledně jmenovanou teorii je možné podpořit právě těsnou spojitostí NEC G3 a uroteliálního karcinomu. To jsme mohli pozorovat i v našem prvním případě. Nádory se šíří do okolí měchýře, ale mohou tvořit i vzdálené metastázy, nejčastěji v plicích a játrech. Objevily se i metastázy v neobvyklých lokalizacích: v jednom případě v mozku (14) a ve druhém případě v kůži (15). V této lokalizaci je nutné vyloučit karcinom z Merkelových buněk, zvláště pak, když nádor exprimuje CK20. Exprese tohoto markeru se u uroteliálních karcinomů vyskytuje poměrně často (15,16). Nádory v obou našich případech CK20 neexprimovaly. V jednom případě jsme zjistili pozitivní nález s protilátkou proti CK7. Tento marker je pozitivní u řady uroteliálních karcinomů a malobuněčných NEC G3 močového měchýře (15).
Velkobuněčný NEC G3 močového měchýře se objevuje zřídka. Do roku 2011 bylo popsáno 17 takových nádorů (17). Naše dva případy zvyšují jejich množství na 19. Nádor je charakterizovaný velkými buňkami, které jsou polygonální, nukleoplazmatický index je nízký, jaderný chromatin je zpravidla hrubě zrnitý a často jsou přítomny nukleoly. Mitotický index je vysoký. Histologicky se nádor podobá NEC G3 jiných lokalizací. Ložiska nádorových buněk mají zpravidla palisádovité postavení proti okolí nebo tvoří trabekuly. Nádorové buňky vykazují pozitivní imunohistochemický průkaz s markery: NSE, CD56, synaptofyzinem a chromograninem. V našich dvou případech byl pozitivní nález s protilátkami proti CD56, synaptofyzinu a NSE. Oba nádory neexprimovaly protilátku TTF-1. Ukazuje se, že asi 30 % – 50 % NEC G3 v mimoplicní lokalizaci exprimuje TTF-1. Oktreoscanová scintigrafie bývá pozitivní v nádorových masách a ve vzdálených metastázách. Výsledky tohoto vyšetření jsou přesnější, než je tomu u vyšetření CT a MRI (18). Nejčastějším klinickým symptomem je hematurie, bolesti v oblasti pánve a obstrukce močových cest.
Malobuněčný karcinom (NEC G3) je častější než výše uvedený NEC G3 z velkých buněk. Frekvence výskytu se pohybuje v rozmezí 0,5 – 0,7 % (3) ze všech primárních nádorů močového měchýře. Frekvence výskytu je největší v 7. dekádě u mužů. Na rozdíl od obdobného karcinomu, který se objevuje v plicích, zpravidla chybí paraneoplastické projevy. Morfologicky se podle některých autorů (3,19,20) asi v 50 % případů objevuje v kombinaci s uroteliálním karcinomem a u karcinomů se skvamózní či glandulární diferenciací. Většinou se chová značně agresivně a má proto horší prognózu než samotný uroteliální karcinom. V urogenitálním systému se vyskytuje nejčastěji právě v močovém měchýři. Klinická symptomatologie je obdobná jako u uroteliálního karcinomu. Patří sem: dysurie, poruchy vyprazdňování, ztráta váhy, bolesti v oblasti pánve a břicha, obstrukce ureteru a opakované infekce močového systému. Nejčastěji se objevuje hematurie. Jako rizikový faktor pro vznik nádoru se považuje kouření.
Prognóza malobuněčného NEC G3 závisí na rozsahu postižení v době diagnózy. Jiné faktory, např. status p53, věk pacienta, pohlaví a současná symptomatologie, zdá se, nekorelují s prognózou (21). Podle některých autorů (22) samotný malobuněčný karcinom má horší prognózu než jeho kombinace např. s uroteliálním karcinomem. Průměrná doba přežití je 6 - 34,9 měsíců a pětileté přežití se pohybuje v rozmezí 8 – 40 % (1,23–26).
Léčba velkobuněčného i malobuněčného NEC G3 je závislá na stagingu, ale vzhledem k malé četnosti těchto nádorů nebyl vypracován závazný algoritmus léčby. Léčba spočívá v aplikaci radikálních chirurgických metod, např. cystektomie, parciální cystektomie, transuretrální resekce. Tato léčba se kombinuje s chemoterapií a radioterapií. Samotná transuretrální resekce se rezervuje na případy, kde není možná agresivní chirurgická léčba.
Adresa pro korespondenci:
Prof. MUDr. Jirka Mačák, CSc.
Ústav patologie, Fakultní nemocnice Ostrava
17. listopadu 1790, 708 52 Ostrava
e-mail: macak.jirka@seznam.cz
tel.: 737054581
Zdroje
1. Amin MB. Histological variants of urothelial carcinoma: diagnostic, therapeutic and prognostic implications. Modern Pathol 2009; 22: S96-S118.
2. Chen Y-B, Epstein JI. Primary carcinoid tumors of the urinary bladder and prostatic urethra: a clinicopathologic study of 6 cases. Am J Surg Pathol 2011; 35 : 442-446.
3. Lee KH, Ryu SB, Lee MC, Park CS, Juhnag SW, Choi C. Primary large cell neuroendocrine carcinoma of the urinary bladder. Pathol Int 2006; 56 : 688-693.
4. Sugihara A, Kajio K, Yoshimoto T, et al. Primary carcinoid tumor of the urinary bladder. Int Urol Nephrol 2002; 33 : 53-57.
5. Zozumi M, Nakai M, Matsuda I, et al. Primary carcinoid tumor of the urinary bladder with prominent subnuclear eosinophilic granules. Pathol Res Pract 2012; 208 : 109-112.
6. Martignoni G, Eble JN. Carcinoid tumors of the urinary bladder. Immunohistochemical study of 2 cases and review of the literature. Arch Pathol Lab Med 2003; 127: e22-e24.
7. Mascolo M, Atieri V, Mignogna C, Napodano G, deRosa G, Insabato L. Calcitonin-producing well-differentiated neuroendocrine carcinoma (carcinoid tumor) of the urinary bladder: case report. BMC Cancer 2005; 27 : 88.
8. Bertaccini A, Marchiori D, Cricca A, et al. Neuroendocrine carcinoma of the urinary bladder: case report and review of the literature. Anticancer Res 2008; 58 : 1369-1372.
9. Hailemariam S, Gaspert A, Komminoth P, Tamboli P, Amin M. Primary pure large cell neuroendocrine carcinoma of the urinary bladder. Mod Pathol 1998; 11 : 1016-1020.
10. Dundr P, Pešl M, Povýšil C, Vítková I, Dvořáček J. Large cell neuroendocrine carcinoma of the urinary bladder with lymphoepithelioma-like features. Pathol Res Pract 2003; 199 : 559-563.
11. Alijo Serrano F, Sánchez-Mora N, Angel AJ, Hernández C, Alvarez-Fernández E. Large cell and small cell neuroendocrine bladder carcinoma: immunohistochemical and outcome study in a single institution. Am J Clin Pathol 2007; 128 : 733-739.
12. Evans AJ, Al-Maghrabi J, Tsihlias J, Lajole G, Sweet JM, Chapman WB. Primary large cell neuroendocrine carcinoma of the urinary bladder. Arch Pathol Lab Med 2002; 126 : 1229-1232.
13. Abbas F, Civantos F, Benedetto P, Soloway MS. Small cell carcinoma of the bladder and prostate. Urology 1995; 46 : 617-630.
14. Tsugu A, Yoshiyama M, Matsumae M. Brain metastasis from large cell neuroendocrine carcinoma of the urinary bladder. Surg Neurol Int 2011; 2 : 84.
15. Lee WJ, Kim CH, Chang SE, et al. Cutaneous metastasis from large-cell neuroendocrine carcinoma of the urinary bladder expressing CK20 and TTF-1. Am J Dermatopathol 2009; 31 : 166-169.
16. Buchumensky V, Klein A, Zemer R, Kessler OJ, Zimlichman S, Nissenkom J. Cytokeratin 20: a new marker for early detection of bladder carcinoma? J Urol 1998; 160 : 1971-1974.
17. Martin IJP, Vilar DG, Aguado JM, et al. Large cell neuroendocrine carcinoma of the urinary bladder. Bibliographic review. Arch Esp Urol 2011; 64 : 105-113.
18. Li Y, Outman JE, Mathur SC. Carcinosarcoma with a large cell neuroendocrine epithelial component: first report of an unusual biphasic tumour of the urinary bladder. J Clin Pathol 2004; 57 : 318-320.
19. Cheng L, Pan CX, Yang XJ, et al. Small cell carcinoma of the urinary bladder: a clinicopathologic analysis of 64 patients. Cancer 2004; 101 : 957-962.
20. Choong NW, Quevedo JF, Kaur JS. Small cell carcinoma of the urinary bladder. The Mayo Clinic experience. Cancer 2005; 103 : 1172-1178.
21. Church DN, Bahl A. Clinical review – small cell carcinoma of the bladder. Cancer Treat Rev 2006; 32 : 588-593.
22. Ismaili N, Heudel PE, Elkarak F, et al. Outcome of recurrent and metastatic small cell carcinoma of the bladder. BMC Urol 2009; 9 : 1-8.
23. Pan CX, Yang XJ, Lopez-Beltran A, et al. c-kit expression in small cell carcinoma of the urinary bladder: prognostic and therapeutic implications. Mod Pathol 2005; 18 : 320-323.
24. Bex A, Nieuwenhuijzen JA, Kerst M, et al. Small cell carcinoma of bladder: a single-center prospective study of 25 cases treated in analogy to small lung cancer. Urology 2005; 65 : 295-299.
25. Sved P, Gomez P, Manoharan M, Civantos F, Soloway MS. Small cell carcinoma of the bladder. BJU Int 2004; 94 : 12-17.
26. Abrahams NA, Moran C, Reyes AO, Siefker-Radtke A, Ayala AG. Small cell carcinoma of the bladder: a contemporary clinicopathological study of 51 cases. Histopathology 2005; 46 : 57-63.
Štítky
Patologie Soudní lékařství Toxikologie
Článek Jak se vám líbí?Článek Ceny za rok 2012
Článek vyšel v časopiseČesko-slovenská patologie

2013 Číslo 2-
Všechny články tohoto čísla
- Životní jubileum prof. MUDr. Ctibora Povýšila, DrSc.
-
Jak se dělá časopis
Česko-slovenská patologie - … mcdonaldizaci patologie je třeba čelit!
- MONITOR aneb nemělo by vám uniknout, že...
-
Cytopatologie 2012: screening – vzdělávání – diagnostika
Hlavní témata 37. evropského cytologického kongresu:
Dubrovník – Cavtat, Chorvatsko 30. 9. – 3. 10. 2012 - Lidské papilomaviry se neúčastní v etiopatogeneze nádorů slinných žláz
- Subependymálny obrovskobunkový astrocytóm s atypickými klinickými a patologickými črtami: diagnostická pasca
- Primární velkobuněčný neuroendokrinní karcinom močového měchýře
- Intersticiální plicní procesy
- Perineurióm podobný angiofibrómu. Kazuistika
- Nová zárodečná mutace v CYLD genu u slovenského pacienta s Brookeovým-Spieglerovým syndromem
- Jak se vám líbí?
- Intersticiální plicní procesy
- Ceny za rok 2012
- Nediagnostikovaná Whippleova choroba s letálnym koncom
- Difuzní idiopatická hyperplázie neuroendokrinních buněk: popis případu a přehled literatury
- Česko-slovenská patologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Nediagnostikovaná Whippleova choroba s letálnym koncom
- Primární velkobuněčný neuroendokrinní karcinom močového měchýře
- Životní jubileum prof. MUDr. Ctibora Povýšila, DrSc.
- Difuzní idiopatická hyperplázie neuroendokrinních buněk: popis případu a přehled literatury
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



