-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Metodické přístupy pro analýzu bakteriomu kořenového systému zubu postiženého apikální periodontitidou
Methodological approaches for the bacteriome analysis of the root canal system of a tooth affected by apical periodontitis
Introduction, aim: Apical periodontitis (AP) is an inflammatory disease of the dental periradicular tissues caused by a bacterial infection. Various methodological approaches are used to determine the bacteria inhabiting the root canals, however, the analysis of the entire root system of a tooth affected by AP still remains a challenge. The aim of our study was to perform a literature search focused on sample collection procedures and methodologies for bacteriome analysis, and then propose a suitable methodological approach for the purpose of studying the etiopathogenesis of this disease.
Methods: After searching the PubMed database, we selected only publications of the original work type in which the bacterial DNA of human teeth was analyzed, for the search.
Results: Methodologically, the studies differ greatly, in terms of sample collection, DNA isolation, and bacterial DNA analysis itself. A common method of sample collection is the use of sterile endodontic paper points. Although this method of sampling is suitable in clinical practice, it is considered insufficient for a comprehensive analysis of the environment of the root canal system, due to the morphology of the tooth itself and the presence of ramifications. Another method of sampling is resection of the root tip using sterile burs and subsequent grinding of the apex or smearing with sterile endodontic paper pins. Only the apical part of the tooth is used to determine the bacteriome, therefore bacteria that colonize the coronal part of the tooth and participate in the etiopathogenesis of the disease cannot be analyzed. In recent studies, a method is used in which the entire extracted tooth affected by AP is ground into a fine homogeneous powder using cryogenic grinding. It is possible to determine the complex bacteriome of the root canal system and the pulp chamber from the dust of a crushed tooth, and therefore this method seems optimal for the sample preparation from an experimental study point of view. Most often, an effective column method with various purification kits is used for DNA isolation, and for subsequent DNA analysis, methodologies based on the principle of the polymerase chain reaction are mostly used. Sequencing the variable regions of the gene for 16S rRNA is nowadays already the gold standard for categorizing bacteria and characterizing bacterial communities.
Conclusion: To study the AP bacteriome, it seems most appropriate to use extracted tooth samples and immediate freezing of the sample without further pre-analytical steps. The crushed tooth is a suitable matrix for the isolation of microbial DNA with commercially available kits, provided that sterile conditions are maintained during cryogenic grinding. Currently, next-generation sequencing is the best choice for determining the bacteriome and obtaining information about the relative abundance of bacterial genera, both analytically and economically.
Keywords:
apical periodontitis, root canal, cryomill, bacteriome, sequencing
Autoři: S. Cerulová 1; D. Száraz 2; D. Gachová 1; M. Kapitán 3; P. Bořilová Linhartová 1,2,4
Působiště autorů: Recetox, Přírodovědecká fakulta, Masarykova univerzita, Kotlářská 2, Brno 1; Klinika ústní, čelistní a obličejové chirurgie, Masarykova univerzita, Lékařská fakulta, a Fakultní nemocnice Brno 2; Stomatologická klinika, Univerzita Karlova, Lékařská fakulta v Hradci Králové, a Fakultní nemocnice Hradec Králové 3; Stomatologická klinika, Masarykova univerzita, Lékařská fakulta, a Fakultní nemocnice u sv. Anny v Brně 4
Vyšlo v časopise: Česká stomatologie / Praktické zubní lékařství, ročník 123, 2023, 4, s. 105-114
Kategorie: Přehledový článek
Souhrn
Úvod a cíl: Apikální periodontitida (AP) je zánětlivé onemocnění zubních periradikulárních tkání vyvolané bakteriální infekcí. Ke stanovení bakterií osídlujících kořenové kanálky jsou využívány různé metodické přístupy, analýza bakteriomu celého kořenového systému zubu postiženého AP je však zatím stále výzvou. Cílem naší přehledové práce bylo vytvořit literární rešerši zaměřenou na postupy pro odběr vzorku a metodiku pro analýzu bakteriomu a poté navrhnout vhodný metodický přístup k účelu studia etiopatogeneze tohoto onemocnění.
Metodika: Po vyhledávání v databázi PubMed jsme do rešerše vybrali pouze publikační výstupy typu původní práce, ve kterých byla analyzována bakteriální DNA lidských zubů.
Výsledky: Metodicky se studie mezi sebou velmi liší, a to jak způsobem odběru vzorku, izolací DNA, tak i samotnou analýzou bakteriální DNA. Častým způsobem odběru vzorku je využití sterilních endodontických papírových čepů. Tento způsob odběru vzorku je sice vhodný v rámci klinické praxe, avšak pro komplexní analýzu prostředí kořenového systému je považován za nedostatečný, a to kvůli samotné morfologii zubu a přítomnosti ramifikací. Jiným způsobem odběru vzorku je resekce kořenového hrotu pomocí sterilních fréz a následné rozemletí apexu nebo provedení stěru sterilními endodontickými papírovými čepy. Ke stanovení bakteriomu je tak využívána pouze apikální část zubu, tudíž bakterie, které kolonizují koronární část zubu a podílejí se na etiopatogenezi onemocnění, nemohou být analyzovány. V recentních studiích je využívána metoda, při které je celý extrahovaný zub postižený AP nadrcen na jemný homogenní prach pomocí kryogenního mletí. Z prachu nadrceného zubu je možné stanovit komplexní bakteriom kořenového systému i dřeňové dutiny, a proto se tento způsob z pohledu přípravy vzorku pro experimentální studii jeví jako optimální. Nejčastěji je při izolaci DNA využívána efektivní kolonková metoda různými purifikačními soupravami a k následné analýze DNA slouží většinou metodiky založené na principu polymerázové řetězové reakce. Sekvenování variabilních oblastí genu pro 16S rRNA je v dnešní době již zlatým standardem pro kategorizaci bakterií a charakterizaci bakteriálních komunit.
Závěr: Ke studiu bakteriomu AP se jeví jako nejvhodnější použít vzorky extrahovaných zubů a bezprostředně je zamrazit bez dalších preanalytických kroků. Nadrcený zub je při dodržení sterilních podmínek při kryogenním mletí vhodnou matricí pro izolaci mikrobiální DNA komerčně dostupnými kity. V současné době je pro stanovení bakteriomu a získání informace o relativní abundanci bakteriálních rodů, a to z analytického i ekonomického hlediska, sekvenování nové generace nejlepší volbou.
Klíčová slova:
apikální periodontitida, kořenový kanálek, kryomlýn, bakteriom, sekvenování
ÚVOD
Apikální periodontitida (AP) je onemocnění zubních periradikulárních tkání způsobené mikrobiální infekcí. Dřeňová dutina nevitálního zubu je infikována endogenními orálními mikroorganismy, které prostupují ze zubního kazu nebo skrze praskliny způsobené traumatem tvrdé zubní tkáně či z parodontálního chobotu. Postupně dochází k infikování kořenových kanálků (KK). Přítomností orální mikrobioty v kořenovém systému a pronikáním bakterií či jejich metabolitů přes foramen apicale dochází k iniciaci zánětlivé odpovědi organismu. V případě chronické formy zánětu dochází k vytvoření periapikálního granulomu. Bakterie, které jsou přítomné a dlouhodobě osídlují apikální kořenový systém, se tak přímo podílejí na etiopatogenezi tohoto zánětlivého onemocnění [1, 2].
Infekce KK má heterogenní složení, kde žádný jednotlivý bakteriální druh nebo kmen nelze považovat za hlavní endodontický patogen. Příčinou AP je dysbióza a výskyt vícero bakterií s patogenním potenciálem v oblasti periradikulárních tkání [3, 4]. Mikrobiální komunita systému KK zubu postiženého AP je tvořena bakteriemi aerobními i anaerobními. Aerobní bakterie se nacházejí převážně v koronární části kořene, protože je zde dostatečný přísun kyslíku, který potřebují nejen pro přežití, ale především pro rozmnožování. V systému KK zubu s AP celkově převládají bakterie anaerobní, nejvíce jsou pak zastoupené v apikální části kořene. Nejčastějšími anaerobními bakteriemi, které osídlují infikovaný KK, jsou Fusobacterium nucleatum, Porphyromonas gingivalis, Prevotella baroniae a Olsenella uli. Přítomné jsou také Gemella morbillorum nebo Streptococcus mitis, což jsou typičtí zástupci fakultativně anaerobních bakterií [4–7]. U nevitálního zubu s infikovaným KK (gangréna) se mohou vyskytovat také houby, např. Candida sp. [8].
V oblastech zubu s obtížným přístupem pro nástroje a iriganty, jako je apikální část KK, laterální kanálky, ramifikace, isthmy a dentinové tubuly, je komplexní analýza mikrobioty výzvou. Bakterie, které kolonizují tato místa, mohou být v přímém kontaktu s periodonciem, což může vést k rozvoji perzistentní AP. Dalšími faktory, které se mohou podílet na vzniku perzistentní formy AP, jsou nedodržení aseptické kontroly, nenalezení KK při ošetření, špatně provedený debridement neboli odstranění nekrotické tkáně, neadekvátní opracování stěn KK, nedostatečná dezinfekce kořenového systému a také zhotovení netěsné výplně [13, 14]. Léčba AP spočívá v ošetření infikovaných KK postiženého zubu [11, 12]. Toto ošetření nemusí být vždy úspěšné ani při adekvátním opracování a zaplnění kořenového kanálku, např. z důvodu extraradikulární infekce nebo přítomnosti biofilmu, a proto AP v takových případech dále přetrvává [13]. Doporučenou léčbou při perzistentní AP je odstranění zdroje zánětu operačními postupy. Chirurgická léčba zahrnuje resekci kořenového hrotu s retrográdním plněním, případně extrakci zubu [14].
S progresem molekulárně biologických metod se k analýze bakterií KK u zubů postižených AP využívá analýzy jejich genomu (konkrétně bakteriomu, neboli souhrnné bakteriální genetické informace ve vzorku). Hlavním cílem našeho článku bylo sumarizovat používané metodické přístupy, diskutovat o jejich výhodách a nevýhodách a následně navrhnout nejefektivnější metodu ke stanovení komplexního bakteriomu systému KK zubu s AP v rámci studia etiopatogeneze tohoto onemocnění.
METODIKA
K vyhledávání informačních zdrojů jsme použili databázi PubMed. Do tohoto vyhledávacího nástroje jsme zadali klíčová slova (apical OR periapical) AND (periodontitis OR granulom* OR lesion OR cystogranulom*) AND (microb* OR bacter* OR infect* OR pathogen) AND (isolationion OR sampling). Zařadili jsme pouze články, které i) byly publikovány od roku 2010, z důvodu aktuálnosti molekulárně biologických přístupů používaných ve studiích, ii) jsou typu „original articles“ a „case report“, iii) zabývají se stanovením mikrobiomu u pacientů s AP (primární, sekundární i perzistentní). Vyhledávání podle stanovených kritérií provedli dva spoluautoři nezávisle na sobě, následně jsme dvě literární rešerše mezi sebou porovnali a provedli po kontrole sporných položek jejich sloučení. Podle dohodnutých kritérií jsme provedli další selekci informačních zdrojů, a to vyřazení publikace, která i) je duplikátem jiné zařazené publikace, ii) se věnuje mykobiomu a nikoli bakteriomu, iii) obsahuje sice vzorky od pacientů s AP, ale nebyl analyzován zub nebo KK, a iv) neobsahovala dostatečný metodický popis analýzy bakteriomu KK.
Do literární rešerše jsme zahrnuli studie, ve kterých je popsána analýza komplexního bakteriomu KK, ale i ty, jejichž cílem bylo stanovit pouze jednu nebo několik vybraných bakterií.
VÝSLEDKY
Podle stanovených kritérií jsme nalezli celkem 67 článků vhodných pro vytvoření literární rešerše, která je sumarizována v doplňkové tabulce S1 (dostupná online na webu www.cspzl.dent.cz). U každé studie jsme zaznamenali: i) odběr vzorků – jak byl vzorek pro analýzu bakteriomu zubu odebírán, ii) přípravu vzorků na analýzu – jak byl vzorek zpracován, iii) jak proběhla izolace DNA a iv) analýza bakteriomu, a v) kolik vzorků bylo analyzováno. Schéma metodického postupu při odběru biologického materiálu a analýze bakteriomu KK zubu jsme sumarizovali v obrázku 1.
Celkem bylo v těchto studiích analyzováno 2027 zubů, a to v rozmezí 5 až 231 zubů na studii. Průměrně bylo analyzováno 30 vzorků na studii. V 66 článcích bylo uvedeno, že před odběrem vzorků byla provedena dezinfekce dutiny ústní nebo samotného vzorku zubu. V 78 % ze všech vyhledaných studií využili k odběru vzorku endodontické papírové čepy. Ve 13 z 52 těchto studií byly navíc k odběru dalších vzorků použity i jiné endodontické či chirurgické nástroje. Invazivní způsob odběru vzorku zahrnující extrakci a/nebo resekci zubu byl využit v necelé pětině všech studií. V devíti studiích (13 % ze všech publikací zařazených do rešerše) byla k drcení zubu využita metoda kryogenního mletí, tyto studie jsou shrnuty v tabulce 1 [10, 15–22]. V osmi z devíti těchto výzkumů byly extrahované zuby před nadrcením rozděleny na apikální a koronární část, aby bylo možné stanovit bakteriom v jednotlivých fragmentech a porovnat výsledky.
V 54 studiích byl k izolaci DNA použit komerční kit, z čehož v 65 % byl využíván QIAamp DNA Mini Kit (Qiagen, Německo). Ve 44 studiích byla provedena sekvenační analýza genu pro 16S rRNA. Dalšími poměrně často využívanými přístupy při analýze bakteriální DNA byla kvantitativní polymerázová řetězová reakce (qPCR), která byla využita v téměř 18 % studií, nebo DNA hybridizační metoda, která byla použita v 16 % studií.
Tab. 1. Přehled metodických postupů analýzy bakteriomu zubu postiženého apikální periodontitidou – výběr pouze studií zahrnujících kryogenní mletí vzorku. Tab. 1 Overview of methodological procedures for the analysis of the bacteriome of a tooth affected by apical periodontitis – selection of only studies involving cryogenic grinding of the sample. 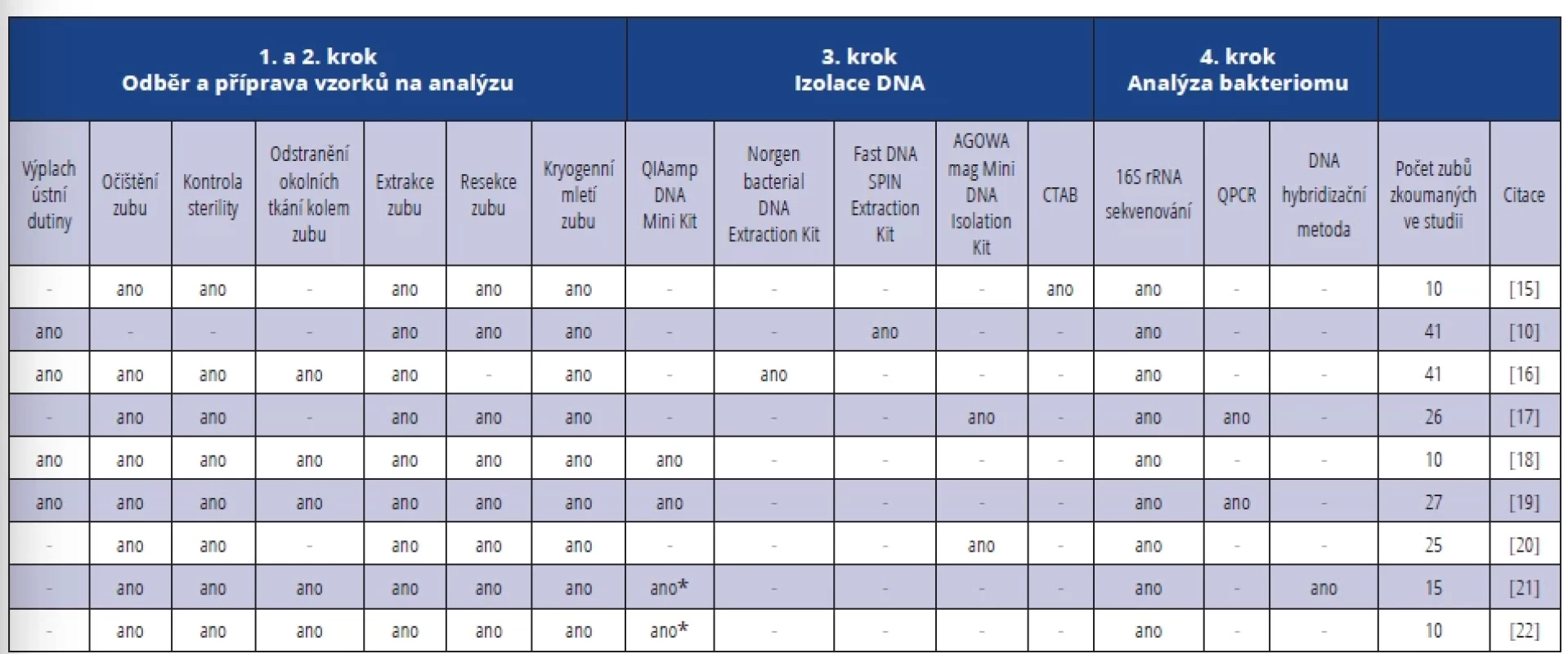
* inkubace s lyzozymem
* incubation with lysozymeObr. 2 Extrahovaný zub v mlecí patroně před kryogenním mletím a nadrcený zub ve formě homogenního prášku.Fig. 2 Extracted tooth in a grinding cartridge before cryogenic grinding and crushed tooth in the form of a homogeneous powder. 
DISKUSE
Odebrat reprezentativní vzorek z KK zubu postiženého AP neinvazivními způsoby není snadné. Důvodem je samotná morfologie systému KK a případně přítomnost výplňového materiálu, jedná-li se o zub s již ošetřenými KK. Bakterie, které se nacházejí v oblastech, jako jsou akcesorní KK a apikální část KK, je tedy obtížné stanovit. Pokud je odebráno jen omezené množství infekčního materiálu z KK, a pokud není citlivost metody použité pro identifikaci dostatečně vysoká, mnoho bakterií nemusí být při analýze zachyceno [10, 23].
POUŽÍVANÉ ZPŮSOBY ODBĚRU VZORKU (ZE) ZUBU POSTIŽENÉHO AP
Odběr vzorku ze zubu nebo zubu postiženého AP je napříč studiemi rozličný, v zásadě lze odběry klasifikovat jako neinvazivní (odběr pomocí endodontického papírového čepu a jiných endodontických nástrojů), které lze využít v klinické praxi, a invazivní (extrakce a/nebo resekce kořenového hrotu), pro jejichž volbu musí být indikace. Ve studiích je uvedeno, že před chirurgickými zákroky může být ústní dutina vypláchnuta dezinfekčními roztoky, případně je zub následně omyt fyziologickým roztokem, stejně jako u odběru vzorků pomocí endodontických papírových čepů [10, 19, 21, 25].
Neinvazivní odběry vzorků ze zubu postiženého infekcí a jejich skladování
Tento způsob je používán nejčastěji, kvůli jeho jednoduchosti a především neinvazivnímu přístupu během odběru, tzn. postižený zub je endodonticky ošetřen s cílem, aby byl zachráněn. V případě zubů postižených perzistentní AP je před odběrem vzorku z KK odstraněna kořenová výplň. Podle literární rešerše je analýza mikrobiomu KK prováděna ve vzorcích odebraných pomocí stěrů, endodontických papírových čepů nebo z aspirátů. K neinvazivním způsobům odběru vzorku se dále řadí odběr pomocí endodontických nástrojů (např. K-file) [3, 14, 26].
Při odebírání vzorků z KK pomocí endodontických papírových čepů je důležité dbát na to, aby čep byl vložen co nejhlouběji do KK a odběr probíhal za přísných aseptických podmínek. V různých studiích jsou používány odlišné dezinfekční látky a roztoky pro očištění ústní dutiny i samotného vzorku zubu, jako je například 0,12% chlorhexidin nebo roztoky H2O2, NaClO či Na2S2O3 [3, 26, 27]. Ke kontrole dostatečné aseptické práce jsou využívány stěry z povrchu zubů [22]. Odběr pomocí endodontických papírových čepů je prováděn podle protokolů popsaných v dřívějších studiích [3, 24, 29, 30], tzn. přístupová kavita pro odběr vzorku je připravena vysokorychlostním sterilním karbidovým vrtákem [24] a před obnažením dřeně je zub očištěn. Obsah hlavního KK je absorbován do endodontického papírového čepu, který je přenesen do sterilní zkumavky [30, 31]. Endodontické papírové čepy mohou být uchovávány v různých roztocích či pufrech, jako je například Tris-EDTA pufr, PBS aj. [23, 24, 25–27]. Teplota skladování odebraných vzorků je nejčastěji -20 °C nebo -80 °C. Rovněž rychlost zamrazení vzorku po odběru je nutné standardizovat, a to proto, aby v době mezi odběrem a uskladněním nedošlo k nárůstu některých kmenů ve vzorku, což by ovlivnilo výsledek analýzy.
Invazivní způsoby odběru vzorků ze zubu postiženého infekcí a jejich skladování
Kvůli technickým omezením vzorkování, které je dáno morfologií KK, je při výzkumu vhodnější provést analýzu mikrobioty KK u extrahovaných zubů postižených AP. V extrahovaných zubech je možné identifikovat bakterie, které jsou přítomny v celém systému KK, a zároveň tak stanovit bakterie ve všech částech zubu – v apikální, střední a koronální části [21, 22]. Limitací tohoto přístupu je, že ho lze aplikovat pouze v případě zubů s indikací k periradikulární operaci nebo extrakci. Extrakce zubu postiženého AP je indikována, pokud není perspektiva dostatečně dlouhé životnosti zubu po ošetření, nebo v případě vzniku radikulární cysty, kterou je třeba exstirpovat. Vzorek extrahovaného zubu bývá podroben kryogennímu mletí, aby byla získána vhodná matrice k následné analýze, v jedné ze studií však byl pro odběr materiálu KK z extrahovaného zubu použit nástroj K-file a endodontický papírový čep, které byly zavedeny retrográdně po resekci kořenového hrotu [32].
PŘÍPRAVA VZORKU ZE ZUBU POSTIŽENÉHO AP PRO DALŠÍ ANALÝZY
Příprava vzorku zahrnuje jeho zpracování do matrice vhodné pro další analýzy (např. kryogenní mletí zubu) a/nebo provedení kultivace infekčního materiálu za specifických podmínek.
Kryogenní mletí zubu
Kryogenní mletí zubů nebo jeho fragmentu je metoda, která byla navržena pro získání reprezentativního vzorku pro selektivní a komplexní analýzu mikrobiomu KK [7, 8, 12, 16, 35]. Do kryogenního mlýnku se vkládá celý extrahovaný zub nebo pouze jeho určitý segment, který má být analyzován. K separaci zubu na apikální a koronární fragment před samotným kryogenním mletím může být přistoupeno z důvodu stanovení mikrobioty ve specifické části kořenu, nicméně čím více je se zubem manipulováno, tím větší je riziko vnesení mikrobiální kontaminace do vzorku a znehodnocení vzorku. Bylo zjištěno, že mikrobiota apikálního a koronárního fragmentu se vzájemně liší [20, 25]. V apikální části kořene jsou přítomny pomalu rostoucí mikroorganismy, které vykazují větší závislost na mezidruhových interakcích než ty, které kolonizují koronární fragment [33].
Princip drcení zubu v kryomlýnu byl poprvé popsán v článku Alvese a kol. z roku 2009 [19]. Ke kryogennímu mletí jsou využívány kryomlýny (Spex, Metuchen, New Jersey), které pracují při teplotě tekutého dusíku (-197 °C). Po dobu mletí zůstává teplota v kryomlýnu neměnná. Extrahované zuby jsou vkládány do polykarbonátových válců s kovovými zátkami, viz obrázek 2. Koncové zátky z nerezové oceli, nárazová tyč a polykarbonát lahvičky musí být před každým použitím dezinfikovány. Jeden z používaných způsobů uvedli Alves et al. ve své studii [19], kde je uveden postup dezinfekce podle následujícího protokolu: kartáčování a mytí neutrálním detergentem, opláchnutí 70% etanolem, ponoření do 2,5% NaClO na jednu minutu, opláchnutí milliQ vodou, sušení při 70 °C a sterilizace pod ultrafialovým světlem po dobu 15 minut. Dalším způsobem sterilizace polykarbonátových válců je využití kyselého prostředí 0,1 M HCl. V 0,1 M HCl dochází především k depurinaci DNA skrze kyselou hydrolýzu, která vede postupně k tvorbě kratších fragmentů a poté k úplné hydrolýze DNA. Je známo, že většina bakterií není schopná přežít v prostředí, kde je pH menší než 4, tudíž 0,1 M HCl, jejíž pH = 1, je ideální ke sterilizaci polykarbonátových válců. Po omytí válců v kyselině po dobu jedné hodiny následuje důkladné opláchnutí milliQ H2O a oschnutí při laboratorní teplotě [34, 35].
Vzorky zubů jsou rozemlety magneticky se pohybujícím ocelovým nárazovým válcem oscilujícím tam a zpět proti dvěma stacionárním koncovým zátkám z nerezové oceli, které uzavírají patronu. Tato patrona je během drcení ponořena v tekutém dusíku, díky kterému je i během oscilace ocelového válce v patroně zachovávána stála teplota. Před použitím kryomlýnu je nejprve nastaveno předchlazení patrony se vzorkem po dobu 15 minut. Následuje mletí vzorku v patroně po dobu jedné minuty, a poté opětovné chlazení po dobu šesti sekund, což je období mezi dvěma pracovními cykly, kdy byla oscilace válce přerušena, aby se zabránilo zahřívání v důsledku tření. U každého vzorku jsou standardně provedeny dva cykly drcení. Frekvence nárazové tyče bývá nastavena na 10, což je 20 skutečných nárazů za sekundu (jeden na každou stranu) [19]. Metoda kryogenního mletí je považována za velice jednoduchou a rychlou k získání vhodné matrice k následné izolaci DNA ze vzorku zubu.
Díky rozmělnění zubu jsou zachyceny bakteriální taxony, které se nacházejí v místech, jako jsou již zmíněné vedlejší KK a apikální část kořene, ze kterých není možné endodontickými papírovými čepy vzorek odebrat. Analýza zubu tímto postupem je považována za mnohem přesnější než při odběrech z KK pomocí endodontických nástrojů a papírových čepů [17, 18]. Hlavní nevýhodou přístupu zahrnujícího kryogenního mletí zubu je, že jej lze aplikovat pouze na zuby s indikací k periradikulární operaci nebo extrakci a nelze jej použít ke sledování případu ani ke kontrole eliminace bakterií po terapii. Ve většině studií se považuje za nezbytné provést pečlivou dezinfekci vnějších povrchů kořenů před nadrcením, aby se odstranily vnější kontaminanty a snížilo se riziko falešně pozitivních výsledků. Je však důležité zdůraznit, že tento přístup může eliminovat bakterie, které potenciálně tvoří extraradikulární biofilm a které mohou být příčinou onemocnění po léčbě. Navíc se mohou dezinfekční roztoky během jejich aplikace dostat do KK, a znehodnotit tak výsledek analýzy [18]. V mnohých stu-
diích byl k nastavení správných metodických postupů odebírán stěr z povrchu dezinfikovaného zubu ke kontrole dodržení aseptické práce [29, 32, 36].Analýza bakterií pomocí kultivačních
metodMetody analýzy a identifikace bakterií v KK zubu postiženém AP mohou být velice variabilní, jak vyplývá z literární rešerše. K analýze bakterií KK ze vzorků odebíraných pomocí endodontických papírových čepů a jiných již zmíněných endodontických nástrojů byly často používány kultivační metody. Identifikace bakterií po kultivaci je standardně prováděna metodami, jako jsou Gramovo barvení, biochemické testy, mikroskopické pozorování a v neposlední řadě počítání bakteriálních kolonií (CFU), případně MALDI-TOF MS (Biotyper Microflex, Bruker Daltonics) [36–38]. Limitací tohoto způsobu analýzy je nejen časová náročnost, ale především to, že je možné stanovit pouze kultivovatelné bakterie [39].
IZOLACE DNA
Důležitým krokem při analýze bakteriomu je volba postupu extrakce DNA ze vzorku. Nutno podotknout, že ze vzorku je bez specifického ošetření izolována DNA nejen ze živých, ale i z mrtvých buněk. V drtivé většině publikovaných studií se používají k extrakci DNA určené k následné analýze bakteriomu komerční izolační sady (kity) – QIAamp DNA Mini kit (Qiagen, Německo), QIAamp DNeasy Blood and Tissue Kit (Qiagen, Německo), QIAamp Fast DNA Kit (Qiagen, Německo), Direct
DNA Extraction Kit (Bacteria) (Norgen, Kanada), QIAamp Micro Kit (Qiagen, Německo), Mag Mini DNA Isolation Kit (AGOWA, LGC Genomics, Německo) apod. Tyto izolační techniky využívají adsorpce DNA na pevný podklad. Zatímco Mag Mini DNA Isolation Kit využívá pro vazbu DNA magnetické kuličky, u ostatních kitů, které jsou založeny na kolonkové izolaci, dochází k selektivní vazbě nukleové kyseliny na silikagelovou membránu s následným promýváním kolonky pufry, opakovanými kroky s centrifugací vzorku a finální elucí DNA do specifického pufru [40]. Velkou výhodou této metody, oproti jiným izolačním technikám, je její vysoká specifita a zisk čisté DNA bez případných inhibitorů následujících PCR reakcí nebo Next Generation Sequencing (NGS) [41]. Před izolací může být vzorek mechanicky zpracován a/nebo inkubován s lyzozymem nebo jinými enzymy případně jejich směsí, díky čemuž je možné izolovat DNA i grampozitivních bakterií. Z rešerše vyplynulo, že pro extrakci DNA určené k následné analýze bakteriomu KK zubu s AP je ve studiích dominantně využíván QIAamp DNA Mini kit (Qiagen, Německo), navíc u čtyř studií bylo s tímto kitem použito ošetření vzorku lyzozymem [17, 22, 26, 31], což se jeví v současné době jako optimální přístup, aby nebyly podceněny v celkovém obraze grampozitivní bakterie. Vzhledem k tomu, že různé kity obsahují různé kontaminanty, je způsob izolačního procesu nutno zohlednit při komparaci výsledků studií.ANALÝZA BAKTERIOMU
Díky technikám molekulární biologie je možné studovat mikrobiální osídlení KK zubů postižených AP, a to včetně stanovení mikrobiálních taxonů, které jsou obtížně kultivovatelné. Ve studiích využívajících molekulárně biologické metody tak byla odhalena vyšší komplexnost endodontické mikroflóry, než jak bylo dříve uváděno ve studiích používajících kultivační přístupy [16].
Ke stanovení diverzity a relativní abundance bakteriálních taxonů, resp. přítomnosti jejich DNA v daném vzorku, se využívá profilování pomocí amplifikace genu pro 16S rRNA metodou založenou na PCR. Pomocí analýzy oblasti genu pro 16S rRNA je možné analyzovat bakteriom i bez předchozí kultivace vzorku. Sekvence tohoto genu obsahuje hypervariabilní oblasti, které mohou poskytnout druhově specifické sekvence užitečné pro identifikaci bakterií. K sekvenování se v dnešní době nejčastěji používá platforma Illumina, což reflektují i výsledky naší rešerše, kdy většina studií analýzy bakteriomu KK zubů s AP byla na sekvenaci hypervariabilních oblastí genu pro 16S rRNA pomocí Illumina kitů na přístroji MiSeq založena. Avšak i tato metoda má svá technická omezení, např. v některých případech je komplikované rozlišit blízce příbuzné druhy podle variability genu pro 16S rRNA [42].
Další často používanou molekulárně biologickou technikou k detekci odlišných bakteriálních taxonů u analýzy vzorků KK zubů je hybridizace DNA-DNA. Tato metoda je rychlá a citlivá technika molekulární identifikace, která umožňuje stanovení přítomnosti více druhů bakterií ve velmi velkém počtu vzorků obsahujících komplexní směsi mikroorganismů. Limitací této techniky je to, že může detekovat pouze druhy, pro které byly připraveny DNA sondy, a navíc nedetekuje mikroorganismy, které jsou pod detekčními limity metody (103 až 104 buněk) [30, 44, 45].
Ve studiích zaměřených na kvantifikaci endodontických patogenů způsobujících AP se používá metoda qPCR [27, 46, 47]. Výhodou qPCR je možnost kvantifikace vybraných bakteriálních taxonů v reálném čase. Tato metoda je velice citlivá a poskytuje kvalitní výsledky, avšak neposkytuje komplexní obraz o bakteriální DNA ve vzorku. Kvantitativní analýza specifických bakteriálních kmenů na bázi qPCR je jednoduchá, má vysoký aplikační potenciál v klinické praxi a ve srovnání s analýzou bakteriomu pomocí NGS je méně finančně náročná. Doporučuje se, aby kvantitativní profilování mikrobiomu založené na qPCR genu pro 16S rRNA bylo součástí standardní analýzy mikrobiomu pomocí NGS [47].
Méně často využívanými metodami, které byly použity při studiu bakterií osídlujících KK zubu postiženého AP, jsou PCR-DGGE (denaturační gradientová gelová elektroforéza), AP-PCR (neboli libovolně aktivovaná PCR, která k amplifikaci využívá primery, jež nasedají za nízké stringence na náhodná místa templátové DNA za vzniku charakteristického souboru amplikonů pro daný bakteriální druh) aj. DGGE je jedna z metod přímé DNA diagnostiky, při které jsou separované DNA fragmenty při elektroforéze v gradientovém denaturačním gelu. Jedná se o velmi citlivou metodu, která je v mikrobiologii využívána k vyhodnocení diverzity bakteriomu [48].
ZÁVĚR
V našem přehledovém článku jsme shrnuli možnosti analýzy bakteriomu KK zubu postiženého AP. Jako nejvhodnější postup při studiu tiopatogeneze AP a snaze získat komplexní výsledek o bakteriální DNA celého zubu se jeví ten, který zahrnuje extrakci celého zubu bez ošetření dezinfekčními roztoky, jeho kryogenní mletí pro získání homogenní matrice k izolaci DNA pomocí komerčního kitu a následné sekvenování genu pro 16S rRNA. Postup může být doplněn o analýzu pomocí qPCR
pro identifikaci a kvantifikaci specifických bakteriálních kmenů ve vzorku. Je vhodné zařadit i analýzu bakteriální DNA ze stěru z daného zubu a postupovat při izolaci a sekvenaci/qPCR podle stejného protokolu. V preanalytické fázi je nutné dodržet způsob skladování vzorku tak, aby nedošlo k jeho znehodnocení a vnesení chyby do celé analýzy. Při výzkumu etiopatogeneze tohoto onemocnění je klíčové provést odběr vzorku pouze od těch pacientů, kteří neprodělali v posledním měsíci antimikrobiální terapii, jež by ovlivnila výsledky analýz.Dedikace
Podpořeno z programového projektu Ministerstva zdravotnictví ČR s reg. č. NU-20-08-00205. Veškerá práva podle předpisů na ochranu duševního vlastnictví jsou vyhrazena. Článek vznikl s podporou MZ ČR – RVO (FNBr, 65269705). Tato práce byla provedena za podpory Výzkumné infrastruktury RECETOX (ID LM2023069, MŠMT).
Korespondující autorka
doc. RNDr. Petra Bořilová Linhartová, Ph.D., MBA
Environmentální genomika RECETOX
Přírodověděcká fakulta MU
625 00 Brno
e-mail: petra.linhartova@recetox.muni.cz
Zdroje
1. Bouillaguet S, Manoil D, Girard M, Louis J, Gaïa N, Leo S, et al. Root microbiota in primary and secondary apical periodontitis. Front Microbiol. 2018; 9 : 2374. doi: 10.3389/fmicb.2018.02374
2. Gomes BPF de A, Herrera DR. Etiologic role of root canal infection in apical periodontitis and its relationship with clinical symptomatology. Braz Oral Res. 2018; 32 (suppl 1): e69. doi: 10.1590/1807-3107bor-2018.vol32.0069
3. Tzanetakis GN, Azcarate-Peril MA, Zachaki S, Panopoulos P, Kontakiotis EG, Madianos PN, et al. Comparison of bacterial community composition of primary and persistent endodontic infections using pyrosequencing. J Endod. 2015; 41(8): 1226–1233. doi: 10.1016/j.joen.2015.03.010
4. Rôças IN, Siqueira JF. Root canal microbiota of teeth with chronic apical periodontitis. J Clin Microbiol. 2008; 46(11): 3599–3606. doi: 10.1128/JCM.00431-08
5. de Sousa ELR, Ferraz CCR, Gomes BPF de A, Pinheiro ET, Teixeira FB, de Souza-Filho FJ. Bacteriological study of root canals associated with periapical abscesses. Oral Surg Oral Med Oral Pathol Oral Radiol Endodontology. 2003; 96(3): 332–339. doi: 10.1016/s1079-2104(03)00261-0
6. Brennan CA, Garrett WS. Fusobacterium nucleatum – symbiont, opportunist and oncobacterium. Nat Rev Microbiol. 2019; 17(3): 156–166. doi: 10.1038/s41579-018-0129-6
7. Hong L, Hai J, Yan-Yan H, Shenghui Y, Benxiang H. [Colonization of Porphyromonas endodontalis in primary and secondary endodontic infections]. Hua Xi Kou Qiang Yi Xue Za Zhi West China J Stomatol. 2015; 33(1): 88–92. doi: 10.7518/hxkq.2015.01.020
8. Kumar J, Sharma R, Sharma M, Prabhavathi V, Paul J, Chowdary CD. Presence of Candida albicans in root canals of teeth with apical periodontitis and evaluation of their possible role in failure of endodontic treatment. J Int Oral Health JIOH. 2015; 7(2): 42–45.
9. Siqueira JF, Rôças IN, Ricucci D, Hülsmann M. Causes and management of post-treatment apical periodontitis. Br Dent J. 2014; 216(6): 305–312. doi: 10.1038/sj.bdj.2014.200
10. Nair PNR. On the causes of persistent apical periodontitis: a review. Int Endod J. 2006; 39(4): 249–281. doi: 10.1111/j.1365-2591.2006.01099.x
11. Cope AL, Francis N, Wood F, Chestnutt IG. Systemic antibiotics for symptomatic apical periodontitis and acute apical abscess in adults. Cochrane Database Syst Rev. 2018; 9(9): CD010136. doi: 10.1002/14651858.CD010136.pub3
12. Qian W, Ma T, Ye M, Li Z, Liu Y, Hao P. Microbiota in the apical root canal system of tooth with apical periodontitis. BMC Genomics. 2019; 20(S2): 189. doi: 10.1186/s12864-019-5474-y
13. Ricucci D, Siqueira JF, Lopes WSP, Vieira AR, Rôças IN. Extraradicular infection as the cause of persistent symptoms: a case series. J Endod. 2015; 41(2): 265–273. doi: 10.1016/j.joen.2014.08.020
14. Isik BK, Gürses G, Menziletoglu D. Acutely infected teeth: to extract or not to extract? Braz Oral Res. 2018; 32: e124. doi: 10.1590/1807-3107bor-2018.vol32.0124
15. Sakamoto M, Siqueira Jr JF, Rôças IN, Benno Y. Molecular analysis of the root canal microbiota associated with endodontic treatment failures. Oral Microbiol Immunol. 2008; 23(4): 275–281. doi: 10.1111/j.1399-302X.2007.00423.x
16. Vengerfeldt V, Špilka K, Saag M, Preem JK, Oopkaup K, Truu J, et al. Highly diverse microbiota in dental root canals in cases of apical periodontitis (Data of Illumina Sequencing). J Endod. 2014; 40(11): 1778–1783. doi: 10.1016/j.joen.2014.06.017
17. Rôças IN, Alves FRF, Santos AL, Rosado AS, Siqueira JF. Apical root canal microbiota as determined by reverse-capture checkerboard analysis of cryogenically ground root samples from teeth with apical periodontitis. J Endod. 2010; 36(10): 1617–1621. doi: 10.1016/j.joen.2010.07.001
18. Antunes HS, Rôças IN, Alves FRF, Siqueira JF. Total and specific bacterial levels in the apical root canal system of teeth with post-treatment apical periodontitis. J Endod. 2015; 41(7): 1037–1042. doi: 10.1016/j.joen.2015.03.008
19. Alves FRF, Siqueira JF, Carmo FL, Santos AL, Peixoto RS, Rôças IN, et al. Bacterial community profiling of cryogenically ground samples from the apical and coronal root segments of teeth with apical periodontitis. J Endod. 2009; 35(4): 486–492. doi: 10.1016/j.joen.2008.12.022
20. de Brito LCN, Doolittle-Hall J, Lee CT, Moss K, Bambirra Júnior W, Tavares WLF, et al. The apical root canal system microbial communities determined by next-generation sequencing. Sci Rep. 2020; 10(1): 10932. doi: 10.1038/s41598-020-67828-3
21. Sánchez-Sanhueza G, Bello-Toledo H, González-Rocha G, Gonçalves AT, Valenzuela V, Gallardo-Escárate C. Metagenomic study of bacterial microbiota in persistent endodontic infections using Next-generation sequencing. Int Endod J. 2018; 51(12): 1336–1348. doi: 10.1111/iej.12953
22. Hong BY, Lee TK, Lim SM, Chang SW, Park J, Han SH, et al. Microbial analysis in primary and persistent endodontic infections by using pyrosequencing. J Endod. 2013; 39(9): 1136–1140. doi: 10.1016/j.joen.2013.05.001
23. Wang QQ, Zhang CF, Chu CH, Zhu XF. Prevalence of Enterococcus faecalis in saliva and filled root canals of teeth associated with apical periodontitis. Int J Oral Sci. 2012; 4(1): 19–23. doi: 10.1038/ijos.2012.17
24. Wang J, Jiang Y, Chen W, Zhu C, Liang J. Bacterial flora and extraradicular biofilm associated with the apical segment of teeth with post-treatment apical periodontitis. J Endod. 2012; 38(7): 954–959. doi: 10.1016/j.joen.2012.03.004
25. Barbosa-Ribeiro M, Arruda-Vasconcelos R, Louzada LM, dos Santos DG, Andreote FD, Gomes BPFA. Microbiological analysis of endodontically treated teeth with apical periodontitis before and after endodontic retreatment. Clin Oral Investig. 2021; 25(4): 2017–2027. doi: 10.1007/s00784-020-03510-2
26. Santos AL, Siqueira JF, Rôças IN, Jesus EC, Rosado AS, Tiedje JM. Comparing the bacterial diversity of acute and chronic dental root canal infections. Gilbert JA, editor. PLoS ONE. 2011; 6(11): e28088. doi: 10.1371/journal.pone.0028088
27. Buonavoglia A, Latronico F, Pirani C, Greco MF, Corrente M, Prati C. Symptomatic and asymptomatic apical periodontitis associated with red complex bacteria: clinical and microbiological evaluation. Odontology. 2013; 101(1): 84–88. doi: 10.1007/s10266-011-0053-y
28. Sousa ELR, Gomes BPFA, Jacinto RC, Zaia AA, Ferraz CCR. Microbiological profile and antimicrobial susceptibility pattern of infected root canals associated with periapical abscesses. Eur J Clin Microbiol Infect Dis. 2013; 32(4): 573–580. doi: 10.1007/s10096-012-1777-5
29. Ferreira NS, Martinho FC, Cardoso FGR, Nascimento GG, Carvalho CAT, Valera MC. Microbiological profile resistant to different intracanal medications in primary endodontic infections. J Endod. 2015; 41(6): 824–830. doi: 10.1016/j.joen.2015.01.031
30. Ito IY, Junior FM, Paula-Silva FWG, da Silva LAB, Leonardo MR, Nelson-Filho P. Microbial culture and checkerboard DNA-DNA hybridization assessment of bacteria in root canals of primary teeth pre - and post-endodontic therapy with a calcium hydroxide/chlorhexidine paste: Assessment of bacteria pre - and post-endodontic therapy. Int J Paediatr Dent. 2011; 21(5): 353–360. doi: 10.1111/j.1365-263X.2011.01131.x
31. Siqueira JF, Alves FRF, Rôças IN. Pyrosequencing analysis of the apical root canal microbiota. J Endod. 2011; 37(11): 1499–1503. doi: 10.1016/j.joen.2011.08.012
32. Chugal N, Wang JK, Wang R, He X, Kang M, Li J, et al. Molecular characterization of the microbial flora residing at the apical portion of infected root canals of human teeth. J Endod. 2011; 37(10): 1359–1364. doi: 10.1016/j.joen.2011.06.020
33. Özok AR, Persoon IF, Huse SM, Keijser BJF, Wesselink PR, Crielaard W, et al. Ecology of the microbiome of the infected root canal system: a comparison between apical and coronal root segments: Microbiome of infected roots. Int Endod J. 2012; 45(6): 530–541. doi: 10.1111/j.1365-2591.2011.02006.x
34. Porto-Figueira P, Câmara JS, Vigário AM, Pereira JAM. Understanding the tolerance of different strains of human pathogenic bacteria to acidic environments. Appl Sci. 2022; 13(1): 305. doi: 10.3390/app13010305
35. An R, Jia Y, Wan B, Zhang Y, Dong P, Li J, et al. Non-enzymatic depurination of nucleic acids: factors and mechanisms. PLoS ONE. 2014; 9(12): e115950. doi: 10.1371/journal.pone.0115950
36. Tandon J. Evaluation of bacterial reduction at various stages of endodontic retreatment after use of different disinfection regimens: an in vivo study. Eur Endod J. 2022; 7(3):210-216. doi: 10.14744/eej.2022.42713
37. Nóbrega LMM, Montagner F, Ribeiro AC, Mayer MAP, Gomes BPFA. Molecular identification of cultivable bacteria from infected root canals associated with acute apical abscess. Braz Dent J. 2016; 27(3): 318–324. doi: 10.1590/0103-6440201600715
38. Mindere A, Kundzina R, Nikolajeva V, Eze D, Petrina Z. Microflora of root filled teeth with apical periodontitis in Latvian patients. Stomatologija. 2010; 12(4): 116–121.
39. Machado FP, Khoury RD, Toia CC, Flores Orozco EI, de Oliveira FE, de Oliveira LD, et al. Primary versus post-treatment apical periodontitis: microbial composition, lipopolysaccharides and lipoteichoic acid levels, signs and symptoms. Clin Oral Investig. 2020; 24(9): 3169–3179. doi: 10.1007/s00784-019-03191-6
40. Höss M, Pääbo S. DNA extraction from pleistocene bones by a silica-based purification method. Nucleic Acids Res. 1993;21(16):3913–4. doi: 10.1093/nar/21.16.3913
41. Yang DY, Eng B, Waye JS, Dudar JC, Saunders SR. Improved DNA extraction from ancient bones using silica-based spin columns. Am J Phys Anthropol. 1998; 105(4): 539–543. doi: 10.1002/(SICI)1096-8644(199804)105 : 4<539::AID-AJPA10>3.0.CO;2-1
42. Poretsky R, Rodriguez-R LM, Luo C, Tsementzi D, Konstantinidis KT. Strengths and limitations of 16S rRNA gene amplicon sequencing in revealing temporal microbial community dynamics. PLoS ONE. 2014; 9(4): e93827. doi: 10.1371/journal.pone.0093827
43. de Miranda RG, Colombo APV. Clinical and microbiological effectiveness of photodynamic therapy on primary endodontic infections: a 6-month randomized clinical trial. Clin Oral Investig. 2018; 22(4): 1751–1761. doi: 10.1007/s00784-017-2270-4
44. Rovai E da S, Matos F de S, Kerbauy WD, Cardoso FG da R, Martinho FC, Oliveira LD de, et al. Microbial profile and endotoxin levels in primary periodontal lesions with secondary endodontic involvement. Braz Dent J. 2019; 30(4): 356–362.
doi: 10.1590/0103-644020190247145. Lima AR, Herrera DR, Francisco PA, Pereira AC, Lemos J, Abranches J, et al. Detection of Streptococcus mutans in symptomatic and asymptomatic infected root canals. Clin Oral Investig. 2021; 25(6): 3535–3542. doi: 10.1007/s00784-020-03676-9
46. Abushouk S. Quantitative analysis of candidate endodontic pathogens and their association with cause and symptoms of apical periodontitis in a Sudanese population. Eur Endod J. 2020; 6(1): 50-55. doi: 10.14744/eej.2020.52297
47. Jian C, Luukkonen P, Yki-Järvinen H, Salonen A, Korpela K. Quantitative PCR provides a simple and accessible method for quantitative microbiota profiling. PLoS ONE. 2020;15(1):e0227285. doi: 10.1371/journal.pone.0227285
48. Paiva SSM, Siqueira JF, Rôças IN, Carmo FL, Leite DCA, Ferreira DC, Rachid CTC, Rosado AS. Molecular microbiological evaluation of passive ultrasonic activation as a supplementary disinfecting step: A clinical study. J Endod. 2013; 39(2): 190–194.
Štítky
Chirurgie maxilofaciální Ortodoncie Stomatologie
Článek vyšel v časopiseČeská stomatologie / Praktické zubní lékařství
Nejčtenější tento týden
2023 Číslo 4- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Orální lichen planus v kostce: Jak v praxi na toto multifaktoriální onemocnění s různorodými symptomy?
- Význam ústní sprchy pro čištění mezizubních prostor
- MIH – komplexní problém s nutností komplexního přístupu
- Benzydamin v léčbě zánětů v dutině ústní
-
Všechny články tohoto čísla
- Ohlédnutí za kongresem Pražské dentální dny 2023
- XXVII. Sazamův den
- Metodické přístupy pro analýzu bakteriomu kořenového systému zubu postiženého apikální periodontitidou
- Podmínky pro publikaci v časopisu ČSPZL
- Rejstřík ČSPZL 2023
- Editorial
- K životnímu jubileu MUDr. Věry Bartákové, CSc.
- Poděkování recenzentům
- Nechirurgické ošetrenie peri-implatitídy pomocou mikroabrazívneho pieskovača s celkovou antibiotickou terapiou alebo bez nej
- Česká stomatologie / Praktické zubní lékařství
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Metodické přístupy pro analýzu bakteriomu kořenového systému zubu postiženého apikální periodontitidou
- K životnímu jubileu MUDr. Věry Bartákové, CSc.
- Nechirurgické ošetrenie peri-implatitídy pomocou mikroabrazívneho pieskovača s celkovou antibiotickou terapiou alebo bez nej
- XXVII. Sazamův den
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




