-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Vplyv rýchlosti rastu supratentoriálnych grade II gliómov na ich prognózu
The Effect of Supratentorial Grade II Gliomas Growth Rate on their Prognosis
The impact of growth rate of supratentorial infiltrative grade II gliomas on their prognosis has been shown to be highly significant. This is probably one of the most important prognostic markers predicting a risk of early malignant transformation. The aim of this summary report is to describe current knowledge concerning the impact of growth rate of untreated grade II gliomas on their prognosis as well as to describe the options for growth rates quantification.
Key words:
low-grade glioma – growth rate – prognosis – malignant transformation
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři: M. Fabian 1,2; M. Jezberová 2; Ľ. Pružincová 2; V. Belan 2; M. Chorvath 3; B. Rychlý 4; P. Kalina 5; J. Šteňo 6; A. Šteňo 6
Působiště autorů: Rádiodiagnostická klinika LF UK a UN Bratislava 1; Dr. Magnet s. r. o., pracovisko Kramáre, Bratislava 2; Klinika stereotaktickej rádiochirurgie OÚSA a VŠZASP, Bratislava 3; Cytopathos s. r. o., Bratislava 4; II. Neurologická klinika LF UK a UN Bratislava 5; Neurochirurgická klinika LF UK a UN Bratislava 6
Vyšlo v časopise: Cesk Slov Neurol N 2015; 78/111(3): 274-281
Kategorie: Přehledný referát
Souhrn
Vplyv rýchlosti rastu supratentoriálnych infiltratívnych gliómov mozgu druhého stupňa zhubnosti na prognózu pacientov sa v nedávnych prácach ukázal ako veľmi významný. Pravdepodobne sa jedná o jeden z najdôležitejších ukazovateľov rizika skorej malígnej transformácie. Cieľom tohto prehľadného referátu je informovať o súčasných poznatkoch o vplyve rýchlosti rastu onkologicky neliečených infiltratívnych gliómov druhého stupňa zhubnosti na ich prognózu a taktiež popísať možnosti, ako je možné rýchlosť rastu kvantifikovať.
Kľúčové slová:
low-grade glióm – rýchlosť rastu – prognóza – malígna transformáciaÚvod
Supratentoriálne gliómy druhého stupňa zhubnosti (low ‑ grade gliómy; LGG) predstavujú heterogénnu skupinu tumorov. V priebehu ich prirodzeného rastu však všetky histologické podtypy LGG podliehajú postupnej dediferenciácii (malígnej transformácii) a postupne vedú k neurologickým deficitom a ku smrti [1 – 3]. Okrem známych znakov nepriaznivej prognózy sa však v poslednom čase ukazuje, že jedným z najdôležitejších ukazovateľov je rýchlosť rastu LGG. V tomto prehľadnom referáte sa zaoberáme možnosťami kvantifikácie rýchlosti rastu onkologicky (chemo ‑ a rádioterapiou) neliečených LGG a ich prognostickým významom.
Pre úplnosť uvádzame, že hoci sa názov low ‑ grade gliómy v minulosti často používal spoločne pre gliómy prvého aj druhého stupňa malignity podľa gradingu Svetovej zdravotníckej organizácie (World Health Organization; WHO), v tomto prehľadom referáte budeme termín LGG používať (podobne ako väčšina novších prác) výhradne pre gliové nádory druhého stupňa zhubnosti podľa WHO.
Poznámky k biologickému správaniu LGG
Bez ohľadu na histologický podtyp všetky neliečené supratentoriálné LGG kontinuálne rastú [4,5]. Rast LGG je infiltratívny, nádorové bunky LGG sa šíria aj do vzdialenosti niekoľkých centimetrov za hranice nádoru viditeľné na zobrazení magnetickou rezonanciou (MR), čo znemožňuje ich úplné chirurgické odstránenie [6]. Resekcia býva navyše sťažená aj čiastočnou „neviditeľnosťou“ tkaniva LGG, ktoré (na rozdiel od zobrazenia na MR) nebýva často vizuálne odlíšiteľné od tkaniva zdravého mozgu ani v operačnom mikroskope [1]. Difúzny rast LGG spôsobuje infiltráciu funkčného mozgového tkaniva nádorovými bunkami, pričom funkčne dôležité (elokventné) mozgové tkanivo sa môže nachádzať i vo vnútri jednoznačne nádorového tkaniva [7].
V drvivej väčšine prípadov LGG časom podliehajú malígnej dediferenciácii, t.j. zmene na gliómy III., resp. IV. stupňa zhubnosti podľa WHO (high‑grade gliómy; HGG) s fatálnym koncom [8]. Čas do malígnej transformácie môže trvať niekoľko rokov, je však značne variabilný [9,10], pričom v niektorých prípadoch môže byť kratší ako štyri mesiace [11]. Dĺžka prežívania je približne 5–8 rokov u pacientov s difúznymi astrocytómami, u pacientov s oligodendrogliómami môže byť prežívanie aj vyše 10 rokov [6]. Ako u astrocytómov, tak aj v prípade oligoastrocytómov a oligodendrogliómov je však dĺžka prežívania značne individuálna, pričom nepriaznivú prognózu je možné predpokladať na základe viacerých ukazovateľov: veľkosti (najväčšieho priemeru) tumoru nad 6 cm [12], resp. nad 4 cm [13], veku pacienta nad 50 rokov [13], prítomnosti astrocytárnej komponenty [12], lokalizácii tumoru v elokventnej oblasti [13], prítomnosti neurologického deficitu pri stanovení diagnózy [12], tumoru presahujúceho strednú čiaru [12] a Karnofsky Performance Scale skóre ≤ 80 % [13]. Za nepriaznivý prognostický znak je považovaná aj prítomnosť gemistocytov, lebo gemistocytárne gliómy majú vyššiu tendenciu k včasnej malígnej transformácii [3]. Priaznivým prognostickým znakom je genetická mutácia – delécia 1p, 19q, vyskytujúca sa častejšie u oligodendrogliových tumorov [6]. Z genetických markerov je známa aj strata heterozygozity na chromozómoch 9p a 10q, ktorá patrí medzi znaky nepriaznivej prognózy [14]. Do skupiny genetických alterácii ovplyvňujúcich prognózu a aj liečbu pacientov s LGG náleží aj marker izocitrátdehydrogenáza 1 (IDH1). Pacienti s mutáciou IDH1 majú lepšiu prognózu v porovnaní s pacientmi bez tejto mutácie [15], pričom predklinické štúdie ukazujú, že LGG s mutáciou IDH1 majú pravdepodobne vyššiu senzitivitu na chemoterapiu [16].
Hoci prospektívna randomizovaná štúdia vplyvu rozsahu resekcie na prognózu LGG absentuje (a z etických dôvodov ju zrejme ani nebude možné zrealizovať), v posledných rokoch bolo publikovaných množstvo dát dokladujúcich, že rozsiahla resekcia priaznivo vplýva na prognózu pacientov s LGG [17 – 23]. Maximálna bezpečná resekcia so zachovaním elokventných oblastí mozgu je v súčasnosti považovaná za primárnu liečebnú modalitu [3]. Rozsiahla resekcia zlepšuje kontrolu epileptických záchvatov, predlžuje interval do progresie ochorenia, redukuje riziko skorej malígnej transformácie a dlhšie zachováva funkčný stav pacienta [24].
Problémom však môže byť načasovanie rádio ‑ a chemoterapie (ktoré bezprostredne po operáciách LGG v mnohých prípadoch nie sú indikované [3]) ako aj prípadnej reoperácie LGG, najmä pokiaľ ide o rastúce rezíduum, ktoré ešte nevykazuje známky malígnej transformácie. Faktory priamo asociované s rizikom skorej malígnej transformácie totiž nie sú dostatočne preskúmané [25]. Definícia spoľahlivých prognostických ukazovateľov skorej malígnej transformácie reziduálnych (a recidivujúcich) LGG by mohla mať veľký význam pri indikovaní a presnom načasovaní ich reoperácie [26]. V nových prácach sa ako jeden najdôležitejších prediktorov rizika malígnej transformácie ukazuje rýchlosť rastu LGG [27 – 30].
Zobrazenie LGG na MR
LGG vykazujú vyššiu signálovú intenzitu v T2 váženom obraze a sekvencii Fluid Attenuated Inverse Recovery (FLAIR) a nižšiu signálovú intenzitu v T1 váženom obraze v porovnaní so zdravým mozgovým tkanivom [3]. Zvyšovanie signálovej intenzity v T1 váženom obraze v postkontrastnom zobrazení vo väčšine prípadov nie je prítomné, môže sa nachádzať v oblastiach, v ktorých nastala malígna dediferenciácia LGG [3], prítomné však môže byť aj u oligodendrogliómov druhého stupňa malignity [31]. Na zobrazenie a sledovanie LGG sú vhodné sekvencie T2 a najmä FLAIR, ktorá je najvhodnejšia [32]. FLAIR sekvencia najlepšie zobrazuje samotnú léziu vrátane jej okrajov, lepšie zobrazuje jednotlivé komponenty tumoru, lokálne šírenie tumoru pozdĺž vlákien bielej hmoty a subependymálne [32]. T2 vážený obraz ani FLAIR sekvencia však nezobrazujú infiltrované mozgové tkanivo v celom rozsahu. Platí, že bunky LGG sa nachádzajú aj v okolitom mozgovom tkanive, ktoré má úplne normálny MR signál [6,33].
Za najznámejšiu známku malígnej transformácie sa všeobecne považuje objavenie sa postkontrastného enhancementu alebo progresia rozsahu už predtým prítomného enhancementu [19]. Zároveň je však známy fakt, že až tretina HGG sa nemusí farbiť kontrastnou látkou [34,35]. Konvenčné MR teda často nie je dostatočne senzitívne na detekciu malígnej transformácie [29]. Spresniť stupeň zhubnosti gliómov je možné doplnením základného MR vyšetrenia s kontrastnou látkou o MR spektroskopiu a perfúznu MR [36].
Odlíšenie LGG od HGG je možné okrem MR vyšetrenia aj vyšetrením pozitrónovou emisnou tomografiou (PET) s využitím rozličných rádiofarmák – napr. 18F ‑ 2 - fluoro-2 - deoxy ‑ D ‑ glukózy, kedy je pre LGG charakteristické znížené a pre HGG naopak jej zvýšené metabolizovanie [37]. Predoperačná identifikácia malých fokusov incipientnej anaplastickej transformácie v LGG (tzv. hot spots) je možná pomocou PET s využitím značených aminokyselín – napr. 11C ‑ metionínu [38].
Kvantifikácia rastu LGG pomocou MR
Základnou metódou hodnotenia rastu LGG je kvantifikácia nárastu tzv. Mean Tumor Diameter (MTD), teda „virtuálneho” stredného priemeru nádoru. Najjednoduchšie sa hodnota MTD získava meraním priemerov tumoru na MR tzv. technikou troch rozmerov, pričom hodnota sa vypočíta podľa vzorca MTD = (D1 × D2 × D3)1/ 3 (pri predpokladanom elipsoidnom tvare tumoru) [39]; D1, D2 a D3 sú najväčšie priemery namerané v axiálnej rovine (predozadný a laterolaterálny priemer) a v sagitálnej rovine (kraniokaudálny priemer). Túto metódu možno použiť pri hodnotení starších MR snímok vyhotovených v čase, kedy digitalizácia dát bola zväčša nedostupná, a hodnoty sú preto merané priamo na celuloidových snímkach [39]. Obdobnou technikou sa dá z troch rozmerov vypočítať aj približný objem podľa vzorca V = (D1 × D2 × D3)/ 2 [30]. Medzi hlavné limitácie uvedenej metódy patrí nadhodnotenie veľkosti tumorov z dôvodu, že ich tvar býva v skutočnosti nepravidelný a najčastejšie nie je elipsoidný [40]. Príklad použitia tejto techniky merania je na obr. 1.
Obr. 1. Meranie priemerov tumoru u pacienta s LGG v pravom frontálnom laloku vo FLAIR sekvencii. 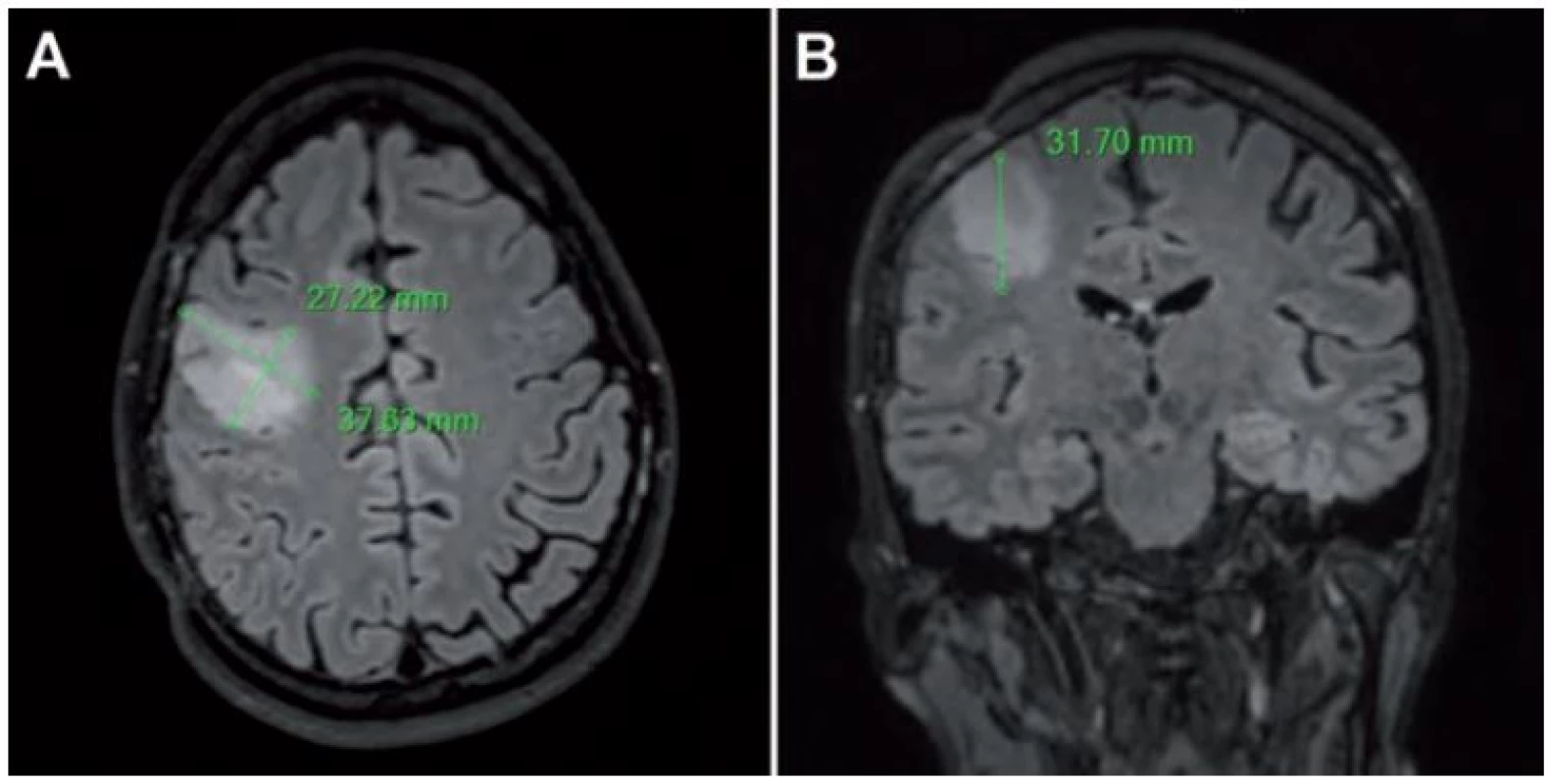
Použitá technika merania troch rozmerov, dva rozmery sú merané v axiálnej rovine (A), tretí rozmer je meraný v koronárnej rovine (B). V súčasnej dobe sú digitálne dáta v Digital Imaging and Communications in Medicine (DICOM) formáte bežne dostupné a kontúry tumoru môžu byť označené na každom reze (technika nazývaná segmentácia), čo umožňuje vypočítanie objemu tumoru počítačom. Napriek pokrokom v automatickej segmentácii (tj. keď kontúry tumoru sú označené špeciálnym softvérom), manuálna segmentácia (tj. manuálne obkreslenie kontúr) je stále odporúčaná metóda, i keď je časovo náročná (obr. 2). Z objemu tumoru je potom vypočítaný „virtuálny” (stredný) priemer použitím vzorca MTD = (2 × V)1/ 3 [39].
Obr. 2. Meranie objemu tumoru v pravom frontálnom laloku použitím techniky manuálnej segmentácie vo FLAIR sekvencii. 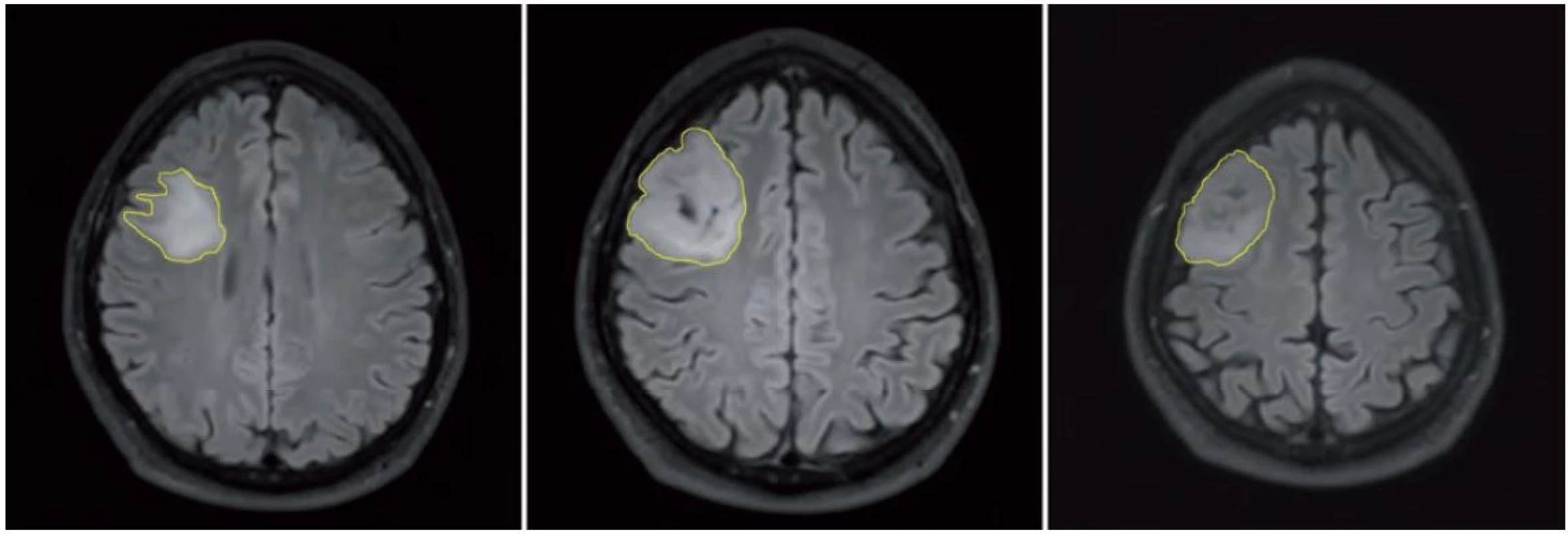
Zobrazené je obkreslenie kontúr LGG na vybratých troch rezoch. Z vypočítaných hodnôt MTD nameraných pri jednotlivých kontrolných MR vyšetreniach je následne určovaná rýchlosť rastu LGG v mm/ rok – tj. parameter nazývaný „rýchlosť rastu priemeru nádoru” (Velocity of Diametric Expansion; VDE) – teda zmena MTD v čase [39] (napr. pri náraste MTD z 34 mm na 38 mm za 12 mesiacov je hodnota VDE 4 mm/ rok). Vo viacerých štúdiách rastu LGG [39 – 42] autori zistili, že krivka rastu priemeru nádoru (VDE) má lineárny charakter. Inými slovami, priemer (nie však objem) viditeľného LGG na MR rastie konštantnou rýchlosťou, pokiaľ sa nezmenia jeho biologické vlastnosti. Zisteniu, že VDE má lineárny charakter, zodpovedá aj matematický model rastu gliómov, ktorý berie do úvahy nielen proliferáciu, ale aj migráciu a difúziu nádorových buniek a lineárny rast priemeru gliómov vysvetľuje [43,44]. Vzhľadom na lineárnosť VDE sa dá jednoducho vypočítať ročný prírastok na základe dvoch meraní v priebehu relatívne krátkeho časového intervalu; napr. nárast priemeru 1 mm za tri mesiace alebo 2 mm za šesť mesiacov vedie ku ročnému nárastu priemeru 4 mm (teda VDE je 4 mm/ rok) [39]. V protiklade s lineárnym rastom MTD nárast objemu tumoru lineárny charakter nemá [39]. Navyše pri hodnotení objemového prírastku je nutné vziať do úvahy vstupný objem – rovnaký nárast objemu môže byť výsledkom pomalého rastu veľkého tumoru alebo rýchleho rastu malého tumoru. Dva odlišné tumory s rovnakým prírastkom napr. 3 ml za tri mesiace, ale inými hodnotami vstupného objemu teda nemajú rovnakú rýchlosť rastu [39]. Nakoľko krivka rastu objemu nie je lineárna, je ťažké interpretovať prírastky objemu z hľadiska rastovej aktivity, zatiaľ čo lineárnosť VDE umožňuje priamočiarejšie posúdenie [39].
Mandonnet et al porovnávali rýchlosť rastu LGG pred ‑ a pooperačne [8]. U väčšej časti súboru bola použitá na meranie veľkosti tumoru technika segmentácie [40]; u 13 pacientov neboli dostupné digitálne dáta, v týchto prípadoch bola na meranie veľkosti tumoru použitá technika merania troch rozmerov [41]. U všetkých pacientov bol vypočítaný objem tumoru a následne MTD a VDE. Autori zistili, že rýchlosť rastu LGG pred ‑ a pooperačne je podobná, teda že chirurgická liečba nemení rýchlosť rastu LGG a pôsobí ako cytoredukcia [8]. U dvoch pacientov bola zistená znížená rýchlosť rastu pooperačne v porovnaní s predoperačnou hodnotou. Ako možné vysvetlenie autori pripúšťajú resekciu časti tumoru s vysokou proliferačnou aktivitou, čo mohlo ovplyvniť rastovú dynamiku LGG a nepôsobilo tak len iba ako cytoredukcia. U dvoch pacientov prišlo pooperačne ku koncu sledovania k akcelerácii rýchlosti rastu, čo autori dávali do súvisu s pravdepodobnou incipientnou malígnou transformáciou [8].
Úskalia merania dynamiky rastu LGG
Hlavným problémom pri meraní rastovej dynamiky LGG je ich infiltratívny charakter, ktorý často podmieňuje neostré ohraničenie gliómu voči okolitému mozgovému tkanivu, teda meranie priemeru, resp. obkreslenie kontúr nádoru je obtiažne. V iných situáciách sú hranice LGG na MR relatívne zreteľné (obr. 3).
Obr. 3. Neostro ohraničený LGG v ľavom frontálnom laloku vo FLAIR sekvencii (A). 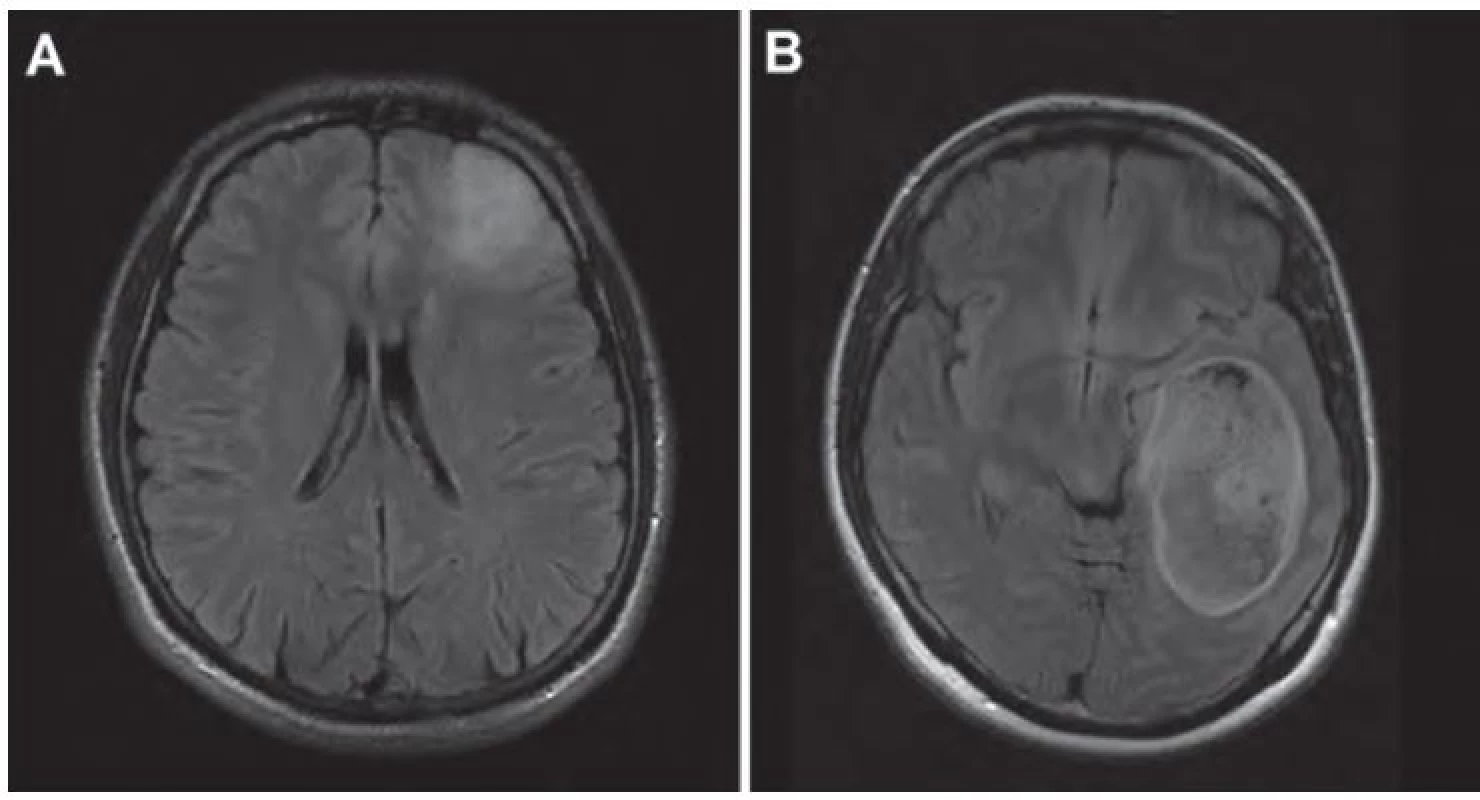
Rozsiahly, pomerne dobre ohraničený LGG v ľavom temporálnom laloku vo FLAIR sekvencii (B). Medzi úskalia merania rastovej dynamiky LGG patrí aj vplyv hrúbky rezu použitého pri MR vyšetrení a tiež efekt rozdielnej rotácie, resp. rozdielneho sklonu hlavy pacienta pri jednotlivých MR vyšetreniach. Touto otázkou sa zaoberali vo svojej práci Schmitt et al [45]. Autori kvantifikovali rast LGG v skupine 65 pacientov dvoma spôsobmi. Prvou technikou bolo meranie dvoch maximálnych priemerov tumoru, druhá technika bola založená na meraní objemu tumoru technikou segmentácie a následnej kalkulácii ekvivalentného priemeru tumoru (MTD). Realizované boli simulácie rôznej hrúbky rezu a rotácie hlavy pacienta a skúmali ich vplyv na uvedené dva parametre rastu [45]. Autori zistili, že hrúbka rezu a rotácia hlavy pacienta spôsobujú nepresnosť merania v prípade techniky dvoch maximálnych rozmerov 6 – 32 %, pričom nepresnosť merania volumetrickou (segmentačnou) technikou a následnou kalkuláciou ekvivalentného priemeru tumoru bola len 0,1 – 8 %. Z práce teda vyplýva, že volumetrická technika merania rastu LGG je menej ovplyvnená použitou hrúbkou rezu a rotáciou hlavy pacienta [45].
Sorensen et al skúmali interindividuálnu odchýlku merania veľkosti tumoru „technikou troch rozmerov” v porovnaní s technikou „počítačom asistovanej segmentácie” [46]. Aj keď sa pri realizovaní manuálnej segmentácie jednotlivými rádiológmi objemy tumorov o niekoľko voxelov líšili, bola zaznamenaná vysoká miera zhody; prípade „techniky troch rozmerov” bola miera zhody medzi jednotlivými rádiológmi v meraní troch rozmerov tumoru menšia [46]. Interindividuálna odchýlka merania objemu tumoru „technikou troch rozmerov” bola menšia v prípade použitia štandardizovaných smerov merania priemerov (anterioposteriórny, laterolaterálny, kraniokaudálny) v porovnaní s meraním najväčších troch priemerov [46].
Problémom vyššie uvedených metód je však fakt, že LGG nemusia rásť všetkými smermi rovnako rýchlo (obr. 4), pričom rastová akcelerácia len malej časti tumoru nemusí významným spôsobom ovplyvniť MTD. Z tohto dôvodu na našom pracovisku používame aj techniku, ktorú sme pracovne nazvali „meranie priemeru v mieste najrýchlejšieho rastu”. Potrebná je 3D FLAIR (alebo T2) sekvencia s izotropným zobrazením, teda s rovnakou kvalitou zobrazenia vo všetkých rovinách. Z trojrozmernej sekvencie je následne možné sekundárne vyrekonštruovať ľubovoľnú rovinu – na našom pracovisku najčastejšie využívame axiálnu. Pri rekonštruovaní axiálnej roviny rešpektujeme jednak Hypofýza ‑ Fastigium líniu (HYFA línia – línia spájajúca spodinu hypofýzy a fastigium IV. mozgovej komory) a jednak korigujeme náklon hlavy do strany v koronárnej rovine (obr. 5). Týmto spôsobom získavame na všetkých MR vyšetreniach porovnateľné rezy (bez ohľadu na rotáciu, resp. sklon hlavy), kvantifikácia rýchlosti rastu LGG je teda presnejšia. Nevýhodou je relatívna časová náročnosť, ktorá však nie je väčšia ako pri manuálnej segmentácii. Skúmanie prognostického významu tejto metódy však doteraz nebolo ukončené, prebieha štatistické vyhodnotenie získaných dát.
Obr. 4. Meranie priemeru v mieste najrýchlejšieho rastu LGG vo FLAIR sekvencii. 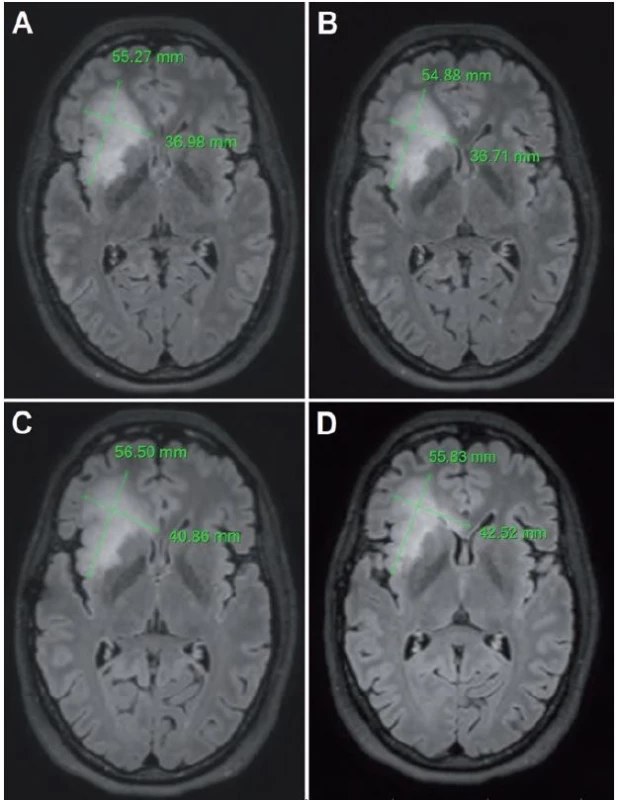
Vstupné vyšetrenie z decembra 2012 (A, B) a kontrolné vyšetrenie z augusta 2014 (C, D). Rast tumoru nie je rovnaký vo všetkých smeroch, pozorovať rýchlejší rast smerom do corpus callosum (maximálny rast v tomto smere 3,5 mm/rok) v porovnaní s rastom v predozadnom rozmere (maximálny rast v tomto smere 0,7 mm/rok). Obr. 5. Post-processing s použitím 3D FLAIR sekvencie s následnou rekonštrukciou axiálnej roviny naklonenej podľa HYFA línie (A) a po korekcii rotácie hlavy pacienta (B). 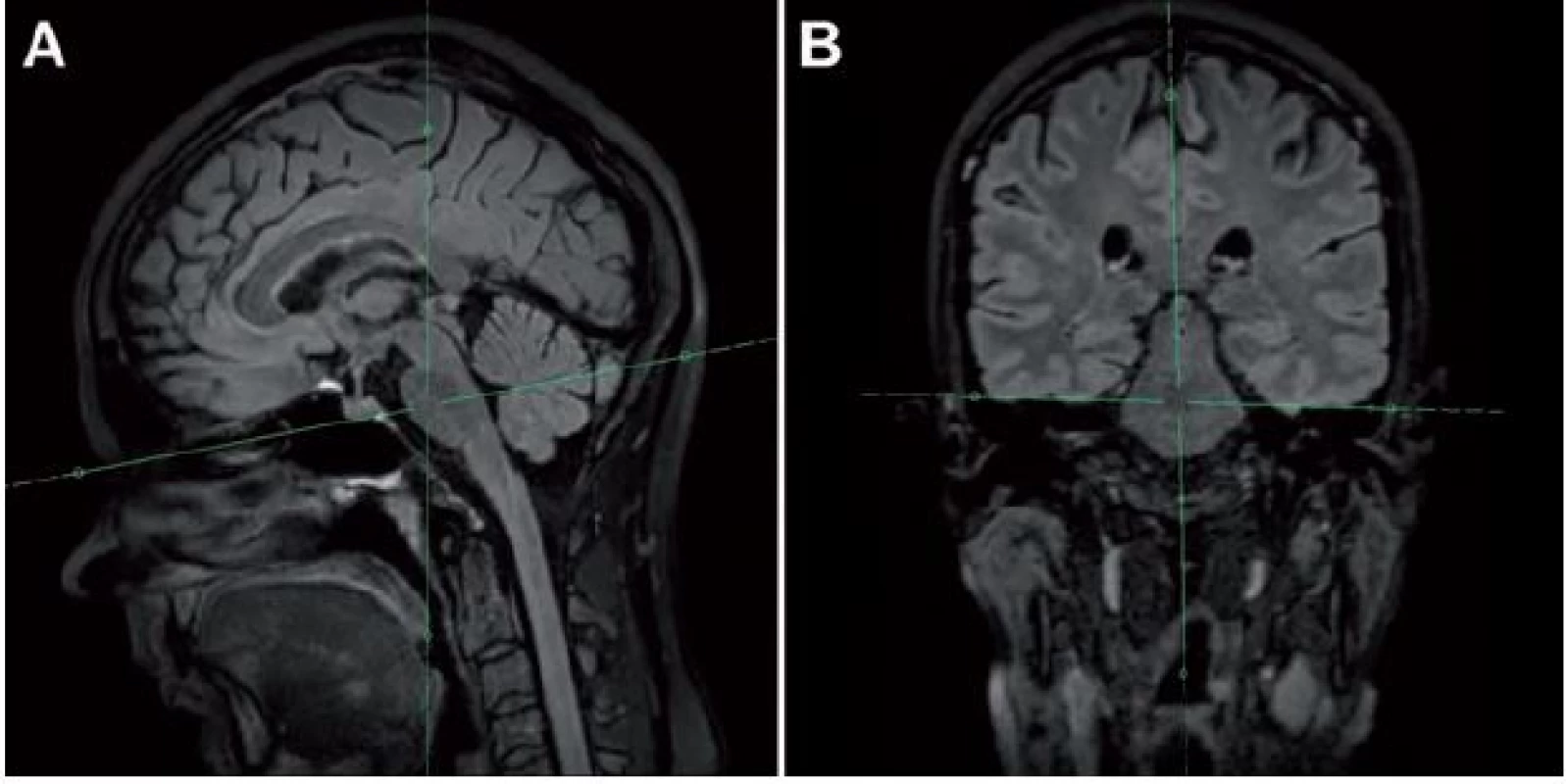
Za dôležité považujeme upozorniť, že pomalý rast LGG môže byť v niektorých prípadoch prehliadnutý (obr. 6) [41,30]. Jakola et al popisujú prípad 29 - ročnej pacientky s inzulárnym LGG, u ktorej pri opakovaných MR vyšetreniach bol popisovaný veľkostne stacionárny nález [47]. Pri detailnej volumetrickej štúdii však bol medzi jednotlivými vyšetreniami zistený nárast objemu 10 %, pri poslednej kontrole bol nárast objemu 24 % voči predposlednému vyšetreniu; objem tumoru pri poslednom vyšetrení bol oproti objemu nameranému pri prvom vyšetrení dokonca dvojnásobný [47]. Dôležité je teda porovnanie aktuálneho vyšetrenia nielen s predchádzajúcim vyšetrením, ale aj s iniciálnym vyšetrením [47], nakoľko v dlhšom časovom odstupe je zjavnejší nárast objemu, resp. priemeru tumoru.
Obr. 6. Ľavostranný inzulárny LGG, meranie priemeru v mieste najrýchlejšieho rastu vo FLAIR sekvencii. 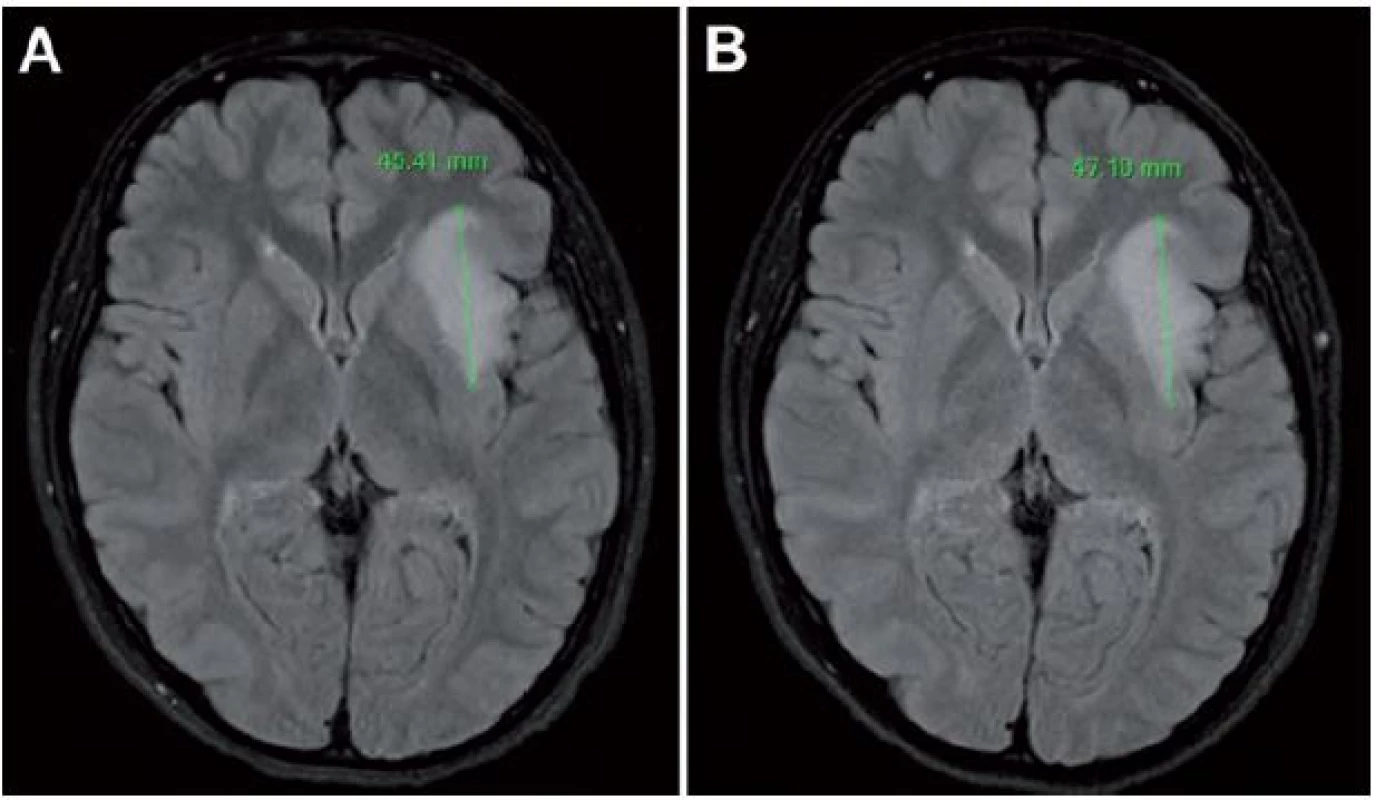
Vstupné vyšetrenie (A) a kontrolné vyšetrenie o 19 mesiacov (B) na posúdenie rastovej dynamiky; stav bol na inom pracovisku nesprávne popísaný ako stacionárny. Prognostický význam rýchlosti rastu LGG
Prvú štúdiu skúmajúcu vplyv rýchlosti rastu LGG na dĺžku prežívania pacientov realizovali v roku 2006 Pallud et al, ktorí retrospektívne analyzovali súbor 143 pacientov s LGG [48]. Pacienti absolvovali len biopsiu, sledovaní boli až do času malígnej transformácie, resp. ďalšej liečby (chirurgickej, resp. onkologickej). Na meranie veľkosti tumoru bola použitá technika merania troch rozmerov, pričom dva rozmery boli merané v axiálnej rovine v T2 zobrazení, tretí rozmer bol meraný v sagitálnej rovine v T1 zobrazení (nakoľko nebola dostupná T2 sekvencia v inej ako axiálnej rovine). Autori zistili inverznú koreláciu medzi rýchlosťou rastu LGG a dĺžkou prežívania pacientov. Pri rýchlosti rastu LGG 8 mm/ rok a viac bol medián prežitia 5,16 roka, zatiaľ čo pri raste menej ako 8 mm/ rok bol medián prežitia viac ako 15 rokov. LGG rastúce rýchlosťou nad 8 mm/ rok majú teda obdobnú prognózu ako anaplastické gliómy [48].
V roku 2009 Brasil Caseiras et al skúmali skupinu 34 pacientov s LGG, všetci absolvovali len biopsiu a potom boli sledovaní [28]. Každý pacient mal odmeraný vstupný objem tumoru a objem o šesť mesiacov neskôr. Na meranie objemu bola použitá FLAIR sekvencia v koronárnej rovine s hrúbkou rezu 5 mm, s použitím semiautomatickej segmentácie. Autori identifikovali prognosticky významnú prahovú hodnotu zväčšenia objemu tumoru o 6,21 ml v priebehu šesť mesiacov. U podskupiny pacientov so zväčšením objemu o viac ako 6,21 ml v priebehu šesť mesiacov bol čas do malígnej transformácie 1,82 roka; v podskupine pacientov so šesťmesačným nárastom objemu o 6,21 ml alebo menej bol čas do malígnej transformácie signifikantne dlhší – 3,91 roka [28].
V reakcii na prácu Brasil Caseiras et al [28] namietali Pallud et al [5], že autori nekvantifikovali rast aj pomocou priemerov tumorov (ale len meraním ich objemov). Pallud et al upozornili, že je dôležité brať do úvahy najmä nárast objemu vo vzťahu ku vstupnému objemu LGG (nielen samotný nárast objemu tumoru v priebehu času) [5]. Ako príklad uvádzajú, že nárast objemu tumoru o 6,21 ml v priebehu šiestich mesiacov u malého tumoru s objemom napr. 4 ml znamená VDE na úrovni 14,6 mm/ rok, čo v praxi predstavuje, že sa môže jednať už o anaplastický tumor. Naproti tomu šesťmesačný nárast objemu o 6,21 ml znamená v prípade veľkého tumoru so vstupným objemom napr. 80 ml VDE na úrovni 2,7 mm/ rok. Nárast objemu o 6,21 ml za šesť mesiacov je teda rovnako možný u veľkého pomaly rastúceho tumoru, ale aj u malého tumoru s rýchlym rastom a agresívnym správaním [5]. Popisovaný prognostický význam rastu objemu tumoru [28] teda môže byť v skutočnosti kombináciou dvoch nezávislých prognostických ukazovateľov, vstupného objemu tumoru a rýchlosti rastu [5].
Percentuálny nárast objemu tumoru hodnotili Rees et al [27]. Skúmaný bol súbor 34 pacientov s LGG, pričom v 27 prípadoch bola diagnóza potvrdená biopsiou, u siedmich pacientov bola diagnóza stanovená len na základe grafických vyšetrení. Všetci pacienti boli liečení až po objavení sa malígnej transformácie. Autori porovnávali rýchlosť rastu LGG u dvoch podskupín pacientov – do prvej podskupiny boli zaradení pacienti, u ktorých nastala počas doby sledovania malígna transformácia, do druhej podskupiny patrili pacienti, u ktorých transformácia nenastala. Na výpočet objemu tumoru bola použitá technika semiautomatickej segmentácie. Autori zistili, že v skupine „transformerov” (v skupine pacientov s malígnou transformáciou) nastala výrazná akcelerácia rastu v čase šesť mesiacov pred rádiologicky zjavnou malígnou transformáciou [27]. Uvedená rastová akcelerácia pred rádiologicky identifikovateľnou malígnou transformáciou môže teda predstavovať predstupeň malígnej transformácie (resp. už jej počiatočné štádium).
Hlaihel et al retrospektívne skúmali skupinu 22 pacientov s LGG z hľadiska prognostického významu rýchlosti rastu priemeru tumoru vo vzťahu ku skorej malígnej transformácii [29]. Parciálnu resekciu absolvovalo 14 pacientov, osem pacientov biopsiu. Pacienti boli rozdelení do dvoch podskupín; na podskupinu, u ktorej prišlo k malígnej transformácii a podskupinu bez malígnej transformácie. Meranie veľkosti tumoru bolo realizované technikou merania troch rozmerov, pričom bol využívaný geometrický priemer nameraných troch hodnôt. Priemerná rýchlosť rastu všetkých LGG bola 3,65 mm/ rok (teda bola takmer identická s priemernou rýchlosťou rastu LGG zistenou autormi Pallud et al – 4 mm/ rok) [48]. V podskupine bez malígnej transformácie bola rýchlosť rastu na úrovni 2,14 mm/ rok, zatiaľ čo LGG v podskupine s malígnou transformáciou rástli priemerne rýchlosťou 7,87 mm/ rok. Autori zistili, že rast priemeru tumoru viac ako 3 mm/ rok je asociovaný s vyšším rizikom skorej malígnej transformácie. Medzná hodnota 3 mm/ rok je teda výrazne nižšia ako medzná „cut‑off“ hodnota VDE 8 mm/ rok zistená Palludom et al [48], po prekročení ktorej mali pacienti signifikantne kratšie prežívanie. Hlaihel et al [29] ani Pallud et al [48] však jednoznačne nevysvetľujú, ako „cut‑off‘ hodnoty stanovili.
Nateraz najväčšiu štúdiu zameriavajúcu sa na prognostický význam rýchlosti rastu LGG na dĺžku prežívania prezentovali Pallud et al [30], ktorí rozšírili súbor LGG publikovaný v roku 2006. Autori na súbore 407 LGG skúmali, či a do akej miery môže rýchlosť rastu predpovedať čas do malígnej transformácie a dlhodobé prežitie pacientov. Všetci pacienti zaradení do súboru absolvovali pred akoukoľvek liečbou aspoň dve MR vyšetrenie s odstupom minimálne šiestich týždňov. Na vypočítanie objemu tumoru bola použitá elipsoidná aproximácia V = (D1 × D2 × D3)/ 2, pričom D1, D2 a D3 boli najväčšie rozmery tumoru v troch rovinách (axiálnej, koronárnej, sagitálnej T2, resp. FLAIR sekvencii); následne boli vypočítané MTD a VDE. Za známky malígnej transformácie autori považovali objavenie sa ložísk s postkontrastným zvyšovaním signálovej intenzity v T1 vážení alebo zvýraznenie uvedeného signálu v postkontrastnom zobrazení, keď boli už pôvodne prítomné. Malígna transformácia bola posudzovaná aj na základe histologického vyšetrenia. Pomaly rastúce LGG boli asociované s dlhším časovým intervalom do malígnej transformácie a tiež celkovo dlhším prežitím, bez ohľadu na histopatologický nález a genetický status [30]. U pacientov s VDE < 4 mm/ rok; ≥ 4 < 8 mm/ rok; ≥ 8 < 12 mm/ rok; ≥12 mm/ rok bol čas do malígnej transformácie 117, 83, 60 a 31 mesiacov, pričom rozdiely v čase do malígnej transformácie medzi jednotlivými skupinami boli signifikantné. Pacienti s VDE < 4 mm/ rok;≥ 4 < 8 mm/ rok; ≥ 8 < 12 mm/ rok; ≥ 12 mm /rok mali celkový čas prežitia 253, 210, 91 a 75 mesiacov, pričom rozdiely v čase do malígnej transformácie medzi jednotlivými skupinami boli opäť signifikantné. Dokázaná teda bola inverzná korelácia medzi rýchlosťou rastu, časom do malígnej transformácie a celkovým časom prežitia pacientov [30].
Zaujímavý je fakt, že autori, ktorí skúmali rozdiely v rýchlosti rastu medzi jednotlivými histologickými podtypmi LGG (astrocytómami, oligodendrogliómami a oligoastrocytómami), nezistili signifikantný rozdiel; vo všetkých prípadoch však boli zo súborov vyradené gemistocytárne astrocytómy [8,30,48].
Na základe publikovaných relevantných dát je možné považovať VDE za parameter so silnou prognostickou hodnotou, ktorý by mal byť braný do úvahy zároveň s ostatnými známymi ukazovateľmi pri odhadovaní prognózy u konkrétneho pacienta s LGG [38]. Vzhľadom na prognostickú hodnotu VDE niektorí autori dokonca odporúčajú realizovať druhé MR vyšetrenie pred akoukoľvek ďalšou liečbou; je však potrebné optimalizovať interval medzi prvým a druhým MR vyšetrením [39]. Na jednej strane síce dlhý interval zvýši presnosť merania, na druhej strane však príliš dlhý interval medzi iniciálnym a druhým MR vyšetrením zvyšuje riziko anaplastickej transformácie. Pallud et al [39] navrhujú využitie kritérií podľa Changa (tj. University of California at San Francisco low ‑ grade glioma prognostic scoring system) [13,49]. U pacientov s Changovým skóre 3 – 4 navrhujú realizáciu druhého kontrolného MR vyšetrenia v priebehu šesťtýždňového intervalu po prvotnom vyšetrení. U pacientov s Changovým skóre 0 – 2 autori odporúčajú kontrolné vyšetrenie o tri mesiace. Na overenie efektívnosti a najmä bezpečnosti tohto postupu je však potrebná prospektívna štúdia. Navyše je potrebné zdôrazniť, že rýchlosť rastu LGG sa po resekcii podstatne nemení [8], teda je možné predpokladať, že aj včasne pooperačne meraná rýchlosť rastu reziduálnych LGG môže byť významným prognostickým ukazovateľom. U rýchlo rastúcich reziduálnych (príp. recidivujúcich) LGG sa teda javí ako vhodný aktívny liečebný prístup (napr. včasná onkologická liečba, resp. opätovná rozsiahla resekcia – ak je bezpečne možná). Efektivitu a bezpečnosť takéhoto postupu je však taktiež nutné overiť prospektívnymi štúdiami; tieto sú navyše potrebné aj na stanovenie „cut‑off“ hodnoty rýchlosti rastu, pri ktorej je indikovaná ďalšia liečba. Navyše hodnotenie pooperačných stavov – teda rastu reziduálnych (a recidivujúcich) LGG – môže byť v niektorých prípadoch relatívne komplikované. Malo by byť preto realizované skúseným rádiológom.
Záver
LGG bez onkologickej liečby kontinuálne rastú a postupne transformujú na gliómy vyššieho stupňa malignity. Na základe dostupných dát sa rýchlosť rastu LGG ukazuje ako významný prognostický ukazovateľ. LGG s rýchlejším rastom transformujú skôr a pacienti žijú kratšie. Na to, aby sa VDE stal všeobecne akceptovanou súčasťou objektivizácie rizika včasnej malígnej transformácie u konkrétneho LGG, je potrebná realizácia prospektívnych štúdií.
Táto práca vznikla za podpory grantovej agentúry VEGA číslo grantu 1/1005/16.
Zoznam použitých skratiek
DICOM Digital Imaging and Communications in Medicine
FLAIR Fluid Attenuated Inverse Recovery
HGG high‑grade glióm, gliový tumor III., resp. IV. stupňa malignity
HYFA línia hypofýza – fastigium štvrtej mozgovej komory
IDH1 izocitrátdehydrogenáza 1
LGG low ‑ grade glióm, gliový tumor II. stupňa malignity
MR magnetická rezonancia
MTD Mean Tumor Diameter (stredný priemer nádoru)
PET pozitrónová emisná tomografia
VDE Velocity of Diametric Expansion (rýchlosť nárastu priemeru tumoru)
WHO World Health Organization (Svetová zdravotnícka organizácia)
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Prijato k recenzii: 2. 3. 2015
Prijaté do tlače: 2. 4. 2015
doc. MUDr. Andrej Šteňo, PhD.
Neurochirurgická klinika
LF UK a UN Bratislava
Limbová 5
833 05 Bratislava
e-mail: andrej.steno@gmail.com
Zdroje
1. Šteňo A, Belan V, Kalina P, Fabian M, Šteňo J. Vplyv chirurgickej liečby na prognózu dospelých pacientov so supratentoriálnymi low ‑ grade gliómami. Cesk Slov Neurol N 2011; 74/ 107(3): 273 – 278.
2. Pouratian N, Schiff D. Management of low ‑ grade glioma. Curr Neurol Neurosci Rep 2010; 10(3): 224 – 231. doi: 10.1007/ s11910 ‑ 010 ‑ 0105 ‑ 7.
3. Soffieti R, Baumert BG, Bello L, von Deimling A, Duffau H, Frénay M et al. Guidelines on management of low ‑ grade gliomas: report of an EFNS ‑ EANO Task Force. Eur J Neurol 2010; 17(9): 1124 – 1133. doi: 10.1111/ j.1468 ‑ 1331.2010.03151.x.
4. Potts MB, Smith JS, Molinaro AM, Berger MS. Natural history and surgical management of incidentally discovered low ‑ grade gliomas. J Neurosurg 2012; 116(2): 365 – 372. doi: 10.3171/ 2011.9.JNS111068.
5. Pallud J, Capelle L, Mandonnet E. Comment on parameters of low ‑ grade glioma as predictors. Radiology 2010; 256(3): 1014. doi: 10.1148/ radiol.100299.
6. Perry A. Pathology of low ‑ grade gliomas: an update of emerging concepts. Neuro Oncol 2003; 5(3): 168 – 178.
7. Schiffbauer H, Ferari P, Rowley HA, Berger MS, Roberts TP. Functional activity within brain tumors: a magnetic source imaging study. Neurosurgery 2001; 49(6): 1313 – 1320.
8. Mandonnet E, Pallud J, Fontaine D, Taillander L, Bauchet L, Peruzzi P et al. Inter ‑ and intrapatients comparison of WHO grade II glioma kinetics before and after surgical resection. Neurosurg Rev 2010; 33(1): 91 – 96. doi: 10.1007/ s10143 ‑ 009 ‑ 0229 ‑ x.
9. Afra D, Osztie E, Sipos L, Vitanovics D. Preoperative history and postoperative survival of supratentorial low ‑ grade astrocytomas. Br J Neurosurg Rev 1999; 13(3): 299 – 305.
10. Whittle IR. The dilemma of low-grade glioma. J Neurol Neurosurg Psychiatry 2004; 75 (Suppl 2): ii31 – ii36.
11. Frazier JL, Johnson MW, Burger PC, Weingart JD, Quinones ‑ Hinojosa A. Rapid malignant transformation of low ‑ grade astrocytomas: report of 2 cases and review of the literature. World Neurosurg 2010; 73(1): 53 – 62. doi: 10.1016/ j.surneu.2009.05.010.
12. Pignatti F, van den Bent M, Curran D, Debruyne C, Sylvester R, Therasse P et al. Prognostic factors for survival in adult patients with cerebral low ‑ grade glioma. J Clin Oncol 2002; 20(8): 2076 – 2084.
13. Chang EF, Smith JS, Chang SM, Lamborn KR, Prados MD,Butowski N et al. Preoperative prognostic classification system for hemispheric low ‑ grade gliomas in adults. J Neurosurg 2008; 109(5): 817 – 824. doi: 10.3171/ JNS/ 2008/ 109/ 11/ 0817.
14. Houillier C, Mohktari K, Carpentier C, Criniere E, Marie Y,Rousseau A. Chromosome 9p and 10q losses predict outcome in low ‑ grade gliomas. Neuro Oncol 2010; 12(1): 2 – 6. doi: 10.1093/ neuonc/ nop002.
15. Chen R, Ravindra VM, Cohen AL, Jensen RL, Salzman KL, Prescot AP et al. Molecular features assisting in diagnosis, surgery, and treatment decision making in low ‑ grade gliomas. Neurosurg Focus 2015; 38(3): E2. doi:10.3171/ 2015.1.FOCUS14745.
16. Wang JB, Dong DF, Wang MD, Gao K. IDH1 overexpression induced chemotherapy resistance and IDH1 mutation enhanced chemotherapy sensitivity in Glioma cells in vitro and in vivo. Asian Pac J Cancer Prev 2014; 15(1): 427 – 432.
17. McGirt MJ, Chaichana KL, Attenello FJ, Weingart JD,Than K, Burger PC et al. Extent of surgical resection is independently associated with survival in patients with hemispheric infiltrating low ‑ grade gliomas. Neurosurgery 2008; 63(4): 700 – 707. doi: 10.1227/ 01.NEU.0000325729.41085.73.
18. Ahmadi R, Dictus C, Hartmann C, Zurn O, Edler L, Hartmann M. Long‑term outcome and survival of surgically treated supratentorial low ‑ grade glioma in adult patients. Acta Neurochir (Wien) 2009; 151(11): 1359 – 1365. doi: 10.1007/ s00701 ‑ 009 ‑ 0435 ‑ x.
19. Smith JS, Chang EF, Lamborn KR, Chang SM, Prados MD, Cha S et al. Role of extent of resection in the long‑term outcome of low ‑ grade hemispheric gliomas. J Clin Oncol 2008; 26(8): 1338 – 1345. doi: 10.1200/ JCO.2007.13.9337.
20. Claus EB, Horlacher A, Hsu L, Schwartz RB, Dello ‑ Lacono D, Talos F et al. Survival rates in patients with low ‑ grade glioma after intraoperative magnetic resonance image guidance. Cancer 2005; 103(6): 1227 – 1233.
21. Duffau H, Lopes M, Arthuis F, Bitar A, Sichez JP, Van Effentere R et al. Contribution of intraoperative electrical stimulation in surgery of low ‑ grade gliomas: a comparative study between two series without (1985 – 1996) a and with (1996 – 2003) functional mapping in the same institution. J Neurol Neurosurg Psychiatry 2005; 76 : 845 – 851.
22. Jakola AS, Myrmel KS, Kloster R, Torp SH, Lindal S, Unsgard G et al. Comparison of a strategy favoring early surgical resection vs a strategy favoring watchful waiting in low ‑ grade gliomas. JAMA 2012; 308(18): 1881 – 1888.
23. Sanai N, Berger MS. Glioma extent of resection and its impact on patient outcome. Neurosurgery 2008; 62(4): 753 – 764. doi: 10.1227/ 01.neu.0000318159.21731.cf.
24. Riva M, Bello L. Low ‑ grade glioma management: a contemporary surgical approach. Curr Opin Oncol 2014; 26(6): 615 – 621. doi: 10.1097/ CCO.0000000000000120.
25. Chaichana KL, McGirt MJ, Laterra J, Olivi A, Quinones ‑ Hinosaja A. Recurrence and malignant degeneration after resection of adult hemispheric low ‑ grade gliomas. J Neurosurg 2010; 112(1): 10 – 17. doi: 10.3171/ 2008.10.JNS08608.
26. Martino J, Taillandier L, Gasser SM, Peggy G, Duffau H. Re ‑ operation is a safe and effective therapeutic strategy in reccurent WHO grade II gliomas within eloquent areas. Acta Neurochir 2009; 151(5): 427 – 436. doi: 10.1007/ s00701 ‑ 009 ‑ 0232 ‑ 6.
27. Rees J, Watt H, Jager HR, Benton C, Tozer D, Tofts Pet al. Volumes and growth rates of untreated adult low ‑ grade gliomas indicate risk of early malignant transformation. Eur J Radiol 2009; 72(1): 54 – 64. doi: 10.1016/ j.ejrad.2008.06.013.
28. Brasil Caseiras G, Ciccarelli O, Altmann DR, Benton CE,Tozer DJ, Tofts PS et al. Low ‑ grade gliomas: six month tumor growth predicts patient outcome better than admission tumor volume, relative cerebral blood volume, and apparent diffusion coefficient. Radiology 2009; 253(2): 505 – 512. doi: 10.1148/ radiol.2532081623.
29. Hlaihel C, Guilloton L, Guyotat J, Streichenberger N, Honnorat J, Cotton F. Predictive value of multimodality MR using conventional, perfusion, and spectroscopy MRI in anaplastic transformation of low ‑ grade oligodendrogliomas. J Neuro‑Oncol 2010; 97(1): 73 – 80. doi: 10.1007/ s11060 ‑ 009 ‑ 9991 ‑ 4.
30. Pallud J, Blonski M, Mandonnet E, Audureau E, Fontaine D, Sanai N et al. Velocity of tumor spontaneous expansion predicts long‑term outcomes for diffuse low ‑ grade gliomas. Neuro Oncol 2013; 15(5): 595 – 606. doi: 10.1093/ neuonc/ nos331.
31. Rychlý B, Fabian M. Oligodendrogliové tumory: histologicko‑rádiologické korelácie. Lek Obzor 2010; 5(59): 203 – 204.
32. Bynevelt M, Britton J, Seymour H, MacSweeney E, Tomas N, Sandhu K. Flair imaging in the follow‑up of low ‑ grade gliomas: time to dispense with the dual echo? Neuroradiology 2001; 43(2): 129 – 133.
33. Pallud J, Varlet P, Devaux B, Geha S, Badouval M, Deroulers C et al. Diffuse low ‑ grade oligodendrogliomas extend beyond MRI ‑ defined abnormalities. Neurology 2010; 74(21): 1724 – 1731. doi: 10.1212/ WNL.0b013e3181e04264.
34. Scott JN, Brasher PM, Sevick RJ, Rewcastle NB, Forsyth PA. How often are nonenhancing supratentorial gliomas malignant? A population study. Neurology 2002; 59(6): 947 – 949.
35. While ML, Zhang Y, Kirby P, Ryken TC. Can tumor contrast enhancement be used as a criterion for differentiating tumor grades of oligodendrogliomas? AJNR Am J Neuroradiol 2005; 26(4): 784 – 790.
36. Belan V, Pružincová Ľ, Srbecký M. MR v diagnostike a liečbe primárnych nádorov mozgu. Onkológia (Bratisl) 2010; 5(3): 138 – 141.
37. Pročka V, Makaiova I, Šteňo J, Kalina P, Belan V, Pružincová Ľ et al. Skúsenosti s využitím 18FDG PET v diferenciálnej diagnostike low ‑ grade a highgrade gliomov. Onkologia (Bratisl) 2010; 5(3): 156 – 116.
38. Widhalm G, Wolfsberger S, Minchev G, Woehrer A, Krssak M, Czech T et al. 5 – Aminolevulinic acid is a promising marker for detection of anaplastic foci in diffusely infiltrating gliomas with nonsignificant contrast enhancement. Cancer 2010; 116(6): 1545 – 1552. doi: 10.1002/ cncr.24903.
39. Pallud J, Taillandier L, Capelle L, Fontaine D, Peyre M,Ducray F et al. Quantitative morphological magnetic resonance imaging follow‑up of low ‑ grade glioma: a plead for systematic measurement of growth rates. Neurosurgery 2012; 71(3): 729 – 739.
40. Mandonnet E, Pallud J, Clatz O, Taillander L, Konukoglu E, Duffau H et al. Computational modeling of the WHO grade II glioma dynamics: principles and applications to management paradigm. Neurosurg Rev 2008; 31(3): 263 – 269. doi: 10.1007/ s10143 ‑ 008 ‑ 0128 ‑ 6.
41. Mandonnet E, Delattre JY, Tanguy ML, Swanson KR, Carpentier AF, Duffau H et al. Continuous growth of mean tumor diameter in a subset of grade II gliomas. Ann Neurol 2003; 53(4): 524 – 528.
42. Ricard D, Kaloshi G, Amiel ‑ Benouaich A, Lejeune J, Marie Y, Mandonnet E et al. Dynamic history of low ‑ grade gliomas before and after temozolomide treatment. Ann Neurol 2007; 61(5): 484 – 490.
43. Woodward DE, Cook J, Tracqui P, Cruywagen GC, Murray JD, Alvord EC jr et al. A mathematical model of glioma growth: the effect of extent of surgical resection. Cell Prolif 1996; 29(6): 269 – 288.
44. Swanson KR, Alvord EC jr, Murray JD. A quantitative model for differential motility of gliomas in grey and white matter. Cell Prolif 2000; 33(5): 317 – 329.
45. Schmitt P, Mandonnet E, Perdreau A, Angelini ED. Effect of slice thickness and head rotation when measuring glioma sizes on MRI: in support of volume segmentation versus two largest diameters methods. J Neurooncol 2013; 112(2): 165 – 172. doi: 10.1007/ s11060 ‑ 013 ‑ 1051 ‑ 4.
46. Sorensen AG, Patel S, Harmath C, Bridges S, Synnott J,Sievers A et al. Comparison of diameter and perimeter methods for tumor volume calculation. J Clin Oncol 2001; 19(2): 551 – 557.
47. Jakola AS, Moen KG, Ole S, Kvistad KA. “No growth” on serial MRI scans of a low-grade glioma? Acta Neurochirurgica 2013; 155(23): 2243 – 2244. doi: 10.1007/ s00701 ‑ 013 ‑ 1914 ‑ 7.
48. Pallud J, Mandonnet E, Duffau H, Kujas M, Guillevin R,Galanaud D et al. Prognostic value of initial magnetic resonance imaging growth rates for World Health Organization grade II gliomas. Ann Neurol 2006; 60(3): 380 – 383.
49. Chang EF, Clark A, Jensen RL, Bernstein M, Guha A, Carrabba G et al. Multiinstitutional validation of the University of California at San Francisco Low ‑ grade Glioma Prognostic Scoring System. Clinical article. J Neurosurg 2009; 111(2): 203 – 210.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek Využití škály QUALID k hodnocení kvality života u pacientů v pozdní fázi demence v České republiceČlánek Projekt ncRNAPainČlánek Výskyt periferního primitivního neuroektodermálního nádoru v průběhu spinálního kořene – kazuistikaČlánek ErratumČlánek Webové okénkoČlánek Analýza dat v neurologii
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2015 Číslo 3- Magnosolv a jeho využití v neurologii
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Diagnostika epileptických záchvatů
- Míšní šok – od patofyziologie ke klinickým projevům
- Biomarkery roztroušené sklerózy – současné možnosti a perspektivy
- Vplyv rýchlosti rastu supratentoriálnych grade II gliómov na ich prognózu
- Příčiny vzniku Parkinsonovy nemoci – nové představy a nové výzvy
- Testy verbální fluence, česká normativní studie pro osoby vyššího věku
- Addenbrookský kognitivní test – orientační normy pro českou populaci
- Komise pro funkční odbornost v EEG upozorňuje
- Současný stav léčby anaplastických gliomů v České republice
- Využití škály QUALID k hodnocení kvality života u pacientů v pozdní fázi demence v České republice
- Výsledky chirurgické léčby pacientů s „čistým“ úrazovým epidurálním krvácením
- Neuropsychologický výkon u pacientů s první epizodou schizofrenie
- Kennedyho choroba v materiáli Centra pre neuromuskulárne ochorenia Bratislava
- Absces zadní jámy lební s obstrukčním hydrocefalem u dítěte s dermoidální cystou s dermálním sinusem – kazuistika
- Projekt ncRNAPain
- Výskyt periferního primitivního neuroektodermálního nádoru v průběhu spinálního kořene – kazuistika
- Erratum
- Absces mozku jako první klinická manifestace hereditární hemoragické teleangiektázie – tři kazuistiky
- Ovlivnění výsledku traktografie pyramidové dráhy volbou oblasti zájmu trasování – kazuistika
- Vzduchová embolie mozku – kazuistika
- Životní jubileum profesorky Soni Nevšímalové
- Zvečnená spomienka na profesora Cigánka
- Prof. MUDr. Peter Kukumberg, PhD., 70- ročný
- Webové okénko
- Analýza dat v neurologii
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Addenbrookský kognitivní test – orientační normy pro českou populaci
- Míšní šok – od patofyziologie ke klinickým projevům
- Diagnostika epileptických záchvatů
- Testy verbální fluence, česká normativní studie pro osoby vyššího věku
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



