-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Hidradenitis suppurativa, črevný mikrobióm a SIBO – komplexný prehľad problematiky
Hidradenitis suppurativa, intestinal microbiome and SIBO – a comprehensive overview of the issue
Hidradenitis suppurativa (HS) is a chronic immune-mediated inflammatory skin disease. It is characterized by an inflammation that affects apocrine gland bearing skin in axillae, groin and under the breasts with the formation of painful nodules, abscesses and purulent discharge, sinuses and scaring. Patients with HS have an increased incidence of inflammatory bowel disease (IBD), which also indicates their cross-sections in the pathogenesis of dysregulation congenital and adaptive immunity. Recently, there has been a significant increase of interest in the intestinal microbiome and skin disease, as much as its role in the pathogenesis of HS. According to literature, intestinal dysbiosis promotes the production of proinflammatory cytokines and consequently the formation of HS lesions. Overgrowth of bacteria in the small intestine (SIBO) is a condition characterized by an increased concentration of bacteria in the large intestine. Eradication of SIBO was able to improve psoriasis measured by the psoriasis severity index. In this context, it is hypothesized that eredication of SIBO may have a beneficial effect on the severity of manifestations in inflammatory immune-mediated skin diseases, including HS.
Keywords:
hidradenitis suppurativa – immune-mediated infl ammation – gut microbio me – small intestinal bacterial overgrowth – SIBO – interprofessional cooperation
Autoři: B. Ivanková 1
; J. Baloghová 1,2
Působiště autorů: Klinika dermatovenerológie UN L. Pasteura, Košice 1; LF UPJŠ Košice 2
Vyšlo v časopise: Gastroent Hepatol 2024; 78(1): 41-46
Kategorie: Klinická a experimentální gastroenterologie: přehledová práce
doi: https://doi.org/10.48096/ccgh202441Souhrn
Súhrn: Hidradenitis suppurativa (HS) je chronický imunitne mediovaný zápal pilosebaceóznej jednotky a apokrinných potných žliaz s tvorbou bolestivých uzlov, abscesov, hnisajúcich fistúl a jaziev predilekčne v intertiginóznych priestoroch. U pacientov s HS je zvýšená incidencia zápalových ochorení čreva (IBD – inflammatory bowel disease), čo poukazuje na ich vzájomné priesečníky v patogenéze dysregulácie vrodenej a adaptívnej imunity. Nedávno sa výrazne zvýšil záujem o črevný mikrobióm kožných ochorení, predmetom záujmu je aj jeho úloha v patogenéze HS. Podľa literárnych údajov črevná dysbióza podporuje produkciu prozápalových cytokínov a následne tvorbu HS lézií. Syndróm prerastania baktérií v tenkom čreve (SIBO – small intestinal bacterial overgrowth) je stav, ktorý sa vyznačuje zvýšenou koncentráciou baktérií hrubého čreva v tenkom čreve. Eredikácia SIBO bola napr. schopná zlepšiť kožné prejavy pri psoriáze, v zmysle zníženia indexu jej závažnosti. V tomto kontexte existuje hypotéza, že eredikácia SIBO môže mať priaznivý vplyv na závažnosť prejavov zápalových imunitne mediovaných kožných ochorení, vrátane HS.
Klíčová slova:
hidradenitis suppurativa – imunitne mediovaný zápal – črevný mikrobióm – small intestinal bacterial overgrowth – SIBO – medziodborová spolupráca
Úvod
Hidradenitis suppurativa (HS), inak označovaná aj ako akné inversa, je chronické, bolestivé, progresívne zápalové ochorenie predilekčne sa objavujúce v intertriginóznych oblastiach tela so zvýšenou koncentráciou apokrinných potných žliaz. Predovšetkým sú to axily, inguiny, gluteálne a submamárne oblasti (obr. 1–4). Etiopatogenetickým podkladom ochorenia je imunologicky mediovaný zápal pôsobiaci na keratinocyty vo výstelke ústia folikulu. Autoinflamácia vedie k oklúzii folikulu (klinicky sa tvorí nodozita či absces) a následne k jeho ruptúre a postupnej tvorbe fistulácií a sínusových traktov [1].
Dôležitým faktorom v spustení zápalového procesu je genetická záťaž. Pozitívnu rodinnú anamnézu má 30–40 % pacientov. V posledných rokoch sa mnoho diskutuje o defekte signálnych ciest Notch a gama-sekretázy. Viaceré štúdie dokazujú zvýšenú hladinu cytokínov IL-1beta, IL-10, TNFa, IL-12, IL-23, IL-17 v léziách HS v porovnaní so zdravou kožou. Medzi vyvolávajúce faktory patrí fajčenie a významnú úlohu zohráva aj obezita, vďaka mechanickej iritácii, oklúzii a macerácii [2,3].
Incidencia ochorenia varíruje od 1 do 4 %, postihuje predovšetkým ženské pohlavie. Hlavným diagnostickým kritériom ochorenia je recidíva jednej či viacerých typických lézií, t. j. nodozita či absces, v jednej z predilekčných oblastí viac ako 2-krát za 6 mesiacov [4].
Na objektivizáciu závažnosti ochorenia a jej dynamiky využívame skórovacie systémy, ktoré majú vplyv aj pri rozhodovaní sa o ďalších terapeutických postupoch. V praxi sa najčastejšie využíva hodnotenie stupňa závažnosti podľa Hurley klasifikácie (tab. 1) a na hodnotenie aktivity ochorenia sa uplatňuje HS-PGA škála závažnosti (HS Physician’s Global Assessment, tab. 2). Kvalitu života pacienta s HS hodnotíme na základe dotazníkov kvality života DLQI (Dermatological Life Quality Index).
Na posúdenie úspešnosti liečby a sledovanie aktivity ochorenia bol vytvorený index – HISCR (HS Clinical Response). Podľa HISCR je liečba úspešná, ak je po 4 mesiacoch prítomná aspoň 50% redukcia počtu abscesov a nodozít, nepribudne žiaden nový absces či fistulácia, novo vytvorené nodozity sú akceptované [5].
Pacienti s HS trpia rôznym spektrom symptómov, od lokálnych cez systémové. Medzi lokálne patrí bolestivosť a pálenie ložísk, pruritus a nadmerné potenie. Výnimkou nie je ani anémia, hypoproteinémia, sekundárny lymfedém a muskuloskeletálne abnormality. Chronický invalidizujúci charakter hlavne stredne ťažkej a ťažkej formy ochorenia predstavuje pre pacienta nielen záťaž psychickú, ale má aj výrazný celospoločenský ekonomický dopad [6].
Obr. 1. Gluteálny fenotyp HS. // Gluteal HS phenotype. 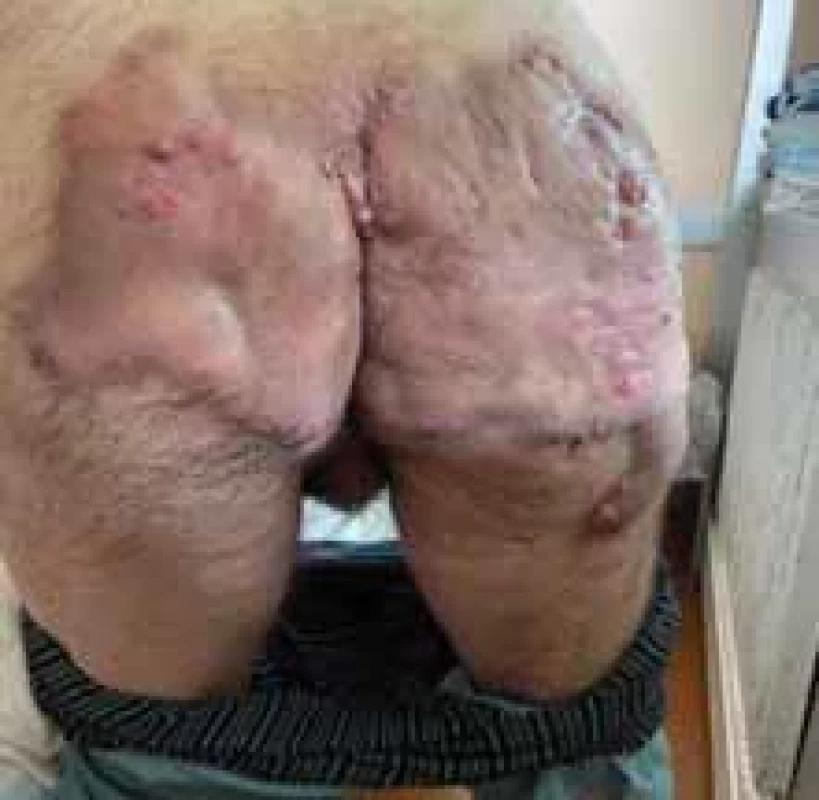
Zdroj: Archív Kliniky dermatovenerológie UN L. Pasteura, Košice.
Source: Archives of the UN L. Pasteur Department of Dermatovenerology, Košice.Obr. 2. Axilárne postihnutie pri HS. // Axillary involvement in HS. 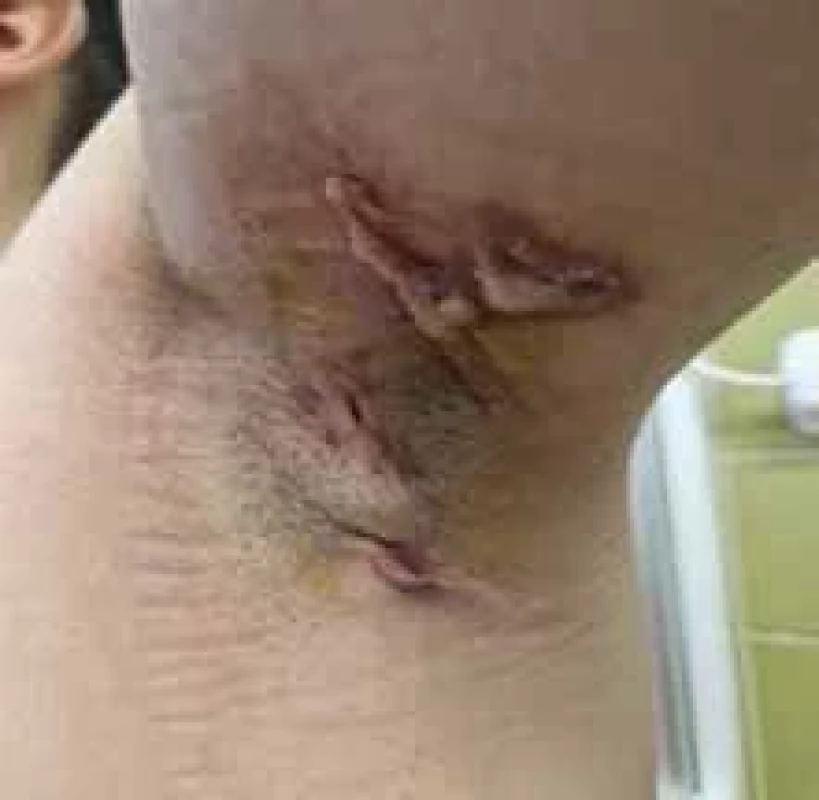
Zdroj: Archív Kliniky dermatovenerológie UN L. Pasteura, Košice.
Source: Archives of the UN L. Pasteur Department of Dermatovenerology, Košice.Obr. 3. Typická distribúcia HS. // Typical HS distribution. 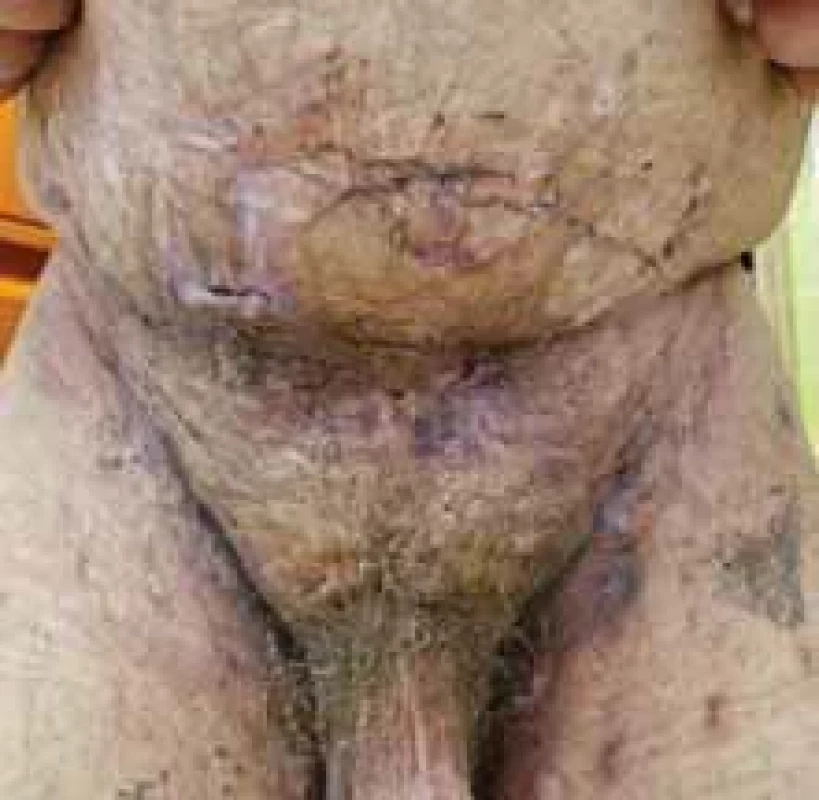
Zdroj: Archív Kliniky dermatovenerológie UN L. Pasteura, Košice.
Source: Archives of the UN L. Pasteur Department of Dermatovenerology, Košice.Obr. 4. Zápalové prejavy HS u pacientky – nodozity, drenujúce fi stuly, jazvy. // Infl ammatory manifestations of HS in the patient – nodositis, draining fi stulas, scars. 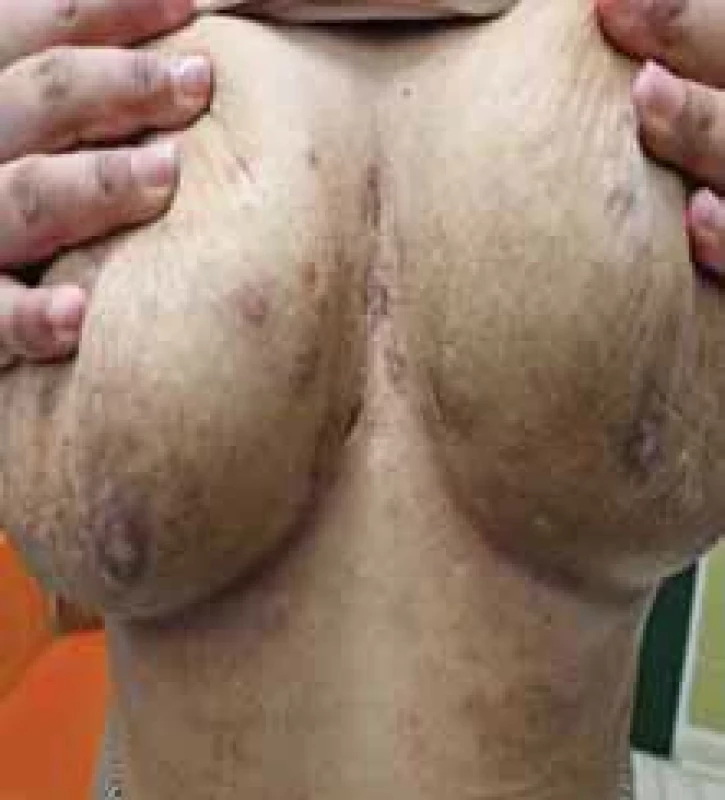
Zdroj: Archív Kliniky dermatovenerológie UN L. Pasteura, Košice.
Source: Archives of the UN L. Pasteur Department of Dermatovenerology, Košice.Tab. 1. Hurley klasifi kácia stupňa závažnosti HS [spracované podľa 5]. // Hurley classification of the degree of severity of HS [processed according to 5]. ![Hurley klasifi kácia stupňa závažnosti HS [spracované podľa 5]. // Hurley classification of the degree of severity of HS [processed according to 5].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/adea8aa4cb70ce0048a5b0efb855354b.png)
Tab. 2. Hodnotenie škály závažnosti HS-PGA [spracované podľa 5]. // HS-PGA Severity Scale Rating [adapted from 5]. ![Hodnotenie škály závažnosti HS-PGA [spracované podľa 5]. // HS-PGA Severity Scale Rating [adapted from 5].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/e58e07e2f926db29f692fa4bb71c78cf.png)
Črevný mikrobióm pri HS
Nedávno sa výrazne zvýšil záujem o mikrobióm kožných ochorení. Zvlášť zaujímavá je os črevo–mozog–koža, ktorú navrhli Stokes a Pillsbury v roku 1930, pričom sa predpokladá, že emocionálne stavy by mohli zmeniť črevný mikrobión, zvýšiť priepustnosť čriev a viesť k systémovému zápalu, a tým zhoršiť stav kože. Mikrobióm je predmetom záujmu aj v patogenéze HS [7].
Ľudský črevný mikrobióm je definovaný ako komplexný ekosystém pozostávajúci z baktérií, húb a vírusov, pričom všetky sa podieľajú na zdraví svojho hostiteľa [8]. Je známe, že sa podieľa na rôznych procesoch, vrátane trávenia, syntézy živín a stimulácie imunitného systému. Z prevažnej časti možno v ľudskom črevnom mikrobióme nájsť 6 kmeňov baktérií: Fusobacteria, Proteobacteria, Verrucomicrobia, Actinobacteria, Bacteroides a Firmicutes. Črevný mikrobióm môže ovplyvniť niekoľko faktorov, medzi ktoré patrí aj spôsob pôrodu a kàmenia novorodencov, strava dojčiat a dospelých, body mass index (BMI), pohlavie, užívanie antibiotík, proces starnutia a stres. U zdravých jedincov je zloženie stolice v priebehu času stabilné, je dôležité udržiavať črevnú eubiózu, nakoľko znížená mikrobiálna diverzita môže viesť k zvýšeniu zápalových parametrov, ako je C-reaktívny proteín, IL-6, IL-8 a TNFa [8,9].
Keďže dysbióza v črevnom mikrobióme bola spojená s viacerými patofyziologickými procesmi zahrňujúcimi imunitnú dysreguláciu, bola vyslovená hypotéza, že by mohla zohrať úlohu aj v patogenéze hidradenitis suppurativa. Podľa literárnych údajov črevná dysbióza podporuje produkciu prozápalových cytokínov, ako sú IL-6, IL-17 a TNFa črevným epitelom, po čom nasleduje zvýšenie cirkulujúcich cytokínov IFNg a TNFa. To následne vedie k zvýšenej hladine matrixových metaloproteináz (MMP-2, MMP-8 a MMP-9) a k tvorbe HS lézií [10].
V štúdii, ktorú prezentovali McCarthy et al., sa zistilo, že je rozdiel medzi črevným mikrobiómom jedincov s HS a zdravej kontroly. Do štúdie bolo zaradených 59 pacientov s HS, ktorí poskytli vzorky stolice, ako aj výtery z nosa a kože. Na celkovej DNA získanej zo vzoriek vykonali sekvenovanie amplikónov génu bakteriálnej 16S ribozomálnej RNA. Marker variácie mikrobiálnych druhov, označovaný aj ako a-diverzita, bol významne nižší u subjektov s HS. Preukázala sa aj zvýšená hladina Ruminococcus gnavus a Clostridium ramosum v porovnaní s mikrobiómami kontrolnej skupiny [11].
Zistilo sa, že u účastníkov štúdie s HS je nadmerne zastúpený Ruminococcus gnavus, ale aj u pacientov s Crohnovou chorobou a zároveň je spojený so spondyloartritídou a syndrómom dráždivého čreva. Jeho úloha pri Crohnovej chorobe bola podporená produkciou prozápalového polysacharidu, ktorý zvyšuje produkciu TNFa interakciou s toll-like receptorom 4 (TLR4) imunitných buniek, predovšetkým dendritických. Autori predpokladajú, že produkcia tohto polysacharidu môže prispieť k patogenéze HS [9,11].
V limitovanej vzorke sledovaných pacientov s HS, ktorú prezentovali Kam et al. sa uvádza, že toto ochorenie môže súvisieť so zníženou druhovou diverzitou črevnej mikroflóry, zvýšeným výskytom Bilophila a Holdemania a zníženým množstvom ochranných Lachnobactrium a Firmicutes [12].
SIBO – small intestinal bacterial overgrowth – znamená syndróm bakteriálneho prerastania čreva, teda poruchu nadmerného rastu baktérií v tenkom čreve. Je to klinický syndróm charakterizovaný zvýšeným počtom a/ alebo abnormálnym typom baktérií v tenkom čreve. Nadmerné nefyziologické osídlenie tenkého čreva baktériami môže spôsobovať poškodenie steny čreva a jeho funkcie. Najčastejšími klinickými prejavmi SIBO sú vodnatá hnačka, nadúvanie, bolesti brucha a distenzia. Môže sa prejaviť aj nedostatkom vitamínov a minerálov [13].
Bežne tenké črevo obsahuje koncentráciu baktérií nižšiu ako 103 jednotiek tvoriacich kolónie [colony forming unit] (CFU)/ ml a väčšina z nich sú grampozitívne organizmy. Hranica 105 CFU/ ml sa považuje za optimálny prah pre diagnostiku SIBO. V praxi sa využívajú vodíkové dychové testy, najmä laktulózový a glukózový dychový test. SIBO sa však nevyznačuje len kvantitatívnym posunom, ale aj kvalitatívnou zmenou. V skutočnosti sa pri SIBO často pozoruje prevaha gramnegatívnych a anaeróbnych druhov. Najvýraznejšie sa zdá prepojenie SIBO a syndrómu dráždivého čreva (IBS – irritable bowel syndrome), nakoľko frekvencia SIBO u jedincov s IBS sa pohybovala medzi 4 a 78 %, zatiaľ čo u zdravých asymptomatických jedincov u 1–40 %. Metaanalýza na túto tému založená na 25 štúdiách s 3 192 pacientmi s IBS a 3 320 kontrolami ukázala, že prevalencia SIBO u pacientov s IBS je o 3,7-krát vyššia, ako u kontrol [14].
Metaanalýza jedenástich štúdií ukázala riziko SIBO 9,51-krát vyššie u zápalových ochorení čriev (IBD), ako u kontrol [15].
Ekosystém ľudskej mikroflóry môže ovplyvniť kožnú fyziológiu a patológiu nepriamo, reguláciou imunitného systému a priamo prostredníctvom prenosu črevného mikrobiómu a ich metabolitov do kože. Po nedávnych štúdiách, ktoré analyzovali vzťah medzi SIBO a zápalovými kožnými ochoreniami, ako je rosacea a psoriáza, sa predpokladá možný patogénny mechanizmus. Weinstock et al. zaznamenali výrazné zlepšenie kožného nálezu u všetkých pacientov s rosaceou a SIBO po liečbe rifaximínom [16,17].
Eredikácia SIBO bola schopná zlepšiť kožné prejavy pri psoriáze v zmysle indexu závažnosti psoriázy a erytému. V tomto kontexte existuje hypotéza, že eredikácia SIBO môže mať priaznivý vplyv na závažnosť prejavov zápalových imunitne mediovaných kožných ochorení [18].
Prevalencia SIBO a jeho úloha pri HS nebola doteraz preskúmaná a je predmetom ďalšieho výskumu.
Obr. 5. Perifoliculitis capitis abscendens et sufoidens. 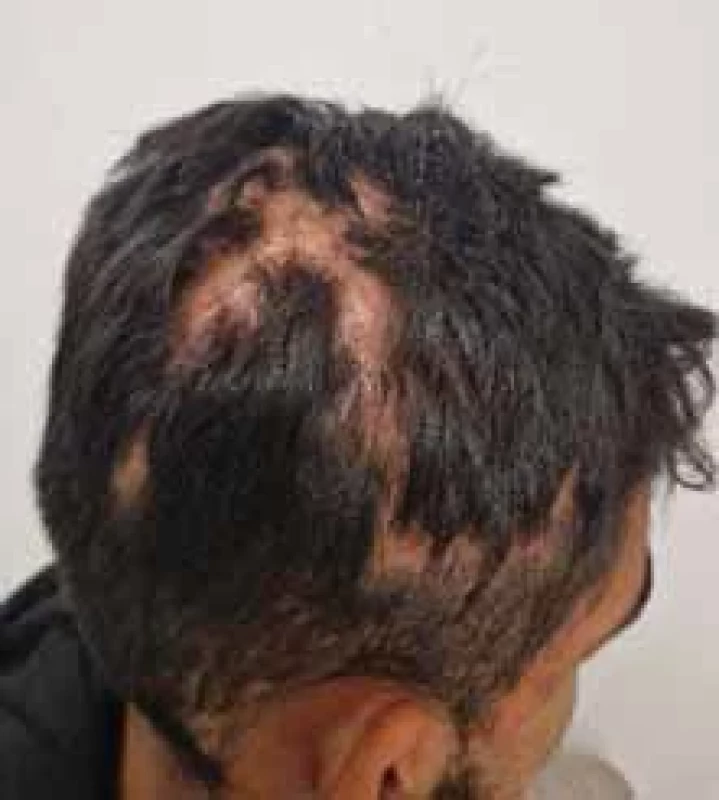
Zdroj: Archív Kliniky dermatovenerológie UN L. Pasteura, Košice.
Source: Archives of the UN L. Pasteur Department of Dermatovenerology, Košice.Obr. 6. Acne conglobata. 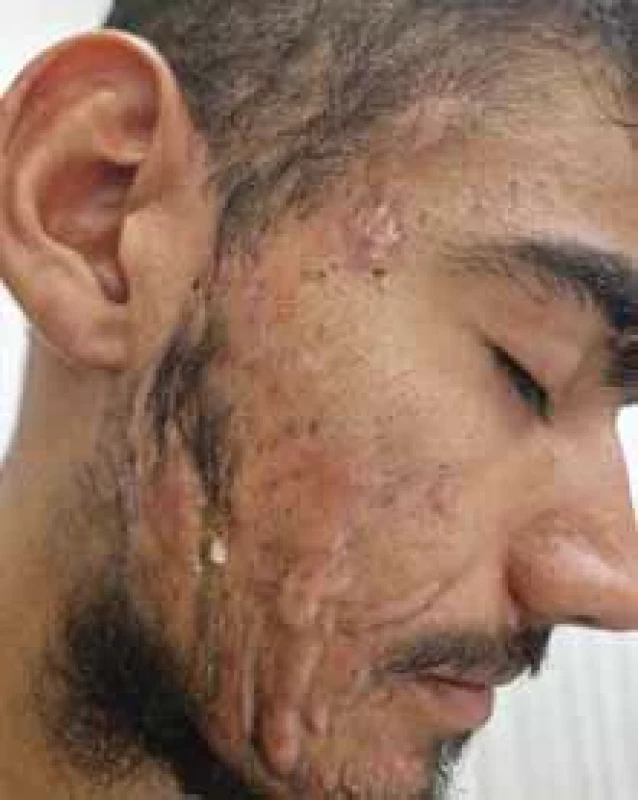
Zdroj: Archív Kliniky dermatovenerológie UN L. Pasteura, Košice.
Source: Archives of the UN L. Pasteur Department of Dermatovenerology, Košice.Obr. 7. Perianálne postihnutie pri HS. // Perianal involvement in HS. 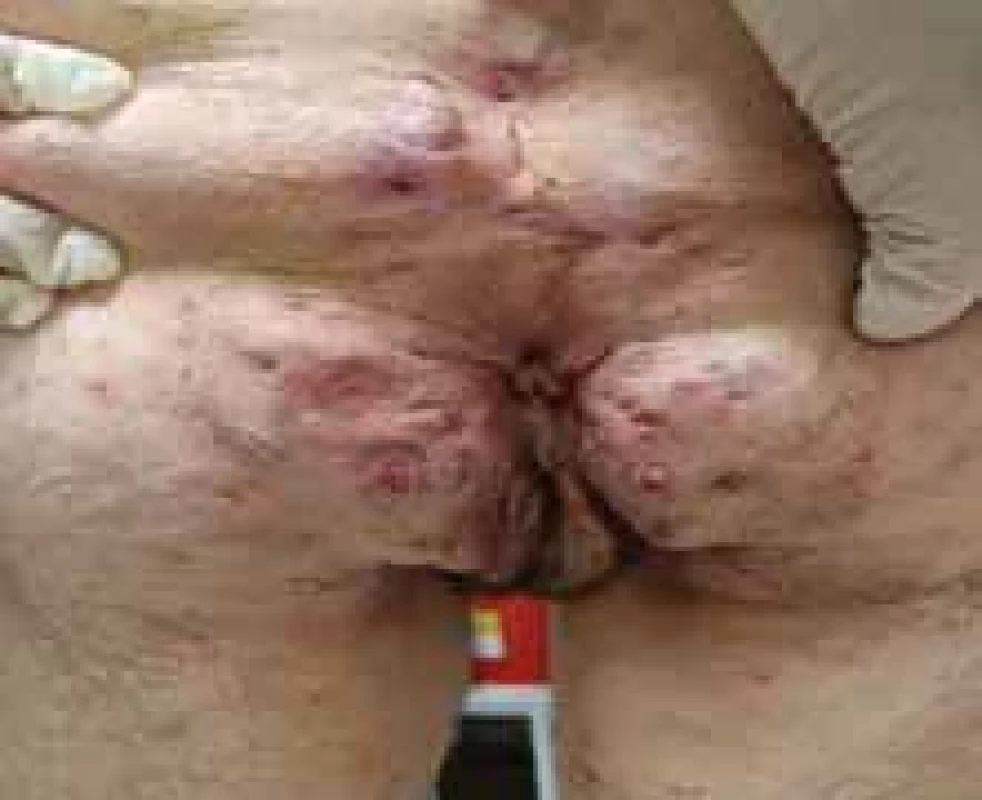
Zdroj: Archív Kliniky dermatovenerológie UN L. Pasteura, Košice.
Source: Archives of the UN L. Pasteur Department of Dermatovenerology, Košice.Obr. 8. SCC v teréne HS s postihnutím gluteálnej oblasti Hurley III. // SCC in the fi eld of HS with involvement of the gluteal region Hurley III. 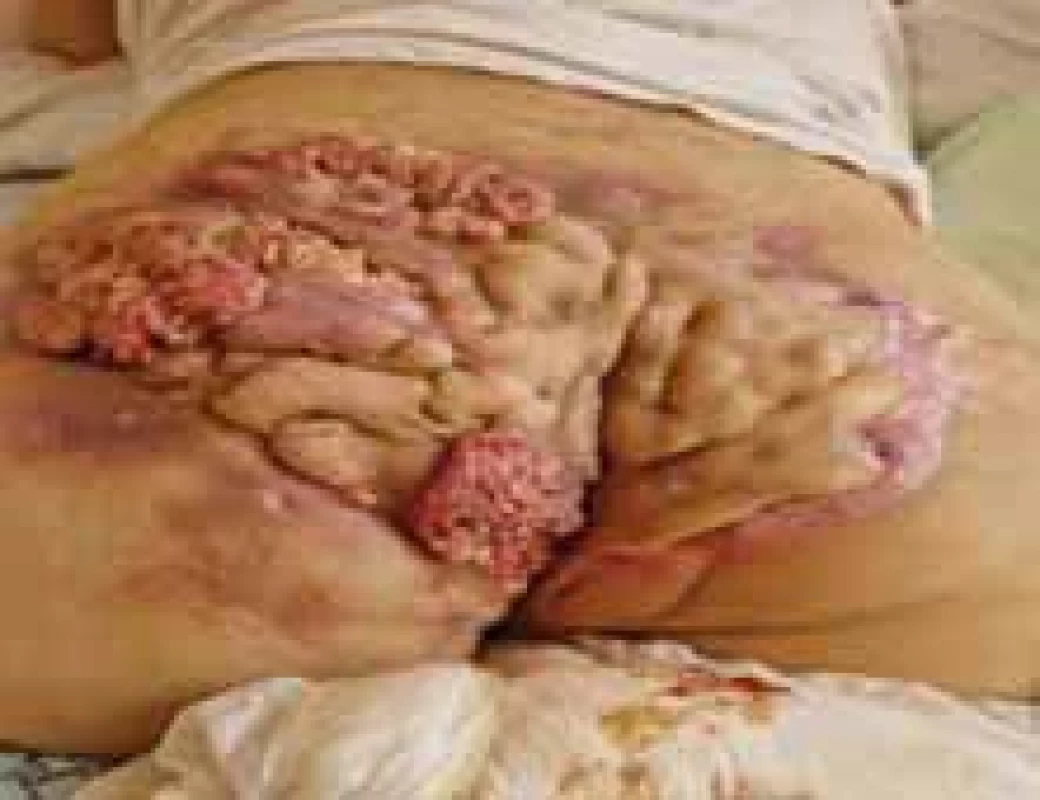
Zdroj: Archív Kliniky dermatovenerológie UN L. Pasteura, Košice.
Source: Archives of the UN L. Pasteur Department of Dermatovenerology, Košice.HS – asociované ochorenia a komorbidity v medziodborovej spolupráci
Pri ochorení HS je potrebné sa zamerať aj na sledovanie komorbidít, ktoré môžu byť asociované s ochorením a môžu ho ovplyvniť. S chronickým zápalom a HS je asociovaný metabolický syndróm, ktorý zahàňa diabetes mellitus, arteriálnu hypertenziu, dyslipidémiu a obezitu [19].
HS je aj súčasťou akné triády – HS, acne conglobata (obr. 5) a perifoliculitis capitis abscendens et sufoidens (obr. 6) a so sinus pinoidalis aj akné tetrády. HS môže byť asociovaná aj s autoinflamačnými nozologickými jednotkami a byť súčasťou syndrómov, ako PAPASH (pyoderma gangrenosum, akné, pyogénna artritída a HS) alebo PsAPASH (psoriatická artritída, pyoderma gangrenosum, akné, HS) [20].
Ukazuje sa, že existuje výrazná súvislosť medzi HS a Crohnovou chorobou (CD) na základe klinických a histologických podobností (vývoj sínusových trakov, granulomatózny zápal a jazvenie), priesečníkov v patogenéze (genetické lokusy, mechanizmy imunitnej disregulácie a zmeny mikrobiómu), ako aj zhody v liečbe (anti-TNF7a). Početné štúdie ukázali, že pacienti s CD majú výrazne 9-krát vyššie riziko HS ako bežná populácia [21].
Len málo štúdií sa zameralo na koreláciu medzi HS a CD na úrovni mikrobiómu a génu. Mikrobióm ovplyvňuje imunologickú a fyziologickú homeostázu kožného epitelu a črevnej sliznice aktiváciou Toll-like receptorov, aby rozpoznala patogény a opravila poškodenie. Rôzne enviromentálne faktory však môžu zmeniť mikrobiálnu rovnováhu, čo vedie k zníženiu mikrobiálnej diverzity. Takéto zmeny mikrobiómu môžu spôsobiť imunitnú dysreguláciu a náchylnosť na HS a zápalové ochorenia čreva (IBD) [22].
Niekedy je ťažké odlíšiť perianálne fistulujúce prejavy CD od HS iba klinickými znakmi a patologickými prejavmi (obr. 7). Približne 17–40 % pacientov s CD má aj perianálne postihnutie HS, kde sa symptómy často prekrývajú, preto je mimoriadne dôležité zobrazovacie vyšetrenie magnetickou rezonanciou (MR). Monnier et al. porovnávali charakteristické znaky MR panvy u 23 pacientov s HS a 46 pacientov s CD s anoperineálnym postihnutím. Výsledky ukázali, že medzi špecifické charakteristiky HS patrila najmä prevaha „abscencie znakov“ v perianálnej oblasti, abscencia zhrubnutia steny rekta a bilateralita znakov. Ďalšie ukazovatele zahàňali podkožný edém, menšie postihnutie análneho zvierača a sínusové trakty bez spojenia s anorektálnym kanálom [23].
U pacientov so simultánnym postihnutím CD a HS sa zvyčajne vyskytuje závažnejšie postihnutie CD hrubého čreva. Kamal et al. retrospektívne skúmali 15 pacientov s CD a HS. 47 % pacientov malo CD hrubého čreva, 53 % pacientov ileokolonické CD, neboli žiadne prípady izolovaného postihnutia ilea alebo CD hornej časti gastrointestinálneho traktu a 67 % pacientov bolo s perianálnymi léziami. Priemerný vek pacientov bol 34 rokov. Miesta lézií pri HS boli axilárne (53 %), inguinálne (47 %) a perianálne/ perineálne (73 %). Trinásť pacientov (93 %) malo štádium HS podľa Hurley klasifikácie II alebo III [22,24].
Pri HS je v teréne chronického zápalu v ložiskách zvýšené riziko rozvoja spinocelulárneho karcinómu (SCC) [25]. Bola hlásená aj zvýšená incidencia lymfómov, predovšetkým sa jedná o non-Hodgkinov lymfóm [26]. SCC transformácia pri HS je častejšia u mužov, hlavne perianálne, perineálne a v gluteálnej oblasti (obr. 8). V literatúre boli popísané aj prípady SCC vulvy. Tieto lokality sú viac exponované bakteriálnej, mykotickej alebo vírusovej expozícii, čo môže potencovať chronický zápal a rozvoj SCC. Infekcia ľudským papilomavírusom (HPV – human papillomavirus) býva významný kofaktor. V kontexte s HS je vhodná diskusia aj o HPV vakcinácii, nakoľko sa ukázal profitujúci profil pomeru benefit – riziko, ako prevencia rakoviny krčka maternice a anogenitálnej intraepiteliálnej neoplázie, ako aj invazívneho análneho karcinómu. Imunosupresívna terapia sa popri chronickej infekcii a fajčení ukazuje ako ďalší rizikový faktor neoplázie [27,28].
Terapia HS
Voľbu liečby ovplyvňuje stupeň závažnosti ochorenia a lokalizácia prejavov. Komplexným prehľadom, ako postupovať, sú európske S1 odporúčania pre liečbu HS (schéma 1). Vo všeobecnosti je liečba medikamentózna, adjuvantná a chirurgická. Liečba spočíva v dvoch základných cieľoch: liečba existujúcich lézií a zabránenie vzniku nových prejavov [29].
V literatúre máme údaje o použití aj iných biologických liekov (anakinra – inhibítor IL-1, golimumab – TNF-blokátor, guselkumab – inhibítor IL-23, ustekinumab – inhibítor IL-12/ 23, sekukinumab – inhibítor IL-17, brodalumab – inhibítor IL-17, bimekizumab – inhibítor IL-17A a IL-17F) [29,30].
Schéma 1. Modifikovaný algoritmus liečby HS [spracované podľa 29,30]. ![Schéma 1. Modifikovaný algoritmus liečby HS [spracované podľa 29,30].](https://pl-master.mdcdn.cz/media/image/0fe80417ea55084cbe9b4c61b0e41acd.png?version=1710240758)
Scheme 1. Modified HS treatment algorithm [edited according to 29,30]. Záver
Niektoré zdroje uvádzajú ako priemernú dobu od prvých príznakov HS po stanovenie správnej diagnózy u pacienta 7,5 roka. Práve včasná diagnostika a liečba v počiatočných prejavoch je kľúčová z hľadiska kontroly zápalovej aktivity ochorenia a ďalšej prognózy. Dôsledný monitoring komorbidít a komplikácií HS, ktoré vychádzajú zo samotného ochorenia a jeho liečby, je kľúčová pre kvalitu života pacienta s touto nepríjemnou diagnózou. Dostupné dáta naznačujú, že črevný mikrobióm zohráva významnú úlohu v rozvoji imunitných zápalových kožných ochorení, vrátane HS. Je predmetom ďalšieho výskumu a sledovania určiť prevalenciu bakteriálneho prerastania čreva u pacientov s HS a jeho možný dopad na závažnosť prejavov a asociované ochorenia. U všetkých pacientov s pokročilým ochorením je potrebný multidisciplinárny prístup.
Zdroje
1. Sabat R, Jemec GBE, Matusiak Ł et al. Hidradenitis suppurativa. Nat Rev Dis Primers 2020; 6(1): 18. doi: 10.1038/ s41572-020-0149-1.
2. Van der Zee HH, Riuter L, Broecke DG et al. Elevated levels of tumor necrosis factor alfa, interleukin 1 beta in hidradenitis suppurativa skin: a rationale for targeting TNF alfa and Il beta. Br J Dermatol 2011; 164(6): 1292–1298. doi: 10.1111/ j.1365-2133.2011.10254.x.
3. Prens E, Deckers I. Pathophysiology of hidradenitis suppurativa. J Am Acad Dermatol 2015; 73(5 suppl 1): S8–S11. doi: 10.1016/ j.jaad.2015.07.045.
4. Revuz JE, Canoui-Poitrine F, Wolkenstein P et al. Prevalence and factors associated with hidradenitis suppurativa: Results from two case-control studies. J Am Acad Dermatol 2008; 59(4): 596–601. doi: 10.1016/ j.jaad.2008.06.020.
5. Kimball AB, Jemec GB, Yang M et al. Assessing the validity, responsiveness and meaningfulness of the Hidradenitis suppurativa Clinical Response (HiSCR) as the clinical endpoint for hidradenitis suppurativa treatement. Br J Dermatol 2014; 171(6): 1434–1442. doi: 10.1111/ bjd.13270.
6. Kohorst J, Baum C, Otley C et al. Surgical management of Hidradenitis Suppurativa. Dermatol Surg 2016; 42(9): 1030–1040. doi: 10.1097/ DSS.0000000000000806.
7. Ursell LK, Metcalf JL, Partfrey lW et al. Defining the human microbiome. Nutr Rev 2012; 70(1): S38–S44. doi: 10.1111/ j.1753-4887.2012.00493.x.
8. Heintz-Buschart A, Wilmes P. Human Gut Microbiome: Function Matters. Trends Microbiol 2018; 26(7): 563–574. doi: 10.1016/ j.tim.2017.11.002.
9. Świerczewska Z, Lewandowski M, Surowiecka A et al. Microbiome in Hidradenitis Suppurativa – What We Know and Where We are Heading. Int J Mol Sci 2022; 23(19): 11280. doi: 10.3390/ ijms231911280.
10. Molnar J, Mallonee CJ, Stanisic D et al. Hidradenitis suppurativa and 1-CarbonMetabolism: Role of Gut Microbiome, matrix Metalloproteinases and Hyperhomocysteinemia. Front Immunol 2020; 11 : 1730. doi: 10.3389/ fimmu.2020.01730.
11. McCarthy S, Barret M, Kirthi S et al. Altered Skin and Gut Microbiome in Hidradenitis Suppurativa. J Invest Dermatol 2021; 142(2): 459–468. doi: 10.1016/ j.jid.2021.05.036.
12. Kam S, Collard M, Lam J et al. Gut Microbiome Pertubations in patients with Hidradenitis Suppurativa: A Case Series. J Invest Dermatol 2021; 141(1): 225–228. doi: 10.1016/ j.jid.2020.04.017.
13. Dukowicz AC, Lacy BE, Levine GM. Small intestinal bacterial overgrowth: a comprehensive review. Gastroenterol Hepatol (NY) 2007; 3(2): 112–122.
14. Losurdo G, Salvatore D‘Abramo F, Indellicati G et al. The Influence of Small Intestinal Bacterial Overgrowth in Digestive and Extra-Intestinal Disorders. Int J Mol Sci 2020; 21(10): 3531. doi: 10.3390/ ijms21103531.
15. Shah A, Morrison M, Burger D et al. Systematic Review with metaanalysis: The prevalence of small intestinal bacterial overgrowth in inflammatory bowel disease. Aliment Pharmacol Ther 2019; 49(6): 624–635. doi: 10.1111/ apt.15133.
16. Weinstock LB, Steinhoff M. Rosecea and small intestinal bacterial overgrowth: Prevalence and response to rifaximin. J Am Acad Dermatol 2013; 68(5): 875–876. doi: 10.1016/ j.jaad.2012.11.038.
17. Salem I, Ramser A, Isham N, Ghannoum MA. The Gut Microbiome as a Major Regulator of the Gut-Skin Axis. Front Microbiol 2018; 9 : 1459. doi: 10.3389/ fmicb.2018.01459.
18. Drago F, Ciccarese G, Indemini E et al. Psoriasis and small intestine bacterial overgrowth. Int J Dermatol 2018; 57(1): 112–113. doi: 10.1111/ ijd.13797.
19. Miller IM, Ellervik C, Vinding GR et al. Associoation of metabolic syndrome and hidradenitis suppurativa. AMA Dermatol 2014; 150(12): 1273–1280. doi: 10.1001/ jamadermatol.2014.1165.
20. Vorčáková K, Péčová K, Madleňák M et al. Hidradenitis suppurativa – terapeutická výzva pre dermatológa. Dermatol Prax 2021; 15(2): 62–67.
21. Zhang M, Chen QD, Xu HX et al. Association of hidradenitis suppurativa with Crohn’s disease. World J Clin Cases 2021; 9(15): 3506–3516. doi: 10.12998/ wjcc.v9.i15.3506.
22. Chen WT, Chi CC. Association of Hidradenitis suppurativa With Inflamatory Bowel Disease: A systemic Review and meta-analysis. JAMA Dermatol 2019; 155(9): 1022–1027. doi: 10.1001/ jamadermatol.2019.0891.
23. Monnier L, Dohan A, Amara N et al. Anoperineal disease in Hidradenitis suppurativa: MR imaging distinction from perianal Crohn’s disease. Eur Radiol. 2017; 27(10): 4100–4109. doi: 10.1007/ s00330-017-4776-1.
24. Kamal N, Cohen BL, Buche S et al. Features of Patients With Crohn’s Disease and Hidradenitis Suppurativa. Clin Gastroenterol Hepatol 2016; 14(1): 71–79. doi: 10.1016/ j.cgh.2015.04.180.
25. Manolitas T, Biankin S, Jaworski R et al. Vulval squamouscell carcinoma arising in chronic hidradenitis suppurativa a case report and rewiev of the literature. Int Wound J 2017; 14(2): 435–438. doi: 10.1111/ iwj.12671.
26. Tannebaum R, Strunk A, Garg A. Association between hidradenitis suppurativa and lymphoma. JAMA Dermatol 2019; 155(5): 624–625. doi: 10.1001/ jamadermatol.2018.5230.
27. Racanelli E, Jfri A, Gefri A et al. Cutaneous Squamous Cell Carcinoma in Patients with Hidradenitis Suppurativa. Cancers (Basel) 2021; 13(5): 1153. doi: 10.3390/ cancers13051153.
28. Gierek M, Niemiec P, Szyluk K et al. Hidradenitis supurrativa and squamous cell carcinoma: a systemic review of the literature. Postepy Dermatol Alegol 2023; 40(3): 350–354. doi: 10.5114/ ada.2023.126563.
29. Zouboulis CC, Desai N, Emtestam L et al. European S1 guideline for the treatment of hidradenitis suppurativa/ acne inversa. J Eur Acad Dermatol Venereol 2015; 29(4): 619–644. doi: 10.1111/ jdv.12966.
30. Urbanček S, Vorčáková K. Aktuálna farmakoterapia Hidradenitis suppurativa. Dermatol Prax 2022; 16(1): 14–16.
ORCID autorov
B. Ivanková 0009-0005-6036-9357,
J. Baloghová 0000-0003-4470-5777.
Doručené/ Submitted: 8. 11. 2023
Prijaté/ Accepted: 6. 1. 2024MU Dr. Barbara Ivanková, MBA
Klinika dermatovenerológie
UPJŠ LF a UN LP Košice
Trieda SNP 1
040 01 Košice
barbara.ivankova@unlp.skŠtítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2024 Číslo 1- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Jaké bude vaše doporučení pro terapii těžké ulcerózní kolitidy?
- Doporučení Pracovní skupiny pro idiopatické střevní záněty pro diagnostiku Crohnovy choroby
- Snížená hladina magnezia v moči po ileokolické resekci u pacientů s Crohnovou chorobou
- Mirikizumab – první protilátka anti-IL12 p19 v terapii ulcerózní kolitidy
- Editorial
- Účinnosť a bezpečnosť prechodu z intravenózneho na subkutánnu liečbu CTP-13 u pacientov s IBD – ročná retrospektívna štúdia z veľkého slovenského IBD centra
- Metotrexát – znovuobjevený lék u Crohnovy nemoci
- Hidradenitis suppurativa, črevný mikrobióm a SIBO – komplexný prehľad problematiky
- Idiopatický hypereozinofilní syndrom s postižením zažívacího traktu
- Heuréka!
- Simultánní robotická resekce kolorektálního karcinomu a jaterní metastázy – naše první zkušenosti
- Výběry z mezinárodních časopisů
- Hoffmanová I. Abdominální sonografie žlučníku a žlučových cest
- Kreditovaný autodidaktický test: IBD
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Metotrexát – znovuobjevený lék u Crohnovy nemoci
- Idiopatický hypereozinofilní syndrom s postižením zažívacího traktu
- Mirikizumab – první protilátka anti-IL12 p19 v terapii ulcerózní kolitidy
- Doporučení Pracovní skupiny pro idiopatické střevní záněty pro diagnostiku Crohnovy choroby
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



