-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaKapilárna zónová elektroforéza v spojení s UV detekciou pre simultánne stanovenie tramadolu a paracetamolu vo vzorkách farmaceutického a biologického charakteru
Capillary zone electrophoresis in combination with UV detection for simultaneous determination of tramadol and paracetamol in pharmaceutical and biological samples
The aim of the present study is the development and validation of a simple method based on capillary zone electrophoresis coupled with UV detection for simultaneous determination of tramadol and paracetamol in pharmaceutical and biological samples. The background electrolyte was composed of 50 mM ammonium carbonate, which is a type of a non-conventional electrolyte system. The developed method was characterized by suitable validation parameters, such as linearity (coefficient of determination r2 ≥ 0,995), selectivity or the limit of detection at the level of 0.25 – 0.5 μg/ml. Acceptable values of accuracy and precision were obtained, which were in good agreement with the recommended validation guidelines for analysis of pharmaceutical and biological samples. Detection was performed at a wavelength of 200 nm. The developed method was successfully applied to determine tramadol and paracetamol in various dosage forms and in urine biological samples. Achieved results indicate a potential of the method to be integrated in the common quality control processes of drugs and/or in bioanalysis.
Keywords:
quality control – capillary zone electrophoresis – UV detection – tramadol – paracetamol – bioanalysis
Autoři: Andrea Horniaková; Ondrej Štefánik; Ivana Čižmárová; Michaela Matušková; Peter Mikuš; Juraj Piešťanský
Vyšlo v časopise: Čes. slov. Farm., 2022; 71, 67-77
Kategorie: Původní práce
doi: https://doi.org/https://doi.org/10.5817/CSF2022-2-65Souhrn
Prezentovaná práca sa zameriava na vývoj a validáciu analytickej metódy na báze kapilárnej zónovej elektroforézy v spojení s UV detekciou pre simultánne stanovenie tramadolu a paracetamolu vo farmaceutických a biologických vzorkách. Základný elektrolyt bol tvorený 50 mM uhličitanom amónnym, ktorý predstavuje pomerne atypický elektrolytový systém. Vyvinutá metóda disponuje vhodnými validačnými parametrami ako linearita (koeficient determinácie r2 ≥ 0,995), selektivita alebo medza dôkazu na úrovni 0,25 – 0,5 μg/ml. Metóda bola charakterizovaná adekvátnymi hodnotami presnosti a správnosti, ktoré boli v súlade s kritériami validačných smerníc, či už pre matrice farmaceutického alebo biologického charakteru. Detekcia bola uskutočnená pri vlnovej dĺžke 200 nm. Daná metóda bola úspešne použitá pre potreby stanovenia tramadolu a paracetamolu v rozličných liekových formách a v biologickej matrici moču. Dosiahnuté výsledky indikujú potenciál začlenenia metódy do procesov kontroly kvality liečiv a/alebo bioanalýzy.
Klíčová slova:
kontrola kvality – kapilárna zónová elektroforéza – UV detekcia – tramadol – paracetamol – bioanalýza
Úvod
Bolesť predstavuje subjektívny nepríjemný pocit v dôsledku skutočného alebo možného poškodenia tkaniva a patrí medzi najčastejší sprievodný jav širokého spektra akútnych či chronických ochorení1). Z tohto dôvodu je tlmenie bolesti jednou z hlavných terapeutických priorít súčasnosti. Rozoznávame tri základné typy bolesti, a to bolesť nociceptívnu (poškodenie najmä muskuloskeletálne), neuropatickú (poškodenie nervov) a psychickú2). Hlavnými skupinami liečiv uplatňovanými v terapii bolesti sú analgetiká, nesteroidné antiflogistiká, opioidy a v špeciálnych prípadoch, najmä pri tlmení neuropatickej bolesti, sa môžu použiť aj tricyklické antidepresíva alebo antiepileptiká1).
Tramadol, chemicky trans-(±)-2-(dimetylaminometyl)-1-(metoxyfenyl)cyklohexanol, patrí do skupiny syntetických opioidných analgetík. Tieto zlúčeniny pôsobia na centrálny nervový systém a spôsobujú supresiu vnímania bolesti. Tramadol je indikovaný na liečbu akútnej a chronickej bolesti miernej až stredne silnej intenzity. Pôsobí dvoma hlavnými mechanizmami účinku, a to plnou neselektívnou agonizáciou opioidných μ, δ a κ receptorov (vykazuje však vyššiu afinitu k μ-opioidným receptorom) a inhibíciou spätného vychytávania noradrenalínu a sérotonínu3).
Zo stereochemického hľadiska je tramadol chirálna molekula s dvoma chirálnymi centrami. Stereoizoméry sa mierne líšia aj mechanizmom pôsobenia, avšak prítomnosť oboch enantiomérov, čiže ich racemickej zmesi, je dôležitá pre zachovanie synergie terapeutického efektu. Aktívna zlúčenina tramadolu predstavuje zmes (+) (1R,2R)-tramadolu, ktorý prednostne inhibuje spätné vychytávanie sérotonínu a (–) (1S,2S)-tramadolu, ktorý aktivuje α-2 adrenergné receptory a tým znižuje spätné vychytávanie adrenalínu zo synaptickej štrbiny4).
Tramadol vykazuje desaťnásobne nižší analgetický účinok oproti morfínu, ale má bezpečnejší terapeutický profil a nižšie riziko vzniku závažných nežiadúcich účinkov. Je indikovaný hlavne pri bolestiach svalov, kĺbov, pooperačných rán, chronickej bolesti chrbta, dentálnej alebo neuropatickej bolesti. Kontraindikáciou je vek pod 16 rokov, tehotenstvo, laktácia, alebo deficiencia enzýmu CYP2D6 – zodpovedného za metabolizáciu tramadolu. Abúzus tramadolu vedie k závažným prejavom, ako sú výrazné zníženie srdcovej frekvencie alebo tlmenie centra dýchania v predĺženej mieche. Pri dlhodobom užívaní, ktoré si často manažment terapie chronickej bolesti vyžaduje, sa môže objaviť fyzická závislosť, tolerancia či abstinenčný syndróm po vynechaní. V praxi sa často môžeme stretnúť s fixnou kombináciou tramadolu s ďalším analgetikom, a to paracetamolom. Výhody danej fixnej kombinácie pramenia zo synergie účinku týchto dvoch liečiv. Podanie dvoch analgeticky pôsobiacich liečiv s rozdielnym mechanizmom účinku vyvolá rýchlejší nástup účinku a jeho dlhšie trvanie5).
Paracetamol (alebo acetaminofén), chemicky N-(4-hydroxyfenyl)acetamid, je jedným z najpoužívanejších voľnopredajných liečiv, určených na terapiu bolesti a pyrexie. Mechanizmus účinku nie je úplne objasnený ale predpokladá sa nekompetitívna reverzibilná inhibícia enzýmu cyklooxygenáza (COX) s vyššou selektivitou v mozgu, taktiež dochádza k znižovaniu tkanivových koncentrácií prostaglandínov a iných prozápalových mediátorov. Na rozdiel od nesteroidných antiflogistík (NSAID) sa ale nevyznačuje protizápalovým účinkom a nemá ani vplyv na zrážanlivosť krvi, lebo nepôsobí ako inhibítor syntézy tromboxánu. Výhodou však je, že vykazuje výrazne menšie riziko vzniku žalúdočného krvácania a vredov v porovnaní s NSAID1, 6). Jedným z metabolitov paracetamolu je N-arachidonylaminofenol (AM404), ktorý vykazuje analgetický účinok. Predpokladá sa viacero mechanizmov analgetického pôsobenia tohto metabolitu v organizme, ako napríklad blokáda neuronálneho vychytávania anandamidu či blokáda neuronálnych sodíkových kanálov1, 6).
Paracetamol je určený na terapiu miernej akútnej aj chronickej bolesti, v kombinácii s NSAID alebo opioidmi aj na liečbu stredne silnej bolesti. Štandardná jednorazová dávka u dospelých by mala byť od 500 mg do 1000 mg, pričom denná dávka by nemala prekročiť 3 – 4 g7). Pri dlhodobom užívaní vysokých dávok hrozí zvýšené riziko kardiovaskulárnych, gastrointestinálnych a renálnych nežiadúcich účinkov či akútne zlyhanie pečene6).
Metabolizmus paracetamolu je spriahnutý s enzýmom CYP2D6, pričom na základe rôznej expresie tohto enzýmu v organizme je možné jedincov rozdeliť na extenzívnych, ultrarýchlych a pomalých metabolizérov paracetamolu. Z toho vyplýva i variabilita tolerancie dávky alebo rôzna náchylnosť na prejavenie nežiadúcich účinkov6). Paracetamol nie je odporúčaný osobám s akútnou alebo chronickou hepatopatiou, pri abúze alkoholu či malnutrícii8).
Medzi najnebezpečnejšie nežiadúce účinky na úrovni gastrointestinálneho traktu (GIT) patrí jeho hepatotoxicita, ktorá je dôsledkom nadmerného hromadenia metabolitu N-acetyl-p-benzochinónimínu. Ten sa v prípade vyčerpania dostupného glutatiónu nevyhnutného k jeho inaktivácii viaže na mitochondriálne proteíny, kde dochádza k formovaniu cytotoxických aduktov, čo vedie k mitochondriálnej dysfunkcii a závažnej hepatocelulárnej nekróze. Ako primárne antidotum sa využíva N-acetylcysteín6, 9).
Tramadol spolu s paracetamolom patria medzi frekventovane predpisované liečivá a s tým sa spája aj potreba vývoja efektívnych analytických metód pre ich kvalitatívne aj kvantitatívne hodnotenie v biologických matriciach, akými sú predovšetkým krv a moč. Takéto metódy sú schopné prispieť k zefektívneniu samotnej liečby v dôsledku možnosti monitorovania compliance pacienta (zvýšenie terapeutického účinku) a eliminácie/minimalizácie nežiadúcich účinkov. Odhliadnuc od hodnotenia liečiv v biologických matriciach je nevyhnutné disponovať vhodnými analytickými metódami aj v procese zabezpečovania ich kontroly kvality. Medzi štandardné a rutinne aplikované analytické prístupy pre potreby identifikácie a kvantifikácie daných liečiv vo vzorkách farmaceutického aj biologického charakteru patria chromatografické techniky (kvapalinová a plynová chromatografia) v spojení s rôznymi typmi detekcie10–19). Je tomu tak z dôvodu ich kváziuniverzality, vysokej presnosti, správnosti, robustnosti, schopnosti analýzy širokého spektra zlúčenín a relatívnej jednoduchosti obsluhy20).
Avšak v súčasnosti sa začínajú čoraz častejšie v oblasti analýzy farmaceutických a klinických vzoriek presadzovať techniky kapilárnej elektroforézy (CE), ktoré v porovnaní so štandardnými chromatografickými prístupmi prinášajú značné výhody21, 22). Sú nimi napr. vysoká separačná účinnosť, relatívne krátky čas analýz, jednoduchosť prevedenia, spotreba minimálneho množstva vzorky a organických rozpúšťadiel a minimálna až absentujúca potreba rozsiahlej externej predúpravy vzorky22, 23).
Z hľadiska CE módov aplikovaných do prostredia analýzy tramadolu a/alebo paracetamolu vo vzorkách farmaceutického a/alebo biologického charakteru v doteraz publikovaných vedeckých prácach zaujíma dominantné postavenie kapilárna zónová elektroforéza (CZE). Tramadol bol vo vzorkách liekových foriem alebo modelových vodných vzorkách analyzovaný CZE v spojení s detekciou na báze DAD24, 25), laserom indukovanej fluorescencie (LIF)26), vodivostnej – C4D27) alebo elektrochemiluminiscenčnej detekcie28). Jedna z prác naviac popisuje využitie CE realizovanej v nevodnom prostredí25). Zmienenými prístupmi bolo možné dosiahnuť hodnoty medze dôkazu (LOD) na úrovni 0,008 – 2,05 μg/ml.
Rovnako v prípade analýzy paracetamolu vo vzorkách farmaceutického charakteru bola preferovaným separačným módom CZE29–36), použitá však bola i micelárna elektrokinetická chromatografia – MEKC37). CE v spojení s UV29–32), DAD33), MS34), C4D27, 35) alebo chemiluminiscenčnou36) detekciou poskytovala hodnoty LOD na úrovni 0,085 ng/ml až 5,0 μg/ml. Pri analýze paracetamolu vo farmaceutických vzorkách bola využitá aj metóda CZE s ampérometrickou detekciou v prevedení na mikročipe38). V prípade vzoriek farmaceutického charakteru je dôležité podotknúť, že žiadna z vyššie uvedených metód nevyžadovala extenzívnu predúpravu vzorky.
Z doteraz publikovaných štúdií zameraných na bioanalýzu tramadolu a paracetamolu vyplýva, že preferovanými matricami boli biologické vzorky moču8, 34, 36, 39–44), plazmy38) a krvného séra39, 45, 46). Testované však boli i vzorky slín47) alebo pečeňového a obličkového tkaniva48). Popísané boli CZE metódy s UV39–41, 45–49), MS8, 34, 39, 50), elektrochemiluminiscenčnou42, 43) alebo chemiluminiscenčnou36) detekciou. Pre biologickú matricu moču sa hodnoty LOD pohybovali na úrovni 0,004 – 0,1 μg/ml pre tramadol a na úrovni 0,085 ng/ml až 5,2 μg/ml pre paracetamol. Hodnoty LOD pre tramadol a paracetamol v krvnej plazme a sére boli 0,1 μg/ml (tramadol) a 0,3 – 5,2 μg/ml (paracetamol). Drvivá väčšina vyvinutých metód vyžadovala pomerne rozsiahlejšiu a viackrokovú predúpravu vzorky, ktorá zahŕňala napr. extrakciu na tuhej fáze – SPE41, 44), mikrodialýzu49), elektromembránovú extrakciu – EME40), mikroextrakciu na kvapalnej fáze – LPME44), extrakciu podporenú mikrovlnným žiarením – MAE50), precipitáciu proteínov a následnú centrifugáciu38, 45, 47).
Z doteraz publikovaných prác vyplýva, že na separáciu tramadolu a paracetamolu v CZE móde sú zvyčajne používané konvenčné základné elektrolyty (BGE) reprezentované prevažne fosfátovými28, 30–33, 37, 40, 42, 43) alebo borátovými24, 26, 29, 36, 39, 46, 48) tlmivými roztokmi. Výber BGE je však vo veľkej miere determinovaný použitou detekčnou technikou. Elektrolytové systémy vhodné pre CZE-UV sú častokrát nevhodné pre CZE-MS. Cieľom predkladanej práce bol preto vývoj relatívne rýchlej a jednoduchej CZE-UV metódy pre potreby simultánneho hodnotenia tramadolu a paracetamolu vo vzorkách farmaceutického a biologického charakteru, ktorá by súčasne poskytovala z hľadiska zloženia BGE vysokú mieru kompatibility s MS detekciou. Takéto prístupy k analýze liečiv v rozličných typoch matríc sú zaujímavé z hľadiska kontroly kvality liečiv a liekov, a súčasne i z hľadiska bioanalytických aplikácií.
Pokusná časť
Inštrumentácia
Elektroforetické experimenty boli prevedené s použitím systému Agilent 7100 CE vybaveného UV detektorom (Agilent Technologies, Santa Clara, California, USA). Separácia bola realizovaná v kremennej kapiláre s vnútorným priemerom 50 μm, vonkajším priemerom 300 μm, celkovou dĺžkou 70 cm a efektívnou dĺžkou kapiláry 62,5 cm. Pred prvým použitím bola kapilára premytá roztokom 1 M NaOH po dobu 30 minút, demineralizovanou vodou (10 minút) a nosným elektrolytom – BGE (10 minút). Každý deň pred začiatkom meraní bola kapilára preplachovaná 0,1 M NaOH 10 minút, demineralizovanou vodou 10 minút a BGE 10 minút. Na konci každého dňa sa kapilára prepláchla demineralizovanou vodou po dobu 10 minút. Vzorky boli injektované do kapiláry hydrodynamicky tlakom 50 mbar počas 10 sekúnd. Separácia bola prevedená v móde pozitívnej polarity aplikáciou napätia o hodnote +20 kV, ktoré sa zvyšovalo na začiatku separácie z 0 kV na +20 kV po dobu 20 sekúnd. Pred každým injektovaním vzorky bola kapilára prekondiciovaná aplikáciou negatívneho napätia –25 kV počas 15 sekúnd s následným premytím nosným elektrolytom 1 minútu, aby sa predišlo „carry-over“ efektu. Merania boli realizované pri teplote 20 °C a detekcia bola uskutočnená pri vlnovej dĺžke 200 nm.
Chemikálie a vzorky
Štandardy analytickej čistoty – hydrochlorid tramadolu a paracetamol – boli získané od spoločnosti Zentiva (Praha, Česká republika). Chemikálie použité na prípravu elektrolytových systémov uhličitan amónny ((NH4)2CO3) a hydrogenuhličitan amónny (NH4HCO3) disponovali LC-MS čistotou a boli zakúpené od spoločností Merck (Darmstadt, Nemecko) a Sigma Aldrich (Steinheim, Nemecko). Všetky roztoky štandardov liečiv aj roztoky elektrolytov boli pripravované s použitím demineralizovanej vody, ktorá bola získaná purifikačným systémom Millipore Simplicity 185 (UV) (Millipore, Molsheim, Francúzsko). Všetky zásobné roztoky štandardov a elektrolytov boli skladované pri teplote 2–8 °C.
Vzorky liekových foriem Doreta (tbl), Zaldiar (tbl) a Tramabene (gtt) boli získané z miestnej lekárne. Príslušné lieky boli po dobe expirácie a boli k dispozícii v našom laboratóriu.
Príprava roztokov štandardov
Zásobné roztoky štandardov dvojice liečiv tramadolu a pracetamolu boli pripravené rozpustením 10 mg štandardu tramadolu v 10 ml demineralizovanej vody a rozpustením 10 mg štandardu paracetamolu v zmesi 5 ml metanolu s 5 ml demineralizovanej vody. Kalibračné roztoky štandardov boli pripravené zriedením zásobných roztokov štandardov na požadované koncentračné úrovne 5, 10, 20, 50 a 100 μg/ml tramadolu a paracetamolu pridaním demineralizovanej vody. Vzorky boli premeriavané 3-krát.
Biologická vzorka moču, ktorá bola získaná od dvoch zdravých dobrovoľníkov, nebola nijakým spôsobom predupravovaná, iba zriedená 5-krát pridaním demineralizovanej vody. Do zriedeného moču sa pridali alikvótne množstvá štandardov tramadolu a paracetamolu tak, aby boli dosiahnuté požadované kalibračné koncentrácie na úrovni 5, 10, 20, 50 a 100 μg/ml. Vzorky boli premeriavané 3-krát.
Príprava farmaceutických vzoriek liekových foriem
Vzorky tabliet liekov Doreta a Zaldiar boli upravené nasledovným postupom pre oba lieky. Päť tabliet sa odvážilo, následne rozdrvilo v mažiari a navážila sa priemerná hodnota hmotnosti jednej tablety, ktorá sa rozpustila v 100 ml demineralizovanej vody. Takto pripravený roztok sa dal na 45 minút do ultrazvukového kúpeľa a následne bol prefiltrovaný použitím filtračného papiera Whatman s veľkosťou pórov 11 μm (Sigma Aldrich). Zásobné roztoky liekových foriem boli pred injektovaním do CE-UV zriedené na požadovanú koncentráciu použitím demineralizovanej vody.
Pri príprave vzoriek lieku Tramabene (gtt) bol 1 ml kvapiek doplnený na objem 10 ml použitím demineralizovanej vody. Takto pripravený roztok sa následne zriedil demineralizovanou vodou na požadovanú koncentráciu a bol injektovaný do CE-UV analyzátora. Vzorky všetkých liekových foriem boli premeriavané 3-krát.
Príprava vzoriek liekových foriem na hodnotenie výťažnosti
Pri hodnotení výťažnosti liekových foriem sa využila metóda štandardného prídavku. Do pripravených roztokov reálnych matríc liekových foriem sa pridali štandardy tramadolu a paracetamolu na troch koncentračných úrovniach, a to 5, 10 a 20 μg/ml. Pripravili sa aj individuálne vzorky liekových foriem bez prídavku, ktoré slúžili ako porovnávací štandard. Všetky vzorky sa premerali 3-krát.
Príprava QC vzoriek
QC vzorky boli pripravené na troch koncentračných úrovniach, a to 5 μg/ml (nízka), 15 μg/ml (stredná) a 70 μg/ml (vysoká) pridaním štandardov tramadolu a paracetamolu do moču 5-krát zriedeného demineralizovanou vodou. Vzorky boli zhomogenizované a injektované do CE analyzátora. Každá koncentračná úroveň bola premeraná 3-krát.
Výsledky a diskusia
Optimalizácia CZE-UV metódy
Medzi najdôležitejšie optimalizačné aspekty pri vývoji CE metód patrí výber vhodného zloženia BGE, voľba separačného napätia a vlnovej dĺžky, pri ktorej je analýza realizovaná. Nosný elektrolyt je esenciálne zvoliť tak, aby bola zabezpečená adekvátna separačná účinnosť a minimalizácia negatívnych disperzných javov. Testované boli dva typy elektrolytových systémov, a to (NH4)2CO3 a NH4HCO3, na troch koncentračných úrovniach (10, 20 a 50 mM). Dané testované systémy pritom predstavujú bežne odporúčané separačné prostredie kompatibilné s MS detekciou51), čo vytvára dobrý predpoklad pre budúce spojenie navrhovanej metódy s takýmto pokročilým typom detekcie. Jednotlivé výsledky z optimalizačného procesu výberu BGE názorne približuje obrázok 1.
Obr. 1. Elektroforeogramy získané z optimalizačného procesu separačného prostredia pre simultánnu analýzu tramadolu (TRA) a paracetamolu (PAR)
a – testovanie separačného elektrolytu tvoreného (NH4) 2CO3 o rozličných koncentráciách, b – testovanie separačného elektrolytu tvoreného NH4HCO3 o rozličných koncentráciách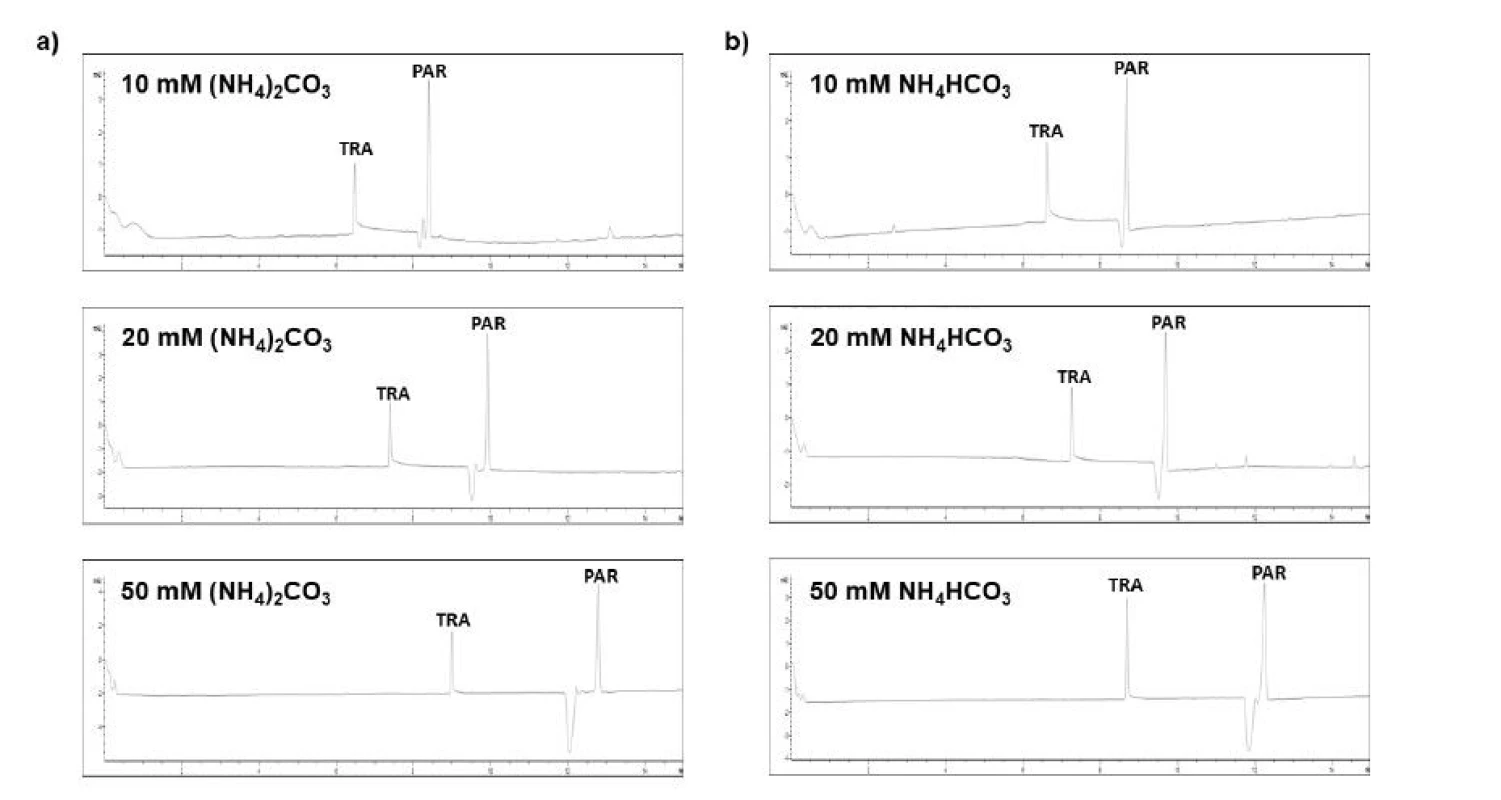
Z dvojice testovaných elektrolytov sa z hľadiska migračných časov, rozlíšenia, tvaru a intenzity píkov ako vhodnejší ukázal byť elektrolyt zložený z (NH4)2CO3. Optimalizačný proces preukázal, že zvyšovanie koncentrácie BGE viedlo k predlžovaniu migračných časov jednotlivých analytov. Na druhej strane sa však zvyšovalo rozlíšenie medzi jednotlivými analytmi, symetria píkov a separačná účinnosť. Vyššie koncentrácie BGE zároveň minimalizovali mieru chvostovania píkov analytov. Ako je možné vidieť na obrázku 1, paracetamol pri nižších koncentráciách BGE migroval veľmi blízko elektroosmotického toku, čo by v konečnom dôsledku spôsobovalo výrazné skreslenie a zvýšenú variabilitu výsledkov. V zmysle daných skutočností sa ako optimálny ukázal byť elektrolytový systém tvorený 50 mM (NH4)2CO3 (pH 9,23).
Detekcia pomocou UV bola optimalizovaná porovnaním analytických signálov tramadolu a paracetamolu pri vlnových dĺžkach 200, 210, 220, 254 a 272 nm. Ako vhodný kompromis pre simultánnu detekciu tramadolu a paracetamolu bola nakoniec zvolená vlnová dĺžka 200 nm.
Validácia
Vyvinutá CZE-UV metóda bola validovaná na základe odporúčaní dvojice smerníc – ICH Q2(R1)52) a US FDA53), a to v závislosti od typu analyzovaných vzoriek. Smernica ICH Q2(R1) bola využitá pri validácii metódy pre analýzu liekových foriem a FDA smernica bola využitá pri validácii metódy pre analýzu biologickej matrice moču. Medzi základné hodnotené parametre v procese validácie patrí linearita, medza dôkazu (LOD – limit of detection), dolná medza stanovenia (LLOQ – lower limit of quantification), presnosť, správnosť, selektivita alebo robustnosť metódy. Prehľad základných validačných a operačných parametrov CZE-UV metódy je prehľadne zosumarizovaný v tabuľke 1.
Tab. 1. Prehľad vybraných operačných a validačných parametrov navrhnutej CZE-UV metódy pre simultánne stanovenie tramadolu a paracetamolu 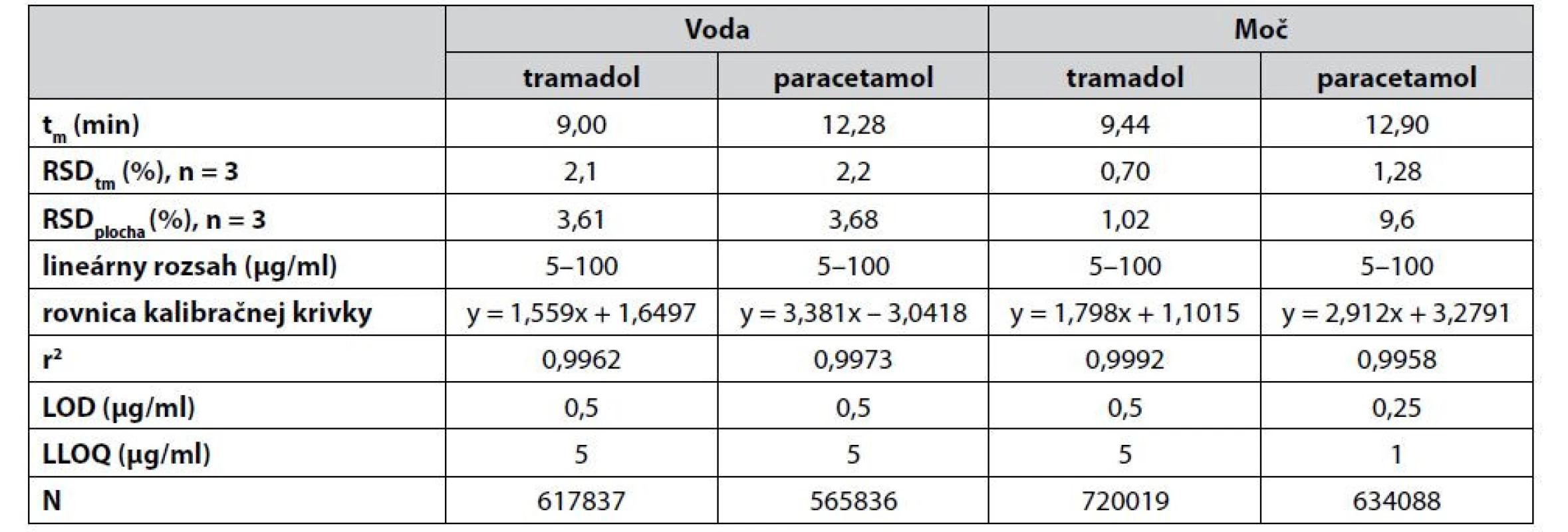
tm – migračný čas, N – separačná účinnosť (počítaná na základe vzťahu N = 5,545(tm/w1/2)2, kde w1/2 je šírka píku v polovici jeho výšky), RSDtm a RSDplocha (relatívne štandardné odchýlky) boli počítané zo vzoriek na koncentračnej úrovni zodpovedajúcej 5 μg/ml. Výsledky pre biologickú matricu moču sa vzťahujú na predupravenú (5-krát zriedenú) vzorku. Selektivita sa radí medzi dôležité validačné parametre a predstavuje schopnosť jednoznačne určiť sledovaný analyt aj v prítomnosti iných možných zložiek, ktoré sú súčasťou matrice. Ako dokumentuje obrázok 2, tak v priebehu analýz nedochádzalo k žiadnym interferenciám medzi migračnými časmi sledovaných analytov a ostatných zložiek matrice.
Obr. 2. Reprezentatívne elektroforeogramy získané z analýzy tramadolu a paracetamolu v reálnych vzorkách: a – farmaceutického charakteru (liek Doreta), b – biologickej matrice moču s prídavkom štandardu tramadolu (TRA) a paracetamolu (PAR) na koncentračnej úrovni 5 μg/ml 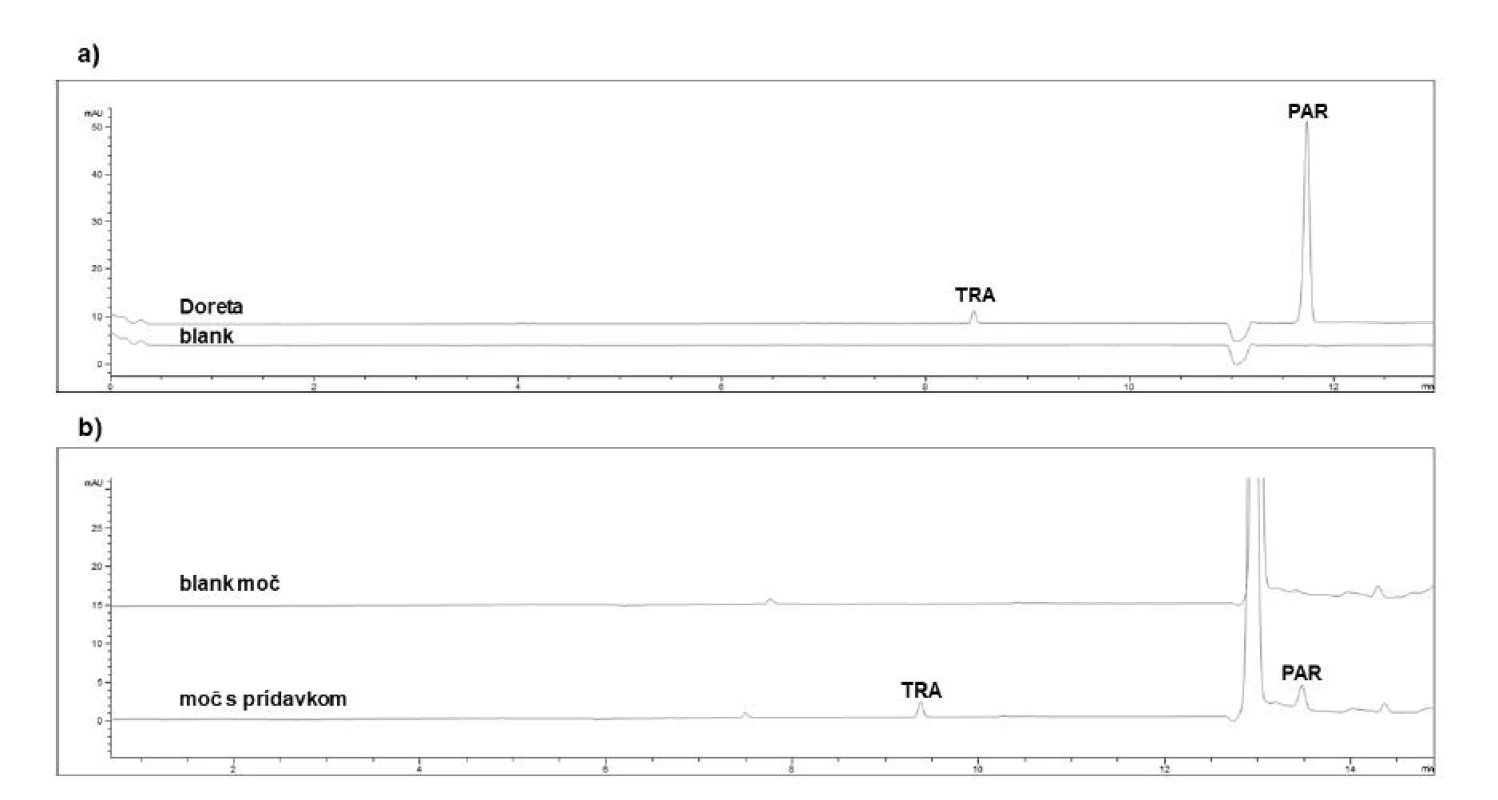
Linearita bola hodnotená na základe meraní zmesi štandardov tramadolu a paracetamolu na koncentračných hladinách 5, 10, 20, 50 a 100 μg/ml. Vyhotovením kalibračných kriviek, ktoré predstavujú závislosť plochy píku od koncentrácie štandardu, sme získali údaje o kalibračných rovniciach a hodnote koeficientu stanovenia (r2), ktorá bola vyššia než 0,995 pre oba analyty, čo potvrdilo akceptovateľnú mieru linearity danej metódy v testovanom rozsahu koncentrácií.
Hodnoty LOD a LLOQ boli predikované na úrovni 0,5 μg/ml a 5 μg/ml pre tramadol vo vodnej i biologickej matrici (5-krát zriedený moč), na úrovni 0,5 μg/ml a 5 μg/ml pre paracetamol vo vodnej matrici a na úrovni 0,25 μg/ml a 1 μg/ml pre paracetamol v matrici 5-krát zriedeného moču. Tieto hodnoty boli získané experimentálne premeriavaním štandardov analytov so znižujúcou sa koncentráciou v príslušných matriciach. Súčasne musela platiť podmienka ohľadne pomeru signálu a šumu (S/N), keď hodnota LOD zodpovedá 3xS/N a hodnota LLOQ zodpovedá 5xS/N. Získané hodnoty LOD a LLOQ boli naviac postačujúce pre potreby aplikácie vyvinutej metódy na analýzu farmaceutických vzoriek aj biologických vzoriek moču. Vyvinutá metóda navyše disponovala mimoriadne vysokou separačnou účinnosťou, keď počet teoretických priehradiek presahoval hodnotu 550 000.
Hodnotenie presnosti a správnosti metódy v prípade vzoriek farmaceutického charakteru bolo realizované na základe odporúčaní smernice ICH Q2(R1)52) analýzou piatich koncentračných hladín od 5 do 100 μg/ml pre tramadol aj paracetamol. Vnútrodňová presnosť bola vyhodnotená trojnásobným premeraním vzoriek v rámci jedného dňa a medzidňová presnosť bola vyhodnotená trojnásobným premeriavaním vzoriek po dobu 3 dní. Výsledky sú zosumarizované v tabuľke 2 a na základe získaných údajov môžeme povedať, že metóda je dostatočne presná, lebo hodnoty RSD (relatívnej štandardnej odchýlky) a RE (relatívnej chyby) neprekročili odchýlky ±15%, ktoré predpisuje i smernica FDA53).
Tab. 2. Hodnotenie presnosti a správnosti CZE-UV metódy pre potreby analýzy vzoriek farmaceutického charakteru 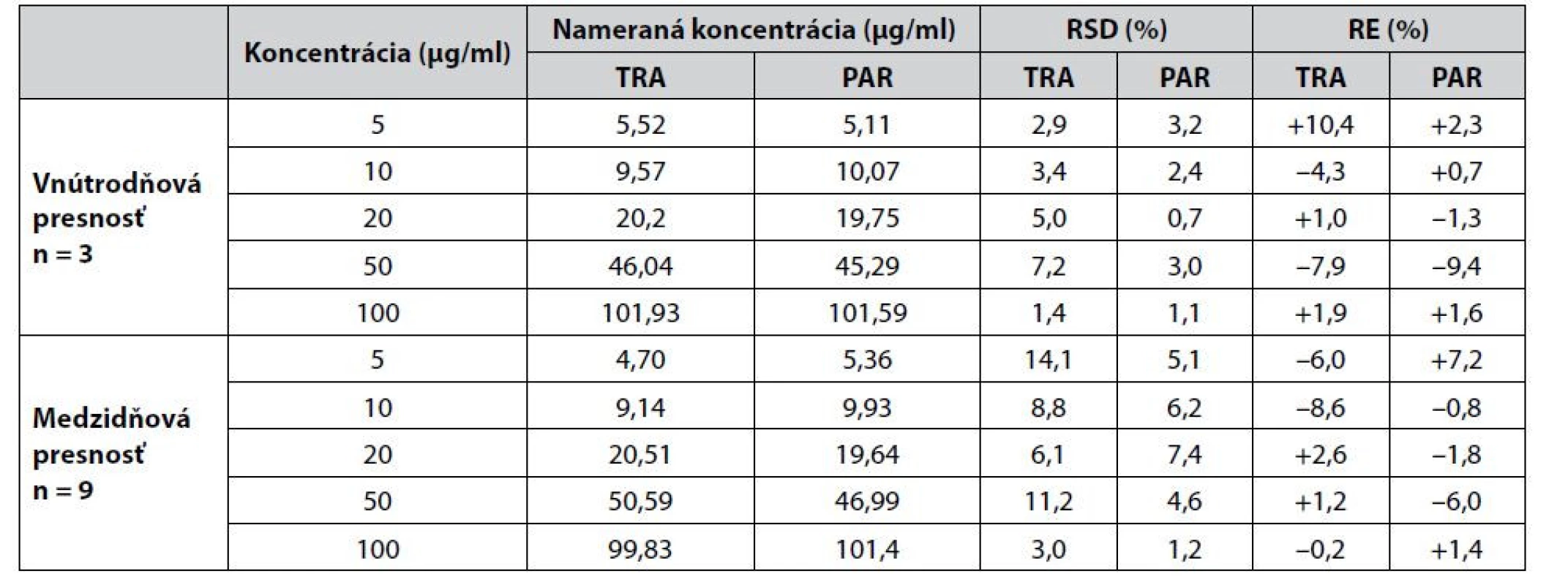
Výťažnosť metódy sa hodnotila metódou štandardných prídavkov štandardov tramadolu a paracetamolu k reálnym matriciam farmaceutických vzoriek. Prídavky boli na troch koncentračných úrovniach, a to 5, 10 a 20 μg/ml. Vzorky sa premerali trikrát a súčasne sa premerala aj vzorka bez prídavku, ktorá slúžila ako porovnávací štandard. Výťažnosť sa následne vypočítala vzťahom: výťažnosť(%) = 100 × [c(matrica+prídavok) – c(matrica)]/c(prídavok). Jednotlivé hodnoty výťažností pre tramadol a paracetamol sú uvedené v tabuľke 3.
Tab. 3. Hodnotenie výťažnosti CZE-UV metódy pre vzorky farmaceutického charakteru 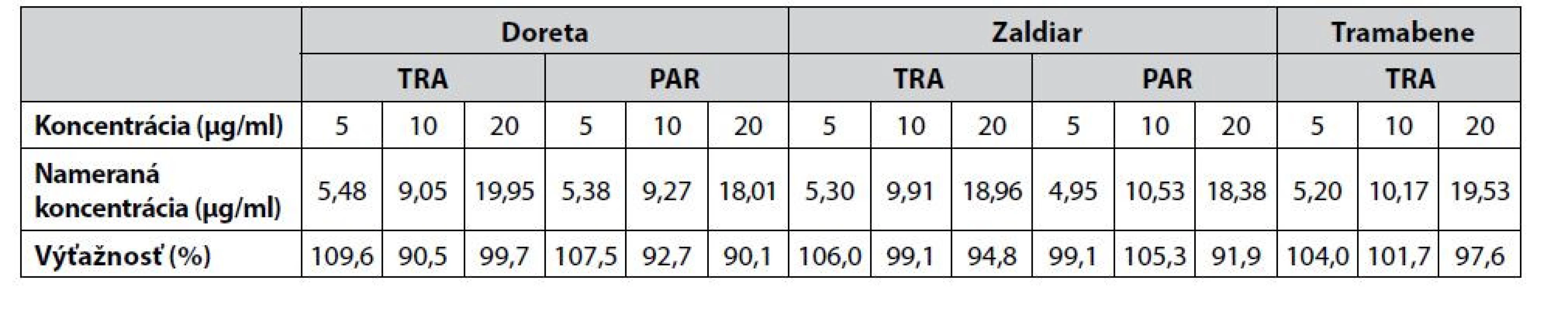
Podobná validačná schéma sa aplikovala aj na vzorky biologickej matrice 5-krát zriedeného moču, kde sa postupovalo na základe odporúčaní smernice FDA pre vývoj bioanalytických metód53). Bioanalytické metódy sa zvyčajne validujú použitím špecifických vzoriek kontroly kvality (QC – quality control) na troch koncentračných úrovniach – nízkej, strednej a vysokej. Príslušné koncentrácie QC vzoriek boli zvolené na základe odporúčaní smernice FDA, ktorá preferuje ich výber tak, aby spadali do definovaného rozsahu kalibračnej krivky. Príprava takýchto vzoriek, ktoré boli použité pre potreby validácie vyvinutej CZE-UV metódy, je detailne popísaná v časti Príprava QC vzoriek.
Presnosť a správnosť CZE-UV metódy (tab. 4) bola hodnotená na základe vnútrodňovej a medzidňovej presnosti s použitím QC vzoriek 5-krát zriedeného moču s prídavkom štandardov tramadolu a paracetamolu na troch koncentračných hladinách, a to 5 μg/ml (nízka QC), 15 μg/ml (stredná QC) a 70 μg/ml (vysoká QC). Vnútrodňová presnosť bola na úrovni 0,7 – 5,0 % pre tramadol a na úrovni 3,6 – 12,1 % pre paracetamol. Medzidňová presnosť sa pohybovala na úrovni 3,4 – 13,8 % pre tramadol a 4,0 – 13,9 % pre paracetamol. V oboch prípadoch dosiahnuté hodnoty nepresahovali smernicou stanovenú hodnotu ±15 %, resp. ±20 % v prípade QC vzoriek zodpovedajúcich koncentračnej úrovni LLOQ.
Tab. 4. Hodnotenie presnosti a správnosti CZE-UV metódy prostredníctvom QC vzoriek 5-krát zriedenej matrice moču 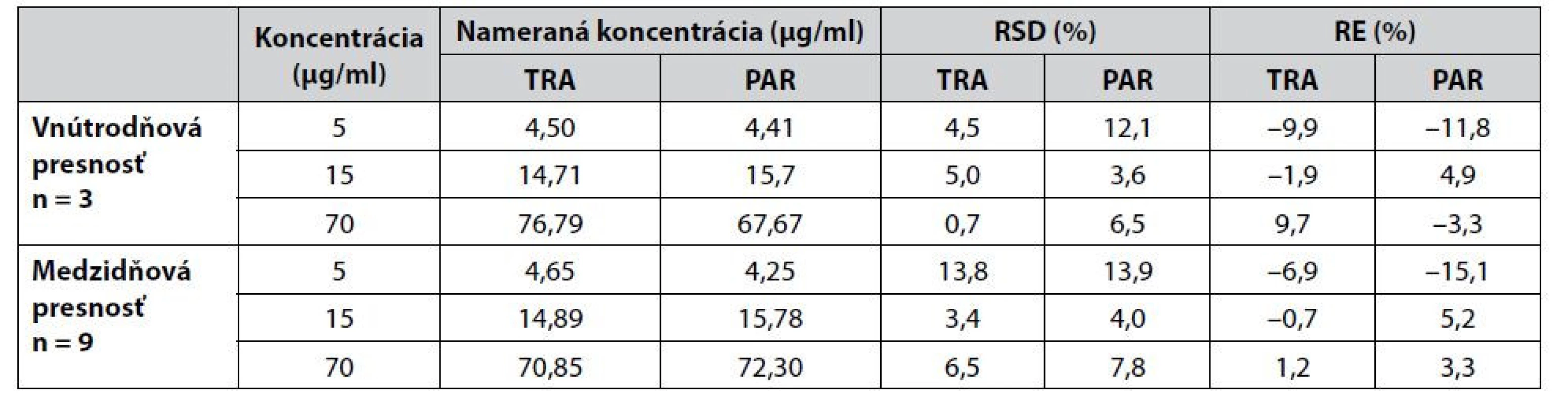
Výsledky zosumarizované v tabuľke 5 taktiež hovoria o akceptovateľnej miere správnosti vyvinutej metódy, keďže výťažnosť sa pohybovala na úrovni 99,4 – 101,5 % pre tramadol a 103,7 – 105,7 % pre paracetamol.
Tab. 5. Testovanie stability analytov a výťažnosti CZE-UV metódy 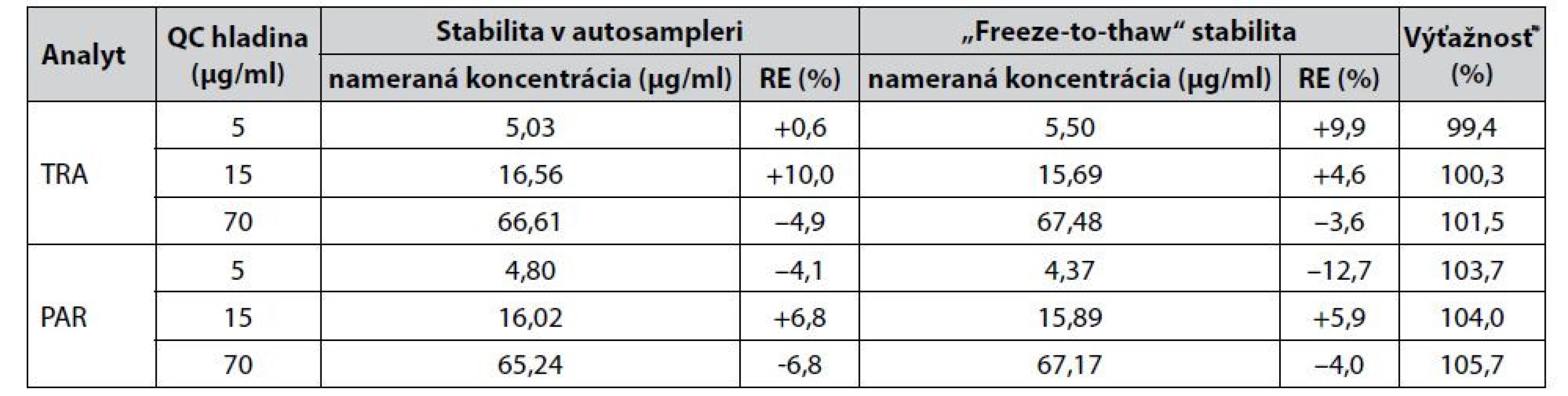
*Výsledky výťažnosti predstavujú hodnoty získané v rámci samostatných meraní. Nevzťahujú sa na proces testovania stability. Stabilita analytov bola testovaná na ich QC vzorkách krátkodobými stabilitnými štúdiami založenými na ponechaní vzoriek po dobu 24 h v autosampleri (stabilita v autosampleri) a opakovanom zmrazení a rozmrazení (tri cykly) testovaných vzoriek („freeze-to-thaw“ stabilita). Na základe dosiahnutých výsledkov, ktoré sú prehľadne zosumarizované v tabuľke 5, možno potvrdiť akceptovateľnú mieru stability v oboch prípadoch testovacích podmienok, keďže hodnoty RE (%) nepresiahli smernicou požadovaných ±15 %.
V poslednej fáze validačných štúdií sme sa zamerali na testovanie robustnosti vyvinutej CZE-UV metódy, ktoré zahŕňalo sledovanie vplyvu malých zmien separačných podmienok na analytický signál tramadolu a paracetamolu. Testovaným vplyvom bola zmena koncentrácie BGE o ±1 mM. Dosiahnuté výsledky potvrdili adekvátnu robustnosť, keďže odchýlky plôch sledovaných analytov v porovnaní s originálnymi podmienkami neprekročili hodnoty 1,9 % (paracetamol), resp. 3,8 % (tramadol).
Aplikácia
Po procese validácie bola CZE-UV metóda aplikovaná na stanovenie obsahu liečiv tramadol a paracetamol v liekoch Doreta, Zaldiar a Tramabene. Všetky analyzované lieky boli po exspirácii, čiže očakávaný obsah liečiv by mal byť nižší, než je deklarovaný obsah, keďže liečivá podliehajú časom prirodzenému rozkladu. Výsledky analýz (tab. 6) potvrdili správnosť nášho predpokladu, keďže v tabletových liekových formách bol obsah tramadolu nižší o 8,8 % (Doreta), resp. 9,9 % (Zaldiar) a paracetamolu nižší o 0,1 % (Zaldiar), resp. 5,9 % (Doreta) v porovnaní s deklarovaným obsahom. Najvýraznejší pokles v obsahu tramadolu bol identifikovaný v lieku Tramabene, a to až o 26,5 % v porovnaní s výrobcom deklarovaným obsahom. Z daných výsledkov možno usudzovať, že jednotlivé liečivá vykazujú vyššiu mieru stability v tuhých liekových formách (lieky Doreta, Zaldiar) v porovnaní s liekovými formami kvapalnými (liek Tramabene). Zároveň tramadol vykazoval nižšiu dlhodobú stabilitu než paracetamol. Bolo preukázané, že čas je výrazným faktorom ovplyvňujúcim stabilitu liečiv (čas, ktorý prešiel od dátumu exspirácie, bol najdlhší v prípade lieku Tramabene – 9 rokov). Ilustratívny záznam z analýzy tramadolu a paracetamolu v lieku Doreta je znázornený na obrázku 2a.
Tab. 6. Analýza tramadolu a paracetamolu v rozličných liekových formách a modelových vzorkách 5-krát zriedeného moču 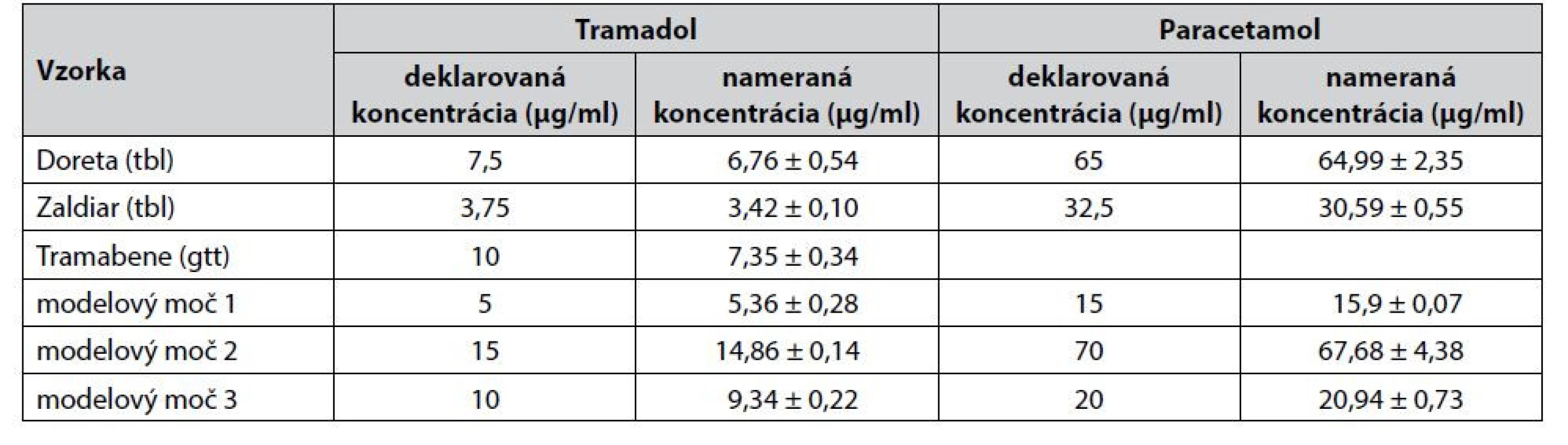
Bioanalytický aplikačný potenciál vyvinutej CZEUV metódy pre potreby stanovenia tramadolu a paracetamolu v biologickej matrici moču bol overený zaslepenou štúdiou. Pracovníci laboratória pripravili tri zaslepené vzorky pridaním štandardov tramadolu a paracetamolu do 5-krát zriedenej biologickej matrice moču na rôznych koncentračných úrovniach v rámci kalibračného rozsahu, pričom pracovníci realizujúci meranie nevedeli, aké koncentrácie daných liečiv boli pridané do matrice moču. Výsledky z daných experimentov sú predmetom tabuľky 6 a ilustratívny záznam získaný z merania takejto zaslepenej vzorky je znázornený na obrázku 2b. Dosiahnuté výsledky po porovnaní s odslepenými koncentračnými hladinami pridanými do biologickej matrice moču preukázali aplikovateľnosť vyvinutej CZE-UV metódy v oblasti bioanalýzy.
Záver
Hlavným zámerom práce bol vývoj a validácia metódy CZE v spojení s UV detekciou pre potreby simultánneho stanovenia tramadolu a paracetamolu vo vzorkách farmaceutického (liekové formy) a biologického (moč) charakteru. Takáto metóda bola charakterizovaná výraznými výhodami, ako je napr. vysoká miera selektivity, relatívne krátky čas analýzy (celkový čas analýzy bol 15 minút), nízka spotreba vzoriek, rozpúšťadiel a chemikálií, z čoho pramení aj nízke ekonomické zaťaženie analýz. Signifikantným benefitom je aj absencia potreby extenzívnej predúpravy vzoriek (predovšetkým biologických). Pridanou hodnotou práce je i to, že separačným prostredím bol elektrolytový systém odporúčaný predovšetkým pre prevedenie CE analýz s MS detekciou. Tento fakt umocňuje potenciál budúceho prenesenia metódy do prostredia CE-MS bez akýchkoľvek ťažkostí. Dosiahnuté validačné parametre a následné aplikačné príklady preukázali, že nami vyvinutá metóda disponuje možnosťou byť implementovaná do prostredia kontroly kvality liečiv a liekov, resp. klinických aplikácií.
Etická komisia
Štúdia realizovaná na biologických vzorkách bola schválená Etickou komisiou Farmaceutickej fakulty Univerzity Komenského (stanovisko 05/2021 vydané dňa 15. 12. 2021).
Poďakovanie
Práca vznikla s podporou grantov APVV-15-0585, VEGA 1/0463/18 a KEGA 027UK-4/2020.
Stret záujmov: žiadny.
Došlo 9. januára 2022 / Prijato 24. februára 2022
A. Horniaková • O. Štefánik • I. Čižmárová • M. Matušková
Katedra farmaceutickej analýzy a nukleárnej farmácie FaF UK
Bratislava, SR
P. Mikuš1,2, PharmDr. Juraj Piešťanský, PhD.1,2
1Katedra farmaceutickej analýzy a nukleárnej farmácie
Farmaceutická fakulta Univerzity Komenského
Odbojárov 10, 832 32 Bratislava, SR
e-mail: piestansky@fpharm.uniba.sk
2Toxikologické a antidopingové centrum FaF UK, Bratislava, SR
Zdroje
1. Ritter J. M., Flower R. J., Henderson G., Loke Y. K., MacEwan D., Rang H. P. Rang and Dale’s Pharmacology E-Book. Philadelphia, UNITED KINGDOM: Elsevier 2018.
2. Brook P., Pickering T., Connell J. Oxford Handbook of Pain Management. Oxford: Oxford University Press USA – OSO 2011.
3. Sarkany A., Hancu G., Drăguț C., Modroiu A., Barabás-Hajdu E. Capillary Electrophoresis Methods for the Determination of Tramadol: A Review. Pharm. Sci. 2019b; 25, 278–286.
4. Sarkany A., Hancu G., Cârje A., Drăguț C., Papp L. A. Chiral separation of tramadol enantiomers by capillary electrophoresis using cyclodextrins as chiral selectors and experimental design method optimization. Chem. Pap. 2019a; 73, 2363–2370.
5. Subedi M., Bajaj S., Kumar M. S., Yc M. An overview of tramadol and its usage in pain management and future perspective. Biomed. Pharmacother. 2019; 111, 443–451.
6. Freo U., Ruocco C., Valerio A., Scagnol I., Nisoli E. Paracetamol: A Review of Guideline Recommendations. J. Clin. Med. 2021; 10, 3420.
7. https://www.adc.sk/databazy/produkty/detail/paralen - 500-620569.html
8. Lecoeur M., Rabenirina G., Schifano N., Odou P., Ethgen S., Lebuffe G., et al. Determination of acetaminophen and its main metabolites in urine by capillary electrophoresis hyphenated to mass spectrometry. Talanta 2019; 205.
9. Montaseri H., Forbes P. B. C. Analytical techniques for the determination of acetaminophen: A review. TrAC – Trends Analyt. Chem. 2018; 108, 122–134.
10. Abdelshakour M. A., Abdel Salam R. A., Hadad G. M., Abo-ElMatty D. M., Abdel Hameed E. A. HPLC-UV and UPLC - MS/MS methods for the simultaneous analysis of sildenafil, vardenafil, and tadalafil and their counterfeits dapoxetine, paroxetine, citalopram, tramadol, and yohimbine in aphrodisiac products. RSC Adv. 2021; 11, 8055–8064.
11. Boogaerts T., Quireyns M., Covaci A., de Loof H., van Nuijs A. L. N. Analytical method for the simultaneous determination of a broad range of opioids in influent wastewater: Optimization, validation and applicability to monitor consumption patterns. Talanta 2021; 232.
12. Lee J., Park J., Go A., Moon H., Kim S., Jung S., Jeong W, Chung H. Urine Multi-drug Screening with GC-MS or LC-MS-MS Using SALLE-hybrid PPT/SPE. J. Anal. Toxicol. 2018; 42, 617–624.
13. Adlnasab L., Shahdousti P., Ahmar H. Layered double hydroxide intercalated with tyrosine for ultrasonic-assisted microextraction of tramadol and methadone from biological samples followed by GC/MS analysis. Microchim. Acta 2020; 187, 265.
14. Sefaty B., Masrournia M., Es’haghi Z., Bozorgmehr M. R. Determination of Tramadol and Fluoxetine in Biological and Water Samples by Magnetic Dispersive Solid-Phase Microextraction (MDSPME) with Gas Chromatography - Mass Spectrometry (GC-MS). Anal. Lett. 2021; 54, 884–902.
15. Naguib I. A., Ali N. A., Elroby F. A., El Ghobashy M. R., Abdallah F. F. US FDA-validated green GC-MS method for analysis of gabapentin, tramadol and/or amitriptyline mixtures in biological fluids. Bioanalysis 2020; 12, 1521–1533.
16. Salem Rizk M., Sultan M., Mohamed D., MoussaTony R. Simultaneous determination of dantrolene and paracetamol in human plasma by liquid chromatography tandem mass spectrometry. J. Chromatogr. B 2021; 1179, 122816.
17. Geib T., Lento C., Wilson D. J., Sleno L. Liquid Chromatography - Tandem Mass Spectrometry Analysis of Acetaminophen Covalent Binding to Glutathione S-Transferases. Front. Chem. 2019; 7, 558.
18. Mohamed D., Hegazy M. A., Elshahed M. S., Toubar S. S., Helmy M. I. Liquid chromatography-tandem MS/ MS method for simultaneous quantification of paracetamol, chlorzoxazone and aceclofenac in human plasma: An application to a clinical pharmacokinetic study. Biomed. Chromatogr. 2018; 32, e4232.
19. Salih M. E., Aqel A., Abdulkhair B. Y., Alothman Z. A., Abdulaziz M. A., Badjah-Hadj-Ahmed A. Y. Simultaneous Determination of Paracetamol and Chlorzoxazone in Their Combined Pharmaceutical Formulations by Reversed-phase Capillary Liquid Chromatography Using a Polymethacrylate Monolithic Column. J. Chromatogr. Sci. 2018; 56, 819–827.
20. Vitha M. F. Chromatography: Principles and Instrumentation. Hoboken: John Wiley & Sons 2017.
21. Hrušková H., Voráčová I., Řemínek R., Foret F. Current applications of capillary electrophoresis-mass spectrometry for the analysis of biologically important analytes in urine (2017 to mid-2021): A review. J. Sep. Sci. 2022; 45, 305–324.
22. Wätzig H., Günter S. Capillary Electrophoresis – A High Performance Analytical Separation Technique. Clin. Chem. Lab. Med. 2003; 41, 724–738.
23. Zhang C., Woolfork A. G., Suh K., Ovbude S., Bi C., Elzoeiry M., Hage D. S. Clinical and pharmaceutical applications of affinity ligands in capillary electrophoresis: A review. J. Pharm. Biomed. Anal. 2020; 177, 112882.
24. Ciurba A., Hancu G., Cojocea L.-M., Sipos E., Todoran N. Development of new formulation and its evaluation by capillary electrophoresis of tablets containing tramadol hydrochloride and paracetamol. Pharm. Dev. Technol. 2014; 19, 833–838.
25. Gourmel C., Grand-Guillaume Perrenoud A., Waller L., Reginato E., Verne J., Dulery B., Veuthey J.-L., Rudaz S., Schappler J., Guillarme D. Evaluation and comparison of various separation techniques for the analysis of closely-related compounds of pharmaceutical interest. J. Chromatogr. A 2013; 1282, 172–177.
26. Soetebeer U. B., Schierenberg M.-O., Möller J.-G., Schulz H., Grünefeld G., Andresen P., Blaschke G., Ahr G. Capillary electrophoresis with laser-induced fluorescence in clinical drug development – Routine application and future aspects. J. Chromatogr. A 2000; 895, 147–155.
27. Cunha R. R., Ribeiro M. M. A. C., Muñoz R. A. A, Richter E. M. Fast determination of codeine, orphenadrine, promethazine, scopolamine, tramadol, and paracetamol in pharmaceutical formulations by capillary electrophoresis. J. Sep. Sci. 2017; 40, 1815–1823.
28. Dong Y., Liu E. Simultaneous Determination of Tramadol and Diltiazem in Waterbodies by Capillary Electrophoresis with End-Column Electrochemiluminescence Detection. Asian J. Chem. 2016; 28, 1239–1243.
29. Azhagvuel S., Sekar R. Method development and validation for the simultaneous determination of cetirizine dihydrochloride, paracetamol, and phenylpropanolamine hydrochloride in tablets by capillary zone electrophoresis. J. Pharm. Biomed. 2007; 43, 873–878.
30. Capella-Peiró M.-E., Bose D., Rubert M. F., Esteve - Romero J. Optimization of a capillary zone electrophoresis method by using a central composite factorial design for the determination of codeine and paracetamol in pharmaceuticals. J. Chromatogr. B 2006; 839, 95–101.
31. Chi Z., Azhar I., Khan H., Yang L., Feng Y. Automatic Dissolution Testing with High-Temporal Resolution for Both Immediate-Release and Fixed-Combination Drug Tablets. Sci. Rep. 2019; 9, 17114.
32. Vijaya Bhaskar Reddy A., Yusop Z., Jaafar J., Jamil N. H., Majid Z. A., Aris A. B. Development and Validation of Capillary Electrophoresis Method for Simultaneous Determination of Six Pharmaceuticals in Different Food Samples Combining On-line and Off-line Sample Enrichment Techniques. Food Anal. Methods 2018; 11, 533–545.
33. Sultan M. A., Maher H. M., Alzoman N. Z., Alshehri M. M., Rizk M.S ., Elshahed M. S., Olah I. V. Capillary electrophoretic determination of antimigraine formulations containing caffeine, ergotamine, paracetamol and domperidone or metoclopramide. J. Chromatogr. Sci. 2013; 51, 502–510.
34. Maráková K., Piešťanský J., Veizerová L., Galba J., Dokupilová S., Havránek E., Mikuš P. Multidrug analysis of pharmaceutical and urine matrices by on-line coupled capillary electrophoresis and triple quadrupole mass spectrometry. J. Sep. Sci. 2013; 36, 1805–1816.
35. Cunha R. R., Chaves S. C., Ribeiro M. M. A. C., Torres L. M. F. C., Muñoz R. A. A, Santos W. T. P. D., Richter E. M. Simultaneous determination of caffeine, paracetamol, and ibuprofen in pharmaceutical formulations by high-performance liquid chromatography with UV detection and by capillary electrophoresis with conductivity detection: Liquid Chromatography. J. Sep. Sci. 2015; 38, 1657–1662.
36. Zhao S., Bai W., Yuan H., Xiao D. Detection of paracetamol by capillary electrophoresis with chemiluminescence detection. Anal. Chim. Acta 2006; 559, 195–199.
37. Németh T., Jankovics P., Németh-Palotás J., Kőszegi - Szalai H. Determination of paracetamol and its main impurity 4-aminophenol in analgesic preparations by micellar electrokinetic chromatography. J. Pharm. Biomed. Anal. 2008; 47, 746–749.
38. Abdollahi-Aghdam A., Majidi M. R., Veladi H., Omidi Y. SU8/glass microchip capillary electrophoresis integrated with Pt electrodes for separation and simultaneous detection of phenylephrine and acetaminophen. Bioimpacts 2021; 11, 263–269.
39. Heitmeier S., Blaschke G. Direct determination of paracetamol and its metabolites in urine and serum by capillary electrophoresis with ultraviolet and mass spectrometric detection. J. Chromatogr. B Biomed. Sci. Appl. 1999; 721, 93–108.
40. Aladaghlo Z., Fakhari A. R., Hasheminasab K. S. Carrier assisted electromembrane extraction based on nonionic lipophilic surfactants for the determination of basic drugs in urine samples. Anal. Methods 2017; 9, 5659–5667.
41. Lehtonen P., Siren H., Ojanperä I., Kostiainen R. Migration behaviour and separation of tramadol metabolites and diastereomeric separation of tramadol glucuronides by capillary electrophoresis. J. Chromatogr. A 2004; 1041, 227–234.
42. Ju H. Simultaneous determination of ethamsylate, tramadol and lidocaine in human urine by capillary electrophoresis with electrochemiluminescence detection. Electrophoresis 2006; 27, 3467–3474.
43. Cao W., Liu L., Qiu H., Yang X., Wang E. Simultaneous determination of tramadol and lidocaine in urine by end-column capillary electrophoresis with electrochemiluminescence detection. Electroanalysis 2002; 14, 1571–1576.
44. Nordman N., Sikanen T., Moilanen M.-E., Aura S., Kotiaho T., Franssila S., Kostiainen R. Rapid and sensitive drug metabolism studies by SU-8 microchip capillary electrophoresis-electrospray ionization mass spectrometry. J. Chromatogr. A 2011; 1218, 739–745.
45. Hložek T., Křížek T., Tůma P., Bursová M., Coufal P., Čabala R. Quantification of paracetamol and 5-oxoproline in serum by capillary electrophoresis: Implication for clinical toxicology. J. Pharm. Biomed. Anal. 2017; 145, 616–620.
46. Reed P. A., Cardoso R. M., Muñoz R. A. A., Garcia C. D. Pyrolyzed cotton balls for protein removal: Analysis of pharmaceuticals in serum by capillary electrophoresis. Anal. Chim. Acta 2020; 1110, 90–97.
47. Saar-Reismaa P., Brilla C.-A., Leiman K., Kaljurand M., Vaher M., Kulp M., Mazina-Šinkar J. Use of a newly - developed portable capillary electrophoresis analyser to detect drugs of abuse in oral fluid: A case study. Talanta 2020; 211, 120662.
48. Bohnenstengel F., Kroemer H. K., Sperker B. In vitro cleavage of paracetamol glucuronide by human liver and kidney β-glucuronidase: determination of paracetamol by capillary electrophoresis. J. Chromatogr. B Biomed. Sci. Appl. 1999; 721, 295–299.
49. Wang L. Microdialysis Coupled with Capillary Electrophoresis Method for Continuous Monitoring of Free Tramadol in Rabbit Blood. Asian J. Chem. 2014; 26, 967–970.
50. Świądro M., Stelmaszczyk P., Wietecha-Posłuszny R., Dudek D. Development of a new method for drug detection based on a combination of the dried blood spot method and capillary electrophoresis. J. Chromatogr. B 2020; 1157, 122339.
51. Pantůčková P., Gebauer P., Boček P., Křivánková L. Electrolyte systems for on-line CE–MS: Detection requirements and separation possibilities. Electrophoresis 2009; 30, 203–214.
52. ICH Harmonised Tripartite Guideline: Validation of Analytical Procedures Q2 (R1) Step 4 Version 2005.
53. U.S. Department of Health and Human Services Food and Drug Administration, Center for Drug Evaluation and Research (CDER) Center for Veterinary Medicine (CVM). Bioanalytical Method Validation Guidance for Industry; US FDA: Rockville, MD, USA, 2018.
Štítky
Farmacie Farmakologie
Článek vyšel v časopiseČeská a slovenská farmacie
Nejčtenější tento týden
2022 Číslo 2- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Verejní lekárnici a správna aplikácia inhalačných liekov
- Názory a znalosti týkající se doplňků stravy mezi studenty farmacie
- Kapilárna zónová elektroforéza v spojení s UV detekciou pre simultánne stanovenie tramadolu a paracetamolu vo vzorkách farmaceutického a biologického charakteru
- Digoxin v subkardiotonické dávce k modulaci antikonvulzivního potenciálu valproátu, levetiracetamu a topiramátu u experimentálních primárně generalizovaných záchvatů
- Česká a slovenská farmacie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Kapilárna zónová elektroforéza v spojení s UV detekciou pre simultánne stanovenie tramadolu a paracetamolu vo vzorkách farmaceutického a biologického charakteru
- Verejní lekárnici a správna aplikácia inhalačných liekov
- Digoxin v subkardiotonické dávce k modulaci antikonvulzivního potenciálu valproátu, levetiracetamu a topiramátu u experimentálních primárně generalizovaných záchvatů
- Názory a znalosti týkající se doplňků stravy mezi studenty farmacie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



