-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Filmy z kyseliny poly-γ-glutamové a poly-ε-lysinu jako potenciální prostředek pro terapii ran – formulace, příprava a hodnocení
Films from poly-γ-glutamic acid and poly-ε-lysine as the potential wound dressings – formulation, preparation and evaluation
Film wound dressings represent one of the options in wound therapy. Various polymers can be used for their production. Currently, research focuses on materials of natural origin, more friendly to the human body, which are in many cases able to participate actively in the wound healing process. These include polyamino acids of bacterial origin, substances that are biodegradable, non-toxic, and have a great potential for an application not only in the medical field. From the point of view of film wound dressing formulation, poly-γ-glutamic acid (PGA), as a film-forming agent, and poly-ε-lysine (PL), characterized by antimicrobial activity, are of interest from this group. Therefore, the aim of our experiment was to prepare films consisting of PGA or a combination of PGA and PL with the addition of different plasticizers. The films were prepared by solvent evaporation method and then evaluated for their organoleptic (appearance, colour, transparency, ease of handling), physicochemical (thickness, density, opacity, surface pH), and mechanical properties (tensile strength and tear resistance). As a result, films showing mutual compatibility between the two polymers were obtained, with satisfactory properties for wound application.
Keywords:
films – technology – wound therapy – poly-γ-glutamic acid – poly-ε-lysine
Autoři: Kamila Světlíková; Ruta Masteiková; Kateřina Tenorová; David Vetchý; Jurga Bernatoniene
Vyšlo v časopise: Čes. slov. Farm., 2021; 70, 186-195
Kategorie: Původní práce
doi: https://doi.org/https://doi.org/10.5817/CSF2021-5-186Souhrn
Filmy jako krycí prostředky představují jednu z možností v terapii ran. K jejich výrobě lze použít různé polymery. V současné době se výzkum zaměřuje na materiály přírodního původu, pro lidský organismus přívětivější, které jsou v řadě případů schopné zapojit se aktivně do procesu hojení rány. K takovým patří polyaminokyseliny bakteriálního původu, látky biodegradabilní, netoxické, skýtající velký potenciál pro uplatnění nejen ve zdravotnictví. Z hlediska formulace filmového krytí na rány jsou v této skupině zajímavé kyselina poly-γ-glutamová (PGA), jako látka filmotvorná, a poly-ε-lysin (PL) charakteristický antimikrobiálním účinkem. Proto cílem našeho experimentu bylo připravit filmy tvořené PGA nebo kombinací PGA a PL s přísadou různých změkčovadel. Filmy se připravovaly metodou odpaření rozpouštědla a následně se hodnotily jejich organoleptické (vzhled, barva, průhlednost, snadnost manipulace), fyzikálně-chemické (tloušťka, hustota, opacita, pH výluhu i povrchové pH) i mechanické vlastnosti (pevnost v tahu a odolnost proti protržení). Výsledkem byly filmy vykazující vzájemnou kompatibilitu obou polymerů s vyhovujícími vlastnostmi z hlediska aplikace na ránu.
Klíčová slova:
filmy – technologie – terapie ran – poly-γ-glutamová kyselina – poly-ε-lysin
Úvod
V současné době se v terapii ran používá celá řada prostředků, jejichž cílem je urychlit hojení, snížit výskyt komplikací a též redukovat finanční náklady vynaložené na léčbu1). Jelikož neexistuje ideální prostředek vhodný pro všechny indikace, probíhá neustálé hledání nových materiálů, popř. nových kombinací či aplikačních forem.
Jednu z možností v oblasti prostředků na ošetřování ran představují filmy, svojí podstatou mnohostranné přípravky s širokou škálou potenciálního uplatnění2). V současnosti slouží filmová krytí v klinické praxi převážně k ochraně rány proti mechanickému poškození a proti kontaminaci mikroorganismy nebo k fixaci primárních krytí či kanyl. Jsou vyrobeny ze syntetických materiálů (hlavně z polyuretanu), nejsou schopné vytvářet optimální mikroklima v ráně a prakticky neumožňují zabudování aktivních látek. Proto v této oblasti probíhá intenzivní výzkum zaměřený hlavně na oblast materiálů přírodního původu, příznivých pro lidský organismus a schopných zapojit se do procesu hojení rány. Zajímavou možnost z tohoto hlediska poskytují polyaminokyseliny (PAA) bakteriálního původu – polyamidy tvořené jedním typem aminokyseliny, čímž se liší od proteinů složených z různých aminokyselin. PAA se také odlišují jinou cestou biosyntézy v mikroorganismech3). Amidové vazby v proteinech se tvoří pouze mezi α-amino a α-karboxylovými skupinami, zatímco vazby v PAA jsou tvořeny též β - a γ-karboxylovými a ε-amino skupinami4). V přírodě se vyskytuje několik polyaminokyselin, zajímavé z hlediska terapie ran jsou např. poly-γ-glutamová kyselina (PGA) a poly-ε-lysin (PL)3).
PGA je přirozeně se vyskytující hydrofilní polymer tvořený jednotkami L - a D-glutamové kyseliny5, 6). Přítomnost volných karboxylových skupin uděluje této sloučenině aniontový charakter, který zajišťuje interakci s kationtovými polymery. Vysoká biologická rozložitelnost, poživatelnost, rozpustnost ve vodě, šetrnost k životnímu prostředí, absence imunogenicity a antigenicity z něj činí slibnou sloučeninu7, 8) nacházející možné uplatnění ve zdravotnictví, ve farmaceutickém, kosmetickém, potravinářském průmyslu a dalších oblastech8), např. jako zahušťovadlo, kryoprotektant, vodu absorbující hydrogel, absorbent těžkých kovů, materiál zajišťující prodloužené uvolňování nebo transport léčiva v organismu7) atd. Byly popsány i filmotvorné vlastnosti PGA9).
Zajímavou a žádoucí vlastností poly-ε-lysinu je antimikrobiální účinek. Tato polyaminokyselina, jejímž hlavním producentem je Streptomyces albulus, je tvořena 25 až 35 jednotkami L-lysinu vzájemně vázaných přes α-karboxylové a ε-aminoskupiny8). Antimikrobiální účinek PL je vysoce závislý na přítomnosti primárních aminoskupin s kladnými náboji, které interagují se záporně nabitým povrchem mikroorganismů10, 11). Tato interakce způsobuje narušení integrity buněčné membrány a následnou smrt mikroorganismů. Zjevný účinek má na grampozitivní i gramnegativní bakterie a také na kvasinky, houby, viry a další12). PL je jedlý, tepelně stabilní, netoxický, biodegradabilní a je rozpustný ve vodě, což jsou vlastnosti předurčující jeho vysokou využitelnost. Uplatnění nachází jak v potravinářském, tak i ve farmaceutickém průmyslu, například jako potravinový konzervant11, 13), obalový materiál, součást lékových transportních systémů14) nebo krytí k léčbě infikovaných ran15).
Pro získání požadovaných vlastností vyvíjených krytí na rány je často výhodné kombinovat různé materiály. Proto cílem tohoto experimentu bylo připravit a zhodnotit filmy tvořené PGA, která se následně kombinovala s PL za účelem vzniku krytí s potenciálním antibakteriálním účinkem.
Pokusná část
Materiál
Pro přípravu filmů byla použita sodná sůl poly-γ-glutamové kyseliny (NaPGA), kterou vyrobila a dodala firma Bloomage Freda Biopharm Co., Ltd., Čína, a poly-ε-lysin dodaný firmou Spec-Chem Industry Inc., Čína. Použitými změkčovadly pro přípravu filmů byl glycerol 85% (dodavatel Fagron a.s., Česká republika), makrogol 300 (dodavatel Fagron a.s., Česká republika), propylenglykol (dodavatel Fagron a.s., Česká republika), pentylenglykol (dodavatel Safic-Alcan, Česká republika) a Zemea ® propan-1,3-diol (dodavatel Biesterfeld Silcom s.r.o., Česká republika). Čištěná voda určená k přípravě i hodnocení filmů byla připravena pomocí přístroje Rodem 4.
Metodika
Příprava filmů
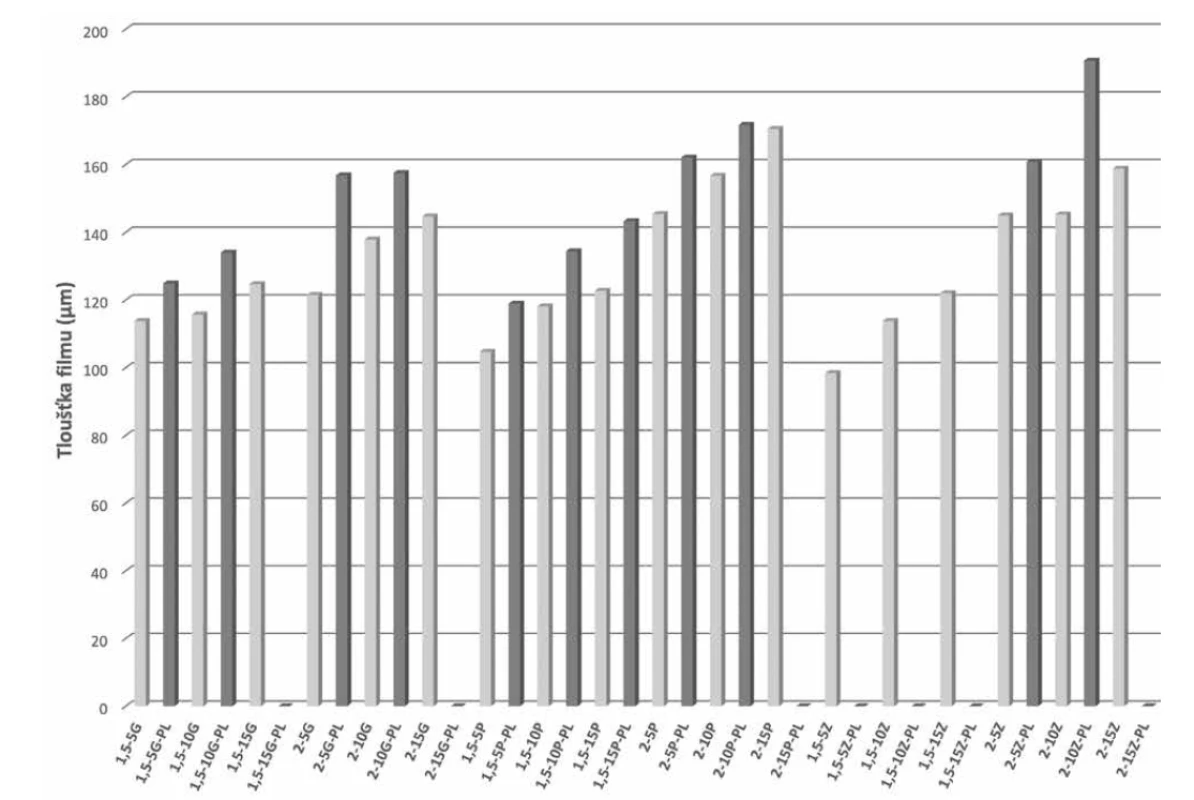
Filmy se připravovaly metodou odpaření rozpouštědla. Byly připraveny filmy o dvou tloušťkách/koncentracích NaPGA, a to 1,5 g/100 cm2 a 2,0 g/100 cm2. Množství použitého změkčovadla se vztahovalo k množství NaPGA a bylo v 5%, 10% a 15% poměru k NaPGA. Poly-ε-lysin se přidával v 10% množství v poměru k NaPGA (1 : 10). Složení připravovaných filmů znázorňuje tabulka 1.
Tab. 1. Složení a označení filmů 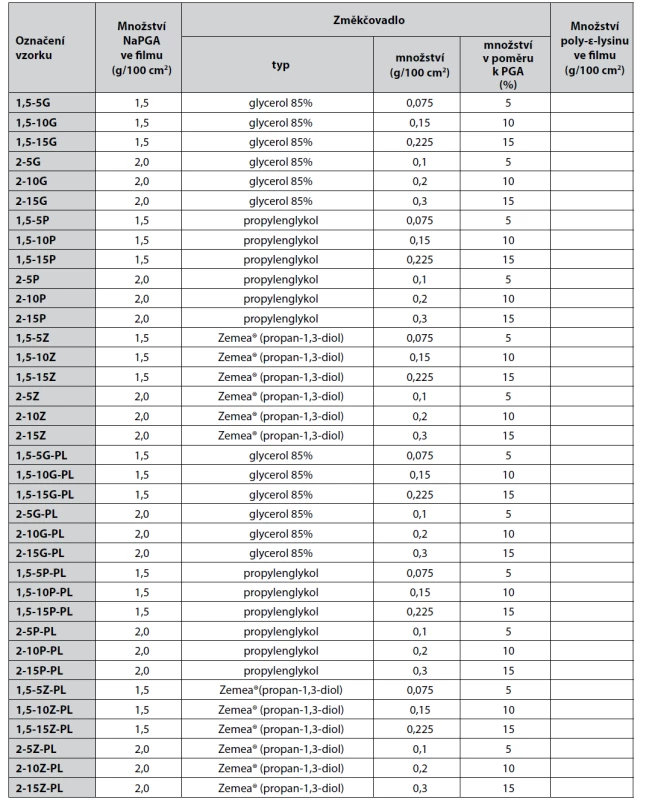
V tabulce nejsou uvedeny vzorky se změkčovadly, s nimiž se nepodařilo připravit vyhovující filmy. Filmy byly odlévány na hranaté plastové Petriho misky o rozměrech 12 x 12 cm. Disperze pro odlévání se připravila rozpuštěním NaPGA a změkčovadel, popř. poly-ε-lysinu v potřebném množství čištěné vody tak, aby roztokem bylo rovnoměrně pokryto celé dno Petriho misky. Sušení probíhalo při pokojové teplotě. Usušené filmy byly z misek vyjmuty, vyřadily se nekvalitní filmy a ty vyhovující po organoleptické stránce se uchovávaly v uzavřených boxech do dalšího hodnocení.
Hodnocení připravených filmů
Organoleptické vlastnosti disperzí a připravených filmů
V rámci experimentu se hodnotil nejenom vzhled připravených filmů, ale i vlastnosti vylévaných disperzí, jež byly základním předpokladem pro vznik kvalitních filmů. U disperzí se posuzovalo zabarvení, čirost, homogenita, viskozita, přítomnost bublinek a také snadnost odlévání disperze na polystyrenovou Petriho misku. U hotových filmů se hodnotily následující parametry: barva, průhlednost, homogenita, pevnost a snadnost manipulace s filmem. Filmy s nevyhovujícími vlastnostmi byly z dalšího hodnocení vyřazeny.
Tloušťka filmů
Tloušťka filmů byla měřena pomocí digitálního tloušťkoměru Elcometer 456 (Gamin, Česká republika). Každý film se umístil na nerezovou desku a sondou tloušťkoměru bylo rovnoměrně po celé ploše filmu naměřeno celkem 30 hodnot, ze kterých výse vypočítala průměrná tloušťka filmu v μm a směrodatná odchylka.
Hmotnostní stejnoměrnost
Jelikož Český lékopis nedefinuje podmínky pro hodnocení filmů včetně hodnocení jejich hmotnostní stejnoměrnosti, byla pro naše účely použita lékopisná zkouška uvedená v ČL 2017 v kapitole 2.9.5. Hmotnostní stejnoměrnost pevných jednodávkových lékových forem. Za pomocí kovového razidla se z každého typu filmu vyrazilo 20 vzorků o rozměrech 25 x 25 mm, které se následně zvážily na analytických vahách. Ze získaných hodnot se vypočítal aritmetický průměr a hranice maximální a minimální povolené odchylky, která činí pro tablety s hmotností pod 80 mg 10 %. Maximálně dvě hmotnosti se mohly lišit od této 10% odchylky, avšak žádná se nesměla lišit o více než její dvojnásobek.
Hustota filmů
Ze známých rozměrů vyražených čtverečků (25 x 25 mm) a zjištěných hodnot tloušťky jednotlivých filmů se vypočítal objem 20 vzorků. Z objemu a hmotnosti jednotlivých čtverečků byla následně vypočítána hustota (g/cm3) dle rovnice:
, kde m je hmotnost (g) a V je objem (cm3).
Ze získaných hodnot hustoty se následně vypočítal průměr a směrodatná odchylka.
Opacita filmů
Opacita filmů se měřila u šesti vzorků pomocí spektrofotometru UV-1600 PC Spectromether (VWR, USA). Kovovým razidlem vyražený proužek filmu o rozměrech 10 x 40 mm se vložil do kyvety spektrofotometru a změřila se absorbance při 600 nm. Dle následující rovnice se vypočítaly hodnoty opacity:
kde T je tloušťka filmů (mm).
Ze získaných hodnot se vypočítal průměr a směrodatná odchylka.
pH vodného výluhu
Pro stanovení vodného výluhu se použily tři předem zvážené čtverečky filmu, které se jednotlivě vložily do kádinek a zalily čerstvě převařenou čištěnou vodou pokojové teploty v množství odpovídajícím stonásobku hmotnosti čtverečku. Po 15 minutách se obsah kádinky důkladně promíchal a pomocí ponorné elektrody (pH metr Profiline pH 3210 a elektroda SenTix 41, Wissenschaftlich-Technische Werkstätten GmbH, Německo) se stanovila hodnota pH. Ze získaných hodnot se vypočítal průměr a směrodatná odchylka.
Povrchové pH po navlhčení kapkou vody
Stanovení povrchového pH filmů se provádělo pomocí pH metru (Profiline pH 3210, Wissenschaftlich-Technische Werkstätten GmbH, Německo) s kontaktní skleněnou elektrodou (Flatrode, Hamilton Company, USA) na třech vzorcích filmu. Film se zakápl čerstvě převařenou čištěnou vodou a po vsáknutí kapky se přiložením elektrody změřilo povrchové pH. Ze získaných hodnot se vypočítal průměr a směrodatná odchylka.
Mechanické vlastnosti
Hodnocení mechanických vlastností filmů se provádělo pomocí texturometru (Texture analyzer CT3 4500, Brookfield Engineering Laboratories, USA) s PC programem TexturePro CT. U každého typu filmu se hodnotila pevnost v tahu a odolnost filmu proti protržení. Od každého vzorku bylo provedeno pět měření, ze získaných hodnot se vypočítal průměr a směrodatná odchylka.
Pevnost v tahu
Vzorek filmu o rozměrech 10 x 40 mm se upevnil do čelistí texturometru TA-DGA. Po spuštění přístroje se čelisti od sebe pohybovaly rychlostí 2 mm/s. Výslednými parametry měření byly zátěž (g), deformace (mm) a práce potřebná k roztržení filmu (mJ). Z naměřených hodnot zátěže se vypočítala síla F (N) potřebná k roztržení filmu dle následující rovnice:
, kde Z je zátěž (g) a g je tíhové zrychlení 9,81 m/s2.
Odolnost proti protržení
Vzorek filmu o velikosti 25 x 25 mm se upevnil do držáku TA-CJ. Směrem dolů ke vzorku se pohybovala tyčová sonda TA39 o průměru 2 mm rychlostí 0,5 mm/s tak dlouho, dokud nedošlo k protržení vzorku. Výslednými parametry měření opět byly zátěž (g), deformace (mm) a vykonaná práce (mJ) potřebná k protržení vzorku. Z hodnot zátěže se vypočítala síla F (N) dle výše uvedeného vzorce.
Výsledky a diskuze
Z organoleptického hlediska měly všechny vylévané disperze podobný vzhled – byly homogenní, čiré, mírně nažloutlé a poměrně viskózní. Po odlití a uschnutí vznikly na Petriho miskách transparentní a celistvé filmy s výjimkou vzorků, kde se jako změkčovadlo zkoumaly makrogol 300 a pentylenglykol (nepravidelné bílé zabarvení, ztráta průhlednosti, již na pohled nerovnoměrná tloušťka) – tyto filmy byly z dalšího hodnocení vyřazeny. Na vzhled filmu, jeho ohebnost a snadnost manipulace s ním měla významný vliv koncentrace změkčovadla a přítomnost poly-ε-lysinu. Jak je zjevné z obrázků 1 a 2, filmy s 15% koncentrací změkčovadla již většinou měly sklon se při manipulaci s nimi kroutit a byly mírně lepivé, což nesplňuje požadavky pro kvalitní film16). Tento vliv byl méně výrazný u filmů o větší tloušťce a v případě propylenglykolu jako změkčovadla. Přítomnost PL organoleptické vlastnosti zhoršila, u vyšších koncentrací změkčovadla dokonce natolik, že některé filmy byly nepoužitelné – kroutily se a slepovaly již při sundávání z Petriho misky a nebylo možné u nich provést hodnocení fyzikálních vlastností (v následujících tabulkách označeny jako nehodnocené).
Obr. 1. Vzhled filmů 2-5G (vlevo), 2-10G (uprostřed) a 2-15G (vpravo) 
Obr. 2. Vzhled filmů 2-5G-PL (vlevo), 2-10G-PL (uprostřed) a 2-15G-PL (vpravo) 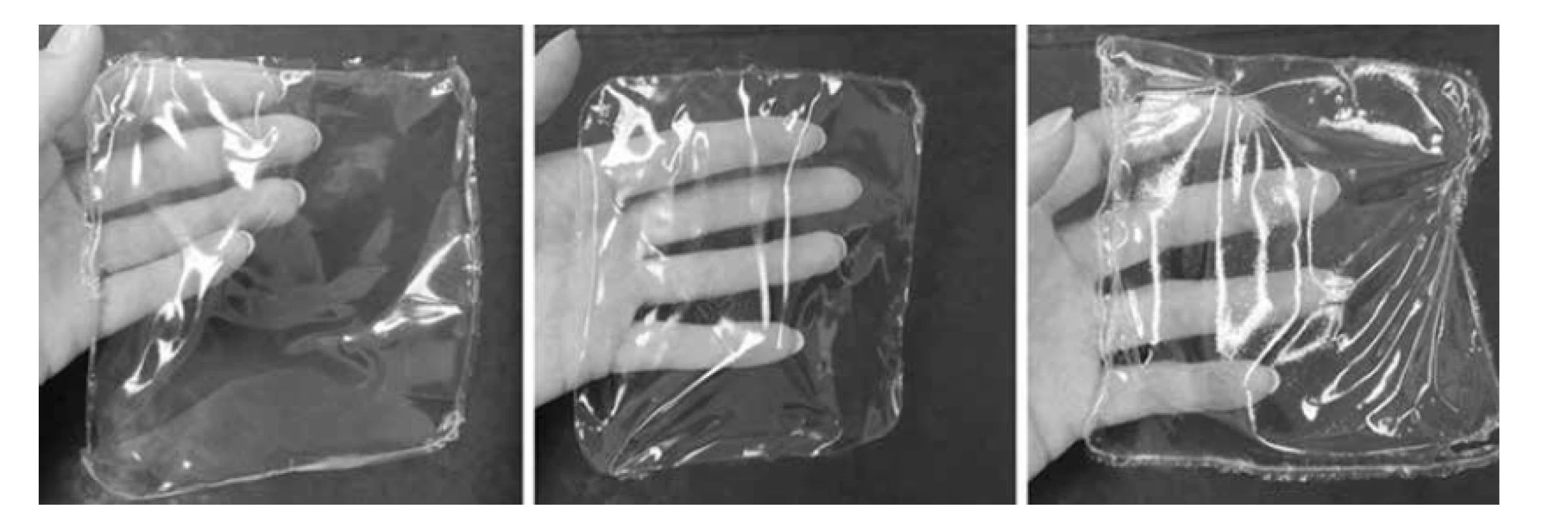
Měření tloušťky je významné pro posouzení, zda jsou filmy po celé ploše rovnoměrné16, 17). Tento parametr je obzvlášť důležitý u filmů obsahujících léčivo, jelikož přímo souvisí s přesností podávané dávky18). Filmy by rovněž měly mít dostatečnou tloušťku, aby si udržely svou celistvost, ale příliš velká tloušťka může pacientovi způsobovat nepříjemné pocity cizího tělesa v místě aplikace19). Z tohoto důvodu je třeba zvolit optimální tloušťku, která bude kompromisem zmíněných požadavků. Tloušťku filmů lze regulovat změnou objemu vylévané disperze8), rovnoměrnost tloušťky se pak zajistí sušením filmu na rovném povrchu20). Na základě výsledků znázorněných na obrázku 3 lze konstatovat, že se tloušťka námi připravených filmů zvyšovala s rostoucí koncentrací změkčovadla. Rovněž je zřejmé, že naměřené hodnoty u všech filmů NaPGA/PL jsou vyšší než u filmů pouze ze samotné NaPGA, což může souviset s větším obsahem vlhkosti ve filmu, který dle Karimi et al. ovlivňuje přísada PL21).
Hodnocení pH filmů řadíme k jedné z nejdůležitějších zkoušek z hlediska praktické aplikace krytí na rány. Pro bezproblémové hojení ran je velmi důležité zachování hodnot pH ideálně v mírně kyselé oblasti, neboť nižší hodnota pH příznivě ovlivňuje řadu biochemických reakcí probíhajících v ráně (proliferace fibroblastů, epitelizace, angiogeneze) a současně snižuje riziko bakteriální infekce22, 23). Chronické nehojící se rány jsou totiž charakteristické zásaditými hodnotami pH, příznivými pro množení mikroorganismů, a též vyšší hladinou MMPs (matricových metaloproteináz), kdy dochází k nežádoucí destrukci vznikající zdravé extracelulární matrice23, 24). Jak je patrné z tabulky 2, u všech filmů ze samotné NaPGA byly hodnoty pH v rámci obou měření zachovány v mírně kyselé oblasti a pohybovaly se v rozmezí 4,6–5,7. U vzorků s obsahem poly-ε-lysinu byly tyto hodnoty pH podobné (pH 4,1–5,9) s výjimkou filmů, kde jako změkčovadlo sloužil glycerol (vzorky 1,5-5G-PL; 1,5-10G-PL; 2-5G-PL; 2-10G-PL), tam byly tyto hodnoty vyšší (pH 7,2–8,3). Z tohoto důvodu se kombinace glycerolu 85% a PL nejeví jako optimální.
Tab. 2. Výsledky hodnocení povrchového pH a pH výluhu připravených filmů 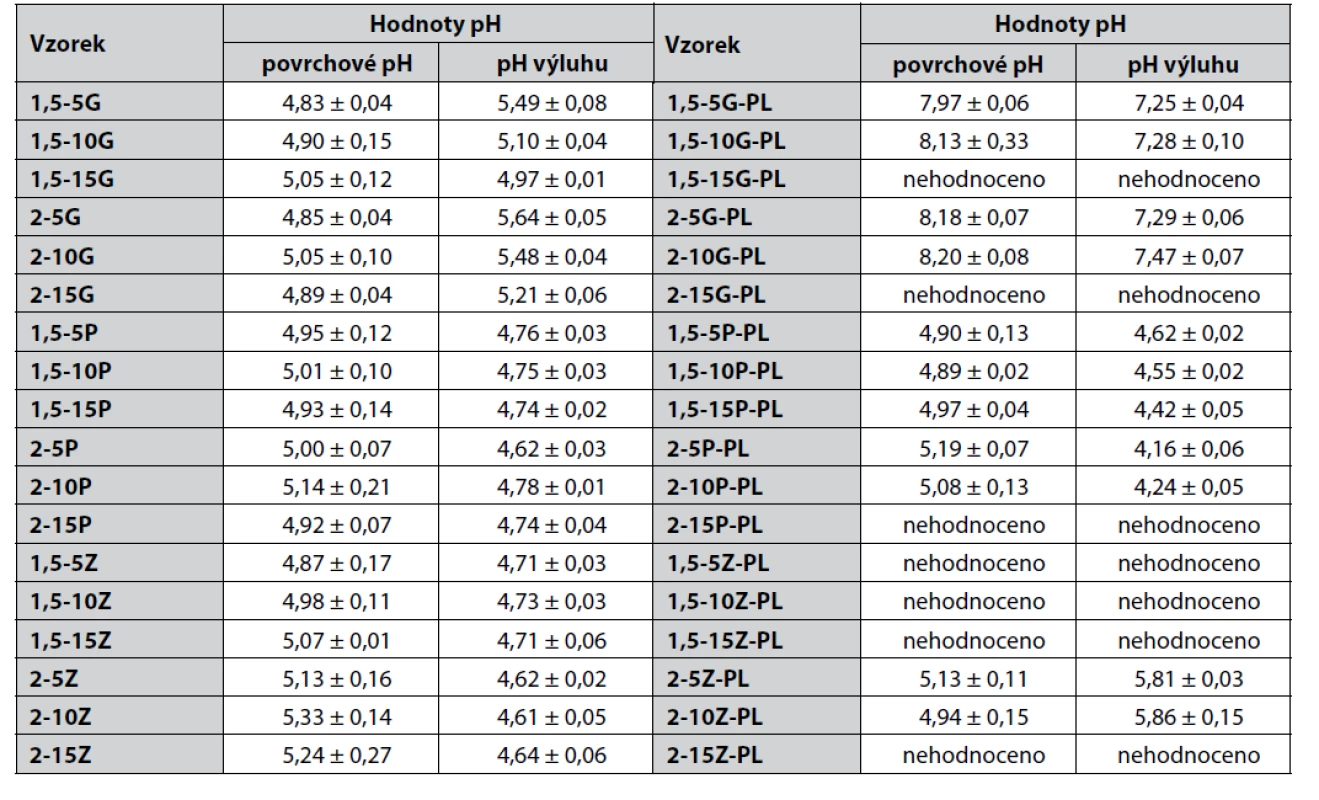
Pro filmové krytí je žádoucí, aby mělo dostatečnou transparentnost, která je důležitá z hlediska možnosti kontroly rány bez nutnosti výměny krytí, čímž se snižuje mechanické namáhání rány spojené s jeho odstraněním25). To, zda a jak je film průhledný (transparentní), je však záležitost poměrně subjektivní, a proto se v této souvislosti pro vyjádření míry transparentnosti filmů používá opacita. Tu je možné charakterizovat stupnicí 0–126) nebo 0–10027), kdy 0 znamená maximální průhlednost (transparentnost) a 1, resp. 100, absolutní neprůhlednost. Opacita biopolymerních filmů je ovlivněna homogenitou, mikrostrukturou, indexem lomu obsažených složek, distribucí velikostí částic a zpracováním filmů během sušícího procesu28). Karimi et al. uvádí, že u PGA/PL filmů roste hodnota opacity s rostoucí koncentrací PL21), a též, že opacitu ovlivňuje hustota filmu. I v další studii bylo zjištěno, že přítomnost PL v peptidových obalech může vést ke zvýšení opacity29). Jak je vidět z tabulky 3, náš experiment potvrdil tato zjištění – přidáním PL se hodnota opacity filmů znatelně zvětšila. Opacita též korelovala s hustotou, která se zvyšovala s rostoucím množstvím změkčovadla.
Tab. 3. Výsledky hodnocení hustoty a opacity připravených filmů 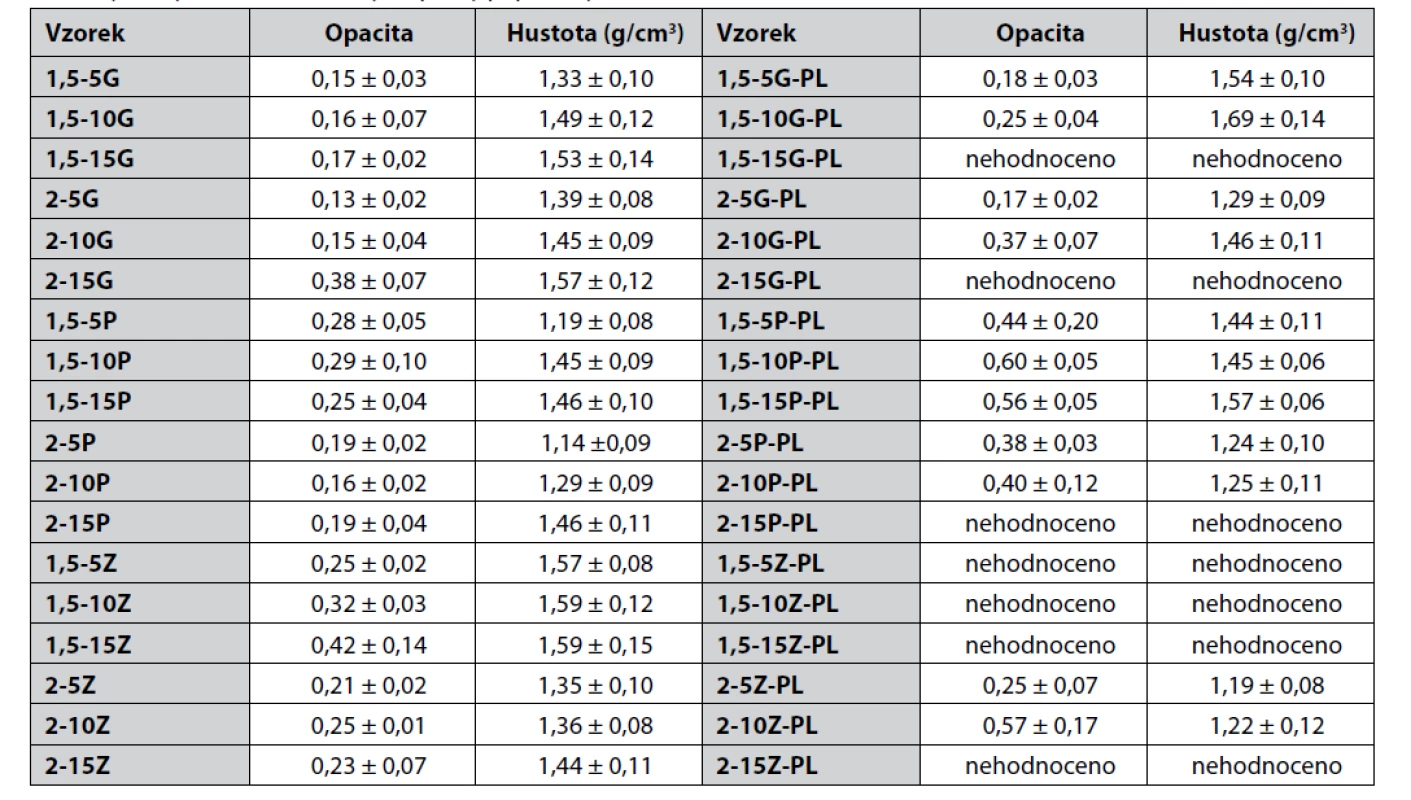
Hodnocení mechanických vlastností je důležité pro posouzení chování filmu při aplikaci na ránu. Je nezbytné, aby krytí lehce přilnulo k poškozené kůži či ráně, aplikace byla pro pacienta příjemná a nezpůsobovala bolest30, 31). Ideálním krytím by měl být flexibilní, tenký, avšak dostatečně robustní film, který by kromě vhodných aplikačních vlastností umožňoval optimální vstřebání s pozitivním účinkem na ránu. V literatuře byl popsán biomodulující vliv PGA na hojení ran34, 35), z toho důvodu ji lze považovat za látku filmotvornou i aktivní. NaPGA je snadno rozpustná ve vodě, proto námi připravené filmy lze zařadit do druhé skupiny. Rozpustné filmy poskytují rovněž příležitost pro snazší zapracování aktivních látek různého charakteru, např. PL, který byl v našem případě přidán k NaPGA za účelem získání antimikrobiálního účinku krytí.
Jelikož spojením NaPGA a PL vznikly rozpustné filmy, byly jejích mechanické vlastnosti hodnoceny pouze v suchém stavu. Obecně lze říct, že všechny připravené filmy byly velmi pružné a odolné – při měření pevnosti v tahu se ze všech připravených vzorků roztrhl pouze jeden, a to 1,5-5P-PL (síla 20,8 ± 4,6 N, deformace 1,35 ± 0,24 mm, práce 219,19 ± 34,24 mJ), ostatní se pouze protáhly, jak lze vidět na obrázku 4.
Obr. 4. Měření pevnosti v tahu – stav proužku filmu před zahájením testu (vlevo) a po ukončení testu (vpravo) 
Při měření odolnosti filmu proti protržení se protrhly filmy s nižší tloušťkou a nižší koncentrací změkčovadel (tab. 4). Mechanické vlastnosti ovlivnila též přítomnost PL – ve většině případů došlo ke zvýšení deformace u filmů obsahujících PL. Tyto naše výsledky se shodují se studií Karimi et al., kde se uvádí, že přísadou PL a zvyšováním jeho koncentrace lze dosáhnout snížení křehkostí a vyšší deformace filmů21), podobně jako je tomu přidáním změkčovadel. Vytvoření kompozitních filmů může tedy být jedním z postupů k dosažení lepších fyzikálních a mechanických vlastností20).
Tab. 4. Výsledky hodnocení mechanických vlastností filmů – protržení 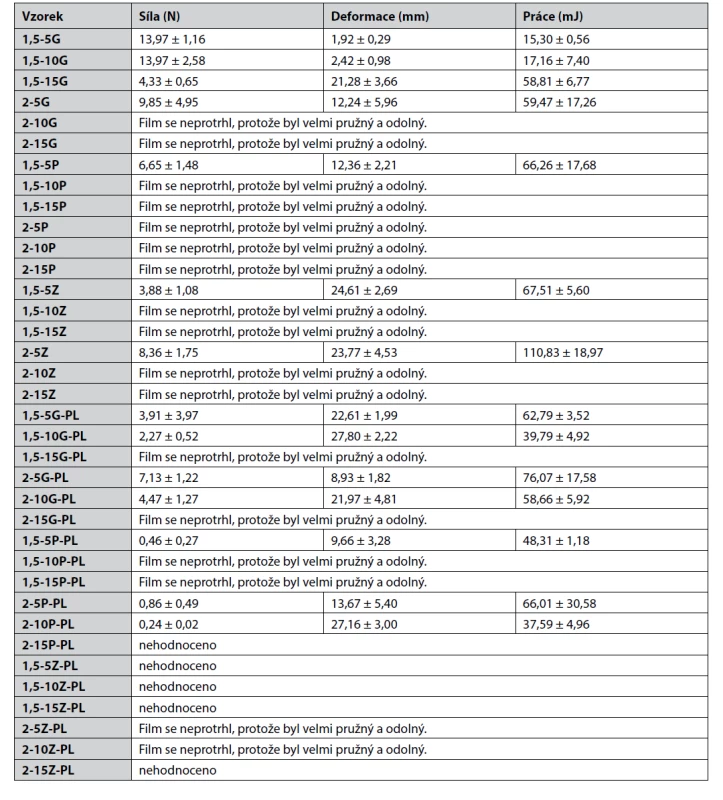
Závěr
Použití metody odpaření rozpouštědla se potvrdilo jako vhodné pro přípravu filmů z NaPGA a NaPGA/PL. Oba polymery jsou vzájemně kompatibilní, což vede ke vzniku organolepticky a aplikačně vyhovujících filmů. Glycerol 85%, propylenglykol, propan-1,3-diol se prokázaly jako vhodné plastifikátory nejlépe v koncentracích 5 % nebo 10 % v poměru k NaPGA.
Krytí na rány z NaPGA a její kombinace s PL zatím na trhu uplatnění nemají. Tyto filmy by ale mohly být vhodné pro aplikaci na hojící se rány, kde ve vlhkém prostředí vytvoří hydrogel zajišťující vlhké hojení ran, které je v dnešní době upřednostňováno. Vytvořený hydrogel by v případě filmů PGA/PL mohl mít významný antimikrobiální účinek. Filmy by bylo vhodné aplikovat s kompatibilním sekundárním krytím, které zajistí fixaci filmu v místě aplikace a případně podpoří absorpci exsudátu.
Střet zájmů: žádný.
K. Světlíková • R. Masteiková • PharmDr. Kateřina Tenorová • David Vetchý
Masarykova univerzita, Farmaceutická fakulta
Ústav farmaceutické technologie
Palackého třída 1946/1, 612 00 Brno
e-mail: K.Tenorova@seznam.cz
J. Bernatonienė
Akademie medicíny, Litevská univerzita zdravotnických věd
Farmaceutická fakulta, Katedra technologie léků a sociální farmacie Kaunas, Litva
Zdroje
1. Westgate S., Cutting K. F., DeLuca G., Asaad K. Collagen dressings made easy. Wounds UK 2012; 8(1), 1–4.
2. Schmitz M., Mustafi N., Rogmans S., Kasparek S. Pilot - -study switchable film dressing & elderly skin/patients with chronic wounds: A non-interventional, non-placebo - controlled, national pilot study. Wound Med. 2020; 30, 100189.
3. Kunioka M. Biosynthesis and chemical reactions of poly (amino acid)s from microorganisms. Appl. Microbiol. Biotechnol. 1997; 47(5), 469–475.
4. Candela T., Fouet A. Poly-gamma-glutamate in bacteria. Mol. Microbiol. 2006; 60(5), 1091–1098.
5. Nair P., Navale G. R., Dharne M. S. Poly-gamma-glutamic acid biopolymer: a sleeping giant with diverse applications and unique oppotunities for commercialization. Biomass Conver. Biorefin. 2021; 1–19.
6. Kumar M. M. M., Xaver J. R., Gopalan N., Ramana K. V., Sharma R. K. Poly (γ-) Glutamic Acid: A Promising Biopolymer. Def. Life Sci. J. 2018; 3, 301–306.
7. Bajaj I., Singhal R. Poly (glutamic acid) – an emerging biopolymer of commercial interest. Bioresour. Technol. 2011; 102(10), 5551–5561.
8. Pereira A. E. S., Sandoval-Herrera I. E., Zavala-Betancourt S. A., Oliveira H. C., Ledezma-Pérez A. S., Romero J., Fraceto L. F. γ-Polyglutamic acid/chitosan nanoparticles for the plant growth regulator gibberellic acid: Characterization and evaluation of biological activity. Carbohydr. Polym. 2017; 157, 1862–1873.
9. Sabbah M., Di Pierro P., Ruffo F., Schiraldi C., Alfano A., Cammarota M., Porta R. Glutamic Acid as Repeating Building Block for Bio-Based Films. Polymers 2020; 12(7), 1613.
10. Shao Z., Fang S., Li Y., Chen J., Meng Y. Physicochemical properties and formation mechanism of electrostatic complexes based on ε-polylysine and whey protein: Experimental and molecular dynamics simulations study. Int. J. Biol. Macromol. 2018; 118, 2208 – 2215.
11. Zhang L., Li R., Dong F., Tian A., Li Z., Dai Y. Physical, mechanical and antimicrobial properties of starch films incorporated with ε-poly-l-lysine. Food Chem. 2015; 166, 107–114.
12. Luz C., Calpe J., Saladino F., Luciano F. B., Fernandez - Franzón M., Mañes J., Meca G. Antimicrobial packaging based on ε‐polylysine bioactive film for the control of mycotoxigenic fungi in vitro and in bread. J. Food Process. Preserv. 2018; 42(1), 1–6.
13. Li S., Zhang L., Liu M., Wang X., Zhao G, Zong W. Effect of poly-ε-lysine incorporated into alginate-based edible coatings on microbial and physicochemical properties of fresh-cut kiwifruit. Postharvest Biol. Technol. 2017; 134, 114–121.
14. Chheda A. H., Vernekar M. R. A natural preservative ε-poly-L-lysine: fermentative production and applications in food industry. Int. Food Res. J. 2015; 22(1), 23–30.
15. Fürsatz M., Skog M., Sivlér P., Palm E., Aronsson C., Skallberg A., Greczynski G., Khalaf H., Bengtsson T., Aili D. Functionalization of bacterial cellulose wound dressings with the antimicrobial peptide ε-poly-L - -lysine. Biom. Mater. 2018; 13(2), 1–11.
16. Hoffmann E. M., Breitenbach A., Breitkreutz J. Advances in orodispersible films for drug delivery. Expert Opin. Drug Deliv. 2011; 8(3), 299–316.
17. Vinklárková L., Masteiková R., Vetchý D., Doležel P., Bernatonienė J. Formulation of novel layered sodium carboxymethylcellulose film wound dressings with ibuprofen for alleviating wound pain. Biomed Res. Int. 2015; 2015, 1–11.
18. Dixit R. P., Puthli S. P. Oral strip technology: overview and future potential. J. Control. Release 2009; 139(2), 94–107.
19. Thomas S. Exudate-handling mechanism of the Cutimed ® cavity range of foam dressings. London: BSN Medical 2009. https://pdf4pro.com/view/exudate-handlingmechanisms - of-the-cutimed-153d42.html (26. 6.2021).
20. Rezvanian M., Amin M. C. I. M., Ng S. F. Development and physicochemical characterization of alginate composite film loaded with simvastatin as a potential wound dressing. Carbohydr. Polym. 2016; 137, 295–304.
21. Karimi M., Yazdi F. T., Mortazavi S. A., Shahabi-Ghahfarrokhi I., Chamani J. Development of active antimicrobial poly (l-glutamic) acid-poly (l-lysine) packaging material to protect probiotic bacterium. Polym. Test. 2020; 83, 106338.
22. Schneider L. A., Korber A., Grabbe S., Dissemond J. Influence of pH on wound-healing: a new perspective for wound-therapy? Arch. Dermatol. Res. 2007; 298(9), 413–420.
23. Jones E. M., Cochrane C. A., Percival S. L. The effect of pH on the extracellular matrix and biofilms. Adv. in Wound Care 2015; 4(7), 431–439.
24. Pospíšilová A. Léčba chronických ran moderními krycími prostředky. Prak. lékáren. 2010; 6(6), 276–281.
25. Sussman G. Technology update: understanding film dressings. Wounds Int. 2010; 1(2), 1–4.
26. Günther T., Theisel H., Gross M. Decoupled opacity optimization for points, lines and surfaces. Comput. Graph. Forum 2017; 36(2), 153–162.
27. Midtfjord H., Green P., Nussbaum P. A model of visual opacity for translucent colorants. J. Electron. Imaging 2018; 2018(8), 209–201.
28. Rubilar J. F., Zúñiga R. N., Osorio F., Pedreschi F. Physical properties of emulsion-based hydroxypropyl methylcellulose/whey protein isolate (HPMC/ WPI) edible films, Carbohydr. Polym. 2015; 123, 27 – 38.
29. Alemán A., Mastrogiacomo I., López-Caballero M. E., Ferrari B., Montero M. P., Gómez-Guillén M. C. A novel functional wrapping design by complexation of ε-polylysine with liposomes entrapping bioactive peptides. Food Bioproc. Tech. 2016; 9(7), 1113–1124.
30. Paunonen S. Strength and barrier enhancements of cellophane and cellulose derivative films: a review. BioResources 2013; 8(2), 3098–3121.
31. Wang B., Jia D. Y., Ruan S. Q., Qin S. Structure and properties of collagen-konjac glucomannan-sodium alginate blend films. J. Appl. Polym. Sci. 2007; 106(1), 327–332.
32. Pagano C., Ceccarini M. R., Calarco P., Scuota S., Conte C. Primavilla S., Ricci M., Perioli L. Bioadhesive polymeric films based on usnic acid for burn wound treatment: Antibacterial and cytotoxicity studies. Colloids Surf. B: Biointerfaces 2019; 178, 488–499.
33. Akkaya N. E., Ergun C., Saygun A., Yesilcubuk N., Akel-Sadoglu N., Kavakli I. H., Turkmen H. S., Catalgil - Giz H. New biocompatible antibacterial wound dressing candidates; agar-locust bean gum and agar-salep films. Int. J. Biol. Macromol. 2020; 155, 430–438.
34. Choi J. C., Uyama H., Lee C. H., Sung, M. H. Promotion effects of ultra-high molecular weight poly-γ-glutamic acid on wound healing. J. Microbiol. Biotechnol. 2015; 25(6), 941–945.
35. Hinchliffe J. D., Parassini Madappura A., Syed Mohamed S. M. D., Roy I. Biomedical applications of bacteria - derived polymers. Polymers 2021; 13(7), 1081.
Štítky
Farmacie Farmakologie
Článek vyšel v časopiseČeská a slovenská farmacie
Nejčtenější tento týden
2021 Číslo 5- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Využití droplet-based mikrofluidních technik při přípravě mikročástic
- Telacebek (Q203): Vynára sa na obzore nové efektívne a bezpečné antituberkulotikum?
- Antiadhezívna, antibiofilmová a disperzná aktivita biosurfaktantov izolovaných z Bacillus amyloliquefaciens 3/22
- Vliv meloxikamu a extraktu z kryokonzervované placenty na počáteční zánětlivou reakci – experimentální studie
- Filmy z kyseliny poly-γ-glutamové a poly-ε-lysinu jako potenciální prostředek pro terapii ran – formulace, příprava a hodnocení
- Laudatio RNDr. Roman Smieško – 70 rokov
- Česká a slovenská farmacie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Využití droplet-based mikrofluidních technik při přípravě mikročástic
- Telacebek (Q203): Vynára sa na obzore nové efektívne a bezpečné antituberkulotikum?
- Antiadhezívna, antibiofilmová a disperzná aktivita biosurfaktantov izolovaných z Bacillus amyloliquefaciens 3/22
- Vliv meloxikamu a extraktu z kryokonzervované placenty na počáteční zánětlivou reakci – experimentální studie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání