-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Zvýšení sérových hladin S100–A11 a AIF-1 u pacientek s karcinomem hrdla děložního a postižením lymfatických uzlin
Serum concentrations of S100–A11 and AIF-1 are elevated in cervical cancer patients with lymph node involvement
Objective: The aim of this study was to compare the serum levels of TFF3, AIF-1, S100–A11 and DKK1 in surgically staged patients with cervical cancer, and in healthy female controls.
Methods: In total 85 consecutive patients diagnosed at the Department of Obstetrics and Gynecology, University Hospital in Olomouc with cervical cancer undergoing radical hysterectomy or fertility sparing surgery with pelvic lymphadenectomy were included. Ninety patients who underwent elective total hysterectomy for nonmalignant disorder represented a control group. In all patients, preoperative serum samples were taken and separated; the sera were all stored at –80 °C until analysis for TFF3, AIF-1, S100–A11 and DKK1.
Results: According to the final histopathological examination, 32 (40.5%) out of 79 cervical cancer patients with microscopically examined lymph nodes were lymph node-positive. S100–A11 (P < 0.0001) and AIF-1 levels (P < 0.0001) were higher in cervical cancer patients than in controls. Furthermore, the serum levels of S100–A11 (P > 0.04) and AIF-1 (P > 0.01) were significantly higher in lymph node-positive patients as compared to lymph node-negative patients. The levels of TFF3 and DKK1 were higher (P < 0.0001) in controls than in cervical cancer patients and were not different in groups with or without nodal involvement.
Conclusion: S100–A11 and AIF-1 represent potential biomarkers in patients with cervical cancer. Moreover, the levels of S100–A11 and AIF-1 increase in patients with lymph node involvement.
Keywords:
oncogynecology – biomarkers – cervical cancer – S100–A11 – TFF-3 – AIF-1 – DKK1
Autoři: Maděrka M. 1; Dvořák V. 2; Hambálek J. 1; Stejskal D. 3,4; Krejčí G. 3; Švesták M. 3; Langová K. 5; Pilka R. 1
Působiště autorů: Porodnicko-gynekologická klinika LF UP a FN Olomouc 1; Centrum ambulantní gynekologie a primární péče, Brno 2; Oddělení laboratorní medicíny, AGEL Středomoravská nemocniční, a. s., Prostějov 3; Ústav laboratorní diagnostiky, FN Ostrava 4; Ústav lékařské biofyziky, LF UP v Olomouci 5
Vyšlo v časopise: Ceska Gynekol 2021; 86(1): 17-21
Kategorie: Původní práce
doi: https://doi.org/10.48095/cccg202117Souhrn
Cíl studie: Cílem této studie bylo porovnat sérové hladiny TFF3, AIF-1, S100–A11 a DKK1 u pacientek s karcinomem hrdla děložního a u zdravých kontrol.
Metodika: Celkem bylo zařazeno na Porodnicko-gynekologické klinice ve Fakultní nemocnici v Olomouci 85 pacientek s diagnózou karcinomu děložního hrdla, které podstoupily radikální hysterektomii nebo fertilitu zachovávající operaci s pánevní lymfadenektomií. Kontrolní skupinu tvořilo 90 pacientek, které podstoupily jakoukoli hysterektomii pro nemaligní onemocnění. U všech pacientek byly předoperačně odebrány a separovány vzorky séra a všechna séra byla skladována při teplotě –80 °C až do analýzy hladin TFF3, AIF-1, S100–A11 a DKK1.
Výsledky: U 32 pacientek (40,5 %) ze 79 s karcinomem hrdla děložního, u kterých byly lymfatické uzliny histologicky vyšetřeny, byly pozitivní lymfatické uzliny. Sérové hladiny S100–A11 (p < 0,0001) a AIF-1 (p < 0,0001) byly vyšší u pacientek s karcinomem hrdla děložního než u kontrol. Kromě toho byly sérové hladiny S100–A11 (p > 0,04) a AIF-1 (p > 0,01) významně vyšší u pacientek s pozitivními lymfatickými uzlinami ve srovnání s pacientkami s negativními lymfatickými uzlinami. Hladiny TFF3 a DKK1 byly vyšší (p < 0,0001) u kontrol než u pacientek s karcinomem hrdla děložního a nelišily se ve skupinách s postižením lymfatických uzlin, nebo bez něj.
Závěr: S100–A11 a AIF-1 představují potenciální biomarkery u pacientek s karcinomem hrdla děložního. V naší studii byly současně vyšší hladiny S100–A11 a AIF-1 u pacientek s přítomností metastáz v lymfatických uzlinách.
Klíčová slova:
onkogynekologie – biomarkery – karcinom hrdla děložního – S100–A11 – TFF3 – AIF-1 – DKK1
Úvod
Karcinom hrdla děložního je celosvětově čtvrtým nejčastějším zhoubným nádorem u žen [1]. Incidence v ČR v roce 2016 byla 15,3/100 000 žen, což je 822 nových případů za rok. Incidence tohoto nádorového onemocnění je v ČR tedy přibližně o 50 % vyšší než v západních evropských zemích. Mortalita v roce 2016 byla 6,28/100 00 žen, což je v absolutních číslech 384 žen. Karcinom hrdla děložního má dva věkové vrcholy výskytu, a to v 30–35 letech a 60–65 letech a je častější u sociálně a ekonomicky slabší populace. Pánevní lymfatické uzliny jsou primárními lymfatickými uzlinami u tohoto nádorového onemocnění a jejich postižení výrazně zhoršuje šance na přežití [1–3]. Dosud neexistuje možnost spolehlivé neinvazivní predikce případného metastatického postižení lymfatických uzlin u pacientek s karcinomem hrdla děložního.
Jako tumor marker označujeme chemickou substanci, která je produkována tumorem nebo hostitelem jako odpověď na přítomnost nádoru. Nachází se v krvi, moči nebo tkáních pacientů s nádorovým onemocněním, může být ale produkována i u benigních onemocnění [4]. Biomarker bývá definován jako měřitelný indikátor určitého biologického stavu či podmínek. V souvislosti s postižením uzlin u karcinomu hrdla děložního byl studován SCC-Ag (antigen skvamocelulárního karcinomu), CA125, CEA (karcinoembryonální antigen), CA19-9 a CYFRA-21 [5–9].
Studované biomarkery
Trefoil faktor 3 (TFF3) je protein, který byl v roce 1991 objeven u krys [10]. Trifoláty jsou skupinou malých polypeptidů bohatých na cystein, jsou exprimovány ve tkáních, které obsahují buňky produkující hlen, obzvláště v gastrointestinálním traktu a v jiných epiteliálních tkáních. V roce 1989 byly pojmenovány Thimem jako „trefoil“ peptidy a dosud byly identifikovány tři: TFF1, TFF2 a TFF3 [11]. Bylo prokázáno, že sérové hladiny TFF3 jsou významně vyšší u pacientek s karcinomem endometria než u pacientek s endometriální hyperplazií a u kontrol [12].
Allograft inflammatory factor 1 (AIF-1) je protein nacházející se v cytoplazmě buněk a byl objeven roku 1995 u krys [13]. U proteinu AIF-1 již byla prokázána zvýšená exprese u karcinomu hrdla děložního. Není ovšem známo, jak se na patogenezi tohoto onemocnění podílí [14].
Proteiny rodiny S100 mají poměrně nízkou molekulovou hmotnost a do současnosti jich bylo objeveno již 25. Většina S100 proteinů váže kalcium a je lokalizována intracelulárně. Tyto proteiny mají různé funkce, jsou zastoupeny v širokém spektru biologických procesů a jejich název je odvozen od vlastnosti proteinů rozpouštět se v nasyceném roztoku síranu amonného. Proteiny S100 jsou asociovány s různými nádorovými onemocněními, ačkoli ve většině případů není funkce S100 proteinů v nádorových buňkách stále známá [15]. U námi studovaného proteinu S100–A11 již byla v literatuře publikována asociace s karcinomem prsu, slinivky břišní, žaludku, močového měchýře, prostaty a ledvin. U karcinomu hrdla děložního byla prokázána asociace s hladinou proteinu S100–A9 [16].
Dickkopf-related proteins (DKK) je rodina sekrečních proteinů, které jsou celkem čtyři, a to DKK1, DKK2, DKK3, DKK4. Tyto proteiny mají molekulovou hmotnost 24–38 kDa [17]. DKK1 je protein, který je exprimován převážně osteoblasty a stromálními buňkami kostní dřeně a je u lidí kódován genem DKK1 [18]. Byl objeven roku 1998 Glinkou u drápatky vodní (Xenopus laevis) a podílí se na embryonálním vývoji prostřednictvím inhibice signální dráhy Wnt [19,20]. Tato inhibice hraje klíčovou roli při embryonálním vývoji srdce, hlavy a horních končetin [21]. Signální dráha Wnt hraje důležitou roli také v tumorogenezi, což bylo prokázáno například u kolorektálního karcinomu [18,22].
Cílem této studie bylo porovnat sérové hladiny TFF3, AIF-1, S100 – A11 a DKK1 u pacientek s karcinomem hrdla děložního a u zdravých kontrol, dále jsme porovnávali tyto sérové hladiny u pacientek s postižením a bez postižení lymfatických uzlin.
Metodika
Tato experimentální prospektivní studie probíhala od října 2012 do června 2015 na Porodnicko-gynekologické klinice Fakultní nemocnice v Olomouci. Studie byla schválena lokální etickou komisí a všechny pacientky potvrdily svou účast ve studii podpisem informovaného souhlasu. Celkem bylo do studie zařazeno 85 pacientek s karcinomem hrdla děložního, které podstoupily radikální hysterektomii nebo fertilitu zachovávající operaci s pánevní lymfadenektomií. Histopatologicky byl diagnostikován spinocelulární karcinom u 68 (80 %), adenokarcinom u 13 (15 %), mukoepidermoidní karcinom u 2 (2 %), adenoskvamózní karcinom u 1 (1 %) a 1 (1 %) pacientka měla diagnostikován clear cell karcinom. Dle klasifikace FIGO 2009 bylo 45 (53 %) pacientek v I. stadiu, 31 (36 %) ve II. stadiu, 7 (8 %) ve III. stadiu a 2 (2 %) pacientky ve IV. stadiu onemocnění. U 32 pacientek (40,5 %) ze 79 s karcinomem hrdla děložního, u kterých byly lymfatické uzliny histologicky vyšetřeny, byly metastázy v pánevních nebo paraaortálních lymfatických uzlinách. Kontrolní skupinu tvořilo 90 pacientek, které podstoupily jakoukoli hysterektomii pro nemaligní onemocnění. Ve skupině pacientek s karcinomem hrdla děložního měla nejmladší pacientka 29 let, nejstarší 83 let, medián věku byl 45 let a průměrný věk 48,1 let. Ve skupině kontrol měla nejmladší pacientka 15 let, nejstarší 77 let, medián věku byl 41 let a průměrný věk 41,6 let.
U všech pacientek byly předoperačně odebrány vzorky séra po 12 hod lačnění. Poté byly vzorky centrifugovány (1 600 × g, 10 min, +4 °C) a následně byla provedena separace séra. Dále bylo 200 µl séra rozředěno s 100 µl fosfátového pufru (15 mmol/l, pH 6,5) a dále deproteinizováno pomocí 100 µl chlazeného etanolu (10 min, –25 °C). Po další centrifugaci (14 000 × g, 10 min) byl supernatant filtrován za použití titračních filtrů a vakuován, filtrovaný roztok byl vložen do HPLC (high-performance liquid chromatography) sloupce. Všechna séra byla skladována při teplotě –80 °C až do analýzy hladin TFF3, AIF-1, S100–A11 a DKK1.
Statistické vyhodnocení dat bylo provedeno ve spolupráci s Ústavem lékařské biofyziky Lékařské fakulty Univerzity Palackého v Olomouci. Ke statistickému zpracování dat byl použit statistický software IBM SPSS Statistics for Windows, Version 23.0. (Armonk, NY: IBM Corp).
Korelace byly testovány Mann-Whitneyovým U-testem. Vodorovná čára v krabicovém grafu znázorňuje hodnotu mediánu, dolní hrana krabice hodnotu 1. kvartilu (25. percentilu), horní hrana hodnotu 3. kvartilu (75. percentilu). Anténky ukazují maximální a minimální naměřené hodnoty. Pokud byly v souboru nalezeny odlehlé a extrémní hodnoty, jsou zakresleny kroužky a hvězdičkami (graf 1, 2).
Graf 1. Na tomto grafu je znázorněno významné zvýšení sérové hladiny S100–A11 (p > 0,040) u pacientek s pozitivními lymfatickými uzlinami (1) ve srovnání s pacientkami s negativními lymfatickými uzlinami (0).
Graph 1. This graph shows a significant increase in serum S100–A11 levels (P > 0.040) in patients with positive lymph nodes (1) compared to those with negative lymph nodes (0).
Graf 2. Na tomto grafu je znázorněno významné zvýšení sérové hladiny AIF-1 (p > 0,010) u pacientek s pozitivními lymfatickými uzlinami (1) ve srovnání s pacientkami s negativními lymfatickými uzlinami (0).
Graph 2. This graph shows a significant increase in serum AIF-1 levels (P > 0.010) in patients with positive lymph nodes (1) compared to those with negative lymph nodes (0).
Výsledky
Sérové hladiny S100–A11 (p < 0,0001) a AIF-1 (p < 0,0001) byly vyšší u pacientek s karcinomem děložního hrdla než u kontrol, což je znázorněno na grafech 1 a 2. U 32 pacientek (40,5 %) ze 79 s karcinomem hrdla děložního, u kterých byly lymfatické uzliny histologicky vyšetřeny, byly pozitivní lymfatické uzliny. Sérové hladiny S100–A11 (p > 0,04) a AIF-1 (p > 0,01) byly statisticky významně vyšší u pacientek s pozitivními lymfatickými uzlinami ve srovnání s pacientkami s negativními lymfatickými uzlinami (tab. 1). Sérové hladiny S100–A11 byly ve skupině s pozitivními lymfatickými uzlinami na úrovni (průměr ± směrodatná odchylka) 14,8 ± 13,7 ng/ml (0,9–58,1), ve skupině s negativními lymfatickými uzlinami byly 12,6 ± 17,8 ng/ml (1,4–94,4). Sérové hladiny AIF-1 byly ve skupině s pozitivními lymfatickými uzlinami na úrovni (průměr ± směrodatná odchylka) 939,6 ± 733,5 pg/ml (167,0–3 689,0), ve skupině s negativními lymfatickými uzlinami byly 778,2 ± 991,5 pg/ml (41,1–5 242,0).
Tab. 1. V této tabulce je prezentován medián, minimální a maximální hodnota, průměr a směrodatná odchylka sérových hladiny TFF-3, S100–A11, AIF-1 a DKK1 a věk pacientek v době odběru (jednotky SI soustavy jsou uvedeny v závorce) u pacientek s karcinomem hrdla děložního s postižením a bez postižení lymfatických uzlin.
Tab. 1. This table presents the median, minimum and maximum values, mean and standard deviations of serum TFF-3, S100–A11, AIF-1 and DKK1 levels and the age of patients with cervical cancer with and without lymph node involvement (SI units in brackets).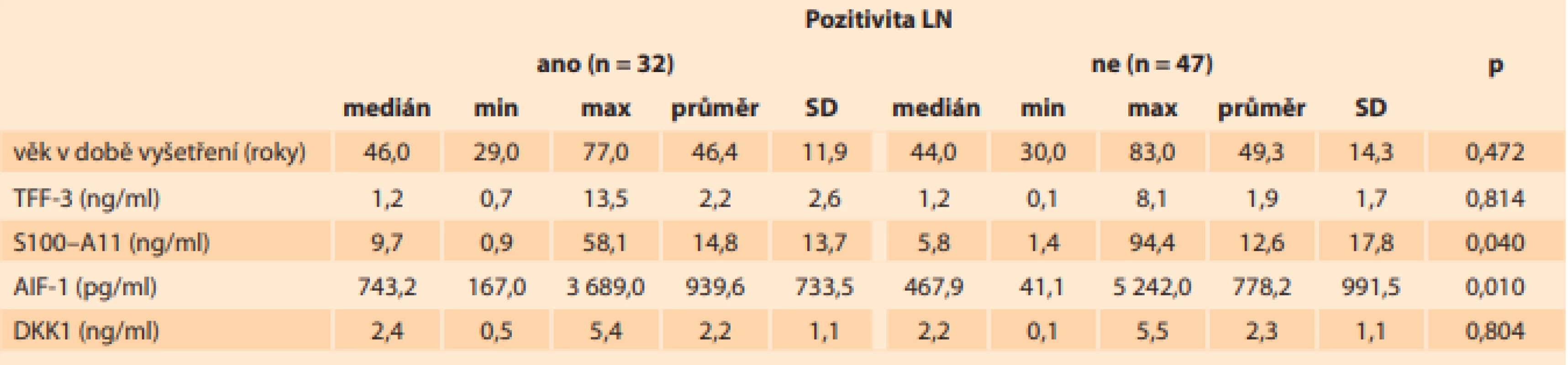
Vysvětlivky: LN – lymfatické uzliny, n – počet, SD – směrodatná odchylka, p – p-hodnota, min – minimální hodnota, max – maximální hodnota Hladiny TFF3 a DKK1 byly vyšší (p < 0,0001) u kontrol než u pacientek s karcinomem hrdla děložního a nelišily se ve skupinách s postižením lymfatických uzlin, nebo bez něj (tab. 1). Sérové hladiny TFF3 byly ve skupině s pozitivními lymfatickými uzlinami na úrovni (průměr ± směrodatná odchylka) 2,2 ± 2,6 ng/ml (0,7–13,5), ve skupině s negativními lymfatickými uzlinami byly 1,9 ± 1,7 ng/ml (0,1–8,1). Sérové hladiny DKK1 byly ve skupině s pozitivními lymfatickými uzlinami na úrovni (průměr ± směrodatná odchylka) 2,2 ± 1,1 ng/ml (0,5–5,4), ve skupině s negativními lymfatickými uzlinami byly 2,3 ± 1,1 ng/ml (0,1–5,5).
Spearmanovým korelačním koeficientem byla prokázána statisticky významná slabá negativní korelace mezi věkem pacientek a všemi sledovanými markery (S100–A11, AIF-1, TFF3 a DKK1). Z tohoto lze usuzovat, že se zvyšujícím se věkem produkce všech těchto proteinů klesá, a jsou tedy i nižší sérové hladiny. Věk pacientek ve skupině s pozitivními lymfatickými uzlinami byl na úrovni (průměr ± směrodatná odchylka) 46,4 ± 11,9 let (29,0–77,0), ve skupině s negativními lymfatickými uzlinami 49,3 ± 14,3 let (30,0–83,0) (tab. 1).
Diskuze
Karcinom hrdla děložního je v ČR čtvrtým nejčastějším gynekologickým nádorem po karcinomu prsu, endometria a ovaria [3]. Dokud se nepodaří zajistit celoplošnou primární prevenci tohoto onemocnění, bude nadále nutné zlepšovat sekundární prevenci formou screeningu, diagnostiku i follow-up již nemocných pacientek. Tak jako u jiných onkologických onemocnění jsou centrem zájmu nové potenciální biomarkery. Velmi rychle narůstá množství informací o nových proteinech TFF3, AIF-1, S100–A11, DKK1 a jejich fyziologickém i patofyziologickém významu.
Metastáza v lymfatických uzlinách je u pacientek s cervikálním karcinomem jedním z důležitých prognostických faktorů. Dalšími jsou stadium onemocnění, objem tumoru, stromální invaze, grading, histologický typ (špatná prognóza např. u neuroendokrinního karcinomu a clear cell karcinomu) a také poruchy imunity [2].
Sérový marker pro spinocelulární karcinom SCC-Ag je používán v klinické praxi. Je přítomen ve vysokých hladinách u 20–60 % pacientek s časným stadiem cervikálního karcinomu. Zvýšené hladiny SCC-Ag jsou přítomny u 64 % pacientek se spinocelulárním karcinomem a u 25 % pacientek s adenokarcinomem [23]. Sérová hladina SCC-Ag před léčbou je asociována s velikostí tumoru, stadiem onemocnění, hloubkou stromální invaze, invazí lymfovaskulárního prostoru i s postižením lymfatických uzlin. Se zvýšenými sérovými hladinami SCC-Ag bylo signifikantně asociováno postižení společných ilických a paraaortálních uzlin [5,6].
Dalšími používanými biomarkery u cervikálního karcinomu jsou antigen CA125, CA19–9 a CYFRA21–1 [7]. Zvýšené hladiny CA125 jsou asociovány s vyšším stadiem karcinomu hrdla děložního, a to u 42,6 % pacientek s adenokarcinomem a 18,9 % pacientek se spinocelulárním karcinomem [24]. Bylo zjištěno, že hladina CA125 je významně vyšší u pacientek s metastázami v pánevních a paraaortálních lymfatických uzlinách než u pacientek bez postižení lymfatických uzlin [25]. Bylo prokázáno, že vyšetřením sérové hladiny kombinace tumor markerů SCC-Ag, CEA a CA19–9 lze předpovědět pozitivní pánevní lymfatické uzliny a postižení parametrií u spinocelulárního karcinomu děložního hrdla [8]. Byla také prokázána korelace mezi sérovou hladinou CYFRA-21 a přítomností metastáz v lymfatických uzlinách u pacientek s karcinomem hrdla děložního [9].
Naše výsledky prokazují korelaci mezi zvýšením sérových hladin S100–A11 a AIF-1 a metastatickým postižením pánevních lymfatických uzlin, a mohou tedy být využity v predikci tohoto metastatického postižení.
Závěr
Proteiny S100–A11 a AIF-1 představují potenciální biomarkery u pacientek s karcinomem hrdla děložního. V naší studii jsme prokázali zvýšení sérové hladiny S100–A11 a AIF-1 u těchto pacientek v porovnání s kontrolní skupinou. Sérové hladiny S100–A11 a AIF-1 se dále u těchto pacientek významně zvyšují, pokud byly prokázány metastázy v lymfatických uzlinách.
Tumor markery hrají stále důležitější roli při detekci nádorových onemocnění. V současnosti užívané tumor markery u karcinomu hrdla děložního nejsou ideální, protože jim chybí silná specificita. Výzkum by se měl zaměřit na vývoj kombinačních panelů více biomarkerů, které by byly pro diagnostiku nejúčinnější.
Obdrženo/Submitted: 24. 11. 2020
Přijato/Accepted: 28. 12. 2020
MUDr. Martin Maděrka
Porodnicko-gynekologická klinika
LF UP a FN Olomouc
I. P. Pavlova 6
775 20 Olomouc
Zdroje
1. Bray F, Ferlay J, Soerjomataram I et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 2018; 68 (6): 394–424. doi: 10.3322/caac.21492.
2. Cibula D, Petruželka L et al. Onkogynekologie. Praha: Grada Publishing a. s. 2009 : 616.
3. ÚZIS ČR. [online]. Dostupné na: https: //www.uzis.cz/.
4. Tchagang AB, Tewfik AH, DeRycke MS et al. Early detection of ovarian cancer using group biomarkers. Mol Cancer Ther 2008; 7 (1): 27–37. doi: 10.1158/1535-7163.MCT-07-0565.
5. Lekskul N, Charakorn C, Lertkhachonsuk AA et al. The level of squamous cell carcinoma antigen and lymph node metastasis in locally advanced cervical cancer. Asian Pac J Cancer Prev 2015; 16 (11): 4719–4722. doi: 10.7314/apjcp.2015.16.11.4719.
6. Li D, Xu XX, Yan DD et al. Clinical significance of serum squamous cell carcinoma antigen in patients with early cervical squamous cell carcinoma. Zhonghua Zhong Liu Za Zhi 2019; 41 (5): 357–362. doi: 10.3760/cma.j.issn.0253-3766.2019.05.007.
7. Laengsri V, Kerdpin U, Plabplueng C et al. Cervical cancer markers: epigenetics and microRNAs. Lab Med 2018; 49 (2): 97–111. doi: 10.1093/labmed/lmx080.
8. Ikeda S, Yoshimura K, Onda T et al. Combination of squamous cell carcinoma-antigen, carcinoembryonic antigen, and carbohydrate antigen 19-9 predicts positive pelvic lymph nodes and parametrial involvement in early stage squamous cell carcinoma of the uterine cervix. J Obstet Gynaecol Res 2012; 38 (10): 1260–1265. doi: 10.1111/j.1447-0756.2012.01862.x.
9. Gaarenstroom KN, Bonfrer JM, Kenter GG et al. Clinical value of pretreatment serum Cyfra 21-1, tissue polypeptide antigen, and squamous cell carcinoma antigen levels in patients with cervical cancer. Cancer 1995; 76 (5): 807–813. doi: 10.1002/1097-0142 (19950901) 76 : 5<807:: aid-cncr2820760515>3.0.co; 2 - m.
10. Thim L, Wöldike HF, Nielsen PF et al. Characterization of human and rat intestinal trefoil factor produced in yeast. Biochemistry 1995; 34 (14): 4757–4764. doi: 10.1021/bi00014a033.
11. Lau WH, Pandey V, Kong X et al. Trefoil factor-3 (TFF3) stimulates de novo angiogenesis in mammary carcinoma both directly and indirectly via IL-8/CXCR2. PLoS One 2015; 10 (11): e0141947. doi: 10.1371/journal.pone.0141947.
12. Neubert D, Ondrová D, Hambálek J et al. Elevated levels of TFF3 in endometrial cancer patients. Ceska Gynekol 2018; 83 (2): 109–114.
13. Meyerhardt JA, Mangu PB, Flynn PJ et al. Follow-up care, surveillance protocol, and secondary prevention measures for survivors of colorectal cancer: American Society of Clinical Oncology clinical practice guideline endorsement. J Clin Oncol 2013; 31 (35): 4465–4470. doi: 10.1200/JCO.2013.50.7442.
14. Ducreux M, Cuhna AS, Caramella C et al. ESMO Guidelines Committee. Cancer of the pancreas: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2015; 26 (Suppl 5): v56–v68. doi: 10.1093/annonc/mdv295.
15. Molina R, Marrades RM, Augé JM et al. Assessment of a combined panel of six serum tumor markers for lung cancer. Am J Respir Crit Care Med 2016; 193 (4): 427–437. doi: 10.1164/rccm.201404-0603OC.
16. Maděrka M, Pilka R, Neubert D et al. New serum tumor markers S100, TFF3 and AIF-1 and their possible use in oncogynecology. Ceska Gynekol 2019; 84 (4): 303–308.
17. Niehrs C. Function and biological roles of the Dickkopf family of Wnt modulators. Oncogene 2006; 25 (57): 7469–7481. doi: 10.1038/sj.onc.1210054.
18. Niida A, Hiroko T, Kasai M et al. DKK1, a negative regulator of Wnt signaling, is a target of the beta-catenin/TCF pathway. Oncogene 2004; 23 (52): 8520–8526. doi: 10.1038/sj.onc.1207 892.
19. Glinka A, Wu W, Delius H et al. Dickkopf-1 is a member of a new family of secreted proteins and functions in head induction. Nature 1998; 391 (6665): 357–362. doi: 10.1038/34848.
20. Mukhopadhyay M, Shtrom S, Rodriguez-Esteban C et al. Dickkopf1 is required for embryonic head induction and limb morphogenesis in the mouse. Dev Cell 2001; 1 (3): 423–434. doi: 10.1016/s1534-5807 (01) 00041-7.
21. Schneider VA, Mercola M. Wnt antagonism initiates cardiogenesis in Xenopus laevis. Genes Dev 2001; 15 (3): 304–315. doi: 10.1101/gad.855601.
22. Polakis P. Wnt signaling and cancer. Genes Dev 2000; 14 (15): 1837–1851.
23. Kim BG. Squamous cell carcinoma antigen in cervical cancer and beyond. J Gynecol Oncol 2013; 24 (4): 291–292. doi: 10.3802/ jgo.2013.24.4.291.
24. He SM, Xing F, Sui H et al. Determination of CA-125 levels in the serum, cervical and vaginal secretions, and endometrium in Chinese women with precancerous disease or endometrial cancer. Med Sci Monit 2011; 17 (11): CR618–CR625. doi: 10.12659/msm.882046.
25. Kotowicz B, Fuksiewicz M, Kowalska M et al. The value of tumor marker and cytokine analysis for the assessment of regional lymph node status in cervical cancer patients. Int J Gynecol Cancer 2008; 18 (6): 1279–1284. doi: 10.1111/ j.1525-1438.2007.01176.x.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicína
Článek vyšel v časopiseČeská gynekologie
Nejčtenější tento týden
2021 Číslo 1- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Magnosolv a jeho využití v neurologii
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
-
Všechny články tohoto čísla
- Zvýšení sérových hladin S100–A11 a AIF-1 u pacientek s dysplazií děložního hrdla
- Zvýšení sérových hladin S100–A11 a AIF-1 u pacientek s karcinomem hrdla děložního a postižením lymfatických uzlin
- Kouření u žen s chronickým vaginálním diskomfortem není spojeno se sníženým výskytem Lactobacillus spp. ale podporuje nadměrný růst bakterií Mobiluncus a Gardnerella spp. – sekundární analýza dat z klinické studie zahrnující mikrobiální analýzu
- Kombinovaná peripartálna separácia symfýzy a sakroiliakálneho kĺbu
- Myomatóza děložních rudimentů u pacientky s Mayer-Rokitansky-Küster-Hauser syndromem
- Editorial
- Aktuální etické aspekty léčby absolutního uterinního faktoru neplodnosti pomocí transplantace dělohy
- Poruchy příjmu potravy v ambulanci gynekologa pro děti a dospívající
- Aspekty výběru embryí a jejich příprava pro vznik lidských embryonálních kmenových buněk určených k humánní terapii
- Nežádoucí účinky PARP inhibitorů
- 30. sympozium asistované reprodukce s mezinárodní účastí a 19. česko-slovenská konference reprodukční medicíny, 10.–11. listopadu 2020, Brno
- Osobní vzpomínka na MUDr. Karla Nouzu, DrSc.
- Česká gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Nežádoucí účinky PARP inhibitorů
- Kombinovaná peripartálna separácia symfýzy a sakroiliakálneho kĺbu
- Aspekty výběru embryí a jejich příprava pro vznik lidských embryonálních kmenových buněk určených k humánní terapii
- Poruchy příjmu potravy v ambulanci gynekologa pro děti a dospívající
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



