-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Novinky ve FIGO stagingu karcinomu ovaria, tuby a peritonea
Current FIGO staging classification for cancer of ovary, fallopian tube and peritoneum
Introduction:
Pelvic high-grade serous carcinomas (HGSCs) include carcinoma of ovary, fallopian tube, and peritoneum. Five-year survival, irrespective of the stage, is between 35–40%. Most patients are diagnosed in advanced stages of the disease. The new revised and expanded dualistic model of ovarian carcinogenesis shows that type II tumors are composed for the most part of high-grade serous ovarian carcinoma, carcinosarcoma, undifferentiated carcinoma and can be further subdivided into morphologic and molecular subtypes. Many type II carcinomas develop from STIC predominantly in the distal portion of the fallopian tube and it is very likely the point of the origin of a significant subset of the pelvic high-grade serous carcinomas.Objective:
To provide an overview of major changes in our understanding of the origin of ovarian cancer, that led to the revision of FIGO (International Federation of Gynecology and Obstetrics) classification and its unification for the ovary, fallopian tube and peritoneum. We summarize the new classification, main changes compared to the former one and their clinical impact.Methods:
For this review, we have used the results of studies and review articles on the subject published in English up to October 2016. They were identified through a search of literature using PubMed, MEDLINE-Ovid, Scopus and Cochrane Library with the keywords (“serous tubal intraepithelial carcinoma” or “high-grade serous ovarian carcinoma” or “FIGO ovarian cancer staging 2014”). We retrieved and assessed potentially relevant studies, and checked the reference lists of all papers of interest to identify additional relevant publications.Conclusion:
The origin of most cases of pelvic HGSC (carcinoma of ovary, the fallopian tube, and peritoneum) is expected in the fallopian tube epithelium. The main changes in the revised FIGO classification for extrauterine pelvic serous carcinomas were subdivision of stages IC, III and IV and elimination of the stage IIC, based on new knowledge and prognostic data. A prerequisite for the proper treatment of patients is to perform adequate surgical and pathological staging, including determining the grade of carcinoma. These factors, coupled with appropriately performed operation with zero postoperative residuum (R0), are the most important prognostic factors for patients with carcinoma of the ovary, fallopian tube, and peritoneum.Keywords:
staging, STIC, high-grade serous carcinoma
Autoři: I. Šišovská 1; Luboš Minář 2
; Michal Felsinger 2
; Matěj Anton 2
; Markéta Bednaříková 3
; J. Hausnerová 4; E. Jandáková 4; Vít Weinberger 2
Působiště autorů: Gynekologicko-porodnické oddělení Nemocnice Kyjov, primář MUDr. J. Maruška 1; Gynekologicko-porodnická klinika LF MU a FN, Brno, přednosta prof. MUDr. P. Ventruba, DrSc., MBA 2; Interní hematologická a onkologická klinika LF MU a FN, Brno, přednosta prof. MUDr. J. Mayer, CSc. 3; Ústav patologie LF MU a FN, Brno, přednosta doc. MUDr. L. Křen, Ph. D. 4
Vyšlo v časopise: Ceska Gynekol 2017; 82(3): 230-236
Souhrn
Úvod:
Pánevní high-grade serózní karcinomy (HGSCs) zahrnují karcinom ovaria, vejcovodu a peritonea. Pětileté přežití se bez ohledu na stadium nemoci pohybuje mezi 35–40 %. Většina pacientek je diagnostikována v pokročilých stadiích nemoci. Nový revidovaný a rozšířený dualistický model vzniku karcinomu ovaria ukazuje, že tumory typu II zahrnují většinu high grade serózních karcinomů, karcinosarkom, nediferencovaný karcinom a mohou být dále děleny na morfologické a molekulární subtypy. Mnoho karcinomů typu II se vyvíjí ze serózního tubárního intraepiteliálního karcinomu (STIC), dominantně v distální části vejcovodu, což je velmi pravděpodobné místo původu významné podskupiny high-grade pánevních serózních karcinomů.Cíl práce:
Podat přehled o hlavních změnách v chápání vzniku maligních ovariálních nádorů, které vedly k revizi FIGO (International Federation of Gynecology and Obstetrics) klasifikace a jejímu sjednocení pro nádory ovaria, vejcovodu a peritonea. Souhrnně prezentujeme novou klasifikaci, hlavní provedené změny oproti původní klasifikaci a jejich klinický dopad.Metodika:
Byly použity výsledky studií a přehledových článků s daným tématem publikovaných do října roku 2016, získaných vyhledáváním s použitím PubMed, MEDLINE-Ovid, Scopus a Cochrane Library pomocí klíčových slov („serous tubal intraepithelial carcinoma“ nebo „high-grade serous ovarian carcinoma“ nebo „FIGO ovarian cancer staging 2014“). Vyhledali jsme a vyhodnotili potenciálně relevantní publikace a prošli jejich referenční seznamy s cílem určit další vhodné studie a publikace.Závěr:
Původ většiny případů pánevního HGSC (karcinom ovaria, tuby a peritonea) se předpokládá v epitelu vejcovodu. Hlavními změnami v revidované FIGO klasifikaci extrauterinních pánevních serózních karcinomů bylo rozdělení stadií IC, III a IV, vynechání stadia IIC na základě nových poznatků a zpřesnění prognostických dat. Předpokladem pro správnou léčbu pacientek je adekvátní provedení chirurgického a patologického stagingu včetně určení grade karcinomu. Tyto faktory jsou spolu s operací provedenou s nulovým pooperačním reziduem (R0) nejzásadnějšími prognostickými faktory pro pacientky s karcinomem ovaria, tuby a peritonea.Klíčová slova:
staging, STIC, high-grade serózní karcinomÚVOD
Spektrum extrauterinních pánevních serózních karcinomů zahrnuje ovariální karcinom, primární peritoneální karcinom a karcinom vejcovodu [7]. Maligní nádory ovaria jsou pátým nejčastějším nádorovým onemocněním žen ve vyspělých zemích [18]. Pětileté přežití se bez ohledu na stadium nemoci pohybuje mezi 35–40 %. U většiny pacientek (75 %) je nemoc diagnostikována v pokročilých stadiích (III–IV) s pětiletým přežitím 5–25 %. Dokonce i při zjištění nemoci v časných stadiích je pětileté přežití u pánevních high-grade serózních karcinomů (HGSCs) pouze 60–85 % [2].
Maligní ovariální nádory jsou skupinou onemocnění, která se vzájemně liší morfologií i biologickým chováním. V 90 % se jedná o maligní epiteliální karcinom. Mnohem méně časté jsou nádory ze zárodečných buněk (dysgerminom, nádor ze žloutkového váčku, nezralý teratom, choriokarcinom, embryonální karcinom) a nádory z buněk stromatu a zárodečných pruhů (nádor z buněk granulózy, arhenoblastom, androblastom) [11, 18].
Staging pánevního HGSC (karcinom ovaria, tuby a peritonea) má dva hlavní cíle. Poskytuje standardní terminologii umožňující srovnání pacientek mezi jednotlivými centry a zařazení pacientek do prognostické skupiny vyžadující odpovídající léčbu. Původní FIGO klasifikace ovariálních malignit byla publikována v roce 1988 (Rio de Janeiro). Důvodem revize FIGO klasifikace v roce 2014 byly dvě zásadní změny v pohledu na ovariální maligní nádory.
První změnou byl poznatek, že epiteliální ovariální karcinom není jednotné onemocnění a na základě histopatologických, imunohistochemických a molekulárně-genetických analýz jej lze rozdělit do pěti hlavních typů: high-grade serózní karcinom (70 %), endometroidní (10 %), clear-cell (10 %), mucinózní (3 %) a low-grade serózní karcinom (5 %) [18]. Kurmanův dualistický model klasifikuje ovariální karcinomy do dvou odlišných skupin, které se liší biologickým chováním, odpovědí na léčbu a prognózou. Typ I (low-grade malignity) zahrnuje low-grade serózní karcinom, low-grade endometroidní karcinom, clear cell karcinom, karcinom z přechodných buněk a mucinózní karcinom. Typ II (high-grade malignity) zahrnuje high-grade serózní karcinom, high-grade endometroidní karcinom, karcinosarkom a nediferencovaný karcinom [14].
Druhým významným objevem ovlivňujícím současný přístup bylo poznání, že mnoho karcinomů typu II se vyvíjí ze serózního tubárního intraepiteliálního karcinomu (STIC), dominantně v distální části vejcovodu, což je velmi pravděpodobné místo původu významné podskupiny pánevních HGSCs [4, 15]. Stejný původ je pravděpodobný u některých tubárních a peritoneálních high-grade serózních karcinomů.
Vzhledem ke společnému původu a identické chirurgické a farmakologické léčbě těchto karcinomů byl v nové revizi sjednocen staging pro zhoubné nádory ovaria, vejcovodů a peritonea [19]. Nová FIGO klasifikace 2014 bere v úvahu nejvýznamnější prognostické parametry sdílené všemi typy nádorů. Histopatologická diagnóza je zásadně důležitá pro adekvátní staging, neboť různé histologické typy nádorů korespondují s různou odpovědí na léčbu.
PATOGENEZE HIGH-GRADE SERÓZNÍHO PÁNEVNÍHO KARCINOMU
Vznik HGSC nebyl dosud exaktně popsán a pochopen. Již v roce 1969 byly publikovány názory a teorie směřující k jeho možnému multifokálnímu původu, potenciálně i ve vejcovodu. Nedávno byla obecně přijata teorie serózního tubárního intraepiteliálního karcinomu (STIC) vycházející z hodnocení vzorků z profylaktické salpingo-ooforektomie u žen s mutací BRCA [3]. Podrobné imunohistochemické vyšetřování odhalilo u nositelek BRCA mutací vyšší incidenci okultního tubárního karcinomu než okultního ovariálního karcinomu [23]. STIC byl popsán také u pokročilého stadia sporadických HGSCs s ovariální nádorovou masou a ve vzácných případech primárního tubárního nebo peritoneálního HGSC bez zřejmého postižení ovarií [18]. Imunohistochemické znaky podporující diagnózu STIC jsou nadměrná nebo zcela chybějící exprese p53, zvýšení Ki-67 proliferačního indexu [12]. TP53 mutace přítomné u STIC i HGSC ukazují na jejich klonální vztah [19]. STIC má ve srovnání s paralelním odpovídajícím HGSC kratší telomery a zkrácení telomer je jedna z nejčasnějších molekulárních změn v karcinogenezi [13]. STIC není metastázováním ovariálního karcinomu, ale jeho tubární prekurzorovou lézí (rozdílné délky telomer mezi STIC a ovariálním karcinomem) [6]. Tyto skutečnosti jsou jádrem důkazů na podporu (ne potvrzení) tubární hypotézy HGSC [23].
Na druhé straně u low-grade ovariálních serózních karcinomů (LGSCs) se předpokládá postupný vývoj z histologicky rozpoznatelných prekurzorů, zejména z benigních serózních cystadenomů/adenofibromů (vznikajících z epiteliálních inkluzních cyst ovariálního povrchu) přes stadium borderline tumorů [7, 19]. Dualistický model připisuje vzniku high-grade a low-grade karcinomům různé genetické charakteristiky [16]. LGSCs jsou spojeny s KRAS a BRAF mutacemi a nesouvisejí s abnormalitami TP53 a BRCA [19].
FIGO STAGING KLASIFIKACE 2014 – KLÍČOVÉ ZMĚNY
Na základě uznání tubárního původu většiny extrauterinních pánevních serózních karcinomů, Mezinárodní federace gynekologů a porodníků FIGO v roce 2014 schválila a publikovala podstatné změny v původní chirurgické a patologické klasifikaci ovariálních maligních nádorů [18].
STADIUM I
Onemocnění stadia I je omezeno na vaječníky nebo vejcovody, případně jsou přítomny maligní buňky v ascitu či peritoneálním výplachu. Tumor limitovaný na jeden vaječník nebo jeden vejcovod je klasifikován jako stadium IA. Tumor limitovaný na oba vaječníky nebo vejcovody je klasifikován jako stadium IB. Onemocnění s přítomností nádorových buněk na povrchu vaječníku nebo vejcovodu, ruptura tumoru nebo přítomnost maligních buněk v ascitu či peritoneálním výplachu spadá do stadia IC [19]. Zásadní rozdíl oproti původní klasifikaci spočívá v konstatování, že vejcovod je pravděpodobným místem vzniku velké části pánevních HGSCs, a v novém rozdělení stadia IC (tab. 1). Mikroskopický rozsev nádoru mimo adnexa je dále dělen do stadií IC1 – iatrogenní ruptura tumoru, IC2 – ruptura pouzdra před chirurgickým zákrokem nebo přítomnost nádoru na povrchu vaječníku nebo vejcovodu, IC3 – maligní buňky v ascitu nebo peritoneálním výplachu [19].
Tab. 1. FIGO 2014 stage I karcinomu ovaria a tuby. Rozdíly mezi starou a novou klasifikací. 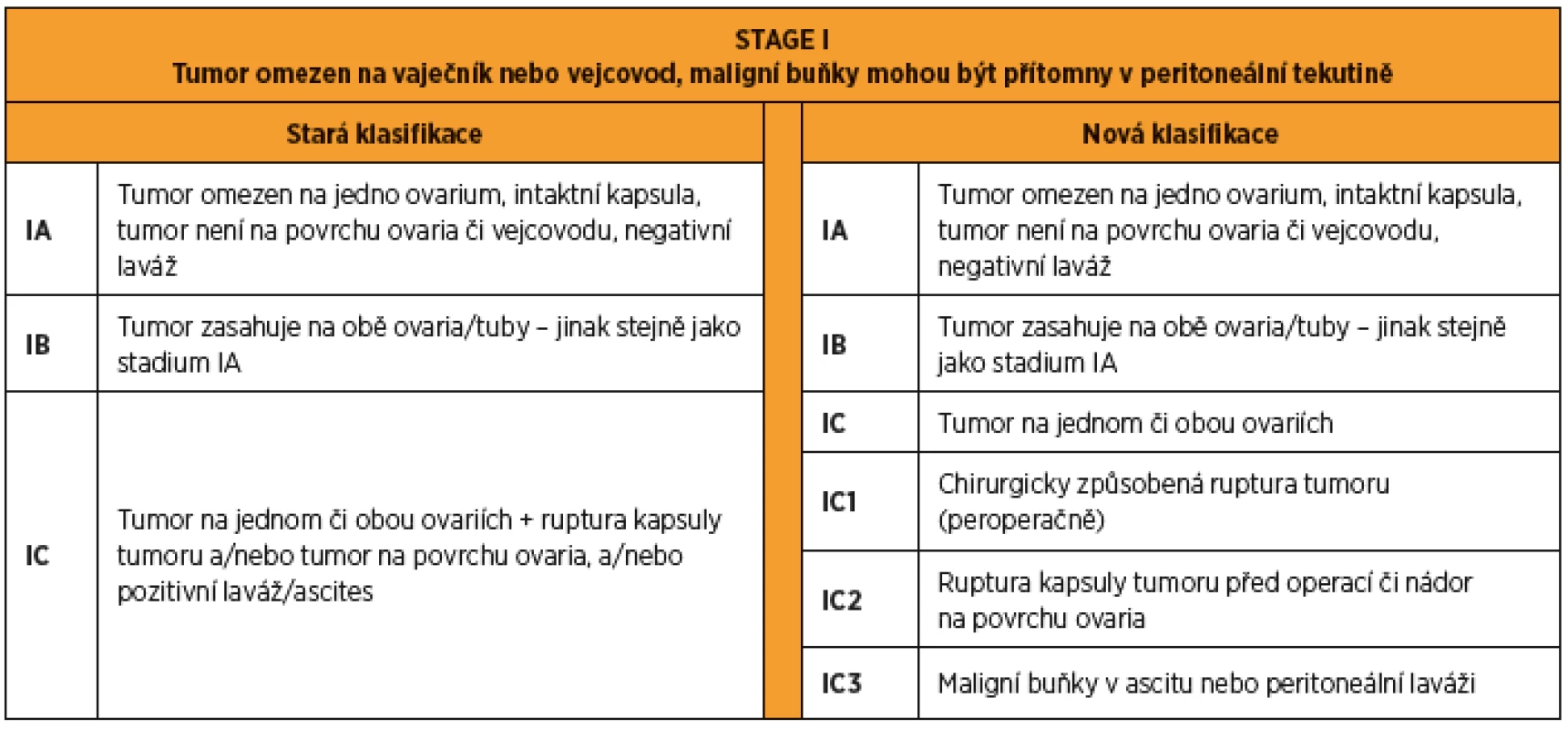
STADIUM II
Onemocnění omezené na malou pánev a pánevní peritoneum je klasifikováno jako stadium II bez ohledu na to, zda vychází z vaječníků, nebo vejcovodů. Makroskopicky patrné rozšíření a/nebo implantace nádoru na vejcovody a/nebo vaječníky a/nebo postižení dělohy je klasifikováno jako stadium IIA. Šíření na jiné pánevní orgány (tlusté střevo, močový měchýř) je klasifikováno jako stadium IIB. Všechna onemocnění stadia II jsou léčena adjuvantní chemoterapií, další dělení proto není nutné. V původní klasifikaci uváděné stadium IIC (IIA nebo IIB s maligními buňkami v ascitu či peritoneálním výplachu) bylo zhodnoceno jako nadbytečné a v nové klasifikaci bylo vynecháno (tab. 2). Klasifikace primárního peritoneálního karcinomu začíná od stadia II [18]. V případě postižení peritonea mimo malou pánev musí být onemocnění hodnoceno jako stadium III [19].
Tab. 2. FIGO 2014 stage II karcinomu ovaria, tuby a peritonea. Rozdíly mezi starou a novou klasifikací. 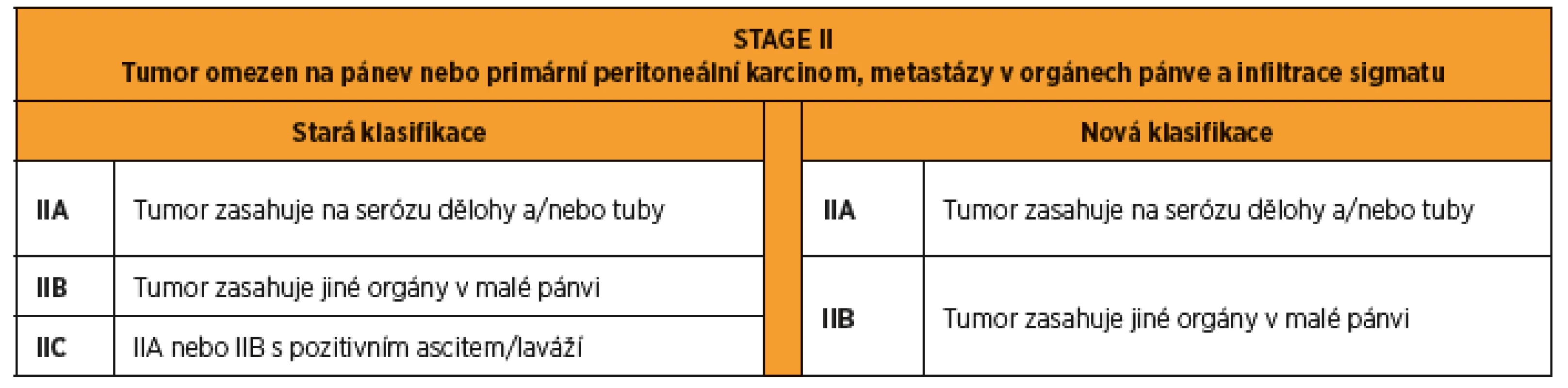
STADIUM III
Stadium III je největší skupinou pokročilých nádorů a zahrnuje tumory mimo pánev s postižením peritonea dutiny břišní, omenta, renální fascie, jaterního pouzdra, slezinného pouzdra (bez metastáz v parenchymu) a/nebo metastázy v lymfatických uzlinách [19] (tab. 3). Méně než 10 % ovariálních karcinomů se šíří mimo pánev samostatným postižením lymfatických uzlin bez postižení peritonea. Samostatné metastázování do retroperitoneálních lymfatických uzlin se řadí do stadia IIIA1 s dalším dělením na IIIA1(i) pro metastázy do 10 mm v největším rozměru a IIIA1(ii) pro metastázy větší než 10 mm [18]. Takové onemocnění má lepší prognózu, proto je nově klasifikováno jako IIIA1, a ne IIIC, jak tomu bylo dříve. Mikroskopické peritoneální postižení mimo malou pánev s/nebo bez pozitivních lymfatických uzlin je klasifikováno jako stadium IIIA2. Stadium IIIB zahrnuje makroskopické peritoneální metastázy mimo pánev o velikosti do 2 cm v největším rozměru. Jsou-li peritoneální metastázy mimo pánev větší než 2 cm, je onemocnění klasifikováno jako stadium IIIC [19].
Tab. 3. FIGO 2014 stage III karcinomu ovaria, tuby a peritonea. Rozdíly mezi starou a novou klasifikací. 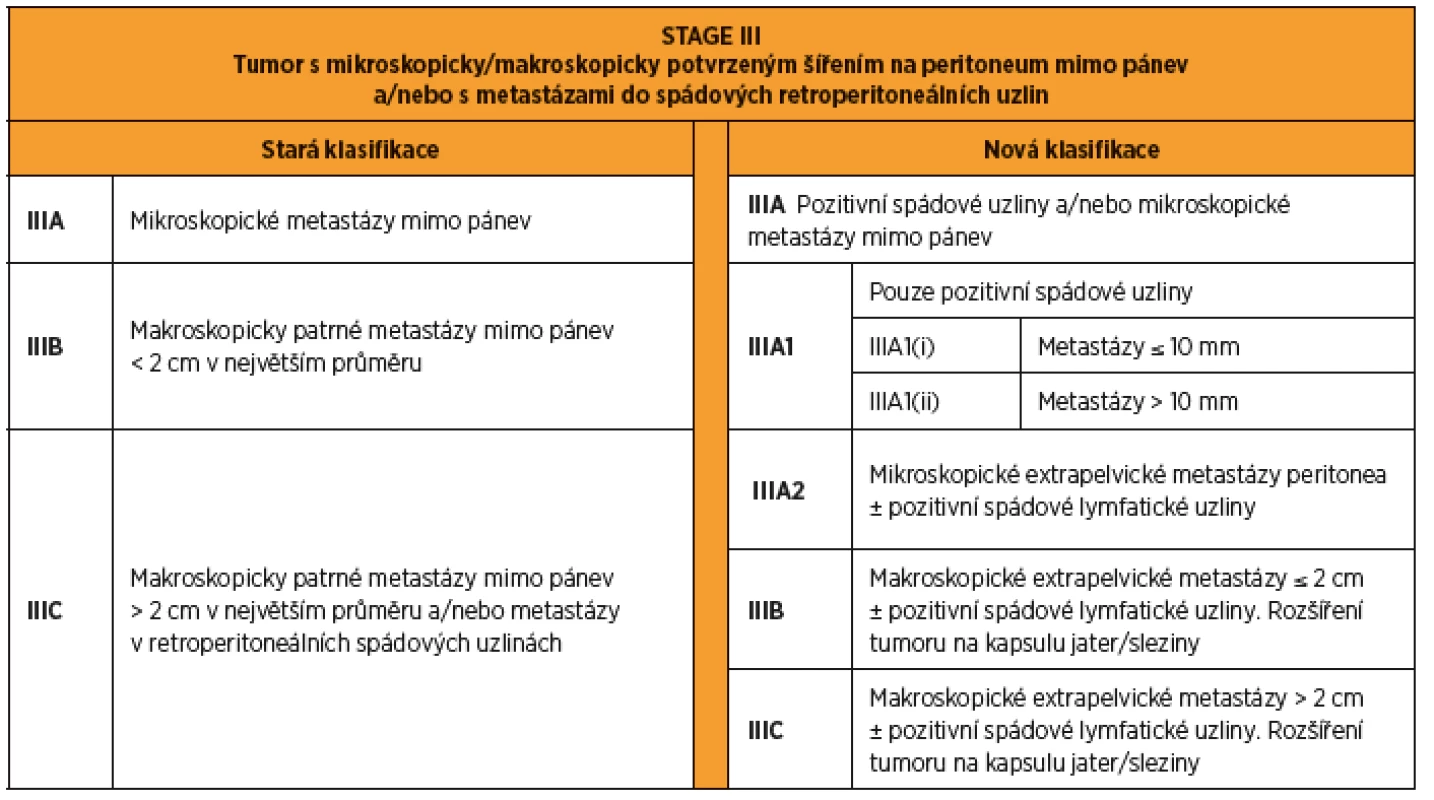
STADIUM IV
Stadium IV zahrnuje všechny tumory se vzdálenými metastázami s vyloučením peritoneálních, spadajících do stadia II a III (tab. 4). Stadium IV se nově dělí na stadium IVA, kam patří onemocnění projevující se maligním pleurálním výpotkem, a stadium IVB, do kterého řadíme parenchymatózní metastázy nebo extraabdominální metastázy (lymfatické uzliny mimo břišní dutinu, ingvinální lymfatické uzliny, tumory pupku a břišní stěny, střevní infiltráty s postižením sliznice) [19].
Tab. 4. FIGO 2014 stage IV karcinomu ovaria, tuby a peritonea. Rozdíly mezi starou a novou klasifikací. 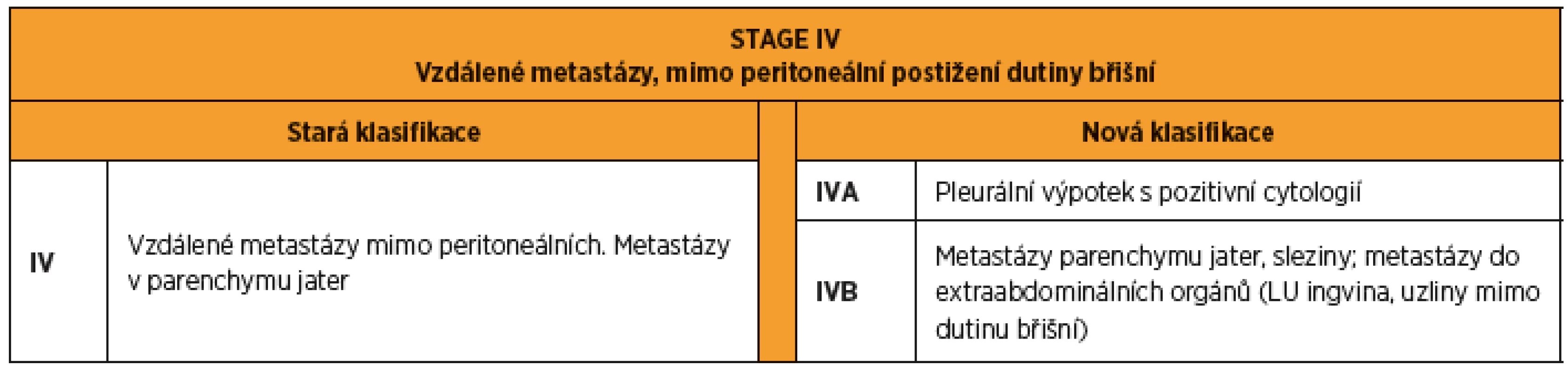
DISKUSE
Nejdůležitější změnou ve FIGO klasifikaci karcinomu ovaria z roku 2014 bylo přidání tumorů vycházejících z tuby a peritonea a sjednocení jejich stagingu. Pro účely nové FIGO klasifikace je nutné určit primární místo vzniku extrauterinních high-grade serózních karcinomů jako ovariální, tubární nebo primárně peritoneální [18]. V pokročilých stadiích onemocnění jsou prekurzorové léze často překryty, což znesnadňuje diagnostiku a správné zařazení původu tumoru. Zásadním krokem k určení původu tumoru je detailní vyšetření vejcovodu, kde se pravděpodobně ve velkém množství případů nachází prekurzorová léze či původní nádor. Doporučený postup histologického zpracování tub u HGSCs a nosiček mutace BRCA nazývaný SEE-FIM (Sectioning and Extensively Examining the Fimbriated end of the fallopian tube) umožňuje hodnocení největší možné plochy povrchu fimbrií pro nalezení přítomnosti STIC nebo počátečního HGSC [9, 20]. Přítomnost STIC bez invaze nebo extratubárního šíření by měla být klasifikována jako FIGO stadium IA tubárního karcinomu s vysvětlením, že není přítomen invazivní karcinom. STIC je schopen šíření a tvorby vzdálených metastáz, přestože se nejedná o invazivní nádor vejcovodu. Jako primárně tubární by měly být popsány všechny případy, kdy je STIC nalezen ve vejcovodu bez ohledu na množství tumoru na ovariu, peritoneu či v tubě. Případy s dominantním ovariálním postižením a identifikovatelným vejcovodem bez STIC by měly být klasifikovány jako primárně ovariální. Jako primárně peritoneální by měly být popsány případy s vyloučenou přítomností STIC nebo malého HGSC v tubě, kdy oba vaječníky jsou normální velikosti, postižení extraovariální je větší než postižení na povrchu kteréhokoliv ovaria [20].
Význam ruptury nádoru, jak spontánní, tak iatrogenní, není zcela jasný. Z některých studií vyplývá, že rozdělení stadia IC na tři subtypy v nové FIGO klasifikaci má svůj prognostický význam, ale dosud bez reálného terapeutického dopadu [8, 21, 22]. Některé studie odhalily, že perioperační ruptura pouzdra zvyšuje riziko recidivy onemocnění. Vergote et al. prezentovali, že ruptura nádoru během chirurgického zákroku a před ním má nezávislý nepříznivý vliv na přežití bez příznaků nemoci [22]. Suh et al. ve své retrospektivní studii došli k výsledku, že pětileté přežití pacientek stadia IC1 bylo podobné jako u stadia IA, a bylo tedy jasně vyšší než u pacientek stadia IC3 [21]. Naopak Kim et al. v nedávné metaanalýze neprokázal, že by iatrogenní ruptura tumoru ovlivnila prognózu pacientek v časném stadiu onemocnění [1, 5, 8, 10]. Stupeň diferenciace byl v několika analýzách tumorů stadia I identifikován jako nejsilnější prognostický indikátor přežití bez příznaků onemocnění. Stadium I u primárního peritoneálního karcinomu neexistuje [18].
Stadium II je relativně vzácné. Pro revidované stadium II Paik et al. a Suh et al. nepotvrdili výhody v lepší předpovědi prognózy pacientek. Klinicky je těžké rozlišit stadium IIA od stadia IIB, neboť seróza vejcovodu, dělohy a vaječníků tvoří kontinuum pánevního peritonea. Časté jsou případy, kdy vzhledem k závažným srůstům nelze zcela vyloučit peritoneální postižení, přestože není histologicky prokázáno. Podle závěrů těchto studií jsou pro dosažení statisticky významných výsledků potřebné další studie s početnější populací a bude nutné porovnat výsledky celkového přežití pacientek ve stadiu II s časným stadiem III [17, 21]. Jistě je rozdíl v biologickém chování tumoru, který se šíří per continuitatem od toho, který skokově metastázuje, což ale nová klasifikace nezohledňuje. Některé práce ukazují na fakt, že peritoneum je anatomická jednotka a postižení pánevního či extrapelvického peritonea je prognosticky podobné. Navrhují definovat všechny případy s postižením peritonea (včetně děložní serózy) jako stadium III. Na druhou stranu ale existují jasné rozdíly v délce přežití mezi případy s pánevním a extrapelvickým rozsevem choroby [18].
HGSCs jsou většinou diagnostikovány ve stadiu IIIC a tyto tumory se typicky šíří po peritoneálních površích – omentum, mezenterium, střeva, parakolický prostor vpravo, bránice, povrch jater a sleziny [19]. Důležitou otázkou původního stadia IIIC je rozdíl v prognóze mezi onemocněním s intraabdominálními metastázami a onemocněním s izolovaným postižením retroperitoneálních lymfatických uzlin. Paik et al. prokázali jasnou výhodu v přežití pro stadium IIIA1 a IIIA2 oproti stadiu IIIC v revidované FIGO klasifikaci [17]. Jedním z přijatelných vysvětlení může být vyšší míra cytoredukce ve srovnání se stadiem IIIC s intraperitoneálními metastázami ve větší velikosti než 2 cm. Suh et al. ukázali, že optimální cytoredukce byla nezávislým prognostickým faktorem pro celkové přežití pacientek ve stadiu IIIC [21]. Kontroverzní je nastaveví cut-off hladiny velikosti metastáz 1 cm mezi stadii IIIA1(i) a IIIA1(ii) a rovněž diskutabilní je rozměr 2 cm k odlišení stadií IIIB od IIIC. Někteří autoři navrhují rozdělit stadium IIIB a IIIC na mikroskopické a makroskopické postižení peritonea [18].
Onemocnění stadia IV může být více heterogenní skupinou, než se předpokládalo. Retrospektivní studie demonstrovaly významné rozdíly v celkovém přežití mezi pacientkami stadia IV s metastázami pouze v supraklavikulárních lymfatických uzlinách a pacientkami s jinými formami vzdálených metastáz [17, 21]. Metastáza v pupku je řazena do stadia IVB, ačkoli se někteří autoři domnívají, že svým původem (postižení peritonea v reziduu urachu) a prognózou by měla být řazena do stadia IIIC [18].
ZÁVĚR
Nová revize FIGO klasifikace 2014 sjednotila staging karcinomu ovaria, vejcovodu a primárního peritoneálního karcinomu na základě přijetí STIC teorie jejich převážně společného původu. Hlavními změnami v revidované FIGO klasifikaci extrauterinních pánevních serózních karcinomů bylo rozdělení stadií IC, III a IV a vynechání stadia IIC na základě nových poznatků a zpřesnění prognostických dat. Předpokladem pro správnou léčbu pacientek je adekvátní provedení chirurgického a patologického stagingu včetně určení gradu karcinomu. Tyto faktory jsou spolu s adekvátně provedenou operací s nulovým pooperačním reziduem (R0) nejzásadnějšími prognostickými faktory pro pacientky s karcinomem ovaria, tuby a peritonea.
Korespondující autor
MUDr. Vít Weinberger, Ph.D.
Gynekologicko-porodnická klinika
LF MU a FN
Obilní trh 11
602 00 Brno
e-mail: vit.weinberger@gmail.com
Zdroje
1. Bakkum-Gamez, JN., Richardson, DL., Seamon, LG., et al. Influence of intraoperative capsule rupture on outcomes in stage I epithelial ovarian cancer. Obstet Gynecol, 2009, 113, p. 11–17.
2. Bolton, KL., Chenevix-Trench, G., Goh, C., et al. Association between BRCA1 and BRCA2 mutations and survival in women with invasive epithelial ovarian cancer. JAMA, 2012, 307(4), p. 382–390.
3. Crum, CP., Drapkin, R., Kindelberger, D., et al. Lessons from BRCA: the tubal fimbria emerges as an origin for pelvic serous cancer. Clin Med Res, 2007, 5, 1, p. 35–44.
4. Crum, CP., Drapkin, R., Miron, A., et al. The distal fallopian tube: a new model for pelvic serous carcinogenesis. Curr Opin Obstet Gynecol, 2007, 19(1), p. 3–9.
5. Goude, CS., Li, Z., Downs, LS. Jr. The influence of intraoperative tumor rupture on recurrence risk in stage IC epithelial ovarian cancer. Eur J Gynaecol Oncol, 2009, 30, p. 25–28.
6. Chene, G., Rahimi, K., Mes-Masson, AM., Provencher, D. Surgical implications of the potential new tubal pathway for ovarian carcinogenesis. J Minim Invasive Gynecol, 2013, 20, 2, p. 153–159.
7. Katabathina, VS., Amanullah, FS., Menias, CO., et al. Extrauterine pelvic serous carcinomas: current update on pathology and cross-sectional imaging findings. RadioGraphics, 2016, 36, 3, p. 918–932.
8. Kim, HS., Ahn, JH., Chung, HH., et al. Impact of intraoperative rupture of the ovarian capsule on prognosis in patients with early-stage epithelial ovarian cancer: a meta-analysis. Eur J Surg Oncol, 2013, 39, p. 279–289.
9. Kindelberger, DW., Lee, Y., Miron, A., et al. Intraepithelial carcinoma of the fimbria and pelvic serous carcinoma: evidence for a causal relationship. Am J Surg Pathol, 2007, 31, p. 161–169.
10. Kodama, S., Kase, H., Tanaka, K., Matsui, K. Multivariate analysis of prognostic factors in patients with endometrial cancer. Int J Gynaecol Obstet, 1996, 53, p. 23–30.
11. Kolařík, D., Halaška, M., Feyereisl, J. Repetitorium gynekologie. Praha: Maxdorf, 2008, s. 794–818.
12. Kuhn, E., Kurman, RJ., Soslow, RA., et al. The diagnostic and biological implications of laminin expression in serous tubal intraepithelial carcinoma. Am J Surg Pathol, 2012, 36(12), p. 1826–1834.
13. Kuhn, E., Meeker, A., Wang, TL., et al. Shortened telomeres in serous tubal intraepithelial carcinoma: an early event in ovarian highgrade serous carcinogenesis. Am J Surg Pathol, 2010, 34(6), p. 829–836.
14. Kurman, RJ., Shih, IM. Molecular pathogenesis and extraovarian origin of epithelial ovarian cancer: shifting the paradigm. Hum Pathol, 2011, 42(7), p. 918–931.
15. Morrison, JC., Blanco, LZ., Vang, R., Ronnett, BM. Incidental serous tubal intraepithelial carcinoma and early invasive serous carcinoma in the nonprophylactic setting: analysis of a case series. Am J Surg Pathol, 2015, 39(4), p. 442–453.
16. Ning, G., Bijron, JG., Yamamoto, Y., et al. The PAX2-null immunophenotype defines multiple lineages with common expression signatures in benign and neoplastic oviductal epithelium. J Pathol, 2014, 234(4), p. 478–487.
17. Paik, ES., Lee, Y-Y., Lee, E-J., et al. Survival analysis of revised 2013 FIGO staging classification of epithelial ovarian cancer and comparison with previous FIGO staging classification. Obstet Gynecol Sci, 2015, 58(2), p. 124–134.
18. Prat, J., FIGO Committee on Gynecologic Oncology. Staging classification for cancer of the ovary, fallopian tube, and peritoneum. Int J Gynaecol Obstet, 2014, 124, 1, p. 1–5.
19. Saida, T., Tanaka, YO., Matsumoto, K., et al. Revised FIGO staging system for cancer of the ovary, fallopian tube, and peritoneum: important implications for radiologists. Radiology, 2016, 34, p. 117–124.
20. Singh, N., Gilks, CB., Wilkinson, N., McCluggage, WG. Assignment of primary site in high-grade serous tubal, ovarian and peritoneal carcinoma: a proposal. Histopathology, 2014.
21. Suh, DH., Kim, TH., Kim, J-W., et al. Improvements to the FIGO staging for ovarian cancer: reconsideration of lymphatic spread and intraoperative tumor rupture. J Gynecol Oncol, 2013, 24, 4, p. 352–358.
22. Vergote, I., De Brabanter, J., Fyles, A., et al. Prognostic importance of degree of differentiation and cyst rupture in stage I invasive epithelial ovarian carcinoma. Lancet, 2001, 357, p. 176–182.
23. Weinberger, V., Bednarikova, M., Cibula, D., Zikan, M. Serous tubal intraepithelial carcinoma (STIC) – clinical impact and management. Expert Rev Anticancer Ther, 2016, 16(12), p. 1311–1321.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicína
Článek vyšel v časopiseČeská gynekologie
Nejčtenější tento týden
2017 Číslo 3- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
-
Všechny články tohoto čísla
- Analýza případů monochoriálních dvojčat porozených v Ústavu pro péči o matku a dítě ve čtyřletém období (2012–2015)
- Vzácné formy feto-fetální transfuze v klinické praxi
- Komplikace vyplývající z neposkytnutí relevantních klinických údajů patologovi vyšetřujícímu placenty
- HELLP syndrom vyžadující plazmaferézu pro rozvoj multiorgánové dysfunkce s dominující encefalopatií, respirační a renální insuficiencí
- Dva roky metody medikamentózního ukončení gravidity ve Slezské nemocnici v Opavě, úspěšnost a poznatky
- Význam materského mikrobiómu v tehotnosti
- Ultrazvukový staging časných stadií karcinomu endometria, analýza vlastního souboru za období let 2012–2016
- Agresivní angiomyxom – kazuistika
- Novinky ve FIGO stagingu karcinomu ovaria, tuby a peritonea
- Hirsutismus
- Komplikace vaginálních tahuprostých páskových operací
-
První česko-slovenský diskusní den na téma reprodukce –zpráva ze sympozia
Bratislava 16. 2. 2017 -
Recenze knihy
The Psychological Context of Labour Pain
- Česká gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Komplikace vaginálních tahuprostých páskových operací
- Novinky ve FIGO stagingu karcinomu ovaria, tuby a peritonea
- Hirsutismus
- Analýza případů monochoriálních dvojčat porozených v Ústavu pro péči o matku a dítě ve čtyřletém období (2012–2015)
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



