-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Úloha interleukinu 6 v patogenezi a léčbě Castlemanovy choroby – pohled imunologa
The role of interleukin 6 in the pathogenesis and therapy of Castleman disease – an immunologist's perspective
Castleman disease (CD) is a heterogeneous group of diseases characterized by lymphadenopathy and systemic inflammatory manifestations. CD can be divided into uni - (UCD) and multicentric form (MCD) according to the disease extent. MCD is usually accompanied by the features of a systemic inflammatory response including fever, weight loss, hepatosplenomegaly, ascites, and edema. In these patients, we can also observe elevation of inflammatory parameters and anemia within the laboratory assessment. Based on etiological nature, the CD can be further divided into human herpesvirus-8-associated (HHV8-associated) and idiopathic form. Interleukin 6 (IL-6) plays a central role in the disease pathogenesis. Inhibition of IL-6 has been shown to be an effective treatment modality. Currently, siltuximab, a chimeric monoclonal antibody targeting IL-6, is the only approved treatment for MCD. Its short-term and long-term efficacy and safety have been demonstrated in a few clinical studies.
Keywords:
interleukin 6 – Castleman disease – siltuximab – TAFRO – POEMS – HHV-8
Autoři: Tomáš Milota; Zuzana Střížová; Marta Sobotková; Jiřina Bartůňková
Působiště autorů: Ústav imunologie 2. LF UK a FN Motol, Praha
Vyšlo v časopise: Čas. Lék. čes. 2023; 162: 106-111
Kategorie: Přehledový článek
Souhrn
Castlemanova choroba (CD) je heterogenní skupinou onemocnění charakterizovanou především lymfadenopatií a systémovými zánětlivými projevy. Podle rozsahu rozdělujeme její formu na unicentrickou (UCD) a multicentrickou (MCD). MCD je obvykle doprovázena projevy systémové zánětlivé odpovědi zahrnujícími horečku, váhový úbytek, hepatosplenomegalii, ascites a otoky. V laboratorních nálezech se vyskytují elevace zánětlivých parametrů nebo anémie. Etiologicky může být rozvoj choroby spojený s lidským herpesvirem 8 (HHV-8) nebo se může jednat o idiopatickou formu.
Centrální úlohu v patogenezi hraje interleukin 6 (IL-6). Inhibice IL-6 se ukázala jako účinná léčebná modalita. V současnosti je siltuximab, chimerická monoklonální protilátka cílená proti IL-6, jediným schváleným léčebným přípravkem indikovaným k léčbě MCD. Jeho krátkodobá i dlouhodobá účinnost a bezpečnost byly potvrzeny řadou klinických studií.
Klíčová slova:
interleukin 6 – Castlemanova choroba – siltuximab – TAFRO – POEMS – HHV-8
ÚVOD
Castlemanova choroba (CD) je heterogenní skupina lymfoproliferativních onemocnění zahrnující několik klinicko-patologických jednotek. Onemocnění bylo popsáno lékaři Castlemanem a Townem v roce 1954 u pacienta s expanzí v mediastinu (1).
Základní dělení zahrnuje unicentrickou a multicentrickou formu. Zatímco unicentrická forma (UCD) postihuje jednu lymfatickou uzlinu, pro multicentrickou (MCD) je charakteristická generalizovaná lymfadenopatie doprovázená projevy systémové zánětlivé odpovědi. MCD pak zahrnuje subtyp asociovaný s infekcí virem HHV-8 a idiopatický (iMCD). Incidence UCD se pohybuje kolem 5 případů na 1 milion obyvatel, multicentrické pak kolem 16/1 milion (2). Vyskytuje se převážně u mladších jedinců (3.–4. dekáda), multicentrická forma se může vyskytnout v jakémkoliv věku. Subtyp asociovaný s infekcí HHV-8 nalézáme obvykle u imunokompromitovaných pacientů a velmi často je spojený také s infekcí HIV (3).
Histologicky lze rozdělit CD na hypervaskulární typ (dříve označovaný také jako hyalinně-vaskulární) charakteristický pro unicentrickou formu a plazmocelulární nebo smíšený, který častěji nalézáme u multicentrických forem (4). Obraz MCD se ale vyskytuje také u syndromů TAFRO (trombocytopenie, anasarka, horečka, retikulinová fibróza kostní dřeně / renální insuficience, organomegalie) a POEMS (polyneuropatie, organomegalie, endokrinopatie, monoklonální gamapatie, kožní změny). Odlišit jednotlivé typy je zcela zásadní pro určení prognózy a volbu správné léčby (obr. 1).
Obr. 1. Formy Castlemanovy choroby 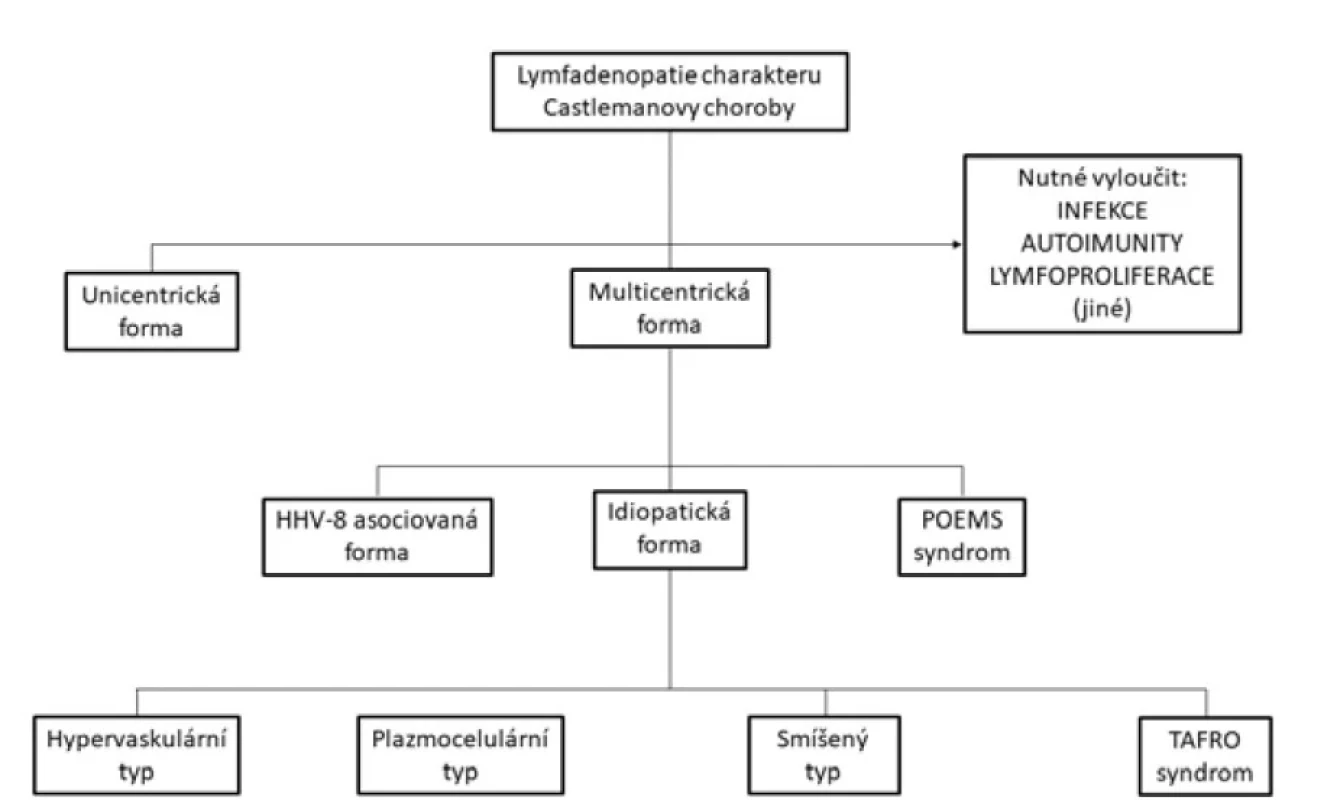
KLINICKÝ OBRAZ
UCD je obvykle asymptomatická, případně její projevy souvisejí s útlakem okolních struktur. Systémové projevy jsou u této varianty vzácné, nacházíme je především u multicentrické (5, 6). Zahrnují hlavně nespecifické projevy, jako jsou horečky, únava, noční pocení, váhový úbytek, hepatosplenomegalie, ascites a otoky, které mají až charakter anasarky. Laboratorně nalézáme známky zánětu se zvýšenou hladinou C-reaktivního proteinu (CRP) a sedimentací erytrocytů (FW), anémii, trombocytózu (u syndromu TAFRO je ale přítomna spíše trombocytopenie, viz dále) a známky renálního postižení. Z imunologických parametrů dochází k rozvoji hypergammaglobulinémie (typicky ve třídách IgG a IgA), elevaci hladiny interleukinu 6 (IL-6), solubilního receptoru pro IL-2 a vaskulárního endotelového růstového faktoru (VEGF). Nejvýznamnější klinické a laboratorní známky CD jsou zahrnuty do doporučených diagnostických kritérií (tab. 1) (7).
Tab. 1. Diagnostická kritéria multicentrické formy Castlemanovy choroby (7) 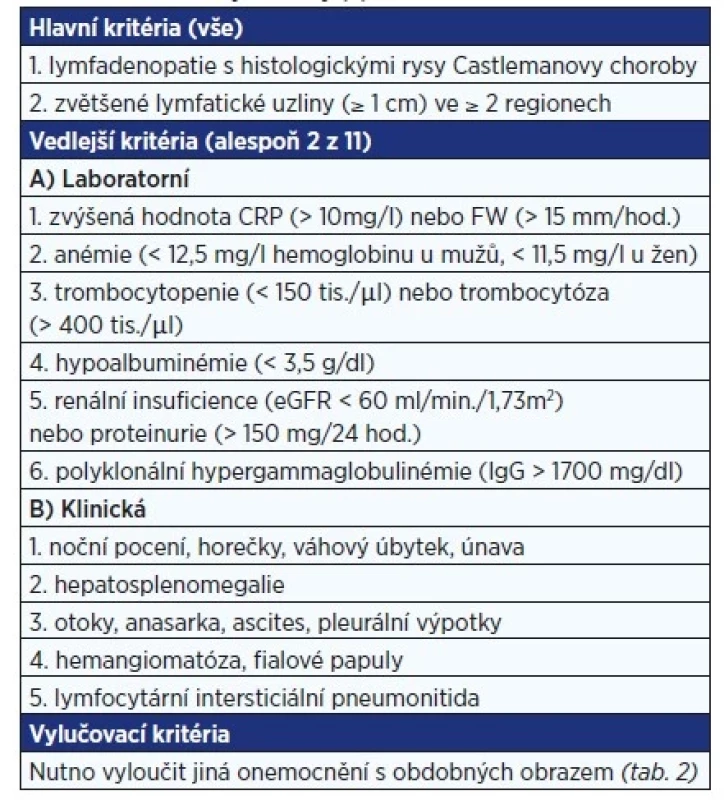
V rámci komplexního vyšetření pátráme také po přítomnosti HHV-8, který je zodpovědný za rozvoj odlišné multicentrické varianty. Za subvariantu idiopatické MCD je považován tzv. Syndrom TAFRO, patřící k HHV-8-negativní variantě, který je charakterizovaný trombocytopenií, anasarkou, horečkou, organomegalií a myelofibrózou. Ve srovnání s idiopatickou variantou bývá absence hypergammaglobulinémie a elevace koncentrace alkalické fosfatázy. Syndrom TAFRO má obvykle agresivnější průběh, vyšší mortalitu a je refrakterní k léčbě systémovými kortikosteroidy (8). Obdobný rozsah postižení jako MCD může doprovázet i syndrom POEMS, který je ale považován za paraneoplazii. Navíc dochází k rozvoji demyelinizační polyneuropatie (charakteru CIDP), organomegalii, monoklonální gamapatii (obvykle typu λ) a kožní změny. Z ostatních symptomů se vyskytují edém papily očního nervu, otoky, osteosklerotické kostní léze, abnormální plicní funkce. Laboratorně nacházíme trombocytózu, erytrocytózu a elevaci hodnoty VEGF (9).
Pro stanovení diagnózy je ale nutné vyloučit jiná onemocnění, imitující obraz iMCD, který zahrnuje spektrum infekcí, autoimunitních, autoinflamatorních a lymfoproliferativních chorob nebo vrozených poruch imunity (tab. 2).
Tab. 2. Diferenciální diagnostika multicentrické formy Castlemanovy choroby (HHV-8, HIV, EBV) (7) 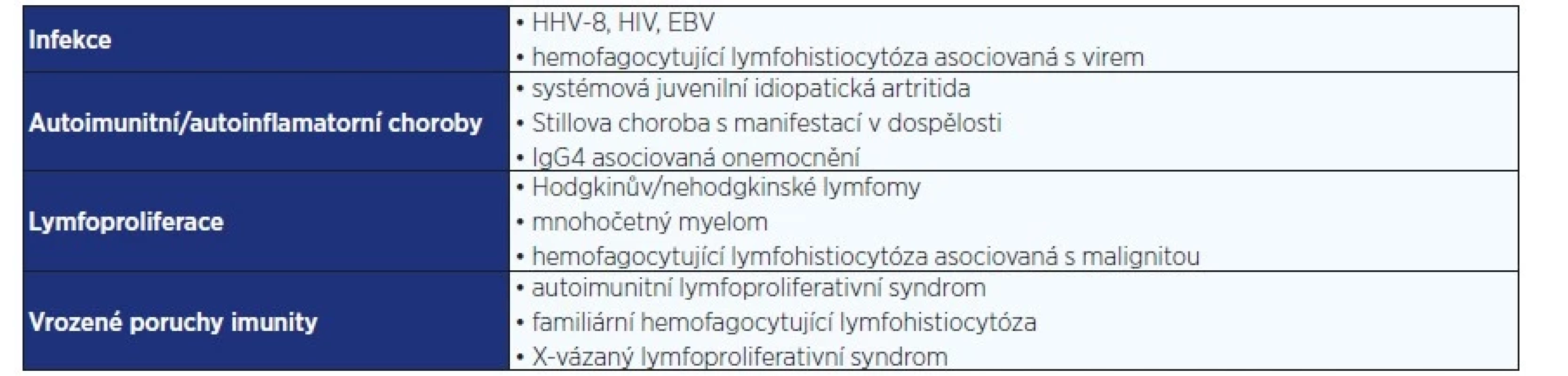
Zcela zásadní roli v patogenezi MCD, a to i v případě HHV-8 asociovaných variant, hraje IL-6. HHV-8 je schopen po infikování lymfatických uzlin replikace v plazmablastech, kde probíhá také transkripce virových homologů IL-6. K produkci cytokinů, včetně samotného IL-6, dochází i v rámci imunitní reakce. IL-6 je ale zodpovědný za klinické projevy i u HHV-8 negativních forem, i když jeho zvýšené hladiny nemusejí být detekovatelné a přibližně polovina pacientů neodpovídá na jeho inhibici. Mechanismus účinku IL-6 u buněk imunitního systému je shrnutý na obr. 2.
Obr. 2. Vazba IL-6 na receptor IL-6Rα/gp130 (A, klasická cesta aktivace) nebo přes solubilní IL-6Rα (B, trans-signalizace), aktivace signální dráhy, (C) Ras-Raf-MEK-MAPK (proteinové kinázy aktivované mitogenem), (D) PI3K (fosfoinositid 3-kináza)-AKT (proteinkináza B), (E) NF-kB (nukleární faktor kappa B), (F) STAT3 (převodník signálu a aktivátor transkripce 3) vedoucí k aktivaci efektorových mechanismů buněk imunitního systému a prozánětlivé odpovědi (10) 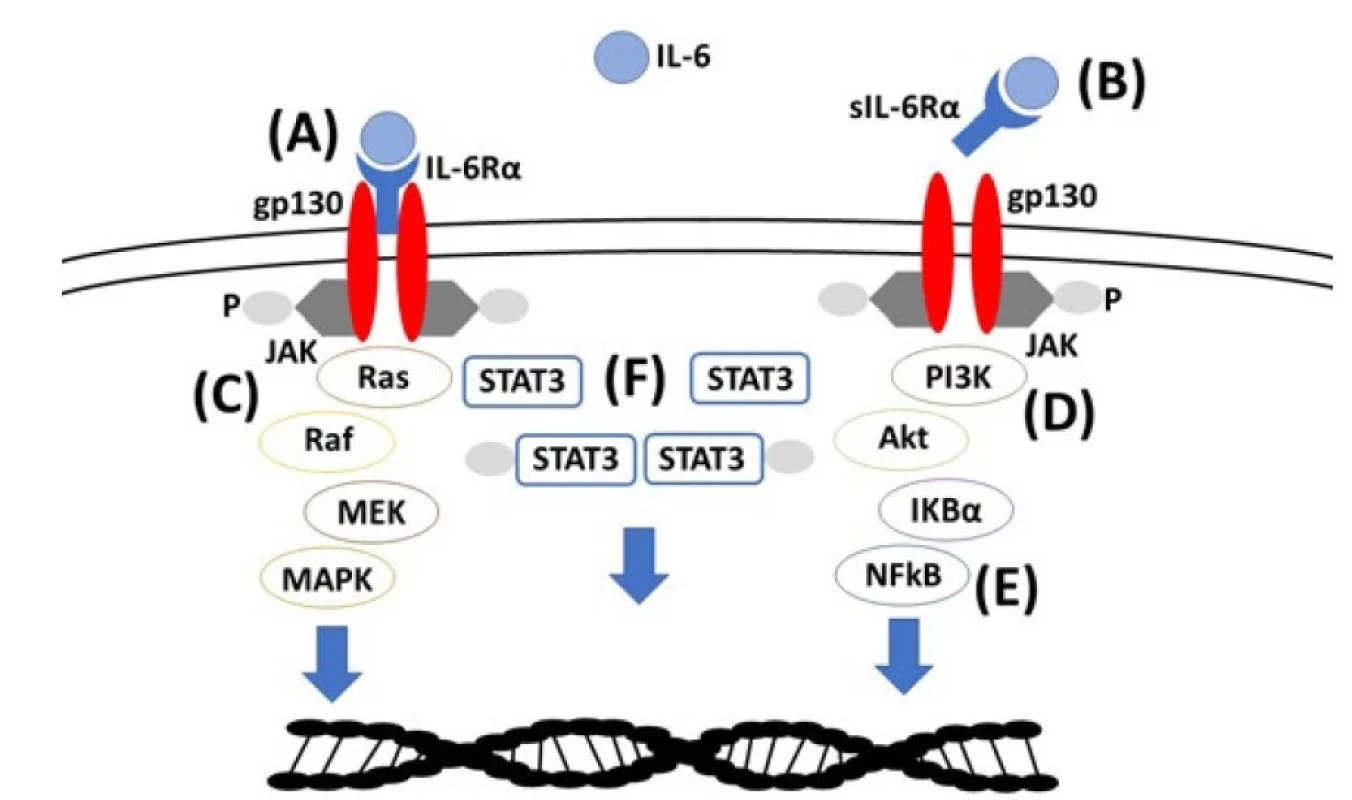
Z dalších faktorů dochází také k elevaci hladiny VEGF, především u syndromu POEMS. Etiologie zvýšené koncentrace IL-6 u idiopatických forem MCD je nejasná. U iMCD se zdá vliv virových infekcí málo pravděpodobný. Diskutován je podíl autoimunity, autoprotilátky jsou detekovány u přibližně 1/4 pacientů s iMCD. U významného procenta pacientů byly také nalezeny polymorfismy receptoru pro IL-6. Existují ale také důkazy pro neoplastickou etiologii se zvýšeným rizikem hematologických malignit a klinicko-patologickou podobností s Hodgkinovými lymfomy a myelofibrózou. Monoklonální plazmatické buňky pak patří k obrazu syndromu POEMS (4).
IL-6 je prozánětlivý cytokin s pleiotropními účinky, produkují ho buňky vrozené imunity – monocyty a makrofágy. Mimo CD byla dysregulovaná produkce IL-6 popsána u celé řady chronických zánětlivých stavů a autoinflamatorních či autoimunitních chorob. Jeho hlavní účinky představují produkce reaktantů akutní fáze (CRP, sérový amyloid A, fibrinogen, transferrin, apod.), podílí se na maturaci B lymfocytů a stimuluje syntézu a sekreci imunoglobulinů. Spolu s dalšími cytokiny se podílí také na diferenciaci odlišných subpopulací pomocných T lymfocytů (CD4+, TH). IL-6 také umožňuje vývoje folikulárních pomocných T lymfocytů, které produkují IL-21 – klíčový cytokin pro maturaci B lymfocytů v germinálních centrech periferních lymfatických orgánů. IL-6 a TGF-β zajišťují diferenciaci směrem k TH17 lymfocytů, omezením dostupnosti TGF-β snižují i zastoupení regulačních T lymfocytů s inhibičními a imunosupresivními vlastnostmi. IL-6 ovlivňuje ale také řadu buněk mimo imunitní systém (hepatocyty, osteoklasty, keratinocyty, fibroblasty). Rovněž podporuje tvorbu VEGF, který se podílí na angiogenezi a zvýšené vaskulární permeabilitě (obr. 3) (11, 12).
Obr. 3. Účinky interleukinu 6 (IL-6) a jejich vztah k projevům multicentrické formy Castlemanovy choroby (11, 12) 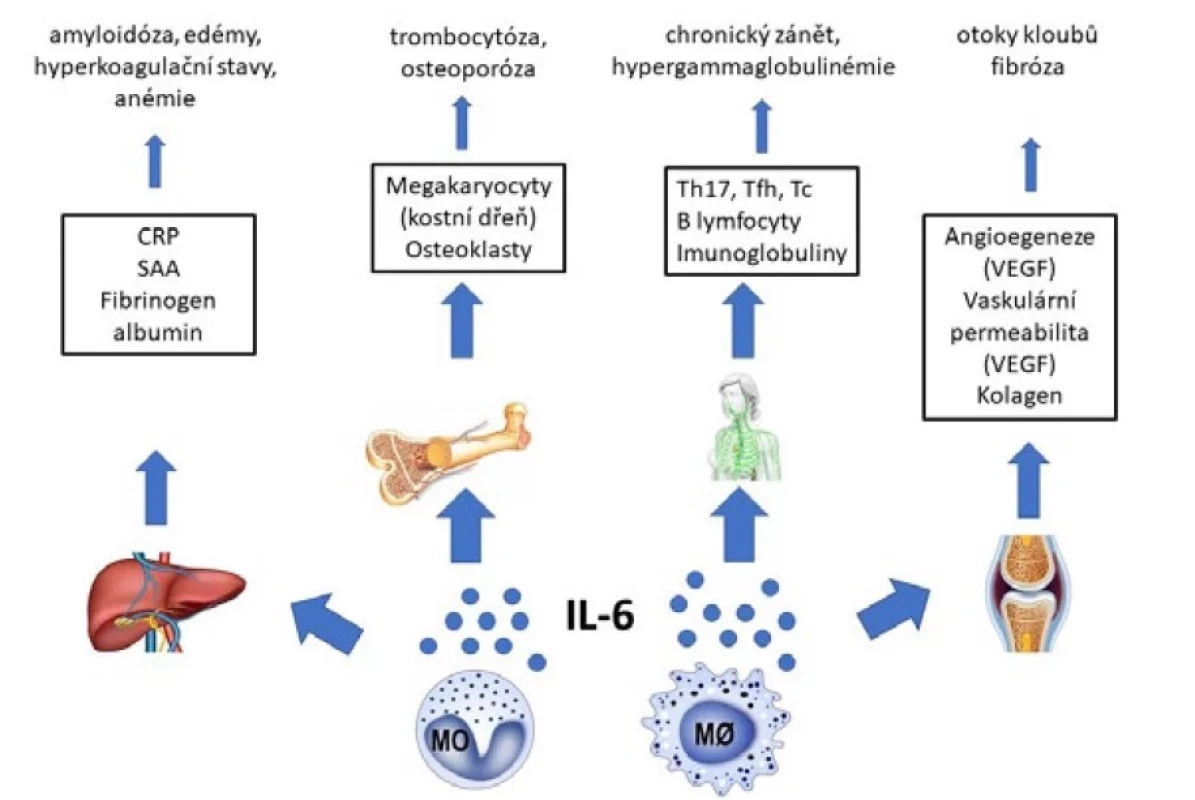
LÉČBA
Operativní řešení hraje klíčovou roli v léčbě UCD. V případě nemožnosti resekce záleží na přítomnosti systémových projevů zánětu. Pokud se UCD manifestuje pouze známkami komprese lokálních struktur, zahajuje se obvykle terapie rituximabem (monoklonální protilátka anti-CD20) s, nebo bez kortikoterapie. Anti-IL-6 léčba se zahajuje v případě projevů systémového zánětu, který je ale typičtější pro iMCD (6).
Strategie léčby závisí na závažnosti CD, která se obvykle určuje na základě klasifikace CDCN (Castleman Disease Collaborative Network) (tab. 3) (4). U závažných forem se terapie zahajuje podáním inhibitorů IL-6 – siltuximabu (kategorie evidence 1) nebo tocilizumabu spolu s vysokými dávkami kortikosteroidů (kategorie evidence 2A). Při selhání této strategie by mělo být zvažováno podání kombinované chemoterapie. U méně závažného průběhu by mělo být preferováno podání anti-IL-6 léčby, alternativou je podání rituximabu (kategorie evidence 2B). U iniciálních fázích léčby by měly být přidány kortikoidy. Alternativně lze u non-respondérů podat jiná imunomodulační léčiva (thalidomid, cyklosporin A, sirolimus, anakinra, bortezomib) (13). Tato doporučení jsou reflektována i v „Léčebných postupech v hematologii“ vydaných Českou hematologickou společností ČLS JEP (14).
Tab. 3. Klasifikace CDCN závažnosti Castlemanovy choroby
(ECOG PS, eGFR) (4)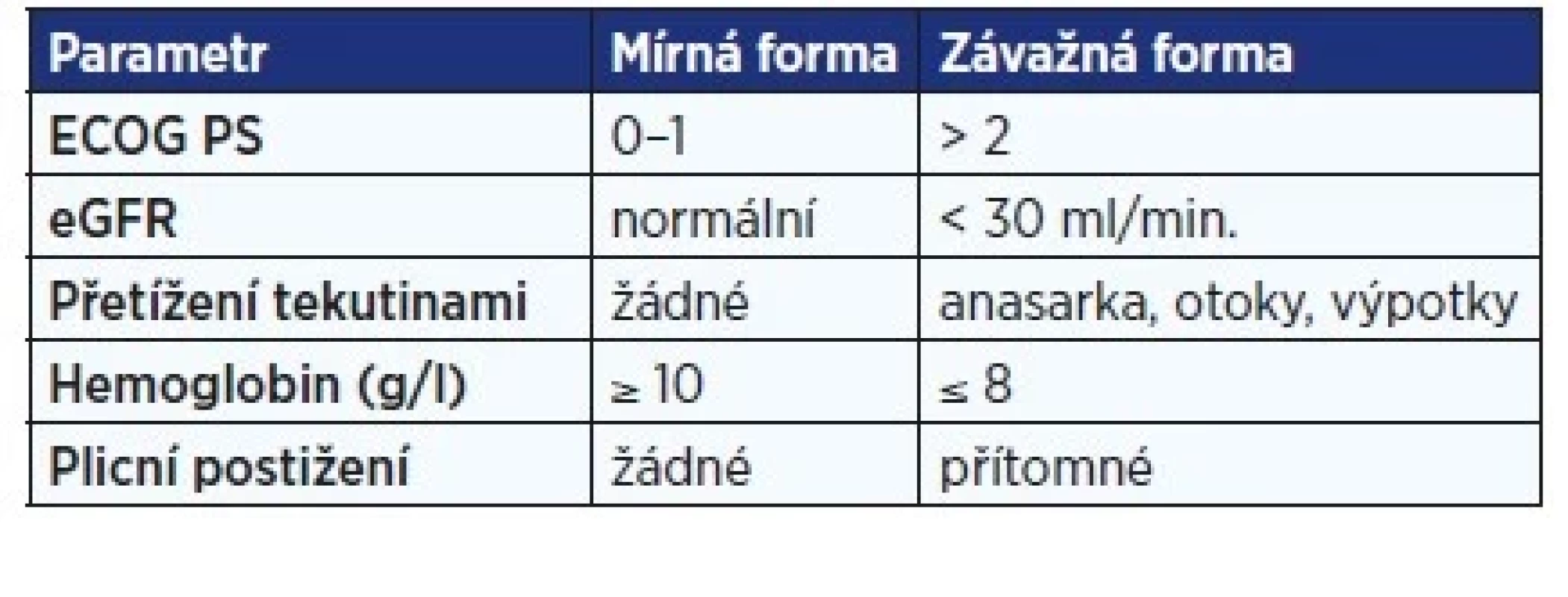
Siltuximab
Siltuximab je chimerická (lidská/myší) monoklonální protilátka podtřídy IgG1 cílená přímo proti IL-6. V roce 2014 van Rhee et al. prezentovali výsledky randomizované dvojitě zaslepené placebem kontrolované studie, do které bylo zahrnuto celkem 79 pacientů (53 s aktivní léčbou, 26 s placebem) se všemi histologickými podtypy a přítomností nejméně 3 symptomů. Parciální nebo úplné remise bylo dosaženo u 34 % (n = 18). K ústupu systémových projevů došlo u 57 % (n = 30), zmenšení rozsahu lymfadenopatie pak u 51 % (n = 20). Průměrná doba od zahájení léčby do odpovědi byla 170 (u symptomů), respektive 155 dnů (u lymfadenopatie). Průměrná doba přetrvávání odpovědi pak byla 383 dnů (232–676). Významné zlepšení nastalo u sledovaných laboratorních parametrů (CRP, FW, koncentrace fibrinogenu, albuminu a hemoglobinu). Roční přežití v aktivně léčené skupině bylo 100 %, v placebové pak 92 %. Z bezpečnostního hlediska došlo k rozvoji závažných nežádoucích příhod (NP) u 23 % (n = 12) pacientů. Mezi nejčastěji uváděné NP patřily pruritus, makulopapulózní exantém, váhový přírůstek, infekce horních cest dýchacích a lokalizované otoky. Z laboratorních abnormalit se nejčastěji objevovaly poruchy krvetvorby (trombocytopenie, anémie, neutropenie). NP spojené s ukončením léčby souvisely s aktivitou základního onemocnění, respektive selháním terapie. V souvislosti s léčbou nedošlo k žádnému úmrtí (15).
Příznivý efekt siltuximabu v terapii MCD byl potvrzen i v rozsáhlém systematickém přehledu, do kterého bylo zahrnuto celkem 161 pacientů (58 % mužů, 42 % žen) s průměrným věkem 56,8 let (18–78). U většiny (88,8 %, n = 143) byla diagnostikována idiopatická forma. Terapie siltuximabem byla obvykle zahajována po selhání konvenční léčby zahrnující systémovou kortikoterapii, rituximab, cyklofosfamid, thalidomid, chirurgickou intervenci, radioterapii i autologní transplantaci krvetvorných buněk. Průměrná doba sledování pacientů na léčbě činila 39 měsíců (10,5–64,7). Během této doby došlo k pouhým 2 úmrtím. Léčba siltuximabem vedla k úplné remisi u 85,5 % pacientů (47 z 55), u kterých byl tento údaj dostupný, k parciální remisi pak u 12,7 % (7 z 55). Interval 5letého přežití byl dosažen u 96,4 % pacientů ve srovnání s 55–75 % u tradičních léčebných metod udávaných v dostupné literatuře. Současně léčba siltuximabem zvyšuje i kvalitu života pacientů, což je doprovázeno hlavně ústupem únavy a bolesti (16).
Léčba siltuximabem je spojena také s příznivým bezpečnostním profilem. Analýza ze 2 klinických hodnocení fáze II sledovala výskyt NP v kohortě 60 pacientů s iMCD po dobu 6 let (medián). Nežádoucí příhody se stupněm závažnosti ≥ 3 byly popsány u 60 % z nich (36 ze 60). Mezi nejčastější se řadily arteriální hypertenze (13 %; 8 z 60), únava (8 %; 5 z 60), nauzea (7 %; 4 z 60), neutropenie (7 %; 4 z 60), zvracení (5 %; 3 z 60). Necelá polovina pacientů (42 %; 25 z 60) rozvinula NP hodnocenou jako závažnou, nejčastěji se jednalo o infekční komplikaci (13 %; 8 z 60). V souvislosti s léčbou nedošlo k žádnému úmrtí (17).
Prediktory klinické odpovědi na léčbu
Prediktory klinické odpovědi byly hodnoceny v kohortě 53 pacientů zařazených do klinického hodnocení fáze II. Celkem bylo hodnoceno 38 parametrů. Nejvýznamnější markery v predikci odpovědi na terapii představovaly v době před zahájením léčby hodnoty albuminu, CRP, fibrinogenu, hemoglobinu, imunoglobulinu A a G, sérové hladiny sodíku a triglyceridů (tab. 3) (18). Přestože skupiny respondérů a non-respondérů se významně nelišily v hladině IL-6, úloha tohoto cytokinu byla reflektována ve vztahu k ostatním parametrům. IL-6 ovlivňuje produkci reaktantů akutní fáze, jako jsou CRP, fibrinogen či hepcidin, jeden z hlavních regulátorů metabolismu železa (19). Zvýšené hodnoty hepcidinu vedou ke snížení jeho dostupnosti a nedostatečné tvorby hemoglobinu s následným rozvojem anémie (20). IL-6 je také důležitý pro správnou funkci B lymfocytů, kde působí jako potentní růstový faktor, zajišťuje diferenciaci plazmatických buněk a podporuje produkci IgA a IgG (21). Výsledky studie tak naznačují, že blokáda IL-6 je účinnější u pacientů s laboratorně vyjádřenými IL-6 asociovanými abnormalitami.
ZÁVĚR
Castlemanova choroba je heterogenní skupinou onemocnění, která je charakterizovaná lymfadenopatií a systémovou zánětlivou odpovědí. Ta bývá častější u multicentrických forem. Klíčovým patofyziologickým procesem je nadprodukce IL-6, kterou můžeme ovlivnit řadou léčivých přípravků, jako je tocilizumab či siltuximab. Siltuximab je v současnosti jediný léčivý přípravek se schválenou indikací k terapii idiopatické formy multicentrické Castlemanovy choroby. Ve srovnání s ostatními léčebnými přístupy prokázal účinnost a příznivý bezpečnostní profil i při dlouhodobém podávání, a to v řadě klinických studií.
Čestné prohlášení
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Seznam použitých zkratek
CD Castlemanova choroba
CDCN Castleman Disease Collaborative Network
CIDP chronická zánětlivá demyelinizační polyneuropatie (chronic inflammatory demyelinating polyneuropathy)
CRP C-reaktivní protein
EBV virus Epsteina a Barrové
ECOG PS výkonnostní stav dle ECOG (Eastern Cooperative Oncology Group)
eGFR odhadovaná glomerulární filtrace
FW sedimentace erytrocytů (Fahræusova-Westergrenova metoda)
HHV lidský herpesvirus
HIV virus lidské imunodeficience
IL interleukin
MCD, UCD multicentrická (unicentrická) forma Castlemanovy choroby
POEMS polyneuropatie, organomegalie, endokrinopatie, monoklonální gamapatie, kožní změny (syndrom)
TAFRO trombocytopenie, anasarka, horečka, retikulinová fibróza kostní dřeně/renální insuficience, organomegalie (syndrom)
TGF transformující růstový faktor
TH pomocný T lymfocyt
VEGF vaskulární endotelový růstový faktor
Adresa pro korespondenci:
MUDr. Tomáš Milota, Ph.D.
Ústav imunologie 2. LF UK a FN Motol
V Úvalu 84, 150 06 Praha 5
Tel.: 224 435 961
e-mail: tomas.milota@fnmotol.cz
Zdroje
- Cabot RC, Castleman B, Towne VW. Case 40351. Case records of the Massachusetts General Hospital. N Engl J Med 1954; 251 : 396–400.
- Simpson D. Epidemiology of Castleman disease. Hematol Oncol Clin North Am 2018; 32 : 1–10.
- Cronin DMP, Warnke RA. Castleman disease: an update on classification and the spectrum of associated lesions. Adv Anat Pathol 2009; 16 : 236–246.
- Dispenzieri A, Fajgenbaum DC. Overview of Castleman disease. Blood 2020; 135 : 1353–1364.
- Wong RSM. Unicentric Castleman Disease. Hematol Oncol Clin North Am 2018; 32 : 65–73.
- van Rhee F, Oksenhendler E, Srkalovic G et al. International evidence-based consensus diagnostic and treatment guidelines for unicentric Castleman disease. Blood Adv 2020; 4 : 6039–6050.
- Fajgenbaum DC, Uldrick TS, Bagg A et al. International, evidence-based consensus diagnostic criteria for HHV-8-negative/idiopathic multicentric Castleman disease. Blood 2017; 129 : 1646–1657.
- Sakashita K, Murata K, Takamori M. TAFRO syndrome: current perspectives. J Blood Med 2018; 9 : 15–23.
- Dispenzieri A. POEMS syndrome: 2021 update on diagnosis, risk-stratification, and management. Am J Hematol 2021; 96 : 872–888.
- Luo Y, Zheng SG. Hall of fame among pro-inflammatory cytokines: Interleukin-6 gene and its transcriptional regulation mechanisms. Front Immunol 2016; 7 : 604.
- Kaur S, Bansal Y, Kumar R, Bansal G. A panoramic review of IL-6: structure, pathophysiological roles and inhibitors. Bioorg Med Chem 2020; 28 : 115327.
- Tanaka T, Narazaki M, Kishimoto T. Il-6 in inflammation, immunity, and disease. Cold Spring Harb Perspect Biol 2014; 6: a016295.
- van Rhee F, Voorhees P, Dispenzieri A et al. International, evidence-based consensus treatment guidelines for idiopathic multicentric Castleman disease. Blood 2018; 132 : 2115–2124.
- Doubek M, Mayer J (eds.). Léčebné postupy v hematologii – aktualizace 2022. Česká hematologická společnost ČLS JEP 2022 : 416–438.
- van Rhee F, Wong RS, Munshi N et al. Siltuximab for multicentric Castleman disease: A randomised, double-blind, placebo-controlled trial. Lancet Oncol 2014; 15 : 966–974.
- Sitenga J, Aird G, Ahmed A, Silberstein PT. Impact of siltuximab on patient-related outcomes in multicentric Castleman disease. Patient Relat Outcome Meas 2018; 57 : 1149–1156.
- van Rhee F, Casper C, Voorhees PM et al. Long-term safety of siltuximab in patients with idiopathic multicentric Castleman disease: a prespecified, open-label, extension analysis of two trials. Lancet Haematol 2020; 7: e209–e217.
- Morra DE, Pierson SK, Shilling D et al. Predictors of response to anti-IL6 monoclonal antibody therapy (siltuximab) in idiopathic multicentric Castleman disease: secondary analyses of phase II clinical trial data. Br J Haematol 2019; 184 : 232–241.
- Castell JV, Gómez-Lechón MJ, David M et al. Interleukin-6 is the major regulator of acute phase protein synthesis in adult human hepatocytes. FEBS Lett 1989; 242 : 237–239.
- Vadhan-Raj S, Zhou X, Bueso-Ramos CE et al. Interleukin-6, hepcidin, and other biomarkers in anemia of chronic disease (ACD) and chemotherapy-induced anemia (CIA): potential therapeutic targets. Blood 2012; 120 : 2086.
- Kishimoto T. IL-6: from its discovery to clinical applications. Int Immunol 2010; 22 : 347–352.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
2023 Číslo 2-3- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- S MUDr. Štěpánem Budkou o rizicích obezity pro fertilitu ze všech úhlů pohledu
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
-
Všechny články tohoto čísla
- Minnesotská škála tabákových abstinenčních příznaků, revize 2020, validizované české znění
- Úloha interleukinu 6 v patogenezi a léčbě Castlemanovy choroby – pohled imunologa
- Hepatocelulární karcinom a multiplicitní primární neoplazie a jejich asociace s diabetem mellitem 2. typu
- Chirurgická drenáž, její začátky a kde jsme dnes
- Kdo byl Plénies?
- Purkyňova cena udělena profesoru Janu Švihovcovi
- Za docentkou Jarmilou Večerkovou
- ÚVODEM
- EDITORIAL
- Sezónní a týdenní výkyvy v užívání alkoholu v Česku
- Zdravotní aspekty chování obyvatel Česka v době pandemie COVID-19 z pohledu veřejného zdraví
- Cesta k datům: Stanoviska a doporučení pro poskytování zdravotních dat pro sekundární využití
- Společnost vstřícná životu s demencí (dementia-friendly community) a její implikace ve zdravotnictví
- Zkušenosti lékařů s interkulturními rozdíly v komunikaci s ukrajinskými uprchlíky v době rusko-ukrajinského ozbrojeného konfliktu
- Proměny úrovně zdravotní gramotnosti v Česku mezi lety 2015 a 2020
- Efektivizace systému nemocniční péče v Česku prostřednictvím dobrovolnické činnosti
- Zdravotnické systémy v zrcadle mezinárodních srovnání
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Sezónní a týdenní výkyvy v užívání alkoholu v Česku
- Zkušenosti lékařů s interkulturními rozdíly v komunikaci s ukrajinskými uprchlíky v době rusko-ukrajinského ozbrojeného konfliktu
- Proměny úrovně zdravotní gramotnosti v Česku mezi lety 2015 a 2020
- Zdravotnické systémy v zrcadle mezinárodních srovnání
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



