-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaStatiny a játra
Statins and liver
Statins are widely accepted hypolipidemics that work by inhibiting hydroxymethylglutaryl coenzyme A reductase and thereby inhibiting cholesterol synthesis. They significantly reduce cardiovascular risk. Their use could be associated with side effects, which are serious only in rare cases. However, an unhealthy lifestyle, obesity, and elevation of blood lipids do not only damage the cardiovascular system. The current topic not only in hepatology is non-alcoholic fatty liver disease – NAFLD. The aim of this article is, among others, to draw attention to the pleiotropic effects of statins, which could be used in the treatment of this disease in the future. Recent studies have suggested that the administration of statins to patients with NAFLD is beneficial.
Keywords:
NAFLD – statins – hepatopathy
Autoři: Jiří Hlušička 1; Mahak Arora 2; Radan Brůha 1; Aleš Žák 1
Působiště autorů: 4. interní klinika – klinika gastroenterologie a hepatologie 1. LF UK a VFN v Praze 1; Farmakologický ústav 1. LF UK a VFN v Praze 2
Vyšlo v časopise: Čas. Lék. čes. 2022; 161: 80-83
Kategorie: Přehledový článek
Souhrn
Statiny jsou všeobecně uznávaná hypolipidemika, která v důsledku inhibice reduktázy hydroxymetylglutaryl koenzymu A inhibují syntézu. Významně snižují kardiovaskulární riziko. S jejich užíváním se pojí i nežádoucí účinky, které bývají závažné jen ve vzácných případech. Nezdravý životní styl, obezita, elevace krevních lipidů však nepoškozuje pouze kardiovaskulární aparát. Aktuálním tématem vnitřního lékařství je nealkoholové ztukovatění jater (NAFLD). Jsou uvedeny pleiotropní účinky statinů, které by v budoucnu mohly být využity v terapii tohoto onemocnění. Poslední studie naznačují, že podávání statinů u pacientů s NAFLD je výhodné.
Klíčová slova:
NAFLD – statiny – hepatopatie
ÚVOD
Cholesterol je syntetizován na membránách endoplazmatického retikula a v cytoplazmě buněk všech lidských tkání – nejvíce v buňkách jater, střev, kůry nadledvin, reprodukčních orgánů. Játra mohou vyprodukovat až 70 % celkového cholesterolu v těle, pokud toho však játra nejsou schopna, hladina cholesterolu klesá (1).
Biosyntéza cholesterolu začíná ve všech buňkách kondenzační reakcí dvou molekul acetyl koenzymu za vzniku hydroxymetylglutaryl koenzymu A (HMG-CoA). Účinkem reduktázy HMG-CoA (HMGCR) je HMG-CoA přeměněn na mevalonát, což je v syntéze cholesterolu prvním krokem. Mevalonát dále prochází řadou reakcí, na jejichž konci je cholesterol (2). Hepatocyty reagují na pokles koncentrace cholesterolu, což aktivuje proteázy, které vytlačují proteiny vázající sterolový regulační element z endoplazmatického retikula. To podporuje genovou expresi a translokaci LDL receptorů z jádra na buněčný povrch pro příjem LDL a jeho prekurzorů (2).
Statiny jsou heterogenní skupinou látek, které kompetitivně inhibují reduktázu HMG-CoA. Snížení intracelulární koncentrace cholesterolu v játrech zvyšuje expresi LDL receptorů, která ústí ve zvýšené vychytávání LDL a dalších lipoproteinů obsahujících apolipoprotein (apo) B (IDL, malé VLDL). Statiny jsou léky, které prokázaly účinnost při snižování mortality a morbidity v primárně i sekundárně preventivních studiích, v populacích s vysokým i nízkým rizikem, u obou pohlaví, ve všech věkových kategoriích dospělých (2, 3).
INDIKACE A ÚČINKY STATINŮ
Aterosklerotická kardiovaskulární onemocnění (ASKVO) jsou celosvětově jednou z hlavních příčin morbidity a mortality. Významné riziko ASKVO představuje hyperlipidémie (HLP). Pacienti s hyperlipidémií mají minimálně dvojnásobné kardiovaskulární riziko ve srovnání s pacienty bez HLP (4). Publikována byla řada velkých studií s klinicky prokázanými účinky statinů (5, 6). Metaanalýza zahrnující celkem 26 randomizovaných studií a 170 tisíc participantů prokázala u subjektů léčených různými statiny, že pokles LDL cholesterolu (LDL-c) o 2,16 mmol/l celkově odpovídá 24% snížení rizik spojených s ASKVO. Největší snížení LDL-c bylo pozorováno u rosuvastatinu, atorvastatinu a pitavastatinu. Simvastatin a lovastatin dosáhly mírnějšího snížení hladiny LDL-c, nejnižší účinnost byla popsána u pravastatinu a fluvastatinu (7).
Statiny jsou indikovány u všech typů dyslipidémií se zvýšenými koncentracemi LDL-c (³ 3,40 mmol/l), tj. u izolované hypercholesterolémie a smíšené hyperlipidémie. U smíšené hyperlipidémie je předpokladem vhodnosti statinu jako léku 1. volby koncentrace triglyceridů < 5,17 mmol/l (8). V kardiologii se statiny užívají v primární prevenci koronárních příhod, k redukci rizika u revaskularizačních procedur, v sekundární prevenci akutního koronárního syndromu, redukci rizika cévních mozkových příhod, ke zpomalení progrese aterosklerózy (9). Statiny se liší farmakokinetikou (absorpcí, biologickou dostupností, vazbou na bílkoviny, jaterní biotransformací cestou cytochromu P450, liposolubilitou).
Mimo hypolipidemické účinky mají i ty „extrahypolipidemické“, pleiotropní účinky, které zahrnují antioxidační, protizánětlivé a antifibrotické působení. Naproti tomu protektivní účinky statinů u osteoporózy a Alzheimerovy choroby potvrzeny nebyly (10, 11). Cílem léčby statiny je dosažení cílové koncentrace LDL-c podle kategorie rizika, nebo alespoň 50% pokles LDL-c při podávání maximálně tolerovatelné dávky.
Obr. 1. Potenciální mechanismy, kterými mohou statiny příznivě ovlivnit histologii jater a jaterní komplikace u NAFLD (26) 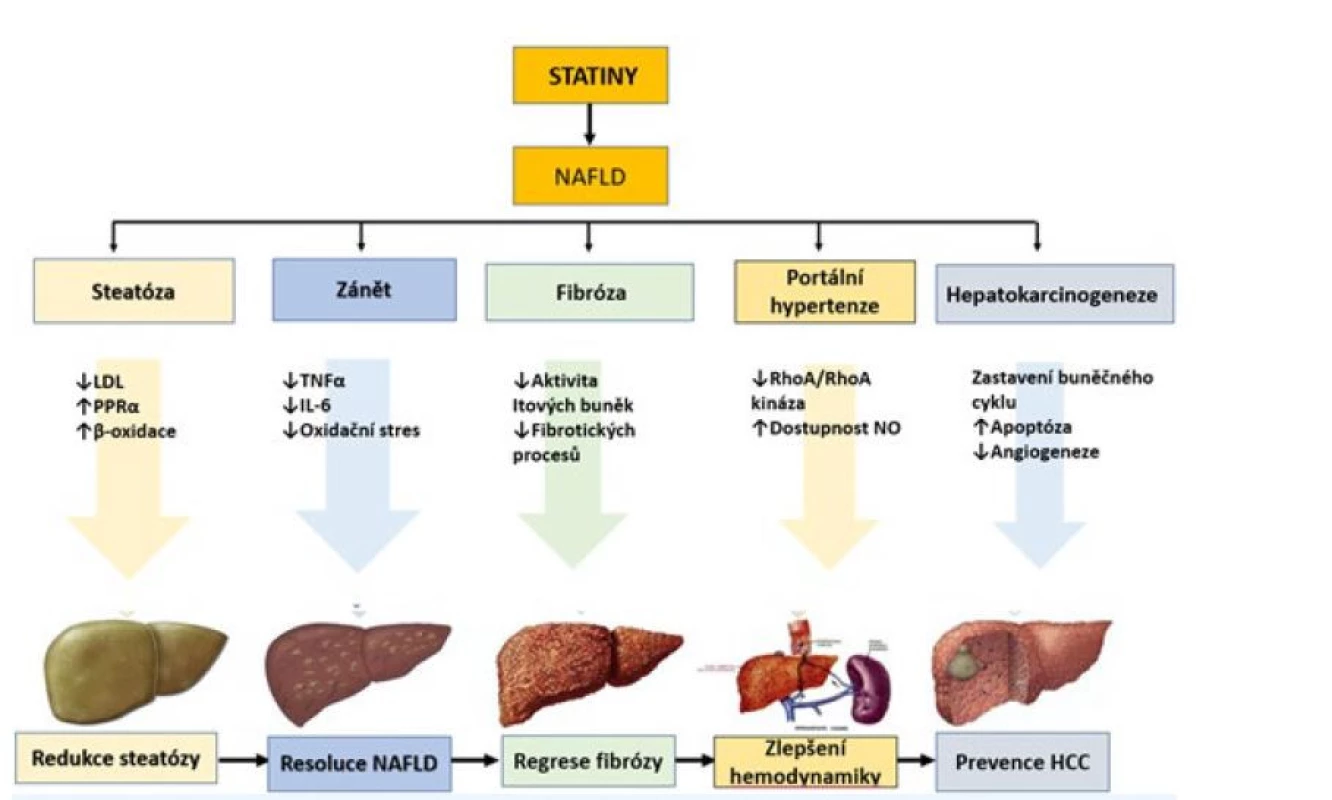
NEŽÁDOUCÍ ÚČINKY A KOMPLIKACE SPOJENÉ S LÉČBOU STATINY
Statiny, podobně jako většina farmak, mají i nežádoucí účinky. Mezi ně patří myopatie (u 5–10 % léčených), elevace jaterních testů (u < 2 %) a zvýšené riziko diabetu mellitu 2. typu (u 10 %).
Patogeneze statiny asociované myopatie není jasná. Existuje celá řada teorií popisujících mechanismus svalového poškození – inhibici HMGCR a sníženou syntézu ubichinonu (12). Další je statiny indukovaná apoptóza myocytů zprostředkovaná Rho, Ras proteiny (13). Nejčastějším svalovým nežádoucím efektem statinů jsou myalgie. Vzácnější jsou myopatie a velmi vzácnou komplikací je rhabdomyolýza s myoglobinurií a selháním ledvin. Riziko této komplikace zvyšuje současné užívání inhibitorů cytochromu CYP3A4 (erytromycin, azoly, SSRI, fibráty). Četnost těchto případů je uváděna v řádu jednotek na 100 000 pacientů za rok (14).
Významným zjištěním je, že u asi 10 % pacientů léčených statiny se rozvine diabetes mellitus 2. typu. Jeden případ se odhalí u 225 osob léčených po dobu 4 roků. Zvýšené riziko vzniku diabetu mellitu je po podávání účinnějších statinů (atorvastatin a rosuvastatin) a po vyšších dávkách; u starších osob, u obezity/nadváhy a stavů spojených s inzulinovou rezistencí. Prospěch z léčby statiny na globální KV riziko je zhruba 9× vyšší než KV riziko asociované s diabetem mellitem (8, 15).
Další obavou u nežádoucích účinků statinů je hepatopatie. Elevaci jaterních transamináz zřejmě způsobuje kombinace působení na cytochromový jaterní systém a postižení transportních systémů pro žlučové kyseliny (16). K tomu skutečně dochází, ale incidence hepatopatií, které by byly klinicky závažné, je velmi nízká. Studie s pravastatinem uvádí 5× zvýšené hodnoty alaninaminotransferázy (ALT) u 0,5 % pacientů a 9× zvýšené ALT u 0,2 % pacientů (17). Publikace analyzující změny jaterních testů u 74 tisíc osob popsala významnou elevaci transamináz u 1,4 % a u 1,1 % kontrol, spontánní pokles byl zaznamenán v 70 % (18). Případy, kdy užívání statinů vedlo k těžkému lékovému poškození jater, jsou extrémně vzácné (3, 19), zahraniční autoři uvádějí 1–2 případy na milion pacientů (20). Statin by měl být vysazen, pokud dojde k elevaci jaterních testů nad trojnásobek horní hranice normy. Dojde-li k normalizaci jaterních testů po vysazení preparátu, je možno léčbu statinem zahájit znovu – nejlépe jiným statinem. Kontroly jaterních testů by měly být prováděny minimálně 2× ročně (21).
SOUVISLOST METABOLICKÝCH PORUCH A NAFLD A MOŽNOSTI VYUŽITÍ STATINŮ
Poruchy metabolismu lipidů, zvýšený energetický příjem, snížená fyzická aktivita, obezita, metabolický syndrom však neohrožují pacienty pouze rozvojem ASKVO, ale také poškozením jater. Po objevení úspěšné terapie hepatitidy C se do popředí zájmu hepatologů dostala nealkoholová tuková choroba jater (NAFLD). Ta je definována jako jaterní steatóza, na jejíž etiologii se nepodílí nepřiměřená konzumace alkoholu, vrozená metabolická onemocnění a určitá léčiva (22).
NAFLD je prokazatelně spojena s metabolickým syndromem – u těžce obézních až v 80 % případů, u pacientů s diabetem mellitem 2. typu v 75 % (23). Jedná se o nejčastější chronické onemocnění jater ve vyspělém světě. Jeho prevalence je odhadována na 25 % (24).
V terapii NAFLD má největší význam celková změna životního stylu, související se zvýšenou fyzickou aktivitou, úpravou stravování a behaviorální změny. Doporučuje se přejít na středomořskou dietu – spočívající ve sníženém množství nasycených tuků, tuků vůbec, a naopak zvýšeném množství omega-3 vícenenasycených a monoenových mastných kyselin, zeleniny, vlákniny, redukci cukrů (především fruktózy a sacharózy). Největší vliv na NAFLD má fyzická aktivita. Redukce hmotnosti o 5 % má efekt na zlepšení steatózy a pokles jaterních transamináz, pokles hmotnosti o 10 % se projeví také zlepšením histologického nálezu. Toho času neexistuje účinný preparát na léčbu NAFLD. Doporučuje se tedy terapie jednotlivých komponent metabolického syndromu. Z antihypertenziv jsou doporučovány inhibitory ACE, zejména telmisartan. Na léčbu dyslipidémie statiny, pokud je přítomna i elevace triacylglycerolů tak i fibráty. V poslední době se preferují léky, které zlepšují inzulinovou senzitivitu, upravují narušený metabolismus tuků a sacharidů – agonisté PPAR-γ, mezi něž patří pioglitazon, vitamin E. Zkouší se i nové látky jako kyselina obeticholová (22).
Kromě účinku na syntézu cholesterolu mají statiny i řadu dalších efektů. Pleiotropní účinky statinů zahrnují především antiflogistické, antioxidační, antifibrotizující, antiproliferativní, imunomodulační a protinádorové účinky – ty se zdají potencionálně prospěšné právě v ovlivnění mechanismů uplatňujících se v patogenezi NAFLD/nealkoholové steatohepatitidy (NASH) – steatózy, zánětu a fibrózy (25).
Řada experimentálních lékových studií prokázala účinky, které by mohly být v léčbě NAFLD využitelné. Indukce receptorů PPAR-α a aktivace oxidace mastných kyselin, odstranění volných kyslíkových radikálů (27). Další studie popisují antifibrotické, antioxidační a protizánětlivé účinky (28, 29). Dalším prospěšným efektem je redukce krystalizace cholesterolu v hepatocytech a inhibice vzniku crown like structures, což je typický nález u pacientů s NAFLD/NASH (30).
Statiny mají také prokazatelné protektivní účinky ve vztahu k hepatocelulárnímu karcinomu (31). Většina dat týkajících se příznivého účinku statinů na histologické změny i NAFLD vycházejí hlavně z experimentálních studií, post hoc analýz, průřezových nebo malých intervenčních studií. Klinické testování se zatím jeví jako velice zdlouhavé a nákladné (32). Závěry některých z těchto prací jsou následující: atorvastatin, rosuvastatin jsou v léčbě NAFLD bezpečné, zlepšují NAFLD/NASH a významně redukují riziko ASKVO (32). Terapie statiny má u pacientů s NAFLD/NASH dokonce vyšší protektivní kardiovaskulární efekt než u pacientů bez NAFLD/NASH. I tyto práce potvrzují protizánětlivé a antifibrotické účinky léčby (33). Velká jihokorejská studie z roku 2021 hodnotící jaterní „rizika“ na základě vypočítaných indexů ukazuje, že statiny snižují riziko vzniku NAFLD u pacientů s nízkou hodnotou FLI (Fatty Liver Index = prediktor vypočtený z BMI, obvodu pasu, hodnoty gama-glutamyltransferázy /GGT/ a triacylglycerolů); statiny snižují riziko progrese do fibrózy u pacientů s již existujícím NAFLD (34).
Lze shrnout, že statiny se skutečně ukázaly jako bezpečné u pacientů se zvýšenými jaterními enzymy a s chronickými jaterními onemocněními, včetně NAFLD, přičemž si zachovávají specifickou a zvýšenou účinnost pro kardiovaskulární prevenci, zejména u populace pacientů s NAFLD a zvýšenými jaterními enzymy (3, 26).
ZÁVĚR
Statiny mají v léčbě poruch metabolismu lipidů své pevné místo. Významně snižují kardiovaskulární riziko. Z jejich nežádoucích účinků jsou nejčastější myalgie. Léčba statiny u rizikové skupiny pacientů zvyšuje riziko vzniku diabetu mellitu 2. typu. Hepatopatie spojená s užíváním statinů není závažná. Případy, kdy došlo k vážnému poškození jater v souvislosti s užíváním statinů, jsou extrémně vzácné.
V experimentálních studiích byly objeveny pleiotropní účinky statinů, které jsou u NAFLD potenciálně využitelné. Jedná se převážně o jejich antioxidační a antifibrotické působení. Slibný se ukazuje také jejich protektivní účinek proti rozvoji hepatocelulárnímu karcinomu.
Statiny se jeví jako bezpečné léky u pacientů se zvýšenými jaterními enzymy a s chronickými jaterními onemocněními, včetně NAFLD. Budoucí studie by měly objasnit roli statinů v terapii NAFLD a stanovit, jaký typ a dávka bude u jednotlivých pacientů s NAFLD vhodná.
Čestné prohlášení
Autoři nedeklarují žádný střet zájmů.
Poděkování
Práce byla podpořena následujícími výzkumnými projekty: GA UK 190/54/251753, Cooperatio_PHARM, MZ ČR RVO VFN64165 a Cooperatio11158207034-2 gastroenterology.
Seznam použitých zkratek
ASKVO aterosklerotická kardiovaskulární onemocnění
ALT alaninaminotransferáza
FLI Fatty Liver Index
GGT gama-glutamyltransferáza
HDL lipoprotein s vysokou hustotou
HMG-CoA hydroxymetylglutaryl koenzym A
HMGCR reduktáza hydroxymetylglutaryl koenzymu A
IDL lipoprotein se střední hustotou
KV kardiovaskulární
LDL lipoprotein s nízkou hustotou
NAFLD nealkoholová jaterní tuková choroba
NASH nealkoholová steatohepatitida
PPAR jaderné receptory aktivované proliferátory peroxisomů
VLDL lipoprotein s velmi nízkou hustotou
Adresa pro korespondenci:
MUDr. Jiří Hlušička, Ph.D.
4. interní klinika 1. LF UK a VFN
U Nemocnice 499/2, 128 08 Praha 2
Tel.: 774 124 909
e-mail: jiri.hlusicka@vfn.cz
Zdroje
- Go AS, Mozaffarian D, Roger VL et al. Heart disease and stroke statistics – 2013 update: a report from the American Heart Association. Circulation 2013; 127: e6–e245.
- Stancu C, Sima A. Statins: mechanism of action and effects. J Cell Mol Med 2001; 5 : 378–387.
- Ballantyne CM. Clinical lipidology (2nd ed.). Saunders/Elsevier, Philadelphia, 2015.
- Balakumar P, Maung-U K, Jagadeesh G. Prevalence and prevention of cardiovascular disease and diabetes mellitus. Pharmacol Res 2016; 113 : 600–609.
- Athyros VG, Papageorgiou AA, Mercouris BR et al. Treatment with atorvastatin to the National Cholesterol Educational Program goal versus 'usual' care in secondary coronary heart disease prevention. The GREek Atorvastatin and Coronary-heart-disease Evaluation (GREACE) study. Curr Med Res Opin 2002; 18 : 220–228.
- Bertolini S, Bon GB, Campbell LM et al. Efficacy and safety of atorvastatin compared to pravastatin in patients with hypercholesterolemia. Atherosclerosis 1997; 130 : 191–197.
- Cholesterol Treatment Trialists (CTT) Collaboration, Baigent C, Blackwell L, Emberson J et al. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170 000 participants in 26 randomised trials. Lancet 2010; 376 : 1670–1681.
- Žák A. Obezita a dyslipidemie. In: Hainer V. (ed.): Základy klinické obezitologie (3., zcela přepracované vyd.). Grada, Praha, 2021 : 74–83.
- Cid-Conde L, López-Castro J. Pharmacokinetic Aspects of Statins. In: Abukabda A, Suciu M, Andor M. (eds.): Cardiovascular Risk Factors in Pathology. IntechOpen, London, 2020 : 981.
- Jadhav SB, Girish KJ. Statins and osteoporosis: new role for old drugs. J Pharm Pharmacol 2006; 58 : 3–18.
- Sano M, Bell KL, Galasko D et al. A randomized, double-blind, placebo-controlled trial of simvastatin to treat Alzheimer disease. Neurology 2011; 77 : 556–563.
- Mas E, Trevor AM. Coenzyme Q10 and statin myalgia: what is the evidence? Curr Atheroscler Rep 2010; 12 : 407–413.
- Siddiqi SA, Paul DT. How do you treat patients with myalgia who take statins? Curr Atheroscler Rep 2009; 11 : 9–14.
- Bultas J. Vzájemné srovnání statinů z pohledu farmakologa. Remedia 2013; 23 : 143–150.
- Swerdlow DI, Preiss D, Kuchenbaecker KB et al. HMG-coenzyme A reductase inhibition, type 2 diabetes, and bodyweight: evidence from genetic analysis and randomised trials. Lancet 2015; 385 : 351–361.
- Červený P. Polékové poškození jater. Praktické lékárenství 2013; 9 : 123–126.
- Pfeffer MA, Keech A, Sacks FM et al. Safety and tolerability of pravastatin in long-term clinical trials: prospective Pravastatin Pooling (PPP) Project. Circulation 2002; 105 : 2341–2346.
- Kashani A, Phillips CO, Foody JM et al. Risks associated with statin therapy: a systematic overview of randomized clinical trials. Circulation 2006; 114 : 2788–2797.
- Para JL, Reddy KR. Hepatotoxicity of hypolipidemic drugs. Clin Liver Dis 2003; 7 : 415–433.
- Tolman KG. The liver and lovastatin. Am J Cardiol 2002; 89 : 1374–1380.
- Goláň L. Chyby a úskalí terapie statiny. Interní medicína pro praxi 2005; 5 : 552–553
- Brůha R, Dvořák K, Fejfar T a kol. Doporučený postup České hepatologické společnosti ČLS JEP pro diagnostiku a léčbu Nealkoholové tukové choroby jater (NAFLD). Gastroenterologie a hepatologie 2020; 74 : 103–110.
- Dvořák K, Hainer R, Petrtýl J et al. The prevalence of nonalcoholic liver steatosis in patients with type 2 diabetes mellitus in the Czech Republic. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2015; 159 : 442–448.
- Zelber-Sagi S, Lotan R, Shlomai A et al. Predictors for incidence and remission of NAFLD in the general population during a seven-year prospective follow-up. J Hepatol 2012; 56 : 1145–1151.
- Kavalipati N, Shah J, Ramakrishan A et al. Pleiotropic effects of statins. Indian J Endocrinol Metab 2015; 19 : 554–562.
- Nascimbeni F, Pellegrini E, Lugari S et al. Statins and nonalcoholic fatty liver disease in the era of precision medicine: more friends than foes. Atherosclerosis 2019; 284 : 66–74.
- Park H-S, Jang JE, Ko MS et al. Statins increase mitochondrial and peroxisomal fatty acid oxidation in the liver and prevent non-alcoholic steatohepatitis in mice. Diabetes Metab J 2016; 40 : 376–385.
- Schierwagen R, Maybüchen L, Hittatiya K et al. Statins improve NASH via inhibition of RhoA and Ras. Am J Physiol Gastrointest Liver Physiol 2016; 311: G724–G733.
- Yokohama K, Fukunishi S, Masaaki L et al. Rosuvastatin as a potential preventive drug for the development of hepatocellular carcinoma associated with non-alcoholic fatty liver disease in mice. Int J Mol Med 2016; 38 : 1499–1506.
- Ioannou GN, Van Rooyen DM, Savard C et al. Cholesterol-lowering drugs cause dissolution of cholesterol crystals and disperse Kupffer cell crown-like structures during resolution of NASH. J Lipid Res 2015; 56 : 277–285.
- Fujiwara N, Friedman SL, Goossens N et al. Risk factors and prevention of hepatocellular carcinoma in the era of precision medicine. J Hepatol 2018; 68 : 526–549.
- Doumas M, Imprialos K, Aikaterini Dimakopoulou A et al. The role of statins in the management of nonalcoholic fatty liver disease. Curr Pharm Des 2018; 24 : 4587–4592.
- Athyros GV, Boutari C, Stavropoulos K et al. Statins: an under-appreciated asset for the prevention and the treatment of NAFLD or NASH and the related cardiovascular risk. Curr Vasc Pharmacol 2018; 16 : 246–253.
- Lee JI, Lee HW, Lee KS et al. Effects of statin use on the development and progression of nonalcoholic fatty liver disease: a nationwide nested case-control study. Am J Gastroenterol 2021; 116 : 116–124.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek ÚVODEMČlánek EDITORIALČlánek Jaterní testyČlánek Elastografie jaterČlánek Současná léčba hepatitidy C
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
2022 Číslo 2- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- S MUDr. Štěpánem Budkou o rizicích obezity pro fertilitu ze všech úhlů pohledu
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
-
Všechny články tohoto čísla
- ÚVODEM
- EDITORIAL
- Jaterní testy
- Možnosti diagnostiky jaterní steatózy
- Elastografie jater
- Ztukovatění jater spojené s metabolickou dysfunkcí (MAFLD) jako přesnější název pro NAFLD – společné aspekty patogeneze
- Diagnostika nealkoholové tukové nemoci jater a její aktivní screening v rizikových skupinách
- Současné možnosti léčby nealkoholového ztukovatění jater (NAFLD)
- Statiny a játra
- Alkoholová choroba jater v terénní praxi
- Současná léčba hepatitidy C
- Klinická obezitologie – nejen Základy
- Nutriční návyky studentů lékařských fakult
- Za profesorem Peterem Krištúfkem, čestným prezidentem SLS
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



