-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Výpověď biochemických markerů remodelace kosti při nádorovém postižení skeletu
Clinical Utility of Bone Markers in the Evaluation and Follow-up in Patients with Neoplastic Bone Diseases
The biochemical markers of bone remodeling reflect the rates of bone resorption and bone formation in the whole body rather than in segments of the skeleton. The markers cannot be used for a diagnosis of bone disease. However, they are a valuable tool in the differential diagnosis, in the assessment of fracture risk independent of bone mineral density and, in the monitoring treatments of metabolic and neoplastic bone diseases as well as the side effects of some drugs on bone (e.g., adjuvant treatment with selective inhibitors of aromatase). This review provides characteristics of the markers currently used to assess neoplastic bone diseases and, their clinical values for stratification and monitoring treatments. Currently used markers provide sufficient specificity. However, their sensitivities under various clinical situations have to be respected. The clinical utility of the markers requires their standardization and availability.
Key words:
bone, metastasis, multiple myeloma, osteoporosis, markers, monitoring.
Autoři: J. Štěpán; T. Zima 1; L. Petruželka 2
Působiště autorů: Revmatologický ústav, Praha ; Ústav klinické chemie a laboratorní diagnostiky 1. LF UK a VFN, Praha 1; Onkologická klinika 1. LF UK a VFN, Praha 2
Vyšlo v časopise: Čas. Lék. čes. 2008; 147: 7-13
Kategorie: Přehledový článek
Souhrn
Biochemické markery kostní remodelace vypovídají o celotělové rychlosti novotvorby kosti a osteoresorpce, nikoli však o úrovni metabolizmu v jednotlivých segmentech skeletu. Markery nemohou být užity pro stanovení klinické diagnózy kostního onemocnění (např. osteoporózy nebo určitého nádorového metastatického postižení skeletu), ale jsou cenným vodítkem při diferenciální diagnostice osteopatií. Významným uplatněním markerů je hodnocení rizika zlomenin a monitorování dynamiky kostních změn. V tomto ohledu jsou markery ověřeným nástrojem pro monitorování léčby metabolických a nádorových onemocnění skeletu a pro monitorování nežádoucích účinků některých léků na kostní metabolizmus, například při adjuvantní léčbě selektivními inhibitory aromatázy třetí generace. Markery jsou v tomto přehledu charakterizovány a je uvedena jejich výpověď o metastatickém nádorovém postižení skeletu a výpověď při stratifikaci a monitorování protinádorové léčby. Všechny dnes doporučované markery jsou dostatečně specifické pro kost, ale je třeba respektovat jejich rozdílnou senzitivitu při různých osteopatiích. Klinické využívání markerů předpokládá jejich standardizaci a metodickou dostupnost.
Klíčová slova:
skelet, metastázy, mnohočetný myelom, osteoporóza, markery, monitorování.Metastatické postižení skeletu, časté zejména u nemocných s karcinomem prsu, prostaty, štítné žlázy, ledvin, močového měchýře a plic, stejně jako postižení skeletu při onemocnění mnohočetným myelomem, je příčinou obtížně tišitelných bolestí, hyperkalcémie, zlomenin obratlů a patologických neobratlových zlomenin, neurologických příznaků, chirurgických výkonů a radioterapie při kostních komplikacích. To vše výrazně snižuje kvalitu života pacientů a dobu přežití. Změny struktury a morfologie kosti v úsecích postižených metastatickým procesem umožňují diagnostiku zobrazovacími metodami, jako jsou radiografie, CT, MRI, kvantitativní scintigrafie pomocí 99mTc a pozitronová emisní tomografie. V časnějších stadiích procesu však mohou být morfologické změny a s tím i záchyt radionuklidu v postižených místech diskrétní, nespecifické, falešně pozitivní anebo zcela neprokazatelné. Navíc, zdaleka ne všechny zobrazovací metody jsou vhodné pro monitorování progrese metastatického procesu a případně odpovědi na léčbu (1). Nádorové markery až na vzácné výjimky neposkytují informaci o stupni postižení skeletu. Tuto informaci lze získat vyšetřením koncentrací biochemických markerů remodelace kosti (resorpce a novotvorby kosti), ať už v krevním séru, nebo v moči (tab. 1). Tyto koncentrace závisejí na stupni tvorby markerů, na jejich přestupu do tělních tekutin a na jejich metabolizmu a clearance.
Tab. 1. Přínos a omezení biochemických markerů kostní remodelace při nádorovém postižení skeletu 
Kostní markery vznikají činností osteoklastů, osteoblastů, osteocytů a lining cells, které zajišťují tvorbu (modelaci) skeletu při tělesném růstu, remodelaci kosti během celého života, mechanické funkce kosti (udržení mikroarchitektury a kvality kostní tkáně) a spoluúčast kosti na homeostáze vápníku a úpravě poruch acidobazické rovnováhy. Kostní remodelace se sice uplatňuje při všech kostních onemocněních, ale spřažení funkce osteoklastů a osteoblastů může být porušeno v různém stupni. Při postižení kosti osteoplastickými nádory převažuje funkce osteoblastů nad osteoresorpcí, tvoří se nadbytek organické matrix, ale chaoticky uspořádaná kost je mechanicky málo odolná a láme se. Převaha osteoresorpce nad novotvorbou kosti při osteolytických metastázách vede k hyperkalcémii, úbytku, zhoršení kvality kostní hmoty a zlomeninám. Schopnost osteoblastů syntetizovat kostní matrix je porušena zejména při mnohočetném myelomu, ale může být porušena i v solidních kostních nádorech.
Charakterisktiky markerů kostní remodelace (2, 3)
Biochemické markerykostní novotvorby jsou přímými nebo nepřímými produkty aktivních osteoblastů v různých fázích jejich vývoje. Vypovídají proto o různých aspektech funkce osteoblastů a tvorby organické kostní matrix. V praxi se osvědčilo měření sérových koncentrací kostní alkalické fosfatázy, osteokalcinu a propeptidu kolagenu typu I. Markery kostní resorpce vypovídají o počtu osteoklastů (osteoklastická kys. fosfatáza) a stupni degradace kostní organické matrix a zejména kostního kolagenu (telopeptidy kolagenu typu I).
Kostní alkalická fosfatáza (bALP) je specifická pro osteoblasty, tvoří asi 40 % celkové katalytické aktivity (ALP) v séru zdravých lidí, a protože je z krve očišťována játry, vypovídá o stupni kostní novotvorby i při nevratném selhávání ledvin. Enzym se v séru (S-bALP) stanovuje nejčastěji imunoanalýzou, protilátky však zčásti zkříženě reagují i s jaterní ALP. Enzym lze také stanovit na základě jeho selektivní termostability (termoinaktivace) a inhibovatelnosti (např. L-fenylalaninem) nebo po precipitací lektiny. Metodou volby je elektroforéza séra, protože současně hodnotí přítomnost jaterní, kostní, střevní a nádorové ALP. Současné hodnocení S-bALP a PSA u mužů s karcinomem prostaty zvyšuje diagnostickou senzitivitu pro metastatické postižení skeletu ve srovnání s muži, kteří trpí benigní hyperplazií prostaty (4).
Osteokalcin (OC) je syntetizován převážně osteoblasty a odontoblasty. U dospělých osob je třetina S-OC tvořena intaktní molekulou (1–49), třetina velkým N-terminálním a středním fragmentem molekuly (1–43) a zbytek C-terminálním fragmentem. Fragmenty OC se rovněž uvolňují do oběhu během degradace kostní matrix při osteoresorpci. Proto je S-OC markerem kostní remodelace. Různé imunoanalýzy využívají protilátek nejen proti intaktnímu OC, ale také proti různým fragmentům OC, a proto není interpretace výpovědi tohoto jinak pro kosti velmi specifického sérového markeru jednotná. Protože S–intaktní OC je nestabilní, měří se zpravidla společně s poměrně stabilním fragmentem (1–43). Biologický poločas S-OC se uvádí v minutách. Hlavním místem očišťování plazmy od OC jsou ledviny (obr. 1).
Obr. 1. Schéma koncentrace biochemických markerů v oběhu v závislosti na jejich tvorbě v jednotlivých typech tkání a na clearance markerů (upraveno dle Robins, S. P. Bone Markers. Martin Dunitz, London, 2001, s. 51) 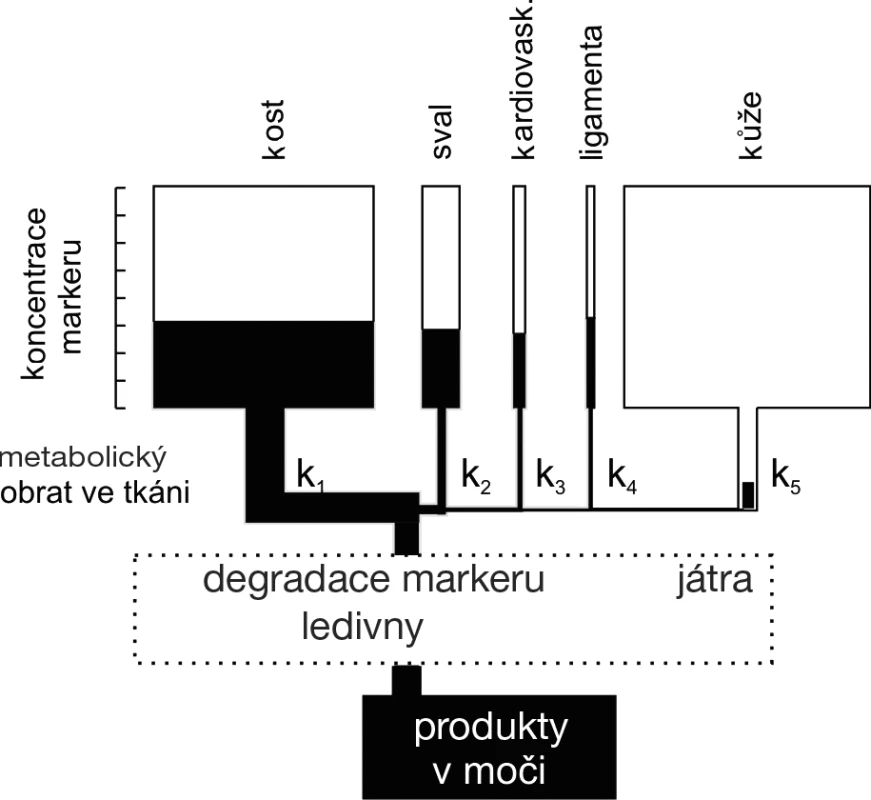
Propeptidy prokolagenu typu I – aminoterminální propeptid (PINP) a karboxyterminální propeptid (PICP) vznikají při syntéze kolagenu typu I, zejména v osteoblastech a fibroblastech. Kolagen typu I tvoří přes 90 % všech bílkovin organické kostní matrix, je však přítomen také v kůži, dentinu, rohovce, cévní stěně, chrupavce a šlachách, které mají u dospělých osob podstatně pomalejší metabolický obrat než kost. V mineralizované kosti se propeptidy neprokazují, a proto nevypovídají o stupni osteoresorpce. PINP je z oběhu eliminován jaterními endoteliálními buňkami, a vypovídá proto o funkci osteoblastů i u nemocných s poruchami ledvin. Marker lze stanovit radioimunoanalýzou nebo elektrochemiluminiscenční imunoanalýzou. PINP i PICP snášejí běžné skladování séra.
Osteoprotegerin (OPG) je tvořen v osteoblastech (obr. 2), ale není pro skelet zcela specifický (5). Rozdíly mezi různými metodami stanovení koncentrace S-OPG v séru nemocných s mnohočetným myelomem nebo při metastatickém nádorovém postižení skeletu zatím nedovolují jednoznačné posouzení výpovědi tohoto markeru o aktivitě a rozsahu nádorového procesu (6). Nádorové buňky metastázující do kosti mohou potlačovat tvorbu OPG.
Obr. 2. Interakce mezi osteoblasty, osteoklasty a nádorovými buňkami PTHrP – parathormone related peptide, TNF-α – tumor necrosis faktor alfa, MIP-1 – makrofágový zánětlivý protein 1 alfa, OPG – osteoprotegerin, RANK – receptor activating nuclear factor kappa B, RANKL – ligand pro RANKL, TGF-β – transformující růstový faktor beta 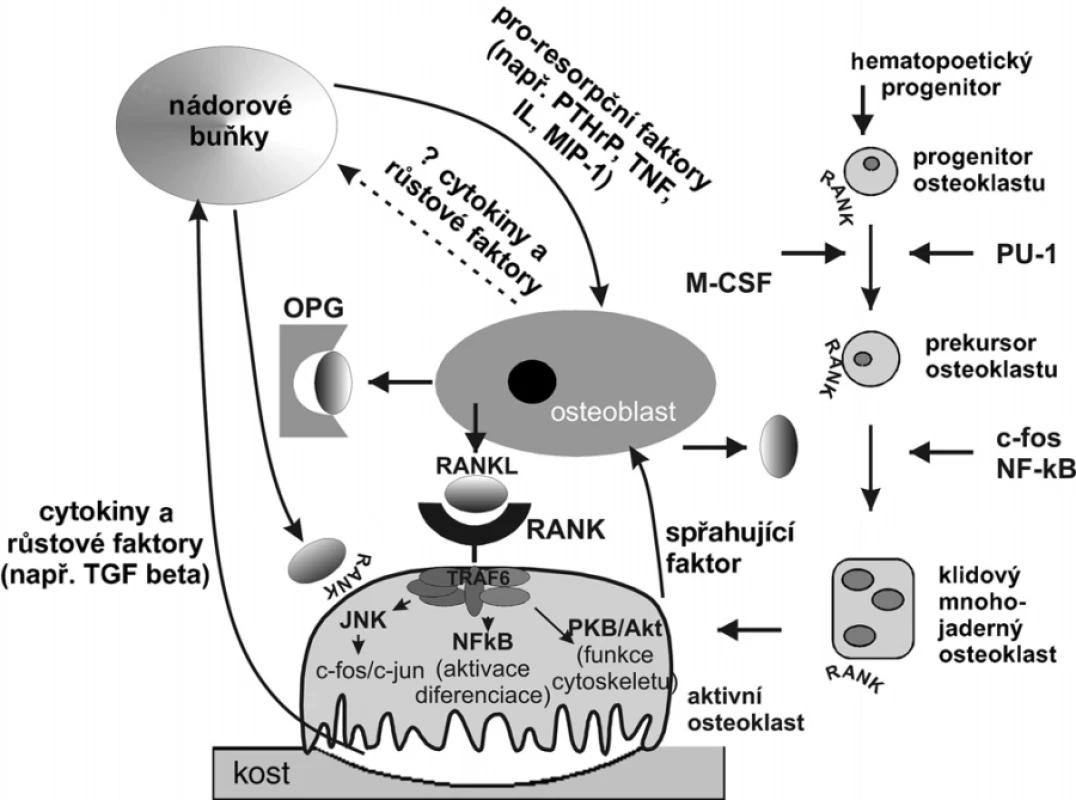
Telopeptidy kolagenu typu I a deoxypyridinolin (DPD, také lyzylpyridinolin) vznikají proteolytickou degradací zralého kolagenu a přecházejí do séra a do moči. Na rozdíl od U-hydroxyprolinu není jejich koncentrace ovlivněna degradací nově syntetizovaných kolagenů ani kolagenu z potravy. Proteolýzou kolagenu katepsinem vznikají aminoterminální telopeptidy (NTX-I) a karboxylterminální telopeptid (CTX I), působením metaloproteinázy vzniká telopeptid označovaný jako CTX-MMP (také ICTP). Telopeptidy a volná spojka DPD se nacházejí převážně v kosti a dentinu (což neplatí pro pyridinolinovou spojku PYD). Koncentrace telopeptidů v krvi i v moči jeví výrazný cirkadiánní rytmus s maximem ráno a minimem odpoledne. Biologický materiál ke stanovení telopeptidů je proto nezbytné odebírat standardně ráno nalačno. Stanovení DPD v moči se dnes nahrazuje měřením sérové koncentrace telopeptidů jednak z metodických důvodů, jednak proto, že velký podíl volného DPD v moči vzniká v ledvinách degradací telopeptidů (obr. 1).
Kostní sialoprotein (BSP) je fosforylovaný glykoprotein kostní matrix, tvořený osteoblasty, odontoblasty, ale také osteoklasty a buňkami karcinomu prsu, štítné žlázy a prostaty. Množství BSP v nádorové tkáni koreluje s tendencí nádoru metastázovat do kostí při karcinomu prsu (7) a při karcinomu prostaty (8).
Osteoklastická (tartarát-rezistentní) kyselá fosfatáza je na rozdíl od většiny tkáňově specifických kyselých fosfatáz rezistentní vůči inhibici vinanem a označuje se také jako ACP 5b (pátá elektroforetická forma, nejblíže ke katodě). Katalytickou aktivitu ACP 5b lze kvantitativně stanovit kolorimetricky v citrátové krevní plazmě, kde se aktivita ACP stabilizuje a kam neinterferují ACP z jiných krevních částic. Specifičtější je stanovení imunoanalýzou. Stanovení enzymu je vhodné i při nevratném selhání ledvin, protože plazma není od ACP 5b očišťována ledvinami. Výhodou markeru je také chybění významnějších diurnálních změn jeho koncentrací, a tedy možnost odebrat krev v kteroukoliv denní dobu.
RANKL (receptor activator of nuclear factor kappa B ligand) je cytokinem ze skupiny TNF (tumor necrosis factor), vypovídajícím o osteoklastogenezi. Buněčným receptorem pro RANKL je RANK, exprimovaný v prekurzorech osteoklastů a v osteoklastech. Vazbou RANKL na RANK se navozuje diferenciace a zrání osteoklastů a aktivují se zralé osteoklasty k osteoresorpci (obr. 2). Do oběhu se dostává jednak secernovaná izoforma RANKL, jednak izoforma uvolňovaná enzymaticky (metaloproteinázami) z buněčné membrány. U nemocných s nádorovým onemocněním se výpověď měření RANKL po amplifikaci signálu ověřuje.
Preanalytické faktory a referenční hodnoty
Analytická přesnost jak manuálního, tak automatizovaného stanovení markerů je v současné době uspokojivá, výsledky však mohou značně záviset na preanalytických vlivech, jako jsou tepelná a proteolytická degradace (ACP, osteokalcin), UV záření (pyridinoliny) nebo hemolýza (BSP, OC). Vzorky séra je nutné skladovat při –70 °C a moč při –30 °C. Většina markerů (kromě propeptidů a telopeptidů kolagenu) je citlivá na opakované rozmrazení. Variabilitu výsledků měření lze snížit měřením vzorků odebraných v několika dnech, anebo měřením směsného vzorku. Laboratorní referenční hodnoty markerů je vhodné stanovit pro ženy před menopauzou (zdravé, s pravidelným cyklem ve věku 30–45 let) (9) a pro muže ve věku 40–60 let. Jako referenční by neměly být užívány výsledky zjištěné v jiné geografické oblasti.
Diagnostická výpověď markerů při nádorovém onemocnění skeletu
Zvýšené hodnoty markerů mohou být vedoucím laboratorním příznakem u nemocných s metastatickým postižením skeletu, nejsou však příznakem specifickým, protože jejich hodnoty mohou být ovlivněny zejména deficitem pohlavních hormonů a léčbou.
Sérové koncentrace markerů novotvorby kosti (bALP, OC, PICP a PINP) jsou zvýšené při metastatickém postižení skeletu u nemocných s karcinomem prsu, prostaty a plic (10). Zvýšené vylučování DPD močí bylo prokázáno u nemocných s karcinomem prsu, prostaty a plic s metastatickým postižením skeletu (11), ale také u pacientů bez metastáz (12). Podobně byla zjištěna významně zvýšená exkrece DPD močí u nemocných s pokročilým mnohočetným myelomem (stadium III), ale marker neodlišil pacienty v časném stadiu MM, pacienty s MGUS a ženy s postmenopauzální osteoporózou (13). Telopeptidy kolagenu typu I jsou citlivým markerem metastatického nádorového postižení skeletu při karcinomu prsu, prostaty, jícnu, pankreatu a plic (14). Vylučování telopeptidů koreluje s histomorfometrií a rozsahem kostního procesu při mnohočetném myelomu (15). Metodou volby při nádorovém postižení skeletu je CTX MMP (ICTP), který vzniká při degradaci kolagenu metaloproteinázou, zatímco ve zdravé tkáni převažuje produktem degradace kolagenu typu I katepsinem (tvorba CTX I a NTX-I). V souhlasu s tím je výsledek pozorování, že S-ICTP má ve srovnání s U-NTX a S-bALP vyšší klinickou specificitu (91 %) při diagnostice metastáz do skeletu (16). U nemocných s mnohočetným myelomem korelují koncentrace S-ICTP se stadiem onemocnění (17), s nálezem při MRI (18) a s prognózou onemocnění (19). Vysokou citlivost pro metastatické nádorové postižení skeletu mají také osteoklastická ACP (20) a BSP (7). V nádorech prsu, prostaty a štítné žlázy se tvoří BSP a zjišťuje se korelace sérových koncentrací PSA a BSP (21).
Za ukazatele špatné prognózy mnohočetného myelomu se považuje zvýšená koncentrace S-ICTP (22), S-BSP (23) a zvýšený poměr sRANKL/OPG (24). Zvýšené hodnoty markerů osteoresorpce při současně nízké koncentraci proteinů tvořených v osteoblastech, jako jsou S-OC, S-bALP nebo osteoprotegerin jsou příznačné pro mnohočetný myelom se špatnou prognózou (22, 25). Je to v souhlasu s přítomností inhibitoru diferenciace osteoblastů (Dickkopf1 proteinu) v myelomových buňkách (26), kde také vznikají faktory stimulující aktivitu osteoklastů (RANKL a cévní endoteliální růstový faktor VEGF). Myelomové buňky adherují také k osteoklastům a podávání osteoprotegerinu, protilátek proti RANKL anebo bisfosfonátů brání destrukci kosti a interferuje s progresí myelomu (27).
Výsledky stanovení markerů nelze interpretovat přímo jako měřítko aktivity kostních buněk, resp. množství vytvářené nebo ztracené kostní hmoty, ale současně je nutné zvažovat stupeň syntézy markerů a způsob jejich uvolňování z kostních buněk a z kosti. V neposlední řadě je nutné také zvažovat biologickou variabilitu koncentrací markerů podmíněnou věkem, pohlavím, cirkadiánními rytmy, sezonními, etnickými a geografickými vlivy, fyzickou aktivitou, výživou, těhotenstvím a kojením, případně prodělanou zlomeninou (3). Výpověď markerů může být ovlivněna metabolickými změnami v jiných tkáních, zejména v játrech a ledvinách, kde jsou markery dále metabolizovány nebo eliminovány z oběhu. Některé markery jsou prokazatelné, byť v menším zastoupení, i ve tkáních jiných než kost a jejich sérové koncentrace mohou být ovlivněny metabolizmem těchto tkání. I když koncentrace biochemických markerů kostní remodelace statisticky významně odlišují skupiny nemocných s prokázaným metastatickým nádorovým postižením skeletu od skupin nemocných bez metastáz, při časné diagnostice metastáz do skeletu zůstává výpověď zvýšené koncentrace markeru u jednotlivých pacientů pouze doplňujícím vyšetřením.
Časná výpověď markerů o metastatickém nádorovém postižení skeletu
Zvýšené sérové nebo močové koncentrace biochemických markerů resorpce kosti jsou v řadě studií metastáz nádorů do kostí prokazovány dříve než jinými metodami. Zvýšené koncentrace U-NTX v tomto ohledu predikovaly 2–3× vyšší riziko závažných kostních komplikací a 3–4× vyšší riziko úmrtí při metastázách karcinomu plic, prostaty a dalších solidních nádorů. U-NTX se při tom uplatňoval lépe než B-ALP, ať už nemocní byli nebo nebyli léčeni bisfosfonáty (28). Nemocní s karcinomem plic, prsu a prostaty přežívali kratší dobu, pokud měli zvýšené markery osteoresorpce (29). Při interpretaci všech těchto studií je nutné zvažovat velkou variabilitu hodnot markerů, které vypovídají nejen o nádorovém postižení skeletu, ale jsou ovlivněny i dalšími příčinami zvýšení kostní remodelace.
Znalost koncentrací biochemických markerů umožňuje lepší stratifikaci léčby, zejména užití nákladné léčby u nemocných s vysokým rizikem kostních komplikací metastatického postižení skeletu. Brown et al. sledovali po dobu 6 měsíců 121 nemocných s metastázami do kostí. Za předpokladu, že léčba snižuje riziko kostních komplikací o třetinu, bylo třeba k odvrácení jedné kostní komplikace léčit 21 nemocných, kteří měli U-NTX nižší než 50 nmol/mmol kreatininu. Při hodnotách U-NTX 50–100, 100–200 a nad 200 nmol/mmol kreatininu bylo třeba léčit 17, 3, respektive jen 2 nemocné (30).
Výpověď markerů při monitorování protinádorové léčby
Při posuzování antiresorpční účinnosti léčby bisfosfonáty u nemocných s metastatickým postižením skeletu při karcinomu prsu se v porovnání s výpovědí DPD/kreatinin v moči lépe osvědčilo hodnocení telopeptidů NTX-I a CTX-I (28), jejichž koncentrace klesají v závislosti na dávce léku (31). Osvědčeným markerem osteoresorpce při mnohočetném myelomu je S-CTX-MMP (17). Dalšími markery osteoresorpce pro monitorování efektu léčby jsou osteoklastická ACP (32) a sialoprotein. Při úspěšné léčbě mnohočetného myelomu se marker osteoresorpce snižuje a současně vzrůstá koncentrace markeru novotvorby kosti (25).
U nemocných s nádorovým metastatickým postižením skeletu je v praxi oceňována výpověď poklesu markerů osteoresorpce během prvních týdnů antiresorpční léčby o zastavení osteoresorpce a později o hojení léze. To při dlouhodobé léčbě může znamenat odvrácení kostních komplikací a zlepšení kvality života. Taková data již přinesla randomizovaná studie u 52 žen s karcinomem prsu, které kromě onkologické léčby dostávaly pamidronát. Zatímco vylučování U-PYD a U-DPD se neměnilo, vylučování NTX průkazně pokleslo a u léčených pacientek se postup kostního postižení zpomalil a počet patologických zlomenin byl nižší (33). Dvě studie u nemocných s mnohočetným myelomem a u žen s metastázami do skeletu při karcinomu prsu prokázaly při léčbě zoledronátem i pamidronátem obdobný průkazný pokles U-NTX a obdobné snížení počtu kostních komplikací kostního procesu (34). Snížení hodnot markerů osteoresorpce bylo rovněž spojeno s úlevou od bolestí při léčbě pamidronátem (35), clodronátem (36) a ibandronátem (37). Tyto klinické studie také ukázaly, že uvedené přínosy léčby lze očekávat při poklesu hodnot markerů do referenčních hodnot zdravé populace (35, 36). Zatím však není známo, při jakých dávkách, po jak dlouhé době léčby, u jakých pacientů, u kterých léků a při jak výrazném utlumení remodelace kosti převažují nežádoucí účinky nad klinickým přínosem léčby. Při antiresorpční léčbě vypovídá pokles markerů pod dolní mez referenčních hodnot o nadměrně suprimované remodelaci kosti, což je hlavní příčinou homogenně zvýšené mineralizace, zhoršené elasticity kosti (38), kumulace mikropoškození (39), nebo až adynamické kostní nemoci (40). Tyto poruchy kvality kosti byly pozorovány zejména při léčbě postmenopauzální osteoporózy alendronátem. Nadměrně suprimovaná remodelace kosti je také jednou z možných příčin osteonekrózy čelisti při častém podávání aminobisfosfonátů při nádorovém postižení skeletu (41).
S tím bezprostředně souvisejí obecnější otázky strategie léčby při metastatickém nádorovém postižení skeletu, kdy se podle charakteru kostního procesu uvažuje změna léčby, kombinace dosavadní léčby s další antiresorpční terapií, případně změna dávky nebo způsobu podávání léku. Stratifikace léčby, která vychází ze znalosti stupně osteoresorpce, umožňuje cílení nákladné léčby nemocným s vysokým rizikem kostních komplikací (30). Po potřebném snížení markeru osteoresorpce lze upravit dávku a frekvenci podávání léku tak, aby hodnoty markeru zůstávaly v rozmezí referenčních hodnot zdravé populace (42). Riziko nežádoucích účinků na kvalitu kosti lze snížit také užitím jiného bisfosfonátu s nižším efektem na supresi kostní remodelace, prodloužením dávkovacího intervalu, nebo aplikací léku i.v. místo p.o. (36). Naopak zjištění vysokých koncentrací markeru osteoresorpce, přetrvávajících i při nákladné terapii, usnadňuje rozhodnutí o přerušení léčby, protože lék nemá očekávaný efekt.
Výpověď markerů při monitorování nežádoucích ÚčINKŮ adjuvantní protinádorové léčby
Podávání selektivních inhibitorů aromatáz třetí generace (SIA, anastrozol, letrozol a exemestan) samostatně nebo sekvenčně po tamoxifenu jsou v současnosti preferovanou volbou adjuvantní léčby časných stadií hormonálně dependentních karcinomů prsu. Ve srovnání s tamoxifenem užívání SIA poslední generace není spojeno se zvýšením rizika vzniku karcinomu endometria, tromboembolických příhod, ischemických cerebrovaskulárních příhod, vzniku hluboké žilní trombózy, návalů a vaginálního krvácení. SIA poslední generace však téměř úplně suprimují aktivitu aromatáz, navozují významný pokles cirkulujících estrogenů, a akcelerují tak úbytek kostní hmoty a zvyšují riziko osteoporózy a osteoporotických zlomenin (43). Rovněž po chirurgické ovarektomii, při medikamentózní ovariální supresi LHRH analogy anebo nepřímo po chemoterapii, která může působit nepřímo blokádou estrogenní produkce, klesá denzita kostního minerálu (BMD) až o 4 % během 6 měsíců. Tato rizika jsou včasně signalizována zvýšením hodnot markerů kostní resorpce. Patogeneze osteoporózy u žen s karcinomem prsu je multifaktoriální, ale deficit estrogenů při aplikaci SIA u premenopauzálních a postmenopauzálních žen se pravděpodobně uplatňuje nejvýznamněji. U tamoxifenu z důvodu selektivně agonistického účinku na receptory estrogenů v kosti lze zaznamenat naopak protektivní efekt a vzestup BMD v průběhu roku v průměru o 0,6 %. SIA však ve většině adjuvantních indikací nahrazují tamoxifen a jejich nežádoucí účinky jsou proto aktuální. V klinické studii s exemestanem byl demonstrován vzestup markerů kostní resorpce (CTX a NTX) a markerů kostní novotvorby (bALP, PINP, OC) a vzestup markerů kostní resorpce byl spojen s rizikem fraktur (44). Americká asociace klinické onkologie doporučila změřit BMD už před zahájením léčby SIA, ale neexistují standardní doporučení pro sledování makerů kostní resorpce nebo formace. Protože kvalita života nemocných s nádorovým onemocněním je z dlouhodobého hlediska velmi důležitá, je nutné včas identifikovat nežádoucí účinky selektivních inhibitorů na skelet a zajistit účinná opatření bránící rozvoji osteoporózy. Z tohoto hlediska je kromě sledování BMD další možností monitorování nežádoucích účinků léčby SIA na kost opakované vyšetření kostních markerů. Kostní markery také umožňují monitorovat snížení osteoresorpce při podávání aminobisfosfonátů k prevenci osteoporózy u pacientek léčených SIA (45).
Závěr
Stanovení markerů kostní remodelace vypovídá v diferenciální diagnostice a při posuzování závažnosti nádorových nemocnění a při monitorování včasně vypovídá o dlouhodobých klinických přínosech (snížení počtu kostních komplikací kostního procesu, úleva od bolesti, zlepšení kvality života) a možných nežádoucích účincích léčby (nadměrná suprese remodelace kosti). Algoritmus využití markerů v onkologii by měl zahrnovat vyšetření alespoň jednoho markeru osteoresorpce a jednoho markeru novotvorby kosti po 3–6 měsících léčby antiresorpčním přípravkem (aminobisfosfonátem). Při zjištění koncentrací markeru pod dolní hranicí referenčních hodnot (nadměrná suprese remodelace kosti) anebo při hodnotách markeru nad horní hranicí referenčního rozmezí (pokračující nadměrná remodelace) by měla být zvážena úprava léčby. Při zavádění nových markerů je třeba zvažovat jejich senzitivitu a specificitu při různých nádorových onemocněních skeletu, interpretovat výsledky měření s ohledem na preanalytické faktory, cirkadiánní variabilitu, metabolizmus a clearance analytu a stanovit referenční hodnoty markerů.
Zkratky
ALP – alkalická fosfatáza
bALP – kostní alkalická fosfatáza
BMD – denzita kostního minerálu
BSP – kostní sialoprotein
DPD – deoxypyridinolin
CTX-I – karboxylterminální telopeptid kolagenu I
CTX-MMP – karboxylterminální telopeptid kolagenu I uvolňovaný metaloproteinázami
MGUS – monoclonal gammopathy of undetermined significance
MM – mnohočetný myelom
NTX-I – aminoterminální telopeptidy kolagenu I
OC – osteokalcin
OPG – osteoprotegerin
PICP – karboxyterminální propeptid prokolagenu I
PINP – aminoterminální propeptid prokolagenu I
PYD – pyridinolin
RANKL – receptor activator of nuclear factor kappa B ligand
S-bALP – kostní isoenzym sérové alkalické fosfatázy
SIA – selektivní inhibitor aromatáz třetí generace (anastrozol, letrozol a exemestan)
TNF – tumor necrosis factor
Práce byla podpořena Výzkumným záměrem MZ ČR 00064165.
Zdroje
1. Hamaoka, T., Madewell, J. E., Podoloff, D. A. et al.: Bone imaging in metastatic breast cancer. J. Clin. Oncol., 2004, 22, s. 2942–2953.
2. Štěpán, J.: Laboratorní diagnostika kostního metabolismu. In: Zima, T. (ed.) Laboratorní diagnostika. 2. ed. Praha, Galén, 2007, s. 229–269.
3. Delmas, P. D., Eastell, R., Garnero, P. et al.: The use of biochemical markers of bone turnover in osteoporosis. Osteoporos Int., 2000, 11 (Suppl. 6), s. S2–S17.
4. Wymenga, L. F., Groenier, K., Schuurman, J. et al.: Pretreatment levels of urinary deoxypyridinoline as a potential marker in patients with prostate cancer with or without bone metastasis. BJU Int., 2001, 88, s. 231–235.
5. Lipton, A., Ali, S. M., Leitzel, K. et al.: Serum osteoprotegerin levels in healthy controls and cancer patients. Clin. Cancer Res., 2002, 8, s. 2306–2310.
6. Depil, S., Mathiot, C., Leleu, X. et al.: Evaluation and prognostic value of serum osteoprotegerin in multiple myeloma. Br. J. Haematol., 2005, 129, s. 706–707.
7. Bellahcene, A., Menard, S., Bufalino, R. et al.: Expression of bone sialoprotein in primary human breast cancer is associated with poor survival. Int. J. Cancer, 1996, 69, s. 350–353.
8. De Pinieux, G., Flam, T., Zerbib, M. et al.: Bone sialoprotein, bone morphogenetic protein 6 and thymidine phosphorylase expression in localized human prostatic adenocarcinoma as predictors of clinical outcome: a clinicopathological and immunohistochemical study of 43 cases. J. Urol., 2001, 166, s. 1924–1930.
9. Michalská, D., Štěpán, J. J., Basson, B. R., Pavo, I.: The effect of raloxifene after discontinuation of long–term alendronate treatment of postmenopausal osteoporosis. J. Clin. Endocrinol. Metab., 2006, 91, s. 870–877.
10. Jukkola, A., Tahtela, R., Tholix, E. et al.: Aggressive breast cancer leads to discrepant serum levels of the type I procollagen propeptides PINP and PICP. Cancer Res., 1997, 57, s. 5517–5520.
11. Behrens, P., Bruns, J., Ullrich, K. P. et al.: Pyridinoline cross–links as markers for primary and secondary bone tumors. Scand. J. Clin. Lab. Inves., 2003, 63, s. 37–44.
12. Pecherstorfer, M., Zimmer-Roth, I., Schilling, T. et al.: The diagnostic value of urinary pyridinium cross–links of collagen, serum total alkaline phosphatase, and urinary calcium excretion in neoplastic bone disease. J. Clin. Endocrinol. Metab., 1995, 80, s. 97–103.
13. Jakob, C., Zavrski, I., Heider, U. et al.: Bone resorption parameters [carboxy–terminal telopeptide of type–I collagen (ICTP), amino–terminal collagen type–I telopeptide (NTx), and deoxypyridinoline (Dpd)] in MGUS and multiple myeloma. Eur. J. Haematol., 2002, 69, s. 37–42.
14. Oremek, G. M., Weis, A., Sapoutzis, N., Sauer-Eppel, H.: Diagnostic value of bone and tumour markers in patients with malignant diseases. Anticancer Res., 2003, 23, s. 987–990.
15. Abildgaard, N., Brixen, K., Kristensen, J. E. et al.: Comparison of five biochemical markers of bone resorption in multiple myeloma: elevated pre–treatment levels of S-ICTP and U‑Ntx are predictive for early progression of the bone disease during standard chemotherapy. Br. J. Haematol., 2003, 120, s. 235–242.
16. Ulrich, U., Rhiem, K., Schmolling, J. et al.: Cross-linked type I collagen C - and N-telopeptides in women with bone metastases from breast cancer. Arch. Gynecol. Obstet., 2001, 264, s. 186–190.
17. Bačovský, J., Ščudla, V., Vytřasová, M. et al.: Monitoring of bone resorption and bone formation in multiple myeloma. Biomed. Pap. Med. Fac. Univ. Palacky Olomouc Czech Repub, 2002, 146, s. 59–61.
18. Jakob, C., Zavrski, I., Heider, U. et al.: Serum levels of carboxy-terminal telopeptide of type-I collagen are elevated in patients with multiple myeloma showing skeletal manifestations in magnetic resonance imaging but lacking lytic bone lesions in conventional radiography. Clin. Cancer Res., 2003, 9, s. 3047–3051.
19. Abildgaard, N., Brixen, K., Eriksen, E. F. et al.: Sequential analysis of biochemical markers of bone resorption and bone densitometry in multiple myeloma. Haematologica, 2004, 89, s. 567–577.
20. Chao, T. Y., Ho, C. L., Lee, S. H. et al.: Tartrate-resistant acid phosphatase 5b as a serum marker of bone metastasis in breast cancer patients. Journal of biomedical science, 2004, 11, s. 511–516.
21. Fedarko, N. S., Jain, A., Karadag, A. et al.: Elevated serum bone sialoprotein and osteopontin in colon, breast, prostate, and lung cancer. Clin. Cancer Res., 2001, 7, s. 4060–4066.
22. Fonseca, R., Trendle, M. C., Leong, T. et al.: Prognostic value of serum markers of bone metabolism in untreated multiple myeloma patients. Br. J. Haematol., 2000, 109, s. 24–29.
23. Woitge, H. W., Pecherstorfer, M., Horn, E. et al.: Serum bone sialoprotein as a marker of tumour burden and neoplastic bone involvement and as a prognostic factor in multiple myeloma. Br. J. Cancer, 2001, 84, s. 344–351.
24. Terpos, E., Szydlo, R., Apperley, J. F. et al.: Soluble receptor activator of nuclear factor kappaB ligand-osteoprotegerin ratio predicts survival in multiple myeloma: proposal for a novel prognostic index. Blood, 2003, 102, s. 1064–1069.
25. Štěpán, J. J., Neuwirtová, R., Pacovský, V. et al.: Biochemical assessment of bone disease in multiple myeloma. Clin. Chim. Acta, 1984, 142, s. 203–209.
26. Tian, E., Zhan, F., Walker, R. et al.: The role of the Wnt-signaling antagonist DKK1 in the development of osteolytic lesions in multiple myeloma. N. Eng.l J. Med., 2003, 349, s. 2483–2494.
27. Yaccoby, S., Pearse, R. N., Johnson, C. L. et al.: Myeloma interacts with the bone marrow microenvironment to induce osteoclastogenesis and is dependent on osteoclast activity. Br. J. Haematol., 2002, 116, s. 278–290.
28. Coleman, R. E., Major, P., Lipton, A. et al.: Predictive value of bone resorption and formation markers in cancer patients with bone metastases receiving the bisphosphonate zoledronic acid. J. Clin. Oncol., 2005, 23, s. 4925–4935.
29. Ali, S. M., Demers, L. M., Leitzel, K. et al.: Baseline serum NTx levels are prognostic in metastatic breast cancer patients with bone–only metastasis. Ann. Oncol., 2004, 15, s. 455–459.
30. Brown, J. E., Thomson, C. S., Ellis, S. P. et al.: Bone resorption predicts for skeletal complications in metastatic bone disease. Br. J. Cancer, 2003, 89, s. 2031–2037.
31. Berenson, J. R., Vescio, R., Henick, K. et al.: A Phase I, open label, dose ranging trial of intravenous bolus zoledronic acid, a novel bisphosphonate, in cancer patients with metastatic bone disease. Cancer, 2001, 91, s. 144–154.
32. Terpos, E., de la Fuente, J., Szydlo, R. et al.: Tartrate-resistant acid phosphatase isoform 5b: a novel serum marker for monitoring bone disease in multiple myeloma. Int. J. Cancer., 2003, 106(3), s. 455–457.
33. Lipton, A., Demers, L., Curley, E. et al.: Markers of bone resorption in patients treated with pamidronate. Eur. J. Cancer, 1998, 34, s. 2021–2026.
34. Berenson, J. R., Rosen, L. S., Howell, A. et al.: Zoledronic acid reduces skeletal-related events in patients with osteolytic metastases. Cancer, 2001, 91, s. 1191–1200.
35. Vinholes, J. J., Purohit, O. P., Abbey, M. E. et al.: Relationships between biochemical and symptomatic response in a double-blind randomised trial of pamidronate for metastatic bone disease. Ann. Oncol., 1997, 8, s. 1243–1250.
36. Jagdev, S. P., Purohit, P., Heatley, S. et al.: Comparison of the effects of intravenous pamidronate and oral clodronate on symptoms and bone resorption in patients with metastatic bone disease. Ann. Oncol., 2001, 12, s. 1433–1438.
37. Body, J. J., Diel, I. J., Lichinitzer, M. et al.: Oral ibandronate reduces the risk of skeletal complications in breast cancer patients with metastatic bone disease: results from two randomised, placebo-controlled phase III studies. Br. J. Cancer, 2004, 90, s. 1133–1137.
38. Richer, E., Lewis, M. A., Odvina, C. V. et al.: Reduction in normalized bone elasticity following long–term bisphosphonate treatment as measured by ultrasound critical angle reflectometry. Osteoporos Int., 2005, 16, s. 1384–1392.
39. Štěpán, J. J., Burr, D. B., Pavo, I. et al.: Low bone mineral density is associated with bone microdamage accumulation in postmenopausal women with osteoporosis. Bone, 2007, 41, s. 378–385.
40. Ott, S. M.: Fractures after long–term alendronate therapy. J. Clin. Endocrinol. Metab., 2001, 86, s. 1835–1836.
41. Dunstan, C. R., Felsenberg, D., Seibel, M. J.: Therapy insight: the risks and benefits of bisphosphonates for the treatment of tumor-induced bone disease. Nature clinical practice, 2007, 4, s. 42–55.
42. Clemons, M., Enright, K., Cesta, A. et al.: Do physicians follow systemic treatment and funding policy guidelines? The Canadian journal of clinical pharmacology, 2004, 11, 168–178.
43. Eastell, R., Hannon, R.: Long-term effects of aromatase inhibitors on bone. J. Steroid. Biochem. Mol. Biol., 2005, 95, s. 151–154.
44. Pandya, N., Morris, G. J.: Toxicity of aromatase inhibitors. Semin. Oncol., 2006, 33, s. 688–695.
45. Gnant, M. F., Mlineritsch, B, Luschin-Ebengreuth, G. et al.: Zoledronic acid prevents cancer treatment–induced bone loss in premenopausal women receiving adjuvant endocrine therapy for hormone–responsive breast cancer. J. Clin. Oncol., 2007, 25, s. 820–828.
Štítky
Adiktologie Alergologie a imunologie Anesteziologie a resuscitace Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská dermatologie Dětská gastroenterologie Dětská gynekologie Dětská chirurgie Dětská kardiologie Dětská nefrologie Dětská neurologie Dětská onkologie Dětská otorinolaryngologie Dětská pneumologie Dětská psychiatrie Dětská radiologie Dětská revmatologie Dětská urologie Diabetologie Endokrinologie Farmacie Farmakologie Fyzioterapie Gastroenterologie a hepatologie Genetika Geriatrie a gerontologie Gynekologie a porodnictví Hematologie a transfuzní lékařství Hygiena a epidemiologie Hyperbarická medicína Chirurgie cévní Chirurgie hrudní Chirurgie plastická Chirurgie všeobecná Infekční lékařství Intenzivní medicína Kardiochirurgie Kardiologie Logopedie Mikrobiologie Nefrologie Neonatologie Neurochirurgie Neurologie Nukleární medicína Nutriční terapeut Obezitologie Oftalmologie Onkologie Ortodoncie Ortopedie Otorinolaryngologie Patologie Pediatrie Pneumologie a ftizeologie Popáleninová medicína Posudkové lékařství Praktické lékařství pro děti a dorost Protetika Psychologie Radiodiagnostika Radioterapie Rehabilitační a fyzikální medicína Reprodukční medicína Revmatologie Sestra Sexuologie Soudní lékařství Stomatologie Tělovýchovné lékařství Toxikologie Traumatologie Urgentní medicína Urologie Laboratoř Domácí péče Foniatrie Algeziologie Zdravotnictví Dentální hygienistka Student medicíny
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
-
Všechny články tohoto čísla
- Zima, T. et al.: Laboratorní diagnostika
- Esenciálna hypertenzia ako syndróm alebo kompenzačný mechanizmus?
- Krajíček, M., Peregrin, J. H., Roček, M. et al.: Chirurgická a intervenční léčba cévních onemocnění
- Zapojení mikroRNA do patogeneze nádorových onemocnění a možnosti jejich využití v diagnostické a prediktivní onkologii
- Předoperační příprava a vyšetření pacienta před plánovaným kardiochirurgickým výkonem
- Blok TXA2 v léčení svědivé dermatózy
- Neuropeptidové léčení pruritu (komentář)
- Vliv nízkokalorické diety na sérové koncentrace a expresi cytoadhezivních molekul v tukové tkáni u obézních žen
- Weiss, P. et al.: Sexuální zneužívání dětí
- Cyklosporín A verzus cyklofosfamid v liečbe detí s nefrotickým syndrómom
- Rudolf, G., Henningsen, P.: Psychotherapeutische Medizin und Psychosomatik
- Psychomotorické tempo a rychlost vyhledávání v sémantické paměti
- Fotodynamická terapie i viditelným světlem
- Migrační tendence u českých lékařů
- Politická korektnost a myšlení lékařů
- Historicko-medicínská výročí v roce 2008
- Celostátní sjezd Společnosti lékařské genetiky ČLS JEP a 40. výroční cytogenetická konference
- Obezitologie 200714. výroční kongres České obezitologické společnosti ČLS JEP
- Bohemica non legantur
- JIŽ POTŘETÍ BYLA UDĚLENA Cena časopisu lékařů českých
- K pětadevadesátinám farmakologické legendy prof. MUDr. Dr.h.c. Heleny Raškové, DrSc. (*2. ledna 1913)
- Prof. MUDr. Vladimír Bencko, DrSc. JUBILUJÍCÍ
- Výpověď biochemických markerů remodelace kosti při nádorovém postižení skeletu
- Laureáti Nobelovy ceny
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Esenciálna hypertenzia ako syndróm alebo kompenzačný mechanizmus?
- Předoperační příprava a vyšetření pacienta před plánovaným kardiochirurgickým výkonem
- Psychomotorické tempo a rychlost vyhledávání v sémantické paměti
- Zima, T. et al.: Laboratorní diagnostika
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



