-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaUžívání antipsychotik v těhotenství a jejich dopad na vrozené malformace a ranou adaptaci novorozence
Use of antipsychotics during pregnancy and their impact on congenital malformations and early neonatal adaptation
Objective: Review of recent literature dealing with the effect of antipsychotic use during pregnancy on early postpartum adaptation of exposed infants and the development of congenital malformations. Results: The use of antipsychotics during pregnancy does not appear to lead to significantly higher risk of congenital malformations but may pose a greater risk for the early adaptation of the newborn (especially the risk of preterm birth and intensive care unit admission). The study to date face methodological limitations – lack of information on exact doses of antipsychotics, lack of control groups of women with psychiatric problems but not taking antipsychotics and failure to control for confounding factors. Conclusion: The available data suggest the relative safety of antipsychotics during pregnancy, provided that potential risks are known, and the woman and her baby are carefully monitored.
Keywords:
childbirth – Antipsychotics – newborn – pregnancy – congenital malformation
Autoři: Kristýna Hrdličková 1,2
; H. Němcová 1,2
; A. Horáková 1,2
; Antonín Šebela 1,3
Působiště autorů: Národní ústav duševního zdraví, Klecany 1; Katedra psychologie, FF UK, Praha 2; 3. LF UK, Praha 3
Vyšlo v časopise: Ceska Gynekol 2023; 88(3): 221-230
Kategorie: Přehledová práce
doi: https://doi.org/10.48095/cccg2023221Souhrn
Cíl: Přehled recentní literatury zabývající se vlivem užívání antipsychotik v těhotenství na ranou poporodní adaptaci exponovaných dětí a vznik vrozených malformací. Výsledky: Užívání antipsychotik v těhotenství patrně nevede k významně většímu riziku vrozených vývojových vad, ale může znamenat větší riziko pro ranou adaptaci novorozence (především riziko předčasného porodu a hospitalizace na jednotce intenzivní péče). Dosavadní studie naráží na metodologické limity – chybějící informace o přesných dávkách antipsychotik, chybějící kontrolní skupiny žen s psychickými obtížemi, ale neužívající antipsychotika, a nekontrolování zavádějících faktorů. Závěr: Na základě dostupných dat lze usuzovat na relativní bezpečnost užívání antipsychotik v těhotenství, za předpokladu vědomí potenciálních rizik a pečlivého sledování ženy i jejího dítěte.
Klíčová slova:
těhotenství – porod – antipsychotika – novorozenec – vrozená malformace
Úvod
Užívání psychofarmak v těhotenství je aktuální a významnou otázkou v péči o psychiatrické pacientky v perinatálním období. Psychické zdraví těhotné ženy je jedním z pilířů bezproblémové gravidity i budoucího vývoje dítěte [1]. Počet žen, které v době těhotenství užívají psychofarmaka z důvodu přítomnosti psychické poruchy, stoupá [2,3]. Otázky ohledně dopadů užívání psychofarmak v těhotenství na vývoj plodu a dítěte patří mezi nejčastější obavy žen v období těhotenství.
V této studii se zaměřujeme na vliv užívání antipsychotik, tedy léčiv užívaných především k léčbě psychóz, bipolární poruchy či v rámci augmentační terapie u těžkých úzkostí a deprese. Taylor et al [4] uvádějí, že až u 24 % žen s neafektivní psychózou a u 12 % žen s afektivní psychotickou či bipolární poruchou dojde v období těhotenství k relapsu onemocnění. Významným rizikovým faktorem relapsu je samovolné vysazení psychofarmak [5].
Přinášíme proto systematický přehled recentní literatury zabývající se vlivem užívání antipsychotik v těhotenství na ranou poporodní adaptaci exponovaných dětí a vznik vrozených malformací. Původní vědecké práce jsme vyhledali v databázích PubMed a SCOPUS za použití klíčových slov – pregnancy, birth, delivery, antipsychotic/s, infant/newborn, neonatal a neonatal adaptation. Nalezeno bylo 2 113 výsledků, z toho bylo zařazeno 17 relevantních studií. Další dvě studie byly doplněny z referencí v identifikovaných pracích. Zařazeny byly pouze práce publikované v posledních 10 letech (mezi lety 2012 a 2022), které zároveň referovaly primární nálezy o vlivu prenatální expozice antipsychotikům na malformace a ranou adaptaci novorozence.
Vliv užívání antipsychotik v těhotenství na dítě
Farmakodynamický účinek antipsychotik se liší dle dané skupiny léků. Ve stručnosti lze nicméně říci, že většina z nich působí skrze antagonizmus na dopaminových a částečně serotoninových receptorech [6]. Pokud jsou antipsychotika užívána během těhotenství, prostupují placentou [7]. Posouzení vhodnosti antipsychotické léčby během těhotenství tak spočívá v porovnání rizika nežádoucích dopadů expozice na dítě a průběh těhotenství a rizika spojeného s neléčeným nebo nedostatečně léčeným psychiatrickým onemocněním.
Malformace plodu
Identifikovali jsme celkem 11 studií, které se věnovaly potenciálnímu vlivu prenatální expozice antipsychotikům na malformace, tedy vrozené vývojové vady (tab. 1). Tři prospektivní studie sledovaly ženy po celou dobu těhotenství až do 2–6 měsíců věku dítěte. Studie se zaměřily na vliv vždy jednoho konkrétního atypického antipsychotika:
• paliperidonu [8];
• aripiprazolu [9];
• kvetiapinu [10].
Tab. 1. Malformace.
Tab. 1. Malformation.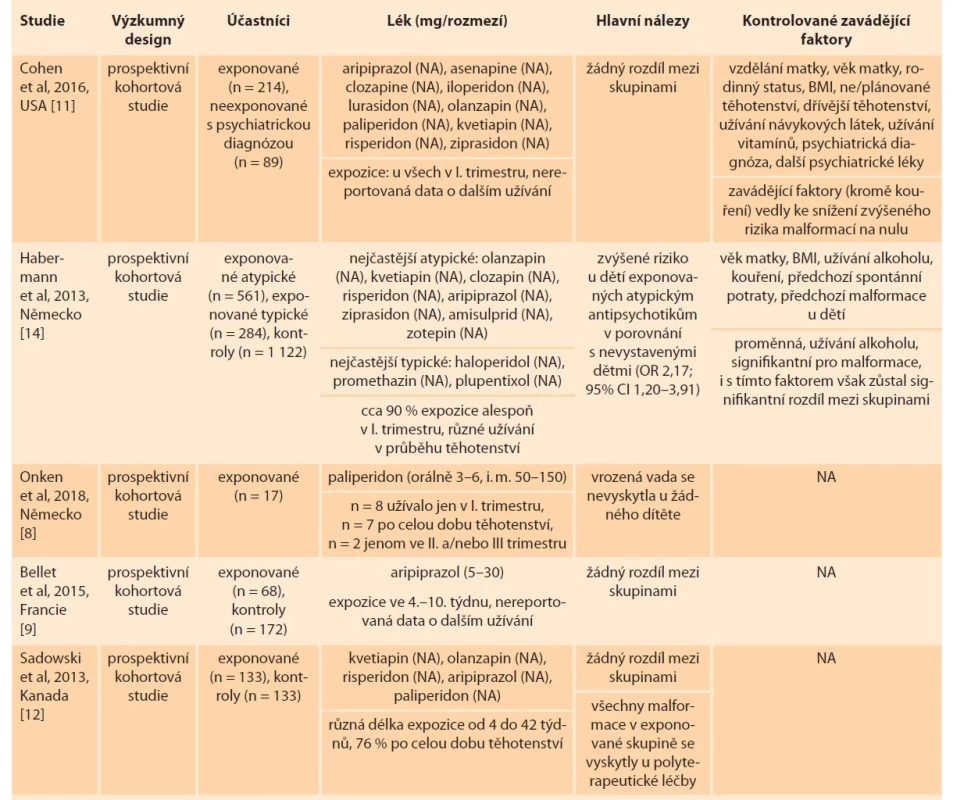
BMI – body mass index, CI – index spolehlivosti, JIP – jednotka intenzivní péče, n – počet, NA – neuvedeno, OR – odds ratio Tab. 1 – pokračování. Malformace.
Tab. 1 – continuing. Malformation.
BMI – body mass index, CI – index spolehlivosti, JIP – jednotka intenzivní péče, n – počet, NA – neuvedeno, OR – odds ratio Ani u jednoho z těchto léčiv zmíněné studie neprokázaly zvýšené riziko výskytu vrozených malformací. Konkrétně Onken et al [8] sledovali 17 žen užívajících paliperidon v průběhu těhotenství (z nich osm pouze v I. trimestru, dvě pouze ve II. a/nebo III. trimestru a sedm po celou dobu těhotenství), které nesrovnávali s žádnou kontrolní skupinou. Vrozená vada se nevyskytla u žádného z narozených dětí. Ve výzkumu od Bellet et al [9] se u 2,8 % dětí prenatálně vystavených aripiprazolu objevily vrozené vady (1krát atrezie jícnu, 1krát mnohočetné kardiovaskulární malformace, a v několika případech méně závažné poruchy kardiovaskulárního a osteoartikulárního systému a genitálního traktu) v porovnání s 1,2 % nevystavených dětí. Ve výzkumu Cohen et al [10] se u 1,3 % dětí prenatálně vystavených kvetiapinu objevily vrozené vady (1krát transpozice velkých tepen, 1krát plicní stenóza v důsledku dysplastické plicní chlopně) v porovnání s 1,4 % nevystavených dětí (jejichž matky však měly psychiatrickou diagnózu a některé z nich užívaly jiná psychofarmaka). Rozdíly nedosáhly statistické významnosti. Ženy sledované v obou těchto studiích užívaly antipsychotika v I. trimestru, informace o možném dalším užívání nejsou dostupné. Jiná prospektivní studie [11] porovnávala 214 žen vystavených v I. trimestru atypickým antipsychotikům s 89 ženami neužívajícími antipsychotika (z nichž však většina měla stanovenou psychiatrickou diagnózu a užívala jiný typ psychofarmak). Ve skupině prenatálně exponovaných dětí se objevily celkem tři vrozené malformace (1krát transpozice velkých tepen, 1krát defekt komorového septa, 1krát atrezie hymenu) v porovnání s jednou malformací v neexponované skupině. Všechny malformace v exponované skupině se vyskytly při léčbě v kombinaci s více užívanými psychofarmaky zároveň. Po zahrnutí zavádějících proměnných (alkohol, diagnóza bipolární poruchy, plánované vs. neplánované těhotenství, body mass index, další užívaná psychofarmaka) se růst rizika pro vrozenou vadu při užívání antipsychotik v těhotenství zdál nevýznamný. Sadowski et al [12] se v prospektivní studii zaměřili na atypická antipsychotika užívaná v monoterapii i v kombinacích s jinými léky. Nejčastějšími současně užívanými léčivy byla antidepresiva a dále benzodiazepiny a antikonvulziva. Počet vyskytnutých malformací se signifikantně nelišil mezi dětmi prenatálně vystavenými a nevystavenými antipsychotikům, i když míra malformací v exponované skupině byla asi 2,5krát větší než v neexponované skupině (6,2 vs. 2,6 %). Je důležité uvést, že všechny malformace v exponované skupině se objevily u dětí narozených ženám léčeným kombinací různých léků. Výsledky nejsou kontrolované pro žádné zavádějící faktory a ženy užívající jakékoli návykové látky byly ze studie vyřazeny. Ani v retrospektivní studii od Hatters Friedman et al [13] nenalezli větší výskyt vrozených malformací u prenatálně exponovaných dětí. Ve skupině 45 žen užívajících antipsychotika se vyskytly dvě malformace (1krát rozštěp patra, 1krát pes equinovarus), ne víc, než je očekávaný populační průměr. K odlišným závěrům dochází prospektivní studie od Habermanna et al [14]. Ta reportuje zvýšené riziko vrozených malformací u dětí prenatálně vystavených atypickým antipsychotikům v porovnání s nevystavenými dětmi, a to i po zahrnutí zavádějící proměnné užívání alkoholu (OR 2,17; 95% CI 1,20–3,91). Post hoc analýza pak ukázala zvýšené riziko vad kardiovaskulárního systému (OR 3,21; 95% CI 1,34–7,67). Výskyt malformací se nelišil mezi dětmi exponovanými typickým antipsychotikům a atypickým antipsychotikům a mezi dětmi exponovanými typickým antipsychotikům a neexponovanými dětmi. V post hoc analýze nebylo identifikováno samostatné zvýšené riziko pro žádné zahrnuté antipsychotikum (všechna zahrnutá léčiva ze studie Habermanna et al [14] i Cohen et al [11] jsou uvedena v tab. 1).
Další práce zkoumající vliv antipsychotik na vrozené malformace mají charakter retrospektivních registrových studií. Jejich výhodou je možnost zkoumání velkého vzorku. Limitem je však to, že expozice antipsychotikům je v těchto studiích definována pouze jako předepsání léku lékařem, a tudíž neposkytují informace o skutečném užívání. Tři tyto studie [15–17] porovnávaly výskyt malformací u dětí prenatálně vystavených atypickým antipsychotikům, typickým antipsychotikům a u dětí nevystavených antipsychotikům. Zároveň všechny kontrolovaly případné riziko na řadu zavádějících faktorů, mezi nimi věk matky, body mass index, užívání alkoholu a jiných drog, kouření, užívání dalších léků a zdravotní obtíže. Takto adjustovaná data neprokázala významné riziko spojené s užíváním typických a atypických antipsychotik, s výjimkou olanzapinu a risperidonu. Pro tato dvě léčiva přináší studie rozporné výsledky:
• Ellfolk et al [15] reportují dvojnásobné riziko vrozených vážných malformací (specificky muskuloskeletální soustavy) při expozici olanzapinu (OR 2,12; 95% CI 1,19–3,76) a nezvýšené riziko při expozici risperidonu (OR 1,48; 95% CI 0,75–2,90);
• Huybrechts et al [16] reportují zvýšené riziko vrozených vážných malformací při expozici risperidonu (RR 1,26; 95% CI 1,02–1,56) a nezvýšené při expozici olanzapinu (RR 1,09; 95% CI 0,85–1,41).
Autoři uvádějí, že tyto výsledky by měly být interpretovány jako signál o potenciální závažnosti jejich užívání, kterou je třeba potvrdit dalšími studiemi.
Montastruc et al [18] použili pro svůj výzkum databázi Světové zdravotnické organizace (WHO) „Global Individual Case Safety Reports“ – databázi hlášených nežádoucích účinků léčiv. Ve srovnání s hodnotami zjištěnými u všech ostatních léků byla míra hlášení významně vyšší u antipsychotik v případě vrozených poruch patra (zvýšení prevalence reportované události, PRR 2,1; 95% CI 1,6–2,9), poruch jícnu (PRR 2,5; 95% CI 1,3–4,7) a anorektálních poruch (PRR 3,0; 95% CI 1,6–5,6). Antipsychotika spojená s těmito nálezy byla především fenothiazinová antipsychotika ze skupiny piperazinů (která jsou v současné době předepisována relativně málo) a risperidon, v souvislosti s anorektálními poruchami též aripiprazol.
Novorozenecká hospitalizace na jednotce intenzivní péče
Další publikace, kterým jsme se v této přehledové studii věnovali, se zaměřovaly na dopady prenatální expozice antipsychotikům na ranou adaptaci novorozence (tab. 2). Jednou ze sledovaných proměnných byla míra hospitalizace novorozence na jednotce intenzivní péče (JIP). Identifikovali jsme sedm studií. Registrová studie Ellfolk et al [15] zjistila v případě atypických antipsychotik vyšší riziko přijetí na JIP (OR 1,46; 95% CI 1,27–1,68) a hospitalizace v 7 dnech od porodu (OR 1,52; 95% CI 1,27–1,82), přičemž riziko se ještě zvýšilo při započítání pouze expozice ve III. trimestru (OR 1,62; 95% CI 1,35–1,94; OR 1,53; 95% CI 1,21–1,93; v tomto pořadí). Také další registrová studie [19] potvrzuje zvýšené riziko přijetí do neonatologické péče u dětí vystavených antipsychotikům ve srovnání s neexponovanými vrstevníky:
• expozice pouze v prvních 90 dnech těhotenství zvyšovala riziko o polovinu (RR 1,5; 95% CI 1,3–1,7);
• expozice v pozdním těhotenství riziko dále zvyšovala (RR 1,8; 95% CI 1,6–2,0) (adjustované na mateřské faktory, tab. 2).
Tab. 2. Novorozenecká data.
Tab. 2. Neonatal data.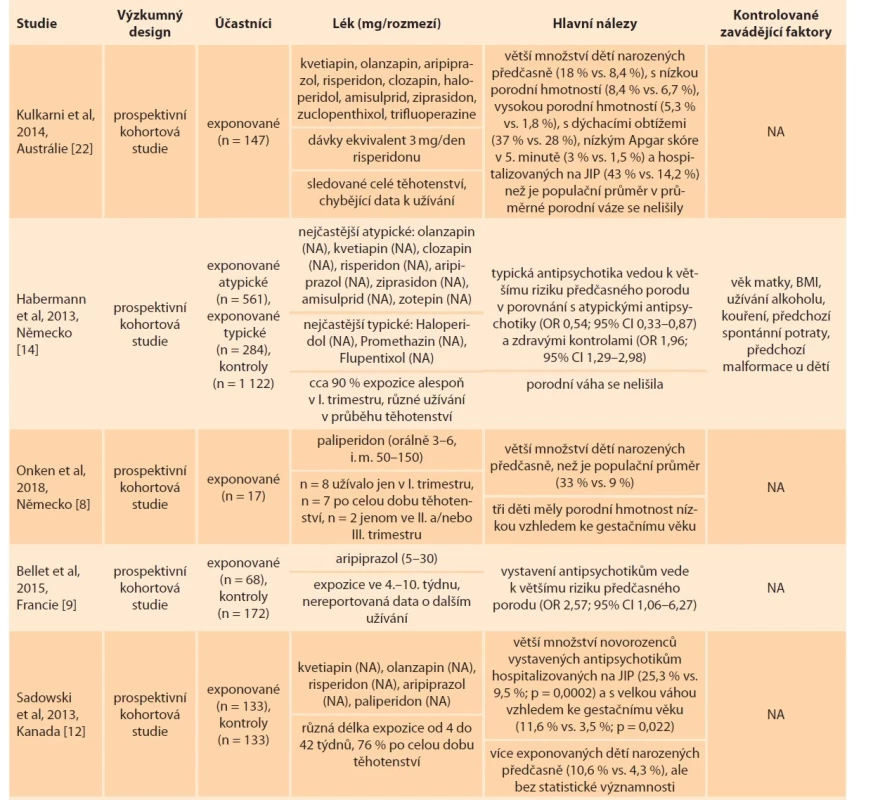
BMI – body mass index, CI – index spolehlivosti, JIP – jednotka intenzivní péče, n – počet, NA – neuvedeno, OR – odds ratio, RRadj – relativní riziko adjustované na zavádějící faktory Tab. 2 – pokračování. Novorozenecká data.
Tab. 2 – continuing. Neonatal data.
BMI – body mass index, CI – index spolehlivosti, JIP – jednotka intenzivní péče, n – počet, NA – neuvedeno, OR – odds ratio, RRadj – relativní riziko adjustované na zavádějící faktory Tab. 2 – pokračování. Novorozenecká data.
Tab. 2 – pokračování. Neonatal data.
BMI – body mass index, CI – index spolehlivosti, JIP – jednotka intenzivní péče, n – počet, NA – neuvedeno, OR – odds ratio, RRadj – relativní riziko adjustované na zavádějící faktory Důvody pro hospitalizaci nebyly v těchto studiích uvedeny.
Také další retrospektivní i prospektivní studie upozorňují na větší výskyt hospitalizací prenatálně exponovaných dětí, přičemž se jedná o cca 40 % dětí. Ve výzkumu Frayne et al [20] bylo na JIP hospitalizováno 41,3 % dětí exponovaných jakémukoli psychofarmaku a 26,9 % neexponovaných dětí (p = 0,035). Skupiny psychofarmak se mezi sebou nelišily. Následná analýza byla provedena pouze pro děti narozené v termínu a adjustovaná pro proměnnou kouření, užívání návykových látek, obezitu a preeklampsii a gestační diabetes. V tomto případě už nepředstavovala expozice psychofarmakům zvýšené riziko (OR 1,82; 95% CI 0,85–3,9). Nguyen et al [21] v retrospektivní studii analyzovali 38 těhotenství exponovaných dlouhodobě působící injekční antipsychotické léčbě a data porovnávali s populačním průměrem. Na JIP muselo být přijato 47,4 % exponovaných novorozenců v porovnání s pouze 12,4 % v rámci populačního průměru (p < 0,001). Podobně Kulkarni et al [22] sledovali po celou dobu těhotenství 147 žen užívajících antipsychotika. Celkem 43 % dětí vyžadovalo hospitalizaci na JIP, tedy více než 3krát populační průměr.
Již zmíněná prospektivní studie Sadowskeho et al [12] reportuje sice nižší poměr hospitalizovaných dětí, ale stále signifikantní rozdíl (exponované děti 25,3 % vs. neexponované 9,5 %; p = 0,002). Větší množství těchto dětí bylo vystaveno polyterapeutické léčbě (kombinovanému užívání antipsychotik s dalším psychofarmakem; 28,8 vs. 16 %), rozdíl mezi polyterapií a monoterapií však nebyl signifikantní.
Pouze retrospektivní kohortová studie Hatters Friedman et al [13] sledující 45 žen užívajících atypická antipsychotika neuvádí rozdíl v počtu hospitalizovaných dětí (4 %) v porovnání s populačním průměrem.
Apgar skóre, porodní výška a hmotnost, předčasný porod
Celkem jsme identifikovali 14 studií, které se zabývaly vlivem na časnou adaptaci novorozence (podrobné informace viz tab. 2). Prospektivní studie Peng et al [23] porovnávala ženy s diagnózou schizofrenie užívající po celou dobu těhotenství atypická antipsychotika s kontrolami bez diagnózy. Jejich narozené děti se nelišily v hodnotách Apgar skóre, v průměrné výšce ani hmotnosti, ale více exponovaných dětí mělo nízkou porodní hmotnost (< 2,5 kg) než neexponovaných (13,2 vs. 2,6 %; p = 0,031). Podobně Kulkarni et al [22] uvádějí u exponovaných dětí očekávanou průměrnou hmotnost, ale současně větší množství dětí s nízkou porodní hmotností (8,4 vs. 6,7 %) a vysokou porodní hmotností (> 4,5 kg; 5,3 vs. 1,8 %). Důležitá jsou také data o předčasném porodu – 18 % exponovaných dětí bylo v tomto vzorku narozeno předčasně, přičemž očekávaná hodnota je 8,4 %. Signifikantní korelace byla nalezena mezi předčasným porodem a množstvím dávky antipsychotik ve 12. týdnu těhotenství (2,6 vs. 5 mg; r2 = 0,12; p = 0,01). Ve sledovaném vzorku Sadowskeho et al [12] bylo více předčasně narozených dětí prenatálně exponovaných atypickým antipsychotikům (10,6 %) než neexponovaných (4,3 %), výsledky ale nedosáhly statistické významnosti. Skupiny se nelišily v průměrné porodní hmotnosti, ale více exponovaných dětí mělo vysokou hmotnost vzhledem ke gestačnímu věku. Dle Vigod et al [24] se počet předčasně narozených dětí a dětí s nízkou či vysokou porodní hmotností nelišil mezi párovanými skupinami žen užívajícími a neužívajícími antipsychotika. Autoři však upozorňují na velmi vysoké množství předčasných porodů (14 %) – 2krát více, než je populační průměr. Podobně dle Nguyen et al [21] se neobjevilo více předčasných porodů v rámci těhotenství exponovaných dlouhodobě působící injekční antipsychotické léčbě v porovnání s populačním průměrem, přesto bylo v první skupině předčasných porodů téměř 2krát více (15,8 vs. 8,7 %).
Podrobnější data poskytují Habermann et al [14]. Ti uvádějí větší množství předčasně narozených dětí prenatálně exponovaných typickým antipsychotikům (15,7 %) v porovnání s dětmi exponovanými atypickým antipsychotikům (9,2 %; OR 1,54; 95% CI 1,33–1,87) a v porovnání s neexponovanými dětmi (8,7 %; OR 1,96; 95% CI 1,29–2,98). Rozdíly v porodní hmotnosti byly mezi skupinami dětí klinicky nevýznamné. Naopak dle registrové studie Ellfolk et al [15] měly ženy užívající atypická antipsychotika větší riziko předčasného porodu než neužívající ženy (OR 1,29; 95% CI 1,03–1,62), ale ne větší než ženy užívající typická antipsychotika (OR 0,87; 95% CI 0,63–1,20) (data adjustovaná na zavádějící proměnné, tab. 2). Petersen et al [17] rovněž v registrové studii porovnávali ženy užívající antipsychotika během těhotenství se ženami, které antipsychotika přestaly užívat před početím, a se ženami, které je nikdy neužívaly. Ženy užívající antipsychotika měly větší riziko předčasného porodu a/nebo nízké porodní hmotnosti dítěte (10 %) v porovnání s bývalými uživatelkami antipsychotik (4,3 %; RRadj 2,04; 95% CI 1,13–3,67), v porovnání s kontrolami rozdíl nebyl nalezen (3,9 %; RRadj 1,43; 95% CI 0,99–2,05). Typická a atypická antipsychotika se mezi sebou nelišila. Celkem 6 % dětí, které byly antipsychotikům vystaveny ve III. trimestru těhotenství, vykazovalo známky špatné rané adaptace (třes, agitovanost, problémy s dýcháním a svalovým tonusem, nízké Apgar skóre), ale po adjustování na zavádějící faktory souběžného užívání antidepresiv a antikonvulziv a faktory zdraví a životního stylu matky nebyl zjištěn statisticky významný rozdíl oproti dalším skupinám. K jinému výsledku dochází v registrových datech studie Bodéna et al [25]. Po adjustování na zavádějící faktory (tab. 2) se riziko nízké porodní hmotnosti vzhledem ke gestačnímu věku nelišilo pro děti prenatálně exponované a neexponované antipsychotikům.
Menší prospektivní studie se zaměřily na vliv jednoho konkrétního léku. Bellet et al [9] zaznamenali větší množství předčasně narozených dětí exponovaných aripiprazolu (16,4 %) v porovnání s neexponovanými dětmi (7,1 %; OR 2,57; 95% CI 1,06–6,27). Studie Onken et al [8] zkoumala vliv paliperidonu. Předčasně bylo narozeno 5 z 15 exponovaných dětí, což je více než očekávaný populační průměr (33 vs. 9 %). Tři děti měly porodní hmotnost nízkou vzhledem ke gestačnímu věku. Výsledky lze alespoň částečně vysvětlit dalšími faktory – matky těchto dětí v průběhu těhotenství kouřily a v jednom případě se jednalo o vícečetné těhotenství. Velikost vzorku a chybějící kontrolní skupina však znemožňuje důkladnou analýzu.
Menší retrospektivní studie [13] nenalezla rozdíl v počtu předčasně narozených dětí, Apgar skóre ani porodní hmotnosti mezi prenatálně exponovanými dětmi a populačním průměrem. V jiné retrospektivní studii [26] autoři porovnávali psychiatrické pacientky užívající a neužívající psychofarmaka. Analýza pro Apgar skóre však byla provedena pro všechny skupiny psychofarmakologických léků společně, a není tak možné popsat pouze vliv antipsychotik. Ve skupině žen užívajících antipsychotika nebylo žádné z dětí předčasně narozené, nemělo nízkou porodní hmotnost ani nízkou porodní hmotnost vzhledem ke gestačnímu věku.
Kritické zhodnocení nálezů
Studie zaměřující se na bezpečnost užívání antipsychotik v těhotenství s ohledem na vývoj plodu a dítěte naráží na metodologické limitace. Většina např. neuvádí informaci o hladině užívaného léku v plazmě matky při dané dávce léku. Grzeskowiak et al [27] ve svém systematickém review uvádí, že klíčové faktory, jako je dávka, doba trvání a načasování expozice psychofarmakům, jsou ve studiích popsány nejednotně. Zároveň existuje velká variabilita ve způsobu hodnocení expozice lékům a ve způsobu, jakým se v analýzách nakládá s daty žen, které přestaly užívat léky před těhotenstvím nebo během časného těhotenství. Velké registrové studie i přes značný přínos velkého vzorku negarantují jistotu skutečného užívání léku ženami. Pouze tři výzkumy popsané v naší přehledové studii porovnávaly ženy užívající antipsychotika se ženami s duševními obtížemi, ale neužívajícími psychofarmaka. Výsledky výzkumů naznačují, že samotná přítomnost psychických obtíží může být faktorem negativně ovlivňujícím vývoj plodu a dítěte [10,11], a to i po konci perinatálního období [28]. Další výzkum by neměl opomenout tyto důležité informace.
Závěr
Důkazy celkově vzato naznačují, že užívání antipsychotik během těhotenství významně nezvyšuje riziko vrozených vývojových vad. Může však znamenat větší riziko pro ranou adaptaci novorozence. Největším rizikem z pozorovaných proměnných se zdá být předčasný porod vedoucí k většímu množství dětí hospitalizovaných na JIP. Na základě zatím dostupných dat lze však usuzovat na relativní bezpečnost užívání antipsychotik v těhotenství za předpokladu vědomí potenciálních rizik a pečlivého sledování ženy i jejího dítěte.
ORCID autorů
K. Hrdličková 0000-0002-8039-290X
H. Němcová 0000-0001-6114-6191
A. Horáková 0000-0001-9582-9900
A. Šebela 0000-0002-1063-7772
Doručeno/Submitted: 28. 3. 2023
Přijato/Accepted: 31. 3. 2023
Mgr. Kristýna Hrdličková
Národní ústav duševního zdraví
Topolová 748
250 67 Klecany
Zdroje
1. Apter G, Devouche E, Gratier M. Perinatal mental health. J Nerv Ment Dis 2011; 199 (8): 575–577. doi: 10.1097/NMD.0b013e318225f2f4.
2. Andrade SE, Raebel MA, Brown J et al. Use of antidepressant medications during pregnancy: a multisite study. Am J Obstet Gynecol 2008; 198 (2): 194.e1–194.e5. doi: 10.1016/ j.ajog.2007.07.036.
3. Riska BS, Skurtveit S, Furu K et al. Dispensing of benzodiazepines and benzodiazepine-related drugs to pregnant women: a population-based cohort study. Eur J Clin Pharmacol 2014; 70 (11): 1367–1374. doi: 10.1007/s00228-014-1744-4.
4. Taylor CL, Broadbent M, Khondoker M et al. Predictors of severe relapse in pregnant women with psychotic or bipolar disorders. J Psychiatr Res 2018; 104 : 100–107. doi: 10.1016/j.jpsychires.2018.06.019.
5. Viguera AC, Whitfield T, Baldessarini RJ et al. Risk of recurrence in women with bipolar disorder during pregnancy: prospective study of mood stabilizer discontinuation. Am J Psychiatry 2007; 164 (12): 1817–1923. doi: 10.1176/appi.ajp.2007.06101639.
6. Raha S, Taylor VH, Holloway AC. Effect of atypical antipsychotics on fetal growth: is the placenta involved? J Pregnancy 2012; 2012 : 315203. doi: 10.1155/2012/315203.
7. Newport DJ, Calamaras MR, DeVane CL et al. Atypical antipsychotic administration during late pregnancy: placental passage and obstetrical outcomes. Am J Psychiatry 2007; 164 (8): 1214–1220. doi: 10.1176/appi.ajp.2007.061 11886.
8. Onken M, Mick I, Schaefer C. Paliperidone and pregnancy-an evaluation of the German Embryotox database. Arch Womens Ment Health 2018; 21 (6): 657–662. doi: 10.1007/s00737-018-0828-z.
9. Bellet F, Beyens MN, Bernard N et al. Exposure to aripiprazole during embryogenesis: a prospective multicenter cohort study. Pharmacoepidemiol Drug Saf 2015; 24 (4): 368–380. doi: 10.1002/pds.3749.
10. Cohen LS, Góez-Mogollón L, Sosinsky AZ et al. Risk of major malformations in infants following first-trimester exposure to quetiapine. Am J Psychiatry 2018; 175 (12): 1225–1231. doi: 10.1176/appi.ajp.2018.18010098.
11. Cohen LS, Viguera AC, McInerney KA et al. Reproductive safety of second-generation antipsychotics: current data from the massachusetts general hospital national pregnancy registry for atypical antipsychotics. Am J Psychiatry 2016; 173 (3): 263–270. doi: 10.1176/appi.ajp.2015.15040506.
12. Sadowski A, Todorow M, Yazdani Brojeni P et al. Pregnancy outcomes following maternal exposure to second-generation antipsychotics given with other psychotropic drugs: a cohort study. BMJ Open 2013; 3 (7): e003062. doi: 10.1136/bmjopen-2013-003062.
13. Hatters Friedman S, Moller-Olsen C, Prakash C et al. Atypical antipsychotic use and outcomes in an urban maternal mental health service. Int J Psychiatry Med 2016; 51 (6): 521–533. doi: 10.1177/0091217417696739.
14. Habermann F, Fritzsche J, Fuhlbrück F et al. Atypical antipsychotic drugs and pregnancy outcome: a prospective, cohort study. J Clin Psychopharmacol 2013; 33 (4): 453–462. doi: 10.1097/JCP.0b013e318295fe12.
15. Ellfolk M, Leinonen MK, Gissler M et al. Second-generation antipsychotic use during pregnancy and risk of congenital malformations. Eur J Clin Pharmacol 2021; 77 (11): 1737–1745. doi: 10.1007/s00228-021-03169-y.
16. Huybrechts KF, Hernández-Díaz S, Patorno E et al. Antipsychotic use in pregnancy and the risk for congenital malformations. JAMA Psychiatry 2016; 73 (9): 938–946. doi: 10.1001/jamapsychiatry.2016.1520.
17. Petersen I, Sammon CJ, McCrea RL et al. Risks associated with antipsychotic treatment in pregnancy: comparative cohort studies based on electronic health records. Schizophr Res 2016; 176 (2–3): 349–356. doi: 10.1016/ j.schres.2016.07.023.
18. Montastruc F, Salvo F, Arnaud M et al. Signal of fastrointestinal congenital malformations with antipsychotics after minimising competition bias: a disproportionality analysis using data from bigibase (®). Drug Saf 2016; 39 (7): 689–696. doi: 10.1007/s40264-016-0413-1.
19. Heinonen E, Forsberg L, Nörby U et al. Neonatal morbidity after fetal exposure to antipsychotics: a national register-based study. BMJ Open 2022; 12 (6): e061328. doi: 10.1136/bmj open-2022-061328.
20. Frayne J, Nguyen T, Bennett K et al. The effects of gestational use of antidepressants and antipsychotics on neonatal outcomes for women with severe mental illness. Aust N Z J Obstet Gynaecol 2017; 57 (5): 526–532. doi: 10.1111/ajo.12621.
21. Nguyen T, Frayne J, Watson S et al. Long-acting injectable antipsychotic treatment during pregnancy: outcomes for women at a tertiary maternity hospital. Psychiatry Res 2022; 313 : 114614. doi: 10.1016/j.psychres.2022.114614.
22. Kulkarni J, Worsley R, Gilbert H et al. A prospective cohort study of antipsychotic medications in pregnancy: the first 147 pregnancies and 100 one year old babies. PLoS One 2014; 9 (5): e94788. doi: 10.1371/journal.pone.0094788.
23. Peng M, Gao K, Ding Y et al. Effects of prenatal exposure to atypical antipsychotics on postnatal development and growth of infants: a case-controlled, prospective study. Psychopharmacology (Berl) 2013; 228 (4): 577–584. doi: 10.1007/s00213-013-3060-6.
24. Vigod SN, Gomes T, Wilton AS et al. Antipsychotic drug use in pregnancy: high dimensional, propensity matched, population based cohort study. BMJ 2015; 350: h2298. doi: 10.1136/bmj.h2298.
25. Bodén R, Lundgren M, Brandt L et al. Antipsychotics during pregnancy: relation to fetal and maternal metabolic effects. Arch Gen Psychiatry 2012; 69 (7): 715–721. doi: 10.1001/archgenpsychiatry.2011.1870.
26. Michielsen LA, van der Heijden FM, Janssen PK et al. Effects of maternal psychotropic drug dosage on birth outcomes. Neuropsychiatr Dis Treat 2014; 10 : 13–18. doi: 10.2147/NDT.S53430.
27. Grzeskowiak LE, Gilbert AL, Morrison JL. Exposed or not exposed? Exploring exposure classification in studies using administrative data to investigate outcomes following medication use during pregnancy. Eur J Clin Pharmacol 2012; 68 (5): 459–467. doi: 10.1007/s00 228-011-1154-9.
28. Englerová K, Takács L. Prenatální, perinatální a neonatální faktory a jejich vliv na školní úspěšnost u dětí mladšího školního věku. Ceska Gynekol 2020; 85 (1): 71–79.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicína
Článek Zrastlice typu thoracopagus
Článek vyšel v časopiseČeská gynekologie
Nejčtenější tento týden
2023 Číslo 3- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
-
Všechny články tohoto čísla
- Detekce sentinelové lymfatické uzliny u karcinomu endometria – porovnání účinnosti robotického a laparoskopického detekčního systému
- Prenatálny záchyt variant so zmenou v počte kópií u plodov so zachytenými vrodenými vývojovými poruchami, v období 2015–2020 metódou Multiplex Ligation-Dependent Probe Amplification a mikročipovou analýzou
- Úloha systémového zánětlivého indexu při určování délky hospitalizace u pacientů s hyperemesis gravidarum
- Fyzioterapia u pacientky s diastázou priameho brušného svalu po pôrode
- Zrastlice typu thoracopagus
- Udržitelnost, populace a reprodukční etika
- Obezita a asistovaná reprodukce
- Intrauterinní adheze a jejich prevence
- Bolesti v oblasti panvy u žien po pôrode a fyzioterapia
- Užívání antipsychotik v těhotenství a jejich dopad na vrozené malformace a ranou adaptaci novorozence
- Prof. MUDr. Zdeněk Hájek, DrSc. – 80letý
- Kompetence lékaře po úspěšném absolvování kmenové zkoušky z oboru gynekologie a porodnictví
- Česká gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Bolesti v oblasti panvy u žien po pôrode a fyzioterapia
- Fyzioterapia u pacientky s diastázou priameho brušného svalu po pôrode
- Intrauterinní adheze a jejich prevence
- Obezita a asistovaná reprodukce
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



