-
Medical journals
- Career
Definice vhodného kandidáta s karcinomem prostaty pro pozorování a pro cílenou fokální terapii
Authors: C. Wiedel; G. Pohlman; P. Arangua; E. D. Crawford
Published in: Urol List 2013; 11(3): 6-12
Overview
Vzhledem k tomu, že karcinom prostaty představuje urology nejčastěji léčený tumor, je zátěž vyvolaná tímto onemocněním poměrně vysoká. U velkého počtu mužů je diagnostikován klinicky nevýznamný karcinom prostaty s nízkým rizikem. V současné době bohužel neexistují žádná spolehlivá diagnostická kritéria, podle nichž by bylo možné spolehlivě stanovit individuální riziko a identifikovat onemocnění, která se rozvinou do stadia ohrožujícího život pacienta. Tuto situaci dále komplikuje skutečnost, že v současné době užívaná technika biopsie naváděné transrektálním ultrazvukovým vyšetřením (TRUS) má velmi špatnou senzitivitu. Rozhodování o tom, kteří pacienti by měli podstoupit definitivní léčbu a kteří by měli být zařazeni pouze do programu aktivního monitorování, je tak velmi obtížné a není podloženo dostatečnými důkazy. Před nedávnem byla vyvinuta zcela nová technika trojrozměrné mapovací biopsie (3DM), s jejíž pomocí lze získat model prostaty s přesnou lokalizací zhoubného nádoru. Pomocí této metody lze pacienty lépe stratifikovat na základě rizika onemocnění, a navíc ji lze využít při TFT (cílené fokální terapii). Tato technologie spočívá v identifikaci ložisek karcinomu pomocí 3DM a jejich následné léčbě, díky čemuž je ušetřena benigní tkáň. Rovněž není nutné provádět rozsáhlejší zákrok spojený s větší morbiditou. V současné době dostupné zobrazovací techniky neumožňují adekvátně identifikovat karcinom prostaty. Příslibem mohou být pokroky v zobrazovacích technikách magnetické rezonance (MR) a pozitronové emisní tomografie (PET), s jejichž pomocí snad bude v budoucnosti možné neinvazivně identifikovat ložisko karcinomu, což by přispělo k dalšímu zdokonalení techniky TFT.
Klíčová slova:
karcinom prostaty, klinicky nevýznamný karcinom prostaty, antigen karcinomu prostaty 3, biopsie naváděná pomocí transrektálního ultrazvuku, aktivní monitorování, trojrozměrná mapovací biopsie, cílená fokální terapieÚvod
Karcinom prostaty stále představuje hlavní nádorové onemocnění u mužů – u jednoho ze šesti mužů bude v průběhu jeho života toto onemocnění diagnostikováno. Odhaduje se, že v roce 2013 bude ve Spojených státech diagnostikováno 238 590 nových případů karcinomu prostaty a 29 720 pacientů na toto onemocnění zemře [1]. Pokroky v léčbě včetně radikální prostatektomie a radioterapie jsou jistě zčásti příčinou nízké míry celkové mortality, primárním faktorem je však indolentní charakter většiny tumorů [2]. Definitivní léčba je spojena s vysokým rizikem morbidity, jako je např. vznik močové inkontinence a erektilní dysfunkce. U řady mužů je diagnostikován karcinom nízkého grade, který je definován hladinou PSA < 10 ng/ml, Gleasonovým skóre vzorku odebraného při biopsii ≤ 6, 0–3 ložisky zasaženými tumorem identifikovanými při biopsii a klinickým stadiem ≤ T2a [3]. Podíl tumorů s nízkým rizikem v době diagnostikování onemocnění se zvýšil ze 27,5 % v letech 1990–1994 na 46,4 % v letech 2000–2001 [4]. Ve stejném období došlo rovněž ke zvýšení počtu pacientů s tumory s nízkým rizikem podstupujících aktivní sledování – z 6,2 % v letech 2000–2001 na 10,2 % v letech 2004–2006 [4]. Podíl pacientů s tumory s nízkým rizikem podstupujících radikální prostatektomii se rovněž pomalu zvyšuje, v roce 2006 bylo pomocí této intervence léčeno 59,6 % pacientů s tumorem s nízkým rizikem [4]. Tento trend je poněkud znepokojující, neboť volba léčby může být ovlivněna nepřesnou diagnostikou. Vhodnou terapií pro řadu mužů s onemocněním s nízkým rizikem může být program aktivního sledování. U mužů, u nichž dojde k progresi onemocnění do pokročilejšího stadia, však při tomto přístupu může být zmeškána příležitost indikovat léčbu vedoucí k odstranění karcinomu. Pro pacienta může být emociálně vyčerpávající žít s vědomím, že v jeho těle bují aktivní maligní onemocnění. Nadbytečná léčba v podobě radikální prostatektomie nebo radioterapie však mohou na druhou stranu negativně ovlivnit kvalitu života pacienta, neboť jsou spojeny s rizikem vzniku močové inkontinence a impotence.
Tento přístup „všechno, nebo nic?“ nabízený pacientům s karcinomem prostaty s nízkým rizikem je však stále častěji zpochybňován. Moderní metody pomáhají lékařům lépe porozumět povaze karcinomu prostaty a lépe predikovat jeho průběh u jednotlivých pacientů. Bylo prokázáno, že testy na bázi nových biomarkerů a biopsie prostaty s metodou 3DM poskytují konkrétnější informaci o každém jednotlivém karcinomu a umožňují tak zvolit adekvátnější léčbu [5].
V tomto článku se zaměřujeme na karcinom prostaty s nízkým rizikem a pokoušíme se jej definovat. Hodnotíme využití moderních metod, jako jsou 3DM a genetické markery pro stratifikaci pacientů na základě rizika. Za pomoci těchto doplňujících testů se pokoušíme definovat ideálního kandidáta pro aktivní sledování. Dále hodnotíme moderní strategii TFT (cílenou fokální terapii) jako modalitu pro definitivní léčbu využívající minimálně invazivní techniky. A konečně hodnotíme také současné zobrazovací techniky (a výhled do budoucna) a jejich roli v rámci léčby karcinomu prostaty.
Definice klinicky nevýznamného karcinomu prostaty
Klinicky nevýznamný karcinom je definován jako málo biologicky agresivní tumor, který nebude příčinou úmrtí pacienta – pacient zemře na jiné onemocnění. Prevalence lokalizovaného, nevýznamného karcinomu prostaty se uvádí v rozmezí 5–30 % [6–8]. Za zlatý standard pro popis těchto lézí se považuje vyšetření patologického vzorku, který však samozřejmě není k dispozici při úvodním vyšetření pacienta. Patologické parametry charakterizující nevýznamný karcinom prostaty zahrnují malý objem léze (0,2–0,5 ml), Gleasonovo skóre ≤ 6 a tumor ohraničený na orgán [6–8]. Další studie se pokoušejí najít souvislost mezi těmito patologickými parametry a klinickými znaky s cílem vytvořit klinickou definici nevýznamného karcinomu prostaty. Tyto klinické parametry jsou v současné době intenzivně zkoumány, neboť prozatím neexistuje žádný biomarker ani jiný test, který by umožňoval odlišit nevýznamný karcinom od agresivního karcinomu. Epstein et al zjistili, že jsou schopni predikovat klinicky nevýznamný karcinom prostaty s prediktivní hodnotou 73 % (negativní prediktivní hodnota 66 %) na základě následujících parametrů: denzita PSA < 0,15 ng/ml na gram a při opakované biopsii žádný pozitivní vzorek nebo nález karcinomu nízkého až středního grade o velikosti < 3 mm pouze v jediném vzorku [6]. V novější studii Epstein et al prokázali 77,2% negativní prediktivní hodnotu při užití těchto kritérií: méně než tři odebrané vzorky zasažené karcinomem, méně než 50% zasažení vzorku tumorem, žádný vzorek s karcinomem Gleasonova skóre 4 nebo 5 a poměr volného ku celkovému PSA > 0,15 [7]. Anast et al užili jiná klinická kritéria: Gleasonovo skóre < 7 a v žádném vzorku nečinil podíl tumoru více než 10 % [8]. Při užití těchto kritérií dosáhli 77% senzitivity a 75% specificity při detekci nesignifikantního karcinomu prostaty, s pozitivní prediktivní hodnotou pouze 51 % [8].
Je tedy zřejmé, že dosud nebylo dosaženo konsenzu v otázce definice klinických kritérií „nevýznamného“ karcinomu prostaty. Dokonce při užití nejlepších dostupných klinických modelů bude značný počet agresivních tumorů klasifikován jako nevýznamné. Navíc vzhledem k výše uváděné chabé negativní prediktivní hodnotě bude spousta pacientů mylně uklidněna.
Pokud je takto klasifikován dokonce i nesignifikantní tumor, hrozí zde značné riziko progrese, uvádí se až 31 % [9]. Pakliže máme k dispozici pouze jediný biomarker PSA, sextantovou biopsii naváděnou ultrazvukem bez dostatečných zobrazovacích modalit, jsou naše možnosti správně detekovat nesignifikantní karcinom značně omezené. Tento problém je ještě umocněn u jednotlivých pacientů s individuální očekávanou délkou života a individuálními komorbiditami. Pacienti a jejich lékaři tak činí rozhodnutí, která mohou změnit života pacienta, a pokoušejí se maximalizovat délku přežití a zachovat jeho kvalitu života na základě pouze nedostatečných informací.
Definice prognostických markerů
Při screeningu karcinomu prostaty se až donedávna ve Spojených státech spoléhalo zejména na prostatický specifický antigen (PSA). Při užití standardní hranice 4,0 ng/ml se uvádí senzitivita pro detekci jakéhokoli karcinomu prostaty 21 % (51 % při detekci lézí vysokého grade) a specificita 91 % [10]. Vzhledem k tomu, že čím dál tím více nevýznamných tumorů je zachyceno v časném stadiu a je tedy indikována nadbytečná léčba, je užívání PSA značně rozporuplné.
Slibné výsledky byly zaznamenány při užití diagnostického biomarkeru PCA3 (antigen karcinomu prostaty 3), nekódující mRNA, který lze izolovat z moči pacienta. V maligním epitelu prostaty dochází k nadměrné expresi PCA3 [11]. Uvádí se, že k nadměrné expresi PCA3 dochází v 95 % buněk karcinomu prostaty s 66násobnou upregulací při srovnání s okolními nemaligními buňkami [12]. Groskopf et al popsali PCA3 skóre, stanovené na základě PCA3 a PSA mRNA, s cílem normalizovat skóre na celkový počet buněk prostaty.
Na základě tohoto PCA3 skóre vytvořil výzkumný tým test pro klinické použití a následně zjistil významné rozdíly ve skóre mezi pacienty s pozitivní vs negativní biopsií [13].
Nakanishi et al zjistili, že PCA3 skóre přímo souvisí s velikostí tumoru – jeho hodnota je téměř dvojnásobná u pacientů s tumory o velkém objemu než u pacientů s malými tumory [14]. Vzhledem k tomu, že u tumorů o větším objemu existuje větší pravděpodobnost, že budou významné a dojde k jejich progresi, mohlo by PCA3 skóre pomoci klasifikovat tumory s vyšším rizikem progrese. Evropská studie na základě výsledků biopsie a PCA3 skóre uvádí, že kliničtí lékaři mohou na základě tohoto skóre posoudit nezbytnost provedení biopsie prostaty u jednotlivých pacientů [15].
Vzhledem ke spojitosti mezi PCA3 skóre a objemem tumoru výzkumné týmy zkoumají možnost využití skóre pro výběr vhodných kandidátů pro aktivní sledování. Ploussard et al zjistili, že PCA3 skóre > 25 koreluje s trojnásobným rizikem významného tumoru o objemu alespoň 0,5 ml (ve srovnání s muži se skóre < 25) [16]. Autorům se však nepodařilo stanovit prahovou hodnotu pro klinické použití. Navzdory možnému využití PCA3 pro výběr vhodných kandidátů pro aktivní sledování, vyšší PCA3 skóre nijak nesouvisí s progresí (při biopsii) [17]. Na základě samotného skóre tedy nelze predikovat, u kterých pacientů dojde k selhání aktivního sledování.
Oncotype DX® (Genomic Health, Redwood City, CA) je nový test, který zkoumá 17 genů ze čtyř biologických drah souvisejících s agresivní povahou karcinomu. Na základě těchto údajů spočítá tzv. skóre genomu prostaty (GPS), podle něhož je možné stratifikovat pacienty na základě rizika. V nedávné době provedené studii na kalifornské univerzitě v San Francisku (zahrnující 395 pacientů) byla pomocí tohoto testu predikována nepříznivá patologie (p = 0,002) [18].
Prolaris (Myriad Genetic Laboratories, Salt Lake City, UT) je podobný test, který využívá RNA 46 genů nejen pro stratifikaci pacientů s diagnostikovaným karcinomem prostaty na základě rizika, ale rovněž pro predikci recidivy [19].
Tyto genomové testy mohou klinickým lékařům poskytnout informace nezbytné pro stratifikaci pacientů podle rizika onemocnění. Zatím je však testování v experimentálním stadiu a pro stanovení jejich validity s dlouhodobějšími parametry je nezbytné provedení dalších studií.
Aktivní monitorování
Doporučujeme termín aktivní monitorování raději než pozorování, neboť lépe popisuje aktivní povahu tohoto procesu. Cílem aktivního monitorování je předejít indikaci nadbytečné léčby, ale současně monitorovat potenciální progresi tumoru, neboť je velmi obtížné předpovědět, u kterých pacientů se rozvine onemocnění do pokročilejšího stadia. Vhodní kandidáti pro aktivní monitorování karcinomu prostaty jsou vybíráni na základě výše zmíněných kritérií podle Epsteina et al [6,7]. Protokoly aktivního monitorování se mohou lišit. Někteří autoři užívají pouze hodnotu PSADT (doby, za niž dojde ke zdvojnásobení hodnoty PSA) [20], zatímco jiní doporučují komplexnější systém měření hladiny volného a celkového PSA jednou za půl roku, digitální rektální vyšetření a odebírání biopsie se 12 vzorky jednou ročně [17]. Koltz et al ve své studii uvádějí u pacientů zařazených do programu aktivního monitorování 30% míru progrese, těmto pacientům byla nakonec nabídnuta radikální léčba [21].
Na příslovečné „okno příležitosti“ existují rozporuplné názory, protože během aktivního monitorování může být ztracena šance na vyléčení onemocnění. Wilt et al v nedávno publikované studii prokázali podobnou míru mortality na karcinom prostaty u pacientů v programu aktivního monitorování (5,8 %) jako u pacientů podstupujících radikální prostatektomii (8,4 %), tyto rozdíly však byly mnohem významnější u pacientů s tumory se středním a vysokým rizikem [22]. Shappley et al ve velké prospektivní studii prokázali, že více než 50 % mužů, u nichž byla zpočátku terapie odložena, nakonec stejně podstoupí léčbu. Přesto však mezi těmito pacienty a pacienty, kteří hned zpočátku podstoupili aktivní léčbu, nebyl zaznamenán žádný rozdíl v mortalitě [23]. Jiné studie uvádějí, že odložení operační léčby u pacientů s karcinomem prostaty s nízkým rizikem o více než šest měsíců je spojeno s biochemickou recidivou a horším výsledkem operace [24,25]. Je důležité poznamenat, že významné procento pacientů si zvolí léčbu s kurativním záměrem, aniž by u nich došlo k progresi během aktivního monitorování, pravděpodobně z důvodu stresu z diagnostikovaného karcinomu.
Zohlednit je třeba rovněž ekonomický aspekt léčby – náklady na aktivní monitorování činí přibližně dvě třetiny nákladů na radikální prostatektomii (indikovanou jako primární léčbu). Celková cena definitivní léčby po aktivním monitorování je samozřejmě mnohonásobně vyšší [26]. Ve většině studií, které prokazují cenovou výhodnost aktivního monitorování, jsou pacienti sledováni pouze po dobu pěti let, což je mnohem méně, než by bylo adekvátní. Úspora nákladů po deseti letech sledování se snižuje o více než 60 % částky uváděné po pěti letech [27].
Jak již bylo uvedeno výše, dokonce ani při užívání nových testů na bázi biomarkerů není možné predikovat, u kterých pacientů dojde během aktivního monitorování k progresi. Ideálním kandidátem pro aktivní monitorování je muž s tumorem s Gleasonovým skóre ≤ 6 s onemocněním ohraničeným na orgán. Pomocí současných technik pro odebírání biopsie je ovšem obtížné s určitostí stanovit, kteří pacienti splňují tato kritéria.
Limitace současných technik biopsie jehlou jsou zapříčiněny celou řadou faktorů. Bylo prokázáno, že většina karcinomů prostaty je multifokálních [28,29]. Karcinom prostaty je rovněž heterogenní [30], a léčba tak může být zvolena na základě výsledků biopsie, jež zcela neodpovídají skutečnému grade tumoru. Pomocí biopsie jehlou lze navíc minout dokonce poměrně velký tumor, uváděná senzitivita činí 32 % [31]. Šance na detekci tumoru u pacientů s velkou prostatou je mnohem menší, uvádí se senzitivita pouze 14 % [32,33]. Při biopsii hrozí rovněž významné riziko bolestivosti a vzniku infekce [34].
Trojrozměrná mapující biopsie prostaty
Slibné výsledky v podobě zlepšení detekce karcinomu a preciznější identifikace jeho lokalizace byly zaznamenány při užití transperineální trojrozměrné mapující (3DM) biopsie prostaty. Přes perineum je umístěna 5mm mřížka, a z prostaty je odebráno 30–90 vzorků, v závislosti na objemu žlázy. Pomocí patologické analýzy a počítačové modelace je následně vytvořena anatomická mapa prostaty a stanovena přesná lokalizace maligního onemocnění. Bylo zjištěno, že tato metoda dosahuje vysoké senzitivity a vysoké negativní prediktivní hodnoty [35]. Studie srovnávající 3DM se zlatým standardem – vyšetřením celého vzorku odebraného při radikální prostatektomii – zjistila, že při hodnocení 64 lézí byl přehlédnut pouze jediný klinicky signifikantní tumor (36]. Barqawi et al provedli 3DM u 180 pacientů, u nichž biopsie naváděná transrektálním ultrazvukovým vyšetřením (TRUS) prokázala negativní výsledek nebo klinicky nevýznamný karcinom: u 27 % mužů bylo stanoveno vyšší Gleasonovo skóre a téměř u poloviny mužů vyšší stadium tumoru [5].
Tato nová metoda může lékaři i pacientovi poskytnout přesnou informaci umožňující učinit informované rozhodnutí. V závislosti na výsledcích si může pacient zvolit aktivní monitorování. Anebo se může na základě znalosti přesné lokalizace karcinomu rozhodnout pro minimálně invazivní léčbu, která poslouží jako definitivní léčba, ovšem s menším výskytem vedlejších účinků.
Cílená fokální terapie
Jednou z moderních metod definitivní léčby je kryoterapie. Kryoterapie pomocí argonu likviduje buňky karcinomu v opakovaných cyklech mrazení a tání. V 90. letech minulého století byla tato technika zdokonalena a od té doby došlo k dramatickému poklesu výskytu vedlejších účinků, jako je např. močová inkontinence a impotence [37]. Slibných výsledků bylo dosaženo při léčbě unilaterálního onemocnění pomocí kryoterapeutické hemiablace prostaty. Onik et al při léčbě 48 pacientů uvádějí stabilní hladinu PSA (po průměrné době sledování 4,5 roku) u 94 % pacientů, u 90 % pacientů zůstala zachována sexuální potence a nebyl zaznamenán jediný případ močové inkontinence [38]. Bahn et al dosáhli (průměrně po 70 měsících sledování) pomocí unilaterální hemiablace u 31 pacientů 93% míry přežití bez biochemické progrese, potence byla zachována u 88 % pacientů [39]. Přínosem by mohlo být větší omezení léčby pouze na postižené části prostaty.
Díky 3DM může urolog spolehlivě provádět cílenou fokální terapii (TFT). Díky TFT lze lokalizovanou léčbu cílit přesně do oblasti maligního onemocnění, a tak ušetřit benigní glandulární tkáň a omezit morbiditu.
V našem centru zavádíme tento moderní přístup s cílem poskytnout pacientovi definitivní léčbu při současné redukci morbidity. V současné době využíváme 3DM a kryoablaci pro lokalizaci a léčbu pouze fokálních lézí. Tato metoda umožňuje zachovat normální tkáň a minimalizovat výskyt vedlejších účinků. Ideálního kandidáta definujeme pomocí následujících kritérií: PSA < 10 ng/ml, Gleasonovo skóre 7 a stadium T1c. Při užití těchto kritérií je vhodnými kandidáty pro TFT s kryoablací po 3DM 40–50 % pacientů [37]. My jsme vybrali 56 pacientů ve věku průměrně 64,3 roku. U několika pacientů navzdory zvyšující se hladině PSA TRUS-biopsie prokázala negativní výsledek (obr. 1 a 2). Tato studie je stále v počáteční fázi a nejsou tedy k dispozici dlouhodobá data. Očekávám však, že profil vedlejších účinků bude příznivější ve srovnání s invazivnějšími výkony. V současné době se vytváří databáze dlouhodobých dat o kvalitě života pacientů, která by umožnila vyhledat nežádoucí příhody a vedlejší účinky, jako jsou např. impotence a inkontinence. V našem centru testujeme rovněž termální laserovou ablaci, tato metoda je však zatím v experimentálním stadiu. Při laserové ablaci se opět využívá 3DM pro lokalizaci a léčbu specifických, fokálních nádorových lézí.
Image 1. Zobrazení prostaty po 3DM biopsii. Karcinom je zobrazen jako žlutý kosočtverec. Rovněž je zobrazen průběh močové trubice. 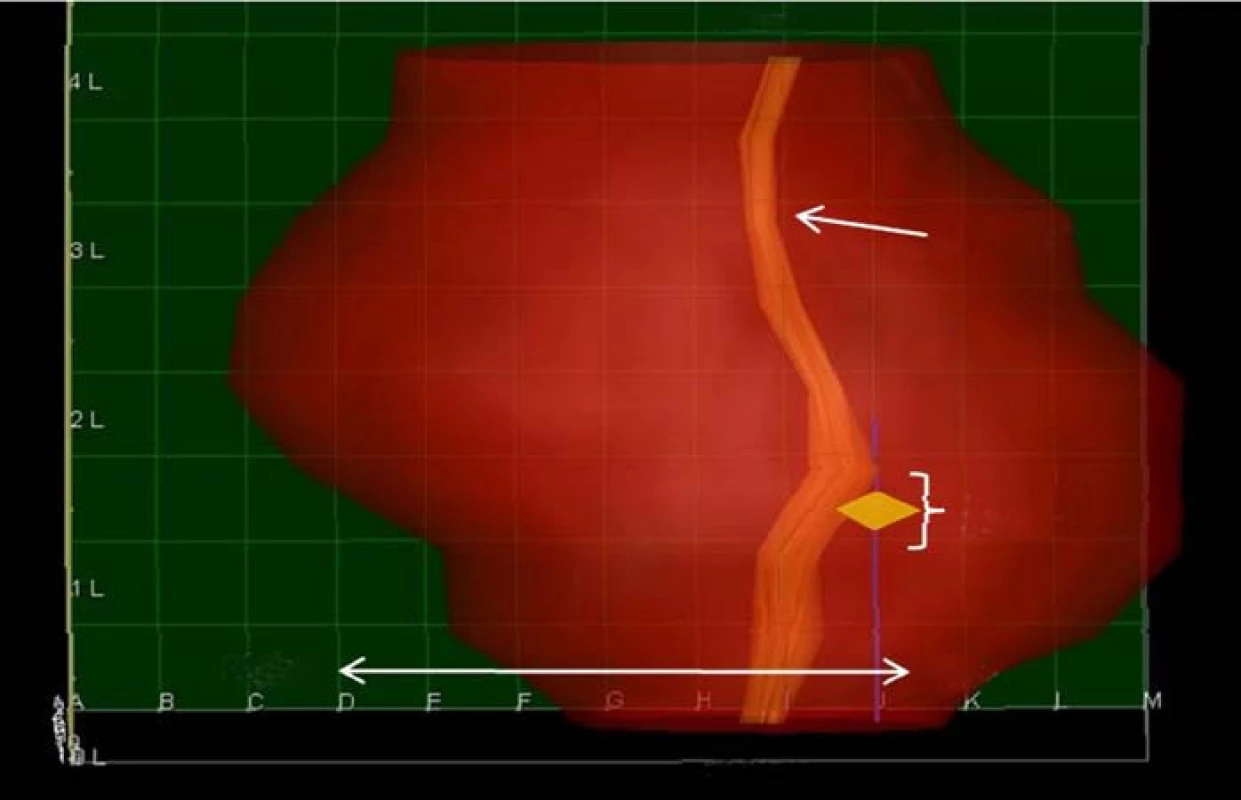
Image 2. Zobrazení prostaty z levé strany. Karcinom je zobrazen jako žlutý kosočtverec, opět je zobrazena močová trubice. 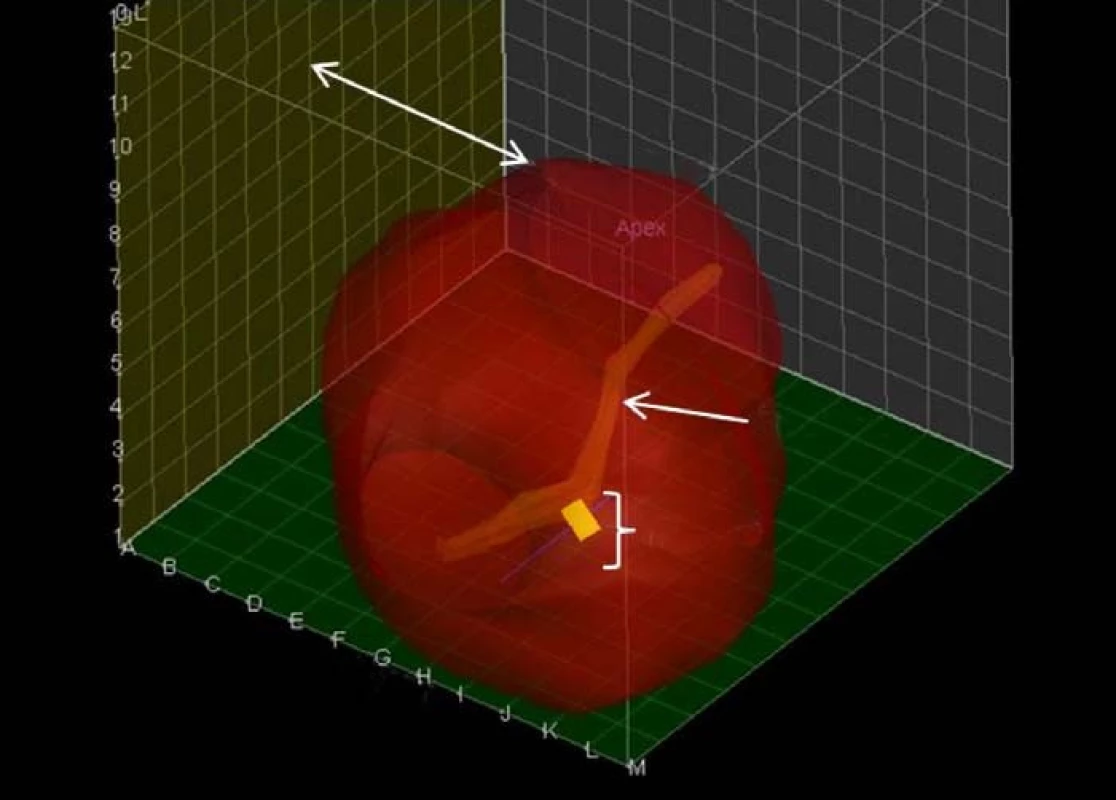
Jako další možnost pro TFT se v současné době zkoumá modalita HIFU (fokusovaný ultrazvuk o vysoké intenzitě). Výhoda této metody oproti kryoablaci spočívá v tom, že nevyžaduje perkutánní přístup a je zcela neinvazivní. Technologie HIFU produkuje pomocí rektálního ultrazvukového zesilovače obrovské teplo a prostřednictvím akustické kavitace dochází k poškození vybraných buněk. Tímto způsobem se v cílené oblasti vytváří lokalizovaná nekróza [40]. Uchida et al uvádějí u 181 mužů s karcinomem prostaty s nízkým, středním a vysokým rizikem, kteří podstoupili HIFU, 78% míru přežití bez biochemické recidivy po pěti letech [41]. Tato technologie má však dvě hlavní limitace: přesnost operace může ovlivnit i sebemenší pohyb pacienta a v jednu chvíli je možné provádět ablaci pouze malého kousku tkáně, díky čemuž je ablace celé žlázy obtížná a destrukce tumoru může být nedostatečná [42,43]. Až jedna pětina pacientů vyžaduje z důvodu nedostatečného výsledku více než jedno sezení HIFU [44]. Morbidita HIFU je z velké části zapříčiněna obstrukcí výtoku z močového měchýře (Uchida et al uvádějí 22 %) [41] a erektilní dysfunkcí, incidence se pohybuje od 13 % do 61 % [44,45].
Další minimálně invazivní modalitou je fotodynamická terapie (PDT), při níž je pacientovi intravenózně podán fotosenzitizér. Tato látka se nahromadí v cílové tkáni. Fotosenzitizéry jsou chemické látky, které jsou neškodné, ale po vystavení světelnému paprsku o určité vlnové délce generují reaktivní kyslík, toxický pro okolní buňky. Světelný paprsek, který spouští tyto toxické chemické reakce, se aplikuje speciální sondou zavedenou do rekta nebo močové trubice [46]. Moore et al v nedávné době publikovali přehled studií zabývajících se PDT [47]. Počet studií, které testují PDT jako primární modalitu pro léčbu karcinomu prostaty, je velmi malý, ale všechny uvádějí významný pokles PSA a minimální výskyt vedlejších účinků [48–50].
Zobrazovací vyšetření
Zdokonalení zobrazovacích technik by bylo užitečné nejen pro diagnostiku karcinomu prostaty, ale rovněž by přineslo důležité informace pro pacienty podstupující TFT. Pokud by bylo možné maligní léze detekovat a mapovat pomocí zobrazovacích technik, mohli bychom tak získat informace nezbytné pro léčbu pacienta bez indikace invazivních výkonů. Navzdory relativnímu pokroku v oblasti zobrazování mají modality pro zobrazení prostaty nadále svá omezení.
Transrektální ultrazvuk (TRUS) se běžně užívá pro navádění biopsie prostaty a jako doplňková modalita při detekci karcinomu. Samotný TRUS však není vhodnou pomůckou pro detekci karcinomu prostaty, zejména v případě menších tumorů. Počítačová tomografie (CT) se užívá pro zobrazování pokročilých, metastazujících onemocnění, ale vzhledem k nedostatečnému rozlišení měkkých tkání neumožňuje detekovat lokalizovaný karcinom.
Slibné výsledky byly zaznamenány při užívání MR, pomocí této techniky lze lokalizovat karcinom prostaty v oblasti nízké intenzity [51,52]. Uváděná přesnost výsledků běžné T2-vážené (T2W) MR se však významně liší [51]. Při MR o vysokém rozlišení byl zaznamenán úspěch při stanovení stadia karcinomu prostaty, zejména v případě extrakapsulárního rozšíření [53]. Ocak et al uvádějí lepší specificitu MR při detekci karcinomu (v rozmezí 37 % až 88 %) při užití dynamické kontrastní MR, což je varianta funkční MR, než při běžné T2W. Těchto výsledků však bylo dosaženo za cenu nižší senzitivity [52]. Novou metodou je magnetická rezonanční spektroskopie (MRS), jež využívá metabolických změn v maligních buňkách. Konkrétně buňky tumoru obsahují jiné hladiny zinku, citrátu, cholinu a kreatininu [54,55]. MRS se užívá pro neinvazivní měření těchto hodnot [51]. Využití této léčebné modality pro léčbu karcinomu prostaty je však zatím omezeno pouze na výzkum. Pilotní studie uvádějí velmi vysokou specificitu, ale opět poměrně nízkou senzitivitu [56]. Schopnost měřit metabolické změny motivovala snahy o vytvoření zobrazovací techniky, která umožní identifikovat signifikantní vs nesignifikantní karcinom, neboť tyto poměry korelují s Gleasonovým skóre [57].
Vytvoření monoklonálních protilátek ke specifickým antigenům karcinomu prostaty usnadnilo zobrazovací techniky (značené radioizotopy). 111In-capromab pendetid (ProstaScint®; Cytogen Corp, Princeton, NJ) se užívá pro tento účel, před navázáním na svůj cíl však vyžaduje narušení buněčné membrány, díky čemuž nedosahuje dobrých výsledků při detekci lokalizovaného karcinomu [51].
Slibné výsledky při detekci lokalizovaného karcinomu prostaty byly zaznamenány při užití pozitronové emisní tomografie (PET). Tato technika identifikuje změněné fyziologické procesy prostřednictvím detekce buněčných metabolitů. Rovněž poskytuje trojrozměrný obraz, potřebný pro TFT. Nejčastěji užívaná látka 18F-fluoro-2-deoxy-2-D-glukóza (18F-FDG) bohužel není vhodná pro detekci karcinomu prostaty, neboť většina tumorů není závislá na metabolizmu glukózy [51]. V současné době je hodnocena senzitivnější látka acetát (značený radioizotopy), první výsledky jsou povzbuzující, zejména pro detekci onemocnění ohraničeného na orgán [58,59]. Studie na zvířecích modelech uvádějí pokroky při užívání analogů s delším poločasem rozpadu [60].
Zdokonalení zobrazovacích technik prostaty je nezbytné pro adekvátní detekci lokalizovaných tumorů v časném stadiu. Spolu s rozvojem technologie TFT bude potřeba těchto technik pro navigaci fokální terapie ještě významnější.
Závěr
Zátěž karcinomu prostaty je nadále vysoká, diagnostika lokalizovaného nebo nesignifikantního karcinomu u řady mužů však vyvolává rozporuplné otázky. V současné době neexistují žádná klinická diagnostická kritéria, která by umožnila identifikovat, které tumory jsou významné a u kterých dojde k progresi. Tuto situaci dále komplikuje nízká senzitivita biopsie jehlou, což znesnadňuje definici ideálního kandidáta pro aktivní monitorování. 3DM je moderní technologií, která umožňuje lékaři přesněji stratifikovat pacienty na základě rizika. Rovněž umožňuje indikaci TFT jako terapeutické modality pro léčbu lokalizovaného karcinomu prostaty, a snižuje tak potřebu indikace procedur spojených s větší morbiditou. Pro detekci lokalizovaného karcinomu prostaty a TFT je však nezbytné vyvinout modernější a dokonalejší zobrazovací techniky.
Cole Wiedel, M.D.
Department of Surgery, Division of Urology, University of Colorado, School of Medicine
12605 E. 16th Ave. Aurora, CO 80045, USA
cole.wiedel@ucdenver.edu
Sources
1. Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013. CA Cancer J Clin 2013; 63 : 11–30.
2. Bill-Axelson A, Holmberg L, Ruutu M et al. Radical prostatectomy versus watchful waiting in early prostate cancer. N Engl J Med 2011; 364 : 1708–1717.
3. AV DA. Combined-modality staging in predicting prostate-specific antigen outcome after definitive local therapy for men with clinically localized prostate cancer. Prostate Cancer: Principles and Practice. Philadelphia: Lippincott Williams & Wilkins; 2002 : 254–268.
4. Cooperberg MR, Broering JM, Kantoff PW et al. Contemporary trends in low risk prostate cancer: risk assessment and treatment. J Urol 2007; 178: S14–S19.
5. Barqawi AB, Rove KO, Gholizadeh S et al. The role of 3-dimensional mapping biopsy in decision making for treatment of apparent early stage prostate cancer. J Urol 2011; 186 : 80–85.
6. Epstein JI, Walsh PC, Carmichael M et al. Pathologic and clinical findings to predict tumor extent of nonpalpable (stage T1c) prostate cancer. JAMA 1994; 271 : 368–374.
7. Epstein JI, Chan DW, Sokoll LJ et al. Nonpalpable stage T1c prostate cancer: prediction of insignificant disease using free/total prostate specific antigen levels and needle biopsy findings. J Urol 1998; 160 : 2407–2411.
8. Anast JW, Andriole GL, Bismar TA et al. Relating biopsy and clinical variables to radical prostatectomy findings: can insignificant and advanced prostate cancer be predicted in a screening population? Urology 2004; 64 : 544–550.
9. Carter HB, Walsh PC, Landis P et al. Expectant management of nonpalpable prostate cancer with curative intent: preliminary results. J Urol 2002; 167 : 1231–1234.
10. Wolf AM, Wender RC, Etzioni RB et al. American Cancer Society guideline for the early detection of prostate cancer: update 2010. CA Cancer J Clin 2010; 60 : 70–98.
11. Hessels D, Schalken JA. The use of PCA3 in the diagnosis of prostate cancer. Nat Rev Urol 2009; 6 : 255–261.
12. Hessels D, Klein Gunnewiek JM et al. DD3(PCA3)-based molecular urine analysis for the diagnosis of prostate cancer. Eur Urol 2003; 44 : 8–15.
13. Groskopf J, Aubin SM, Deras IL et al. APTIMA PCA3 molecular urine test: development of a method to aid in the diagnosis of prostate cancer. Clin Chem 2006; 52 : 1089–1095.
14. Nakanishi H, Groskopf J, Fritsche HA et al. PCA3 molecular urine assay correlates with prostate cancer tumor volume: implication in selecting candidates for active surveillance. J Urol 2008; 179 : 1804–1809.
15. Auprich M, Haese A, Walz J et al. External validation of urinary PCA3-based nomograms to individually predict prostate biopsy outcome. Eur Urol 2010; 58 : 727–732.
16. Ploussard G, Durand X, Xylinas E et al. Prostate cancer antigen 3 score accurately predicts tumour volume and might help in selecting prostate cancer patients for active surveillance. Eur Urol 2011; 59 : 422–429.
17. Tosoian JJ, Loeb S, Kettermann A et al. Accuracy of PCA3 measurement in predicting short-term biopsy progression in an active surveillance program. J Urol 2010; 183 : 534–538.
18. Klein. Unpublished raw data. Genomic Health, Inc: Redwood City, CA. 2013.
19. Cooperberg MR, Simko JP, Cowan JE et al. Validation of a cell-cycle progression gene panel to improve risk stratification in a contemporary prostatectomy cohort. J Clin Oncol 2013; 31 : 1428–1434.
20. Klotz L. Active surveillance for prostate cancer: for whom? J Clin Oncol 2005; 23 : 8165–8169.
21. Klotz L, Zhang L, Lam A et al. Clinical results of long-term follow-up of a large, active surveillance cohort with localized prostate cancer. J Clin Oncol 2010; 28 : 126–131.
22. Wilt TJ, Brawer MK, Jones KM et al. Radical prostatectomy versus observation for localized prostate cancer. N Engl J Med 2012; 367 : 203–213.
23. Shappley WV, Kenfield SA, Kasperzyk JL et al. Prospective study of determinants and outcomes of deferred treatment or watchful waiting among men with prostate cancer in a nationwide cohort. J Clin Oncol 2009; 27 : 4980–4985.
24. O’Brien D, Loeb S, Carvalhal GF et al. Delay of surgery in men with low risk prostate cancer. J Urol 2011; 185 : 2143–2147.
25. Freedland SJ, Kane CJ, Amling CL et al. Delay of radical prostatectomy and risk of biochemical progression in men with low risk prostate cancer. J Urol 2006; 175 : 1298–1302.
26. Keegan K, Dall’Era M, Durban B et al. A Simulation Study of the Costs of Active Surveillance Compared to Immediate Treatment for Prostate Cancer. 2011.
27. Dall’Era M. The economics of active surveillance for prostate cancer. Curr Opin Urol 2013; 23: 278–282.
28. Miller GJ, Cygan JM. Morphology of prostate cancer: the effects of multifocality on histological grade, tumor volume and capsule penetration. J Urol 1994; 152 : 1709–1713.
29. Lucia M. Prostatectomy Data from University of Colorado University Hospital. University of Colorado School of Medicine; 1997–2006.
30. Roy-Burman P, Zheng J, Miller GJ. Molecular heterogeneity in prostate cancer: can TP53 mutation unravel tumorigenesis? Mol Med Today 1997; 3 : 476–482.
31. Rocco B, de Cobelli O, Leon ME et al. Sensitivity and detection rate of a 12-core trans-perineal prostate biopsy: preliminary report. Eur Urol 2006; 49 : 827–833.
32. Letran JL, Meyer GE, Loberiza FR et al. The effect of prostate volume on the yield of needle biopsy. J Urol 1998; 160 : 1718–1721.
33. Leibovici D, Shilo Y, Raz O et al. Is the diagnostic yield of prostate needle biopsies affected by prostate volume? Urol Oncol 2013; 31 : 1003–5.
34. Carmignani L, Picozzi S, Spinelli M et al. Bacterial sepsis following prostatic biopsy. Int Urol Nephrol 2012; 44 : 1055–1063.
35. Crawford ED, Wilson SS, Torkko KC et al. Clinical staging of prostate cancer: a computer-simulated study of transperineal prostate biopsy. BJU Int 2005; 96 : 999–1004.
36. Crawford ED, Rove KO, Barqawi AB et al. Clinical-pathologic correlation between transperineal mapping biopsies of the prostate and three-dimensional reconstruction of prostatectomy specimens. Prostate 2013; 73 : 778–787.
37. Crawford ED, Barqawi A. Targeted focal therapy: a minimally invasive ablation technique for early prostate cancer. Oncology (Williston Park) 2007; 21 : 27–32.
38. Onik G, Vaughan D, Lotenfoe R et al. The „male lumpectomy“: focal therapy for prostate cancer using cryoablation results in 48 patients with at least 2-year follow-up. Urol Oncol 2008; 26: 500–505.
39. Bahn DK, Silverman P, Lee F et al. Focal prostate cryoablation: initial results show cancer control and potency preservation. J Endourol 2006; 20 : 688–692.
40. Barqawi AB, Crawford ED. Emerging role of HIFU as a noninvasive ablative method to treat localized prostate cancer. Oncology (Williston Park) 2008; 22 : 123–129.
41. Uchida T, Ohkusa H, Yamashita H et al. Five years experience of transrectal high-intensity focused ultrasound using the Sonablate device in the treatment of localized prostate cancer. Int J Urol 2006; 13 : 228–233.
42. Tanter M, Pernot M, Aubry JF et al. Compensating for bone interfaces and respiratory motion in high-intensity focused ultrasound. Int J Hyperthermia 2007; 23 : 141–151.
43. Watkin NA, ter Haar GR, Rivens I. The intensity dependence of the site of maximal energy deposition in focused ultrasound surgery. Ultrasound Med Biol 1996; 22 : 483–491.
44. Blana A, Murat FJ, Walter B et al. First analysis of the long-term results with transrectal HIFU in patients with localised prostate cancer. Eur Urol 2008; 53 : 1194–1201.
45. Thüroff S, Chaussy C, Vallancien G et al.. High-intensity focused ultrasound and localized prostate cancer: efficacy results from the European multicentric study. J Endourol 2003; 17 : 673–677.
46. Dolmans DE, Fukumura D, Jain RK. Photodynamic therapy for cancer. Nat Rev Cancer 2003; 3 : 380–387.
47. Moore CM, Emberton M, Bown SG. Photodynamic therapy for prostate cancer – an emerging approach for organ-confined disease. Lasers Surg Med 2011; 43 : 768–775.
48. Moore CM, Nathan TR, Lees WR et al. Photodynamic therapy using meso tetra hydroxy phenyl chlorin (mTHPC) in early prostate cancer. Lasers Surg Med 2006; 38 : 356–363.
49. Windahl T, Andersson SO, Lofgren L. Photodynamic therapy of localised prostatic cancer. Lancet 1990; 336 : 1139.
50. Zaak D, Sroka R, Hoppner M et al. Photodynamic therapy by means of 5-ALA induced PPIX in human prostate cancer – Preliminary results. Med Laser Application 2003; 18 : 91–95.
51. Turkbey B, Pinto PA, Choyke PL. Imaging techniques for prostate cancer: implications for focal therapy. Nat Rev Urol 2009; 6 : 191–203.
52. Ocak I, Bernardo M, Metzger G et al. Dynamic contrast-enhanced MR of prostate cancer at 3 T: a study of pharmacokinetic parameters. AJR Am J Roentgenol 2007; 189 : 849.
53. Augustin H, Fritz GA, Ehammer T et al. Accuracy of 3-Tesla magnetic resonance imaging for the staging of prostate cancer in comparison to the Partin tables. Acta Radiol 2009; 50 : 562–569.
54. Ramírez de Molina A, Rodríguez-González A, Gutiérrez R et al. Overexpression of choline kinase is a frequent feature in human tumor-derived cell lines and in lung, prostate, and colorectal human cancers. Biochem Biophys Res Commun 2002; 296 : 580–583.
55. Costello LC, Franklin RB, Feng P. Mitochondrial function, zinc, and intermediary metabolism relationships in normal prostate and prostate cancer. Mitochondrion 2005; 5 : 143–153.
56. Shukla-Dave A, Hricak H, Moskowitz C et al. Detection of prostate cancer with MR spectroscopic imaging: an expanded paradigm incorporating polyamines. Radiology 2007; 245 : 499–506.
57. Zakian KL, Sircar K, Hricak H et al. Correlation of proton MR spectroscopic imaging with gleason score based on step-section pathologic analysis after radical prostatectomy. Radiology 2005; 234 : 804–814.
58. Oyama N, Akino H, Kanamaru H et al. 11C-acetate PET imaging of prostate cancer. J Nucl Med 2002; 43 : 181–186.
59. Fricke E, Machtens S, Hofmann M et al. Positron emission tomography with 11C-acetate and 18F-FDG in prostate cancer patients. Eur J Nucl Med Mol Imaging 2003; 30 : 607–611.
60. Ponde DE, Dence CS, Oyama N et al. 18F-fluoroacetate: a potential acetate analog for prostate tumor imaging – in vivo evaluation of 18F-fluoroacetate versus 11C-acetate. J Nucl Med 2007; 48 : 420–428.
Labels
Paediatric urologist Urology
Article was published inUrological Journal

2013 Issue 3-
All articles in this issue
- Definice vhodného kandidáta s karcinomem prostaty pro pozorování a pro cílenou fokální terapii
- Inkontinence u pacientů po prostatektomii: přehled současných možností vyšetřování a léčby
- XTANDI (enzalutamid): nová léčba metastazujícího karcinomu prostaty, rezistentního na kastrační léčbu
- Jaký prospěch přináší denosumab (XGEVA®) pacientům s kostními metastázami solidních nádorů?
- Léčba symptomatické benigní prostatické hyperplazie pomocí holmium laseru
- Prognostické faktory, molekulární markery a prediktivní instrumenty pro hodnocení uroteliálního karcinomu horních cest močových
- Endometrióza urogenitálního traktu
- Urological Journal
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Endometrióza urogenitálního traktu
- Jaký prospěch přináší denosumab (XGEVA®) pacientům s kostními metastázami solidních nádorů?
- XTANDI (enzalutamid): nová léčba metastazujícího karcinomu prostaty, rezistentního na kastrační léčbu
- Inkontinence u pacientů po prostatektomii: přehled současných možností vyšetřování a léčby
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

