-
Medical journals
- Career
Sekvence léčby a sledování pacienta s metastatickým kastračně rezistentním karcinomem prostaty
Authors: J. Katolická
Published in: Urol List 2012; 10(4): 41-44
Overview
Dvě studie – TAX 327 a SWOG 9916 – jako první prokázaly evidentní benefit v přežití u pacientů s metastatickým kastračně rezistentním karcinomem prostaty (mCRCP) léčených chemoterapií založenou na docetaxelu, který se stal standardním lékem pro I. linii léčby. V posledních letech studie fáze III s cabazitaxelem, abirateronem, sipuleucelem-T, alpharadinem, enzalutamidem prokázaly benefit v prodloužení přežití v II. linii léčby kastračně refrakterního karcinomu prostaty za dobré kvality života a tolerovatelné toxicity. Je potřeba řady klinických studií a běžných klinických zkušeností, které ukáží správné pořadí jednotlivých preparátů.
Klíčová slova:
kastračně rezistentní karcinom prostaty - docetaxel - cabazitaxel - abirateron - sipuleucel T - alpharadin - enzalutamidKastračně rezistentní karcinom prostaty (CRCP) byl dlouhou dobu považován za onemocnění, kde aplikace chemoterapie nepřináší pacientovi benefit stran prodloužení přežití. Podání mitoxantronu, který byl roky standardní léčbou, mělo vliv pouze na zlepšení kvality života mužů s CRCP.
LÉČBA I. LINIE KASTRAČNĚ REZISTENTNÍHO KARCINOMU PROSTATY
Výrazná změna nastala v roce 2004, kdy dvě studie – TAX 327 a SWOG 9916 – jako první prokázaly evidentní benefit v přežití u pacientů s metastatickým kastračně rezistentním karcinomem prostaty (mCRCP) léčených chemoterapií založenou na docetaxelu. Ve studii TAX 327 bylo 1 006 mužů s metastatickým kastračně rezistentním karcinomem užívajících prednison randomizováno do tří ramen – mitoxantron 12 mg/m2 každé tři týdny, docetaxel 75 mg/m2 ve třítýdenním intervalu a docetaxel 30 mg/m2 týdně po dobu pěti týdnů s vynecháním aplikace v šestém týdnu. Výsledky této studie potvrdily superioritu docetaxelu v třítýdenním intervalu podání před mitoxantronem v signifikantním prodloužení mediánu celkového přežití (19,2 vs 16,3 měsíce; p = 0,004), PSA odpovědi (45 vs 32 %; p < 0,001), ústupu bolesti (35 vs 22 %; p = 0,01) a kvality života (22 vs 13 %; p = 0,009). Výsledky studie SWOG 9916 prokázaly, že léčba kombinací docetaxel + + estramustin signifikantně prodlužuje celkové přežití (17,5 vs 15,6 měsíce; p = 0,02) a odpověď v hodnocení hladin PSA (50 vs 27 %; p < 0,001) ve srovnání s mitoxantronem a prednisonem. Na základě těchto výsledků byl docetaxel v třítýdenním podání doporučen jako standardní léčba I. linie pro metastatický kastračně rezistentní karcinom prostaty.
JAKÉ JSOU MOŽNOSTI LÉČBY II. LINIE KASTRAČNĚ REZISTENTNÍHO KARCINOMU PROSTATY?
Dlouhodobě nebyla k dispozici léčebná modalita pro druhou linii léčby u nemocných s progresí na a/nebo po chemoterapii založené na docetaxelu [1]. Podání starších cytostatik jako mitoxantron, cyklofosfamid, etoposid byla jako jedna z možností, která ale neměla podklad ve výsledcích randomizovaných studií určených pro léčbu II. linie mCRCP. Velmi výrazná změna v přístupu k druholiniové terapii mCRCP nastala v posledním období. Výsledky randomizovaných studií fáze III poukázaly na efektivitu a bezpečnost řady preparátů.
Cabazitaxel byl hodnocen ve studii fáze III TROPIC, kde se sledovala efektivita a bezpečnost cabazitaxelu u mužů s metastatickým kastračně rezistentním karcinomem prostaty předléčených docetaxe-lem [2]. Do studie bylo zařazeno 775 mužů s progresí onemocnění během léčby nebo po ní docetaxelem (kumulativní dávka > 225 mg/m2), kteří při léčbě perorálním prednisonem 10 mg/den byli randomizováni do ramene s mitoxantronem (infuze 12 mg/m2 každé tři týdny; n = 377) nebo do ramene s cabazitaxelem (infuze 25 mg/m2 každé tři týdny; n = 378). Primárním cílem studie bylo hodnocení celkového přežití; sekundární cíl zahrnoval přežití bez progrese onemocnění, hodnocení odpovědi na léčbu, měření bolesti a bezpečnost podání. Medián dalšího sledování byl 12,8 měsíce. Medián počtu léčebných cyklů byl šest pro rameno s cabazitaxelem a čtyři pro rameno s mitoxantronem. V primární analýze měli pacienti léčení kombinací cabazitaxel/prednison signifikantně delší celkové přežití ve srovnání s režimem mitoxantron/prednison (15,1 vs 12,7 měsíce, HR: 0,70; 95% CI: 0,59–0,83; p < 0,0001). Doba přežití bez progrese onemocnění (složeno z doby bez progrese tumoru, bez elevace PSA a progrese bolesti; nebo úmrtí), hodnocení odpovědi na léčbu RECIST kritérií a také hodnocení odpovědi sérové hladiny PSA byla také statisticky signifikantní ve prospěch ramene s cabazitaxelem. Odpověď tumoru na léčbu ve skupině s cabazitaxelem byla zaznamenána u 14,4 % léčených ve srovnání s 4,4 % ve skupině s mitoxantronem. Závěrem studie TROPIC je konstatování, že cabazitaxel s prednisonem statisticky signifikantně prodlužuje přežití u pacientů s metastatickým kastračně rezistentním karcinomem prostaty po předchozí léčbě docetaxelem. Na základě těchto výsledků U. S. FDA (Food and Drug Administration, USA) schválila cabazitaxel v kombinaci s prednisonem pro léčbu nemocných s mCRCP předléčených docetaxelem.
Biosyntéza extragonadálních androgenů může přispět k progresi kastračně rezistentního karcinomu prostaty, proto se v jeho léčbě uplatní inhibitory androgen--regulačních enzymů. Abirateron acetát je inhibitor enzymu CYP17 (cytochromu P-17), který selektivně působí na syntézu androgenů v nadledvinách, varlatech a také tumoru prostaty. Do multicentrické, randomizované, placebem kontrolované studie fáze III bylo zařazeno 1 195 nemocných na základě performans statusu, předchozí terapie, algického syndromu, charakteru progrese onemocnění, a to v poměru 2 : 1 pro abirateron v kombinaci s prednisonem vs placebo s prednisonem [3]. Nemocní předléčení docetaxelem užívali 5 mg prednisonu dvakrát denně v kombinaci s abirateronem v dávce 1 000 mg (jedna tableta á 250 mg) nebo čtyřmi tabletami placeba. Primárním cílem studie bylo stanovení celkového přežití, sekundárními cíli doba do progrese PSA, přežití bez progrese onemocnění a hodnocení odpovědi PSA. Medián sledování byl 12,8 měsíce. V době předem plánované průběžné analýzy redukovala léčba abirateronem v kombinaci s prednisonem riziko úmrtí o 34 % ve srovnání s ramenem léčeným placebem s prednisonem. Medián celkového přežití ve skupině s abirateronem byl 14,8 měsíce a 10,9 měsíce ve skupině s placebem (HR 0,65; 95% CI, 0,54–0,77; p < 0,001). Výsledky hodnocení všech sekundárních cílů stanovených v úvodu studie podpořily efektivitu abirateronu ve srovnání s placebem. Sledování odpovědi PSA 29 % pro abirateron vs 6 % pro placebo (p < 0,001), hodnocení objektivních odpovědí na základě RECIST kritérií u pacientů s měřitelným onemocněním (14 vs 3 %; p < 0,001), doba do progrese PSA (10,2 vs 6,6 měsíce) a medián přežití bez progrese na základě radiologického hodnocení (5,6 vs 3,6 měsíce). U nemocných s algickým syndromem došlo u abirateronu u 44 % léčených k redukci bolesti ve srovnání s 27 % u placeba (p = 0,002). Bezpečnostní profil abirateronu je přijatelný, z nežádoucích účinků se nejvíce objevila retence tekutin, hypertenze a hypokalemie. Abirateron ve studii fáze III (COU-AA-302) u populace nemocných nepředléčených docetaxelem, tj. před zahájením chemoterapie, prokázal velmi dobré výsledky, na základě kterých se možnost jeho podání posouvá i před docetaxel.
Také další nový preparát z řady antiadrogenů, a to enzalutamid (MDV3100), prokázal podle výsledků studie fáze III pod názvem AFFIRM prodloužení přežití o 4,8 měsíce (18,4 měsíce pro enzalutamid vs 13,6 měsíce pro placebo; p < 0,001) u pacientů s metastatickým kastračně rezistentním karcinomem prostaty po léčbě docetaxelem v I. linii. Terapie enzalutamidem redukuje riziko úmrtí o 37 %, 50% pokles PSA byl zaznamenán u 54 % mužů léčených enzalutamidem ve srovnání s 1,5 % léčených placebem, medián doby do progrese byl 8,3 měsíce v léčebném rameni ve srovnání s 3 měsíci v placebové skupině [1].
Jednou z možností léčby po prvotním podání docetaxeluje tzv. retreatment docetaxelem. Opakované podání chemoterapeutického režimu založeného na docetaxelu může být pragmatickým doporučením pro nemocné s dobrou odpovědí na I. linii léčby docetaxelem. Kromě role opakované chemoterapie je zde i jistá možnost překonat rezistenci docetaxelu a případně v kombinaci s jinými cytostatiky podpořit jeho synergický potenciál. Data z retrospektivních hodnocení, kdy nemocným léčeným docetaxelem s dobrou odpovědí v I. linii byl následně při progresi onemocnění podán re-docetaxel v tzv. druhé nebo další linii. Odpověď v hodnocení poklesu sérových hladin PSA o více než 50 % se pohybovala v tzv. druhé linii u 48–72 %, v další linii u 48–60 % pacientů. Doba celkového přežití od zahájení reterapie docetaxelem se pohybovala kolem 16 měsíců (15,9–16) [4,5]. Toxicita opakovaného podání docetaxelu byla dobře zvladatelná. Všechna data ohledně této možnosti léčby v dalších liniích po selhání docetaxelu v I. linii pochází pouze z retrospektivních hodnocení na malých počtech nemocných, bez kontrolního ramene, bez hodnocení kvality života a jen u nemocných s předchozí dobrou léčebnou odpovědí. Nelze proto tento postup doporučit jako standardní.
Paliativní efekt u nemocných s kastračně rezistentním karcinomem prostaty prokázal v I. linii léčby i vinorelbin. Výsledky studie fáze III vinorelbin + hydrokortison vs hydrokortison poukazují, že kombinovaná léčba zvyšuje léčebnou odpověď měřenou poklesem PSA o více než 50 %, a to v 30,1 vs 19,2 % pro monoterapii s hydrokortisonem [7]. Urychluje také nástup klinického efektu léčby a zvyšuje klinický benefit, ale neovlivňuje délku přežití. Rodriguez Garzotto et al [8] hodnotili efektivitu vinorelbinu weekly (60 mg/m2) u 23 nemocných předléčených taxany u metastatického kastračně rezistentního karcinomu prostaty. Třetina nemocných odpověděla > 50% poklesem PSA s nezaznamenanou toxicitou stupně 3–4. Obdobnou zkušenost máme z hodnocení souboru nemocných z pracovišť v České republice, kterou jsme opakovaně prezentovali na národních kongresech. Vzhledem k omezeným možnostem léčby II. linie mCRCP v našich podmínkách byl vinorelbin v II. linii léčby, i přes omezená data, podáván na řadě českých pracovišť.
Imunoterapie je další možností léčby kastračně rezistentního karcinomu prostaty, která na základě výsledků klinických studií z posledního období prokázala, že má své místo v léčbě minimálně invazivního nebo asymptomatického kastračně rezistentního karcinomu prostaty. Sipuleucel-T je produktem aktivní buněčné imunoterapie. Skládá se z autologních dendritických buněk, které jsou izolovány leukaferézou z mononukleárních krevních buněk z periferní krve. Studie IMPACT (Immunotherapy for Prostate Adenocarcinoma Treatment; D9902B) randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie fáze III hodnotila jako primární cíl u 512 zařazených mužů celkové přežití. Byla prováděna pouze ve Spojených státech amerických. Výsledkem je prodloužení mediánu celkového přežití o 4,1 měsíce (25,8 vs 21,7 měsíce). Vakcinace je obecně velmi dobře tolerována, jako nežádoucí účinek se nejčastěji objevuje zimnice, horečka a únava. Sipuleucel-T je efektivní i u pacientů bez předchozí chemoterapie. V případě, že během vakcinace dojde k progresi onemocnění, je doporučeno přejít na jiný typ léčby [6]. FDA byl sipuleucel-T schválen v roce 2010, v té době bylo ve Spojených státech amerických pouze 50 center s možností přípravy s předpokladem, že do konce roku 2011 jich bude 500. Sipuleucel-T je FDA doporučen pouze pro USA vzhledem k tomu, že studie IMPACT byla prováděna pouze ve Spojených státech amerických. Studie v Evropě probíhají nyní. Jeho benefit je u časného podání před chemoterapií, která je provázena denním podáním kortikoidů nebo před podáním abirateronu, kdy se mění imunitním systém.
Přibližně 85–90 % mužů s kastračně rezistentním karcinomem prostaty má radiologicky evidentní metastatické postižení skeletu. Komplikace související s tímto postižením, označované jako skeletal--relatedevents (SREs), zahrnující patologickou frakturu, míšní kompresi, nutnost případného chirurgického řešení nebo radioterapii, zvyšují mortalitu takto postižených nemocných. Radium 223 Alpharadin a jeho dceřiné radionuklidy způsobují změny v DNA s následnou buněčnou smrtí, ale za menší radiační zátěže na zdravou kostní dřeň než běžně používané beta zářiče. Studie fáze III ALSYMPCA probíhala na 922 pacientech se symptomatickým kostním postižením u metastatického kastračně rezistentního karcinomu prostaty. Bylo prokázáno statisticky signifikantní prodloužení celkového přežití v rameni s alpharadinem 14,0 měsíce ve srovnání s placebem 11,2 měsíce (HR 0,695; 95% CI 0,581–0,832; p = 0,00007). Statisticky signifikantně došlo také k prodloužení doby do první SRE 12,2 měsíce pro rameno s alpharadinemvs 6,7 měsíce pro rameno s placebem (p < 0,0001) [9].
JAKÉ JSOU MOŽNOSTI SEKVENČNÍ LÉČBY KASTRAČNĚ REZISTENTNÍHO KARCINOMU PROSTATY?
Radipní změna na poli kastračně rezistentního karcinomu prostaty nastala v roce 2004 s příchodem docetaxelu. Během posledních dvou let s nástupem nových molekul – cabazitaxel, abirateron, sipuleucel-T, alpharadin, enzalutamid (MDV 3100), každá s jiným mechanizmem účinku, každá s prokázaným benefitem na přežití – došlo k posunu ještě výraznějšímu. Cabazitaxel, abirateron i sipuleucel-T jsou po schválení FDA v letech 2010 a 2011 v USA běžně dostupné. Bohužel tato situace neplatí v naší republice. V době vydání tohoto článku jsou cabazitaxeli abirateron registrovány, ale nemají úhradu. Jsou dostupné pouze na tzv. § 16 nebo je možná úhrada z „paušálu“ oddělení.
Možností sekvenční léčby kastračně rezistentního karcinomu prostaty je celá řada (tab. 1). Která je ale ta správná, ta, která prodlouží přežití nemocného za dobré kvality života, s minimální toxicitou? Odpovědět se dá jednoduše, a to jedním slovem – nevíme. Už dnes ale můžeme s jistotou říci, že bude potřeba přepracovat tabulky v EAU doporučeních, která uvádějí odpověď na léčbu u kastračně rezistentního karcinomu po dobu 10–12 měsíců. Při správně zvolené sekvenci jednotlivých preparátů můžeme dosáhnout benefitu až 20,2 měsíce (tab. 2). Je třeba řady nejen klinických studií, ale také běžných klinických zkušeností, které se pokusí dát odpověď na řadu otázek, které léčbu kastračně rezistentního karcinomu prostaty v roce 2012 provázejí.
Table 1. Možnosti sekvenční léčby kastračně rezistentního karcinomu prostaty v roce 2012. 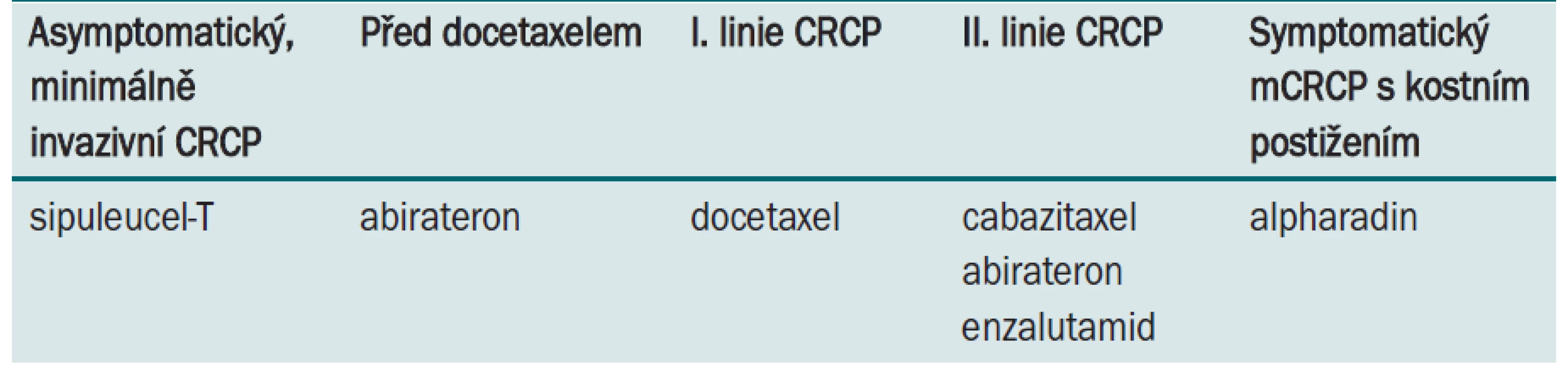
Table 2. Výsledky randomizovaných studií fáze III u kastračně rezistentního karcinomu prostaty po předchozí léčbě docetaxelem. 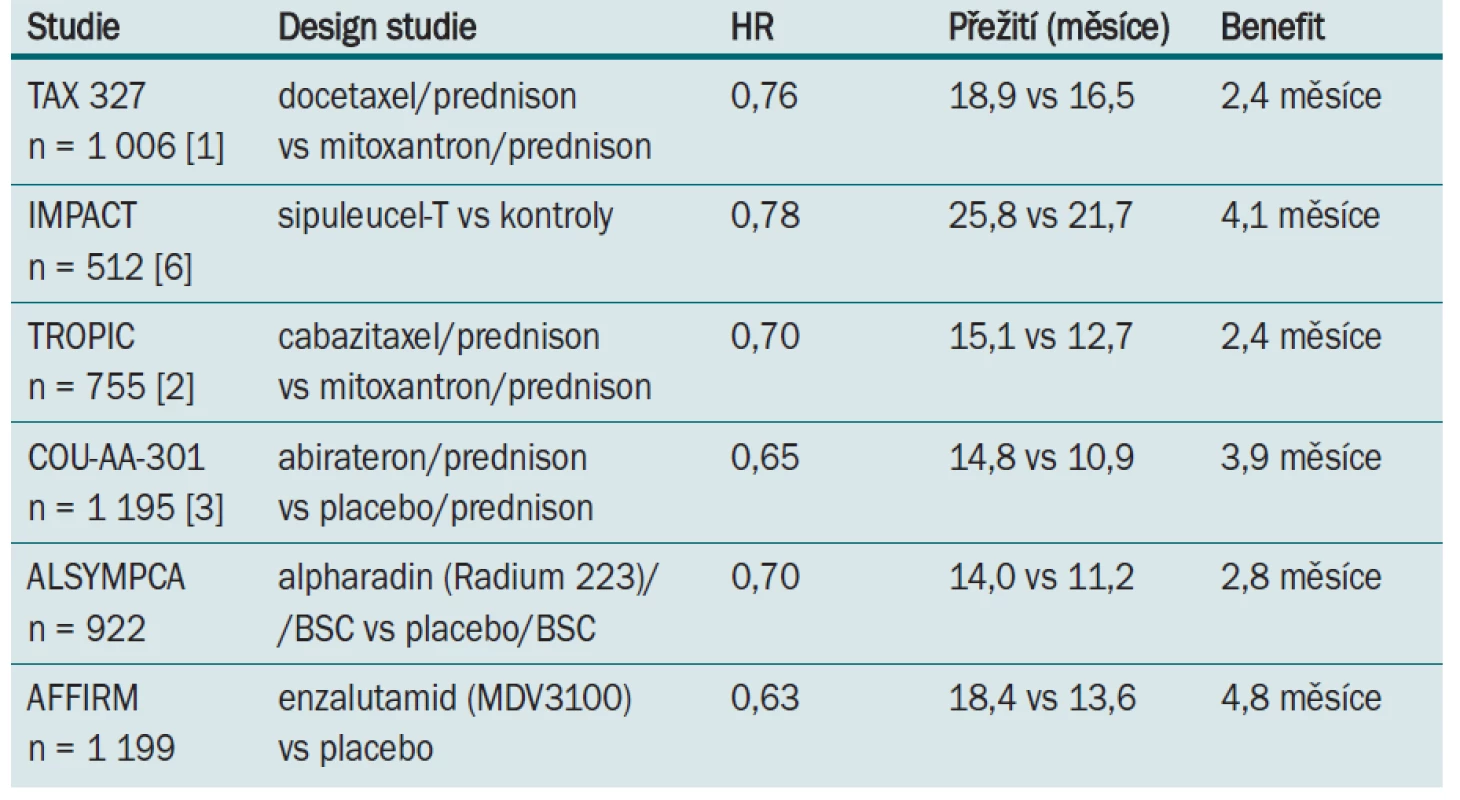
MUDr. Jana Katolická, Ph.D.
Onkologicko-chirurgické oddělení FN u svaté Anny
Pekařská 53, 656 91 Brno
jana.katolicka@fnusa.cz
Sources
1. Ansari J, Hussain SA, Alhasso A et al. Role of second-line systemictreatment post-docetaxel in metastatic castrate resistant prostate cancer – current strategies and future directions. Anticancer Agents Med Chem 2011; 11(3): 296–306.
2. De Bono JS, Oudard S, Ozguroglu M et al. Pred-nisone plus cabazitaxel or mitoxantrone for meta-static castration-resistant prostate cancer (mCRPC) progresing after docetaxel treatment: a rando-mized open-label trial. Lancet 2010; 376(9747): 1147–1154.
3. deBonno JS, Logothetis CJ, Molina A et al. Abiraterone and Oncreased Survival in Metastatic Prostate Cancer. N Engl J Med 2011; 364(21): 1995–2005.
4. Ansari J, Husain SA, Zarkar A et al. Docetaxel and prednisolone chemotherapy for metastatic hormone refraktory prostate canecr as first-line palliative chemotherapy and subsequent re-treatment: Birmingham experience. Oncol Rep 2008; 20(4): 891–896.
5. Eymard JC, Oudard S, Gravis G et al. Docetaxel reintroduction in patients with metastatic castration-resistant docetaxel-sensitive prostate cancer: a retrospective multicentre study. BJU Int 2010; 106(7): 974–978.
6. Cha E, Fong L. Imunoterapie karcinomu pros-taty: biologické a léčebné aspekty. JCO 2011; 3 : 308–315.
7. Zampino MG, Verri E, Locatelli M et al. Vinorelbine--based Chemotherapy in Hormone-refractory Prostate Cancer. Anticancer Res 2006; 26(3B): 2375–2380.
8. Rodriguez GA, Sepulveda J, Cortijo A et al. Oral vinorelbine as a fixed-weekly schedule in taxanes-refractory advanced HRPC: A single institution experience. J Clin Oncol 2009; abstr 16084.
9. Parker C, Nilsson S et al. Updated analysis of the phase III, double-blind, randomized, multinational study of radium-233 chloride in castration-resistant prostate cancer (CRCP) patients with bone metastases (ALSYMPCA), ASCO 2012.
Labels
Paediatric urologist Urology
Article was published inUrological Journal

2012 Issue 4-
All articles in this issue
- Nádory penisu spojené s výskytem dalších novotvarů
- Vedlejší účinky hormonální substituční léčby testosteronem
- Vývoj chirurgického odběru spermií u mužů s azoospermií
- Adenomatoidní tumor varlete – diagnostika a doporučené operační postupy
- Vaporizace prostaty pomocí zeleného laseru (GreenLight laser) – zkušenost z jednoho centra po provedení více než 1 000 výkonů
- Syntetický miduretrální sling při léčbě močové inkontinence u žen: analýza 1 000 případů z jednoho centra
- Virulentný profil a rezistencia Escherichia coli izolovaných od imunokompromitovaných pacientov pri urosepse
- Sekvence léčby a sledování pacienta s metastatickým kastračně rezistentním karcinomem prostaty
- Urological Journal
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Vedlejší účinky hormonální substituční léčby testosteronem
- Adenomatoidní tumor varlete – diagnostika a doporučené operační postupy
- Vaporizace prostaty pomocí zeleného laseru (GreenLight laser) – zkušenost z jednoho centra po provedení více než 1 000 výkonů
- Vývoj chirurgického odběru spermií u mužů s azoospermií
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

