-
Medical journals
- Career
Monoklonální protilátky v léčbě mnohočetného myelomu
: T. Jelínek 1; P. Všianská 2; R. Hájek 1
: Klinika hematoonkologie, Fakultní nemocnice Ostrava 1; Oddělení klinické hematologie, Fakultní nemocnice Brno 2
: Transfuze Hematol. dnes,21, 2015, No. 2, p. 74-83.
: Comprehensive Reports, Original Papers, Case Reports
Monoklonální protilátky jsou jednou z nejdynamičtěji se rozvíjejících skupin látek v léčbě nádorových onemocnění. První protilátkou zavedenou do hematologické praxe byl rituximab, který přinesl významné zlepšení léčebných výsledků u celé řady B-lymfoproliferací, ale jeho efektivita u mnohočetného myelomu (MM) byla nízká. V léčbě MM tedy zatím není schválena žádná monoklonální protilátka, nicméně několik velmi perspektivních molekul je v posledních fázích klinického testování. Zejména daratumumab (anti-CD38) a elotuzumab (anti-CS1) prokázaly výjimečnou efektivitu ve studiích fáze I/II. Jejich vedlejší účinky byly minimální, což je důležité pro jejich zařazení do kombinací s dalšími toxičtějšími léky jako jsou inhibitory proteasomu či imunomodulační látky. V tomto souhrnném sdělení jsou popsány nejperspektivnější monoklonální protilátky, které se v procesu klinického testování dostaly nejdále. Pozornost je věnována i přesnému mechanismu účinku a důvodům proč jsou efektivní právě u mnohočetného myelomu. Pokud se potvrdí dosavadní výsledky i ve studiích fáze III, mohly by se monoklonální protilátky stát nedílnou součástí léčby této plazmocelulární dyskrazie a svým unikátním mechanismem účinku přispět k dalšímu zlepšování celkových výsledků.
Klíčová slova:
mnohočetný myelom, monoklonální protilátky, daratumumab, elotuzumab, siltuximab, lorvotuzumabÚVOD
Mnohočetný myelom patří spolu s chronickou lymfocytární leukemií a difuzním velkobuněčným B-lymfomem mezi 3 nejčastější hematologické malignity s incidencí 6 případů na 100 000 obyvatel a představuje asi 1 % všech nádorových onemocnění [1, 2]. Se zavedením autologní transplantace krvetvorných buněk (ASCT) a tzv. nových látek, jako jsou inhibitory proteasomu (bortezomib) a imunomodulační látky (lenalidomid, thalidomid), došlo k výraznému zlepšení léčebných výsledků. V současné době je medián celkového přežití (OS) u pacientů schopných podstoupit ASCT 6–8 let, přičemž až třetina nemocných žije déle než 10 let, u starších pacientů neschopných podstoupit ASCT je medián OS 4–6 let [3–5]. Přes zmíněné pokroky v léčbě dojde u většiny nemocných k opakovaným relapsům nemoci, které jsou již hůře terapeuticky ovlivnitelné. Medián OS u pacientů refrakterních jak k bortezomibu, tak k některé z imunomodulačních látek (IMiDs), tzv. dvojitě refrakterních pacientů, je pouze 9 měsíců [6]. Právě pro tyto pacienty je nutno vyvíjet nové léky, které by byly schopny překonat nepříznivý průběh onemocnění. V současné době dochází ke klinickému testování nových generací inhibitorů proteasomu (carfilzomib, ixazomib, oprozomib) a třetí generaci IMiDs (pomalidomid), přičemž carfilzomib a pomalidomid jsou již v některých zemích schváleny ke klinickému užití. Dále jsou testovány látky s odlišným mechanismem účinku, jako inhibitory histon deacetylázy, mTOR inhibitory, Akt inhibitory, inhibitory KSP (kinesin spindle protein), monoklonální protilátky a další [7]. Právě monoklonální protilátky představují nejslibnější skupinu látek, která by mohla znamenat zlom v léčbě této neoplazie. Pro snadnější orientaci a přehlednost jsou porovnány všechny dosavadní výsledky léčby monoklonálními protilátkami s výsledky registračních studií standardně používaných látek a jejich kombinací – tabulka 1.
1. Porovnání účinnosti monoklonálních protilátek se standardně užívanými látkami v léčbě RRMM 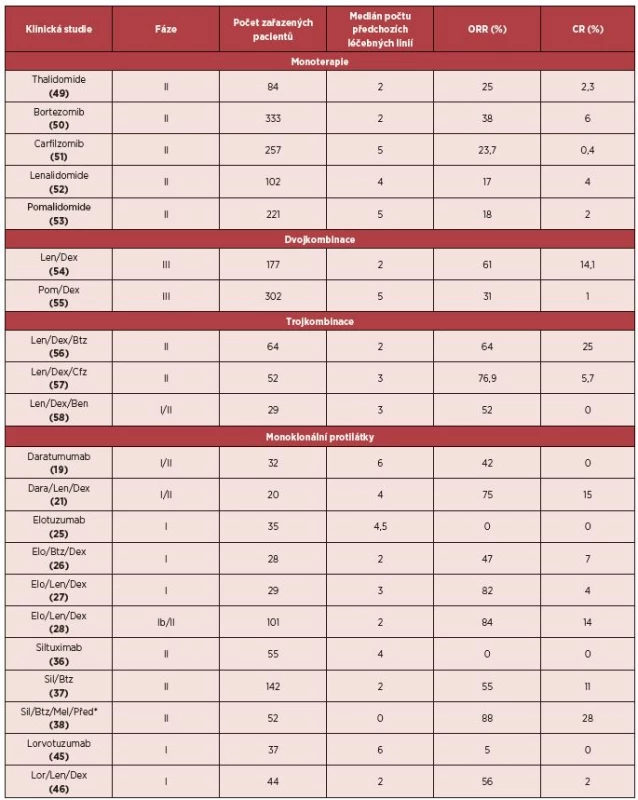
*Studie určená pro pacienty s nově diagnostikovaným MM. DARATUMUMAB (HUMAX™-CD38, DARA)
V minulosti byla zkoumána celá řada anti-CD38 monoklonálních protilátek, ale DARA prokázal dosud největší účinnost a dostal se nejdále v klinickém testování. Existují další příbuzné anti-CD38 protilátky, jako je SAR650984 (Sanofi), MOR03087 (Morphosys) nebo Ab79 (Takeda), které jsou ve vývoji, avšak daratumumab se z nich zdá být v tuto chvíli nejperspektivnější [8, 9].
Daratumumab je lidská IgG1κ monoklonální protilátka namířena proti CD38, což je transmembránový glykoprotein o velikosti 46 kDa [10]. Tato molekula funguje jako ektoenzym regulující cytoplazmatickou koncentraci kalcia, ale rovněž se chová jako receptor účastnící se mezibuněčných interakcí a transmembránové signalizace [11]. Za normálních okolností je CD38 nízce exprimován na povrchu myeloidních i lymfoidních buněk, stejně jako na buňkách jiných tkání (epitelie, pruhované svalstvo, neurony) [12]. Z myeloidních buněk jsou to zejména neutrofily, eozinofily a bazofily, stejně jako CD14++CD16-monocyty [13], z lymfoidních je to poté většina tzv. natural killer (NK) buněk, zralé T-lymfocyty, prekurzorové B-lymfocyty, více než polovina B-lymfocytů kostní dřeně a plazmocytů [14], – obrázek 1. Pluripotentní kmenové buňky, které jsou důležité pro obnovu krvetvorby, neexprimují CD38 vůbec. Nadměrnou expresi znaku CD38 je možné pozorovat u většiny lymfoidních neoplazií, nicméně na maligních plazmocytech je CD38 exprimován vysoce (CD38++), na rozdíl od ostatních buněk [15]. Tato skutečnost z něj dělá ideální cíl pro užití monoklonálních protilátek v léčbě mnohočetného myelomu.
1. Exprese znaku CD38 na buňkách kostní dřeně u pacienta s MM Slabá pozitivita na znak CD38 detekována na části granulocytů (zelená), na monocytech (tmavě modrá), na většině lymfocytů (žlutá) včetně nezralých forem B-lymfocytů (fialová) a malé části zralých B-lymfocytů (světle modrá). Vysoká exprese detekována na plazmocytech (červená). Analýza provedena na průtokovém cytometru FACSCantoII s využitím akvizičního software Diva 6.0 (Becton Dickinson) a analyzačního software Infinicyt 1.6 (Cytognos). pos = CD38 pozitivní buňky, neg = CD38 negativní buňky, ---- = hranice pozitivity/negativity 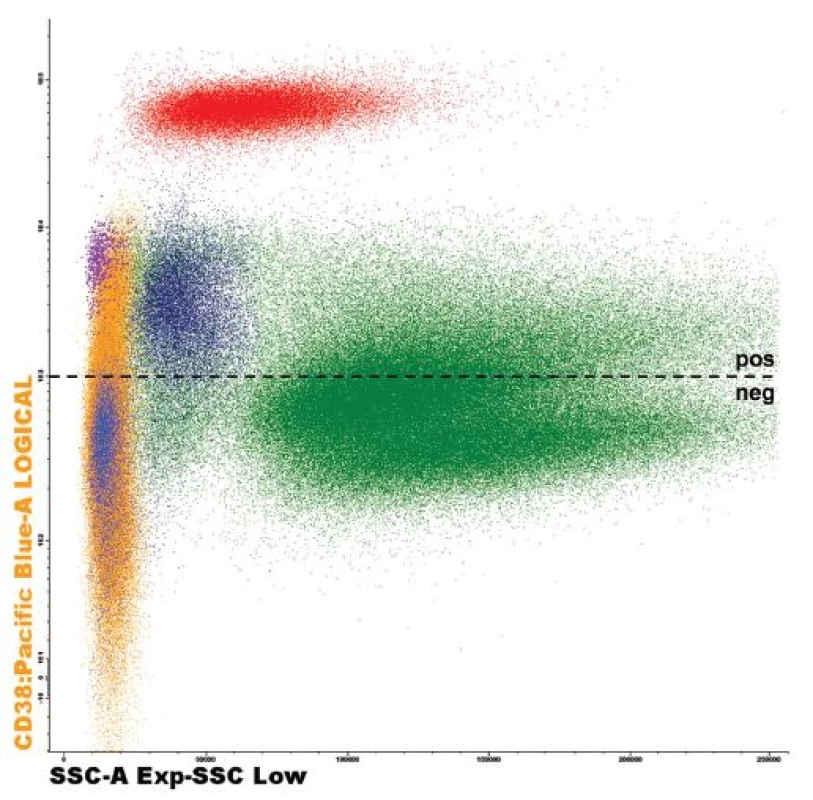
Daratumumab, podobně jako jiné monoklonální protilátky, zabíjí cílové buňky pomocí několika mechanismů účinku. ADCC (antibody-dependent cell–mediated cytotoxicity) je v principu zabití protilátkou označené buňky pomocí cytotoxických efektorových buněk, nejčastěji uvolněním obsahu cytotoxických granul. Efektorové buňky podílející se na ADCC jsou nejčastěji NK buňky, monocyty, makrofágy, neutrofily a eozinofily [16]. CDC (complement-dependent cytotoxicity) je další mechanismus účinku, kdy po navázání protilátky na cílovou buňku dojde k aktivaci komplementového systému. Celá komplementová kaskáda končí vytvořením tzv. membránu atakujícího komplexu – doslova vytvořením děr v membráně a lýze cílové buňky [17]. Mezi další mechanismy účinku monoklonálních protilátek patří ADCP (antibody-dependent cellular phagocytyosis), tedy makrofágy zprostředkovaná fagocytóza a přímá indukce apoptózy v protilátkami označených buňkách [8]. Mechanismus účinku DARA je znázorněn na obrázku 2. Na závěr je nutno zmínit, že imunomodulační látky (IMiDs) zvyšují funkce efektorových buněk (zejména NK buněk, makrofágů), které jsou nezbytné pro efekt daratumumabu. Lze tedy očekávat, že přidáním některého z IMiDs do kombinace dojde ještě ke zvýšení účinnosti této látky [18].
2. Mechanismus účinku daratumumabu Daratumumab indukuje smrt myelomových buněk několika mechanismy: 1. ADCC (antibody dependent cellular cytotoxicity), 2. CDC (complement dependent cytotoxicity), 3. ADCP (antibody-dependent cellular phagocytosis), 4. přímá indukce apoptózy v myelomových buňkách. 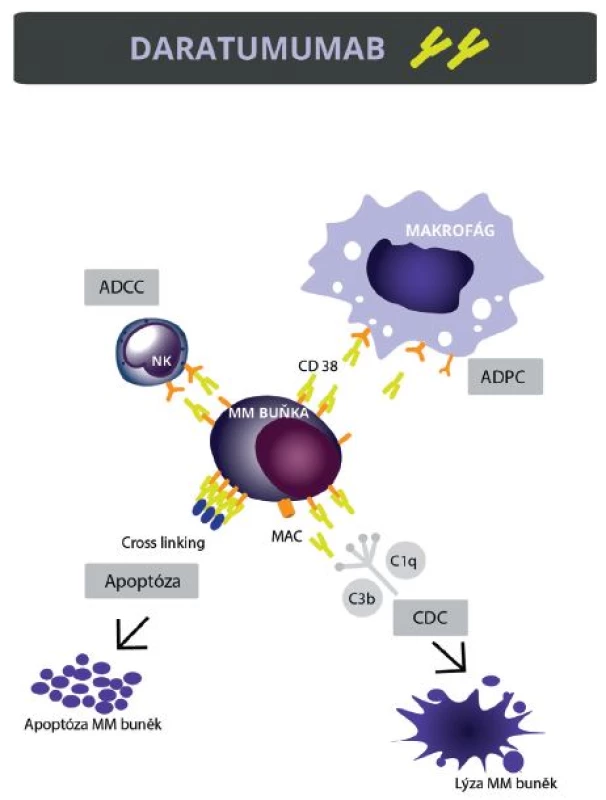
Daratumumab byl poprvé použit v klinické praxi ve studii fáze I/II, do které byli zařazeni pacienti s relabovaným/refrakterním mnohočetným myelomem (RRMM), kteří podstoupili minimálně 2 linie léčby [19, 20]. Do první části studie bylo zařazeno celkem 32 silně předléčených nemocných (medián počtu předchozích linií – 6), z nichž 75 % bylo dvojitě refrakterních (na bortezomib a lenalidomid). Z pacientů, kteří obdrželi DARA v dávce ≥ 4 mg/kg, bylo dosaženo celkové léčebné odpovědi (ORR) u 42 % nemocných, což lze považovat za bezprecedentní výsledek při použití pouze jedné účinné látky. Z nežádoucích účinků byly nejčastější s infuzí spojené reakce, které se vyskytly u 30 % pacientů během podání první dávky. Po zavedení adekvátní premedikace ve formě kortikoidů se nevyskytly žádné účinky vážného charakteru. Po zhodnocení těchto výsledků obdržel DARA označení „breaktrough therapy“ od americké FDA (Food and Drug Administration), což umožní rychlejší uvedení této látky do klinické praxe [8]. Na kongresu ASH 2014 (American Society of Haematology) byly prezentovány první výsledky multicentrické studie fáze I/II zkoumající kombinaci daratumumab + lenalidomid + dexametazon u pacientů s RRMM. Z celkem 20 pacientů, u nichž bylo možné zhodnotit léčebnou odpověď, byla ORR pozorována u 75 % (15/20) nemocných, z toho velmi dobré parciální remise (VGPR) dosáhlo 30 % (6/20) a celkové remise (CR) 15 % (3/20) nemocných. Mezi nejčastější nežádoucí účinky patřila neutropenie a průjem, nicméně celkově byla léčba dobře tolerována a toxicita zvladatelná [21]. V současné době probíhají čtyři klinická hodnocení fáze III jak u pacientů s RRMM, tak s nově diagnostikovaným MM – tabulka 2.
2. Probíhající klinická hodnocení fáze III, zkoumající monoklonální protilátky 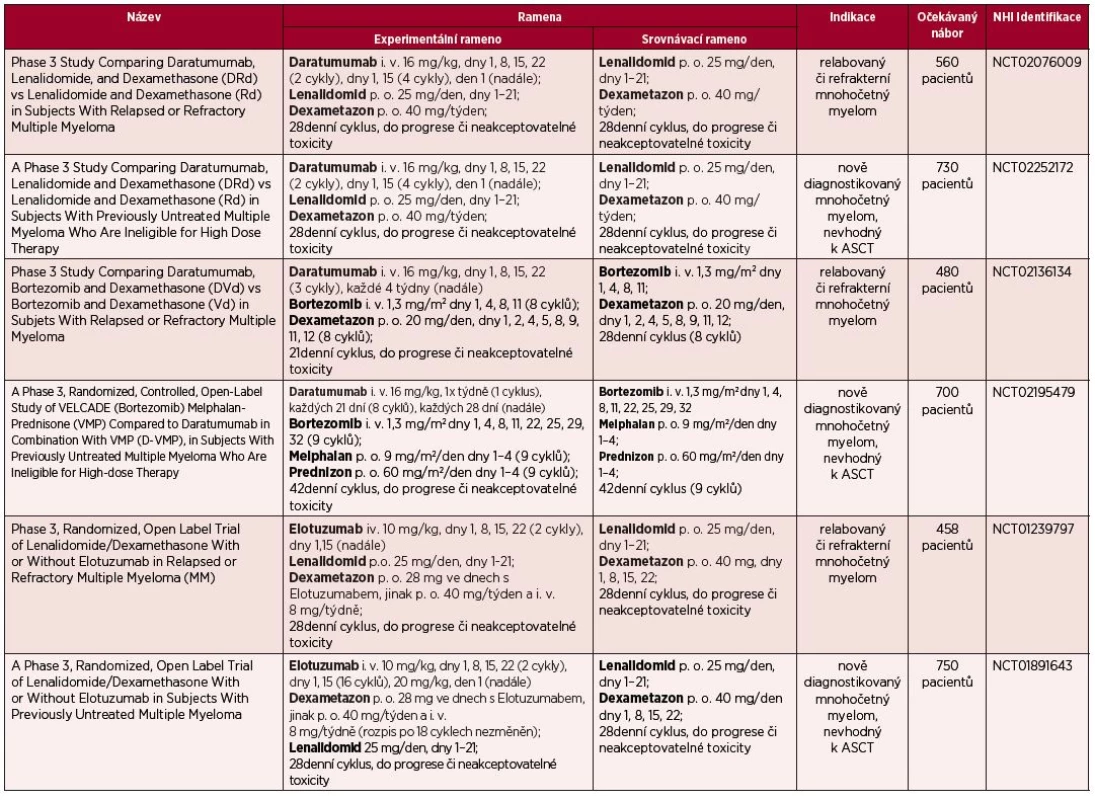
Elotuzumab (HuLuc63, Elo)
Elotuzumab je humanizovaná IgG1 monoklonální protilátka cílená proti membránovému glykoproteinu CS1 (rovněž známému jako SLAMF7, CRACC, CD2 subset-1 nebo CD319). Tento povrchový antigen je vysoce exprimovaný na myelomových buňkách a fyziologických plazmocytech, nižší exprese je pozorována na NK buňkách, NKT (NK-like T) buňkách a části CD8 pozitivních T-lymfocytů. Minimálně, nebo vůbec, je tento antigen přítomen na ostatních buňkách imunitního systému, krvetvorných kmenových buňkách a buňkách jiných tkání [22, 23]. Funkce tohoto glykoproteinu na povrchu plazmocytů zůstává nejasná. Mechanismus účinku elotuzumabu spočívá dominantně v NK buňkami zprostředkované ADCC (antibody-dependent cellular cytotoxicity) [24], rovněž jako u DARA lze očekávat silný synergický účinek s IMiDs.
Poprvé byl elotuzumab testován u pacientů s RRMM v monoterapii, přičemž výsledky této studie fáze I nebyly pozitivní. Celkem bylo zařazeno 35 nemocných s mediánem 4,5 předchozích léčebných linií, přičemž nebyla pozorována žádná objektivní odpověď, 26 % pacientů mělo SD (stabilní nemoc), u zbylých pacientů onemocnění progredovalo [25]. Nicméně následující studie zkoumající kombinace elotuzumabu jak s bortezomibem, tak zejména s lenalidomidem a dexametazonem, prokázaly vysokou účinnost této látky.
Kombinace elotuzumabu s bortezomibem a dexametazonem byla zkoumána u 28 pacientů s RRMM v klinické studii fáze I. Z celkem 27 hodnotitelných pacientů (s mediánem 2 předchozích linií), bylo dosaženo celkové léčebné odpovědi u 47 % nemocných (13/27), z toho 7 % dosáhlo CR (2/27). Mezi nejčastější nežádoucí účinky 3. a 4. stupně patřila lymfopenie (25 %) a únava (14 %) [26]. Výrazně lepší výsledky přinesla studie fáze I, kombinující elotuzumab s lenalidomidem a dexametazonem u 29 pacientů s RRMM, s mediánem 3 předchozích linií léčby. Celkové léčebné odpovědi dosáhlo 82 % léčených pacientů (23/28), z toho VGPR 29 % (8/28) a CR 4 % (1/28) pacientů. Toxicita 3. a 4. stupně této kombinace byla zejména hematologická – neutropenie a trombocytopenie u 36 %, resp. 21 % pacientů [27].
Zatím nejrobustnější data týkající se elotozumabu byla publikována na ASH 2014, a to konečné výsledky studie fáze Ib/II, kde byla rovněž testována kombinace s lenalidomidem a dexametazonem. Celkem bylo zařazeno 101 pacientů s RRMM s více než jednou předchozí linií léčby. Celková léčebná odpověď byla pozorována u 84 % nemocných, z toho 43 % dosáhlo VGPR a 14 % CR. Vážné nežádoucí účinky byly přítomny u 58 % nemocných, nejčastěji pneumonie (12 %), a s infuzí související reakce u 10 % nemocných. Tato studie prokázala vysokou klinickou efektivitu a dostatečnou bezpečnost kombinace Elo/Len/Dex [28]. Aktuálně probíhající klinické studie fáze III s elotuzumabem jsou přehledně zobrazeny – viz tabulka 2.
Siltuximab (CNTO 328)
Již na konci 20. století byla zkoušena celá řada monoklonálních protilátek proti interleukinu-6 (Il-6) [29]. Nejslibnější z nich se zdál být siltuximab, chimérická monoklonální protilátka namířená proti tomuto interleukinu [30]. Il-6 je pleiotropní cytokin, který hraje, mimo jiné, klíčovou roli v patogenezi mnohočetného myelomu a jiných B-lymfoproliferací [31–33]. Tento cytokin se podílí na proliferaci a přežívání maligních plazmocytů. Stejně tak hraje důležitou úlohu při vzniku rezistence k látkám, jako je melfalan či bortezomib a zejména pak při vzniku rezistence na kortikoidy [34, 35]. Ze všech těchto důvodů byla blokáda Il-6 pomocí monoklonálních protilátek logickým krokem.
Bezpečnost a efektivita siltuximabu samotného a v kombinaci s dexametazonem byla hodnocena v klinické studii fáze II u pacientů s relabovaným/refrakterním mnohočetným myelomem. Celkem bylo zařazeno 53 pacientů s mediánem 4 předchozích linií léčby. Na siltuximab v monoterapii neodpověděl ani jeden pacient, 62 % (8/13) zaznamenalo SD, zbytek progresi. Kombinace siltuximabu s dexametazonem byla použita u 38 pacientů, přičemž pouze 11 % (4/38) dosáhlo alespoň PR. Mezi závažné nežádoucí účinky 3. a 4. stupně patřila zejména hematologická toxicita (trombocytopenie, anémie, neutropenie) [36].
Nedávno byly publikovány výsledky největší randomizované studie fáze II, srovnávající siltuximab + bortezomib versus bortezomib v monoterapii. Celkem bylo zařazeno 281 pacientů s RRMM, kteří podstoupili minimálně jednu předchozí linii léčby. Celková léčebná odpověď byla v rameni siltuximab + bortezomib 55 % versus 47 % v rameni se samotným bortezomibem (p = 0,213), kompletní odpovědi bylo dosaženo u 11 % vs. 7 % pacientů, medián přežití bez progrese (progression free survival; PFS) byl 8,0 vs. 7,6 měsíců (p = 0,345) a medián OS byl 30,8 vs. 36,8 měsíců (p = 0,103). Nejčastějšími nežádoucími účinky byly opět trombocytopenie a neutropenie a spolu s infekčními komplikacemi se vyskytovaly častěji v rameni siltuximab + bortezomib. Přidání siltuximabu k bortezomibu nevedlo k prodloužení ani jednoho ze sledovaných ukazatelů přežití v této skupině nemocných [37].
San Miguel et al. publikovali výsledky klinické studie fáze II, kde byl poprvé použit siltuximab v primoléčbě, a to u 106 pacientů s nově diagnostikovaným mnohočetným myelomem neschopných podstoupit autologní transplantaci kostní dřeně. V této randomizované studii byla porovnána standardní léčba bortezomib + melfalan + prednizon (VMP) versus siltuximab + VMP (S + VMP). Celková léčebná odpověď byla v rameni S+VMP 88 % versus 80 % v rameni VMP, VGPR dosáhlo 71 % versus 51 % pacientů (p = 0,0382). Kompletních odpovědí bylo dosaženo v rameni S + VMP u 28 % pacientů, zatímco v rameni VMP u 22 % pacientů, což nepotvrdilo původní hypotézu, že přidání siltuximabu by mělo zvýšit počet CR alespoň o 10 %. Rovněž v této studii byla hematologická toxicita a infekční komplikace zodpovědné za většinu vážných nežádoucích účinků a vyskytovaly se častěji v rameni se siltuximabem. Přidání siltuximabu k režimu VMP nezlepšilo adekvátně množství kompletních odpovědí, ani nevedlo ke zlepšení dlouhodobých výsledků přežití [38].
Pro úplnost je nutno dodat, že v dubnu 2014 byl siltuximab schválen americkou FDA pro léčbu pacientů s multicentrickou Castlemanovou nemocí, kteří jsou jak HIV (human immunodeficiency virus), tak HHV-8 (human herpesvirus-8) negativní [39].
Lorvotuzumab mertansine (IMGN901, BB-10901, LM)
Podobně jako brentuximab vedotin v léčbě Hodgkinova lymfomu a jiných CD30+ lymfoproliferací, je i lorvotuzumab mertansine konjugát monoklonální protilátky a cytotoxické látky. V tomto případě je monoklonální protilátka cílená proti antigenu CD56 a navázaným konjugátem je mitotický jed maytansine, přírodní látka původně izolovaná z etiopského keře Maytenus serrata, až 1 000krát účinnější než vinka alkaloidy [40, 41]. Jakmile je monoklonální protilátka navázána na povrchový antigen, dojde k uvolnění a internalizaci cytotoxického konjugátu, který zastaví polymerizaci tubulinu a cílová buňka umírá.
CD56, rovněž známý jako N-CAM (neural cell adhesion molecule), je membránový glykoprotein, který je za normálních okolností exprimován na tkáních nervového systému a je typickým znakem na povrchu všech NK buněk a také na části cytotoxických T-lymfocytů [42]. Za patologických okolností je poté přítomen na celé řadě solidních tumorů, jako je malobuněčný karcinom plic, ovariální karcinom, neuroblastom a další [43]. Na fyziologických plazmocytech není CD56 přítomen, tzv. normální fenotyp plazmocytů je tedy CD19+56 - (obr. 3). Na druhou stranu je CD56 silně exprimován na patologických plazmocytech téměř v 80 % případů onemocnění mnohočetným myelomem [44].
3. Fenotyp plazmocytů (PC) u pacienta s MM Patologické klonální PC (fialová) s typickým fenotypem CD19-CD56+ (A) a restrikcí cytoplazmatického lehkého imunoglobulinového řetězce kappa (B). Reziduální fyziologické PC (modrá) bez exprese CD56 (A) a normálním poměrem exprese lehkých řetězců kappa/lambda (B). Analýza provedena na flowcytometru FACSCantoII s využitím akvizičního software Diva 6.0 (Becton Dickinson) a analyzačního software Infinicyt 1.6 (Cytognos). 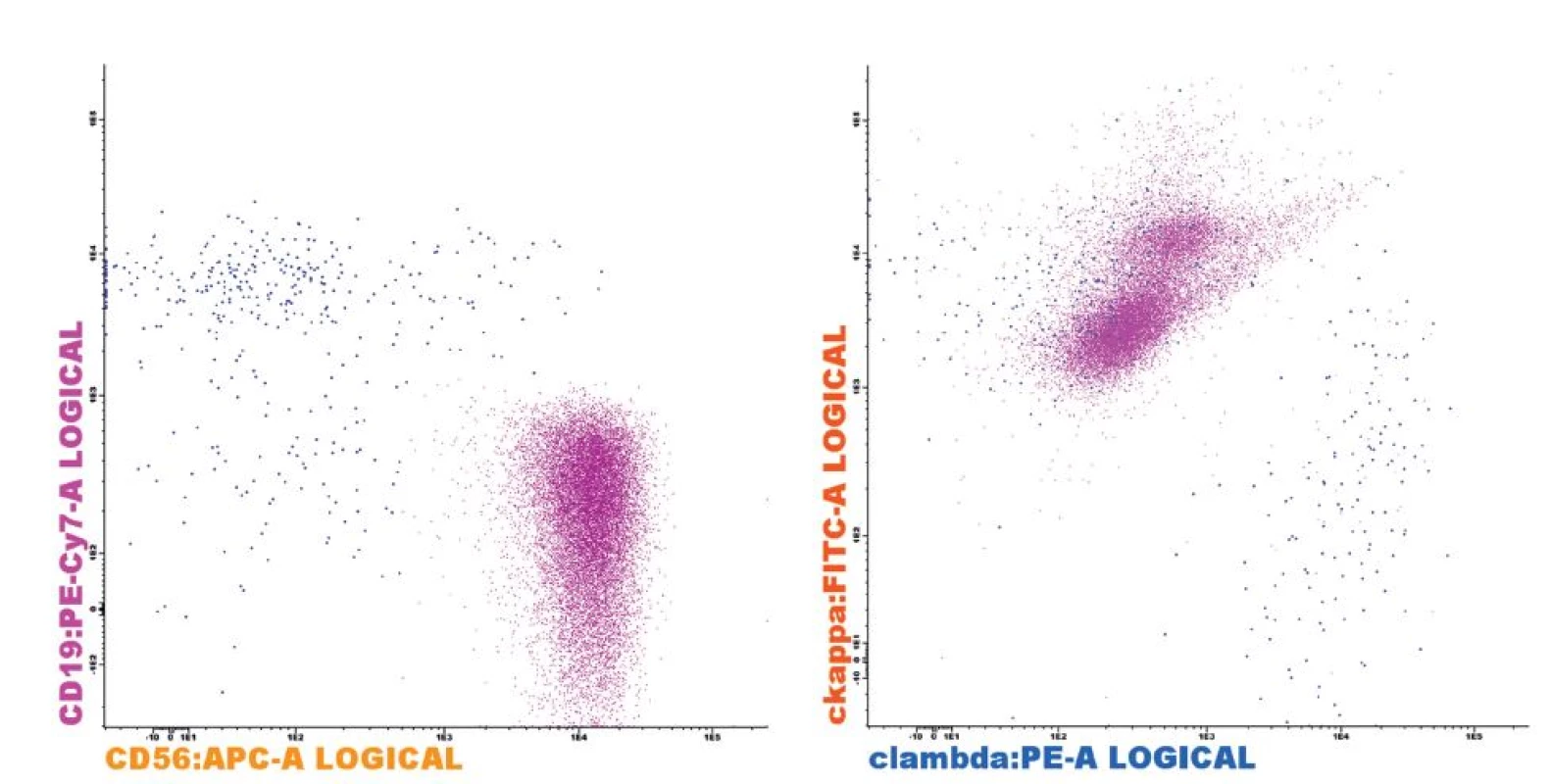
Klinických dat je k dispozici daleko méně než u předešlých protilátek. V monoterapii byl LM použit ve studii fáze I u 37 pacientů s RRMM, s mediánem 6 předchozích linií léčby. U 41 % pacientů (15/37) byla pozorována alespoň SD (stabilní nemoc), nicméně PR bylo dosaženo pouze u 5 % pacientů (2/37) [45]. Dále byl lorvotuzumab mertansine testován v kombinaci s lenalidomidem a dexametazonem v klinické studii fáze I, do které bylo celkem zařazeno 44 pacientů s mediánem 2 předchozích linií léčby. Celkové léčebné odpovědi bylo dosaženo u 56 % pacientů (22/39), z toho VGPR u 28 % (11/39) a CR u 2 % (1/39) hodnotitelných pacientů. Mezi nejčastější nežádoucí účinky této kombinace patřila periferní neuropatie a neutropenie s trombocytopenií [46]. V současné době neprobíhá žádná klinická studie fáze III testující tuto monoklonální protilátku.
V současné době je ve vývoji celá řada dalších monoklonálních protilátek cílených na různé povrchové antigeny na povrchu myelomových buněk. Do fáze I klinického testování se dostaly dvě anti-CD40 monoklonální protilátky lucatumumab a dacetuzumab, jejichž dosavadní výsledky zatím nejsou povzbudivé [47, 48]. CD138, CD74 a celá řada dalších antigenů patří mezi potenciální cíle léčby monoklonálními protilátkami.
ZÁVĚR
Monoklonální protilátky představují novou významnou skupinu látek s unikátním mechanismem účinku, který se liší od doposud užívaných látek v léčbě mnohočetného myelomu. Toxicita, a to jak krátkodobá tak dlouhodobá, se zdá být minimální, což je podstatné pro zařazení těchto molekul do kombinace s toxičtějšími léky. Daratumumab a elotuzumab jsou nejperspektivnější z několika důvodů. Cílové antigeny (CD38, CS1) jsou exprimovány téměř na všech maligních plazmocytech, zatímco na jiných tkáních či krvetvorných kmenových buňkách přítomny nejsou, tedy očekávané postranní účinky nejsou vážné. Toto tvrzení bylo potvrzeno i ve studiích fáze I a II, kdy nejčastější nežádoucí účinky byly s infuzí spojené reakce, které jsou dobře zvládnutelné adekvátní premedikací ve formě kortikoidů, případně paracetamolu a antihistaminik. Efektivita těchto dvou protilátek je výjimečná, obě látky v kombinaci s lenalidomidem a dexametazonem dosáhly ORR okolo 80 % ve skupině pacientů s relabovaným onemocněním. Daratumumab, na rozdíl od elotuzumabu, dosáhl v monoterapii u pacientů s mediánem 6 předešlých linií léčby ORR 42 %, což lze považovat za zcela bezprecedentní výsledek u této skupiny pacientů. Tyto výsledky vedly k iniciaci celé řady klinických hodnocení fáze III, a to jak u pacientů s relabovaným/refrakterním onemocněním, tak s nově diagnostikovaným mnohočetným myelomem (viz tab. 2). Siltuximab, přes velké naděje, které do něj byly vkládány, opakovaně v několika randomizovaných studiích nepotvrdil svoji účinnost a není přínosem pro pacienty s MM. Lorvotuzumab mertansine, i přes svou prokázanou účinnost, nedosahuje kvalit daratumumabu a elotuzumabu. Navíc použití pouze u cca 80 % pacientů (CD56+) a neurotoxicita, dána přítomností CD56 na povrchu neuronů, byly hlavním důvodem, proč se tato látka nedostala do fáze III klinického testování. Elotuzumab s daratumumabem by se již brzy mohly stát součástí protimyelomové léčby a znamenat podobný posun jako rituximab v léčbě non-hodgkinských lymfomů a chronické lymfocytární leukemie.
Podíl autorů na přípravě rukopisu
TJ – napsání rukopisu
PV – pomoc při zpracování rukopisu
RH – kontrola rukopisu
Prohlášení o konfliktu zájmů
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Poděkování
Autoři by rádi poděkovali především Mgr. Evě Jarošové za administrativní podporu. Dále pak Ing. Petře Novotné za pomoc při grafickém zpracování schémat. Tato práce byla podporována následujícím grantem MH CZ-DRO-FNOs/2014, IRP LF OU TRANS6.
Doručeno do redakce: 24. 2. 2015
Přijato po recenzi: 10. 3. 2015
MUDr. Tomáš Jelínek
Klinika hematoonkologie
Fakultní nemocnice Ostrava
17. listopadu 1790
708 52 Ostrava-Poruba
e-mail: tomas.jelinek@fno.cz
Sources
1. Sant M, Allemani C, Tereanu C, et al. Incidence of hematologic malignancies in Europe by morphologic subtype: results of the HAEMACARE project. Blood 2010;116(19): 3724–3734.
2. UK CR. Myeloma incidence statistics [online]. 2014 [cited 2015 Jan 11]. Available from: http://www.cancerresearchuk.org/cancer-info/cancerstats/types/myeloma/incidence/uk-multiple-myeloma-incidence-statistics.
3. San-Miguel JF, Mateos M-V. Can multiple myeloma become a curable disease? Haematologica 2011; 96(9): 1246–1248.
4. Hajek R. Strategies for the Treatment of Multiple Myeloma in 2013: Moving Toward the Cure. In: Hajek R, editor. Multiple Myeloma - A Quick Reflection on the Fast Progress [online]. InTech; 2013 [cited 2015 Jan 12]. Available from: http://www.intechopen.com/books/multiple-myeloma-a-quick-reflection-on-the-fast-progress/strategies-for-the-treatment-of-multiple-myeloma-in-2013-moving-toward-the-cure.
5. Rajkumar SV. Multiple myeloma: 2014 Update on diagnosis, risk-stratification, and management. Am J Hematol 2014; 89(10): 998–1009.
6. Kumar SK, Lee JH, Lahuerta JJ, et al. Risk of progression and survival in multiple myeloma relapsing after therapy with IMiDs and bortezomib: A multicenter international myeloma working group study. Leukemia 2012; 26(1): 149–157.
7. Van de Donk NWCJ, Lokhorst HM. New developments in the mana-gement and treatment of newly diagnosed and relapsed/refractory multiple myeloma patients. Expert Opin Pharmacother 2013; 14(12): 1569–1573.
8. Laubach JP, Tai Y-T, Richardson PG, Anderson KC. Daratumumab granted breakthrough drug status. Expert Opin Investig Drugs 2014; 23(4): 445–452.
9. Deckert J, Wetzel M-C, Bartle LM, et al. SAR650984, a novel humanized CD38-targeting antibody, demonstrates potent antitumor activity in models of multiple myeloma and other CD38+ hematologic malignancies. Clin Cancer Res Off J Am Assoc Cancer Res 2014; 20(17): 4574–4583.
10. Malavasi F, Funaro A, Roggero S, Horenstein A, Calosso L, Mehta K. Human CD38: a glycoprotein in search of a function. Immunol Today 1994; 15(3): 95–97.
11. Deaglio S, Zubiaur M, Gregorini A, et al. Human CD38 and CD16 are functionally dependent and physically associated in natural killer cells. Blood 2002; 99(7): 2490–2498.
12. Deaglio S, Mehta K, Malavasi F. Human CD38: a (r)evolutionary story of enzymes and receptors. Leuk Res 2001; 25(1): 1–12.
13. Han X, Jorgensen JL, Brahmandam A, et al. Immunophenotypic study of basophils by multiparameter flow cytometry. Arch Pathol Lab Med 2008; 132(5): 813–819.
14. Tedder TF, Clement LT, Cooper MD. Discontinuous expression of a membrane antigen (HB-7) during B lymphocyte differentiation. Tissue Antigens 1984; 24(3): 140–149.
15. Lin P, Owens R, Tricot G, Wilson CS. Flow cytometric immunophenotypic analysis of 306 cases of multiple myeloma. Am J Clin Pathol 2004; 121(4): 482–488.
16. Teillaud J-L. Antibody-dependent Cellular Cytotoxicity (ADCC). eLS [online]. John Wiley & Sons, Ltd; 2001 [cited 2015 Jan 19]. Available from: http://onlinelibrary.wiley.com/doi/10.1002/9780470015902.a0000498.pub2/abstract.
17. De Weers M, Tai Y-T, van der Veer MS, et al. Daratumumab, a novel therapeutic human CD38 monoclonal antibody, induces killing of multiple myeloma and other hematological tumors. J Immunol Baltim Md 1950 2011; 186(3): 1840–1848.
18. Van der Veer MS, de Weers M, van Kessel B, et al. The therapeutic human CD38 antibody daratumumab improves the anti-myeloma effect of newly emerging multi-drug therapies. Blood Cancer J 2011; 1(10): e41.
19. Plesner T, Lokhorst H, Gimsing P, Nahi H, Lisby S, Richardson PG. Daratumumab, a CD38 Monoclonal antibody in patients with multiple myeloma – data from a dose-escalation phase I/II Study. ASH Ann Meet Abstr 2012; 120(21): 73.
20. Lokhorst HM, Plesner T, Gimsing P, et al. Phase I/II dose-escalationstudy of daratumumab in patients with relapsed or refractory multiple myeloma. J Clin Oncol [online]. 2013 [cited 2015 Jan 21];31(suppl; abstr 8512). Available from: http://meetinglibrary.asco.org/content/109895-132.
21. Plesner T, Arkenau H-T, Lokhorst HM, et al. Safety and efficacy of daratumumab with lenalidomide and dexamethasone in relapsed or relapsed, refractory multiple myeloma. Blood 2014; 124(21): 84.
22. Hsi ED, Steinle R, Balasa B, et al. CS1, a potential new therapeutic antibody target for the treatment of multiple myeloma. Clin Cancer Res 2008; 14(9): 2775–2784.
23. Tai Y-T, Dillon M, Song W, et al. Anti-CS1 humanized monoclonal antibody HuLuc63 inhibits myeloma cell adhesion and induces antibody-dependent cellular cytotoxicity in the bone marrow milieu. Blood 2008; 112(4): 1329–1337.
24. Collins SM, Bakan CE, Swartzel GD, et al. Elotuzumab directly enhances NK cell cytotoxicity against myeloma via CS1 ligation: evidence for augmented NK cell function complementing ADCC. Cancer Immunol Immunother CII 2013; 62(12): 1841–1849.
25. Zonder JA, Mohrbacher AF, Singhal S, et al. A phase 1, multicenter, open-label, dose escalation study of elotuzumab in patients with advanced multiple myeloma. Blood 2012; 120(3): 552–559.
26. Jakubowiak AJ, Benson DM, Bensinger W, et al. Phase I trial of anti-CS1 monoclonal antibody elotuzumab in combination with bortezomib in the treatment of relapsed/refractory multiple myeloma. J Clin Oncol 2012; 30(16): 1960–1965.
27. Lonial S, Vij R, Harousseau J-L, et al. Elotuzumab in combination with lenalidomide and low-dose dexamethasone in relapsed or refractory multiple myeloma. J Clin Oncol 2012; 30(16): 1953–1959.
28. Richardson PG, Jagannath S, Moreau P, et al. Final Results for the 1703 phase 1b/2 study of elotuzumab in combination with lenalidomide and dexamethasone in patients with relapsed/refractory multiple myeloma. Blood 2014; 124(21): 302–312.
29. Van Zaanen HC, Lokhorst HM, Aarden LA, et al. Chimaeric anti-interleukin 6 monoclonal antibodies in the treatment of advanced multiple myeloma: a phase I dose-escalating study. Br J Haematol 1998; 102(3): 783–790.
30. Trikha M, Corringham R, Klein B, Rossi J-F. Targeted anti-Interleukin-6 monoclonal antibody therapy for cancer a review of the rationale and clinical evidence. Clin Cancer Res 2003; 9(13): 4653–4665.
31. Rawstron AC, Fenton JA, Ashcroft J, et al. The interleukin-6 receptor alpha-chain (CD126) is expressed by neoplastic but not normal plasma cells. Blood 2000; 96(12): 3880–3886.
32. Hong DS, Angelo LS, Kurzrock R. Interleukin-6 and its receptor in cancer: implications for translational therapeutics. Cancer 2007; 110(9): 1911–1928.
33. Kawano M, Hirano T, Matsuda T, et al. Autocrine generation and requirement of BSF-2/IL-6 for human multiple myelomas. Nature 1988; 332(6159): 83–85.
34. Voorhees PM, Chen Q, Small GW, et al. Targeted inhibition of interleukin-6 with CNTO 328 sensitizes pre-clinical models of multiple myeloma to dexamethasone-mediated cell death. Br J Haematol 2009; 145(4): 481–490.
35. Juge-Morineau N, François S, Puthier D, Godard A, Bataille R, Amiot M. The gp 130 family cytokines IL-6, LIF and OSM but not IL-11 can reverse the anti-proliferative effect of dexamethasone on human myeloma cells. Br J Haematol 1995; 90(3): 707–710.
36. Voorhees PM, Manges RF, Sonneveld P, et al. A phase 2 multicentre study of siltuximab, an anti-interleukin-6 monoclonal antibody, in patients with relapsed or refractory multiple myeloma. Br J Haematol 2013; 161(3): 357–366.
37. Orlowski RZ, Gercheva L, Williams C, et al. A phase 2, randomized, double-blind, placebo-controlled study of siltuximab (anti-IL-6 mAb) and bortezomib versus bortezomib alone in patients with relapsed or refractory multiple myeloma. Am J Hematol 2015; 90(1): 42–49.
38. San-Miguel J, Bladé J, Shpilberg O, et al. Phase 2 randomized study of bortezomib-melphalan-prednisone with or without siltuximab (anti-IL-6) in multiple myeloma. Blood 2014; 123(26): 4136–4142.
39. Deisseroth A, Ko C-W, Nie L, et al. FDA Approval: siltuximab for the treatment of patients with multicentric castleman disease. Clin Cancer Res Off J Am Assoc Cancer Res 2015; 21(5): 950–954.
40. Tassone P, Gozzini A, Goldmacher V, et al. In vitro and in vivo activity of the maytansinoid immunoconjugate huN901-N2′-Deacetyl-N2′-(3-Mercapto-1-Oxopropyl)-Maytansine against CD56+ multiple myeloma cells. Cancer Res 2004; 64(13): 4629–4636.
41. Remillard S, Rebhun LI, Howie GA, Kupchan SM. Antimitotic activity of the potent tumor inhibitor maytansine. Science 1975; 189(4207): 1002–1005.
42. Lanier LL, Testi R, Bindl J, Phillips JH. Identity of Leu-19 (CD56) leukocyte differentiation antigen and neural cell adhesion molecule. J Exp Med 1989; 169(6): 2233–2238.
43. Berdeja JG. Lorvotuzumab mertansine: antibody-drug-conjugate for CD56+ multiple myeloma. Front Biosci Landmark Ed. 2014; 19 : 163–170.
44. Sahara N, Takeshita A, Shigeno K, et al. Clinicopathological and prognostic characteristics of CD56-negative multiple myeloma. Br J Haematol 2002; 117(4): 882–885.
45. Chanan-Khan A, Wolf JL, Garcia J, et al. Efficacy analysis from phase I study of lorvotuzumab mertansine (IMGN901), used as monotherapy, in patients with heavily pre-treated CD56-positive multiple myeloma – a preliminary efficacy analysis. ASH Ann Meet Abstr 2010; 116(21): 1962.
46. Berdeja JG, Hernandez-Ilizaliturri F, Chanan-Khan A, et al. Phase I study of lorvotuzumab mertansine (LM, IMGN901) in combination with lenalidomide (Len) and dexamethasone (Dex) in patients with CD56-positive relapsed or relapsed/refractory multiple myeloma (MM). ASH Ann Meet Abstr 2012; 120(21): 728.
47. Hussein M, Berenson JR, Niesvizky R, et al. A phase I multidose study of dacetuzumab (SGN-40; humanized anti-CD40 monoclonal antibody) in patients with multiple myeloma. Haematologica 2010; 95(5): 845–848.
48. Bensinger W, Maziarz RT, Jagannath S, et al. A phase 1 study of lucatumumab, a fully human anti-CD40 antagonist monoclonal antibody administered intravenously to patients with relapsed or refractory multiple myeloma. Br J Haematol 2012; 159(1): 58–66.
49. Singhal S, Mehta J, Desikan R, et al. Antitumor activity of thalidomide in refractory multiple myeloma. N Engl J Med 1999; 341(21): 1565–1571.
50. Richardson PG, Sonneveld P, Schuster MW, et al. Bortezomib or high-dose dexamethasone for relapsed multiple myeloma. N Engl J Med 2005; 352(24): 2487–2498.
51. Siegel DS, Martin T, Wang M, et al. A phase 2 study of single-agent carfilzomib (PX-171-003-A1) in patients with relapsed and refractory multiple myeloma. Blood 2012; 120(14): 2817–2825.
52. Richardson PG, Blood E, Mitsiades CS, et al. A randomized phase 2 study of lenalidomide therapy for patients with relapsed or relapsed and refractory multiple myeloma. Blood 2006; 108(10): 3458–3464.
53. Richardson PG, Siegel DS, Vij R, et al. Pomalidomide alone or in combination with low-dose dexamethasone in relapsed and refractory multiple myeloma: a randomized phase 2 study. Blood 2014; 123(12): 1826–1832.
54. Weber DM, Chen C, Niesvizky R, et al. Lenalidomide plus dexamethasone for relapsed multiple myeloma in North America. N Engl J Med 2007; 357(21): 2133–2142.
55. San Miguel J, Weisel K, Moreau P, et al. Pomalidomide plus low-dose dexamethasone versus high-dose dexamethasone alone for patients with relapsed and refractory multiple myeloma (MM-003): a randomised, open-label, phase 3 trial. Lancet Oncol 2013; 14(11): 1055–1066.
56. Richardson PG, Xie W, Jagannath S, et al. A phase 2 trial of lenalidomide, bortezomib, and dexamethasone in patients with relapsed and relapsed/refractory myeloma. Blood 2014; 123(10): 1461–1469.
57. Wang M, Martin T, Bensinger W, et al. Phase 2 dose-expansion study (PX-171-006) of carfilzomib, lenalidomide, and low-dose dexamethasone in relapsed or progressive multiple myeloma. Blood 2013; 122(18): 3122–3128.
58. Lentzsch S, O’Sullivan A, Kennedy RC, et al. Combination of bendamustine, lenalidomide, and dexamethasone (BLD) in patients with relapsed or refractory multiple myeloma is feasible and highly effective: results of phase 1/2 open-label, dose escalation study. Blood 2012; 119(20): 4608–4613.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2015 Issue 2-
All articles in this issue
- Von Willebrand disease
- Evaluation of bone marrow therapeutic response in patients with high risk myelodysplastic syndrome
- Monoclonal antibodies in the treatment of multiple myeloma
- Advancements in the treatment of adult acute lymphoblastic leukaemia
- The Myelodysplastic Syndrome in Northern and Central Moravia Project
- Quantification of nursing care in haemato-oncology
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Von Willebrand disease
- Monoclonal antibodies in the treatment of multiple myeloma
- Evaluation of bone marrow therapeutic response in patients with high risk myelodysplastic syndrome
- Advancements in the treatment of adult acute lymphoblastic leukaemia
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

