-
Medical journals
- Career
První zkušenosti jednoho centra s použitím přípravku Octaplas® v léčbě pacientky s vrozenou formou trombotické trombocytopenické purpury
: Z. Čermáková 1; Š. Blahutová 2; M. Kořístka 2; R. Hrdličková 2
: Lékařská fakulta Ostravské univerzity 1; Krevní centrum Fakultní nemocnice Ostrava 2
: Transfuze Hematol. dnes,18, 2012, No. 4, p. 162-164.
: Comprehensive Reports, Original Papers, Case Reports
Vrozená forma TTP (Upshaw-Schulmanův syndrom) je závažné, život ohrožující onemocnění, u něhož zůstává lékem první volby léčba plazmou. Pacienti jsou odkázáni na pravidelné transfuze plazmy nebo výměnné plazmaferézy, při nichž jsou opakovaně při výměně 1–1,5 plazmatického volumu vystaveni expozici velkého množství dárcovské karanténní plazmy. U těchto pacientů se po podání plazmy velmi často vyskytují střední až závažné nežádoucí účinky (alergické reakce, transfuzí vyvolané akutní plicní poškození). Autoři sdělují první zkušenosti s podáním přípravku Octaplas® (Octapharma, Vídeň, Rakousko).
Klíčová slova:
trombotická trombocytopenická purpura, Octaplas, výměnná plazmaferézaÚvod
Trombotická trombocytopenická purpura je onemocnění, v jehož patogenezi se uplatňuje snížená aktivita metalloproteázy ADAMTS13 (A Disintegrin and Metalloprotease with ThromboSpondin type 1 motif 13), která je zodpovědná za štěpení ultravelkých multimerů von Willebrandova faktoru. Vrozená forma TTP (Upshaw – Schulmanův syndrom) patří mezi vzácně se vyskytující formy TTP, u níž je deficit ADAMTS13 podmíněn geneticky. Snížená aktivita ADAMTS13 (u vrozených forem < 5 %) vede k trombocytopenii, mikroangiopatické hemolytické anémii (MAHA) a mikrovaskulárním trombózám. Pacienti s vrozenou formou TTP jsou odkázáni na léčbu plazmou (transfuze plazmy v dávce 15–30 ml/kg či na výměnné léčebné plazmaferézy), při níž je dodávána chybějící metalloproteáza a odstraňovány degradační produkty (1, 2, 3). Léčba plazmou však není bez komplikací – mezi nežádoucí účinky podání karanténní plazmy patří alergické reakce, transfuzí vyvolané akutní plicní poškození, krví přenosné infekce a další (4, 5) (tab. 1). Jednou z možností, která eliminuje nežádoucí účinky léčby plazmou je náhrada plazmy přípravkem Octaplas® (Octapharma, Vídeň, Rakousko). Octaplas® je plazma ošetřená solvent-detergentem, směsná patogenně inaktivovaná. Hladina faktorů vč. aktivity ADAMTS13 je shodná s obsahem faktorů v karanténní plazmě (6). Nižší hladina proteinu S a alfa (2)–antiplazminu může být limitujícím faktorem podání přípravku u pacientů s jaterním onemocněním a těžkým defektem proteinu S (7); podle jiných autorů však pokles není statisticky významný a mnohé studie ukazují na dostatečný hemostatický efekt přípravku (8, 9). Octaplas® je podáván ve shodě s AB0 kompatibilitou, exspirační doba je při teplotě -18 °C čtyři roky. Poolování jednotlivých dárcovských jednotek plazmy vede k neutralizaci protilátek a alergenů v plazmě, dále významnému snížení výskytu TRALI a závažných alergických reakcí (10). Mnohé klinické studie potvrzují efektivní využití Octaplasu® v léčbě pacientů s TTP (11, 12). V zemích jako je Irsko, Norsko, Holandsko a Rakousko je SD-plazma využívaná jako léčba první volby u pacientů s TTP (13).
1. Komplikace léčby plazmou (14). 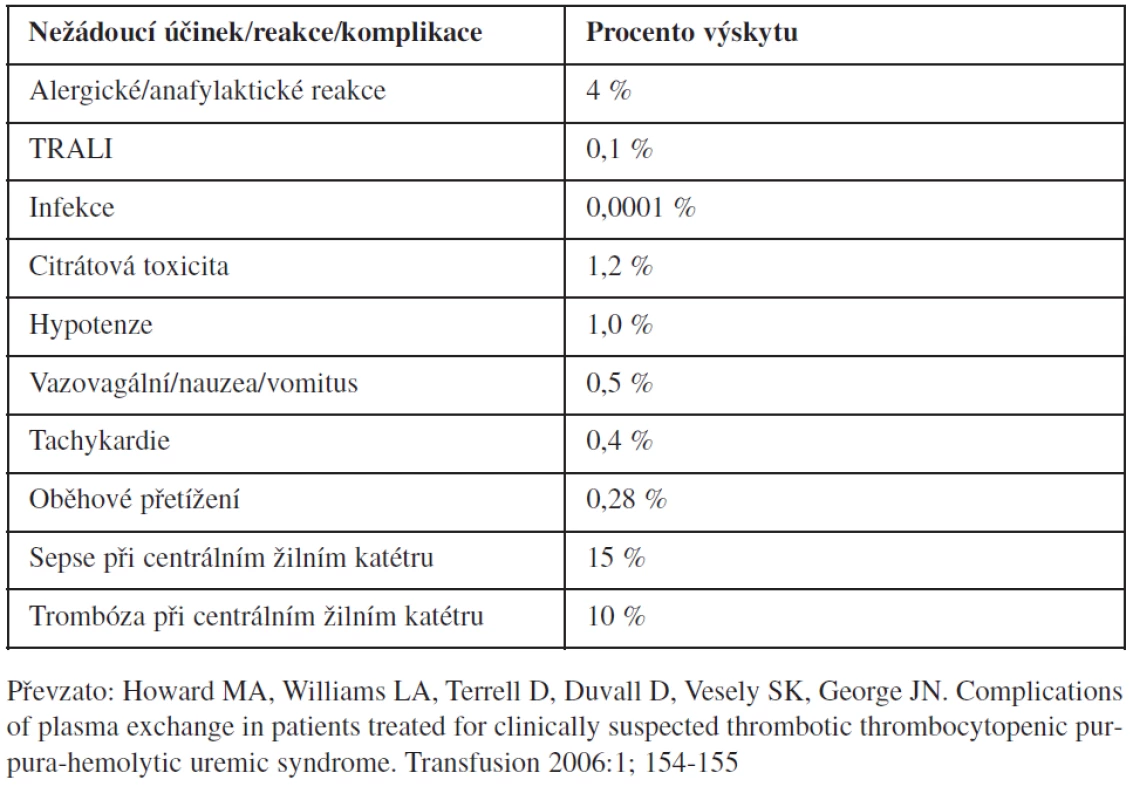
Pacienti
V Krevním centru FN Ostrava je v péči šest pacientů s vrozenou formou TTP, kteří jsou léčeni plazmou či léčebnými plazmaferézami v empiricky získaných intervalech (15, 16). Všichni pacienti mají lehké / střední / těžké alergické reakce přes medikaci antihistaminiky a kortikoidy. Od června roku 2012 jsme přistoupili u pacientky, jejíž alergické reakce po plazmě byly střední až těžké, k náhradě karanténní plazmy přípravkem Octaplas® (tab. 2).
2. Srovnání TPE při substituci plazmou a přípravkem Octaplas<sup>®</sup> u jedné pacientky s vrozenou formou TTP. 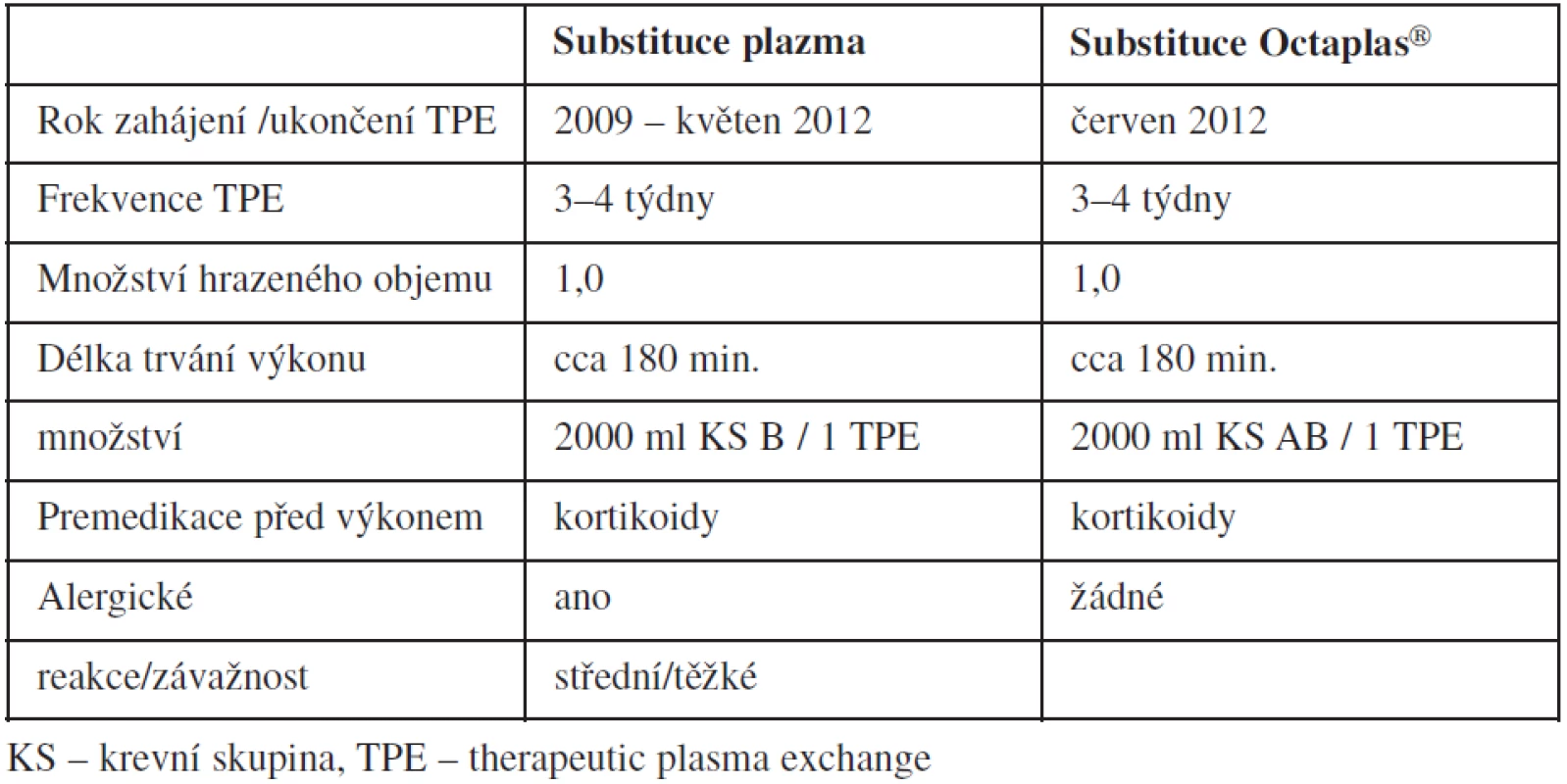
Z anamnézy: pacientka – žena, narozena v r. 1994, s relabující formou TTP, prokázána mutace v genu pro ADAMTS 13 v heterozygotní formě (InsA4143ex29/ InsA4143ex13). Od 5 let sledována pro atypický HUS, docházela k pravidelné aplikaci K-plazmy. Na podzim roku 2009 došlo k závažnému relapsu onemocnění s renálním selháním; pacientka byla opakovaně hemodialyzována. Od tohoto roku dochází pacientka pravidelně ve 3–4týdenních intervalech na výměnné plazmaferézy. V rámci výměnné léčebné plazmaferézy je pacientce aplikováno cca 2000 ml plazmy krevní skupiny B nebo AB. Přes premedikaci kortikoidy (SoluMedrol 40 mg ve 100 ml fyziologického roztoku před výkonem) je každá plazmaferéza komplikována středně těžkými až těžkými alergickými reakcemi. Klinický a laboratorní efekt plazmaferéz je velmi dobrý; počet relapsů je minimální (1/rok). Vzhledem k velmi dobrému klinickému i laboratornímu efektu výměnných léčebných plazmaferéz byla u této pacientky od června letošního roku nahrazena karanténní plazma přípravkem Octaplas®. Do října letošního roku bylo provedeno celkem šest léčebných plazmaferéz, během nichž bylo podáno celkem 12 000 ml přípravku Octaplas® skupiny AB. Výměnné léčebné plazmaferézy proběhly ve stejném režimu jako při použití karanténní plazmy. Během šesti TPE nedošlo k výskytu žádné formy alergické reakce.
Diskuse
Octaplas® je přípravek, jehož indikační spektrum je shodné s karanténní plazmou. Oproti karanténní plazmě má výhodu v patogenní inaktivaci, v dosud nehlášeném výskytu TRALI po jeho podání a ve sníženém riziku těžkých alergických reakcí (17, 18). Alergické reakce jsou přitom nejčastější nežádoucí reakcí po aplikaci transfuzních přípravků, což potvrzují data zahraničních autorů (19, 20). Použití přípravku u pacientů opakovaně exponovaných velkými objemy plazmy by mohlo vést ke sníženému výskytu těžkých alergických reakcí a ke snížení dalších nežádoucích reakcí po podání plazmy (21). Limitujícím kritériem pro plošné rozšíření přípravku Octaplas® v České republice u indikovaných pacientů jsou pravděpodobně vyšší nároky na logistiku a také cena přípravku.
Závěr
První zkušenosti s podáním přípravku Octaplas® u pacientky s vrozenou formou TTP autoři hodnotí pozitivně, i když si jsou vědomi toho, že dosavadní kladné zkušenosti jsou limitovány zatím malým počtem podání. Octaplas® bude postupně zařazen jako náhrada karanténní plazmy u všech pacientů s vrozenou formou TTP, kteří jsou dispenzarizováni a léčeni v Krevním centru FN Ostrava.
Podíl autorů na rukopisu
ČZ – příprava a napsání rukopisu; BŠ – léčba nemocných ; KM – provádění vyšetření; HR – kontrola a revize rukopisu
MUDr. Zuzana Čermáková, Ph.D.
Lékařská fakulta Ostravské univerzity a Krevní centrum Fakultní nemocnice Ostrava
17. listopadu 1790
708 52 Ostrava-Poruba
zuzana.cermakova@fno.cz
Doručeno do redakce: 21. 9. 2012
Přijato po recenzi: 2. 11. 2012
Sources
1. Zheng LX, Kaufman RM, Goodnough LT, Sadler JE. Effect of plasma exchange on plasma ADAMTS13 metalloprotease activity, inhibitory level, and clinical outcome in patients with idiopathic and nonidiopathic thrombotic thrombocytopenic purpura. Blood 2004; 11 : 4043-4049.
2. Kremer-Hovinga JA, Meyer S. Current management of thrombotic thrombocytopenic purpura. Curr Opin Hematol 2008; 15 : 445-450.
3. Vesely SK, George JN, Lämmle B, Studt JD, Alberio L, El-Harake MA, Raskob GE. ADAMTS13 activity in thrombotic thrombocytopenic purpura-hemolytic uremic syndrome: relation to presenting features and clinical outcomes in a prospective cohort of 142 patients. Blood 2003; 102 : 60-68.
4. Howard MA, Williams LA, Terrell D, Duvall D, Vesely SK, George JN. Complications of plasma exchange in patients treated for clinically suspected thrombotic thrombocytopenic purpura-hemolytic uremic syndrome. Transfusion 2006; 1 : 154-155.
5. Rizvi MA, Vesely SK, George JN, Chandler L, Duvall D, Smith JW, Gilcher RO. Complications of plasma exchange in 71 consecutive patients treated for clinically suspected thrombotic thrombocytopenic purpura-hemolytic-uremic syndrome. Transfusion 2000; 40 : 896-901.
6. Kannicht C, Römisch J, Svae TE. Normal levels of ADAMTS13 and factor H are present in the pharmaceutically licenced plasma for transfusion (Octaplas®) and in the universally applicable plasma (Uniplas) in development. Vox Sang 2007; 92 : 206-212.
7. Doyle S, O’Brien P, Murény K, Fleming C, O’Donnell J. Coagulation factor content of solvent/detergent plasma compared with fresh frozen plasma. Blood Coag and Fibrinolysis 2003; 14 : 283-287.
8. Yarranton H, Lawrie AS, Purdy G, et al. Comparison of von Willebrand factor antigen, von Willebrand factor-cleaving protease and protein S in blood components used for treatment of thrombotic thrombocytopenic purpura. Transfus Med 2004; 14 : 39-44.
9. Beck KH, Mortelmans Y, Kretschmer V, Höltermann W, Lukasewitz P. Comparison of solvent/detergent-inactivated plasma and fresh frozen plasma under routine clinical conditions. Infus Ther Transfus Med 2000; 27 : 144-148.
10. Yarranton H, Cohen H, Pavord SR, Benjamin S, Hagger D, Machin SJ. Venous thromboembolism associated with the management of acute thrombotic thrombocytopenic purpura. Br J Haematol 2003; 121 : 778-785.
11. Mintz PD, Neff A, MacKenzie M, et al. Therapeutic plasma exchange (TPE) for thrombotic thrombocytopenic purpura (TTP) using plasma prepared with photochemical treatment (INTERCEPT Plasma). ASH Annual Meeting Abstracts 2004; 104 : 838.
12. Hellstern P. Fresh-frozen plasma, pathogen – reduced single-donor plasma or bio-pharmaceutical plasma? Transf and Aph Sci 2008; 39 : 69-74.
13. Pereira A. Efficacy of different plasma sources in treatment of thrombotic thrombocytopenic purpura. Vox Sang 2009; 4 : 111-117. ISBT Science Series (2009).
14. Howard MA, Williams LA, Terrell D, et al. Complications of plasma exchange in patients treated for clinically suspected thrombotic thrombocytopenic purpura-hemolytic uremic syndrome. Transfusion 2006; 1 : 154-155.
15. Čermáková Z, Hrdličková R, Šuláková T, Kořístka M, Kovářová P, Hrachovinová I. Thrombotic thrombocytopenic purpura: incidence of congenital form of disease in North Moravia (Region Moravia-Silesia). Prague Med Rep 2009; 110 : 239-244.
16. Čermáková Z, Kořístka M, Kořístková B, et al. Možnosti léčby plazmou u pacientů s hereditární formou trombotické trombocytopenické purpury. Čas Lék Čes 2009; 10 : 493-496.
17. Sinnott P, Bodger S, Gupta A, Brophyt M. Presence of HLA antibodies in single-donor-derived fresh frozen plasma compared with pooled, solvent detergent-treated plasma (Octaplas). Eur J Immunogenet 2004; 3 : 271-274.
18. Dachs U, Kauschat D, Bein G. White blood cell-reactive antibodies are undetectable in solvent/detergent plasma. Transfusion 2005; 45 : 1628-1631.
19. Heiden M, Paul Erlich Institute. Severe Transfusion Reaction. Pathogen Inactivation Consensus Conference; Toronto 29th March 2007.
20. De Vries RR., Faber JC., Strengers PF. Haemovigilance: an effective tool for improving transfusion practice. Vox Sang 2011; 100 : 60-67.
21. Scully M, Longair I, Flynn M, Berryman J and Machin SJ. Cryosupernatant and solvent detergent fresh-frozen plasma (Octaplas®) usage at a single centre in acute thrombotic thrombocytopenic purpura. Vox Sang 2007; 93 : 154-158.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2012 Issue 4-
All articles in this issue
- New findings in the pathogenesis of two myelodysplastic syndrome subtypes: 5q- syndrome and sideroblastic anaemia, partially relevant for other onco-haematological diseases
- První zkušenosti jednoho centra s použitím přípravku Octaplas® v léčbě pacientky s vrozenou formou trombotické trombocytopenické purpury
- Zajištění operačních výkonů u pacientů s von Willebrandovou chorobou preparátem Wilate® – první klinické zkušenosti jednoho centra v ČR
- The use of natural colloids in fluid resuscitation of severely burned patients
- Supportive therapy with megestrol acetate in myeloproliferative neoplasms
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- První zkušenosti jednoho centra s použitím přípravku Octaplas® v léčbě pacientky s vrozenou formou trombotické trombocytopenické purpury
- Zajištění operačních výkonů u pacientů s von Willebrandovou chorobou preparátem Wilate® – první klinické zkušenosti jednoho centra v ČR
- Supportive therapy with megestrol acetate in myeloproliferative neoplasms
- The use of natural colloids in fluid resuscitation of severely burned patients
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

