-
Medical journals
- Career
Pozitronová emisní tomografie a integrovaná pozitronová emisní tomografie s počítačovou tomografií ve stážování a hodnocení léčebné odpovědi u ne-hodgkinských lymfomů. Část II.: Hodnocení léčebné odpovědi
Authors: T. Papajík 1; M. Mysliveček 2; E. Buriánková 2; M. Skopalová 3; A. Malán 4; V. Koza 5; H. Mociková 6; M. Trněný 6; P. Koranda 2; K. Indrák 1
Authors‘ workplace: Hemato-onkologická klinika FNO a LF UP v Olomouci 1; Klinika nukleární medicíny FNOL a LF UP v Olomouci 2; PET centrum Nemocnice na Homolce 3; Oddělení nukleární medicíny FN Plzeň 4; Hematologicko-onkologické oddělení FN Plzeň 5; I. interní klinika VFN Praha 6
Published in: Transfuze Hematol. dnes,15, 2009, No. 3, p. 158-168.
Category: Comprehensive Reports, Original Papers, Case Reports
Overview
Pozitronová emisní tomografie (PET) s použitím 2-[fluorin-18] fluoro-2-deoxy-D-glukózy (18F-FDG) a kombinovaná 18F-FDG PET s výpočetní tomografií (CT) představují velmi slibnou zobrazovací metodu u nemocných s maligními lymfomy. Obě metody prokázaly svůj přínos při stanovení léčebné odpovědi u ne-hodgkinských lymfomů (NHL), zvláště pak u difuzního B-velkobuněčného lymfomu (DLBCL). 18F-FDG PET a 18F-FDG PET/CT výrazně zvyšují senzitivitu a specificitu zobrazovacích možností při hodnocení léčebné odpovědi NHL ve srovnání s CT a výsledky 18F-FDG PET vyšetření byly zahrnuty do revidovaných kritérií léčebné odpovědi u maligních lymfomů. Nezávislá prognostická výpovědní hodnota časného 18F-FDG PET vyšetření v průběhu léčby byla jednoznačně prokázána u DLBCL a v blízké budoucnosti by výsledky časného 18F-FDG PET mohly sloužit jako standardní vodítko při intenzifikaci terapie u rizikových PET-pozitivních nemocných. Definitivní role a prognostický význam 18F-FDG PET v hodnocení odpovědi na terapii u jiných typů NHL zůstává nedořešena. Na druhé straně řada procesů nenádorové etiologie (záněty infekční a neinfekční povahy, sarkoidóza, tuberkulóza, tkáňové reparační změny a další) může být zdrojem „falešně“ pozitivních nálezů při 18F-FDG PET zobrazení. Integrovaný PET/CT systém může řadu těchto nálezů blíže identifikovat a tím významně zvýšit specificitu vyšetření.
Klíčová slova:
18F-FDG PET, PET/CT, lymfom, léčebná odpověďÚvod
Moderní metody chemoterapie a zařazení monoklonálních protilátek do standardní léčby ne-hodgkinských lymfomů (NHL) znamenaly výrazné zlepšení prognózy u většiny nemocných. Díky standardnímu podávání imunochemoterapie došlo k významnému nárůstu kompletních remisí lymfomu (CR), prodloužilo se jejich trvání a významně vyšší počet nemocných dlouhodobě přežívá bez známek návratu onemocnění. Navození CR vede k významnému prodloužení období bez návratu choroby (DFS), zatímco remise částečná (PR) je spojena s výrazně horším celkovým přežitím (1, 2, 3).
Konvenční definice léčebné odpovědi
V literatuře se v průběhu posledních 30 let spolu s vývojem zobrazovacích a laboratorních metod objevila řada kritérií, která byla použita pro definici léčebné odpovědi u nemocných s lymfomy. Postupně se harmonizovaly názory na definici CR, PR, stabilní choroby (SD) a progredující choroby (PD), byla snaha definovat relaps či progresi choroby, resp. různé intervaly přežití. Protože se řada definic navzájem lišila, což činilo problém zejména v porovnání výsledku kontrolovaných klinických studií, ustanovila skupina klinických pracovníků z různých zemí pod patronací amerického Národního ústavu pro nádory (NCI) pracovní skupinu, která měla za úkol jednotlivá kritéria sjednotit a vytvořit tak určitý mezinárodně akceptovatelný standard. Skupina po usilovném studiu dostupných pramenů publikovala svá doporučení v roce 1999 (4). Tehdy publikovanou definici léčebné odpovědi, založenou na syntéze klinických dat, histopatologického vyšetření tkáně (kostní dřeň, aj.) a zejména na výsledcích CT vyšetření přehledně uvádí tabulka 1.
Table 1. Konvenční kritéria hodnocení léčebné odpovědi (Cheson B.D., a kol., 1999). 
Problematika zbytkové tkáně
Hlavním problémem pro jednoznačnou interpretaci léčebné odpovědi byla přítomnost zbytkové tkáně po chemoterapii, jenž však v mnoha případech nemusí nutně znamenat přetrvávání onemocnění. Řada studií prokázala, že až 50 % nemocných s agresivními NHL má na CT snímcích po terapii perzistující tkáň v místě původního postižení, i když všechny ostatní klinické a laboratorní známky onemocnění vymizely (4, 5). Po úspěšné léčbě se totiž uzliny infiltrované lymfomem výrazně zmenší, i když fibrotické, nekrotické nebo zánětlivé změny v nich mohou způsobovat jejich přetrvávající zvětšení. Dále může být velmi těžké interpretovat odpověď v oblasti původního paketu uzlin, který se po léčbě rozdělil na menší zbytkové uzliny. Konvenční zobrazovací metody tak nedokážou jednoznačně odlišit mezi aktivním nádorem a fibrózou či nekrózou. Pro tuto situaci byl proto v původních hodnotících kritériích léčebné odpovědi z roku 1999 zvolen termín nepotvrzená kompletní remise (CRu). Ten popisuje situaci, kdy se nádor zmenšil o více jak 75 % a zároveň je pacient bez jiných známek onemocnění (4). Z těchto nemocných jen asi 25 % má ve zbytkové mase přítomny nádorové buňky a dříve nebo později jejich onemocnění zrelabuje. Identifikace takovýchto rizikových nemocných byla v minulosti velmi obtížná. Invazivní metody (biopsie) mohou být zatíženy značným rizikem komplikací výkonu, protože zbytková tkáň je ve většině případů orientována nitrohrudně, nitrobřišně nebo retroperitoneálně. Z neinvazivních metod přicházelo v úvahu scintigrafické vyšetření pomocí radiofarmaka 67Ga-citrátu, jež však bylo limitováno poměrně nízkou citlivostí, fyziologickou distribucí izotopu v zažívacím systému a močových cestách, která znesnadňovala interpretaci nálezů v této oblasti, a dalšími technickým problémy metody (6, 7). První výsledky klinického testování pozitronové emisní tomografie (PET) s použitím fluoru - 2-[fluorin-18] fluoro-2-deoxy-D-glukózy (18F-FDG) naznačily, že by tato metoda mohla zmíněné problémy překonat a s vysokou pravděpodobností určit, zda je nemocný v CR choroby či u něj zůstává zbytková PET-pozitivní viabilní nádorová tkáň (8, 9). U řady pacientů s pozitivním nálezem pak mohou být použity další léčebné metody (radioimunoterapie, záchranná terapie, transplantace kmenových buněk), které povedou k usmrcení nádorových buněk a dosažení CR choroby s předpokladem jejího dlouhodobého trvání.
Pilotní hodnocení významu 18F-FDG-PET vyšetření při stanovení léčebné odpovědi
Na konci minulého a v prvních letech 21. století začalo přibývat dat, která ukazovala na přínos 18F-FDG-PET vyšetření při hodnocení léčebné odpovědi u maligních lymfomů. Cremerius a kolegové v retrospektivní práci porovnali přínos 18F-FDG-PET vyšetření k detekci viabilní nádorové tkáně po chemoterapii u nemocných s nízce i vysoce maligními lymfomy (10). Výsledky 18F-FDG-PET srovnávali s CT nálezy a výsledky biopsií zbylé tkáně. Autoři potvrdili, že 18F-FDG-PET vyšetření má vyšší specificitu (92 % vs 17 %), přesnost (96 % vs 63 %) a pozitivní prediktivní hodnotu (94 % vs 60 %) než klasické CT vyšetření. Podobně i Mikhaeel s kolegy v roce 2000 popsali význam pozitivní a negativní prediktivní hodnoty 18F-FDG-PET vyšetření po ukončení terapie agresivních NHL (11). Všichni nemocní s pozitivním 18F-FDG-PET nálezem zrelabovali, zatímco ze skupiny nemocných s negativním výsledkem vyšetření po ukončení léčby zrelabovalo jen 17 % jedinců. Při hodnocení CT nálezů v identické skupině pacientů zjistili, že při pozitivním CT nálezu choroba zrelabovala u 41 % z nich a při negativním CT nálezu u 25 %. Přežití bez progrese choroby bylo v 1 roce od stanovení odpovědi 0 % pro 18F-FDG-PET pozitivní nemocné, zatímco bez progrese choroby žilo celých 83 % 18F-FDG-PET negativních nemocných. Tato data potvrdila Spaepenová, když referovala, že ze 67 pacientů s 18F-FDG-PET negativním skenem zůstalo v CR 80 % se střední dobou sledování 730 dní (9). Medián času do relapsu u zbývajících 20 % byl 316 dní. Z 29 pozitivní pacientů všichni zrelabovali s mediánem intervalu bez návratu choroby pouhých 105 dní.
Juweid spolu s Chesonem a kolegy porovnali a zkombinovali konvenční kritéria léčebné odpovědi (založené na CT skenech) s výsledky 18F-FDG-PET vyšetření po ukončení léčby u nemocných s agresivními lymfomy (12). Autorský tým jednoznačně dospěl k závěru, že kombinované posouzení léčebné odpovědi (kombinace údajů z CT a PET obrazů) a zejména hodnocení pomocí 18F-FDG-PET má lepší výpovědní hodnotu z hlediska přežití bez progrese choroby než hodnocení konvenční (založené na CT) a v budoucnu by tudíž mělo mít před konvenční metodou přednost. K velmi podobným závěrům dospěl v tomtéž roce i autorský tým kolem Reinhardta (do analýzy zahrnul i pacienty s Hodgkinovým lymfomem), který rovněž použil pro predikci léčebné odpovědi údaje získané 18F-FDG-PET i CT vyšetřením (13). Obě práce potvrdily, že nemocní v PET-negativní remisi bez ohledu na to, zda při CT dosáhli CR či PR mají stejnou naději na 3leté přežití bez progrese choroby (PFS 80 %, resp. 100 %) a Reinhardt zdokumentoval, že i nemocní bez léčebné odpovědi (ve fázi stabilní choroby, SD) s PET-negativními snímky mají poměrně dobrý prognostický výhled (3leté PFS 81 %). Naproti tomu naprostá většina pacientů s PET-pozitivním nálezem po léčbě (PR a SD) do 3 let progreduje a jejich celková prognóza je špatná (PFS 42 % a 17 %, resp. 0 % a 20 %). V ČR jako první referovali o významu PET vyšetření u nemocných s DLBCL Trněný a Bělohlávek a na vlastním souboru pacientů potvrdili význam dosažení PET-negativní léčebné odpovědi (14).
Revidovaná kritéria léčebné odpovědi u maligních lymfomů
S přihlédnutím k těmto důkazům standardizovala v roce 2007 mezinárodní skupina odborníků kritéria použití 18F-FDG-PET vyšetření v hodnocení léčebné odpovědi u lymfomů a na jejich základě vypracoval autorský tým „Revidovaná kritéria léčebné odpovědi u maligních lymfomů“ (15, 16). Kritéria přehledně uvádíme v tabulce (tab. 2). Práce také hovoří o tom, u kterých podtypů a v jakých situacích je 18F-FDG-PET vyšetření přínosné, i když toto stanovisko skupiny odborníků je dnes již v řadě bodů překonané, resp. názory na jeho použití se dnes velmi dynamicky vyvíjí a upřesňují. Je však nutné zdůraznit, že autoři se vyjadřují k tomu, jak a kdy použít 18F-FDG-PET v klinických studiích a nehovoří o tom, co považují za správnou klinickou praxi. Ta se může lišit podle dostupnosti přístrojového vybavení a podle ochoty plátců péče zahrnout toto vyšetření do diagnostických standardů v jednotlivých zemích. Odborníci se také shodli na tom, že pro hodnocení pozitivity vyšetření stačí vizuální posouzení a srovnání aktivity hodnocené tkáně s intenzitou cévních struktur mediastina. Z hlediska možných reparativních a zánětlivých změn po chemoterapii nebo radioterapii doporučují autoři načasovat 18F-FDG-PET vyšetření nejméně za 3 týdny po ukončení chemoterapie, resp. 2–3 měsíce po ukončení radioterapie. Obě práce dále uvádějí řadu dalších pokynů, jak hodnotit sporné nálezy na plicích, slezině, játrech, resp. jak postupovat při hodnocení nálezů aktivity v kostní dřeni. Výčet těchto doporučení překračuje rámec našeho shrnutí a proto odkazujeme na podrobné studium zdrojových pramenů (15, 16).
Table 2. Revidovaná kritéria hodnocení léčebné odpovědi (Cheson B.D., a kol., 2007). 
Význam 18F-FDG-PET vyšetření pro stanovení léčebné odpovědi a prognózy jednotlivých skupin NHL
Prvotní studie hodnotící význam 18F-FDG-PET pro přesné stanovení odpovědi na léčbu a prognózu nemocných uvedené výše pracovaly vesměs s nemocnými s agresivními lymfomy. Naprostou většinu z těchto případů tvořili pacienti s difuzními B-velkobuněčnými lymfomy (DLBCL). Studie, které byly u agresivních lymfomů publikovány se staly zdrojem dat pro velká systematická shrnutí. Reske již v roce 2003 shrnul data 15 prací, kde senzitivita 18F-FDG-PET vyšetření pro detekci aktivní nádorové tkáně dosahovala 71–100 % a specificita 69–100 % (17). Vyšetření vykazovalo velmi slibnou negativní prediktivní hodnotu (80–100 %), na druhé straně drtivá většina nemocných s PET-pozitivním nálezem ve zbytkové tkáni dříve či později se svou chorobou progredovala. Analýza holandských autorů potvrdila rovněž poměrně vysokou 72 % senzitivitu a 100 % specificitu 18F-FDG-PET vyšetření po proběhlé terapii u NHL (18). U nemocných, u nichž byl nález po terapii pozitivní, existovala 97 % pravděpodobnost přítomnosti viabilních nádorových buněk v zobrazené tkáni. A naopak u PET-negativních nálezů dosahovala pravděpodobnost perzistence nádorových buněk v tkáni u 22 % případů. Autoři však narazili na řadu metodických potíží a možných rozdílů v kvalitě zdrojových dat, a proto sami upozornili na limitace svých závěrů a na nutnost budoucí standardizace v interpretaci 18F-FDG-PET vyšetření. O podobné systematické zhodnocení významu 18F-FDG-PET vyšetření u maligních lymfomů se pokusili japonští výzkumníci (19). Ve své práci zjistili poměrně širokou variabilitu senzitivity (33–77 %) a specificity (82–100 %) pro agresivní NHL a významnou limitaci kvality dat u této skupiny diagnóz. Autoři navrhli přesněji zhodnotit význam a citlivost metody v hodnocení léčebné odpovědi u agresivních NHL v prospektivně vedených studiích s jednoznačně volenou metodikou a interpretací PET nálezů.
Zajímavé nálezy u mediastinálních lymfomů publikoval kolektiv italských hematologů (20). Autoři prospektivně sledovali 151 pacientů s mediastinálními NHL a Hodgkinovým lymfomem. U 30 pacientů vyslovili dle pozitivního výsledku 18F-FDG-PET vyšetření podezření na relaps choroby. U všech nemocných byl proveden odběr tkáně, ale jen u 17 z 30 nemocných (57 %) byl histologicky potvrzen relaps choroby. U ostatních pacientů vzorek tkáně vykazoval přítomnost fibrózy, granulomatózy, u 1 nemocného byl diagnostikován thymom. Tato práce dokládá nutnost biopticky, resp. histologicky verifikovat podezřelou tkáň před zahájením nové protinádorové léčby. Relativně vysokou incidenci nespecificky pozitivních PET snímků po léčbě rituximabem a chemoterapií prokázal Han se spolupracovníky (21). Také oni potvrdili, že řadu PET-pozitivních nálezů je nutné biopticky ověřit, protože u některých nemocných je PET-pozitivita spojena se zánětlivými změnami a nádorové buňky se ve zkoumané tkáni nevyskytují. Pozitivní prediktivní hodnota 18F-FDG-PET vyšetření po ukončení terapie byla 71,4 %, negativní prediktivní hodnota 79,2 %, senzitivita však jen 50 % a specificita 90,4 %. Možnosti konsolidační léčby radioterapií u PET-pozitivních nálezů reziduálních mas zhodnotila práce Kahna a spolupracovníků (22). Výsledky jejich analýzy nebyly příliš optimistické a autoři konstatovali, že i přes radioterapii na PET-pozitivní zbytkovou tkáň lymfomu zrelabovalo nebo progredovalo 12 z 19 (63,2 %) léčených. U dále neléčených PET-pozitivních případů byl počet relapsů/progresí srovnatelný–58 % (7 z 12), zatímco u neléčených PET-negativních choroba zrelabovala u 20 % pacientů. U PET-negativních nemocných byla konsolidační radioterapie indikována u 16 případů, jen u 1 nemocného (6,2 %) lymfom zrelaboval. Samotná radioterapie tedy nepředstavuje u PET-pozitivních nemocných účinnou léčebnou možnost a proto je nutné u této skupiny nemocných uvažovat o záchranné či vysocedávkované chemoterapii. Významu 18F-FDG-PET vyšetření před a po vysoce dávkované chemoterapii s autologní transplantací kmenových buněk se věnovala již řada studií (23, 24, 25, 26). Všechny studie konstatovaly, že nemocní, kteří dosáhnou PET-negativního stavu před autologní transplantací (po 2–3 cyklech záchranné terapie), mají významně nižší riziko relapsu a vyšší pravděpodobnost přežití než pacienti, jež zůstávají PET-pozitivní. Výsledek 18F-FDG-PET vyšetření před transplantací byl v multivariantní analýze vyhodnocen jako nezávislý prognostický faktor přežití nemocných (26).
Postavení 18F-FDG-PET v hodnocení léčebné odpovědi a jeho prediktivní význam je u agresivních lymfomů ze značné části vyjasněn. Nepřehledná zůstává situace u jiných histologických podtypů NHL. Z publikovaných prací je zřejmé, že 18F-FDG-PET vyšetření dokáže velmi spolehlivě detekovat zbytková ložiska aktivní lymfomové tkáně po terapii u folikulárních lymfomů (FL), lymfomů z plášťových buněk (MCL) nebo periferních T-buněčných lymfomů (PTCL) (27, 28, 29, 30, 31, 32). Většina analýz potvrdila u FL, MCL i PTCL významně nižší riziko relapsu/progrese lymfomu v případě 18F-FDG-PET negativní remise choroby, na druhé straně však zatím nebyly předloženy důkazy o tom, že by hodnocení léčebné odpovědi pomocí PET znamenalo zásadní pokrok oproti standardním vyšetřovacím metodám (klinické a laboratorní vyšetření, CT, biopsie kostní dřeně). Žádná z prací navíc neprokázala, že by dosažení 18F-FDG-PET negativity po iniciální léčbě bylo spojeno se zlepšením celkového přežití pacientů nebo že by negativní výsledek tohoto vyšetření byl nezávislým prognostickým faktorem, tak jako je tomu u DLBCL nebo HL.
Časné hodnocení léčebné odpovědi u NHL
Brzy po průkazu přínosu 18F-FDG-PET vyšetření ve stážování a hodnocení léčebné odpovědi u agresivních lymfomů byla řadou výzkumných týmů nastolena otázka, zda tato metoda může pomoci stanovit citlivost lymfomu k podané léčbě a předpovědět již v průběhu terapie šanci nemocného na dlouhodobé přežití. S položenou otázkou těsně souvisela další hypotéza, která vyslovila naději na to, že při nedostatečné odpovědi na podávanou léčbu bude možné na základě výsledku 18F-FDG-PET terapii intenzifikovat, překonat chemorezistenci lymfomových buněk a zlepšit vyhlídky pacienta na dosažení CR choroby a dlouhodobého OS.
Römer s kolegy již v roce 1998 pozoroval, že optimální hodnocení časné léčebné odpovědi u agresivních NHL pomocí 18F-FDG-PET je dobré provádět 42 dní po započetí terapie, kdy redukce lymfomu dosahuje u chemosenzitivních pacientů maximálních hodnot (33). Vyšetření provedené v tomto období (v praxi po 2. cyklu terapie) dokáže velmi citlivě odlišit nemocné s nadějí na dosažení dlouhodobě trvající CR onemocnění od těch, kteří CR nedosáhnou nebo po jejím dosažení brzy zrelabují a mají nízkou pravděpodobnost vyléčení. Jerusalem a po něm Kostakoglu i Spaepenová brzy jeho data potvrdili a v jejich souborech pacientů léčených pro agresivní lymfomy byl výsledek časného 18F-FDG-PET vyšetření statisticky významně spojen s prognózou nemocných (34, 35, 36). V první práci Jerusalem zjistil, že nemocní s pozitivním nálezem na časném 18F-FDG-PET mají 2leté PFS 0 %, kdežto nemocní s negativním nálezem 62 % (p = 0,0001). Podobný rozdíl byl nalezen i pro 2leté OS–0 % pro PET-pozitivní vs 68 % pro PET-negativní jedince (p < 0,0001) (34). Kostakoglu a kolegové dokumentovali, že 18měsíční PFS bylo u PET-pozitivních nemocných jen 10 %, kdežto ti, jež měli časné 18F-FDG-PET vyšetření s negativním nálezem přežívali bez progrese choroby v 75 % případů (p < 0,001) (35). Spaepenová zhodnotila nálezy časného 18F-FDG-PET vyšetření u 70 agresivních lymfomů primárně léčených antracyklinovým režimem. U žádného ze 33 pacientů, kteří měli časný PET-pozitivní nález, nebylo dosaženo déletrvající CR choroby, kdežto na druhé straně jen 6 ze 37 PET-negativních pacientů dosáhlo na konci léčby PR nebo zrelabovalo (36). Výsledek časného 18F-FDG-PET vyšetření statisticky významně koreloval jak s PFS, tak i s OS a v multivariantní analýze měl k přežití nemocných silnější vazbu než hodnota mezinárodního prognostického indexu (IPI). Francouzští autoři kolem Haiounové zhodnotili výsledky časného 18FDG-PET vyšetření na souboru 90 nemocných léčených antracyklinovým režimem, u 41 % z nich byl v léčbě použit rituximab (37). Po 2 cyklech terapie byl výsledek časného 18F-FDG-PET negativní u 54 pacientů (60 %), zatímco u zbývajících 36 (40 %) byly nálezy pozitivní. Po skončení indukční chemoterapie 45 z 54 nemocných (83 %) s negativním výsledkem časného 18F-FDG-PET dosáhlo CR nebo nepotvrzené CR hodnocené konvenčními kritérii. Ze skupiny s pozitivním časným 18F-FDG-PET vyšetřením dosáhlo CR a nepotvrzené CR 21 pacientů (58 %). 18F-FDG-PET hodnocení po skončení indukční terapie bylo dostupné u 80 nemocných. 60 z nich (75 %) mělo negativní výsledek 18F-FDG-PET, 13 z nich patřilo do skupiny s pozitivním časným 18F-FDG-PET. Žádný z pacientů, kteří měli negativní časný 18F-FDG-PET neměl prokázán pozitivní nález po skončení indukční terapie. Pravděpodobnost 2letého přežití bez nežádoucí události (EFS) byla 82 % u nemocných s negativním časným 18F-FDG-PET, u nemocných s pozitivním časným vyšetřením to bylo jen 43 % (p = 0,001). OS ve 2 letech se také statisticky významně lišilo–90 % pro skupinu s negativním časným 18F-FDG-PET a 61 % pro nemocné s pozitivním výsledkem (p = 0,006). Prognostický význam vzhledem k EFS si časné 18F-FDG-PET vyšetření zachovalo jak ve skupině nemocných s nízkým rizikem (IPI 1 a 2), tak i u pacientů s vysokým rizikem (IPI 3, 4 a 5), a dále jak u nemocných léčených standardním režimem, tak i u pacientů, kterým byla podávána intenzifikovaná terapie nebo chemoterapie v kombinaci s rituximabem. Výsledek 18F-FDG-PET vyšetření po skončení indukční léčby měl stejnou výpovědní hodnotu a vliv na EFS a OS jako časně provedené 18F-FDG-PET vyšetření. Autoři v závěru práce konstatovali, že časná stratifikace léčby podle IPI a výsledku 18F-FDG-PET vyšetření by mohla být vodítkem pro individuálně volenou intenzitu léčby u nemocných s agresivními NHL a rizikoví nemocní by mohli profitovat z včasně a dobře volené intenzifikace terapie. Mikhaeel ve své práci ještě odlišil třetí skupinu pacientů, a to těch, kteří měli při časném 18F-FDG-PET vyšetření tzv. minimální zbytkovou pozitivitu vychytávání izotopu glukózy (minimal residual uptake; MRU) (38). 5leté PFS PET-negativních nemocných dosahovalo 88,8 %, u PET-MRU 59,3 % a u PET-pozitivních 16,2 %. Také v této práci byly výsledky časného 18F-FDG-PET významným a nezávislým prediktivním faktorem pro PFS i OS. Podobná data s řadou zajímavých pozorování pak publikovali i další autoři (39, 40). Dupuis a Haiounová dále porovnali výpovědní hodnotu časného 18F-FDG-PET s významem hodnocení fenotypu pro nemocné s DLBCL (41). Soubor 81 nemocných byl rozdělen dle exprese CD10, Bcl-6 a MUM1 na nemocné s fenotypem buněk terminálních center (GC; 51 %) a s fenotypem non-GC (nGC; 49 %). Pokud autoři zhodnotili 3leté EFS, pak nenalezli rozdíl pro skupinu nemocných s GC ve srovnání s nGC fenotypem. Zásadní odlišnost v EFS však byla patrná u skupiny s pozitivním nálezem na časném 18F-FDG-PET (46 %) v porovnání se skupinou s negativním obrazem (80 %; p = 0,0003).
V ČR jako první potvrdili užitečnost časného PET vyšetření u DLBCL Trněný a Bělohlávek, když popsali, že pravděpodobnost PFS ve 3 letech je pro negativní pacienty 82 %, pro pozitivní jen 39 % (p = 0,005). Autoři vyslovili myšlenku, že výsledek časného PET vyšetření by mohl sloužit jako další vodítko pro individualizované zvýšení intenzity terapie (14).
První zkušenosti z intenzifikací terapie u pacientů s DLBCL, u kterých přetrvává v průběhu léčby 18F-FDG-PET pozitivní nález, již byly publikovány na odborných fórech. Kasamonová s kolegy hodnotili nálezy na PET po 2 či 3 cyklu terapie R-CHOP a u nemocných s pozitivním nálezem (55 %) léčbu intenzifikovali jedním ze záchranných režimů (R-ESHAP, R-ICE) (42). U většiny z nich pak indikovali vysoce dávkovanou terapii s autologní transplantací kmenových buněk (ATKB) bez ohledu na jejich iniciální IPI. 2leté EFS bylo ve skupině s pozitivním PET nálezem a intenzifikací léčby 67 %, u PET-negativních nemocných léčených R-CHOP pak 86 %. Podobnou strategii zvolili Moskowitz a spolupracovníci, když u PET-pozitivních pacientů zvolili intenzifikaci léčby režimem ICE a jen nemocné s biopticky ověřenou reziduální tkání lymfomu indikovali k ATKB (43). Rozdíl v EFS ve skupině s pozitivním a negativním výsledkem časného 18F-FDG-PET vyšetření nebyl zaznamenán a pro celou skupinu byl 88 % s mediánem sledování 20 měsíců. U nemocných v časných stadiích DLBCL hodnotila Sehnová výsledky PET po 3 cyklech chemoterapie R-CHOP (44). U PET-negativních nemocných byla terapie ukončena po 4. cyklu R-CHOP, u PET-pozitivních nemocných byla léčba doplněna lokální radioterapií. U prvních 50 hodnocených nemocných byl nalezen rozdíl v 2letém EFS–97 % pro PET-negativní pacienty a 67 % pro PET-pozitivní pacienty, kteří podstoupili radioterapii.
Někteří autoři upozornili na riziko vizuální analýzy 18F-FDG-PET snímků při hodnocení časné léčebné odpovědi. Již Mikhaeel ve své práci vymezil skupinu pacientů s MRU, jejichž prognóza byla výrazně lepší než u nemocných s pozitivním PET nálezem (38). Lin s kolegy se pokusil ve své práci využít stanovení časného relativního poklesu hodnoty SUV (standardized uptake value) při 18F-FDG-PET v předpovědi přežití 92 nemocných s DLBCL (45). Na základě pilotních experimentů byla jako optimální hranice stanovena hodnota poklesu SUV větší než 65,7 % výchozí maximální hodnoty. Nemocní s poklesem větším než byla stanovená hranice SUV (dobře reagující na léčbu) měli 2leté EFS 79 %, nemocní s redukcí menší pak jen 21 % (p < 0,0001). 14 z 34 PET-pozitivních pacientů hodnocených jen vizuálně bylo na základě poklesu SUV hodnoceno jako nemocní dobře reagující na léčbu (41 %). Přesnost hodnocení časného 18F-FDG-PET ve vztahu k EFS byla u vizuální metody 65,2 %, u metody stanovení relativního poklesu SUV 76,1 %. Pro potvrzení významu sledování vývoje SUV u NHL bude zapotřebí zhodnotit pacienty v dalších souborech nemocných, nejlépe v prospektivní multicentrické studii se standardizovanou metodikou. Pak bude možné uvažovat o změně dnes standardního vizuálního hodnocení PET snímků za semikvantitativní hodnocení nálezů pomocí hodnot SUV.
Velmi zajímavý je pohled na nákladovou efektivitu časného 18F-FDG-PET vyšetření. Holandští autoři se o to pokusili u pacientů s agresivními lymfomy léčenými chemoterapií CHOP nebo imunochemoterapií R-CHOP (46). Modelovou analýzou prokázali, že časné 18F-FDG-PET vyšetření a alternativní (intenzifikovaná) léčba pacientů s nedostatečnou odpovědí je finančně efektivní a šetří náklady spojené s nepřínosným pokračováním iniciální terapie a pozdě indikovanou záchrannou léčbou.
Úskalí hodnocení léčebné odpovědi u NHL
Limity 18FDG-PET vyšetření při stanovení léčebné odpovědi se z velké části shodují s úskalími, která provázejí tuto vyšetřovací metodu i při primárním stážování lymfomů. Na tyto problémy jsme upozornili již v první části souhrnu, věnované právě problematice 18F-FDG-PET vyšetření v diagnostickém a stážovacím algoritmu NHL (47). Také při hodnocení léčebné odpovědi nemusíme lymfom při PET vyšetření vůbec detekovat (malý rozměr zbytkové tkáně, efekt částečného objemu) či může být maskován fyziologickou distribucí 18F-FDG (střevo, vývodné močové cesty) nebo jiným procesem, který vykazuje zvýšený metabolismus glukózy, může patologickou lymfomovou tkáň napodobit (mimikovat). A právě odlišení přetrvávající pozitivity 18F-FDG-PET ve viabilní nádorové tkáni od nenádorových reaktivních, reparativních či zánětlivých změn může činit v hodnocení léčebné odpovědi – ať již v klinických studiích nebo každodenní praxi – významný problém.
Castelucci a kolegové zhodnotili výsledky 18F-FDG-PET vyšetření u 706 nemocných s maligními lymfomy po předchozí léčbě, u kterých konvenční zobrazovací vyšetření vyslovilo podezření na relaps choroby (48). 23,1 % zobrazení bylo fokálně pozitivních a dalšími vyšetřeními byla tato pozitivita hodnocena jako utilizace 18FDG v nenádorové tkáni. Mezi pozitivními nálezy se vyskytovala přítomnost aktivity hnědého tuku, hyperplastický thymus, kontrahované svaly, nespecifické záněty uzlin, gastritida, kolitida, bakteriální absces či pásový opar. Sonetová analyzovala 103 18F-FDG-PET vyšetření lymfomů ve stejné klinické situaci jako Castelucci (49). Ze 49 pozitivních nálezů identifikovala 7 pozitivních případů (14 %) s nečekaným nálezem–sarkoidózu, aspergilózu a 5 solidních nádorů. Práce Hana publikovaná v loňském roce hovoří o tom, že i po imunochemoterapii s rituximabem se vyskytuje řada falešně pozitivních nálezů na PET snímcích (50). V části jejich práce, která se věnovala prospektivnímu sledování 44 pacientů s NHL po léčbě, bylo popsáno 9 pozitivních nálezů (20 %), u nichž další vyšetření neprokázalo relaps lymfomu. U 3 nemocných byl diagnostikován jiný nádor, u 2 nespecifický zánět a další 3 byli dlouhodobě sledováni bez průkazu relapsu lymfomu. V souboru nemocných olomouckého pracoviště vyšetřených pomocí 18F-FDG-PET po léčbě lymfomu jsme sami identifikovali řadu nálezů, které přímo nesouvisely s perzistencí či relapsem původního lymfomu (51). Mezi popsanými 18F-FDG-PET-pozitivními chorobami byly solidní nádory, adenomy štítné žlázy, infekční zánětlivá onemocnění, granulomatózní choroby či nespecifické záněty žaludku a střeva.
Přínos 18F-FDG-PET/CT v hodnocení léčebné odpovědi u NHL
18F-FDG-PET vyšetření dokáže velmi dobře zobrazit metabolicky aktivní tkáň zvýšenou měrou metabolizující 18F-FDG. Jeho nevýhodou je fakt, že FDG není látka, která by se metabolizovala jen nádorovou buňkou (viz výše), a na straně druhé poskytuje samostatné 18F-FDG-PET vyšetření horší topografickou a anatomickou informaci než CT. Kombinace obou metod však dokáže precizně detekovat metabolicky aktivní tkáň, popsat její strukturu a přesnou lokalizaci v orgánech lidského těla. Pomocí integrace 18F-FDG-PET/CT v jeden funkční diagnostický celek dochází zejména ke zvýšení celkové specificity vyšetření oproti samostatnému PET a CT. Použití PET/CT tak může snížit počet „falešně“ pozitivních či fyziologicky pozitivních, ale nespecifických nálezů, avšak nedokáže je zcela eliminovat. I při současném použití obou metod existují nálezy, u nichž až bioptické a histopatologické vyšetření podezřelé PET-pozitivní tkáně přinese přesnou informaci o její povaze.
Studií zabývajících se rolí a přínosem 18F-FDG-PET/CT v hodnocení léčebné odpovědi u NHL existuje nesrovnatelně méně než prací popisujících přínos samostatného 18F-FDG-PET vyšetření. Navíc tyto publikace obvykle pracují s heterogenními skupinami nemocných v různých klinických situacích a vesměs kladou důraz na zhodnocení úvodního (stážovacího) vyšetření (52, 53). Také prací zabývajících se přínosem 18F-FDG-PET/CT v hodnocení časné léčebné odpovědi je poskrovnu a trpí rovněž heterogenitou hodnocených nemocných (39, 54). Teprve prospektivní, dobře vedené studie analyzující homogenní skupiny nemocných budou moci přesně vymezit přínos a identifikovat limity 18FDG-PET/CT vyšetření při hodnocení léčebné odezvy nemocných s NHL a stanovit jeho prognostický význam.
Na sériích PET/CT snímků ilustrujeme nálezy u pacientů s různými podtypy NHL před zahájením terapie, v časné fázi léčby, po léčbě, resp. při relapsu choroby (obr. 1, 2, 3, 4, 5, 6). Snímky pocházejí z archivu Kliniky nukleární medicíny FNOL A LF UP v Olomouci.
Image 1. Série PET/CT snímků u nemocného s difuzním B-velkobuněčným lymfomem před léčbou, po 2 cyklech léčby a po ukončení léčby. První snímek ukazuje mnohočetná ložiska hypermetabolismu glukózy ve zvětšených lymfatických uzlinách infraklavikulárně a v dutině břišní kolem břišní aorty a v mezenteriu a kolem pánevních cév. Po 2 cyklech léčby došlo ke zmenšení všech lymfatických uzlin, žádná nevykazuje hypermetabolismus glukózy a po skončení léčby je patrná normalizace velikosti lymfatických uzlin, všechny bez hypermetabolismu glukózy. 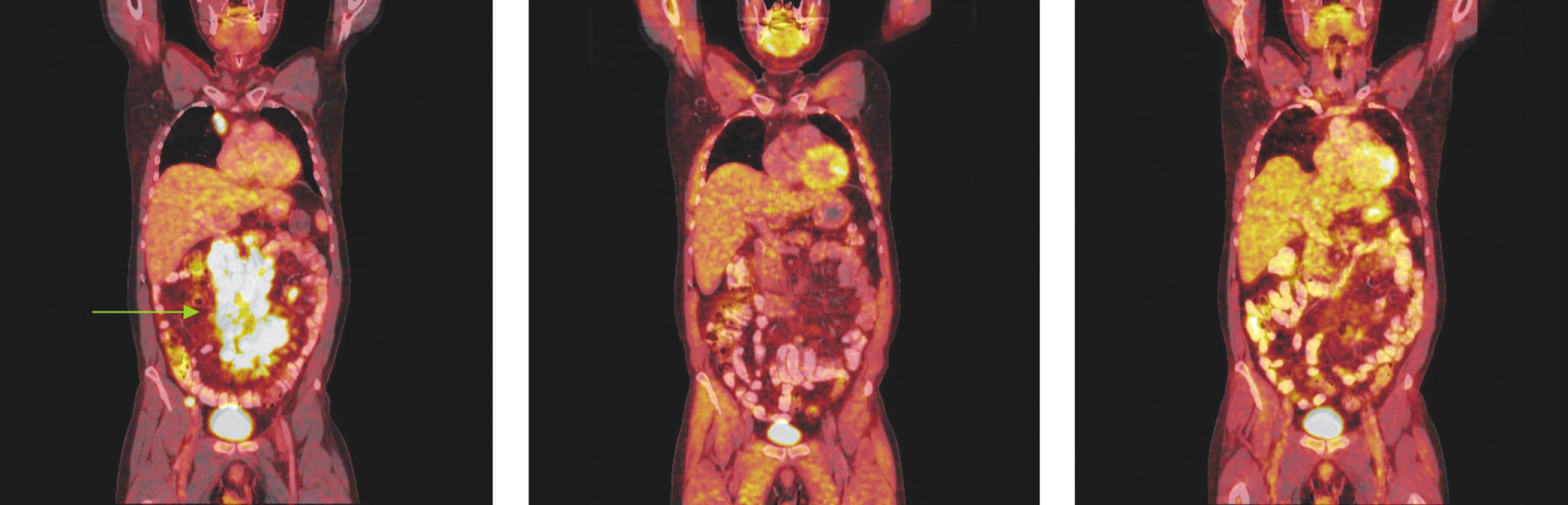
Image 2. Série PET/CT snímků u téhož nemocného s difuzním B-velkobuněčným lymfomem před léčbou, po 2 cyklech léčby a po ukončení léčby. První snímek ukazuje mnohočetná ložiska hypermetabolismu glukózy ve zvětšených lymfatických uzlinách zvětšených lymfatických uzlinách ve všech oddílech mediastina a kolem bříšní aorty. Po 2 cyklech léčby došlo ke zmenšení všech lymfatických uzlin, žádná nevykazuje hypermetabolismus glukózy a po skončení léčby je patrná normalizace velikosti lymfatických uzlin, všechny bez hypermetabolismu glukózy. 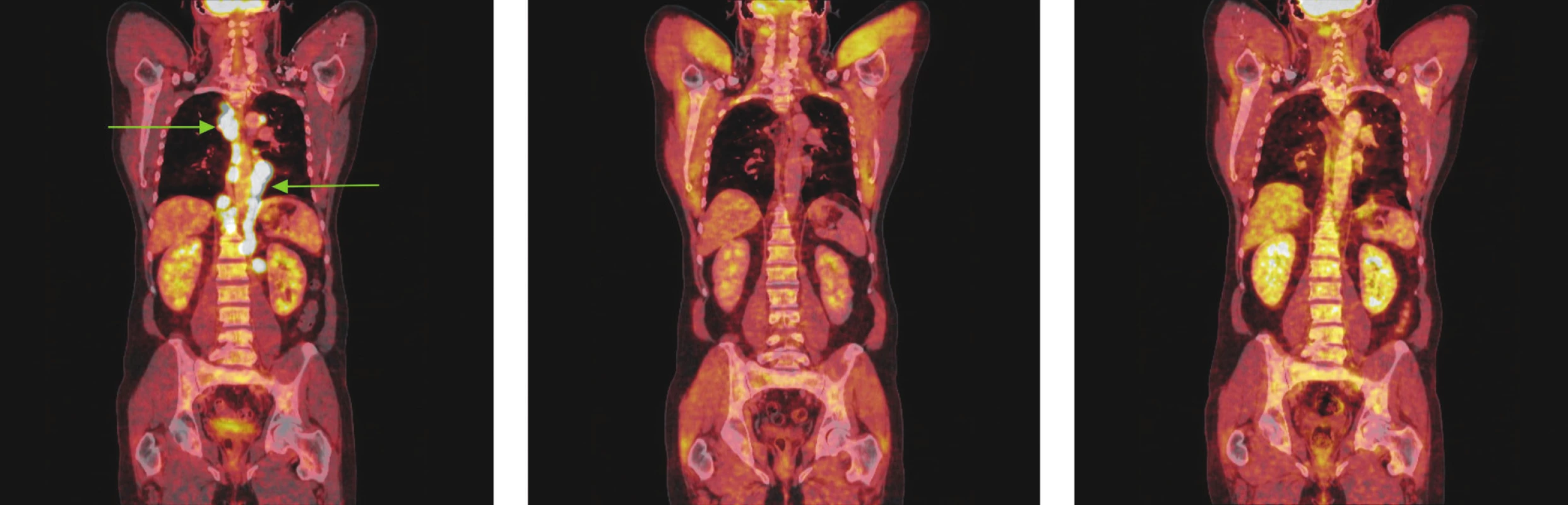
Image 3. Série PET/CT snímků u nemocného s difuzním B-velkobuněčným lymfomem před léčbou, po 2 cyklech léčby a po ukončení léčby. Na prvním snímku nalezeny pakety lymfatických uzlin v levém nadklíčku a v levé axile vykazující výrazný hypermetabolismus glukózy. Další mnohočetná ložiska hypermetabolismu glukózy byla lokalizována ve skeletu páteře, žeber, ve zvětšené slezině a v játrech. Na druhém snímku po 2 cyklech léčby přetrvávají zvětšené lymfatické uzliny v nadklíčku v axile vlevo, ve srovnání s předchozím vyšetřením však na PET snímcích nevykazují hypermetabolismus glukózy a na CT je patrné, že došlo k jejich zmenšení. Na posledním snímku po dokončení léčby nalezeny pouze zvětšené lymfatické uzliny v levé axile, v ostatních lokalizacích bez patologicky změněných lymfatických uzlin. Hypermetabolismus glukózy svědčící pro viabilní nádorovou tkáň neprokázán. 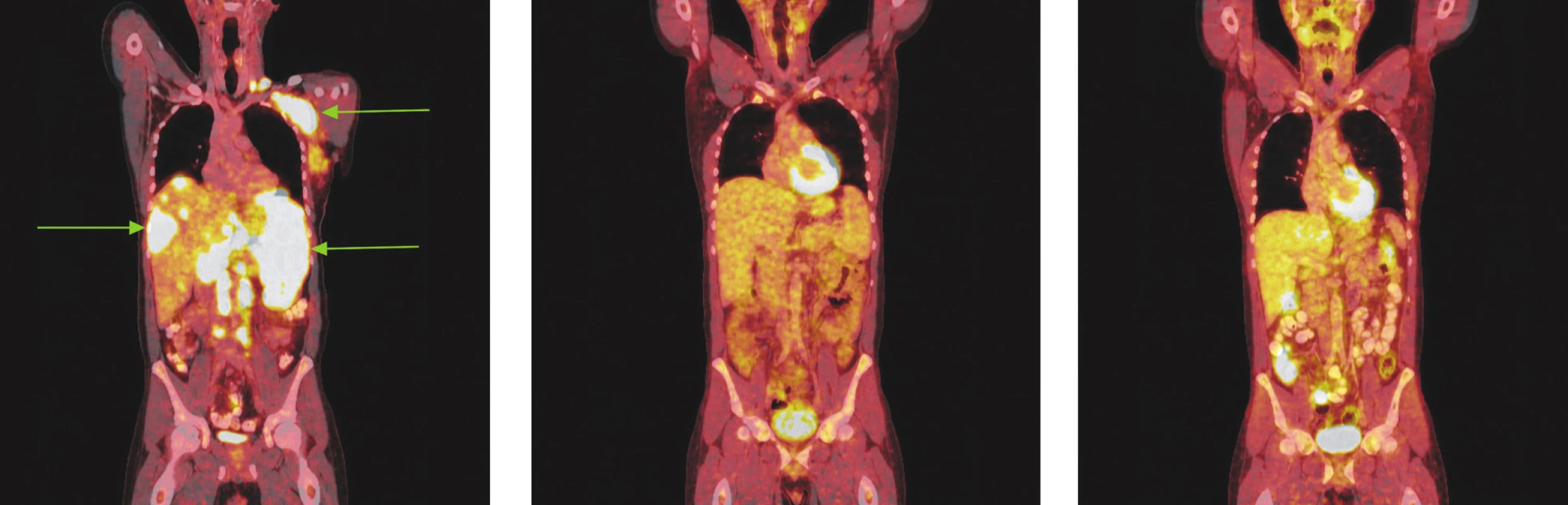
Image 4. Série PET/CT snímků u nemocného s difuzním B-velkobuněčným lymfomem po imunochemoterapii a při relapsu choroby o 18 měsíců později. Na prvním snímku po léčbě nalezeny pouze zvětšené lymfatické uzliny mediastina a měkkotkáňová masa v retroperitoneu podél aorty od odstupu renálních tepen po bifurkaci nevykazující hypermetabolismus glukózy. Pro kumulaci rizikových faktorů indikována radioterapie na zbytkovou masu retroperitonea. Na druhém snímku obraz relapsu choroby, kdy nalezeny mnohočetné zvětšené lymfatické uzliny na krku, v oblasti tonzil, v axilách, ve všech oddílech mediastina, v retroperitoneu podél aorty a dolní duté žíly splývající v pakety, v lymfatických uzlinách na mezenteriu, podél pravé ilické tepny, dále pak ve vícečetných ložiscích obou plic a ve skeletu pravého acetabula vykazující hypermetabolismus glukózy. 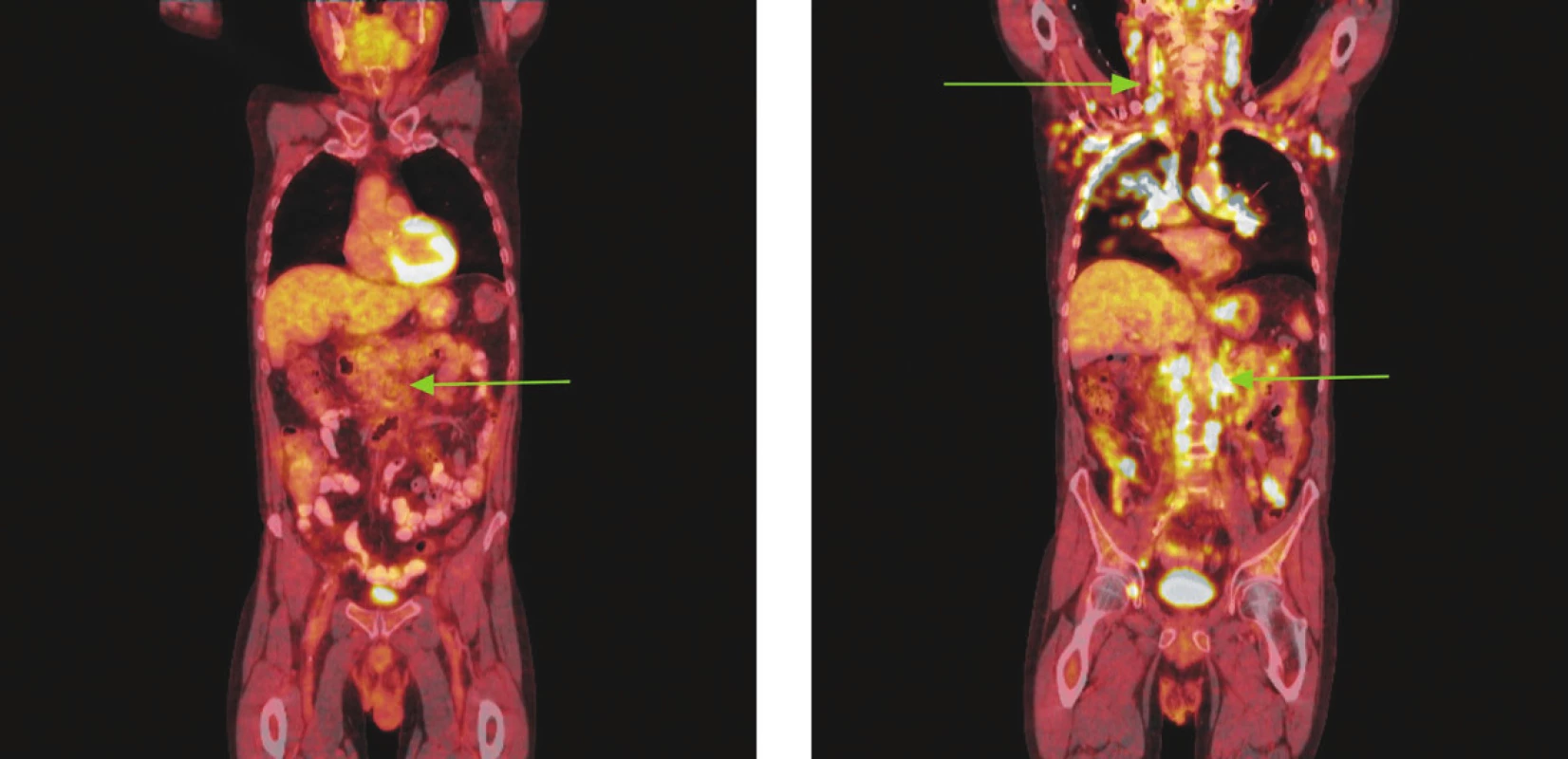
Image 5. Série PET/CT snímků u nemocného s folikulárním lymfomem před léčbou, po 2 cyklech léčby a po záchranné chemoterapii. Na prvním snímku nalezen hypermetabolismus glukózy ve zvětšených lymfatických uzlinách a jejich paketech na krku, ve všech oddílech mediastina, před pravým jaterním lalokem a v břišní dutině. Pakety v mediastinu komprimují horní dutou žílu a levou brachiocefalickou žílu, do obrovského paketu lymfatických uzlin v dutině břišní jsou zavzaty pankreas a levá nadledvina. Oboustranný fluidothorax. Na snímku po 2 cyklech imunochemoterapie došlo jen k částečné regresi patologického nálezu, lymfatické uzliny i jejich pakety se zmenšily, přetrvává v nich však stále hypermetabolismus glukózy. Pacient pro tento nález a kumulaci dalších rizikových faktorů indikován k záchranné imunochemoterapii R-EDHAP. Po 2 cyklech této léčby sice přetrvávají měkkotkáňové masy v mediastinu, retroperitoneu a mezenteriu, nevykazují však hypermetabolismus glukózy. 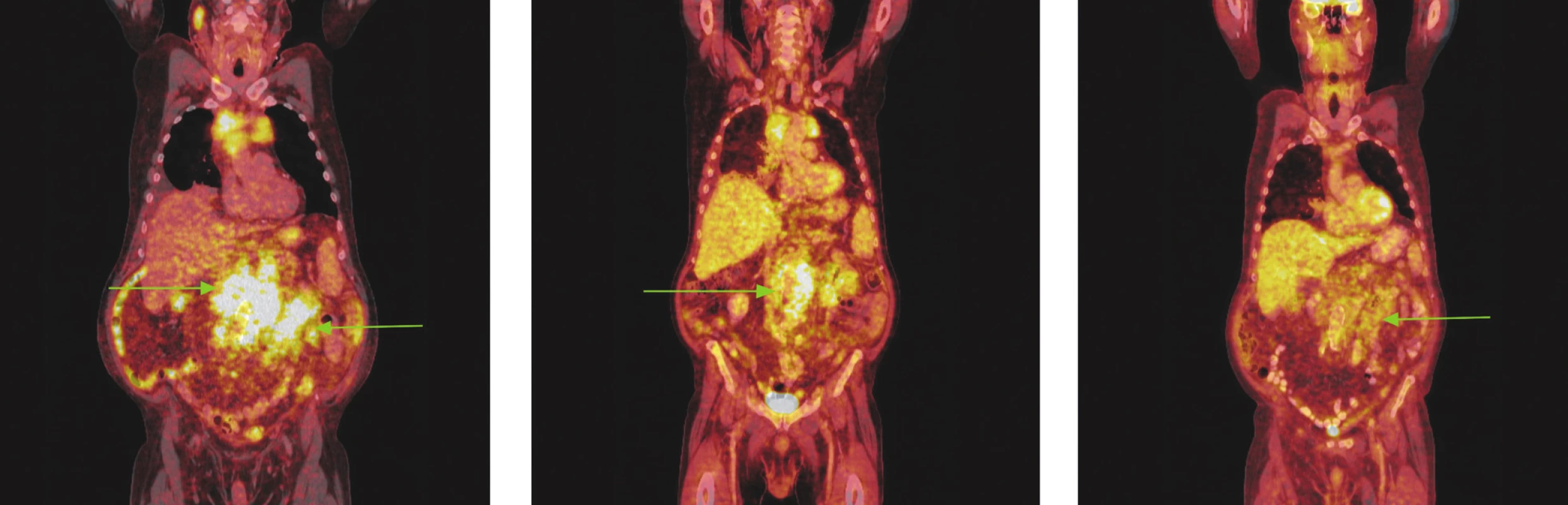
Image 6. Série PET/CT snímků u nemocného s lymfomem z plášťových buněk před léčbou a po 2 cyklech léčby. Na prvním snímku jsou patrné zvětšené lymfatické uzliny vykazující hypermetabolismus glukózy v retroperitoneu a podél ilických tepen, nad tříselnými vazy a v tříslech. V některých lokalizacích lymfatické uzliny splývají až v pakety. Na druhém snímku přetrvávají zvětšené lymfatické uzliny a jejich pakety s hypermetabolismem glukózy v identických lokalizacích jako při předchozím vyšetření. Nedošlo rovněž ke zmenšení velikosti uzlin, resp. jejich paketů. 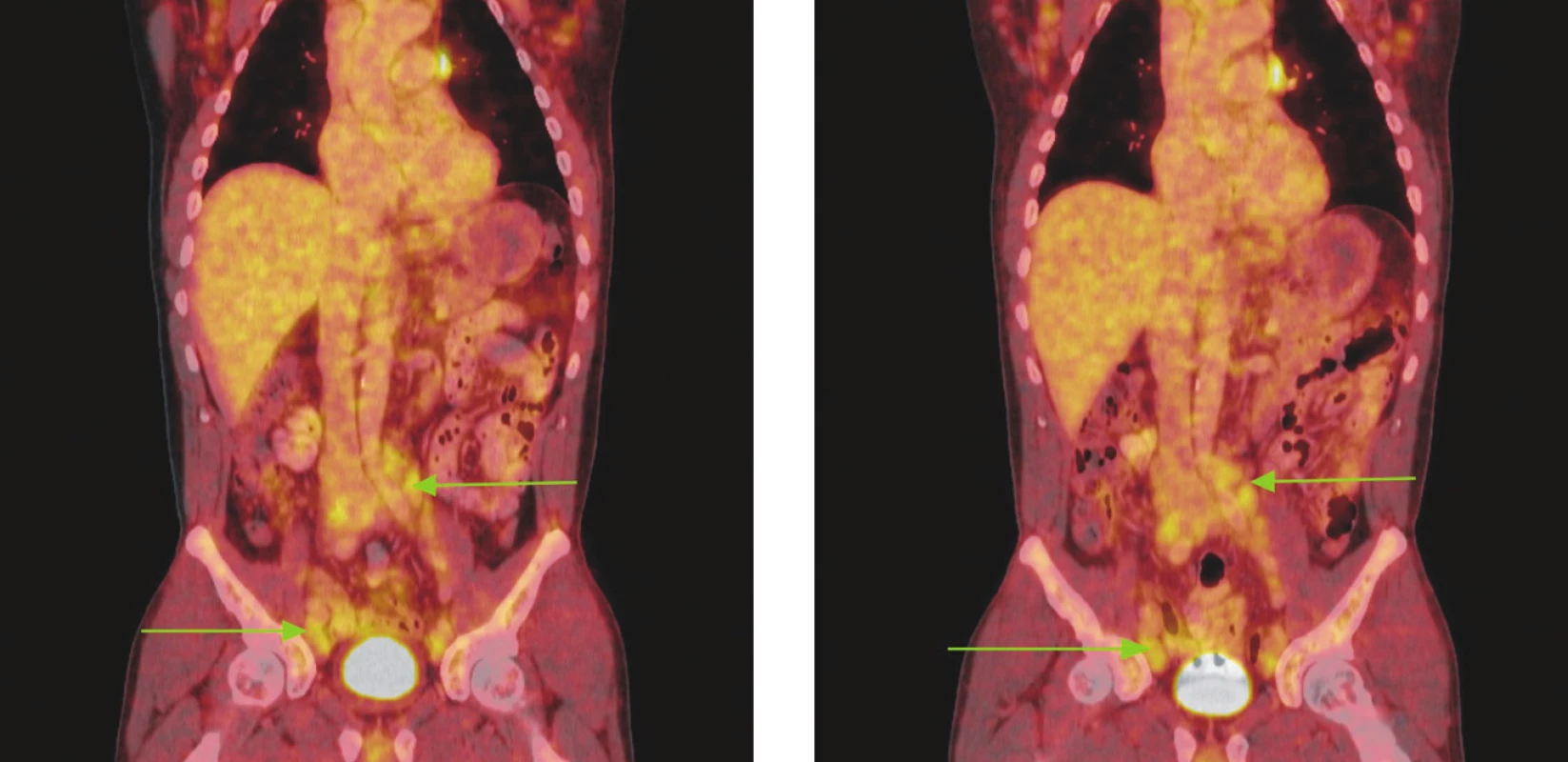
Závěr
Hodnocení léčebné odpovědi pomocí 18F-FDG-PET nebo 18F-FDG-PET/CT představuje bezesporu významný pokrok v možnostech hodnocení léčebné odpovědi u NHL. Výsledek vyšetření, resp. dosažení PET-negativní remise choroby má pro nemocné s DLBCL zásadní prognostický význam, a to jak ve vztahu k PFS, tak i pro OS. U ostatních typů lymfomů je prognostický význam dosažení PET-negativity na konci léčby zatím nejasný, i když se dá předpokládat, že u FL bude mít nejméně k PFS stejnou výpovědní hodnotu jako u DLBCL. Hodnocení časné léčebné odpovědi, rychlá a významná redukce PET-pozitivní nádorové masy je spojena s lepší prognózou a delším OS u pacientů s DLBCL. U ostatních typů NHL takto přesvědčivé údaje zatím chybí. Hodnocení léčebné odezvy pomocí 18F-FDG-PET má však také svá úskalí. Řada PET-pozitivních lézí nemusí být nutně spojena s původním nádorem a jak patologické (zánětlivé), tak fyziologické procesy (regenerativní, reparativní) mohou imitovat zbytkovou nádorovou tkáň. Integrace 18F-FDG-PET/CT v jednom funkčním celku zvyšuje specificitu vyšetření a v řadě případů může pomoci rozhodnout o povaze PET-pozitivního nálezu. V řadě případů se však ani v éře sofistikovaných 18F-FDG-PET/CT systémů neobejdeme bez cíleného bioptického a histopatologického vyšetření tkáně. I když se zdá být úloha 18F-FDG-PET a PET/CT zejména u nemocných s DLBCL dobře popsána, existuje i u této skupiny lymfomů řada nezodpovězených otázek. U ostatních typů lymfomů zhodnotí význam 18F-FDG-PET a PET/CT až další prospektivně sebraná data větších souborů nemocných.
Práce byla podpořena grantem IGA MZ ČR No. NR/9502-3
Doc. MUDr. Tomáš Papajík, CSc.
Hemato-onkologická klinika LF UP a FN Olomouc
I. P. Pavlova 6
775 20 Olomouc
e-mail: tomas.papajik@fnol.cz
Doručeno do redakce: 5. 5. 2009
Přijato do tisku: 24. 7. 2009
Sources
1. Villela L, Lopez-Guillermo A, Montoto S, et al. Prognostic features and outcome in patients with diffuse large B-cell lymphoma who do not achieve a complete response to first-line regimens. Cancer 2001; 91 : 1557–1562.
2. Armitage JO, Weisenburger DD, Hutchins M, et al. Chemotherapy for diffuse large-cell lymphoma - rapidly responding patients have more durable remissions. J Clin Oncol 1986; 4 : 160–164.
3. Haw R, Sawka CA, Franseen E, Berinstein NL. Significance of a partial or slow response to front-line chemotherapy in the management of intermediate-grade or high-grade non-Hodgkin’s lymphoma: a literature review. J Clin Oncol 1994; 12 : 1074–1084.
4. Cheson BD, Horning SJ, Coiffier B, et al. Report of an international workshop to standardize response criteria for non-Hodgkin’s lymphomas. J Clin Oncol 1999; 17 : 1244–1253.
5. Coiffier B, Gisselbrecht C, Herbrecht R, et al. LNH-84 regimen: a multicenter study of intensive chemotherapy in 737 patients with aggressive malignant lymphoma. J Clin Oncol 1989; 7 : 1018–1026.
6. Kaplan WD, Jochelson MS, Herman TS, et al. Gallium-67 imaging: a predictor of residual tumor viability and clinical outcome in patients with diffuse large-cell lymphoma. J Clin Oncol 1990; 8 : 1966–1970.
7. Gasparini M, Bombardieri E, Castellani M, et al. Gallium-67 scintigraphy evaluation of therapy in non-Hodgkin’s lymphoma. J Nucl Med 1998; 39 : 1586–1590.
8. Zinzani PL, Magagnoli M, Chierichetti F, et al. The role of positron emission tomography (PET) in the management of lymphoma patients. Ann Oncol 1999; 10 : 1181–1184.
9. Spaepen K, Stroobants S, Dupont P, et al. Prognostic value of positron emission tomography (PET) with fluorine-18 fluorodeoxyglucose ([18F]FDG) after first-line chemotherapy in non-Hodgkin’s lymphoma: is [18F]FDG-PET a valid alternative to conventional diagnostic methods? J Clin Oncol 2001; 19 : 414–419.
10. Cremerius U, Fabry U, Neuerburg J, et al. Positron emission tomography with 18F-FDG to detect residual disease after therapy for malignant lymphoma. Nucl Med Commun 1998; 19 : 1055–1063.
11. Mikhaeel NG, Timothy AR, O’Doherty MJ, Hain S, Maisey MN. 18-FDG-PET as a prognostic indicator in the treatment of aggressive Non-Hodgkin’s Lymphoma-comparison with CT. Leuk Lymphoma 2000; 39 : 543–553.
12. Juweid ME, Wiseman GA, Vose JM, et al. Response assessment of aggressive non-Hodgkin’s lymphoma by integrated International Workshop Criteria and fluorine-18-fluorodeoxyglucose positron emission tomography. J Clin Oncol 2005; 23 : 4652–4661.
13. Reinhardt MJ, Herkel C, Altehoefer C, Finke J, Moser E. Computed tomography and 18F-FDG positron emission tomography for therapy control of Hodgkin’s and non-Hodgkin’s lymphoma patients: when do we really need FDG-PET? Ann Oncol 2005; 16 : 1524–1529.
14. Trneny M, Jaeger U, Belohlavek O, et al. Early whole body F18-FDG positron emission tomography (PET) restaging has significant prognostic impact in diffuse large cell lymphomas (DLCL-B). Ann Oncol 2005; 16 (Suppl.5): 122–122.
15. Juweid ME, Stroobants S, Hoekstra OS, et al. Use of positron emission tomography for response assessment of lymphoma: consensus of the Imaging Subcommittee of International Harmonization Project in Lymphoma. J Clin Oncol 2007; 25 : 571–578.
16. Cheson BD, Pfistner B, Juweid ME, et al. Revised response criteria for malignant lymphoma. J Clin Oncol 2007; 25 : 579–586.
17. Reske SN. FDG-PET and PET/CT in malignant lymphoma. Recent Results Cancer Res 2008; 170 : 93 –107.
18. Zijlstra JM, Lindauer-van der Werf G, Hoekstra OS, et al. 18F-fluoro-deoxyglucose positron emission tomography for post-treatment evaluation of malignant lymphoma: a systematic review. Haematologica 2006; 91 : 522–529.
19. Terasawa T, Nihashi T, Hotta T, Nagai H. 18F-FDG PET for posttherapy assessment of Hodgkin’s disease and aggressive Non-Hodgkin’s lymphoma: a systematic review. J Nucl Med 2008; 49 : 13–21.
20. Zinzani PL, Tani M, Trisolini R, et al. Histological verification of positive positron emission tomography findings in the follow-up of patients with mediastinal lymphoma. Haematologica 2007; 92 : 771–777.
21. Han HS, Escalon MP, Serafini A, Losos IS. High Incidence of False Positive PET Scans in Patients with Aggressive Non-Hodgkins Lymphoma Treated with Rituximab-Containing Regimens. Blood 2006; 108 : 2401a.
22. Kahn ST, Flowers C, Lechowicz MJ, Hollenbach K, Johnstone PA. Value of PET restaging after chemotherapy for non-Hodgkin’s lymphoma: implications for consolidation radiotherapy. Int J Radiat Oncol Biol Phys 2006; 66 : 961–965.
23. Filmont JE, Czernin J, Yap C, et al. Value of F-18 fluorodeoxyglucose positron emission tomography for predicting the clinical outcome of patients with aggressive lymphoma prior to and after autologous stem-cell transplantation. Chest 2003; 124 : 608–613.
24. Spaepen K, Stroobants S, Dupont P, et al. Prognostic value of pretransplantation positron emission tomography using fluorine 18-fluorodeoxyglucose in patients with aggressive lymphoma treated with high-dose chemotherapy and stem cell transplantation. Blood 2003; 102 : 53–59.
25. Schot BW, Pruim J, van Imhoff GW, et al. The role of serial pre-transplantation positron emission tomography in predicting progressive disease in relapsed lymphoma. Haematologica 2006; 91 : 490–495.
26. Derenzini E, Musuraca G, Fanti S, et al. Pretransplantation positron emission tomography scan is the main predictor of autologous stem cell transplantation outcome in aggressive B-cell non-Hodgkin lymphoma. Cancer 2008; 113 : 2496–2503.
27. Bishu S, Quigley JM, Bishu SR, et al. Predictive value and diagnostic accuracy of F-18-fluoro-deoxy-glucose positron emission tomography treated grade 1 and 2 follicular lymphoma. Leuk Lymphoma 2007; 48 : 1548–1555.
28. Janikova A, Bolcak K, Pavlik T, Mayer J, Kral Z. Value of [18F]fluorodeoxyglucose positron emission tomography in the management of follicular lymphoma: the end of a dilemma? Clin Lymphoma Myeloma 2008; 8 : 287–293.
29. Gill S, Wolf M, Prince HM, et al. [18F]fluorodeoxyglucose positron emission tomography scanning for staging, response assessment, and disease surveillance in patients with mantle cell lymphoma. Clin Lymphoma Myeloma 2008; 8 : 159–165.
30. Brepoels L, Stroobants S, De Wever W, et al. Positron emission tomography in mantle cell lymphoma. Leuk Lymphoma 2008; 49 : 1693–1701.
31. Pro B, Nunez R. F, Romaguera J, et al. Achievement of FDG-PET negativity does not predict durale response in T-cell lymphoma. Blood 2006; 108 : 2404a.
32. Cahu X, Bodet-Milin C, Gastinne T, et al. Interest and Prognosis Value of Fluorine-18-Fluoro-2-Deoxy-D-Glucose Positron Emission Tomography ([18F] FDG-PET/CT) in Aggressive T-Cell Lymphomas. Blood 2008; 112 : 2835a.
33. Römer W, Hanauske AR, Ziegler S, et al. Positron emission tomography in non-Hodgkin’s lymphoma: assessment of chemotherapy with fluorodeoxyglucose. Blood 1998; 91 : 4464–4471.
34. Jerusalem G, Beguin Y, Fassotte MF, et al. Persistent tumor 18F-FDG uptake after a few cycles of polychemotherapy is predictive of treatment failure in non-Hodgkin’s lymphoma. Haematologica 2000; 85 : 613–618.
35. Kostakoglu L, Coleman M, Leonard JP, et al. PET predicts prognosis after 1 cycle of chemotherapy in aggressive lymphoma and Hodgkin’s disease. J Nucl Med 2002; 43 : 1018–1027.
36. Spaepen K, Stroobants S, Dupont P, et al. Early restaging positron emission tomography with (18)F-fluorodeoxyglucose predicts outcome in patients with aggressive non-Hodgkin’s lymphoma. Ann Oncol 2002; 13 : 1356–1363.
37. Haioun C, Itti E, Rahmouni A, et al. [18F]fluoro-2-deoxy-D-glucose positron emission tomography (FDG-PET) in aggressive lymphoma: an early prognostic tool for predicting patient outcome. Blood 2005; 106 : 1376–1381.
38. Mikhaeel NG, Hutchings M, Fields PA, O’Doherty MJ, Timothy AR. FDG-PET after two to three cycles of chemotherapy predicts progression-free and overall survival in high-grade non-Hodgkin lymphoma. Ann Oncol 2005; 16 : 1514–1523.
39. Querellou S, Valette F, Bodet-Milin C, et al. FDG-PET/CT predicts outcome in patients with aggressive non-Hodgkin’s lymphoma and Hodgkin’s disease. Ann Hematol 2006; 85 : 759–767.
40. Ng AP, Wirth A, Seymour JF, et al. Early therapeutic response assessment by (18)FDG-positron emission tomography during chemotherapy in patients with diffuse large B-cell lymphoma: isolated residual positivity involving bone is not usually a predictor of subsequent treatment failure. Leuk Lymphoma 2007; 48 : 596–600.
41. Dupuis J, Gaulard P, Hemery F, et al. Respective prognostic values of germinal center phenotype and early (18)fluorodeoxyglucose-positron emission tomography scanning in previously untreated patients with diffuse large B-cell lymphoma. Haematologica 2007; 92 : 778–783.
42. Kasamon YL, Wahl RL, Ziessman HA, et al. Risk-Adapted Therapy of Aggressive Lymphoma Based on FDG-PET Performed after 2 or 3 Cycles of Initial Chemotherapy. Blood 2007; 110 : 1894a.
43. Moskowitz C, Hamlin PA, Horwitz SM, et al. Phase II Trial of Dose-Dense R-CHOP Followed by Risk-Adapted Consolidation with Either ICE or ICE and ASCT, Based upon the Results of Biopsy Confirmed Abnormal Interim Restaging PET Scan, Improves Outcome in Patients with Advanced Stage DLBCL. Blood 2006; 108 : 532a.
44. Sehn LH, Sabate KJ, Hoskins P, et al. Limited-Stage Diffuse Large B-Cell Lymphoma (DLBCL) Patients with a Negative Pet Scan Following Three Cycles of R-CHOP Can Be Effectively Treated with Abbreviated Chemoimmunotherapy Alone. Blood 2007; 110 : 787a.
45. Lin C, Itti E, Hamoun C, et al. Early 18F-FDG PET for prediction of prognosis in patients with diffuse large B-cell lymphoma: SUV-based assessment versus visual analysis. J Nucl Med 2007; 48 : 1626–1632.
46. Moulin-Romsee G, Spaepen K, Stroobants S, Mortelmans L. Non-Hodgkin lymphoma: retrospective study on the cost-effectiveness of early treatment response assessment by FDG-PET. Eur J Nucl Med Mol Imaging 2008; 35 : 1074–1080.
47. Papajík T, Mysliveček M, Buriánková E, et al. Pozitronová emisní tomografie a integrovaná pozitronová emisní tomografie s počítačovou tomografií ve stážování a hodnocení léčebné odpovědi u nehodgkinských lymfomů. Část I. Určení stadia a postižení jednotlivých orgánů. Transfuze Hematol dnes 2008; 14 : 55–61.
48. Castellucci P, Nanni C, Farsad M, et al. Potential pitfalls of 18F-FDG PET in a large series of patients treated for malignant lymphoma: prevalence and scan interpretation. Nucl Med Commun 2005; 26 : 689–694.
49. Sonet A, Graux C, Nollevaux MC, et al. Unsuspected FDG-PET findings in the follow-up of patients with lymphoma. Ann Hematol 2007; 86 : 9–15.
50. Han HS, Escalón MP, Hsiao B, Serafini A, Lossos IS. High incidence of false-positive PET scans in patients with aggressive non-Hodgkin’s lymphoma treated with rituximab-containing regimens. Ann Oncol 2008; October 7. (Epub ahead of print).
51. Šedová Z, Mysliveček M, Papajík T, et al. Zajímavé 18FDG-PET-pozitivní vedlejší nálezy při PET/CT vyšetření u nemocných léčených pro ne-hodgkinův lymfom. Vnitřní lék 2008; 54 (Suppl. 5): P34.
52. Freudenberg LS, Antoch G, Schütt P, et al. FDG-PET/CT in re-staging of patients with lymphoma. Eur J Nucl Med Mol Imaging 2004; 31 : 325–329.
53. Elstrom RL, Leonard JP, Coleman M, Brown RK. Combined PET and low-dose, noncontrast CT scanning obviates the need for additional diagnostic contrast-enhanced CT scans in patients undergoing staging or restaging for lymphoma. Ann Oncol 2008;19 : 1770–1773.
54. Yang DH, Min JJ, Jeong YY, et al. The combined evaluation of interim contrast-enhanced computerized tomography (CT) and FDG-PET/CT predicts the clinical outcomes and may impact on the therapeutic plans in patients with aggressive non-Hodgkin’s lymphoma. Ann Hematol 2008; November 12. (Epub ahead of print).
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2009 Issue 3-
All articles in this issue
- Cievny endotelový rastový faktor u osôb s diabetom 2. typu
- Pozitronová emisní tomografie a integrovaná pozitronová emisní tomografie s počítačovou tomografií ve stážování a hodnocení léčebné odpovědi u ne-hodgkinských lymfomů. Část II.: Hodnocení léčebné odpovědi
- Warfarínom indukovaná kožná nekróza: kazuistika a prehľad literatúry
- Činnost nemocniční transfuzní služby v České republice v roce 2008
- Detekce mutace JAK2V617F u myeloproliferativních onemocnění – přehled a vlastní zkušenosti
- Úspěšná léčba časného molekulárního relapsu variantní formy sekundární akutní promyelocytární leukemie oxidem arsenitým
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Detekce mutace JAK2V617F u myeloproliferativních onemocnění – přehled a vlastní zkušenosti
- Úspěšná léčba časného molekulárního relapsu variantní formy sekundární akutní promyelocytární leukemie oxidem arsenitým
- Warfarínom indukovaná kožná nekróza: kazuistika a prehľad literatúry
- Pozitronová emisní tomografie a integrovaná pozitronová emisní tomografie s počítačovou tomografií ve stážování a hodnocení léčebné odpovědi u ne-hodgkinských lymfomů. Část II.: Hodnocení léčebné odpovědi
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

