-
Medical journals
- Career
Synchronní, do jater metastazující karcinom rekta a možnosti simultánní resekce
Authors: M. Zatloukal 1; V. Procházka 1; L. Ostřížková 2; V. Válek 3; Z. Kala 1; I. Penka 1
Authors‘ workplace: Chirurgická klinika Fakultní nemocnice Brno a Lékařské fakulty Masarykovy univerzity 1; Interní a hematoonkologická klinika Fakultní nemocnice Brno a Lékařské fakulty Masarykovy univerzity 2; Klinika radiologie a nukleární medicíny Fakultní nemocnice Brno a Lékařské fakulty Masarykovy univerzity 3
Published in: Rozhl. Chir., 2019, roč. 98, č. 10, s. 394-398.
Category: Review
Overview
Léčba metastazujícího karcinomu rekta a jaterních metastáz představuje stále vysoce aktuální problém. Synchronní metastázy jater jsou diagnostikovány až u pětiny pacientů s nově zachyceným karcinomem rekta. Je třeba, aby další strategie diagnosticko-terapeutického postupu probíhala od počátku za těsné mezioborové spolupráce s komisionálním hodnocením. Jen tímto způsobem lze zajistit optimální načasování jednotlivých léčebných modalit a maximální benefit pro pacienta. Složitost problematiky vede v průběhu léčby k uplatnění různých specifických metod a jejich vzájemných kombinací, které není možné v současné době vřadit do jednoduchých a jednoznačných schémat. V samotné chirurgii navíc situaci komplikuje zcela odlišná anatomická lokalizace jater a rekta, a tedy zásadně rozdílný operační přístup v otevřené chirurgii. Velkou perspektivu nyní přináší standardizace laparoskopických resekcí a roboticky asistovaných operací v obou lokalitách. Otevírají se tak možnosti dvoutýmových simultánních výkonů laparoskopickou/robotickou technikou či kombinovaným přístupem. I přes veškerý pokrok v chirurgických technikách však optimální postup není jednoznačně stanoven.
Klíčová slova:
karcinom rekta – synchronní metastázy – simultánní resekce
Úvod
Asi 20 % pacientů s diagnostikovaným karcinomem rekta je postiženo synchronními jaterními metastázami [1], což z této problematiky činí vysoce aktuální problematiku chirurgickou i onkologickou. Donedávna nebyla definice synchronicity plně jednotná; dnes se takto konsenzuálně označují ty metastázy, které jsou zjištěny v době diagnózy origa nebo před ní. Oproti pozdním metachronním metastázám – diagnostikovaným po 12 měsících – vykazují synchronní metastázy agresivnější biologickou povahu a pochopitelně i horší prognózu [2]. Problematika léčby metastazujícího karcinomu je složitá. Současná medicína disponuje různými terapeutickými modalitami, které lze kombinovat k dosažení co nejlepšího výsledku stran přežití a udržení kvality života. V rámci precizace medicíny se uplatňuje multidisciplinární přístup zahrnující pohled chirurga, klinického onkologa, radioonkologa, radiologa, gastroenterologa, patologa a dalších odborností, které volí strategii léčby a mohou přispět ke změně původně plánovaného postupu [3]. Z hlediska dlouhodobého přežití však hraje chirurgie kruciální úlohu, resekce primárního tumoru a metastáz zůstává jediným potenciálně kurativním způsobem léčby [4,5].
Metody
Terapeutická rozvaha
Léčebný plán závisí na kvalitním stagingu, v němž hrají hlavní úlohu zobrazovací vyšetření. U tumorů rekta dnes standardně využíváme zobrazení magnetickou rezonancí (MR) malé pánve, které podrobně zhodnotí velikost ložiska a jeho vztah k okolním strukturám, zejména k mezorektální fascii a svěračům. Dosahuje až 92% specificity při předpovědi negativního cirkumferenčního okraje [6]. Transrektální ultrasonografie (TRUS) je přínosná zejména k posouzení časných stadií nádoru rekta, kdy může přispět k indikaci lokální excize tumoru; u lokálně pokročilé formy onemocnění se její informační hodnota snižuje [7]. Zlatým standardem k diagnostice disseminace onemocnění je thorakoabdominální počítačová tomografie (CT). Výhodou MR oproti CT vyšetření je absence radiační zátěže, větší senzitivita u lézí menších než 1 cm a podle některých autorů lepší vyhodnocení ložisek po neoadjuvantní chemoterapii. Vyšetření pozitronovou emisní tomografií (PET), ve spojení s CT či magnetickou rezonancí, získává v souvislosti s lepší dostupností tohoto vyšetření větší prostor v diagnostice tumorů rekta. Jeho indikace však není rutinní, uplatňuje se při podezření na vzdálené metastázy, a to ve spojení s průkazem významné extramurální vaskulární invaze (EMVI), vysoké hladiny karcinoembryonálního antigenu (CEA) či suspektních lézí na CT či MR s dubiózním onkologickým potenciálem [8,9]. Zásadní význam má PET-CT v hodnocení rekurentních jaterních metastáz, kdy dosahuje senzitivity a specificity vysoko přes 90 % [10], a v posouzení léčebné odpovědi na předoperační onkologickou léčbu.
Hlavním sledovaným nádorovým markerem je CEA, vedlejším CA 19-9. Neslouží jako screeningové markery a není doporučeno je užívat v rámci preventivních vyšetření. V případě prokázaného tumoru se ale zvýšená hladina CEA považuje za nepříznivý prognostický faktor, v pooperačním období může být zvýšení jeho hladiny známkou relapsu onemocnění, proto je doporučeno pravidelně jeho hodnoty kontrolovat [8]. Izolované hodnocení jeho hladiny však není dostatečné a slouží pouze jako podpůrný prostředek [11].
Optimální postup k léčbě těchto pacientů není jednoznačně stanoven. Zcela nezbytné je projednat strategii léčby komisionálně a stanovit terapeutický plán multidisciplinárním konsenzem u jednotlivých pacientů individuálně. Vzhledem k pokročilosti onemocnění se však ve většině případů synchronního postižení doporučuje neoadjuvantní terapie [8], zahrnující chemoterapii, biologickou léčbu a radioterapii, zejména při nízkém karcinomu rekta. Této skutečnosti je rovněž podřízena strategie výkonu u symptomatických tumorů. Obstrukce trávicího traktu ohrožující jeho průchodnost si může vynutit akutní řešení formou derivační stomie; v případě, kdy neočekáváme provedení resekčního výkonu, lze užít samoexpandibilní stent. Krvácení z primárního tumoru způsobující anemii nebývá považováno za důvod k upřednostnění primární resekce origa. Většinou se daří zvládnout krevními převody a v průběhu podávané chemoterapie zpravidla ustává [2]. V případě neresekabilních jaterních metastáz je při systémové onkologické léčbě předpoklad zmenšení jejich velikosti, nepřímo pak lze odvodit senzitivitu tumoru na indukční léčbu [2]. Otázkou zůstává předřazení systémové léčby u resekabilních metastáz, kdy poměr přínosu léčby a vedlejších účinků na zdravý jaterní parenchym nemusí být výhodný pro další operativu v hepatální oblasti [2,12]. Základním požadavkem na chirurga je kompletní odstranění jaterních metastáz s bezpečným lemem zdravé tkáně při zachování dostatečného objemu funkčního jaterního parenchymu (FLR). V současné době je resekční okraj 1 mm zdravé tkáně považován za dostatečný [13,14]. Literární minimum 20 až 25 % ponechaného plně funkčního parenchymu u mladých pacientů se s věkem a zejména aplikovanou chemoterapií navyšuje na 40 i více procent ponechané jaterní tkáně, což může být pro chirurgický výkon výrazně limitující [15]. U menších metastatických ložisek uložených v hloubi parenchymu proto s výhodou užíváme možnosti kombinace s radiofrekvenční ablací (RFA).
Chirurgické postupy
V případě dosažené resekability, jejíž nutnou podmínkou je onkologická radikalita, je standardem léčby etapové chirurgické řešení karcinomu rekta a jaterních metastáz. V otázce načasování chirurgické resekce primárního tumoru či synchronních jaterních metastáz rozlišujeme v současné době tři základní postupy. Volba některého z nich závisí na stupni pokročilosti nálezu na rektu či játrech; obecně má přednost ten orgán, který je více postižen.
Dle toho pak uplatňujeme primary first approach, který je historicky starší, maximálně z něj benefitují symptomatičtí pacienti a dochází k resekci zdroje metastáz [16]. Někteří autoři popisují i přímý benefit resekce primárního tumoru při neresekabilních jaterních metastázách [17]. Chirurgický výkon na játrech pak následuje s odstupem 2−3 měsíců s vhodnou aplikací chemoterapie mezi operacemi [2]. U pacientů s možností rizikové anastomózy se využívá založení protektivní stomie [18,19]. Původní výhrady etapového postupu směřovaly k obavám z progrese nádorového onemocnění v mezidobí. Dnes se zdá, že tato progrese selektuje pacienty s velmi agresivním nádorovým onemocněním a je pravděpodobné, že by profit pro pacienty v těchto případech neznamenala ani simultánní resekce jaterních ložisek.
V případě inverzního, tzv. liver first přístupu je v první době provedena resekce jaterních metastáz. Ty mohou být resekabilní již zpočátku, či je u nich dosaženo resekability po aplikaci systémové terapie. Tyto metastázy jsou, v případě odložení jejich resekce, rizikové z hlediska další progrese a tedy jejich možné budoucí inoperability. Výhodou tohoto přístupu je umožnění včasného zahájení systémové terapie vzhledem k vyloučení možných septických komplikací souvisejících s resekčním výkonem na střevě. Dále je přístup vhodný pro extenzivní jaterní postižení u asymptomatického primárního tumoru rekta a rovněž v případě metastáz, u kterých bylo neoadjuvantní léčbou dosaženo resekability z původní inoperability [2]. Jestliže není před jaterní resekcí neoadjuvantní složka, označujeme tento postup jako up front hepatectomy; hlavním důvodem tohoto postupu volby je prevence chemoterapií indukovaného postižení jater [12].
Simultánní resekce
Koncept simultánní resekce byl u kolorektálního karcinomu představen Vogtem v roce 1991 [20]. Jde o chirurgicky přitažlivé pojetí resekce metastáz a primárního tumoru během jedné anestezie, které může vést ke zkrácení intervalu mezi chirurgickou a případnou adjuvantní léčbou, snížit počet potřebných hospitalizací a zmenšit jejich negativní vliv na pacienta.
Možnosti simultánního řešení karcinomu rekta byly v éře otevřené operativy většinou pouze ve sporadických případech. Specifika a náročnost operativy v malé pánvi spolu s nutností odlišné přístupové cesty obou anatomicky vzdálených orgánů umožňovala pouze řešení indikačně omezená především na oblast tumorů orálního rekta a dobře přístupných povrchových metastáz v segmentech II–VI jater. Výkony byly zatíženy vysokou perioperační morbiditou [21,22].
S rozvojem minimálně invazivní chirurgie, laparoskopických resekcí rekta a roboticky asistovaných operací a případné kombinace těchto modalit s otevřeným přístupem se možnosti simultánních resekcí zvýšily. Došlo k posunu problematiky i do méně přístupných jaterních segmentů a patologií středního a distálního rekta. Limitací širšího uplatnění tohoto přístupu bylo signifikantní prodloužení operačního času a peroperačních ztrát krve – hlavních příčin komplikací, zejména netěsnosti anastomózy střeva [23]. Technologická zlepšení v oblasti endoskopické techniky umožnila snížit tyto negativní faktory a umožnit rozšíření tohoto chirurgického řešení. V posledních letech bylo provedeno několik studií a analýz, které shledaly simultánní resekce s resekcí jater ekvivalentní etapovým postupům v krátkodobém měřítku [4,5,24–28]. Dlouhodobých výsledků bylo doposud publikováno méně, nicméně prezentované výsledky neukazují signifikantní rozdíl mezi uvedenými postupy, což přináší do budoucna slibná očekávání [29–31]. Ačkoliv někteří autoři popisují s příznivými výsledky i simultánní resekce zahrnující velké jaterní zákroky [32], je doporučeno provádět menší jaterní resekce, tj. do tří jaterních segmentů.
Jako perspektivní se jeví možnost kombinovat laparoskopické resekce jater s možnostmi potenciálně kurativního minimálně invazivního neoperačního řešení – k nimž patří zejména perkutánní radiofrekvenční ablace (RFA). RFA využívá proudu s vysokou frekvencí, který se převádí v místě ablace na teplo, čímž dochází k destrukci buněk. S výhodou je užíváme u malých metastáz v hloubi jaterního parenchymu, jež by vyžadovaly odstranění objemné porce zdravé tkáně. Dalším benefitem je zkrácení doby rekonvalescence, a tedy i intervalu bez systémové léčby, která je podstatným předpokladem úspěšné léčby. Z hlediska provedení lze tuto modalitu využít buď perkutánně s CT navigací, a to před operací, nebo po ní, či peroperačně. Limitací kvalitního ošetření s kurativním potenciálem je velikost metastázy do 3 cm [33].
Naše zkušenosti
Níže uvádíme dvě recentní kazuistiky z našeho pracoviště u pacientů s karcinomem rekta, u nichž byly prokázány vícečetné jaterní metastázy. Oba pacienti prodělali neoadjuvantní terapii, poté byli indikováni k resekčnímu výkonu pro příznivý nález při restagingu. Oba pacienti prodělali laparoskopickou resekci rekta současně s resekcí jaterních metastáz. U pacientů s vícečetnými metastázami jsme se zaměřili na odstranění povrchových metastáz; k destrukci intraparenchymatózních sekundárních nádorů byla multidisciplinárním týmem zvolena destrukce pomocí RFA.
Kazuistika 1
V době stanovení diagnózy 47letý pacient se zjištěným tumorem rekta v 10 cm, histologicky verifikován jako tubulární adenokarcinom G2. Dle provedeného MR pánve s podezřením na propagaci do perirektální tukové tkáně, CT břicha s obrazem metastáz bilobárně; největší v segmentu S2 (40x38 mm), další v segmentu S5, drobná ložiska susp. z metastáz v segmentech S6, S7/8, dále přítomny vícečetné nespecifické nodularity jater.
Pacient prošel multioborovou komisí s doporučením systémové chemoterapie a biologické léčby při pozitivní mutaci RAS. Po devíti cyklech chemoterapie a biol. léčby byla doplněna radioterapie na oblast rekta. Při restagingovém PET-MR byl primární tumor stacionární velikosti s lehkou regresí aktivity, nicméně došlo k metabolické a částečně velikostní progresi tří ložisek v S3, S4, S5 jater (21 mm, 14 mm, 8 mm respektive). Byla indikována operační revize zahrnující resekci tumoru a dostupných povrchových metastáz. Zbylá ložiska určena k ošetření radiofrekvenční ablací ve druhé době (Obr. 1).
Image 1. Vícečetné metastázy karcinomu rekta v játrech
Fig. 1: Multiple liver metastases of rectal cancer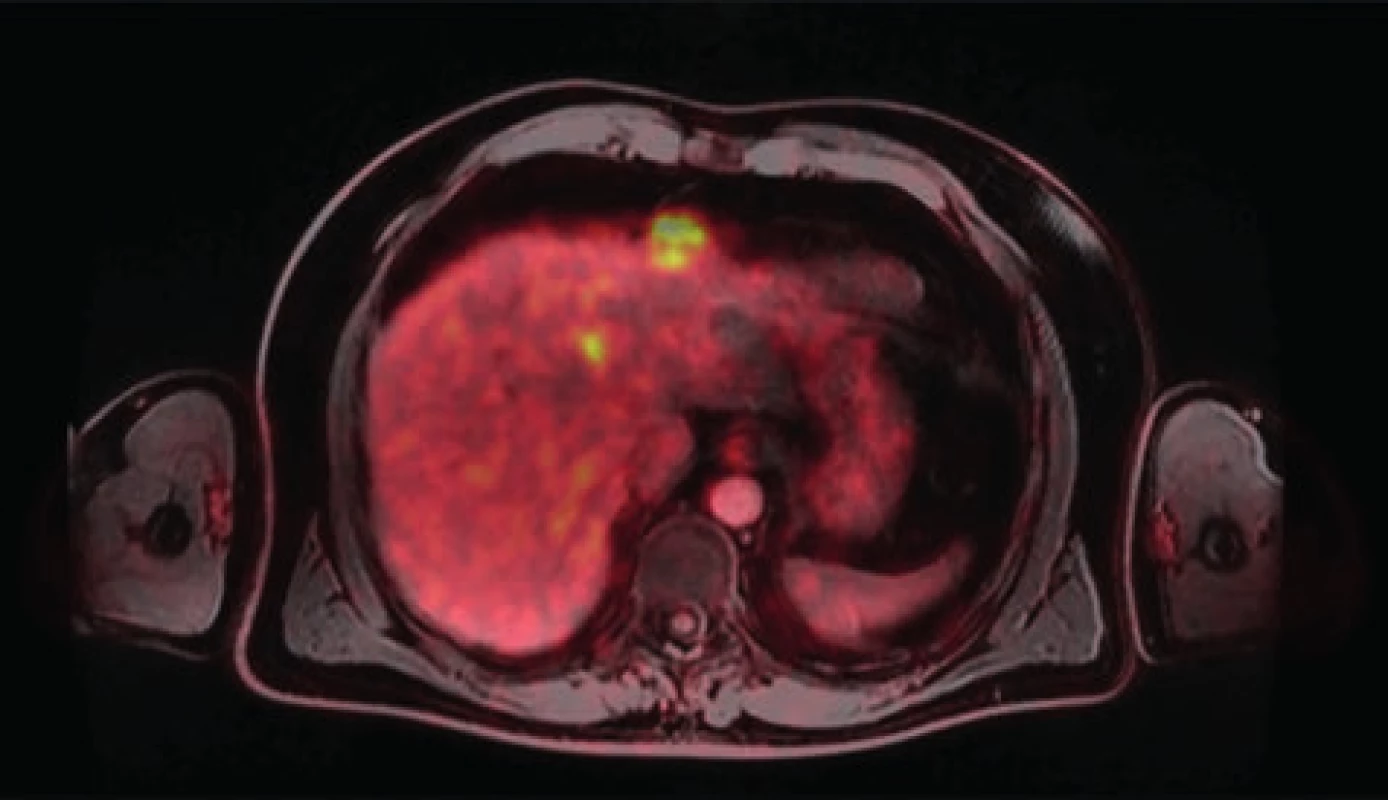
Deset měsíců od stanovení diagnózy byl proveden výkon v rozsahu atypické resekce metastázy v segmentu S3 jater. Výkon na játrech byl bez významného krvácení, bez oběhové nestability pacienta, bylo tedy možné následně provést laparoskopickou resekci rekta s TME (totální mezorektální excizí). Celkově trvala operace 6 hodin, bez významných ztrát krve. Pooperační průběh byl u pacienta komplikován protrahovaným nástupem peristaltiky, po obnovení pasáže a stabilizaci pacient dimitován. S odstupem 28 dnů od operace byl pacient opětovně přijat k RFA zbylých ložisek v játrech. Další den byla provedena ablace ložiska čtvrtého a pátého segmentu jater.
Histologicky byla v resekátu jater verifikována metastáza karcinomu intestinálního typu s bezpečným okrajem zdravé tkáně. V resekátu rekta byl potvrzen středně diferencovaný adenokarcinom infiltrující mezorektální tuk, s mírnou regresí po neoadjuvanci. Přítomných 5 pozitivních uzlin z 15 (typ T3, typ N2 a typ M1), resekční okraje bez přítomnosti malignity (vzdálenost od CRM 3 mm, od DRM 15 mm), kvalita TME 1. Po operaci a RFA přistoupeno k adjuvantní terapii kapecitabinem se zahájením 76 dnů od operace, nyní probíhá její 3. cyklus.
Kazuistika 2
64letý pacient s tumorem rekta ve 12 cm neprůchodným pro endoskop, způsobujícím poruchu pasáže. Dle stagingového PET-MR přítomna infiltrace mezorektální fascie vpravo, lymfadenopatie okolních lymfatických uzlin, 4 metastatická ložiska v jaterních segmentech − S8, dvě v S4b a S6. Po projednání multioborovou komisí doporučena systémová terapie se zajištěním průchodnosti trávicího traktu ileostomií.
Po 6 cyklech chemoterapie s biol. léčbou zjištěna přechodná regrese aktivity a velikosti metastáz v játrech, po doplněné radioterapii na oblast rekta však byla pozorována obnova původních jaterních lézí velikostně i metabolicky. Vzhledem k tomuto vývoji byla naplánována resekce rekta s resekcí povrchových metastáz; RFA zbylých ložisek k doplnění ve druhé době (Obr. 2).
Image 2. PET-MR obraz metastáz v segmentu S4
Fig. 2: PET-MR scan with two metastases in S4 segment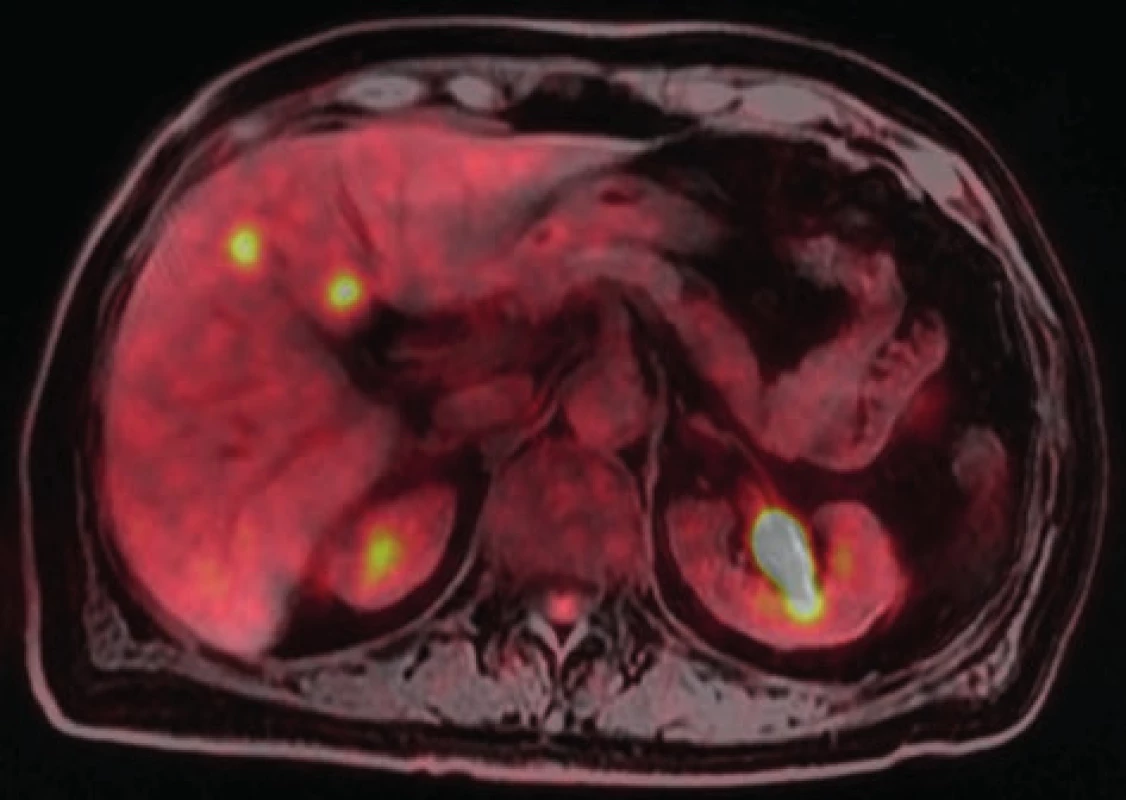
Během operačního výkonu byla provedena atypická resekce metastázy v S4b, které předcházela nutná cholecystektomie. Jaterní část výkonu proběhla bez komplikací, následně byla provedena resekce rekta. Výkon v délce 4 hodin proběhl s minimálními krevními ztrátami. Pooperační průběh byl bez komplikací, vzhledem k příznivému stavu pacienta konsenzuálně domluvena RFA zbývajících ložisek za téže hospitalizace. 9. pooperační den pak ablována zbývající tři metastatická ložiska. Pacient v dobrém stavu dimitován 19. pooperační den. Po operaci byl indikován k adjuvantní terapii, která nyní probíhá.
Histologicky byla potvrzena jaterní metastáza kolorekt. origa, v resekátu rekta klasifikován adenokarcinom typ T3 se střední regresí po neoadjuvanci, zastiženy 4 pozitivní lymfatické uzliny z 21 (typ N2). Resekční linie byly bez průkazu tumoru (vzdálenost tumoru od DRM 20 mm, od CRM 3 mm). Kvalita TME 1.
Závěr
Simultánní resekce synchronních jaterních metastáz a karcinomu rekta jsou diskutovanou variantou chirurgického postupu u čtvrtého stadia onemocnění. V době otevřené chirurgie sporadická a indikačně omezená možnost chirurgické intervence se při rozvoji minimálně invazivní chirurgie a rozšíření sofistikované technologie stala variantou s velkou perspektivou a obdobnými výsledky, jako mají etapové výkony; s výhodami plynoucími ze zkrácení doby hospitalizace a rychlejší chirurgické léčby. S výhodou lze využít kombinaci chirurgických resekcí s intervenčními metodami – RFA a metodami moderní radioterapie, které mohou rozšířit radikalitu výkonu se současným šetřením jaterního parenchymu. Přes všechny výhody a rozvoj tohoto přístupu zůstává simultánní resekce, vzhledem k její vysoké zátěži pro pacienta, vyhrazena citlivě a pečlivě vybraným jedincům s přihlédnutím k jejich celkovému zdravotnímu stavu. Postup léčby by měl vycházet ze shody v rámci mezioborové spolupráce.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
doc. MUDr. Igor Penka, CSc.
FN Brno
Jihlavská 340/20
Brno 625 00
e-mail: penka.igor@fnbrno.cz
Sources
1. Národní onkologický registr (NOR) | ÚZIS ČR. Available from: https://www.uzis.cz/registry-nzis/nor (accessed 14 Jun 2019).
2. Adam R, de Gramont A, Figueras J, et al. Managing synchronous liver metastases from colorectal cancer: a multidisciplinary international consensus. Cancer Treat Rev. 2015;41 : 729–41. doi:10.1016/j.ctrv.2015.06.006.
3. Oxenberg J, Papenfuss W, Esemuede I, et al. Multidisciplinary cancer conferences for gastrointestinal malignancies result in measureable treatment changes: a prospective study of 149 consecutive patients. Ann Surg Oncol. 2015;22 : 1533–9. doi:10.1245/s10434-014-4163-y.
4. Ejaz A, Semenov E, Spolverato G, et al. Synchronous primary colorectal and liver metastasis: impact of operative approach on clinical outcomes and hospital charges. HPB (Oxford) 2014;16 : 1117–26. doi:10.1111/hpb.12302.
5. van der Pool AE, de Wilt JH, Lalmahomed ZS, et al. Optimizing the outcome of surgery in patients with rectal cancer and synchronous liver metastases. Br J Surg. 2010;97 : 383–90. doi:10.1002/bjs.6947.
6. MERCURY Study Group. Diagnostic accuracy of preoperative magnetic resonance imaging in predicting curative resection of rectal cancer: prospective observational study. BMJ 2006;333 : 779. doi:10.1136/bmj.38937.646400.55.
7. Burdan F, Sudol-Szopinska I, Staroslawska E, et al. Magnetic resonance imaging and endorectal ultrasound for diagnosis of rectal lesions. Eur J Med Res. 2015;20 : 4. doi:10.1186/s40001-014-0078-0.
8. Glynne-Jones R, Wyrwicz L, Tiret E, et al. Rectal cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2018;29:iv263. doi:10.1093/annonc/mdy161.
9. Balyasnikova S, Brown G. Optimal imaging strategies for rectal cancer staging and ongoing management. Curr Treat Options Oncol. 2016;17 : 32. doi:10.1007/s11864-016-0403-7.
10. Huebner RH, Park KC, Shepherd JE, et al. A meta-analysis of the literature for whole-body FDG PET detection of recurrent colorectal cancer. J Nucl Med. 2000;41 : 1177–89.
11. Nicholson BD, Shinkins B, Pathiraja I, et al. Blood CEA levels for detecting recurrent colorectal cancer. Cochrane Database Syst Rev. 2015. doi:10.1002/14651858.CD011134.pub2.
12. Lehmann K, Rickenbacher A, Weber A, et al. Chemotherapy before liver resection of colorectal metastases: friend or foe? Ann Surg. 2012;255 : 237–47. doi:10.1097/SLA.0b013e3182356236.
13. Vandeweyer D, Neo EL, Chen JW, et al. Influence of resection margin on survival in hepatic resections for colorectal liver metastases. HPB (Oxford) 2009;11 : 499. doi:10.1111/j.1477-2574.2009.00092.x
14. Are C, Gonen M, Zazzali K, et al. The impact of margins on outcome after hepatic resection for colorectal metastasis. Ann Surg. 2007;246 : 295–300. doi:10.1097/SLA.0b013e31811ea962.
15. Belghiti J, Ogata S. Assessment of hepatic reserve for the indication of hepatic resection. J Hepatobiliary Pancreat Surg. 2005;12 : 1–3. doi:10.1007/s00534-004-0951-2.
16. Lambert LA, Colacchio TA, Barth RJ. Interval hepatic resection of colorectal metastases improves patient selection. Arch Surg. 2000;135 : 473–9; discussion 479−80.
17. Clancy C, O’Leary DP, Burke JP, et al. A meta-analysis to determine the oncological implications of conversion in laparoscopic colorectal cancer surgery. Colorectal Dis. 2015;17 : 482–90. doi:10.1111/codi.12875.
18. Montedori A, Cirocchi R, Farinella E, et al. Covering ileo - or colostomy in anterior resection for rectal carcinoma. Cochrane Database Syst Rev. 2010. doi:10.1002/14651858.CD006878.pub2
19. Meleagros L, Varty PP, Delrio P, et al. Influence of temporary faecal diversion on long-term survival after curative surgery for colorectal cancer. Br J Surg. 1995;82 : 21–5. doi:10.1002/bjs.1800820108
20. Vogt P, Raab R, Ringe B, et al. Resection of synchronous liver metastases from colorectal cancer. World J Surg. 1991;15 : 62–7.
21. Thelen A, Jonas S, Benckert C, et al. Simultaneous versus staged liver resection of synchronous liver metastases from colorectal cancer. Int J Colorectal Dis. 2007;22 : 1269–76. doi:10.1007/s00384-007-0286-.y.
22. Reddy SK, Pawlik TM, Zorzi D, et al. Simultaneous resections of colorectal cancer and synchronous liver metastases: a multi-institutional analysis. Ann Surg Oncol. 2007;14 : 3481–91. doi:10.1245/s10434-007-9522-5.
23. Nakajima K, Takahashi S, Saito N, et al. Predictive factors for anastomotic leakage after simultaneous resection of synchronous colorectal liver metastasis. J Gastrointest Surg. 2012;16 : 821–7. doi:10.1007/s11605-011-1782-5.
24. van der Poel MJ, Tanis PJ, Marsman HA, et al. Laparoscopic combined resection of liver metastases and colorectal cancer: a multicenter, case-matched study using propensity scores. Surg Endosc. 2019;33 : 1124–30. doi:10.1007/s00464-018-6371-1.
25. Ali SM, Pawlik TM, Rodriguez-Bigas MA, et al. Timing of surgical resection for curative colorectal cancer with liver metastasis. Ann Surg Oncol. 2018;25 : 32–7. doi:10.1245/s10434-016-5745-7.
26. Silberhumer GR, Paty PB, Temple LK, et al. Simultaneous resection for rectal cancer with synchronous liver metastasis is a safe procedure. Am J Surg. 2015;209 : 935–42. doi:10.1016/j.amjsurg.2014.09.024
27. Gavriilidis P, Sutcliffe RP, Hodson J, et al. Simultaneous versus delayed hepatectomy for synchronous colorectal liver metastases: a systematic review and meta-analysis. HPB (Oxford) 2018;20 : 11–9. doi:10.1016/j.hpb.2017.08.008.
28. Abelson JS, Michelassi F, Sun T, et al. Simultaneous resection for synchronous colorectal liver metastasis: The new standard of care? J Gastrointest Surg. 2017;21 : 975–82. doi:10.1007/s11605-017-3422-1.
29. Viganò L, Karoui M, Ferrero A, et al. Locally advanced mid/low rectal cancer with synchronous liver metastases. World J Surg. 2011;35 : 2788–95. doi:10.1007/s00268-011-1272-7.
30. Sabbagh C, Cosse C, Ravololoniaina T, et al. Oncological strategies for middle and low rectal cancer with synchronous liver metastases. Int J Surg. 2015;23 : 186–93. doi:10.1016/j.ijsu.2015.08.034.
31. Alexandrescu S, Diaconescu A, Ionel Z, et al. Comparative analysis between simultaneous resection and staged resection for synchronous colorectal liver metastases – a single center experience on 300 consecutive patients. Chirurgia (Bucur) 2017;112 : 278–88. doi:10.21614/chirurgia.112.3.278.
32. Muangkaew P, Cho JY, Han H-S, et al. Outcomes of simultaneous major liver resection and colorectal surgery for colorectal liver metastases. J Gastrointest Surg. 2016;20 : 554–63. doi:10.1007/s11605-015-2979-9.
33. Abitabile P, Hartl U, Lange J, et al. Radiofrequency ablation permits an effective treatment for colorectal liver metastasis. Eur J Surg Oncol. 2007;33 : 67–71. doi:10.1016/j.ejso.2006.10.040.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2019 Issue 10-
All articles in this issue
- Cesta k novým játrům: Decelularizace prasečích jater a jejich znovuosídlení buňkami
- Synchronní, do jater metastazující karcinom rekta a možnosti simultánní resekce
- Radiofrekvenční ablace jaterních metastáz kolorektálního karcinomu
- Léčba jaterních cyst – zkušenosti Chirurgické kliniky FN Plzeň 2009−2018
- Srovnání efektivity chirurgické intervence s terapií Cyberknife® v léčbě jaterních malignit
- Multidisciplinární tým v léčbě kolorektálního karcinomu – analýza vlastní sestavy nemocných za rok 2017
- Endovaskulárna liečba trombózy aorto-hepatického bypassu po transplantácii pečene
- Jaterní chirurgie 21. století
- Zemřel primář Otomar Rychnovský
- Odcházení
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Léčba jaterních cyst – zkušenosti Chirurgické kliniky FN Plzeň 2009−2018
- Srovnání efektivity chirurgické intervence s terapií Cyberknife® v léčbě jaterních malignit
- Radiofrekvenční ablace jaterních metastáz kolorektálního karcinomu
- Cesta k novým játrům: Decelularizace prasečích jater a jejich znovuosídlení buňkami
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

