-
Medical journals
- Career
Lymfatické metastazování očima patologa
Authors: K. Němejcová; P. Dundr
Authors‘ workplace: Ústav patologie 1. LF UK v Praze a VFN, přednosta: Doc. MUDr. P. Dundr, Ph. D.
Published in: Rozhl. Chir., 2014, roč. 93, č. 3, s. 164-169.
Category: Various Specialization
Práce byla podpořena Univerzitou Karlovou v Praze, projekt UNCE č. 204024 a PRVOUK-P27/LF1/.
Práce je určena k postgraduálnímu vzdělávání lékařů.Overview
Metastazování maligních nádorů do lymfatických uzlin je jeden ze základních typů šíření nádoru vyskytující se zejména u karcinomů, ale i u některých sarkomů. Vyšetření lymfatických uzlin je nepostradatelná součást chirurgického stagingu a ovlivňuje prognózu i léčbu pacienta. V následujícím textu jsou probrány obecné mechanismy metastazování a metody zpracování a vyšetření lymfatických uzlin včetně koncepce sentinelové uzliny.
Klíčová slova:
lymfatická uzlina – metastáza – mikrometastáza – sentinelová lymfatická uzlinaÚvod
Slovem metastáza, pocházejícím z řeckého μετα, změna a στασις, místo, se označuje dceřiné ložisko obvykle zhoubného nádoru nebo infekce. Některé nádory zakládají pouze jednu (solitární) metastázu, jiné metastázy vícečetné (mnohotné). Metastázy na více než třech místech nazýváme generalizací.
Metastazování je komplexní proces, který závisí na získávání specifických vlastností nádorových buněk v místě primárního nádoru, ale i v místě metastatického ložiska. V primárním nádoru se zejména vzhledem k častému výskytu chromozomální instability zvyšuje heterogenita nádorové populace se vznikem klonů buněk, které mohou získat schopnost invaze a zakládání metastáz. Metastázy tak mohou vzniknout i ve velmi časných stadiích nádoru. Většina nádorových buněk, které se dostanou do cirkulace, však metastázy nezakládá, pouze zlomky promile z těchto buněk jsou schopny vyústit v metastázy. Schopnost zakládat metastázy se liší nejen mezi různými typy maligních nádorů, ale i mezi nádory stejného histologického typu, lokality i stadia. Příčiny těchto rozdílů je zřejmě nutné hledat na molekulární úrovni. U epitelových nádorů (karcinomů) je zřejmě základním predisponujícím faktorem pro metastazování proces tzv. epiteliálně-mezenchymální tranzice. Epitelové buňky nabývají charakteristik buněk mezenchymových, dochází k poruše mezibuněčných vazeb zejména na podkladě ovlivnění E-cadherinu, buňky se stávají dyskohezivní, zvyšuje se jejich odolnost k apoptóze a schopnost pronikat přes bazální membránu. V místě založení metastázy zřejmě na podkladě ovlivnění lokálním mikroprostředím, ale i dalšími faktory naopak dochází k opačnému procesu tzv. mezenchymálně-epiteliální tranzice, kterým se zvyšuje schopnost nádorových buněk lokálně proliferovat [1]. Genetický podklad těchto procesů a biochemické pochody, které je provázejí, jsou v posledních letech intenzivně zkoumány na různých úrovních. Otázkou zůstává význam těchto pochodů u metastazování neepitelových nádorů. Obecně platí, že čím je nádor méně diferencovaný, tím je jeho metastatický rozsev pravděpodobnější. Nádorové metastazování se děje třemi základními způsoby, které se mohou kombinovat. Mezi tyto způsoby patří implantace nádoru v tělních dutinách (porogenní šíření), které nastává diseminací nádoru ležícího v blízkosti serózy, nebo na serózní povrchy prorůstajícího. Dále pak mají nádory schopnost prorůstat do cév a metastazují cestou krevní nebo lymfatickou. V následujícím textu se zaměříme pouze na problematiku metastazování cestou lymfatickou.
Lymfatické metastazování
Metastazování lymfatickou cestou je typické zejména pro karcinomy, i když se vyskytuje také u některých sarkomů. Odstranění lymfatických uzlin u maligních nádorů zejména epitelového původu (ale i některých jiných – např. maligního melanomu) je častou součástí diagnosticko-terapeutických postupů. Jejich správné vyšetření patologem je zásadní a ovlivňuje stanovení stadia onemocnění (staging) a tím prognózu i léčbu příslušného pacienta.
Nejčastěji se při stanovení stagingu používá systém TMN klasifikace. Tento systém je založen na posouzení charakteristik primárního nádoru, jeho šíření do regionálních lymfatických uzlin a přítomnosti nebo nepřítomnosti vzdálených metastáz (T – tumor, N – lymfatické uzliny, M – vzdálené metastázy). Karcinom in situ je zařazen jako stadium 0, nádory lokalizované v orgánu svého původu jsou zařazeny do stadia I a II, nádory lokálně pokročilé, zejména s metastázami do regionálních lymfatických uzlin, jako stadium III a nádory se vzdálenými metastázami jako stadium IV.
Stanovení TNM klasifikace může být provedeno klinikem na podkladě zobrazovacích vyšetření (cTNM), nebo patologem při bioptickém vyšetření (pTNM). V kategorii pN se hodnotí postižení regionálních lymfatických uzlin a rozsah takového postižení. Přímé šíření primárního nádoru do lymfatické uzliny se klasifikuje jako metastáza lymfatické uzliny. Metastáza v jiné lymfatické uzlině než regionální se hodnotí jako metastáza vzdálená [2]. U některých nádorů je kritériem pro klasifikaci pN nejen počet metastáz, ale i jejich velikost (nikoli tedy velikost celé postižené uzliny). Dle velikosti rozlišujeme metastázy na makrometastázy (větší než 2 mm) a mikrometastázy (0,2 mm až 2 mm). Biologickou charakteristikou, která odlišuje mikrometastázy od makrometastáz, je nepřítomnost cévního zásobení. Buňky mikrometastáz jsou plně závislé na difúzi živin a kyslíku z okolní tkáně, což omezuje jejich růst přibližně na 2 mm. Pokud dojde k novotvorbě cév v metastatické tkáni, mění se mikrometastáza na makrometastázu. Pokud jsou v lymfatické uzlině zastiženy pouze jednotlivé nádorové buňky nebo jejich malé skupiny nejvýše do velikosti 0,2 mm, nález hodnotíme jako izolované nádorové buňky (ITC). Jako doplňující kritérium ITC bylo navrženo, aby byl počet nádorových buněk ve skupině méně než 200 v jednom histologickém řezu. Pro ITC je charakteristické, že nevykazují známky metastatické aktivity (např. proliferaci či reakci stromatu) nebo penetraci skrze stěny cévních a mízních splavů. Většina těchto buněk je v G0 fázi buněčného cyklu, pouze velmi malé procento z nich přežívá a stává se zárodkem metastatického ložiska [3]. Případy s ITC v lymfatických uzlinách jsou klasifikovány jako pN0.
Klinický význam mikrometastáz a ITC v lymfatických uzlinách není zcela jednoznačný. Bylo provedeno mnoho studií zabývajících se touto problematikou u různých nádorů. U karcinomu prsu nebyla ve většině dosud provedených studií prokázána zcela jasná souvislost mezi přítomností mikrometastázy ani ITC (ani v sentinelové lymfatické uzlině) a horší prognózou nemoci [4,5]. Ojediněle se však objevují práce, které popisují zvýšené riziko rekurence (až 38 %) [6]. Stejně tak výsledky studií u pacientů s karcinomem žaludku a kolorektálního karcinomu jsou kontroverzní, dle některých mají mírně zhoršenou prognózu, většina však jednoznačný klinický význam neprokázala [7,8,9]. Ani význam mikrometastáz u pacientů s karcinomem plic dosud nebyl spolehlivě objasněn [10].
Významným prognostickým faktorem je celkový počet postižených lymfatických uzlin. V některých lokalitách však i přítomnost jediné uzlinové metastázy výrazně zhoršuje celkovou prognózu pacienta. Z tohoto důvodu je důležité při lymfadenektomii odstranit dostatečný počet lymfatických uzlin, aby nedošlo k falešně negativním výsledkům. Otázka dostatečného počtu odstraněných uzlin byla celosvětově diskutována a na základě randomizovaných studií byly v TMN klasifikaci pro většinu lokalit stanoveny minimální počty vyšetřených lymfatických uzlin [Tab. 1]. Nicméně z některých rozsáhlých retrospektivních studií vyplývá, že tzv. minimální počet vyšetřených uzlin neexistuje, a uzlin by tedy mělo být odstraněno a vyšetřeno co nejvíce je vzhledem k příslušné lokalitě možné [11,12].
Table 1. Minimální počet uzlin nutných pro staging v různých lokalitách Tab. 1: The minimal number of lymph nodes necessary for staging in various localities 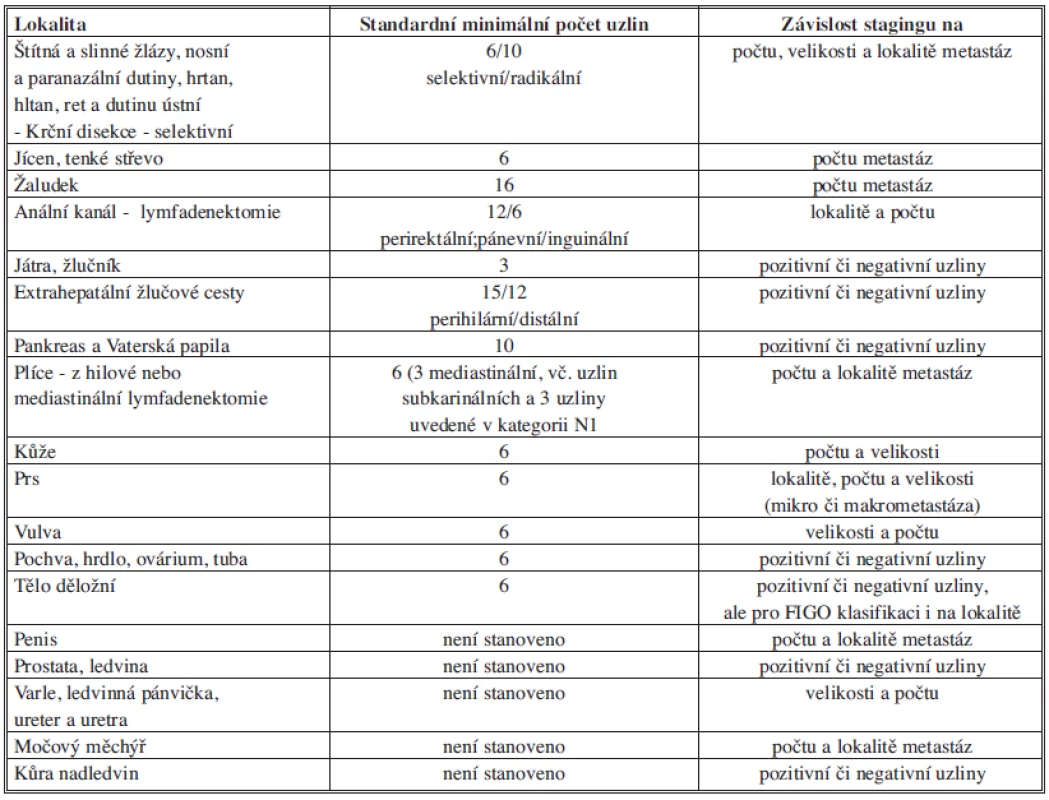
U některých nádorů je významným nepříznivým prognostickým faktorem nejen počet postižených uzlin, ale také velikost metastáz v jednotlivých uzlinách a zejména průnik nádorových buněk přes pouzdro uzliny do okolní tkáně. To má významný prognostický dopad zejména u uzlinových metastáz maligního melanomu, karcinomu prsu a u karcinomů hlavy a krku, u kterých v případě pozitivních regionálních uzlin s pronikáním přes pouzdro dokonce klesá pětileté přežití pod 20 %.
Dalším faktorem, který je nutno posoudit při hodnocení uzlinových metastáz, mohou být jednotlivá nádorová ložiska (satelity), tj. makroskopická nebo mikroskopická hnízda nebo uzly v oblasti lymfatické drenáže primárního nádoru bez histologických známek zbytku lymfatické uzliny v uzlu. Tato ložiska mohou představovat diskontinuální šíření nádoru, žilní invazi s extravaskulární šířením nebo lymfatickou uzlinu zcela nahrazenou nádorem. Např. v případně kolorektálního karcinomu, jsou-li tato ložiska nalezena u nádorů, které by jinak byly klasifikovány jako T1 či T2 (invaze do submukózy či postižení tunica muscularis propria), se klasifikace T nemění a uzel či uzly se hodnotí jako N1c. Je-li uzel patologem považován za zcela nahrazenou lymfatickou uzlinu nádorem (uzel má v tomto případě zpravidla hladký obrys), může být popsán jako pozitivní lymfatická uzlina a ne jako satelit.
Koncepce sentinelové uzliny
První lymfatická uzlina drénovaná z místa primárního nádoru se nazývá sentinelová uzlina. Termín sentinelová lymfatická uzlina (SLN) pravděpodobně poprvé užil E. A. Gould v roce 1960 v souvislosti s karcinomem příušní žlázy [13]. Za autora koncepce SLN a popularizace tohoto termínu je považován R. M. Cabanas, který se v roce 1977 ve své práci zabýval lymfatickou drenáží karcinomu penisu [14]. Sentinelových uzlin může být i několik a lze je u některých nádorů prokázat v průběhu operace nástřikem lymfatického svodu z oblasti nádoru lymfotropním barvivem (např. patentovou modří). Podobně lze využít některé radionuklidy (radiokoliod technecia) a SLN detekovat scintilační kamerou. Při postižení SLN uzliny mohou být nádorem postiženy i další svodné lymfatické uzliny a vyšetření SLN s ohledem na přítomnost či absenci metastázy tedy ovlivní rozhodování o rozsahu chirurgického zákroku. V některých případech však mohou nádorové buňky projít lymfatickými cestami, aniž zakládají metastázy v bezprostředních (sentinelových) uzlinách v okolí nádoru. Zachytí se až ve vzdálenějších uzlinách v primárním lymfatickém spádu – vznikají tzv. přeskakující („skip“) metastázy. To může komplikovat situaci s diagnostikou SLN např. u karcinomů žaludku či jazyka. Koncept SLN byl použit v mnoha různých lokalizacích, např. u karcinomu štítné žlázy, vulvy, jazyka, jícnu, žaludku, plic, tlustého střeva a rekta, prsu, karcinomů ženského genitálu i prostaty. Ve většině těchto lokalit jsou detekce a vyšetření SLN považovány za experimentální metodu, na jejímž základě nelze ovlivnit rozsah prováděného chirurgického zákroku. U některých nádorů, zejména karcinomu prsu a maligního melanomu, však patří vyšetření SLN mezi standardní uznávané postupy a při negativitě tohoto vyšetření se lze vyhnout zbytečné lymfadenektomii a s ní spojenými komplikacemi. Metoda vyšetření SLN byla nejprve zavedena do praxe u maligního melanomu, u kterého bylo prokázáno, že po hodnocení tloušťky nádoru (dle Breslowa) je stav této uzliny druhým nejvýznamnějším prognostickým faktorem. Pětileté přežití u nemocných s pozitivními SLN se pohybuje okolo 50–55 %, zatímco u pacientů s negativními uzlinami dosahuje až 90 %. Také období do relapsu je u nemocných s prokázanými metastázami v SLN významně kratší [15].
U karcinomů žaludku má metoda vyšetření SLN řadu rizik, spočívajících zejména ve složitosti lymfatického systému, častém výskytu uzlinových mikrometastáz a nízké senzitivitě peroperačního histologického vyšetření. Proto je nutné ji stále považovat za experimentální a při radikální resekci žaludku pro karcinom tedy nelze na základě vyšetření SLN od lymfadenektomie ustoupit.
U karcinomu prostaty je v současnosti vyšetření SLN pouze doplňkem pánevní lymfadenektomie, zpřesňujícím staging, s vyšším záchytem mikrometastáz, což vede k posunu ve stagingu onemocnění. Rozvoji metody dosud brání nízká senzitivita peroperačního vyšetření při detekci mikrometastáz [16].
U karcinomů tlustého střeva a rekta mají dosud provedené studie poněkud rozporuplné výsledky, většina studií sice udává vysoké procento záchytu lymfatických uzlin, ale zároveň uvádí i různě vysoké riziko falešně negativních výsledků, a bude proto nutné provést další studie k ozřejmění těchto nesrovnalostí [17,18].
U karcinomů ženského genitálu se v současné době vyšetření SLN provádí u karcinomů vulvy a děložního hrdla, kde však není detekcí sentinelové uzliny vyloučena indikace systematické pánevní lymfadenektomie. Negativita SLN však dle některých novějších studií umožní redukovat radikalitu operace. V ostatních lokalitách ženského genitálu má metoda opět jen experimentální charakter.
U nádorů hlavy a krku se jedná o poměrně obtížnou oblast, je zde cca 25% riziko jak falešně pozitivních, tak i negativních nálezů, ve více než 10 % případů bývají přítomny mnohočetné sentinelové uzliny a kolem 20 % sentinelových uzlin se nachází mimo klasické spádové oblasti.
Dalším problémem v této lokalitě je způsob aplikace barviva nebo radionuklidu, který závisí na typu a umístění nádoru. V oblasti hlavy a krku mohou primární nádor a uzlina ležet často velmi blízko sebe a rozlišení primárního nádoru a uzliny gammakamerou nebo scintilační sondou může být prakticky nemožné. V těchto případech může napomoci vitální barvivo, ale i zde může přebarvení difúzí identifikaci prakticky znemožnit.
Výsledky studií s využitím SLN u karcinomů štítné žlázy se zatím dle některých studií jeví jako velmi slibné, nejsou však zatím jednoznačné důkazy, že by metoda mohla být využitelná z hlediska dlouhodobého přežití pacienta [19]. Další studie ovšem popisují, že tato metoda je limitována nízkou senzitivitou a vyšším počtem falešně negativních výsledků [20].
Způsob vyšetření sentinelové uzliny
Pokud jde o vlastní techniku zpracování sentinelové uzliny, nejsou v současné době dostupné závazné standardy a postupy se mezi jednotlivými pracovišti poměrně výrazně liší. Navíc existují odlišné protokoly pro zpracování i s ohledem na diagnózu (orgán). Některá pracoviště zejména např. v USA provádějí vyšetření sentinelové uzliny dle postupu zahrnujícího zablokování celé uzliny v lamelách šíře 2 mm a vyšetření pouze řezu barveného hematoxylin-eozinem, bez následného prokrajování tkáně či využití dalších metod. Toto zpracování zajistí detekci metastáz [21]. Častý je však určitý stupeň sériového prokrajování tkáně s využitím imunohistochemických metod. Využitím imunohistochemických metod dochází ke zvýšení záchytu metastáz v sentinelové uzlině dle literárních zdrojů o 2–20 %, průměrně o 11 % [22,23]. Vyšetření sentinelové lymfatické uzliny je často prováděno peroperačně metodou zmrazeného řezu. Při negativním nálezu jsou po fixaci materiálu vzorky dále zpracovány dle protokolu. Metoda peroperačního vyšetření sentinelové uzliny má výhodu v možnosti provedení kompletní systematické lymfadenektomie v případě pozitivity uzliny ještě v jedné době, má však i své limitace. Problémem je zejména nízká senzitivita. Peroperační hodnocení sentinelové uzliny je většinou prováděné pouze za pomoci barvení hematoxylin-eosinem a je nutné počítat s 20–30% falešnou negativitou. Nízká senzitivita souvisí zejména s množstvím peroperačně vyšetřené tkáně. Např. u lymfatické uzliny velikosti 5 mm, kterou vyšetříme jedním řezem tloušťky 5 μm, tento řez obsáhne pouze 0,1 % objemu této uzliny. Dalším předpokládaným rizikem při vyšetření ze zmrazených řezů byla i ztráta materiálu při skrojení tkáně, recentní práce však prokázala, že u většiny používaných protokolů naopak paradoxně (vzhledem k prokrojení tkáně) dochází ke zvýšení senzitivity vyšetření [24].
Počet lymfatických uzlin a rozsah lymfadenektomie
Obecně závisí počet zastižených a vyšetřených lymfatických uzlin na mnoha faktorech. Mezi tyto faktory patří věk pacienta (starší pacienti mívají menší lymfatické uzliny a také mohou podstupovat méně extenzivní chirurgické zákroky). Dále může být počet uzlin ovlivněný předchozím léčením radiací či chemoterapií s redukcí velikosti a počtu uzlin. Dalším faktorem je imunitní stav pacienta, kdy při některých systémových onemocněních může dojít ke zvětšení lymfatických uzlin (např. chronický zánět či infekce), nebo naopak ke zmenšení uzlin u imunodeficientních pacientů. V neposlední řadě se počet lymfatických uzlin odvíjí od rozsahu chirurgického zákroku. Při standardních zákrocích zaměřených na příslušné skupiny lymfatických uzlin se bezpochyby také uplatní zkušenost operatéra.
Ze strany patologa mohou ovlivnit počet zastižených uzlin zkušenosti a také technika zpracování materiálu. Při použití speciálních fixativ k projasnění a znázornění lymfatických uzlin obsahujících kyselinu octovou (Carnoy, Methacarn) mohou být lépe detekovatelné i velmi malé lymfatické uzliny, ve kterých se však metastázy mohou také vyskytovat. Počet odstraněných lymfatických uzlin je důležitým kvalitativním ukazatelem chirurgického zákroku a také správného zpracování tkáně patologem.
O radikalitě výkonu a rozsahu disekce lymfatických uzlin a jejich významu pro pacienta v některých lokalitách se vedou stále diskuze. U karcinomů žaludku není o významu lymfadenektomie pro staging sporu. Na základě rozporuplných výsledků studií zejména mezi japonskými a evropskými a americkými centry je však zpochybňován terapeutický efekt rozšířené versus D1 či D2 lymfadenektomie s přímým ovlivněním délky přežívání pacienta (D1 – disekce uzlin podél obou žaludečních kurvatur, D2 – disekce uzlin I. i II. kompartmentu) [25,26].
U karcinomů pankreatu nebyl dosud zcela jasně prokázán výrazný rozdíl v přežití při standardní či rozšířené disekci lymfatických uzlin [27,28].
U nádorů hlavy a krku se podle rozsahu dělí disekce lymfatických uzlin na blokové disekce kompletní (oblast I až V) a selektivní (jedna nebo více oblastí jsou vynechány). Dále se dělí na modifikované a radikální, podle toho, jak se chovají k nelymfatickým strukturám krku (n. accessorius, v. jugularis a m. sternocleidomastoideus). V oblasti krční chirurgie se stále vedou diskuze o indikaci selektivních blokových disekcí u N1, obzvláště pokud je postižena pouze jediná uzlina [29].
U nádorů ženského genitálu byla z hlediska významu a rozsahu lymfadenektomie provedena celá řada studií. U karcinomu vulvy je v současné době dle TNM klasifikace doporučováno vyjmutí alespoň 6 inguinofemorálních uzlin, což ale bývá spojeno s častými komplikacemi. Těmto komplikacím se lze vyhnout pomocí disekce sentinelové uzliny, kdy u pacientek s negativní sentinelovou uzlinou nemusí být disekce tříselných uzlin prováděna [30]. U karcinomů děložního čípku patří metastatické postižení pánevních lymfatických uzlin mezi významný prognostický faktor, který snižuje 5leté přežití pacientek na 50 % a v případě postižení paraaortálních lymfatik klesá 5leté přežití na 20 % [31]. Minimální počet lymfatických uzlin k možnému hodnocení kategorie N v TNM klasifikaci byl u karcinomů čípku s ohledem na rozvojové země stanoven na 10 uzlin, za standardní chirurgický staging se však považuje 20 a více lymfatických uzlin. Význam lymfadenektomie byl posuzován i u karcinomů endometria. Současným doporučením je pro nádory omezené na endometrium či postihující méně než polovinu myometria (stadium FIGO 1A , TNM T1a) provádět pouze standardní chirurgický zákrok bez lymfadenektomie a lymfadenektomie provádět pouze u vysoce rizikových případů tohoto stadia [32].
Závěr
Vyšetření lymfatických uzlin je u některých nádorů nepostradatelnou součástí chirurgického stagingu, který ovlivňuje prognózu i léčbu pacienta. Významným prognostickým faktorem je zejména počet vyšetřených a postižených lymfatických uzlin. Obecně platí, že by mělo být vyšetřeno uzlin co nejvíce, nicméně v TMN klasifikaci byly pro většinu lokalit stanoveny minimální počty vyšetřených uzlin. V některých lokalitách hraje významnou roli i velikost metastáz, přičemž klinický význam mikrometastáz a ITC v lymfatických uzlinách není dosud zcela jednoznačný. Vyšetření SNL patří u některých nádorů, zejména karcinomu prsu a maligního melanomu, mezi standardní uznávané postupy. V řadě lokalit je však stále považováno za experimentální metodu, na jejímž základě nelze ovlivnit rozsah prováděného chirurgického zákroku. Vzhledem k tomu, že v současné době probíhá celá řada studií zabývajících se významem vyšetření SNL v různých lokalitách, významem mikrometastáz a ITC, v některých studiích s možností využití metod molekulární biologie, lze v budoucnu očekávat posun zejména v těchto směrech.
MUDr. Kristýna Němejcová
Ústav patologie 1. LF UK v Praze a VFN
Studničkova 2
128 00 Praha 2
e-mail: kristyna.nemejcova@vfn.cz
Sources
1. Kalluri R, Neilson EG. The basics of epithelial-mesenchymal transition. J Clin Invest 2009;119 : 1420–1428.
2. Sobin LH, Gospodarowicz MK, Wittekind Ch. TNM Classification of Malignant Tumours, 7th Edition 2009, česká verze 2011.
3. Tomášek J, Vyzula R, Coufal O, Rejthar A, Kiss I. Mikrometastázy a volné nádorové buňky, metody detekce, význam vyšetření u kolorektálního karcinomu, Klinická onkologie 2002;15 : 203–206.
4. Strnad P, Rob L, Škapa P, Stankušová H, Michalová K, et al. Prognóza žen s mikrometastázou karcinomu prsu v sentinelové uzlině. Prakt Gyn 2009;13 : 218–223.
5. Houvenaeghel G, Cohen M, Bannier M, Buttarelli M, Jauffret C, et al. Micrometastasis: biological entity and clinical impact? Bull Cancer 2013;100 : 351–356.
6. Van der Heiden-van der Loo M, Schaapveld M, Ho VK, Siesling S, Rutgers EJ, et al. Outcomes of a population-based series of early breast cancer patients with micrometastases and isolated tumour cells in axillary lymph nodes. Ann Oncol 2013; Jul 17. [Epub ahead of print]
7. Fujimura T, Tsukada T, Kinoshita J, Oyama K, Fushida, S, et al. Lymph node micrometastases in gastric cancer. Nihon Geka Gakkai Zasshi 2013;114 : 13–16.
8. Yamamoto H, Doki Y, Mori M. Lymph node micrometastases in colorectal cancer. Nihon Geka Gakkai Zasshi 2013;114 : 17–21.
9. Märkl B, Herbst C, Cacchi C, Schaller T, Krammer I, et al. Prognostic significance of histologically detected lymph node micrometastases of sizes between 0.2 and 2 mm in colorectal cancer. Int J Colorectal Dis 2013;28 : 977–983.
10. Osaki T, Yasumoto K. Clinical significance of micrometastases in the lymph nodes of patients with resectable lung cancer. Nihon Geka Gakkai Zasshi 2013;114 : 28–33.
11. Cserni G, Vinh-Hung V, Burzykowski T. Is there a minimum number of lymph nodes that should be histologically assessed for a reliable nodal staging of T3N0M0 colorectal carcinomas? J Surg Oncol 2002;81 : 63–69.
12. Goldstein NS. Lymph node recoveries from 2427 pT3 colorectal resection specimens spanning 45 years: recommendations for a minimum number of recovered lymph nodes based on predictive probabilities. Am J Surg Pathol 2002;26 : 179–189.
13. Gould EA, Winship T, Philbin PH, Kerr HH. Observations on a “sentinel node” in cancer 99 of the parotid. Cancer 1960;13 : 77–78.
14. Cabanas RM. An approach for the treatment of penile carcinoma. Cancer 1977;39 : 456–466.
15. Krajsová I, Vítková I, Šuk J. Sentinelová uzlina – význam vyšetření u pacientů s melanomem. In: Dermatovenerologie, dětská dermatologie a korektivní dermatologie 2006/07 kolektiv autorů. Trendy v medicíně. Praha, Triton 2006 : 69–76.
16. Staník M, Čapák I, Macík D. Vyšetření sentinelové uzliny u karcinomu prostaty – mapování primární lymfatické drenáže a zhodnocení přínosu pro staging onemocnění. Ces Urol 2013;17 : 42–50.
17. Redston M, Compton CC, Miedema BW, et al. Analysis of micrometastatic disease in sentinel lymph nodes from resectable colon cancer: Results of Cancer and Leukemia Group B trial 80001. J Clin Oncol 2006;24 : 878–883.
18. Bertagnolli M, Miedema B, Redston M, et al. Sentinel node staging of resectable colon cancer: Results of a multicenter study. Ann Surg 2004;240 : 624–630.
19. Roh JL, Koch WM. Role of sentinel lymph node biopsy in thyroid cancer. Expert Rev Anticancer Ther 2010;10 : 1429–1437.
20. Ji YB, Lee KJ, Park YS, Hong SM, Paik SS, at al. Clinical efficacy of sentinel lymph node biopsy using methylene blue dye in clinically node-negative papillary thyroid carcinoma. Ann Surg Oncol 2012;19 : 1868–1873.
21. Weaver DL. Pathology evaluation of sentinel lymph nodes in breast cancer: protocol recommendations and rationale. Mod Pathol 2010;23:S26–32.
22. De Hullu JA, Hollema H, Piers DA. Sentinel lymph node procedure is highly accurate in squamous cell carcinoma of the vulva. J Clin Oncol 2000;18 : 2811–2816.
23. Terada KY, Schimizu DM, Wong JH. Sentinel node dissection and ultrastaging in squamous cell cancer of the vulva. Gynecol Oncol 2000;76 : 40–44.
24. Madsen EV, van Dalen J, van Gorp, J, et al. Frozen section analysis of sentinel lymph nodes in patients with breast cancer does not impair the probability to detect lymph node metastases. Virchows Arch 2012;460 : 69–76.
25. Kitagawa Y, Ando N, Ozawa S, et al. Appropriate extent of lymphadenectomy in esophageal cancer. Nippon Geka Gakkai Zasshi 2001;102 : 477–483.
26. Miwa K. Optimal nodal dissection for early gastric cancer. Nippon Geka Gakkai Zasshi 2001;102 : 484–489.
27. Mukaiya M, Hirata, K, Satoh T, et al. Lack of survival benefit of extended lymph node dissection for ductal adenocarcinoma of the head of the pancreas: Retrospective multinstitutional analysis in Japan. World J Surg 1998;22 : 248–252.
28. Henne-Bruns D, Vogel I, Luttges, J, et al. Surgery for ductal adenocarcinoma of the pancreatic head: staging, complications, and survival after regional versus extended lymphadenectomy. World J Surg 2000;24 : 595–601.
29. Medina JE. Role of Elective Neck Dissection for the N0 Neck. In PENSAK, ML. Controversies in Otolaryngology. New York, Thieme 2001;476.
30. Van der Zee AG, Oonk MH, De Hullu JA, et al. Sentinel node dissection is safe in the treatment of early-stage vulvar cancer. J Clin Oncol 2008;26 : 884–889.
31. Delgado G, Bundy B, Zaino R, Sevin B, Creasman WT, et al. Prospective surgical-pathologic study of disease-free interval in patients with stage Ib squamous carcinoma of the cervix. Gynecologic Oncology 1990;38 : 352–357.
32. ASTEC study group: Kitchener H, Swart AM, et al. Efficacy of systematic pelvic lymphadenectomy in endometrial cancer (MRC ASTEC trial): A randomised study. Lancet 2009;373 : 125–136.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2014 Issue 3-
All articles in this issue
- Problematika diferenciální diagnostiky primárních nádorů jater
- Organizace a využívání tkáňové banky nádorů
- Poranenia extenzorového aparátu v zóne I – mallet deformita
- Analýza komplikací a klinicko-patologických faktorů ve vztahu k laparoskopické cholecystektomii
- Standardizace patologického vyšetření resekátu pankreatu
- Sagitální typ bércové amputace u pacientů se syndromem diabetické nohy
- GIST tenkého střeva v terénu neurofibromatózy jako zdroj masivního krvácení
- Patologická tekutinová kolekce mezenteria, diferenciální diagnostika mezenteriální cysty – kazuistika
- Obecné zásady práce s resekovanými tkáněmi a orgány určenými pro histopatologické vyšetření – požadavky patologů na chirurgy
- Lymfatické metastazování očima patologa
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Lymfatické metastazování očima patologa
- Patologická tekutinová kolekce mezenteria, diferenciální diagnostika mezenteriální cysty – kazuistika
- Sagitální typ bércové amputace u pacientů se syndromem diabetické nohy
- Poranenia extenzorového aparátu v zóne I – mallet deformita
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

