-
Medical journals
- Career
Kombinovaný výkon plicní resekce a radiofrekvenční ablace nádorů plic – kazuistiky
Authors: V. Šimánek 1; J. Klečka 2; V. Třeška 1; M. Pešek 1; V. Bednářová 1
Authors‘ workplace: Chirurgická klinika FN Plzeň, přednosta: prof. MUDr. V. Třeška, DrSc. 1; Klinika tuberkulózy a respiračních nemocí FN Plzeň, přednosta: Prof. MUDr. M. Pešek, CSc. 2
Published in: Rozhl. Chir., 2013, roč. 92, č. 4, s. 205-208.
Category: Case Report
Práce je věnována významnému životnímu jubileu prof. MUDr. Jiřího Valenty, DrSc.
Práce byla podpořena projektem výzkumu a vývoje IGA MZ č. NS/9729-4 a výzkumným záměrem Univerzity Karlovy PS 36.Overview
Autoři popisují formou 2 kazustik možnost kombinovaného výkonu při řešení nádorů plic u pacientů, kteří nejsou indikováni k radikálnímu chirurgickému zákroku. Spojením paliativní plicní resekce a radiofrekvenční ablace se tak otevírá další možnost na kvalitní prodloužení aktivního života.
Klíčová slova:
plicní resekce – plicní karcinom – metastáza do plic – radiofrekvenční ablaceÚvod
Primární i sekundární maligní nádory plic jsou indikovány k radikální chirurgické léčbě. Plicní resekce i torakotomie se řadí mezi větší chirurgické zákroky, které pacienty zatěžují. Asi 2/3 pacientů s primárním nemalobuněčným plicním karcinomem (NSCLC) nejsou indikovány k radikálnímu výkonu pro závažné komorbidity, velikost a lokalizaci nádoru. Vzhledem k tomu, že plíce jsou druhým nejčastějším orgánem postiženým metastázami, dochází v současnosti při zvýšené úspěšnosti léčby primárních nádorů k rozšiřování počtu pacientů s metastatickým postižením plic. Jako metoda volby u pacientů kontraindikovaných k radikální plicní resekci se nabízí radiofrekvenční ablace. Tato metoda byla poprvé použita při ošetření plicního ložiska v roce 1983. Princip radiofrekvenční ablace je založen na účinku střídavého proudu o frekvenci 460 kHz a výkonu 50 až 200 W při zavedení speciální sondy do plicního parenchymu. V okolí sondy dochází k iontové agitaci a k rázovým vzestupům teploty. Teplota kolem 50 °C znamená sférickou koagulační nekrózu plicní tkáně včetně nádorového ložiska, přičemž k enzymatickým a strukturálním změnám buněk dochází již při teplotě 42 °C. Nejlepší výsledky jsou dosaženy u ložisek velikosti méně než 3 cm. Jako nonablaci označujeme stav, kdy v blízkosti velkých cév v důsledku ochlazování proudem krve není dosaženo kompletní koagulační nekrózy tkáně [1,2]. RFA sondu můžeme zavádět do plicního parenchymu jak peroperačně (torakotomie, torakoskopie), tak pod CT kontrolou. Především perkutánní přístup je vhodný pro minimální zátěž pacienta zejména při použití v lokální anestezii v kombinaci s analgosedací. Schneider popsal při hodnocení imunohistochemických preparátů 38% úspěšnost a navrhuje použití RFA plic pouze jako paliativní metodu [3].
Kazuistika 1
55letý polymorbidní pacient s těžkým syndromem spánkové apnoe obstrukčního charakteru v roce 2003 po amputaci rekta dle Milese pro nediferencovaný adenokarcinom a s následnou chemoaktinoterapií. Při kontrole plicním lékařem vysloveno podezření na 2 ložiska v oblasti pravé plíce. Provedeno CT plic s nálezem kulovitého ložiska velikosti 30 mm v S2 a ložiska velikosti 17 mm v S9 pravé plíce (Obr. 1). Provedené bronchoskopické vyšetření s odběrem biopsie z ložiska v dolním laloku (S9) pravé plíce, mikroskopický nález adenokarcinomu, přičemž nebylo jednoznačné, že se jedná o metastázu kolorektálního karcinomu. Pneumologem stav hodnocen jako možný primární karcinom horního laloku pravé plíce s metastázou do laloku dolního. Pacient indikován k operačnímu řešení, provedena explorativní torakotomie s klínovitou resekcí ložiska v horním laloku pravé plíce. Peroperačně vzorek hodnocen jako metastáza kolorektálního karcinomu. Ložisko v dolním laloku pravé plíce destruováno po zavedení jehly radiofrekvenční termální ablací. V dalším průběhu pacient afebrilní, oběhově i ventilačně stabilní, hrudní drén odstraněn. Na kontrolním PET/CT plic se zobrazila kompletní nekróza ložiska po RFA, pravá plíce s plášťovým pneumotoraxem. Pacient propuštěn z hospitalizace 20. pooperační den v dobrém stavu. Dále byl dispenzarizován spádovým onkologem (Obr. 2).
Image 1. Předoperační CT plic – ložisko v S2 pravé plíce Fig. 1: Preoperative lung CT scan – a focus in the right lung S2 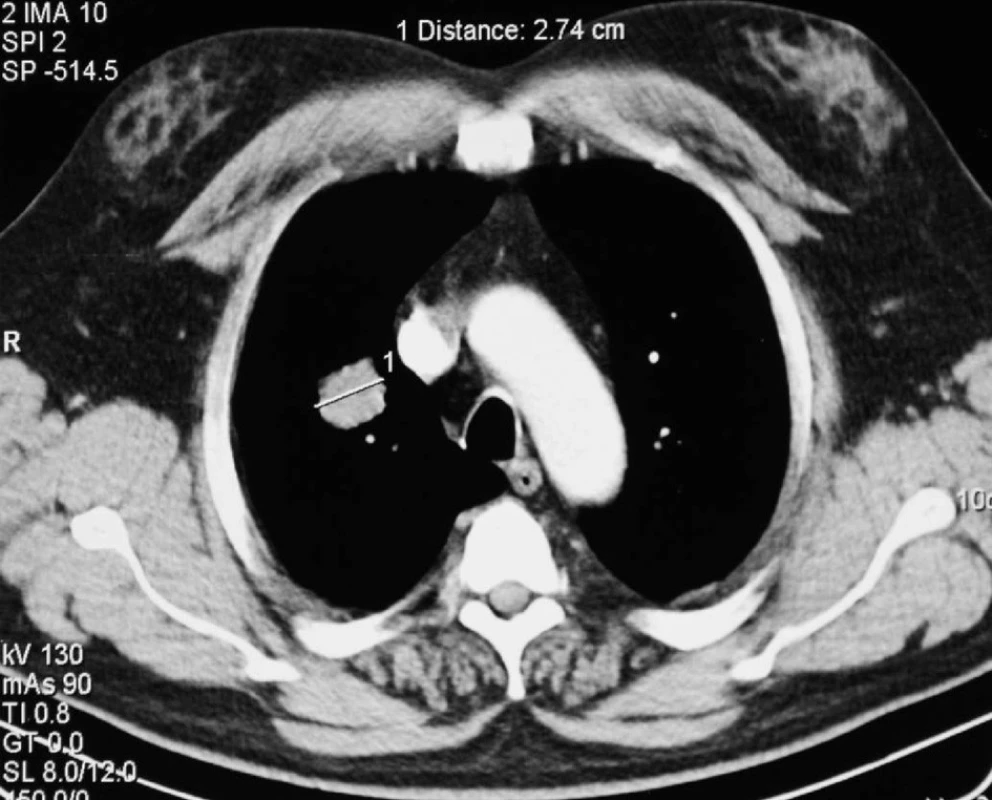
Image 2. CT plic po provedení RFA ložiska v dolním laloku pravé plíce neprokazuje známky viabilní neoplazie Fig. 2: CT after RFAof the foci in the lower lobe of the right lung does not show signs of viable neoplasm 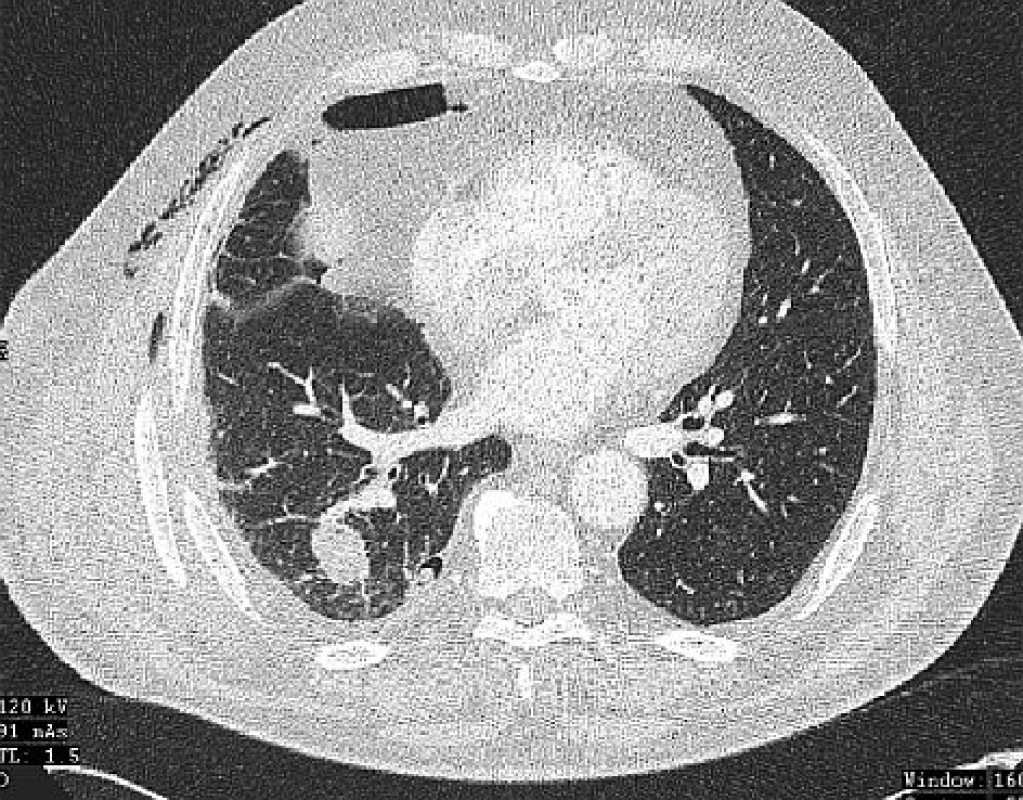
Kazuistika 2
73letá pacientka s ventilační poruchou anamnesticky po operaci invazivně rostoucího duktálního karcinomu pravého prsu bez postižení spádových lymfatických uzlin v roce 1993. Při pravidelné kontrole prokázáno ložisko v horním laloku pravé plíce. Bronchoskopicky stenóza subsegmentů pravého horního plicního laloku, brushing z této lokalizace prokázal maligní elementy vzhledu adenokarcinomu. Provedeno CT plic s nálezem 30mm ložiska v horním laloku a 26mm ložiska v dolním laloku pravé plíce (Obr. 3). Pacientka vzhledem k ventilačním poměrům neúnosná k pravostranné pneumonektomii. Provedena explorativní torakotomie a horní lobektomie vpravo s radiofrekvenční ablací ložiska v dolním plicním laloku. Patolog prokázal v resekátu horního laloku pravé plíce ložisko adenokarcinomu, které po histologickém porovnání s původním nálezem adenokarcinomu prsu hodnotil jako primárně plicní, jednalo se tudíž o nádorovou duplicitu. V dalším průběhu pacientka afebrilní, pro přetrvávající pneumotorax vpravo založena 3. pooperační den hrudní drenáž, nutná opakovaná bronchoskopická sanace dýchacích cest. Pacientka přeložena na plicní kliniku 10. pooperační den. V průběhu další hospitalizace přeléčen herpes simplex rtu a soor v dutině ústní, scintigraficky prokázána čerstvá embolizace plicnice vlevo, nasazen nízkomolekulární heparin s převodem na antikoagulační léčbu. Do domácího ošetřování propuštěna 22. pooperační den. Ambulantně aplikována chemoterapie (Taxol+carboplatina), kterou pacientka dobře tolerovala. Kontrolní CT plic v odstupu 3 měsíců prokázalo regresi ložiska v dolním plicním laloku vpravo (Obr. 4). PET/CT plic bylo provedeno s odstupem 7 měsíců od operačního zákroku, neprokázalo viabilní ložisko v pravé plíci. Pacientka dispenzarizována pneumologem, 4 roky po operaci na kontrolním CT plic prokázána progrese ložiska v dolním laloku pravé plíce (Obr. 5). Pneumolog po konzultaci s onkologem indikoval radioterapii 30 Gy. V dalším průběhu pacientka při dispenzarizaci bez známek progrese ložiska, kontrolní CT plic s odstupem 6 měsíců po radioterapii bez progrese, pouze nález postiradiační fibrózy (Obr. 6).
Image 3. CT plic před provedením RFA – tumor v dolním laloku pravé plíce Fig. 3: Lung CT before RFA – tumour in the lower lobe of the right lung 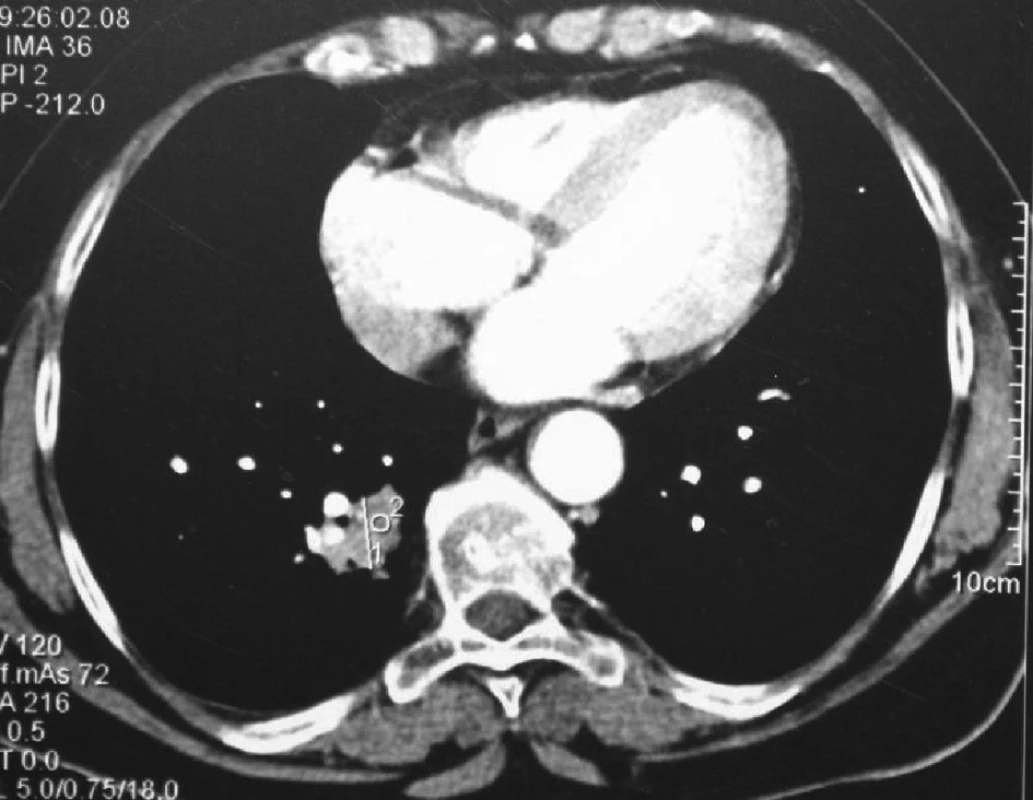
Image 4. CT plic 3 měsíce po RFA ložiska v dolním plicním laloku vpravo Fig. 4: Lung CT 3 months after RFA of the focus in the lower right lung lobe 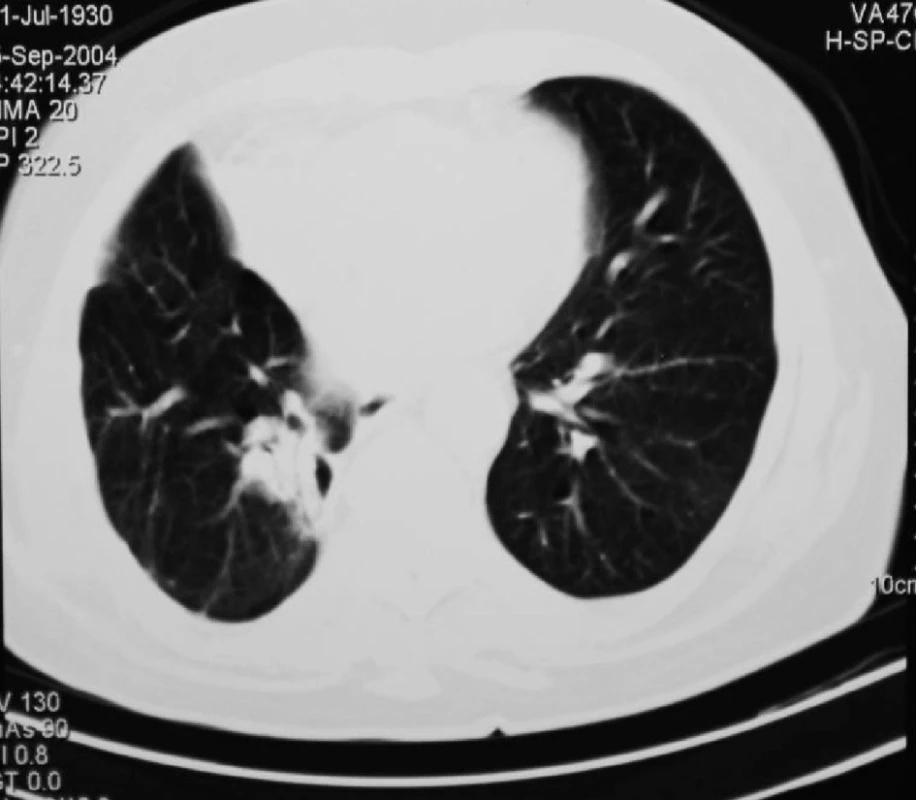
Image 5. CT plic s ložiskem recidivy karcinomu v dolním laloku pravé plíce (4 roky po operaci) Fig. 5: Lung CT showing lung cancer recurrence with a focus in the lower lobe of the right lung (4 years after surgery) 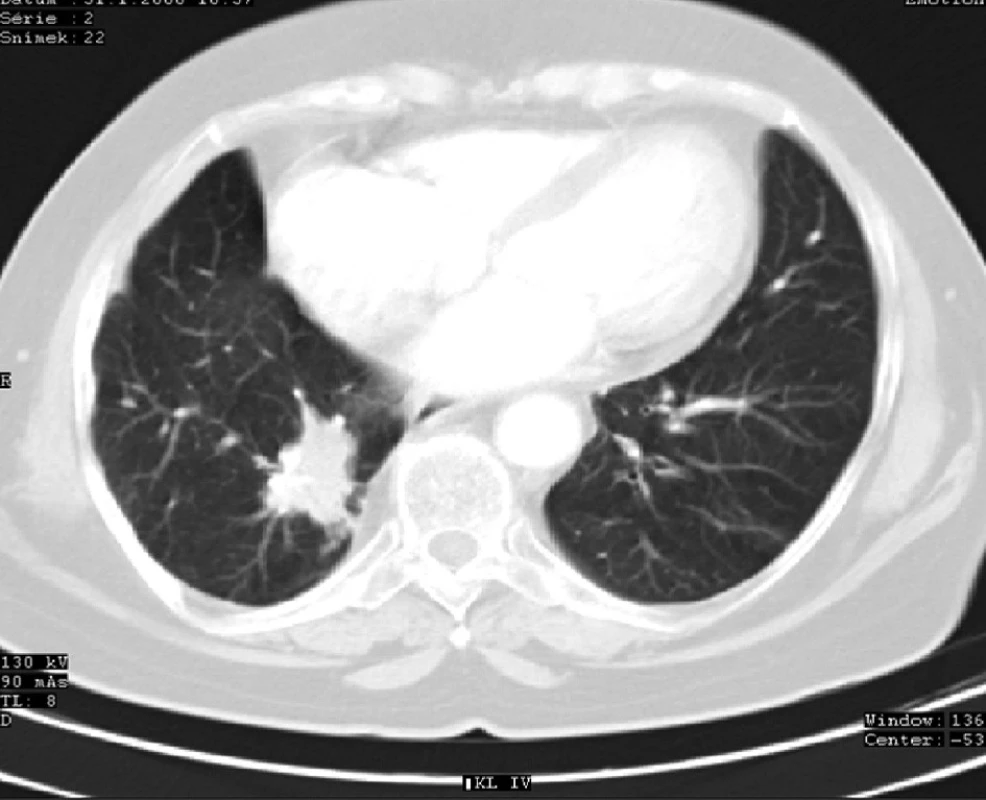
Image 6. CT plic 6 měsíců po radioterapii se známkami postiradiační fibrózy v místě recidivy ložiska karcinomu Fig. 6: Lung CT 6 months after radiotherapy with signs of post-irradiation fibrosis at the site of the tumour focus recurrence 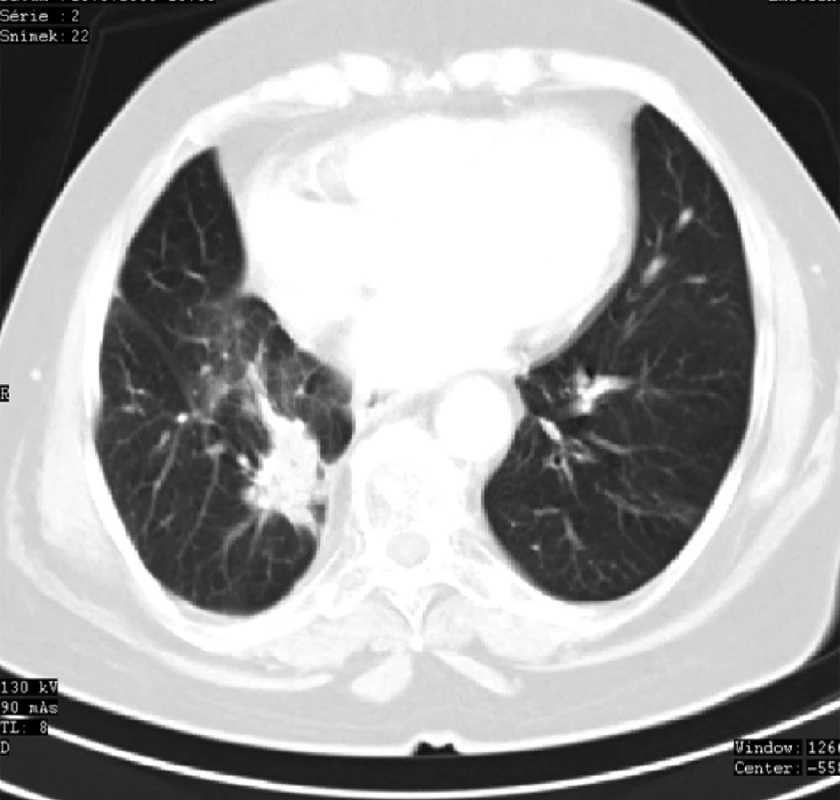
Diskuze
V dnešní době je stále větší snaha o prodloužení kvalitního života i u pacientů, kteří mají prokázána radikálně neresekabilní plicní ložiska. Neustálým rozvojem onkologických metod dochází k rozšiřování spektra paliativní léčby, současně je ale pacientům možné nabídnout i kombinaci chirurgických metod. Plicní resekce ve spojení s RFA plicních tumorů je vhodná paliativní metoda. Při nálezu velkého neresekabilního nádoru je možno RFA použít paliativně ke zmenšení nádorové masy tumoru (debulking) s využitím probíhající hypertermické reakce, která v plicním parenchymu může navíc vyvolat příznivou imunitní odpověď organismu [4]. Použití laserové resekce plicních lézí je vhodné pro parenchymová ložiska mimo plicní hilus. Pro svoji minimální invazivitu a omezenou destrukci okolního zdravého parenchymu je možné použití RFA právě pro centrálně uložená ložiska, ale zatím není jednoznačně dořešená otázka ochrany hilových struktur před tepelným účinkem RFA sondy [5]. Je však nutno počítat s vyšším procentem nonablace, protože na rozdíl od jaterní má plicní tkáň vyšší impedanci a to omezuje její účinnost. Z histologických nálezů byla prokázána perzistence maligních buněk v okolí bronchů. Pro zvýšení účinnosti RFA je možné použití cluster jehly nebo aplikaci fyziologického roztoku do okolí nádoru.
Mezi komplikace plicní resekce a RFA je na prvním místě pneumotorax, jehož přítomnost vylučujeme založením hrudní drenáže. Pleurální výpotek (10–30 %) je pozorován při ošetření povrchových lézí (méně než 1 cm pod pleurou). Méně častými komplikacemi jsou: hemoptýza (5–30 %), bronchopleurální píštěl, paréza bránice, podkožní emfyzém [6]. Infekce (2–5 %) souvisejí s tvorbou dutiny po úspěšné ablaci a mohou se projevit pod obrazem plicního abscesu nebo aspergilózou u imunokompromitovaných pacientů. [7,8].
Závěr
RFA plicních tumorů ve spojení s plicní resekcí rozšiřuje počet pacientů, kterým je možno zajistit prodloužení kvalitního života. Prezentované kazuistiky prokazují, že spojení těchto metod méně zatěžuje pacienta a šetří funkční plicní parenchym. Výrazně lepší výsledky dosahujeme u lézí menších než 3 cm. Tato metoda stejně jako její kombinacemi patří v plicní chirurgii mezi metody paliativní a nelze očekávat, že nahradí radikální resekční metody. Z našeho souboru vyplývá, že jako metoda paliativní pak může při vhodně volené následné onkologické léčbě prodloužit život pacienta [9]. Pro další sledování vývoje ošetřeného ložiska preferujeme PET/CT.
MUDr. Václav Šimánek, PhD
Chirurgická klinika FN Plzeň
e-mail: simanek@fnplzen.cz
Sources
1. Skalický T, Třeška Vl. Radiofrekvenční ablace jaterních nádorů. Maxdorf 2006.
2. Schneider T, Reuss D, Warth A. The efficacy of bipolar and multipolar radiofrequency ablation of lung neoplasms-results of an ablate and resect study. Eur J Cardiothorac Surg 2011;39, 6 : 968–73.
3. Sonntag PD, Hinshaw JL, Lubner MG, et al. Thermal ablation of lung tumors. Surg Oncol Clin N Am 2011;20,2 : 369–87.
4. Rao P, Escudier B, de Baére T. Spontaneous regression of multiple pulmonary metastases after radiofrequency ablation for a single metastasis. Cardiovasc Intervent Radiol 2011;34, 2 : 424–30.
5. Hiraki T, Mimura H, Gobara H, et al. Repeat radiofrequency ablation for local progression of lung tumors: does it have a role in local tumor control? J Vasc Interv Radiol 2008;19,5 : 706–11.
6. Cannella M, Cornelis F, Descat E, et al. Bronchopleural fistula after radiofrequency ablation of lung tumors. Cardiovasc Intervent Radiol 2011;34 Suppl 2:S171–4.
7. Kashima M, Yamakado K, Takaki H. Complications after 1000 lung radiofrequency ablation sessions in 420 patients: single centeręs experiences. AJR Am Roentgenol 2011;197,4:W 576–80.
8. de Baére T. Lung tumor radiofrequency ablation: where do we stand? Cardiovasc Intervent Radiol 2011;34,2 : 241–251.
9. de Baére T, Palussiére J, Aupérin A, et al. Midterm local efficacy and survival after radiofrequency ablation of lung tumors with minimum follow-up of 1 year: prospective evaluation. Radiology 2006;240,2 : 587–96.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2013 Issue 4-
All articles in this issue
- Syndrom břišního kompartmentu – přehled současných znalostí, diagnostiky a řešení
- Operace na vnitřních karotidách v lokoregionální anestezii na chirurgické klinice v Plzni za uplynulých 10 let (2002–2011)
- Lerichův syndrom
- Mediastinitida po perforaci jícnu
- Transplantace ledvin od dárců zemřelých na intoxikaci metanolem
- Kombinovaný výkon plicní resekce a radiofrekvenční ablace nádorů plic – kazuistiky
- Duplikatura žlučníku – vzácný nález
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Lerichův syndrom
- Syndrom břišního kompartmentu – přehled současných znalostí, diagnostiky a řešení
- Duplikatura žlučníku – vzácný nález
- Mediastinitida po perforaci jícnu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

