-
Medical journals
- Career
Syndrom mnohočetné endokrinní neoplázie typu 1 se zvláštním důrazem na tumory pankreatoduodenální oblasti – rozbor vlastní kazuistiky
Authors: K. Menclová 1,2; M. Ryska 1
Authors‘ workplace: Chirurgická klinika 2. LF UK a ÚVN Praha, přednosta: prof. MUDr. M. Ryska, CSc. 1; Fakulta vojenského zdravotnictví Univerzity obrany, Hradec Králové děkan: Plk. doc. MUDr. J. Páral, PhD. 2
Published in: Rozhl. Chir., 2013, roč. 92, č. 11, s. 625-633.
Category: Review
Overview
Úvod:
Syndrom mnohočetné endokrinní neoplázie typu 1 (MEN 1) představuje vzácné dědičné onemocnění predisponující ke vzniku varianty tumorů, z nichž některé mohou být hormonálně aktivní. Hlavními postiženými orgány jsou příštítná tělíska, oblast pankreatoduodenální a hypofýza. I přes ojedinělost syndromu není jeho výskyt v klinické praxi zanedbatelný a jeho neznalost klinickými lékaři často vede k opožděné diagnostice a mylné léčbě.Materiál a metodika:
Cílem souhrnného sdělení je uvést současnou literaturu k této problematice včetně modalit léčby nejkontroverznější části – tumorů pankreatoduodenální oblasti – a prezentovat vlastní kazuistiku. Literatura byla vyhledávána pomocí databáze Pubmed a Dynamed.Diskuze:
Tumory MEN 1 pankreatoduodenální oblasti jsou relativně pomalu rostoucími nádory. Determinujícím faktorem přežití je vznik jaterních metastáz. Chirurgická léčba je vedena s cílem stabilizace onemocnění a prevence jaterních metastáz. Radikálnější chirurgické metody mohou vést v konkrétních případech k větší biochemické kurabilitě. Rozsah výkonu by měl být zvolen individuálně.Závěr:
Znalost problematiky MEN 1 syndromu má své místo v klinické praxi. Bude potřeba dalších prospektivních studií k vyhodnocení efektivity léčebných postupů zejména pro tumory pankreatoduodenální oblasti.Klíčová slova:
syndrom mnohočetné endokrinní neoplázie (MEN) – Zollinger-Ellisonův syndrom – neuroendokrinní tumory pankreatuÚvod
Syndrom mnohočetné endokrinní neoplázie typu 1 (MEN 1), poprvé popsaný Wermerem v roce 1954 (tzv. Wermerův syndrom), může být způsoben kombinací více než 20 různých nádorů, a to hormonálně funkčních či afunkčních, benigních či maligních. Incidence se udává cca 3 případy na 100 tisíc obyvatel. Ženy i muži jsou postiženi stejně často, i když četnost maligních tumorů asociovaných s MEN 1 je u žen udávána až 4krát vyšší. Pro snadné zapamatování se pro něj vžil další, i když méně používaný název, tzv. „PPP syndrom“, protože nejčastěji postiženými orgány jsou příštítná tělíska, pankreas a hypofýza (parathyroid, pancreas, pituitary).
O syndromu MEN 1 hovoříme v případě, že tumory u pacienta postihují minimálně dva z výše uvedených orgánů. O familiárním výskytu mluvíme u pacienta s postižením jednoho z těchto tří orgánů, který má navíc stejně postiženého příbuzného v 1. linii [1].
Onemocnění je způsobeno různými typy genetických mutací 11q13 chromozomu kódujícího gen pro tumor supresorový protein menin. Mutace je bialelicky vázána. Příbuzní v 1. linii jsou postiženi v 50 %. Zlomový byl objev mutace popsané v roce 1997 Chandrasekharappou umožňující vyhledat rizikové pacienty a u nich prospektivně pátrat po jednotlivých tumorech [2]. Prevence není možná, stejně tak ani vyléčení syndromu. Důležité je tumory včas detekovat a léčit je s cílem minimalizovat riziko malignizace s metastazováním do jater, které je nejčastější příčinou úmrtí. Penetrance autosomálně dominantně dědičného syndromu se udává až 100 %. Nejčastější lokalizací MEN 1 tumoru jsou příštítná tělíska s maximem výskytu mezi 2. a 3. decenniem života, následované afunkčními neuroendokrinními tumory pankreatu a gastrinomy s maximální udávanou incidencí mezi 3. a 4. deceniem. Tato skutečnost může sloužit jako vodítko v diferenciální diagnostice se sporadickými tumory, které se častěji vyskytují v pozdějším věku. Dříve popisovaná mortalita u Zollinger-Ellisonova syndromu (ZES) či hyperparathyreoidismu (HPT) u MEN 1 byla díky efektivní medikamentózní léčbě prakticky eradikována. Hlavní příčinou smrti u pacientů s MEN 1 tak dnes zůstávají maligní tumory, zejména gastrinomy, respektive jejich jaterní metastázy. Více než třetina úmrtí asociovaných s MEN 1 je způsobena právě malignitou.
Materiál a metodika
1. Jednotlivé tumory syndromu MEN 1 a jejich manifestace
1. 1. Postižení příštítných tělísek je nejčastější a nejčasněji se manifestující endokrinopatií. Výskyt do 5. decennia se udává v 80–100 % [1] s maximem ve 2.–3. decenniu. Osteoporóza je popisována u žen okolo 35. roku života, navíc hyperkalcemie potencuje sekreci gastrinu u často přidružených gastrinomů (Zollinger-Ellisonův syndrom – ZES). Postižena bývají minimálně 3 příštítná tělíska. Existuje raritní forma MEN 1, tzv. Burinův syndrom, zahrnující postižení příštítných tělísek spolu s prolaktinomy, které v tomto případě mají nezvykle vysokou incidenci. Naopak gastrinomy jsou součástí Burinova syndromu jen výjimečně [1]. Po provedené subtotální paratyreoidektomii je v horizontu 10–12 let pozorována rekurence až v 50 % případů, která si vynutí reoperaci.
1. 2. Tumory hypofýzy se vyskytují u 10–60 % [1] pacientů. Zřídka však bývají první manifestací syndromu. Nejčastěji se jedná o chromofobní hormonálně nefunkční adenomy a prolaktinomy, popsány jsou ale i další typy tumorů. Většinou jde o mikroadenomy velikosti do 10 mm. Symptomatologie se odvíjí od produkovaného působku. Jejich růst se může projevit bolestí hlavy či tlakem na chiasma. Vyznačují se vysokou rekurencí při ponechaném reziduu hypofýzy po chirurgické léčbě.
1. 3. Mezi méně se vyskytující tumory asociované s MEN 1 patří karcinoidy, a to bronchiální, thymu a žaludku (foregut). Existují studie popisující relativně častý výskyt karcinoidů u MEN 1, a to až ve 40 % [4]. Bylo prokázáno, že hypergastrinemie (při současném ZES) výrazně zvyšuje riziko vzniku žaludečního karcinoidu [3]. Zajímavé je, že v rámci symptomatologie karcinoidů asociovaných s MEN nikdy nebyl popsán flush. Karcinoidy, zejména v oblasti foregut, bývají hormonálně němé.
1. 4. Tumory nadledvin s udávanou incidencí 20 až 40 % bývají hormonálně nefunkční a jsou často bilaterální. Nejčastěji se jedná o hyperplázie či adenomy, karcinomy jsou raritní.
1. 5. Lipomy kůže či orgánů postihují asi třetinu pacientů s MEN 1. Jsou dobře ohraničené a po exstirpaci nerecidivují. Častým kožním projevem mohou být angiofibromy.
1. 6. Ve zhruba 6 % bývá MEN 1 doprovázen různými typy tyreopatií [4].
2. Tumory pankreatoduodenální oblasti, Zollinger-Ellisonův syndrom
2. 1. Výskyt tumorů pankreatoduodenální oblasti v rámci MEN 1 je udáván mezi 30–80 % všech nemocných [1]. Maximum incidence se uvádí mezi 3. až 4. decenniem života. V ranějších stadiích bývají detekovány pouze biochemicky, klinická manifestace se může opožďovat. Léze jsou nejčastěji multicentrické, různých velikostí od mikro - po makroadenomy (popisovaný je metastazující Vipom velikosti 25 cm [5]. U všech těchto tumorů se předpokládá, že jsou potenciálně maligní. Jednoznačně však nebyly stanoveny markery či kritéria malignity, které by pomohly rozhodnout o modalitě léčby, resp. o indikaci k chirurgické exstirpaci. Vzhledem k vysoké rekurenci nádorů (zejména u ZES a hormonálně nefunkčních neuroendokrinních tumorů – NET) nemusí být cílem radikální odstranění nádoru, ale výkon směřující ke stabilizaci onemocnění a k prevenci rozvoje jaterních metastáz, který je hlavním negativním faktorem délky přežití. Z možných kritérií predikce malignity zůstává v popředí velikost tumoru, zejména u hormonálně afunkčních NET, které nemůžeme detekovat biochemicky. Většina chirurgických pracovišť indikuje výkon u tumorů větších než 2 cm. Jiná (zejména marburská skupina) se kloní k agresivnějšímu přístupu s indikací k exstirpaci u tumorů nad 1 cm [6]. Existují i nevelké studie vyvracející relevanci velikosti tumoru s maligním potenciálem. Dobrým ukazatelem by mohl být index Ki67, jeho odběr cestou tenkojehlové biopsie (FNA) je však často prakticky neproveditelný (např. u malých lézí v duodenu) [7]. Zjišťován je vliv poklesu E-kadherinu na maligní potenciál [6]. Marburská skupina se též věnovala zkoumání genotypu, resp. konkrétního typu genové mutace na predikci maligního potenciálu. Své výsledky však o několik let později sama negovala [2]. Nejfrekventovaněji detekovanými hormonálními působky jsou CgA, PP a gastrin.
2. 1. 1. Nejčastějšími NET v rámci MEN 1 jsou tumory hormonálně afunkční, tvořící okolo 50–80 % všech NET [3,5]. Lokalizovány jsou do oblasti pankreatu. Manifestovat se mohou jako jiné (např. adenokarcinomy) tumory v oblasti pankreatu. Obecně se má za to, že s velikostí tumoru stoupá jeho maligní potenciál. Doroste-li velikostí nad 10 mm, doporučuje se jeho chirurgické odstranění. Afunkční NET mohou často doprovázet tumory hormonálně aktivní či se mohou objevit v reziduu pankreatu po resekčním výkonu pro hormonálně aktivní tumor.
2. 1. 2. Inzulinom je méně častým hormonálně aktivním tumorem pankreatu. Ve více než 90 % bývá benigního charakteru s nízkou pooperační rekurencí blížící se nule. Proto je chirurgická léčba inzulinomu vždy na místě. Je jedinou a efektivní možností kurativní terapie.
2. 1. 3. Vipom je dalším z funkčních NET. Diagnóza bývá stanovena na základě dvou ukazatelů: klinicky jde o průjmy v množství větším než 6 l/den, v laboratoři je zvýšená hladina vazoaktivního intestinálního peptidu (VIP). Léčba je chirurgická. V konzervativní léčbě se mimo podání analogu somatostatinu zkoumá vliv podávání protilátek proti VIP [8].
2. 1. 4. Gastrinomy (ZES) se vyskytují u 40–80 % pacientů s MEN 1 [1], a jsou tak v rámci syndromu nejčastějšími funkčními NET. Obráceně je známo, že okolo 25 % pacientů se ZES je postiženo mutací MEN 1. Jejich klinická manifestace se může opožďovat za biochemickou detekcí. Může však být u 40 % nemocných prvním projevem MEN 1. Důkladné vyšetření obvykle odhalí i synchronní klinicky němý HPT [4]. Z dostupné literatury víme, že u třetiny (70 % MLN [7]) klinicky se projevujícího ZES jsou synchronně přítomny vzdálené metastázy buď v uzlinách (MLN), či v játrech (MJ). Víme, že až třetina pacientů umírá právě na jaterní diseminaci nádoru. Při prospektivním pátrání po tumoru u pacientů ze známých MEN 1 rodin se většina odborníků kloní, zejména u mladých pacientů, k chirurgické léčbě již při biochemické pozitivitě tumoru, i je-li pod detekovatelností zobrazovacích metod [9]. Kontroverzní přístup k indikaci i rozsahu výkonu (viz 5.) však podněcují data, zejména z dřívějších studií, která poukazují na výborné dlouhodobé přežívání pacientů s tumory pankreatoduodenální oblasti, resp. s jaterními metastázami asociovanými s MEN 1. Důvodem je diametrálně pomalejší růst [6], například v porovnání s adenokarcinomy. Studie sledující konzervativně léčené pacienty s tumory do 25 mm udávají dlouhodobé přežití v 95 % až 100 %. V případě přítomných jaterních metastáz se 20leté přežití snižuje na 15–40 % [3,7]. Nutno zmínit, že existují i agresivnější formy gastrinomů s větším výskytem u žen, které časněji metastazují a snižují dlouhodobé přežívání z 96 % na 30 % [3]. Zatím však neexistují žádné jednoznačné markery agresivního růstu (viz 2. 1.). Významnou roli hraje i vysoká pooperační rekurence onemocnění. Tato skutečnost umocněná vynikajícími možnostmi medikamentózní léčby vede velkou část lékařů, zejména internistů, k volbě konzervativního postupu.
Gastrinomy se často vyskytují mnohočetně v pankreatu, ale 4–10krát častěji v duodenu [7,10]. Bývají drobné, velikosti do 5 mm, většinou pod hranicí detekovatelnosti zobrazovacími metodami. Známé jsou i ektopické lokality jako slezina, ovárium, žlučník, junkce hepatiku, retroperitoneum, malé omentum aj. [3,11,12]. Některá pracoviště popisují primární tumory přímo v uzlinách [3] s negativním nálezem v pankreatu či duodenu. Výše uvedená fakta mají vliv na volbu typu chirurgického výkonu a peroperačních vyšetření. Během operace bychom měli řádně vyšetřit duodenum z duodenotomie. Předoperačně bychom měli ideálně vždy doplnit SASI (selective arterial secretin injection) test dle Imamury (viz dále) ke zpřesnění místa léze a intraoperačně provést sonografii (IOUS) a event. dříve velmi doporučované peroperační měření gastrinemie. Jedině tak pacienta ušetříme zbytečného rizika neefektivní operace. Duodenální gastrinomy metastazují zejména do uzlin, jejichž postižení nemá jednoznačný korelát s délkou přežití. Oproti tomu NET v oblasti pankreatu preferenčně metastazují do jater, což je prognosticky závažnější. Chirurgická léčba zůstává kontroverzním tématem, a to jak stran indikace k výkonu, tak volby rozsahu operačního výkonu. Zatímco některá pracoviště udávají 10letou biochemickou remisi okolo 30 % [3], jiná pracoviště jsou úspěšná až v 70 až 100 % (zejména po operaci dle Whipplea) [1–11]. Agresivnější chirurgické přístupy obecně vykazují nižší pooperační rekurenci onemocnění (Tab. 1).
Table 1. Tumory asociované s MEN 1, diagnostika a léčba Tab. 1: Tumors associated with MEN 1, diagnosis and treatement 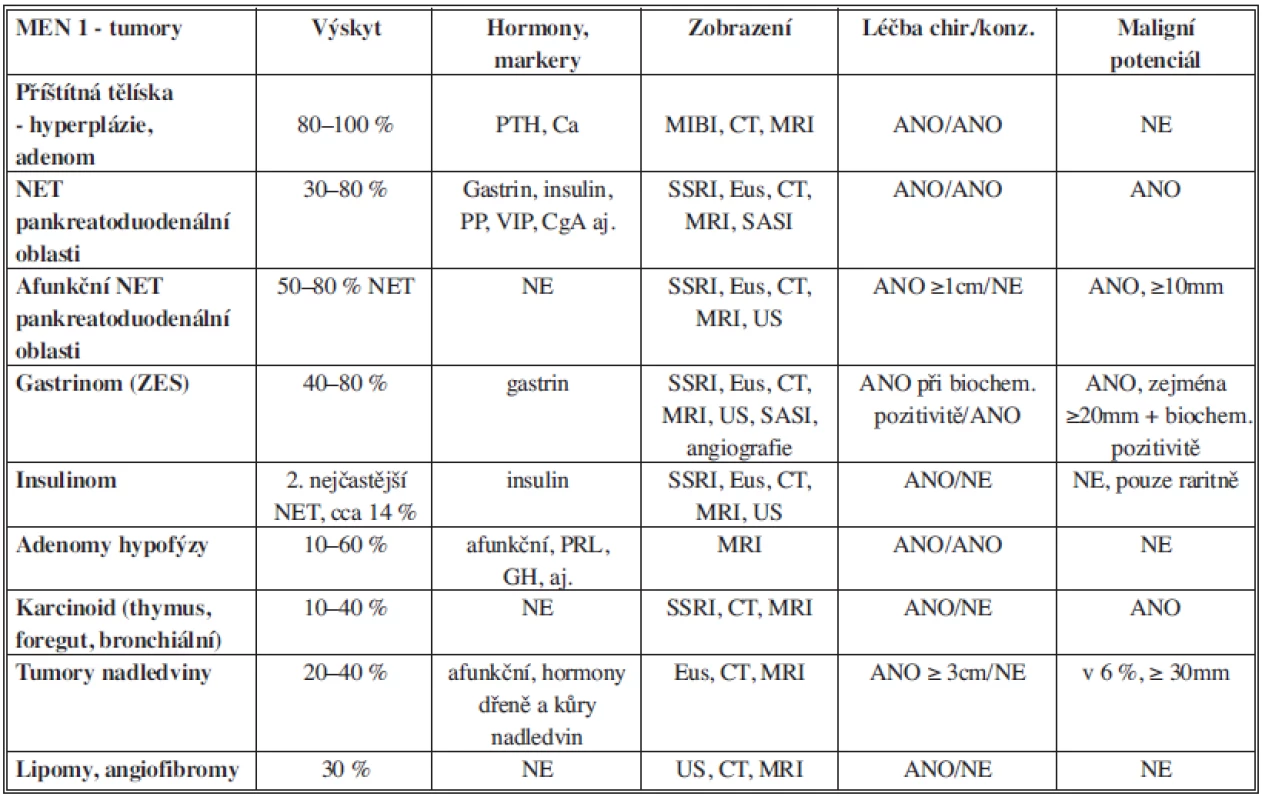
3. Vyšetřovací modality
3. 1. Nedílnou součástí vyšetřovacího algoritmu je podrobný odběr anamnézy spolu s klinickým vyhodnocením stavu, odběr biochemických markerů a zobrazovací metody. Laboratorní testy jsou vzhledem k velké variabilitě lézí extenzivní. Zahrnují odběr parathormonu, kalcitoninu, pankreatického polypeptidu (PP), chromograninu A (CgA), gastrinu, inzulinu, C-peptidu, glukagonu, VIPu, serotoninu, kortizolu, aldosteronu, reninu, DHEAS, prolaktinu, hCG, ACTH [1,2]. Existuje řada endokrinologických testů, z nichž zmíníme zejména sekretin stimulační test. Ten tvoří nedílnou součást vyšetření i v rámci dispenzarizace pacientů s gastrinomy a je jedním z hlavních kritérií tzv. biochemické remise.
3. 2. 1. U HPT předoperační zobrazovací metody nemají očekávaný význam. Důležité je vyšetřit všechna tělíska, protože dříve či později bývají postižena všechna. Při reoperacích nabývají vyšetřovací modality na významu. Nejpřínosnější metodou se stále jeví MIBI scintigrafie.
3. 2. 2. Základními vyšetřeními hypofýzy jsou odběry hormonů a MRI.
3. 2. 3. Ke stanovení diagnózy inzulinomu se užívá stanovení glykemie na lačno (za monitorace na lůžku) a hladiny inzulinu, možný je pozitivní nález na zobrazovacích metodách (CT, EUS). Falešně pozitivní výsledky mohou být u pacientů s rozvíjející se inzulinovou rezistencí. Vyšetření s abnormálními výsledky je třeba opakovat.
3. 2. 4. ZES – biochemická diagnóza je stanovena na základě hypergastrinemie a pozitivního sekretin stimulačního testu, event. hodnoty žaludečního pH pod 2. Sekretin stimulační test má své místo i v dispenzarizaci. Jeho význam tkví především v exkluzi falešně pozitivních výsledků, např. u pacientů s hypochlorhydrií. Většinu i peroperačně nezobrazitelných tumorů pankreatoduodenální oblasti lze peroperačně nalézt pomocí IOUS. Drobné gastrinomy duodena vyšetřujeme vždy palpačně z duodenotomie, event. za využití endoskopické transiluminace. Mezi další zobrazovací techniky patří octreoscan (SSRI, SRS) s vysokou senzitivitou vyšetření dosahující až 92 % [7]. Jeho senzitivita je však závislá na expresi somatostatinových receptorů nádorem. Nejvyšší expresi vykazují gastrinomy, a to až 100 %. Díky tomuto poznatku nám umožní také predikovat efekt somatostatinové terapie [13]. SSRI umožní i zachycení vzdálených metastáz včetně kostních. Představuje zlatý standard ve vyšetřovacích metodách NET. Nevýhodou je, že neurčí velikost léze. Velikost dependentní jsou zobrazovací metody uvedené v pořadí se snižující se senzitivitou: CT – MRI – US [3,7]. Vysoké senzitivity dosahuje abdominální angiografie, dříve užívaný odběr krve z portální žíly (portal vein sampling – PVS) [3,7,12] je dnes již prakticky opuštěný. K zobrazení a stanovení stagingu tumorů pankreatoduodenální oblasti je vhodná endosonografie (EUS). Obtížně detekovatelné zůstávají drobné tumory duodena, kdy senzitivita vyšetření klesá z 85 % na 42 % [3]. Přínos rutinního provedení FNA pro volbu chirurgického výkonu, resp. pro délku dlouhodobého přežití, nebyl prokázán. Jako dostačující se ke stanovení diagnózy jeví funkční a hormonální testy. Specifické testy zahrnují SASI a intraoperační sekretin stimulační test (IST). SASI test dle Imamury [10,12] vychází ze znalosti arteriálního zásobení pankreatoduodenální oblasti, kdy se obvykle předoperačně aplikuje bolus sekretinu (v modifikaci event. kalcium glukonátu) do jedné z vyživujících tepen (a. gastroduodenalis, a. lienalis, a. pancreatoduodenalis inferior, větve horní mezenterické tepny), kdy v případě gastrinomu detekujeme z hepatické žíly nárůst gastrinemie. Nevýhodou je obtížné určení sporných společně zásobených lokalit, jako např. orální část duodena a hlava slinivky aj. V porovnání s ostatními zobrazovacími modalitami je však toto vyšetření nejpřesnější s vysokou senzitivitou, což je pro chirurga zásadní zejména při volbě rozsahu operačního výkonu ve snaze o potenciální kurabilitu. Podobně peroperačně můžeme verifikovat úplnost odstranění gastrinomu pomocí IST [12].
4. Léčebné možnosti MEN 1 syndromu
4. 1. Dnes nejčastěji volenou chirurgickou léčbou HPT je subtotální paratyreoidektomie s limitovanou thymektomií. Načasování operace může být obtížné s ohledem na pravděpodobnou nutnost reoperace. I přes možnou expozici HPT se operace nedoporučuje provádět v dětském věku. Remnant příštítného tělíska se implantuje nejčastěji na předloktí či za kývač. K prevenci možné pooperační hypoparatyreózy je vhodné kryoprezervovat vzorek tělíska k event. pozdějšímu použití jako autograftu. Vzhledem k vysoké rekurenci je alternativou provedení totální paratyreoidektomie se substitucí analogy vitaminu D. Slibnými léky v konzervativní léčbě HPT by mohla být kalcimimetika suprimující jak sekreci parathormonu, tak růst adenomů.
4. 2. Tumory hypofýzy je možné léčit chirurgicky transsfenoidální resekcí, užitím gamma nože či medikamentózně (Carbegoline) [2] s dobrými výsledky všech uvedených modalit.
4. 3. Terapie žaludečního karcinoidu spočívá v chirurgické resekci. Endoskopická léčba je možná, ale její paušální provedení se nedoporučuje pro častou invazi nádoru do submukózy s nemožností spolehlivého endoskopického odstranění při známém maligním potenciálu karcinoidu. Ložiska jsou navíc často mnohočetná.
4. 4. Léčba karcinoidu thymu a bronchiálního karcinoidu je chirurgická, tj. transsternální resekce, resp. torakotomie s resekcí včetně lymfadenektomie. Metastazování do mediastinálních uzlin je časté.
4. 5. Chirurgická léčba lézí nadlevin byla standardně doporučována u hormonálně funkčních nádorů a lézí nad 50 mm v průměru. Některé studie však popisují až 6% zvrat v adrenokortikální karcinom i menších lézí a snižují tak hranici indikace k operačnímu řešení na 30 mm [2]. U dispenzarizovaných pacientů je vhodná kontrola zobrazovacími metodami po 6 či více měsících dle rychlosti růstu nádoru.
5. Chirurgie pankreatoduodenální oblasti a léčba ZES
5. 1. Mimo inzulinomů většina tumorů pankreatoduodenální oblasti dobře odpovídá na konzervativní léčbu. V případě ZES se jedná zejména o použití inhibitorů protonové pumpy (PPI), event. H2 blokátorů. K supresi sekreční aktivity a růstu tumorů lze často s dobrým efektem používat analog somatostatinu. Tumorem, pro který je chirurgická léčba metodou volby, je jednoznačně inzulinom. Rozsah výkonu volíme podle lokalizace léze se snahou zachovat co největší část pankreatu. Dle zvyklosti pracoviště lze volit i laparoskopický přístup, zejména u nádorů lokalizovaných v těle a ocase slinivky. Vždy však pomýšlíme na možnou synchronní přítomnost jiných typů NET [11].
5. 2. Chirurgie NET pankreatoduodenální oblasti, a zejména ZES v rámci MEN 1, je po desetiletí kontroverzní otázkou, která není dosud jasně zodpovězena. Nebyl jednoznačně prokázán přínos agresivní chirurgické léčby na prodloužení života pacientů. Pro vysokou pooperační rekurenci onemocnění nelze mluvit ani o dlouhodobém kurabilním efektu resekce. Cílem chirurgie je proto stabilizace onemocnění s prevencí vzniku jaterních metastáz – jako jediným prokazatelným prediktorem zkrácení délky přežití.
Nejčastěji jmenovanými indikačními kritérii u hormonálně afunkčních NET, resp. ZES k chirurgickému výkonu, je velikost tumoru nad 10 mm, resp. biochemická pozitivita tumoru bez ohledu na klinickou manifestaci.
5. 2. 1. Ve snaze o zachování co možná největší části parenchymu pankreatu v prevenci vzniku inzulin dependentního diabetu, je stále nejfrekventovanějším výkonem levostranná pankreatektomie (Norman-Thompson) po úroveň portální žíly s enukleací ložisek hlavy slinivky a regionální lymfadenektomií. Splenektomie se neprovádí rutinně, pouze u větších tumorů (nad 20 mm) s podezřením na malignitu, kdy je třeba provést lymfadenektomii slezinného hilu. Peroperačně je vhodné provést IOUS k detekci co možná největšího počtu ložisek. U ZES je situace komplikovanější. V případě detekce aktivního gastrinomu v oblasti hlavy slinivky či duodena dle SASI je možné provést enukleaci tumorů hlavy slinivky s duodenotomií a vyšetřením duodena, s možnou excizí jeho lézí a lymfadenektomií. Duodenotomie by měla být provedena rutinně, neboť je spolu s palpací za současného použití IOUS nejsenzitivnější metodou v detekci duodenálních gastrinomů. K verifikaci úspěšného odstranění ZES je možné použít IST. Mnohá pracoviště, zejména u mladých pacientů, preferují volbu radikálnější Whippleovy operace, u níž uvádějí biochemickou kurabilitu okolo 75 % [3,11]. Nevýhodou výkonu je nutnost totální pankreatektomie při rekurenci onemocnění v remnantu slinivky. Rozsah lymfadenektomie je diskutovaným tématem. Z některých studií (viz výše) vyplývá, že primární ZES může být lokalizován do oblasti uzlin a že až v 70 % bývají regionální uzliny metastaticky postiženy. Obecně se tedy doporučuje provést peripankreatickou lymfadenektomii s odstraněním uzlin v oblasti hepatoduodenálního ligamenta a truncus coeliacus [3]. Laparoskopický přístup je pro tyto výkony nevhodný.
Imamura v recentních publikacích poukazuje na možnost provedení pankreas šetřící totální duodenotomie [10], a to v případě, kdy byl gastrinom pomocí SASI identifikován v oblasti hlavy pankreatu či duodena. Po provedení standardní Whippleovy operace byly nezřídka při imunohistochemickém vyšetření detekovány vícečetné mikroléze v oblasti duodena, s negativním nálezem v oblasti hlavy pankreatu. Tento výkon předpokládá peroperační bimanuální vyšetření slinivky s IOUS a provedení standardní lymfadenektomie.
5. 2. 2. Pooperační morbidita výkonů na pankreatu se pohybuje okolo 40 % [5,6,11]. Nejčastější komplikací bývá pankreatická píštěl (10–30 %), která se většinou zhojí konzervativně. Vysoké procento morbidity je způsobeno tím, že tkáň pankreatu je zpravidla měkká s malým průměrem d. pancreaticus, což technicky znesnadňuje provedení pankreatodigestivní spojky. V menší míře se objevují nitrobřišní abscesy a raritně akutní pooperační pankreatitida [6]. Peroperační mortalita ve specializovaných centrech je prakticky nulová.
5. 3. Dříve prováděné resekční výkony na žaludku ve smyslu subtotální až totální gastrektomie či vagotomie pro hyperaciditu při nálezu gastrinomů jsou dnes opuštěny. I když existují data podporující vyšší senzibilizaci žaludeční stěny k H2 antagonistům s možností vysadit PPI po provedené vagotomii [3], u pacientů se ZES při MEN 1 nejsou primární výkony na žaludku indikovány.
5. 4. Snahou chirurga je dosažení R0 resekce. K oprávněnosti provedení R2 cytoredukční resekce u in toto neresekabilních tumorů asociovaných s MEN 1 není dostatek dat. Totéž platí pro event. využití alternativní radiofrekvenční ablace, tak jak je popisováno u pokročilých adenokarcinomů pankreatu a sporadické NET [14]. Multiorgánová resekce bez možnosti dosažení R0 je v současné době neakceptabilní.
5. 5. Přínos resekce jaterních metastáz na dlouhodobé přežívání pacientů nebyl jednoznačně prokázán. Nicméně z některých studií vyplývá, že 5leté přežití se u pacientů po resekčním či RFA výkonu zvyšuje na 72 % [6]. Při přítomnosti synchronních resekabilních jaterních metastáz volíme jednodobý výkon. Difúzní jaterní postižení je kontraindikací chirurgického výkonu. Chemoembolizační metody a radiofrekvenční ablace (RFA) mohou být prováděny, stávající data jsou však nedostačující. Transplantace jater pro NET v současné době nedosahuje uspokojivých výsledků [6,15].
6. Systémová a udržovací léčba
6. 1. K validnímu posouzení účinku chemoterapie u pacientů s maligními NET u MEN 1 chybějí dostatečná data. V léčebných spektrech se užívá kombinace oktreotidu s některým preparátem z řady chemoterapeutik (alpha-interferon, streptozocin, 5-FU aj. [2,6,15]). Slibnější se do budoucna jeví biologická léčba v popředí s inhibitory mTOR (everolimus, sirolimus) či antiangiogenní léčbou (VEGFR Ab, inhibitory TK – sunitib) [15]. Konzervativní léčba u hlavních typů tumorů je zmíněna výše. Dominantní postavení má podávání depotních analogů somatostatinu. Potenciální terapeutický efekt přímo koreluje s expresí somatostatinových receptorů jednotlivých nádorů [13].
7. Screening a dispenzarizace pacientů s MEN 1 syndromem
7. 1. Konsenzus Mezinárodního institutu zdraví s roku 2001 ustanovil doporučení stran dispenzarizace a screeningu pacientů [1,8] z rizikových rodin a pacientů s již detekovaným MEN 1 syndromem. Jde o periodický screening s odběrem anamnézy, se zvláštním důrazem na symptomatologii hormonálně funkčních tumorů. Odběr krve k laboratornímu vyšetření (kalcium, PTH, prolaktin, IGF-1, gastrin, glukagon, CgA, lačná glykemie a inzulin) se doporučuje provádět 1krát ročně a zobrazovací metody opakovat každých 3 až 5 let. Po prezentaci kazuistiky rychle rostoucího NET pankreatu marburská skupina navrhla provádět vyšetření po 6 měsících [9]. Takto rutinně zkrácený interval se však nejeví racionální. Stejná skupina navíc o rok později zredukovala seznam doporučených vyšetření s ohledem na proporcionální četnost výskytu jednotlivých tumorů asociovaných s MEN 1 [2]. Z laboratorních screeningových vyšetření z praktických důvodů postačuje odběr sérového kalcia, gastrinu a prolaktinu. Počítačová tomografie břicha a hrudníku má své místo v primární diagnostice, kdy je největší záchyt lézí, event. v rámci kontrol po operaci pankreatu. V prosté dispenzarizaci se neprovádí, protože málokdy odhalí nově vzniklou lézi. Obzvláště nemá-li korelát v klinice či laboratoři. Vhodnými screeningovými metodami jsou celotělová SSRI a EUS. Vyšetření by měla být prováděna každé 3 roky či při změně stavu. U pacientů s nově diagnostikovaným syndromem MEN 1 geneticky vyšetřujeme všechny příbuzné v první linii od 15 let věku. Manifestní MEN 1 v ranějším věku je extrémně vzácný.
Kazuistika
38letá pacientka s rodinnou anamnézou opakovaných chirurgických revizí pro vředovou chorobu gastroduodena u otce, který byl sledován pro tyreopatii, se dostavila na naše pracoviště pro náhodný ultrasonografický nález tumoru v oblasti hlavy pankreatu. V předchorobí pacientka prodělala exstirpaci ependymomu C0-Th1, kdy pooperační stav byl přechodně komplikován těžkou kvadruparézou. Dva roky poté podstoupila ve spádovém nemocničním zařízení operaci typu Billroth II pro vředovou chorobu žaludku. Poté přes intenzivní medikamentózní léčbu (kombinace PPI a H2 antagonistů) byla u pacientky na kontrolních gastroskopiích opakovaně prokázána ulcerace v místě anastomózy a aborálně od ní. Dva roky po resekčním výkonu na žaludku byl u pacientky při abdominální ultrasonografii náhodně zachycen výše zmíněný tumor v oblasti hlavy pankreatu. V rámci dovyšetření byla enteroskopie negativní. EUS odhalila ložisko v oblasti hlavy, druhé na přechodu hlavy a těla pankreatu, třetí ložisko v oblasti slezinného hilu. Ložiska v duodenu prokázána nebyla. FNA prokázala neuroendokrinní tumor pankreatu nejisté biologické povahy. Doplněná SSRI a CT navíc ukázala další ložiska v oblasti duodena (Obr. 1–3). S diagnózou gastrinomu byla pacientka multioborovým týmem indikována k chirurgické léčbě.
Image 1. Léze v oblasti pankreatu u pacienta s MEN 1 Fig. 1: Pancreatic lesion in a patient with MEN 1 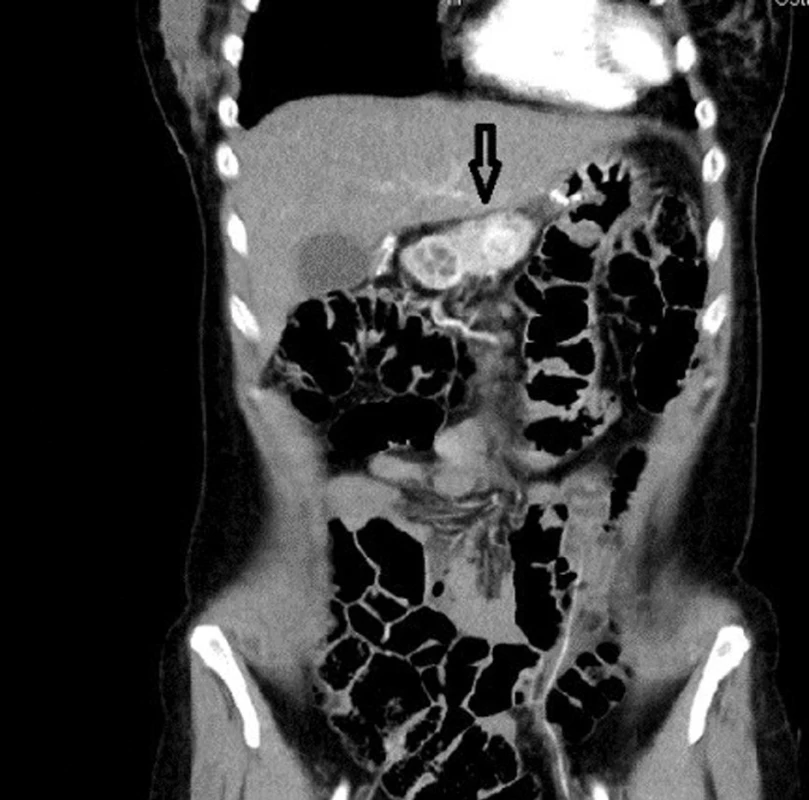
Image 2. Léze v oblasti slezinného hilu Fig. 2: Lesion in the splenic hilum 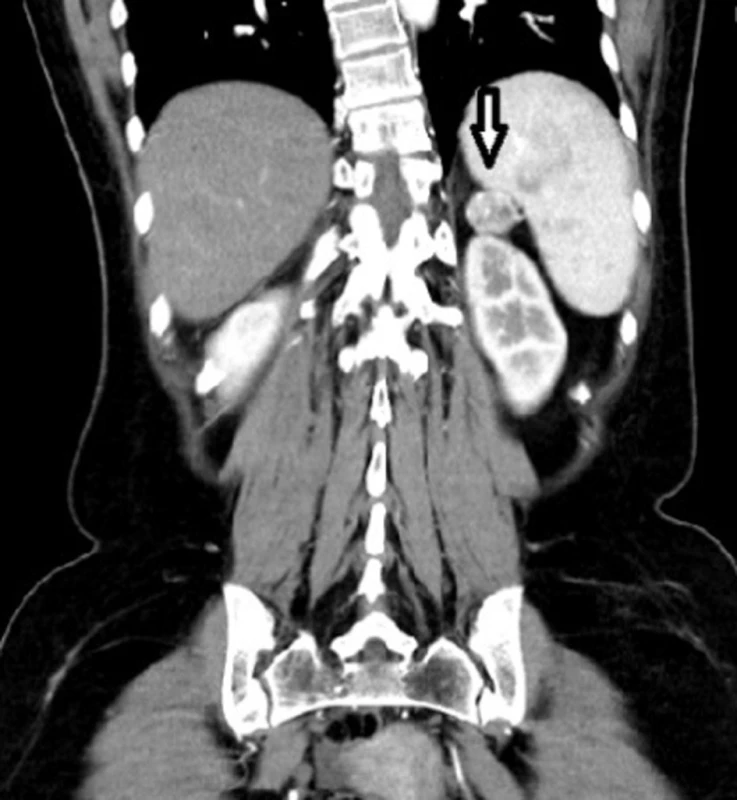
Image 3. Léze v oblasti pankreatu a duodena Fig. 3: Pancreatic and duodenal lesions 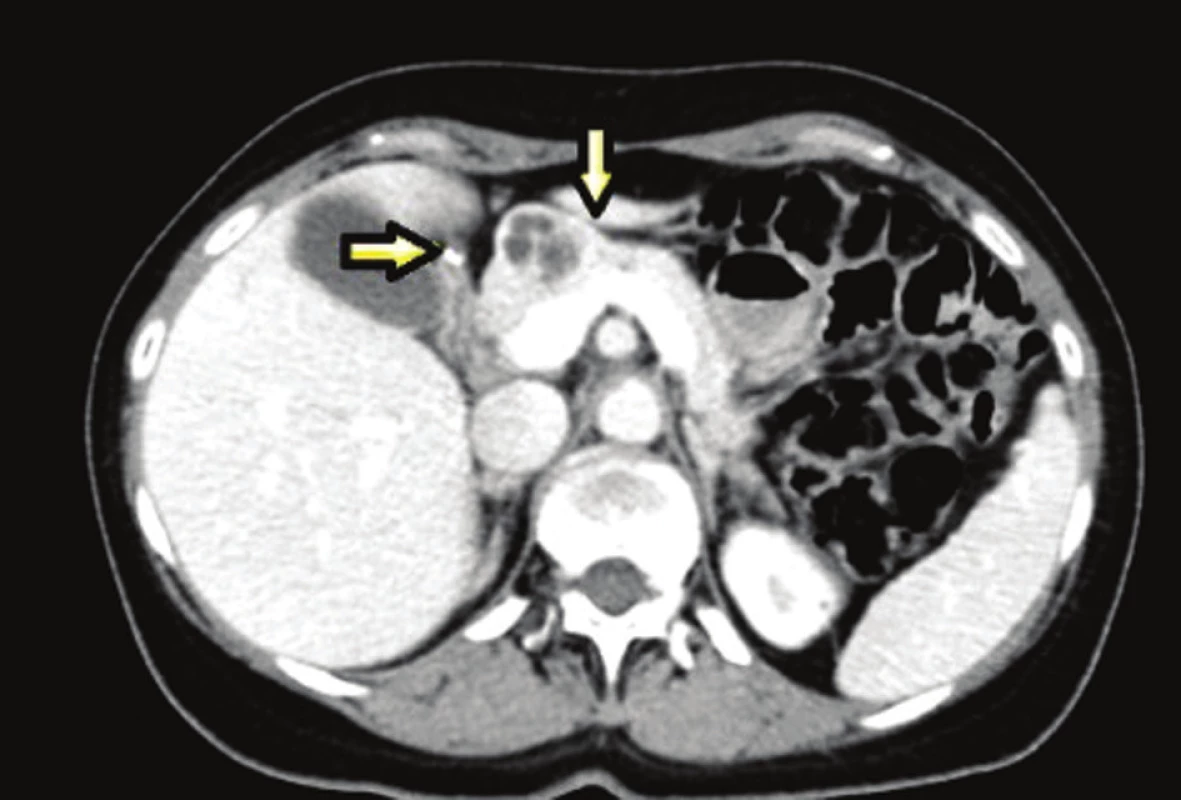
Peroperačně jsme v terénu četných adhezí palpačně verifikovali nádorová ložiska v krčku a v kaudě pankreatu a v hilu sleziny. Provedli jsme levostrannou pankreatektomii se splenektomií. Pooperační průběh byl 7. den komplikován celkovou alterací stavu s elevací zánětlivých parametrů. Při CT vyšetření jsme nalezli pneumoperitoneum. Indikovali jsme operační revizi, při které jsme ošetřili perforovaný žaludeční vřed, který byl příčinou difúzní peritonitidy. Pooperačně jsme pokračovali v intenzivní léčbě. Pro přetrvávající nejasné febrilie jsme opětovně provedli CT vyšetření, které odhalilo suspektní adenom levého příštítného tělíska. Endokrinologem navržená laboratorní vyšetření přinesla tyto výsledky: PTH 10,13 pmol/L (norma do 6,4), PRL 605,6 (norma do 406), sérové kalcium 2,91 (norma 2), zvýšený byl i jeho odpad moči, hodnoty TSH, fT4, LH, FSH, IGF-1 byly v normě. Výsledek definitivního imunohistochemického vyšetření prokázal dobře diferencovaný tumor pankreatu, menší část buněk s pozitivitou na gastrin, 3 ložiska s nízkým a jedno s vyšším maligním potenciálem. V dalším průběhu hospitalizace došlo ke zlepšení stavu pacientky. Za intenzivní nutriční podpory a rehabilitace byla pacientka 5 měsíců po primárním chirurgickém výkonu předána na specializované endokrinologické pracoviště s klinickou diagnózou MEN 1. Proběhlo cytogenetické vyšetření pacientky a její dcery. Kontrolní gastrinemie byla 1500 mIU/L (norma do 115), provedená SSRI verifikovala reziduální aktivní ložiska v oblasti duodena a lemu ponechané části pankreatu (Obr. 4). MIBI scintigrafie příštítných tělísek prokázala bilaterální adenomy (Obr. 5). Pacientka prodělala subtotální paratyreoidektomii. V současné době je normokalcemická, na vysokých dávkách PPI a terapii somatostatinovými analogy.
Image 4. Pooperační CT s reziduální lézí v duodenu Fig. 4: Postoperative CT scan with a residual duodenal lesion 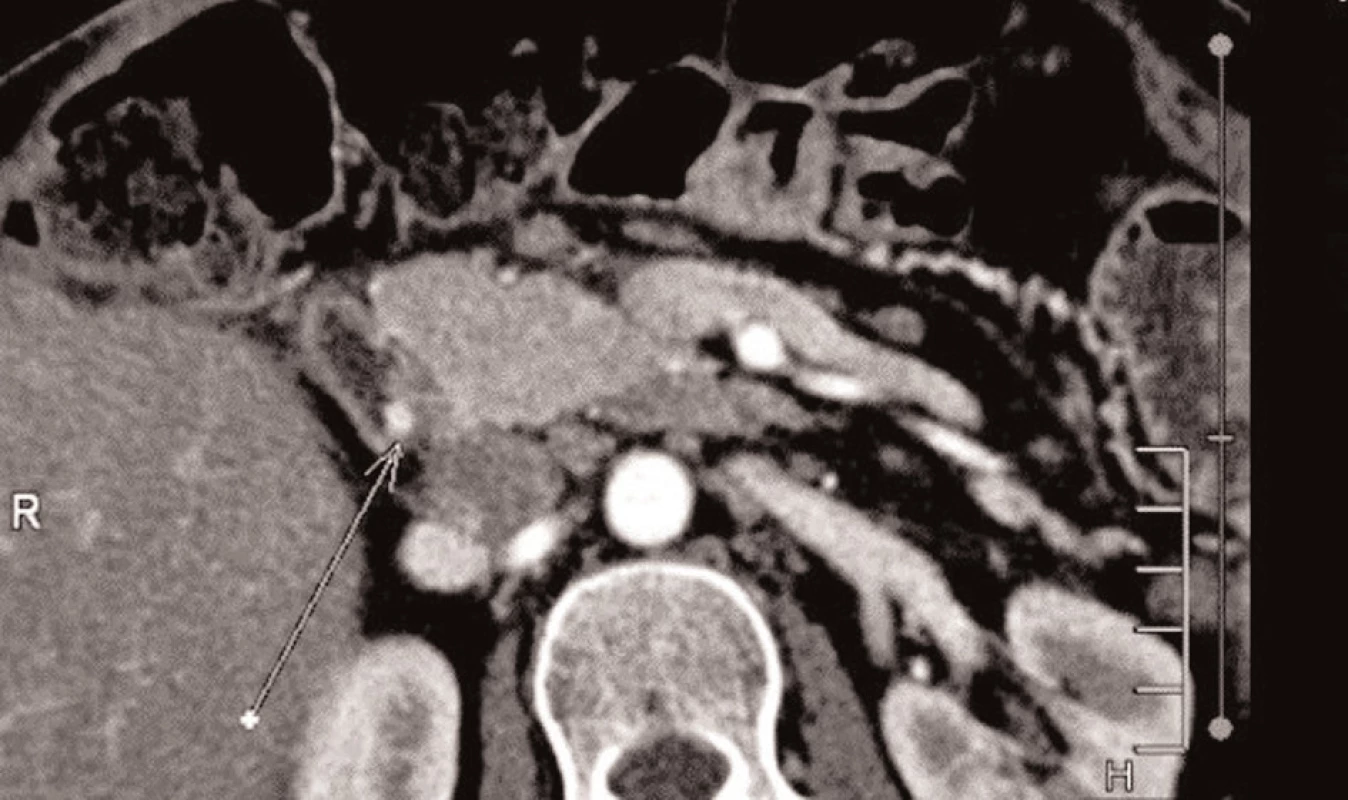
Image 5. MIBI scintigrafie příštítných tělísek u pacientky s MEN 1 a HPT Fig. 5: MIBI scintigraphy of the parathyroid glands in a patient with MEN 1 and HPT 
Diskuze
Chirurgie NET pankreatoduodenální oblasti patří mezi nejkontroverznější a nevyřešené otázky v rámci problematiky MEN 1 syndromu. V popředí stojí nejvíce diskutovaná chirurgie gastrinomů. NET tvoří 2–4 % všech tumorů pankreatu. Až 20 % je asociováno s MEN 1 [6]. Determinujícím faktorem dlouhodobého přežití je vznik jaterních metastáz. Důležitým poznatkem je fakt, že NET asociované s MEN 1 vykazují poměrně pomalý růst. Roční průměrný nárůst tumoru se udává mezi 11,2 a 24,1 %, u pacientů pod 40 let věku dokonce jen mezi 4,7 a 17,1 % [2]. Maligní potenciál je udáván mezi 75–100 %. Některé studie uvádějí 5leté přežívání s neléčeným metastatickým jaterním postižením až 30 % [6], resp. 20leté přežívání u 40 % pacientů s difúzním jaterním postižením [7]. Z Nortonovy studie vyplývá, že pacienti s NET pod 2 cm mají 100 % 15leté přežití i bez chirurgické léčby. Chirurgicky léčení pacienti s prokazatelně maligním tumorem vykazují 5leté přežívání 81 % [6]. Problémem zůstává nízká biochemická kurabilita méně radikálních výkonů. Udává se mezi 0 a 38 %, a to z důvodu perzistujících nádorů či rekurence onemocnění. Mnohá pracoviště se recentně kloní k agresivnější chirurgické léčbě ve smyslu Whippleovy operace. Dokladují biochemickou kurabilitu 75–100 % [3,5,7,10,11]. Vycházejí mimo jiné z poznatku, že většina gastrinomů se vyskytuje v duodenu. Dosud nebyl dokázán vliv agresivnějšího chirurgického výkonu na dlouhodobé přežívání (nad 10 let) pacientů s NET asociovaných s MEN 1. Stejně tak chybějí poznatky o dlouhodobém vedlejším efektu operace u těchto pacientů. Po Whippleově operaci je udávána rekurence nefunkčních PET v remnantu slinivky 73 % [5]. Reoperace po takovémto výkonu je obtížná. Limitaci operace představuje i pro event. embolizační léčbu metachronních jaterních metastáz. Rozsah výkonu se samozřejmě řídí peroperačním nálezem. Zatím však obecně zastávaným chirurgickým výkonem zůstává distální pankreatektomie s provedením IOUS, enukleací tumorů hlavy slinivky, duodenotomií a lymfadenektomií v rozsahu peripankreaticky, truncus coeliacus a ligamentum hepatoduodenale [3]. Whippleova operace je rezervována pro mladé pacienty, pacienty s objemným tumorem hlavy či četnými ložisky v duodenu nebo rychle rostoucí léze. Alternativou může být v konkrétních případech provedení pankreas šetřící duodenektomie s udávanou biochemickou kurabilitou 72 % [10]. Lepších výsledků dosahuje chirurgická léčba u pacientů pod 50 let věku a bez přítomných vzdálených metastáz. Bohužel většina výsledků je získána z nerandomizovaných retrospektivních studií, vzhledem k raritnosti onemocnění provedených na souborech čítajících výrazně pod 100 pacientů.
Za posledních pět let jsme na naší klinice operovali jedinou pacientku s diagnostikovaným MEN 1 syndromem. I přes typický průběh onemocnění bylo u pacientky určení základní diagnózy vleklé a vedlo k opožděnému zahájení adekvátní léčby.
Pacientka byla dlouhodobě konzervativně i chirurgicky léčena pro torpidní vředovou chorobu gastroduodena. S diagnózou ZES byla později operována na našem pracovišti, kdy jsme provedli distální pankreatektomii se splenektomií. V souladu s výše uvedenými poznatky byl zvolen obecně uznávaný méně radikální chirurgický výkon šetřící parenchym pankreatu. Předoperačně nebyla dostupná SASI, stejně tak peroperačně nebyl proveden IST. Léze byly peroperačně bimanuálně verifikovány operatérem, na základě peroperačního nálezu byl proveden zmíněný výkon. Pooperačně však nebylo dosaženo biochemické kurability a CT s oktreoskenem verifikovaly reziduální ložiska v oblasti duodena a pankreatu. Alternativním výkonem mohla být Whippleova resekce s event. parciální resekcí kaudy a exstirpací ložiska slezinného hilu. Možné bylo výkon doplnit o duodenotomii s pokusem o excizi ložisek a enukleací reziduálního ložiska pankreatu. Diagnóza základního onemocnění však byla stanovena až pooperačně při náhodném nálezu ložisek příštítných tělísek a klinicky němým HPT. Nelze vyloučit, že pacientka v budoucnu prodělá další reoperaci. Nyní je onemocnění stabilizováno medikamentózně a pacientka je řádně dispenzarizována. Náš případ poukazuje na důležitost časné diagnostiky pro volbu léčebné strategie u „relativně“ vzácného onemocnění, jakým je syndrom MEN 1.
Závěr
Syndrom mnohočetné endokrinní neoplázie typu 1 je relativně vzácné autosomálně dominantně dědičné onemocnění, na které nebývá v klinické praxi pomýšleno. Z genetického hlediska jde o mutaci chromozomu pro tumor supresorový protein menin. Následkem toho se u pacientů v průběhu života vyvíjejí různé endokrinní či hormonálně afunkční neoplázie. Stěžejně postiženými orgány jsou příštítná tělíska, slinivka a hypofýza. Nejzávažnějším negativním faktorem ovlivňujícím délku přežívání pacientů s MEN 1 je vznik maligních tumorů zejména pankreatoduodenální oblasti, resp. jejich jaterní metastázy, podílející se více než 30 % na mortalitě pacientů s MEN 1. V současné době nejsou k dispozici prostředky k vyléčení. Léčba je vedena s cílem stabilizace onemocnění a prevence jaterních metastáz. Měla by vždy probíhat ve specializovaném centru. Nejkontroverznější otázkou stále zůstávají hormonálně afunkční NET a gastrinomy. O indikaci a rozsahu chirurgické léčby se po desetiletí vedou spory. Trendem mnoha pracovišť je, hlavně u mladších pacientů, volba agresivnějšího, cíleného přístupu se snahou o zachování co největší části tkáně pankreatu. Takto jsme postupovali i u naší 38leté nemocné.
Výsledky léčby nemocných s MEN 1 s projevy v pankreatoduodenální oblasti nejsou stále uspokojivé. Především proto, že se včas na tuto diagnózu v průběhu diagnostiky nepomýšlí. V budoucnu bude třeba dalších prospektivních studií k validnímu zhodnocení dosavadních léčebných metod.
Zkratky
FNA – fine needle biopsy
SASI – selective aretrial secretin injection
SSRI – selective secretin reuptake inhibitor
SRS – somatostatin receptor scintigraphy
EUS – endoultrasonography
NET – neuroendokrinní tumor
IST – intraoperative secretin test
MUDr. Kateřina Menclová
Chirurgická klinika 2. LF UK a ÚVN Praha
U Vojenské nemocnice 1200
169 02 Praha 6
e-mail: katerina.menclova@uvn.cz
Sources
1. Brandi ML. Consensus: Guidelines for Diagnosis and Therapy of MEN Type 1 and Type 2. The Journal of Clinical Endocrinology & Metabolism 2001;86 : 5658–5671.
2. Waldman J, Langer P. Screening of Patiens with Multiple Endocrine Neoplasia Type 1 (MEN-1): A Critical Analysis of Its Value. World J Surg 2009;33 : 1208–1218.
3. Norton JA, Jensen RT. Resolved and Unresolved Controversies in the Surgical Management of Patiens With Zollinger-Ellison Syndrome. Ann Surg 2004;240 : 757–773.
4. Gibril F, Jensen RT. Multiple Endocrine Neoplasia Type 1 and Zollinger-Ellison Syndrome: A prospective study of 107 Cases and Comparison With 1009 Cases From the Literature. Medecine 2004;83 : 43–83.
5. Bartsch D, Rothmund M. Outcome of Duodenopancreatic Resections in Patiens With Multiple Endocrine Neoplasia Type 1. Ann Surg 2005;242 : 757–766.
6. Fendrich V, Langer P, Celik I, Bartsch DK, Zielke A, et al. An aggressive surgical approach leads to long-term survival in patients with pancreatic endocrine tumors. Ann Surg 2006;244 : 845–851
7. Norton JA, Jensen RT. Comparison of Surgical Results in Patiens With Advanced and Limited Disease With Multiple Endocrine Neoplasia Type 1 and Zollinger-Ellison Syndrome. Ann Surg 2001;234 : 495–506.
8. Zamrazil V. Neuroendokrinní tumory. Interní Med 2007;9 : 514–519.
9. Waldman J, Langer P. Fast-growing pancreatic neuroendocrine carcinoma in a patient with multiple endocrine neoplasia type 1: a case report. J Med Case Reports 2008;2 : 354.
10. Imamura M, Inoue N. Biochemically curative surgery for gastrinoma in multiple endocrine neoplasia type 1 patients. World J Gastroenterol 2011;14 : 1343–1353.
11. Tonelli F, Brandi ML. Pancreatectomy in Multiple Endocrine Neoplasia Type 1 – Related Gastrinomas and Pancreatic Endocrine Neoplasias. Ann Surg 2006;244 : 61–70.
12. Imamura M, Tobe T. Curative Resection of Multiple Gastrinomas Aided by Selective Arterial Secretin Injection Test and Intraoperative Secretin Test. Ann Surg 1989;210 : 710–716.
13. Kala Z, Svatoň R. Neuroendokrinní nádory pankreatu – pohled chirurga. Onkologie 2010;4 : 344–348.
14. Hlavsa J. Radiofrekvenční ablace neuroendokrinního nádoru pankreatu. Klin Onkol 2011;24 : 209–215.
15. Kooperativní skupina pro neuroendokrinní nádory [on line], dostupné na www.neuroendokrinni-nadory.cz.
16. Kianmanesh R, Belghiti J. Traitement chirurgical des tumeurs endocrines gastro-entéro-pancréatiques. Journal de chirurgie 2005;142 : 132–149.
17. Krysiak R, Okopień B. Atypical clinical manifestation of multiple endocrine neoplasia type 1 syndrome. Pol Arch Med Wewn 2009;119 : 175–179.
18. Sakurai A. Clinical features of insulinoma in patients with MEN 1: analysis of the database of the MEN Consortium of Japan. Endocrine Journal 2012;59 : 859–866.
19. European Neuroendocrine Tumor Society [on line], dostupné na www.enets.org.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2013 Issue 11-
All articles in this issue
- Syndrom mnohočetné endokrinní neoplázie typu 1 se zvláštním důrazem na tumory pankreatoduodenální oblasti – rozbor vlastní kazuistiky
- Laparoskopická laváž a drenáž v léčbě akutní divertikulitidy: Je čas na změnu?
- Rekonstrukce rozsáhlých defektů stěny břišní metodou separace komponentů
- Miniinvazivní videoasistované operace srdečních vad
- Heparinem indukovaná trombocytopenie u pacientky s akutní trombózou a disekcí břišní aorty a ALI DKK
- Obtížná diferenciální diagnostika maligního melanomu – kazuistiky
- Hrudní drenáž – fyziologické a patofyziologické poznámky a indikace
- Metodika hrudní drenáže
- Hrudní drenážní systémy a komplikace s drenáží spojené
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Hrudní drenážní systémy a komplikace s drenáží spojené
- Metodika hrudní drenáže
- Hrudní drenáž – fyziologické a patofyziologické poznámky a indikace
- Rekonstrukce rozsáhlých defektů stěny břišní metodou separace komponentů
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

