-
Medical journals
- Career
Porucha evakuace žaludku po parciální duodenopankreatektomii
Authors: J. Leffler; T. Krejčí; B. East
Authors‘ workplace: Chirurgická klinika 2. LF a FN Motol, Praha, přednosta: Prof. MUDr. J. Hoch, CSc.
Published in: Rozhl. Chir., 2012, roč. 91, č. 8, s. 422-426.
Category: Original articles
Práce byla věnována prof. MUDr. Jiřímu Hochovi, CSc. při příležitosti jeho významného životního jubilea.
Overview
Úvod:
Porucha evakuace žaludku (PEŽ) je poměrně častou komplikací pooperačního průběhu nemocných po parciální duodenopankreatektomii (PDPE) a významně se podílí na pooperační morbiditě. V naší odborné literatuře byla PEŽ věnována doposud jen malá pozornost. Cílem práce je prezentovat a rozebrat vlastní zkušenosti s výskytem PEŽ po PDPE.Materiál a metodika:
Retrospektivní analýza prospektivně shromažďovaných dat 106 nemocných, kterým byla v letech 2001–2011 provedena PDPE na Chirurgické klinice 2. LF a FN Motol. Vlastní výsledky byly statisticky zpracovány pomocí χ2 testu na shodu podílu s korekcí spojitosti, statistická významnost je na 5% hladině spolehlivosti (p < 0,05).Výsledky:
Ve sledovaném období byla PDPE provedena u 106 pacientů s patologickým procesem v oblasti hlavy pankreatu. V pooperačním období zemřeli 4 pacienti (30denní letalita 3,8 %). Závažné pooperační komplikace se vyskytly u 31 nemocných (morbidita 29 %), přičemž klinicky významnou PEŽ (stupeň B a C) měla téměř polovina z nich (16 nemocných). Současně s PEŽ se vyskytly i další závažné komplikace u 4 nemocných (2krát insuficience pankreatické anastomózy, žlučová píštěl 1krát a zevní pankreatická píštěl 1krát). Neprokázali jsme statisticky významný rozdíl výskytu PEŽ na typu resekce pankreatu ani na typu pankreatické anastomózy.Závěr:
PEŽ se významně podílí na pooperační morbiditě pacientů po PDPE a v nezanedbatelném počtu případů je spojena s jinou závažnou pooperační komplikací.Klíčová slova:
pooperační komplikace po PDPE – porucha evakuace žaludku – typ pankreatické anastomózy – možnosti léčeníÚvod
PDPE je rozsáhlý resekční výkon prováděný pro patologický proces v oblasti hlavy pankreatu. Pooperační letalita (30denní letalita) sice poklesla na přelomu století ve většině center pankreatické chirurgie pod 5 %, problémem ale zůstává poměrně vysoká morbidita dosahující až 60 % [1, 2].
PEŽ se na pooperační morbiditě podílí až v polovině případů [3], a ačkoliv nebývá přímou příčinou úmrtí, podílí se významně na dyskomfortu operovaných i na prodloužení doby hospitalizace. I když PEŽ po PDPE je problém dosti častý, nebyla jí v naší odborné literatuře doposud věnována větší pozornost.
Materiál a metodika
V období I/01 až XII/11 bylo na Chirurgické klinice 2. LF a FN Motol provedeno 106 PDPE pro maligní i benigní patologické procesy v hlavě pankreatu a periampulární oblasti. Retrospektivně jsme vyhodnotili ukládaná data se zaměřením na výskyt PEŽ u těchto pacientů.
Jako PEŽ jsme hodnotili až do roku 2008 stav definovaný skupinou z Baltimoru (4), kdy je u pacienta nutná dekomprese žaludku déle než 10 dní po operaci a/nebo nemocný po této době zvrací či netoleruje příjem p. o. Od roku 2008 používáme kritéria vydaná mezinárodní skupinou pro pankreatickou chirurgii (International Study Group of Pancreatic Surgery ISGPS) [5].
Jelikož údaje odpovídající nejlehčímu průběhu PEŽ (do 7 dnů od operace – stupeň A) v předchozím období chybějí, hodnotíme v celém souboru pacientů jako komplikaci pouze klinicky významné stavy gastroparezy přesahující 10 dnů a odpovídající tak stupni B a C.
V celém souboru jsme sledovali závislost výskytu PEŽ na typu výkonu bez zachování pyloru (Kausch-Whipple) či s jeho zachováním (Traverso-Longmire) a rovněž použitého způsobu anastomózy zbytku pankreatu buď do jejunální kličky (PJA), nebo do zadní stěny žaludku (PGA). Dále jsme sledovali, zda se PEŽ vyskytovala jako jediná pooperační komplikace nebo zda byla pozorována spolu s výskytem některé další závažné komplikace.
Všichni pacienti s PEŽ byli vyšetření endoskopicky k ověření průchodnosti anastomózy mezi žaludkem/duodenem a jejunální kličkou a byla vyloučena organická překážka v oblasti anastomózy.
V léčbě nemocných s PEŽ jsme standardně vedle dekomprese žaludku nasogastrickou sondou zaměřili pozornost na korekci vodní a minerálové dysbalance a kalorické krytí parenterální výživou. Podání prokinetik a blokátorů protonové pumpy bylo používáno nekonstantně v závislosti na dalším vývoji celkového stavu, stejně tak podání kortikoidů k eventuálnímu snížení edému anastomózy. Posouzení efektivity použití jednotlivých součástí konzervativní léčby PEŽ nebylo možno korektně hodnotit a není předmětem studie.
Operační revizi jsme indikovali u nemocných se současným výskytem i jiné závažné komplikace, která vyžadovala chirurgickou intervenci, tedy především při porušeném hojení pankreatické anastomózy. Při samostatném výskytu PEŽ jsme chirurgickou revizi indikovali pouze při neúspěchu konzervativní léčby více než 3 týdny trvající a v závislosti na dynamice vývoje symptomů a celkového stavu pacienta.
Vlastní výsledky byly statisticky zpracovány pomocí χ2 testu na shodu podílu s korekcí spojitosti, statistická významnost je na 5% hladině spolehlivosti (p < 0,05).
Výsledky
Ze 106 pacientů, u nichž byla provedena PDPE, zemřeli v pooperačním období 4 (30denní letalita 3,8 %). Závažné pooperační komplikace spojené s výkonem se vyskytly u 31 operovaných (29 %), přičemž 4 pacienti měli současně dvě. Z těchto 35 komplikací byla nejčastěji zastoupena PEŽ, kterou mělo 16 pacientů, tedy téměř polovina (46 %). Zevní pankreatickou píštěl mělo 8 nemocných (23 % komplikací), insuficienci pankreatické anastomózy 7 pacientů (tj. 20 %, přičemž u 4 pacientů šlo o insuficienci pankreatojejunoanastomózy (PJA) a u 3 pankreatogastroanastomózy (PGA). Ve dvou případech se vyskytla zevní žlučová píštěl (6 %) a 2 nemocní byli reoperováni pro časné krvácení do dutiny břišní.
Samotná PEŽ bez jiné klinicky závažné komplikace byla u 12 nemocných (75 %). U dvou pacientů byla vedle PEŽ insuficience PJA (12,5 %) a po jednom případu provázela PEŽ zevní biliární píštěl a zevní pankreatická píštěl.
U 53 pacientů v souboru byla provedena PDPE s resekcí pylorické oblasti žaludku a gastrojejunoanastomózou (Kausch-Whipple) a PEŽ jsme pozorovali u 9 z nich (17 %). Stejný počet resekcí byl proveden ve variantě se zachováním pyloru (Traverso-Longmire) a PEŽ mělo 7 nemocných (13 %). Mezi oběma skupinami není statisticky významný rozdíl.
Anastomóza zbytku pankreatu byla provedena v 61 případech do jejunální kličky, PEŽ se vyskytla u 11 z nich (18 %). Ve zbývajících 45 případech jsme provedli anastomózu zbytku pankreatu do zadní stěny žaludku a porucha evakuace žaludku byla zaznamenána u 5 (11 %). Ani zde nebyl prokázán statisticky významný rozdíl.
Table 1. Definice poruchy evakuace žaludku ISGPS [5] Tab. 1: ISGPS definition of delayed gastric emptying [5] ![Definice poruchy evakuace žaludku ISGPS [5]
Tab. 1: ISGPS definition of delayed gastric emptying [5]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/9cc0407ebb8f870ca39b549fff0e0e44.png)
Table 2. Komplikace po PDPE ve vztahu k poruše evakuace žaludku (n = 106 pacientů) Tab 2: Complications following PDPE with regards to delayed gastric emptying (n = 106 patients) 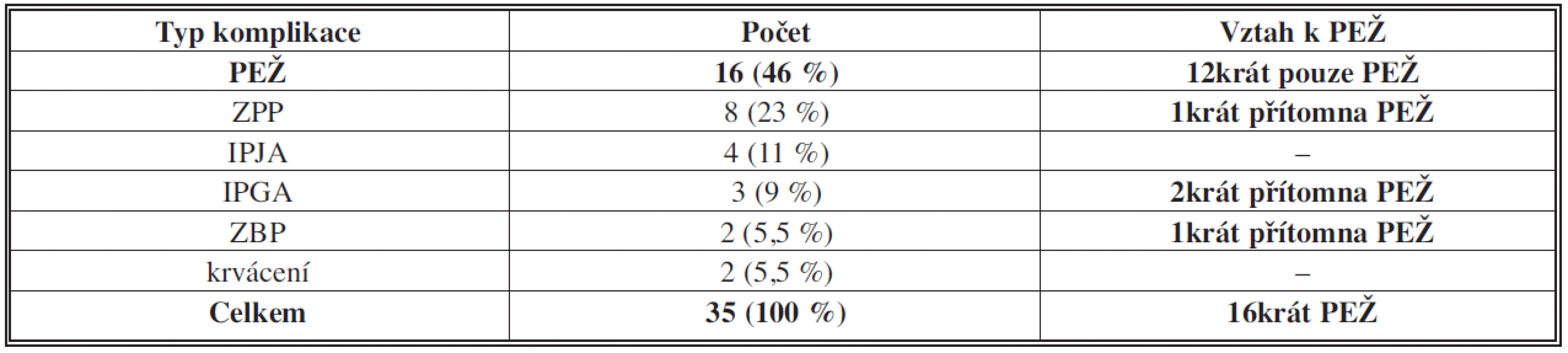
Použité zkratky: PEŽ – porucha evakuace žaludku, ZPP – zevní pankreatická píštěl, IPJA – insuficience pankreato-jejuno anastomózy, IPGA – insuficience pankreato gastro anastomózy, ZBP – zevní biliární píštěl Table 3. Výskyt poruchy evakuace žaludku podle typu resekce pankreatu Tab. 3: Incidence of delayed gastric emptying depending on the type of pancreatic resection 
Table 4. Výskyt poruchy evakuace žaludku podle typu pankreatické anastomózy Tab. 4: Incidence of delayed gastric emptying depending on the type of pancreatic anastomosis 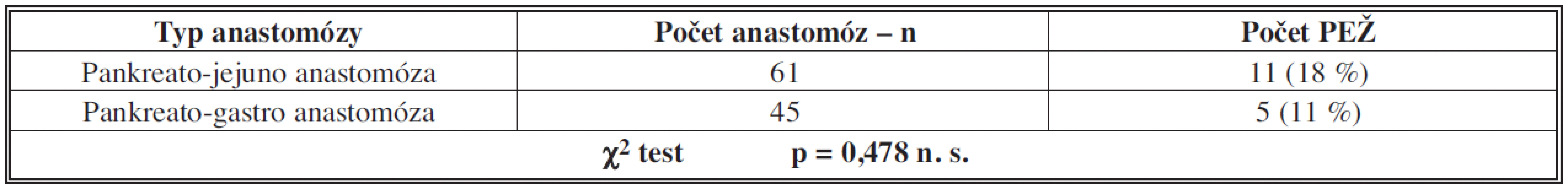
Konzervativní léčba vedla k ústupu symptomů PEŽ u 10 z 12 nemocných, u nichž nebyla PEŽ sdružena s jinou pooperační komplikací. Další 4 pacienti se sdruženou komplikací poruchy hojení pankreatické nebo biliární anastomózy byli léčeni symptomaticky se zaměřením na zvládnutí anastomotické komplikace. V těchto případech ústup symptomatologie PEŽ koreloval s úspěšností zavedené léčby, a PEŽ je tak možno považovat za průvodní komplikaci při porušeném hojení anastomóz. Ve dvou případech déle než 3 týdny trvající neúspěšné konzervativní léčby jsme po opakovaných endoskopických i rentgenových kontrolách anastomózy (v obou případech duodenojejunoanastomózy typu Traverso-Longmire) indikovali operační revizi s plánem resekce pylorické oblasti a převedením na gastrojejunoanastomózu (tedy konverzi na Kausch-Whipple). V prvním případě jsme peroperačně nenalezli žádné morfologické změny v oblasti anastomózy vysvětlující přetrvávající poruchu evakuace, ale po resekci anastomózy a antrektomii se stav bezprostředně upravil. U další pacientky jsme ovšem překvapivě nalezli příčinu přetrvávající PEŽ v podsunutí podstatné části jejuna podél retromezentericky vedené 1. jejunální kličky použité k duodenojejunoanastomóze (a k hepatikojejunoanastomóze, pankreatická anastomóza byla založena do žaludku). Symptomatologie PEŽ tak byla vyvolána neúplnou mechanickou překážkou aborálního úseku jejuna a řešením byla repozice jejuna zpět do inframezokolického prostoru, uzavření retromezenterického defektu a fixace jejunální kličky v příslušné poloze. Pacientka bohužel v dalším průběhu podlehla septickým komplikacím z mimobřišního zdroje.
Diskuze
Porucha evakuace žaludku patří mezi nejčastější komplikace v časném pooperačním průběhu po PDPE. Její výskyt je udáván v širokém rozmezí 15–60 % [1, 6, 7, 8, 9]. Velký rozptyl publikovaných výsledků je možno vysvětlit především nejednotností v použitých definicích PEŽ. V odborné literatuře bylo používáno minimálně 6 různých definic a jistou jednotu lze pozorovat až po vydání konsenzu Mezinárodní skupiny pankreatické chirurgie (ISGPS) v roce 2007 [5], která je v současnosti považována za standard hodnocení evakuační poruchy žaludku. Dále je v některých pramenech PEŽ hodnocena pouze jako solitárně se vyskytující komplikace, bez přítomnosti jiné závažné nitrobřišní komplikace, tzv. primární PEŽ [8], v jiných je naopak zdůrazňován častý výskyt současně s jinou nitrobřišní, nejčastěji anastomotickou, komplikací [10, 11].
Přestože je PEŽ po PDPE komplikací poměrně častou, není o patofyziologických mechanismech především primární PEŽ doposud příliš jasno. Vedle různých poruch neurohumorálního řízení evakuace žaludku působených sníženou hladinou cholecystokininu [23] nebo sekretinu [24] či změnou hladin motilinu po PDPE [25] může významnou roli hrát i peroperační porušení vagové inervace či ischemického poškození antra a pyloru např. při porušení a. gastrica dx. [12, 13, 14]. Za možnou příčinu je uvažována také mechanická překážka působená torzí nebo přílišnou angulací duodenojejunální anastomózy [15, 16]. Tuto hypotézu potvrzují výsledky několika prospektivních studií, kdy byl prokázán významný pokles výskytu PEŽ při konstrukci duodenojejunoanastomózy antekolicky ve srovnání s retrokolickým vedením jejunální kličky [9, 14]. Původně převládající názor, že PEŽ je daleko častější při zachování pyloru ve srovnání s klasickou resekcí dle Kausch-Whipple, byl řadou studií vyvrácen [10, 17, 18, 19]. Tomu odpovídají i vlastní výsledky: PEŽ jsme nalezli u 17 % pacientů po klasické resekci (K-W) a po pylorus zachovávající resekci (Traverso-Longmire) ve 13 %, tedy bez statistického rozdílu. V této souvislosti stojí za zmínku též doporučení některých autorů provádět před provedením duodenojejunoanastomózy mechanickou dilataci pyloru, čímž se výskyt evakuační poruchy sníží [20, 21]. Sami s tímto jednoduchým opatřením nemáme zatím zkušenosti.
Další sledovanou otázkou je, zda výskyt PEŽ je ovlivněn typem pankreatické anastomózy. Srovnání výsledků pankreatojejunoanastomózy (PJA) oproti pankreatogastroanastomóze (PGA) se většinou týká výskytu anastomotických komplikací a sledování PEŽ je věnována pozornost jen okrajově. Prospektivní randomizovaná studie z Verony [22] v této souvislosti prokázala signifikantně nižší výskyt PEŽ ve skupině PGA. Ačkoliv v obou skupinách (PGA vs. PJA) nebyl prokázán rozdíl v celkovém výskytu chirurgických komplikací, byla u pacientů s PJA nalézána častěji současně více než jedna komplikace. Nabízí se tak vysvětlení, že vyšší výskyt PEŽ po PJA koreluje s vyšším počtem sdružených komplikací, a nejedná se tak o primární evakuační poruchu. Ve vlastním souboru jsme významný rozdíl při použití obou typů anastomózy nepozorovali (18 % PEŽ po PJA vs. 11 % po PGA).
Při léčení pacientů s PEŽ je vedle symptomatické léčby, zahrnující nasogastrické odsávání, náhradu tekutin a minerálů a parenterální výživu, doporučována celá škála farmakologických opatření s různým efektem. Nejčastěji jsou v těchto případech stejně jako po jiných závažných operacích na GIT podávána parenterálně prokinetika. Specificky pro pacienty po PDPE je doporučováno i.v. podávání erythromycinu (26), který má obdobnou chemickou strukturu jako motilin. V novější japonské studii byl dokonce prokázán pozitivní efekt erythromycinu i v nízkých dávkách (1 mg/kg a 8 hod. profylakticky od 1. do 14. dne) [27]. V současnosti panuje k profylaktickému i terapeutickému podávání erythromycinu všeobecně spíše zdrženlivost, vlastní zkušenosti také nemáme. Totéž platí i o profylaktickém užití oktreotidu. Perioperační a dále 7 dní trvající podávání 100 mg oktreotidu s.c. zlepšilo pooperační evakuaci žaludku po PDPE v placebem kontrolované prospektivní studii (28). Jiné studie však tyto výsledky neopakovaly [29] a v posledních letech převažuje v indikaci oktreotidu pro profylaxi i léčbu primární PEŽ zdrženlivost [17]. Na Chirurgické klinice 2. LF a FNM jsme od standardního profylaktického podávání oktreotidu ustoupili již před 8 lety bez významného ovlivnění pooperačního průběhu.
Chirurgické léčení primární PEŽ, tedy izolovaně se vyskytující evakuační poruchy bez přítomnosti jiné intraabdominální komplikace, je v literatuře uváděné velmi vzácně [7]. Při přetrvávající symptomatologii je samozřejmě nutné vyloučit mechanickou příčinu neprůchodnosti anastomózy a pooperační ileus. Všichni pacienti s PEŽ podstoupili v závislosti na trvání a intenzitě symptomů i opakované endoskopické vyšetření a nativní i kontrastní rtg vyšetření. Pro přetrvávání symptomatologie v kolísavé intenzitě a nelepšící se po 3 týdnech konzervativní léčby jsme i při negativních nálezech indikovali 2 pacientky k operační revizi. Cílem výkonu bylo vyřešení stavu resekcí mechanicky sice průchodné, ale nefunkční duodenojejunoanastomózy se širokou gastrojejunoanastomózou, tedy jakási konverze z T-L na K-W. U první nemocné jsme skutečně nenalezli makroskopické změny v okolí anastomózy ani mechanickou poruchu průsvitu, ale stav se po resekci pylorické oblasti a antra rychle zlepšil. Přesvědčivé vysvětlení příčiny PEŽ v tomto případě nemáme, snad mohla být příčinou nadměrná angulace 1. jejunální kličky na místě „neoduodena“. Ve druhém případě byla při operační revizi jako příčina opakujícího se intermitentního zvracení nalezena neúplná mechanická obstrukce jejuna, která byla způsobena vysunutím asi 80cm úseku orálního jejuna retromezenterickým defektem do supramezokolického prostoru podél první jejunální kličky použité k anastomóze na duodenum a žlučovod. Stav jsme vyřešili prostou repozicí „přebytečného“ úseku střeva zpět do inframezokolického prostoru a uzávěrem retromezenterického defektu s novou fixací jejunální kličky v něm. Takovouto raritní situaci jsme naprosto nepředpokládali a ani při retrospektivním přezkoumání vývoje stavu a nálezů včetně kontrastního vyšetření pasáže GIT jsme nenašli přesvědčivý důvod k upuštění od hodnocení pooperačního stavu jako primární PEŽ. A právě v tom spatřujeme největší nebezpečí zejména primární, tedy bez jiné komplikace pooperačního průběhu se vyskytující PEŽ. Při současných možnostech korekce vodního a elektrolytového hospodářství i parenterální výživy je možné udržovat pacienta v relativně stabilizovaném stavu i delší dobu, a pokračovat tak v konzervativní léčbě PEŽ. Přetrvává-li však symptomatologie po 3. týdnu po PDPE, a chybí-li jiná komplikace (především anastomotická) jako možná příčina, je třeba zvážit indikaci reoperace k objasnění a úpravě stavu.
Závěr
Porucha evakuace žaludku je nejčastější pooperační komplikací po PDPE bez ohledu na typ pankreatické anastomózy i na (ne)zachování pyloru. Až ve třetině případů se vyskytuje spolu s jinou, zejména anastomotickou komplikací a její zvládnutí je v těchto případech závislé na úspěšnosti léčení poruchy hojení anastomózy. Primární PEŽ má multifaktoriální etiologii a ne vždy zcela objasněnou patofyziologii rozvoje a přetrvávání. Léčba je obvykle symptomatická, ale ve vzácných případech nereagujících na léčbu je i při negativních nálezech endoskopie a kontrastního rtg vyšetření indikována relaparotomie, která může odhalit a odstranit neočekávanou příčinu.
Doc. MUDr. Jan Leffler, CSc.
Hošťálkova 90
169 00 Praha 6
e-mail: jan.leffler@lfmotol.cuni.cz
Sources
1. Vin Y, Sima CS, Getrajdman GI et al. Management and outcomes of postpancreatectomy fistula, leak and abscess: results of 908 pacients resected at single institution between 2000 and 2005. J Am Coll Surg 2008;207 : 490–498.
2. Yeo CJ, Cameron JL, Sohn TA et al. Six hundret fifty consecutive pancreaticoduodenectomies in the 1990s: patology, complications, and outcomes. Ann Surg 1997;226 : 248–257.
3. Balcom JH 4th, Rattner DW, Warshaw AL et al. Ten-year experience with 733 pancreatic resections: changing indications, older patiens, and decreasing lenght od hospitalisation. Arch Surg 2001;136 : 391–398.
4. Crist D, Sitzmann JV, Cameron JL. Improved hospitál morbidity, mortality and surfoval after the Whipple procedure. Ann Surg 1987;206 : 358–365.
5. Wente MN, Bassi C, Dervenis C, et al. Delayed Bystric emptying (DGE) after pancreatic surgery: a suggested definition by the International Study Group of Pancreatic Surgery (ISGPS), Surgery 2007;142 : 761–768.
6. Malleo G, Crippa S, Butturini G et al. Delayed Bystric emptying after pylorus-preserving pancreaticoduodenectomy: validation of International Study Group of Pancreatic Surgery classification and analysis of risk factors. HPB 2010;12(9):610–618.
7. Lytras D, Paraskevas KI, Avgerinos C et al. Therapeutic strategie for the management of delayed gastric empying after pancreatic resection. Langenbecks Arch Surg 2007;392(1):1–12.
8. Eshuis WJ, van Dalen JW, Busch OR, et al. Route of gastroenteric reconstruction in pancreatoduodenectomy and delayed gastric emptying. HPB 2012;14(1):54–59.
9. Tani M, Terasawa H, Kawai M et al. Improvement of delayed gastric emptying in pylorus-preserving pancreaticoduodenectomy. Ann Surg 2006243(3):316–320.
10. Van Berge Henegouwen MI., van Gulik TM, DeWit LT et al. Delayed gastric emptying after standars pancreaticoduodenectomy versus pylorus - preserving pancreaticoduodenectomy: an analysis of 200 consecutive patiens. J Am Coll Surg 1997; 185 : 373–379.
11. Fabre JM, Burgel JS, Navarro F et al. Delayed gastric emptying after pancreaticoduodenectomy and pancreaticogastrostomy. Eur J Surg 1999;165 : 560–565.
12. Braasch JW, Deziel DJ, Rossi RL et al. Pyloric and gastric preserving pancreatic resection: experience with 87 patients. Ann Surg 1986;204 : 411–418.
13. Liberski SM, Kochal, Antip RG et al. Ischemic gastroparesis: resolution after revascularisation. Gastroenetology 1990;99 : 252–257.
14. Hartel M, Wente MN, Hinz U et al. Effect of antecolic reconstruction on delayed gastric emptying after the pylorus-preserving Whipple procedure. Arch Surg 2005;140 : 1094–1099.
15. Horstmann O, Markus PM, Ghadimi MB et al. Pylorus preservation has no impact on delayed gastric emptying after pancreatic head resection. Pankreas 2004;28 : 69–74.
16. Kingsnorth AN, Berg JD, Gray MR. A novel reconstructive technique for pylorus-preserving pancreaticoduodenectomy: avoidance of early postoperative gastric stasis. Ann R Coll Surg Engl 1993;75 : 38–42.
17. Paraskevas KI, Avgerinos C, Manes C et al. Delayed gastric emptying is associated with pylorus-preserving but not classical Whipple pancreaticoduodenectomy: A review of the literature and critical reappriasal of the implicated pathomechanism. World J Gastroenterol 2006;7,12(37):5951–5958.
18. Patel AG, Toyama MT, Kusske AM et al. Pylorus-preserving Whipple resection for pancreatic cancer. Is it any better? Arch Surg 1995;130 : 838–842.
19. Tran KT, Smeenk HG, van Eijck CH et al. Pylorus preserving pancreaticoduodenectomy versus standard Whipple procedure: a prospective, randomized, multicenter analysis of 170 patients with pancreatic and periampullary tumors. Ann Surg 2004;240 : 738–745.
20. Bassi C, Falconi M, Salvia R et al. Management of complications after pancreaticoduodenectomy in a high volume centre: results on 150 consecutive patiens. Dig Surg 2001;18 : 453–457.
21. Uravič M, Zelič M, Petrošič N et al. Effect of pyloric dilatation on gastric emptying after pylorus-preserving pancreaticoduodenectomy. Hepatogastroenterology 2011;5(112):2144–2147.
22. Bassi C, Falconi M, Molinari E et al. Reconstruction by pancreaticojejunostomy versus pancreaticogastrostomy following pancreatectomy. Ann Surg 2005;242(6):767–773.
23. Liddle RA, Merita ET, Conrad CK et al. Regulation of gastric emptying in humans by cholecystokinin. J Clin Incest 1986;77 : 992–996.
24. Kleibeuker JH, Beekhuis H, Piers DA et al. Retardation of gastric emptying of solid food by sekretin. Gastroenterology 1988;94 : 122–126.
25. Miedema BW, van Heerden JA, Nagorney DM et al. Complications following pancreaticoduodenectomy. Current management. Arch Surg 1992;127 : 945–949.
26. Yeo CJ, Barry MK, Kauter PK et al. Erythromycin accelerates gastric emptying after pancreaticoduodenectomy. A prospective, randomized, placebo-controlled trial. Ann Surg 1993;218 : 229–237.
27. Ohwada S, Satoh Y, Kawate S et al. Low-dose erythromycin reduces delayed gastric emptying and improves gastric motility after Billroth I pylorus-preserving pancreatoduodenectomy. Ann Surg 2001;234 : 668–674.
28. Van Berge Henegouwen MI, van Gulik TM, Akkermans LM et al. The effect of octreotid on gastric emptying at dosage used to prezent complications after pancreatic surgery: a randomised, placebo controlled study in volunteers. Gut 1997;41 : 758–762.
29. Yeo CJ, Cameron JL, Lellemoe KD et al. Does prophylactic octreotide decrease the rates of pancreratic fistula and other complications after pancreaticoduodenectomy? Results of a prospective randomised placebo-controlled trial. Ann Surg 2000;232 : 419–429.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2012 Issue 8-
All articles in this issue
- Chirurgická léčba jaterních metastáz karcinomu žaludku
- Porucha evakuace žaludku po parciální duodenopankreatektomii
- K-ras mutace a nádory infiltrující lymfocyty u karcinomu kolon, současnost a výhledy
- Poranenie brušnej steny cudzím telesom s neskorou perforáciou GITu
- Komplikace augmentace – kazuistika
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Komplikace augmentace – kazuistika
- Chirurgická léčba jaterních metastáz karcinomu žaludku
- Porucha evakuace žaludku po parciální duodenopankreatektomii
- Poranenie brušnej steny cudzím telesom s neskorou perforáciou GITu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

