-
Medical journals
- Career
Nekrotizující fasciitida břišní stěny po cholecystektomii – kazuistika
Authors: J. Jandík; J. Vokurka
Authors‘ workplace: Chirurgické oddělení, Oblastní nemocnice Rychnov nad Kněžnou, a. s., prim. MUDr. J. Kudr
Published in: Rozhl. Chir., 2009, roč. 88, č. 1, s. 27-31.
Category: Monothematic special - Original
Overview
Autoři prezentují případ pacienta s život ohrožující infekční rannou komplikací po rutinní operaci s důrazem na nutnost neodkladné diagnostiky a terapie. Po cholecystektomii došlo během 48 hodin k rozvoji sepse a rozsáhlé nekrotizující anaerobní infekce pooperační rány s destrukcí břišní stěny. Stav si vyžádal opakované extenzivní nekrektomie s hospitalizací pacienta na lůžku ARO s nutností umělé plicní ventilace a oběhové podpory. Následně vzniklý rozsáhlý defekt břišní stěny byl během 5 týdnů zhojen s použitím podtlakové léčby a dermoepidermálního štěpu.
Klíčová slova:
nekrotizující fasciitis – ranná infekce – komplikace cholecystektomie klostridiová infekce – nekrotizující infekce měkkých tkáníÚVOD
První literární zmínky o nekrotizujících infekcích lze nalézt již u Hippokrata, z novodobých autorů pak u J. Jonese, chirurga Konfederační armády za občanské války v USA z roku 1871. V evropském písemnictví lze dohledat popis lokalizované nekrotizující infekce měkkých tkání perinea od J. A. Fourniera z roku 1883. Generalizované formy popsal poprvé F. L. Meleney v roce 1924, N. F. Wilson pak poprvé použil termín nekrotizující fasciitidy v roce 1952.
Nekrotizující fasciitida (NF) patří do skupiny klinicky rozmanitých syndromů v literatuře označovaných jako nekrotizující infekce měkkých tkání (necrotizing soft tissue infections – NSTI). Jejich společným rysem je invazivní infekční proces rychle se šířící relativně hypoxickými epifasciálními prostory, který ve svém důsledku vede k trombóze perforátorových cév s následnou nekró - zou podkoží a kůže v daném regionu, nekróze může propadat i přilehlý sval. Postižení bývá plošně i objemově extenzivní a rozsah procesu v hlubších tkáních je obvykle větší než kožní projevy.V literatuře tak nalezneme termíny celulitis, fascitis či myositis pojmenované s ohledem na anatomickou vrstvu dominantně postiženou nekrózou, dalšími používanými synonymy jsou např. synergická gangréna, FourniŹrova gangréna, neklostridiová anaerobní celulitida aj. Klinický průběh je těžko předvídatelný a při prodlevě v diagnostice a terapii vede infekce rychle k sepsi s multiorgánovým selháním, průběh je nezřídka fulminantní s fatálním koncem. Mortalita je v literatuře uváděna s velkým rozmezím od 6 % do 76 %, kumulativní mortalita v souhrnu 700 pacientů z 29 větších publikovaných souborů je uváděna 34 % [1, 2, 10]. Vstupní bránou může být poranění měkkých tkání, kousnutí hmyzem či savci včetně člověka, chronické končetinové defekty, aplikace injekcí u pacientů či častěji drog u intravenózních narkomanů, dále je zdokumentován rozvoj NF jako komplikace perianálních abscesů a samozřejmě operačních ran. Existují kazuistická sdělení o případech nekrotizující fasciitidy jako komplikace perforace divertiklu sigmoidea [1, 2, 3, 5]. Z mikrobiologického hlediska jde o infekce častěji polymikrobiální, nejčastěji izolovanými původci jsou streptokoky sk. A, str. pyogenes, koaguláza negativní stafylokoky, z gramnegativních aerobů pak E. coli, Enterobacter cloacae, Klebsiela sp., Proteus sp., Serratia sp., z anaerobů Bacteroides sp. a Clostridium sp. Méně často (20 %) jde o monomikrobiální procesy způsobené hlavně streptokoky sk. A. [1, 3, 4, 10]. K uváděným rizikovým faktorům rozvoje patří obezita, imunosuprese, diabetes mellitus, chronické choroby včetně malignit, poruchy periferního prokrvení, malnutrice, vysoký věk, užívání drog a renální insuficience [1, 4, 6]. Nebezpečí NSTI tkví v jejich relativní vzácnosti a fatálnímu průběhu, pokud jsou pozdě rozpoznány. Poromanski a Andriessen (2004) uvádějí incidenci 0,4 případy na 100 000 obyvatel [16]. Klinické příznaky [2] lze rozdělit do 3 skupin podle časového průběhu:
1. časné příznaky (prvních 24 hodin):
- poranění povrchu těla vč. operační rány, jež nejeví známky infekce,
- bolest příslušné oblasti těla nebo končetiny, která je neobvyklá a nepřiměřená charakteru rány či jejímu vzhledu, může být charakteru křeče,
- chřipkové příznaky typu horečky, třesavky, nauzey, průjmů, slabost,
- dehydratace,
- pacient se cítí „nejhůře v životě a neví příčinu“.
2. pokročilé příznaky (2.–4. den):
- narůstající otok bolestí postižené těla, často se zarudnutím,
- na kůži se mohou objevovat rozsáhle tmavé skvrny vzhledu staršího hematomu, někdy s puchýři, kůže je napjatá,
- rána se začíná jevit jako nekrotická (bílá, modrá nebo tmavá, skrvnitá), může být zapáchající sekrece,
- podle progrese alterace celkového stavu při nastupující sepsi.
3. pozdní symptomy (4.–5. den)
- hypotenze, septický šok,
- ARDS, multiorgánová dysfunkce, bezvědomí.
Léčba musí být agresivní, zahrnuje kombinaci chirurgického extenzivního debridementu postižené oblasti, intenzivní antibiotickou a celkovou protišokovou léčbu, v literatuře bývá doporučována i hyperbarická oxygenoterapie. Neodkladný chirurgický zákrok je zcela prioritní, rozhoduje o dalším průběhu infekce a tím o osudu pacienta [1, 2, 4, 7). V souhrnu časná mortalita v prvních 24–72 hodinách představuje 34 % úmrtí především v důsledku septického šoku, pozdní úmrtí pak na podkladě protrahovaného multiorgánového selhání i při zvládnutí léčby prvotního infektu [1].
V naší kazuistice chceme presentovat případ pacienta, u kterého došlo po rutinní operaci k rozvoji nekrotizující fasciitidy v operační ráně.
KAZUISTIKA
Pacient, 63 let, se zavedeným kardiostimulátorem pro AV blok III. st., v minulosti operován pro karcinom in situ hrtanu, s 2/3 gastrektomií pro vředovou chorobu, byl poprvé hospitalizován na našem oddělení 16. 3.–18. 3. 2008 pro akutní cholangoitidu, na US prokázána cholecystolitiáza, hydrops žlučníku a dilatace žlučových cest, v laboratorních výsledcích pak známky obstrukčního ikteru s elevací CRP na 134 mmol/1. Po infuzní terapii + ATB Cefobid i.v. klinicky i subjektivně došlo k ústupu obtíží, provedeno ERCP s papilotomií, odstraněn solitární konkrement. Naplánována cholecystektomie s časovým odstupem. Pacient pro bolesti na hrudi přeložen k vyloučení ICHS na interní oddělení, při koronarografíi nebyl zjištěn klinicky významný nález a pacient byl indikován k cholecystektomii bez dalších výhrad. Dne 14. 5. 2008 provedena laparoskopická operace, pro mnohočetné a rozsáhlé srůsty v břišní dutině byla indikována konverze a cholecystektomie byla dokončena klasicky bez perforace žlučníku či jiné peroperační komplikace, pacient po operaci umístěn na operační JIP. Přibližně s odstupem 12 hodin se u pacienta objevuje hypotenze bez jiného klinického nálezu. Vyloučeno krvácení do břišní dutiny a do GIT. Na RTG plic popsán nevelký pneumonický infiltrát s parciální atelektázou v dolním plicním laloku vpravo. Pro přetrvávající hypotenzi a oligurii s celkovou alterací byl pacient přeložen na lůžko ARO s předpokladem rozvíjející se sepse. Dne 16. 5. 2008 se objevuje intenzivní bolest v ráně, v pravém podžebří je obraz napjaté lesklé kůže hnědočervené barvy kolem jizvy po cholecystektomii. Rána byla extrémně citlivá na dotek v lemu 5 cm kolem, lokální nález se šíří po hrudníku k pravé lopatce. Po rozpuštění několika stehů z rány vytéká zkalený zapáchající sekret. Nebyla přítomna krepitace, na RTG nebyl patrný podkožní emfyzém. Službu konající lékař vyslovil podezření na anaerobní rannou infekci a indikoval urgentní revizi rány. Pacientovi nasazena parenterálně antibiotika 5MIU penicilinu i.v. po 4 hodinách, uměle ventilován. Při operaci byla rozpuštěna rána, zjištěna nekrotizující infekce s postižením fascie a m. rectus abd. a m. transversus (Obr. 1). Proveden radikální debridement prakticky až k peritoneu a velkoobjemová laváž H2O2. Rána ponechána otevřená. Následující dny denně převazy a nekrektomie v CAN, 20. 5. extubován, rána je již čistá bez zn. infektu, pacient oběhově stabilizovaný. Při první revizi byl odebrán materiál na kultivaci a na mikroskopii, jako původce byli identifikováni Clostridium perfringens a gramnegativní nonokomiální kmeny. Po stabilizaci stavu pacient přeložen na standardní oddělení. Stav diagnosticky uzavřen jako těžká sepse způsobená pooperační nekrotizující fasciitidou břišní stěny. Následný defekt břišní stěny (Obr. 2) o velikosti 30x15 cm byl pomocí podtlakové léčby připraven (Obr. 3) a po 2 týdnech překryt volným kožním štěpem odebraným ze stehna (Obr. 4). Pacient propuštěn 30. 6. 2008. Zhojení štěpu i odběrového místa je kompletní. Pacient je bez obtíží dosledován ambulantně. I přes naši obavu ze vzniku kýly je stěna v místě původního defektu pevná bez vyklenování. Diabetes nebyl zjištěn, pacient astenický, v laboratoři zjištěna chronická hypoproteinemie a hypoalbuminemie.
Image 1. Operační nález Obr. 1. Intraoperative findings 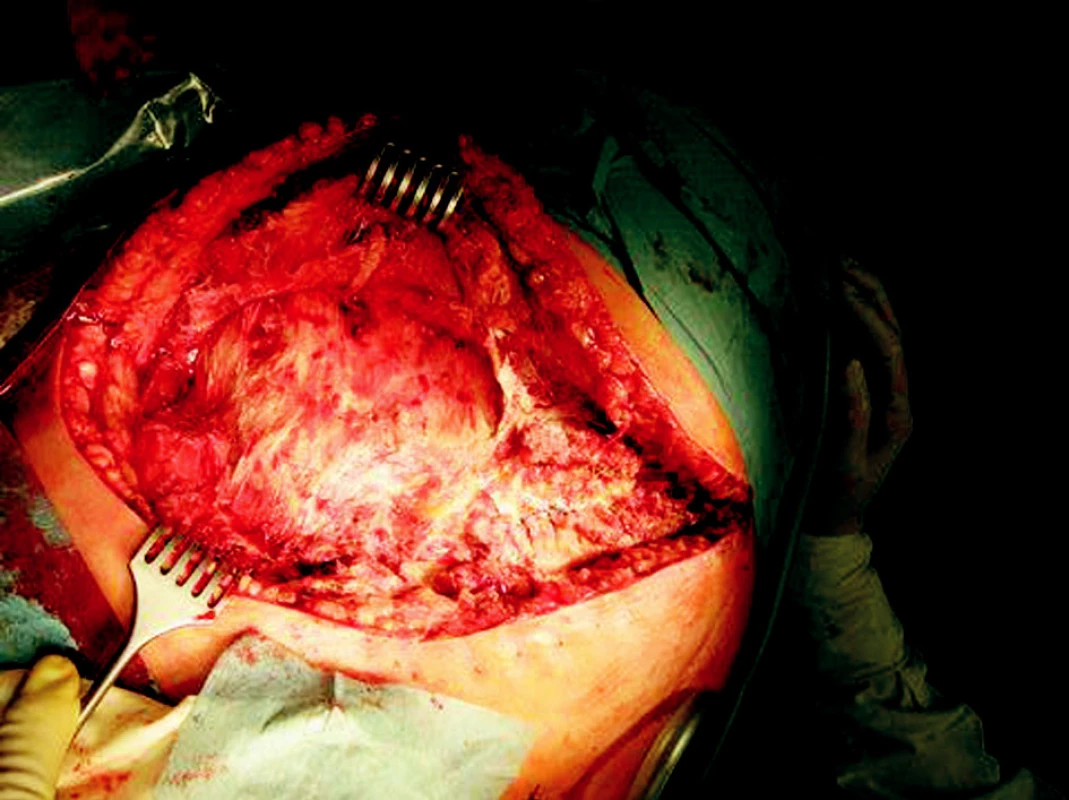
Image 2. Před zahájením podtlakové léčby Obr. 2. Prior to initiation of the vacuum therapy 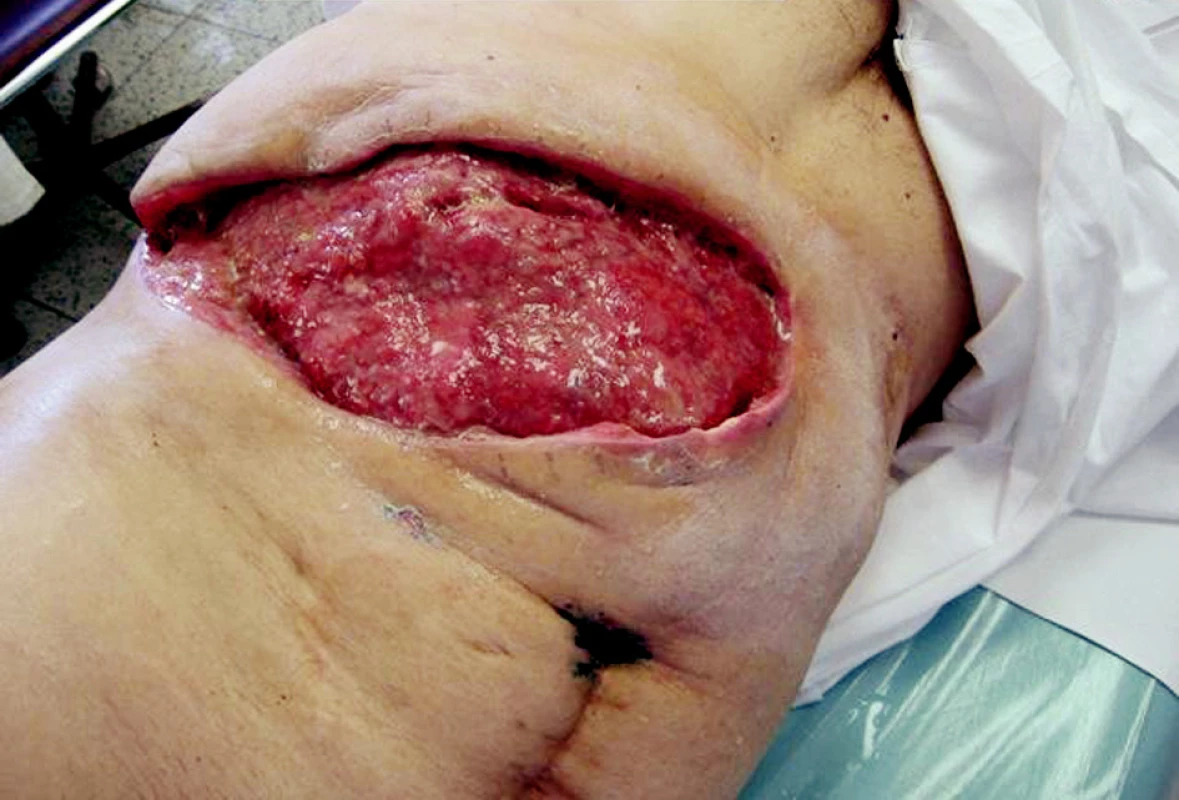
Image 3. Po 14 dnech aplikace podtlaku Obr. 3. After 14 days of the vacuum therapy application 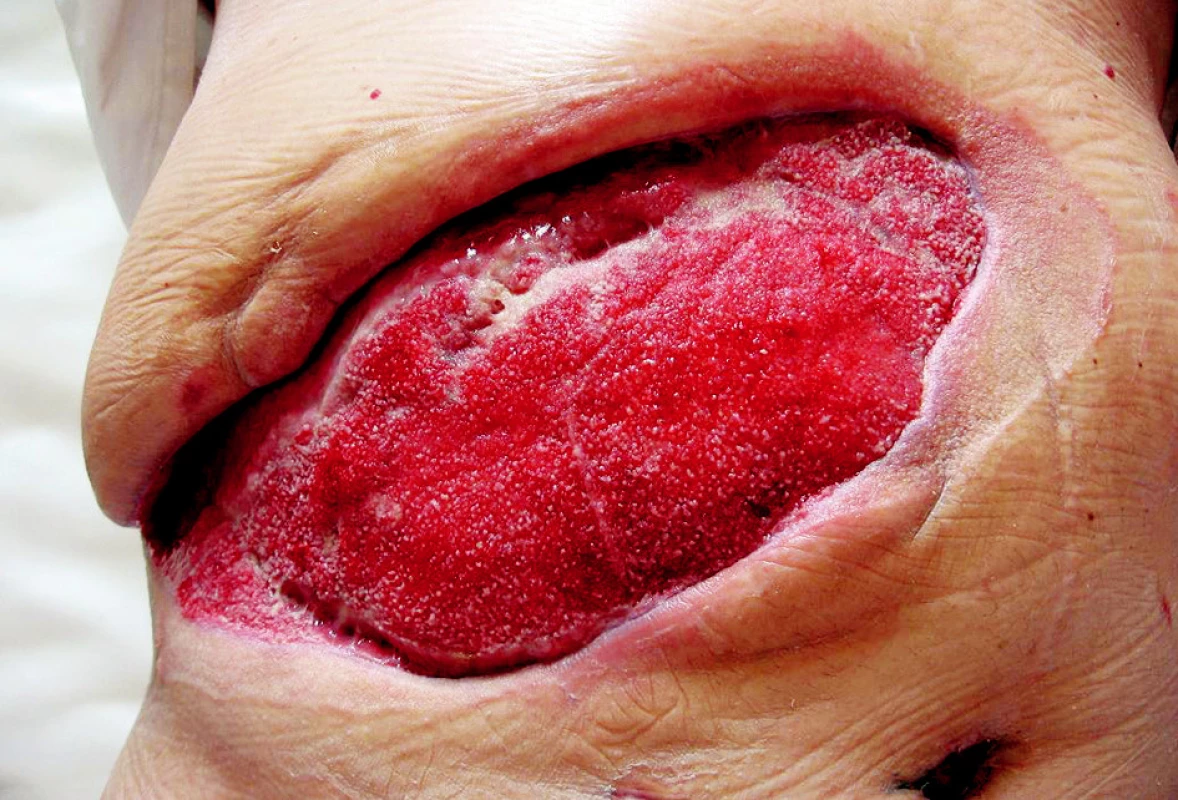
Image 4. Po krytí dermoepidermálním štěpem Obr. 4. After dermoepidermal skin graft 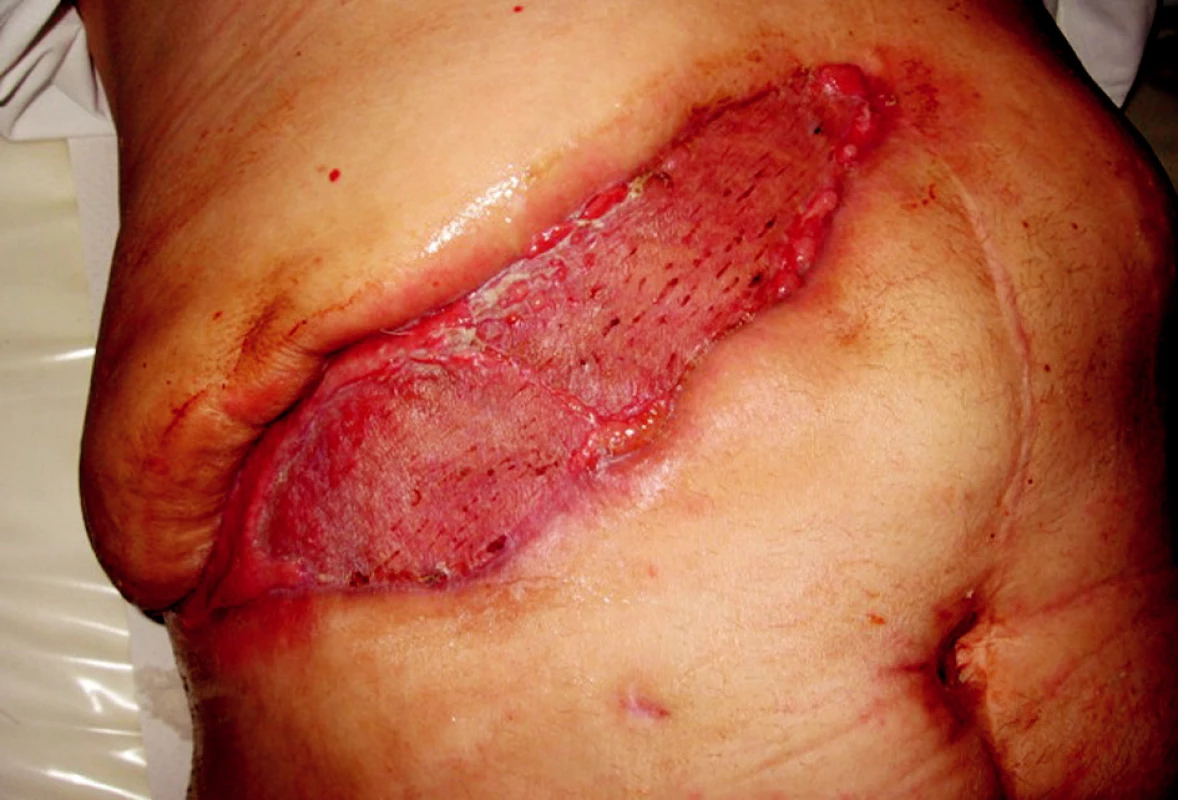
DISKUSE
Literární údaje lze rozdělit do dvou skupin. Jedná se buď o větší soubory pacientů léčené s touto diagnózou během delších časových úseků:
65 pacientů během 5 let udává R. McHenry a kol. [1], z toho 51 pacientů s NF, 12 se současným postižením i svalu a 2 s dominujícím postižením kůže a podkoží. Výskyt je vyrovnaný u obou pohlaví, s průměrným věkem kolem 50 let. Pooperační NF byla diagnostikována u 18 pacientů souboru (28 %), ostatní vznikly v 15 případech (23 %) po úrazu měkkých tkání, 15 (23 %) jako komplikace chronických defektů, perirekt. abscesů v 3 případech (5 %), bez zjevné příčiny idiopaticky 10 případů (15 %), po 2 případech (3 %) jako komplikace uskřinuté kýly a subkutánní injekce. Z rizikových faktorů bylo 30 pacientů obézních, 29 diabetiků, 26 mělo hypoalbuminemii, 17 periferní cévní postižení, u 8 byl zjevný chronický abúzus alkoholu. 7 z nich bylo kortikodependentních a 5 uživatelů i.v. drog. Hlavním faktorem ovlivňujícím mortalitu se jevila především časová prodleva mezi hospitalizací a operačním zákrokem. Dalšími statisticky významnými faktory ovlivňující morbiditu a mortalitu byl vysoký věk, přítomnost periferního cévního postižení a závažné interní komorbidity, především diabetes mellitus.
W. J. Rea a kol. [3] prezentuje 44 pacientů za 15 let, s incidencí 2–3 případy ročně ve velké nemocnici. U 35 z nich vznikla NF po poranění, u 9 pak jako pooperační komplikace (3x apendektomie, lx tříselná hernioplastika, lx gastrektomie, lx explorativní lap., lx aortoil. endarterektomie, lx kostní OS, lx biopsie svalu), s projevem 1–4 dny od operace. Mortalita v tomto souboru byla 30%. Statisticky nejvýraznějším faktorem ovlivňujícím mortalitu v daném souboru byl diabetes mellitus (5 z 8 diabetiků zemřelo), periferní cévní postižení (7 z 10 nediabetiků s prokázaným postižením periferních cév zemřelo) a vysoký věk (kromě případu 1 dítěte byla všechna úmrtí starší 50 let bez ohledu na komorbidity). Statisticky nejdůležitějším faktorem determinujícím přežití byla rychlost diagnostiky a zahájení léčby – průměrná doba mezi příznaky onemocnění a zahájení léčby byla 5 dní. U přeživších pak průměrně 4 dny, u zemřelých 7 dní.
D. C. Elliot a kol. [4] prezentuje 198 pacientů za 8 let (113 mužů, 84 ženy) s mortalitou 25,3 %. U 56,4 % byl zjištěn diabetes mellitus, ale nebyla statisticky významná spojitost s mortalitou izolovaně, pouze ve spojitosti s jiným rizikovým faktorem. Kombinace diabetů, akutního renálního selhání a věku nad 60 let byla spojena s mortalitou 64,7 %. Průměrná doba od vzniku obtíží do hospitalizace byla 4,1 dne. U přeživších byla doba 4,5 dne, u zemřelých 2,5 dne, což pravděpodobně odráží fulminantní průběh než prodlevu v diagnostice (viz výše). K uzávěru rány bylo přistoupeno 2–4 dny po prvním debridementu, u 152 ze 198 pacientů byla rána zhojena již při první hospitalizaci, průměrně po 26,4 dnech (v naší kazuistice 6 týdnů).
H. H. Stone [7] prezentuje 63 pacientů za 13 let, s průměrným věkem 54 let, z toho 26 mužů a 37 žen. Soubor zahrnuje i případy plynatých infektů, v souboru jsou zahrnuti pacienti s polymikrobiální etiologií (synergismus aerobní a anaerobní infekce). U 24 pacientů šlo o komplikace perirektálního abscesu, u 2 periuretrálního abscesu a u 2 šlo o rozsáhlé postižení kůže (cellulitis). U zbylých 35 šlo o infekci na dolních končetinách. Mortalita byla 76 %, v práci lze nalézt vztah k aplikované léčbě a lokalizace infektu. Úmrtí nastalo u 100 % pacientů bez léčby, nebo jen s antibiotiky, ale i též při pouhé incizi a drenáži postižené oblasti s podáním antibiotik. Radikální debridement (včetně časné amputace při končetinovém postižení) spolu s antibiotickou léčbou vykazoval nejmenší mortalitu (50 %). Prakticky 100 % úmrtí bylo pozorováno při rozsáhlejším postižení v oblasti krku a pánve, na končetinách pak kolem 50 %. Diabetes mellitus byl spojen s 85% mortalitou, u nediabetiků to bylo 44 %.
L. A. Sudarsky a kol. [8] prezentuje soubor 33 pacientů za 3 roky. Z rizikových faktorů uvádí abúzus drog (30 %), diabetes (21 %) a obezitu (18 %). Průměrný časový interval od přijetí do nemocnice k operačnímu zákroku byl 43 hodin, průměrný počet nekrektomií byl 3 na 1 případ, průměrná doba hospitalizace pak 47 dní. Pacienti operovaní do 12 hodin od přijetí měli lepší prognózu a kratší dobu hospitalizace (36–38 dní). Prvních 12–48 hodin od přijetí bylo kritickým časovým úsekem, všechna úmrtí či amputační končetinové výkony spadaly do tohoto časového období.
Wong Ch. a kol. [17] prezentuje 89 pacientů s diagnózou NF během 5 let. Pouze u 13 z nich byla diagnóza NF stanovena již při přijetí k hospitalizaci. Hlavním rizikovým faktorem byl diabetes mellitus (70,8 % pacientů). Multivarietní analýza prokázala, že časová prodleva chirurgického zákroku více než 24 hodin od přijetí vedla ke statisticky významnému zvýšení mortality.
Jako statisticky významným a jednoduše zjistitelným prediktorem mortality pacientů se závažnou NSTI uvádí Yaghoubian A. a kol. ve své práci [18] vstupní hodnotu sérové koncentrace laktátu a natria. V souboru 124 pacientů bylo zjištěno, že vstupní plazmatické hodnoty laktátu nad 6 mmol/1 a natria pod 135 mmol/l byly asociovány se statisticky významně vyšší mortalitou.
V literatuře lze nalézt velké množství kazuistických sdělení o případech NF/NSTI jako komplikace např. již zmíněné perforace divertiklu tlustého střeva [5], pokousání člověkem [11], fatální případ NF očního víčka [12], tonzilofaryngitidy [13], či oboustranná hrudní NF jako komplikace infekce horní končetiny [14].
Z přehledu literatury je patrná složitost problematiky a obtížná porovnatelnost výsledků. V reálné situaci budeme intenzivně, zprvu jen symptomaticky a empiricky léčit pacienta v septickém stavu bez zjevné příčiny. Podcenění či přehlédnutí zdánlivě nevýznamných nebo nenápadných kožních projevů a změn může v případě NSTI vést k prodlevě indikace radikálního chirurgického zákroku, který zásadním způsobem rozhoduje o osudu pacienta.
ZÁVĚR
Nekrotizující fasciitida představuje relativně vzácně se vyskytující, avšak potenciálně smrtelnou rychle postupující infekci měkkých tkání, která může komplikovat jakékoliv poranění včetně operační rány. Prodleva v diagnostice a léčbě je spojena s vysokou morbiditou a průměrně 34% mortalitou. V léčbě má zcela zásadní význam radikální chirurgický zákrok spočívající v opakované a důsledné excizi všech nekrotických tkání, který jako jediný při rozvinuté infekci dokáže zvrátit fulminantní průběh. Celkové příznaky předcházejí příznaky lokální. Diabetes mellitus, vysoký věk, postižení periferních tepen a jakýkoliv stav snížené imunity výrazně zvyšuje riziko rozvoje a fatálního průběhu. Vzhledem k statisticky významnému výskytu těchto rizikových faktorů v populaci a zvyšujícímu se věku jak akutně tak plánovaně operovaných pacientů je třeba při neobvyklém pooperačním průběhu vždy v diferenciální diagnostice pomýšlet i na tyto infekce.
MUDr. J. Jandák
Skuhrov nad Bělou 12
517 03 Skuhrov nad Bělou
e-mail: who.dares.jj@seznam.cz
Sources
1. McHenry, C. R., Piotrowsky, J. J., Petrinic, D., Malangoni, M. A. Determinants of mortality for necrotising soft-tissue infections. Ann. Surg., 1995, Vol. 221, No. 5, 558–565.
2. Taviloglu, K., Yanar, H. Necrotising fasciitis: strategies for diagnosis and management. Word J. Emerg. Surg., 2007, 2 : 19.
3. Rea, W. J., Wyrick, W. J. Necrotising fasciitis. Ann. Surg., 1970 Dec, 172(6): 957–964.
4. Elliot, D. C., Kufera, J. A., Myers, R. A. M. Necrotising soft tissue infections. Ann. Surg., 1996, vol. 224, No. 5, 672–683.
5. Harrison, B. J. Perforated sigmoid diverticulum with necrotizing fasciitis of the abdominal wall. J. R. Soc. Med., 1981 August, 74(8), 625–626.
6. Hasham, S., Matteucci, P., Stanley, P. R. W., Hart, N. B. Necrotiíiarfasciitis. B M J., 2005 April 9, 330(7495), 830–833.
7. Stone, H. H., Martin, J. D. Jr. Synergistic necrotizing cellulitis. Ann. Surg., 1972 May, 175(5): 702–711.
8. Sudarsky, L. A., Laschinger, J. C., Coppa, G. F., Spenser, F. C. Improved results from a standardized approach in treating patiens with necrotizing fasciitis. Ann. Surg., 1987 November, 206(5): 661–665.
9. Way, L.W., et al. Současná chirurgická diagnostika a léčba. Grada Publ., 1998, 1. díl, s. 161–162.
10. Plodr, M., Čermák, P., Ferko, A. K problematice klasifikace infekcí měkkých tkání. Rozhl. Chir., 2006, roč. 85, č.11, s. 560–565.
11. Sikora, C. A., Spielman, J., MacDonald, K., Tyrrell, G. J., Embil, J. M. Necrotising fasciitis resulting from human bites: A report of two CASE of disease cause by group A streptococcus. Can. J. Infect. Dis. Med. Microbiol., 2005, 16(4): 221–224.
12. Walter, R. A fatal case of necrotizing fasciitis of the eyelid. Br. J. Ophtalmol., 1998, June, 72(6): 428–431.
13. Persaud, R., Krahé, D., Georgalas, C, Kaniyur, S., Das, S., Alusi, G. Life-treatening necrotizing fasciitis of the neck: an unusual consequence of a sore throat. Ann. R. Coll. Surg. Eng., 2004, 86 : 253–257.
14. Bauwell, P.E., Pereira, J., Powell, B. W. Symmetrical necrotising chest wall infection following paronychia. J. Accid Emerg. Med., 1998 January, 15(1): 58–59.
15. College‘s committee on operating room enviroment: Guideline for prevention of surgical site infection. Bulletin of the American College of Surgeons, July 2000, vol. 85, No. 7.
16. Poromanski, I., Andriessen, A. Developing a tool to diagnose case of necrotisng fasciitis. J. Wound Care, 2004, 13 : 307–310.
17. Wong, Ch., Chang, H. C., Pasupathy, S., Khin, L. W., Tan, J. L., Low, C. O. Necrotizing fasciitis: clinical presentation, microbiology and determinants of mortality. J. Bone Joint Surg. Am., 2003 Aug, 85-A(8): 1454–1460.
18. Yaghoubian, A., De Virgulko, Ch., Dauphine, Ch., Lewis, R. J., Lin, M. Use of admission serum lactate and podium levels to predict mortality in necrotizing soft-tissue infections. Arch. Surg., 2007, 142(9): 840–846.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2009 Issue 1-
All articles in this issue
- Metastáza maligního melanomu distálního ilea jako vzácná příčina ileocekální invaginace – kazuistika
- Laparoskopická splenektómia – naše skúsenosti
- Rupturované mykotické aneuryzma břišní aorty řešené graftem z vena femoralis superficialis – kazuistika
- Neurogenní tumory krku
- Pooperační sledování perfuze gastroplastiky jícnu
- Střednědobé výsledky a přežití nemocných po radikální retropubické prostatektomii (RRP) v současných podmínkách českého zdravotnictví
- Nekrotizující fasciitida břišní stěny po cholecystektomii – kazuistika
- Chirurgická léčba vrozeně strmého talu
- Nekrotizující fasciitida, vzácná komplikace laparoskopické apendektomie
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Nekrotizující fasciitida, vzácná komplikace laparoskopické apendektomie
- Neurogenní tumory krku
- Laparoskopická splenektómia – naše skúsenosti
- Střednědobé výsledky a přežití nemocných po radikální retropubické prostatektomii (RRP) v současných podmínkách českého zdravotnictví
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

