-
Medical journals
- Career
NF - κB, kolorektální karcinom a radioterapie: výsledky klinické a experimentální studie
Authors: R. Vobořil 1,2; J. Weberová-Vobořilová 1; V. Rychterová 3; M. Ambruš 4; L. Horák 2; J. Fanta 2
Authors‘ workplace: Oddělení buněčné a molekulární biologie, Ústav biochemie, buněčné a molekulární biologie, 3. lékařská fakulta UK, Praha, vedoucí oddělení: doc. RNDr. J. Kovář, DrSc. 1; Chirurgická klinika, 3. lékařská fakulta UK a Fakultní nemocnice Královské Vinohrady, Praha, přednosta: doc. MUDr. J. Fanta, DrSc. 2; Ústav patologie, 3. lékařská fakulta UK a Fakultní nemocnice Královské Vinohrady, Praha, přednosta: prof. MUDr. V. Mandys, CSc. 3; Radioterapeutická a onkologická klinika, 3. lékařská fakulta UK a Fakultní nemocnice Královské Vinohrady, Praha, přednostka: MUDr. M. Kubecová 4
Published in: Rozhl. Chir., 2007, roč. 86, č. 5, s. 268-272.
Category: Monothematic special - Original
Overview
Rezistence na radioterapii pozorovaná u karcinomu rekta vede k nutnosti studia mechanismů zodpovědných za tento jev. Zdá se, že nukleární faktor-kappaB (NF - κB), zejména jeho podjednotka p65, by mohla hrát v tomto procesu důležitou roli. Cílem této studie bylo: 1. sledovat expresi p65 v tkáni pacientů s karcinomem rekta a zjistit, zda-li je možné použít míru exprese p65 jako prediktivního faktoru; 2. v pokusu in vitro určit, zda-li je možné ovlivnit aktivaci p65 a povede-li toto případné ovlivnění ke zlepšení účinnosti radioterapie. Zjistili jsme, že míra exprese p65 by mohla sloužit jako prediktivní faktor přežití u pacientů s karcinomem rekta a dále potom, že aktivitu NF - κB vyvolanou zářením je možné inhibovat což je doprovázeno zvýšením účinnosti radioterapie.
Klíčová slova:
NF-kappaB – karcinom rekta – radioterapie – imunohistochemie – markerÚVOD
V léčbě pokročilých stadií karcinomu rekta se uplatňují kombinované terapeutické postupy zahrnující radioterapii [1]. Bohužel řada nádorů je k radioterapii rezistentní [2, 3]. Z tohoto důvodu je mechanismus vzniku radiorezistence intenzivně studován. Zdá se, že důležitou roli ve vzniku rezistence na radioterapii hraje nukleární faktor-kappaB (NF - κB).
NF-κB je transkripční faktor kontrolující genovou expresi. Podílí se mimo jiné na regulaci buněčného růstu a apoptózy [4, 5]. NF - κB zahrnuje skupinu pěti různých podjednotek, které jsou lokalizovány v cytoplazmě v neaktivním stavu vázané na inhibiční molekulu IkB. Při aktivaci NF - κB přechází do jádra, kde se váže na cílové sekvence na DNA [6]. Předpokládá se, že aktivovaný NF-κB chrání nádorové buňky proti apoptóze, čímž podporuje jejich přežití. Nejlépe charakterizovanou podjednotkou NF-κB je p65. Podle mnoha autorů [5, 7, 8] se zdá, že p65 nese hlavní odpovědnost za regulaci genové exprese a tím že hraje jednu z klíčových rolí ve vzniku rezistence nádorů na protinádorovou léčbu.
Naše práce má dvě části, klinickou a experimentální. Cílem klinické části bylo určit: 1. je-li možno využít expresi podjednotky p65 ve vzorcích nádorové tkáně pacientů s karcinomem rekta jako prediktivního markeru přežití a disease free intervalu, cílem experimentální části potom určit v pokusu in vitro; 2. zda-li interleukin-4 (IL-4) jako představitel protizánětlivých cytokinů, o kterých se předpokládá, že mohou modulovat chování nádoru, ovlivní aktivaci p65 a povede-li toto případné ovlivnění ke zlepšení účinnosti radioterapie.
MATERIÁL A METODY
Pacienti, vzorky nádorové tkáně a imunohistochemické barvení p65
Do studie bylo zařazeno 25 pacientů (20 mužů a 5 žen s průměrným věkem 67,2 ± 11,7; rozpětí 37 až 82 roků) s karcinomem rekta, kteří byli léčeni ve Fakultní nemocnici Královské Vinohrady v Praze a kteří podstoupili předoperační radioterapii (25 frakcí po 1,8 Gy/frakce). Charakteristika pacientů je uvedena v tabulce 1. Asi 6 týdnů po skončení radioterapie byl proveden chirurgický zákrok. U každého pacienta byly k dispozici dva vzorky nádorové tkáně, první odebraný během diagnostické kolonoskopie před radioterapií a druhý z doby chirurgického zákroku. V obou vzorcích byla imunohistochemicky detekována míra exprese p65. Pro imunohistochemii byly použity 4 mm silné řezy vzorků nádorové tkáně zalité do parafínu. Detekce byla provedena pomocí primární monoklonální protilátky proti p65 (Santa Cruz Biotechnology, Santa Cruz, CA, USA) a systému Dako CSA II System (DakoCytomation, Carpentaria, CA, USA). Preparáty byly dobarveny hematoxylin-eozinem.
Table 1. Charakteristika pacientů 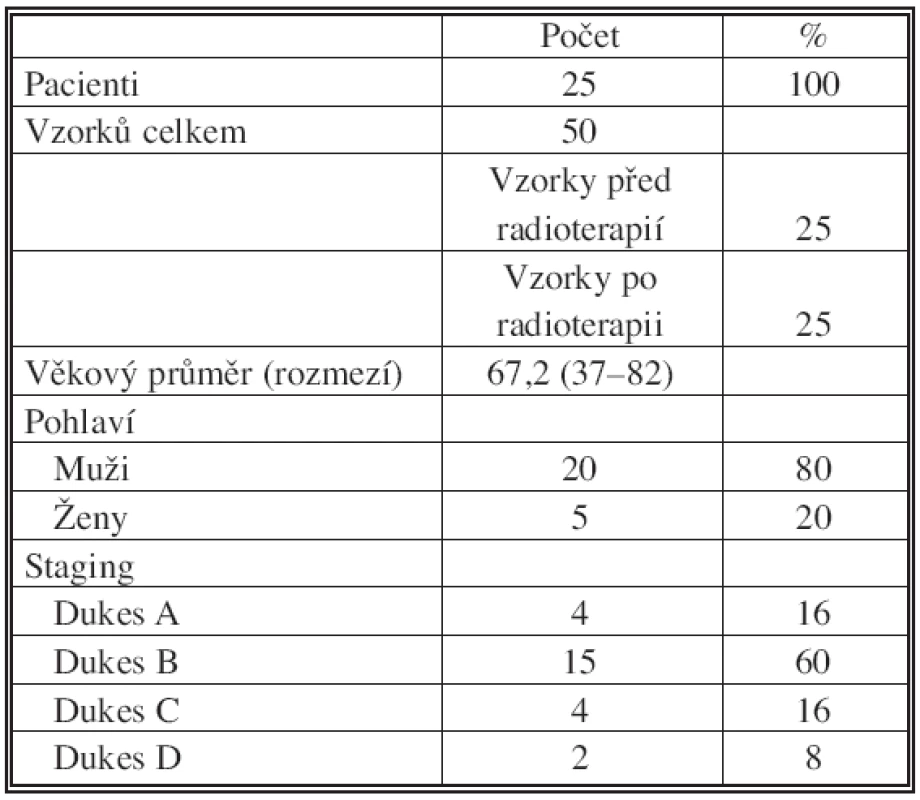
Pacienti byli sledováni v rámci další onkologické léčby.
Buněčná linie, záření buněk, stanovení klonogenního růstu a aktivity podjednotky p65
In vitro experimenty byly prováděny na buněčné linii lidského kolorektálního karcinomu SW620. Lidský rekombinantní interleukin-4 (IL-4) (Sigma, St. Louis, MO, USA) byl přidán k buňkám SW620 6 hodin před ozářením. Jako zdroj záření byl použit Kobalt-60. Klonogenní růst byl sledován 14 dní, vizualizace kolonií byla provedena Coomassie Blue. Byly spočítány klony čítající více než 50 buněk. Pro stanovení aktivity podjednotky p65 byl získán jaderný extrakt pomocí NE-PER kitu (Pierce Biotechnology, Rockford, IL, USA). Množství aktivovaného p65 bylo stanoveno za použití metody založené na ELISA principu (Active Motif, Carlsbad, CA, USA).
Statistická analýza
Pro analýzu přežití byla použita metoda podle Kaplan-Meiera a Gehan-Wilcoxonův test. Data z experimentální studie byla vyjádřena jako průměr ± SEM. Hodnota p < 0,05 ze Studentova t-testu byla považována za statisticky signifikantní.
VÝSLEDKY
Exprese podjednotky p65 ve vzorcích nádorové tkáně může sloužit jako prediktivní marker přežití a disease free intervalu
Exprese p65 ve vzorcích nádorové tkáně
V normální tkáni rekta nebyla nalezena ani cytoplazmatická, ani jaderná pozitivita p65. V nádorové tkáni byla nalezena pozitivita p65 pouze v cytoplazmě nádorových buněk. Jaderná pozitivita p65 byla nalezena v reaktivních lymfocytech nádorového stromatu (použito jako pozitivní kontrola). Při absenci jaderné p65 pozitivity nádorových buněk byla pro další evaluaci použita pozitivita cytoplazmatická, kterou jsme hodnotili v dvoustupňové škále jako nízkou a vysokou. Hranice mezi těmito dvěma skupinami byla určena na základě hodnocení nezávislým patologem. Nízká pozitivita p65 byla nalezena u 18 (72 %) pacientů před radioterapií a u 15 (60 %) po radioterapii. Vysoká p65 pozitivita byla nalezena u 7 (28 %) pacientů před radioterapií a u 10 (40 %) po radioterapii.
Asociace mezi p65 pozitivitou a celkovým přežitím; p65 pozitivitou a disease free intervalem
U každého pacienta jsme zjistili dobu celkového přežití a délku disease free intervalu. Pacienty jsme poté rozdělili do dvou skupin podle míry cytoplazmatické exprese p65 ve vzorku před radioterapií, první skupina s nízkou expresí p65 a druhá s vysokou. Údaje jsme zpracovali za užití Kaplanovy-Meierovy analýzy přežívám a dále pomocí Gehanova-Wilcoxonova testu. Výsledné křivky zaznamenané v grafu (Obr. 1) ukazují, že nemocní s nízkou mírou exprese p65 ve vzorku nádorové tkáně před absolvovanou radioterapií mají delší dobu přežití (p = 0,063) a delší dobu do výskytu metastáz (p = 0,228). Z našich pozorování uzavíráme, že je možné sledovat poměrně silný trend ukazující, že pacienti s nízkou mírou cytoplazmatické exprese podjednotky p65 mají lepší prognózu vyjádřenou delší dobou přežití a delším disease free intervalem.
Image 1. Kaplan-Meierova analýza (A) přežívání a (B) disease-free intervalu pacientů s karcinomem rekta, kteří podstoupili neoadjuvantní radioterapii. Kritériem hodnocení byla exprese p65 v primárním vzorku nádoru odebraného před radioterapií. Exprese byla rozlišena jako nízká (n) nebo vysoká (v). Bylo možno pozorovat trend, kde (A) pacienti s nízkou mírou exprese podjednotky p65 mají delší dobu přežití (p = 0,063) a (B) pacienti s nízkou mírou exprese podjednotky p65 mají delší dobu do výskytu metastáz (p = 0,228). Pic. 1. Kaplan-Meier analysis (A) of the survival period , (B) of the disease-free interval in patients with rectal carcinomas, who underwent neoadjuvant radiotherapy. The study endpoint was expression of NF-κB/p65 in the primary tumor sample, collected prior to radiotherapy. The expression was defined either as low (n) or high (v). (A) Patients with the low NF- κB/p65 expression rate show longer surval periods (p=0,063). (A) Pacients with the low NF-κB/p65 expression rate have longer metastases- free intervals (p=0,228). 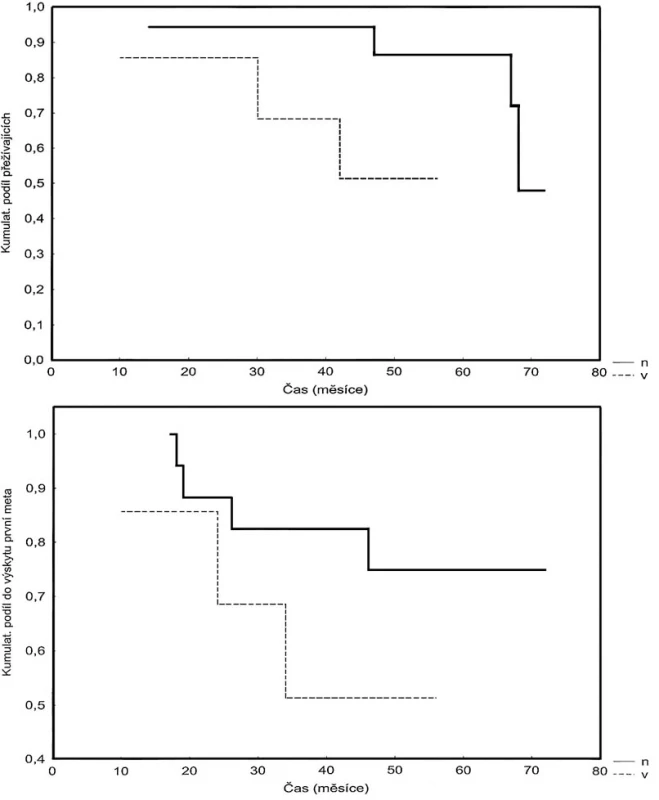
IL-4 zvyšuje účinnost radioterapie a inhibuje aktivaci p65 v experimentu in vitro
IL-4 zvyšuje účinek záření na klonogenní růst
Ukázali jsme, že buňky SW620 vykazují vysokou radiorezistenci [9]. Zkoumali jsme, může-li IL-4 tuto radiorezistenci snížit. Po šestihodinové kultivaci s IL-4 byly buňky ozářeny 8 Gy. Poté byla měřena jejich schopnost klonogenního růstu pomocí testu klonogenicity. Obrázek 2 ukazuje, že samotný IL-4 (100 ng/ml) klonogenní růst buněk SW620 statisticky významně neovlivnil. V kombinaci se zářením ale IL-4 potencoval inhibici klonogenního růstu vyvolanou zářením. Výsledky tohoto experimentu ukazují, že samotný IL-4 neovlivňuje schopnost klonogenního růstu buněk SW620, v kombinaci se zářením však zvyšuje jeho účinnost.
Image 2. IL-4 (100 ng/ml) samotný bez záření snížil klonogenní růst buněk SW620 pouze mírně, bez statistické signifikance. Avšak v kombinaci se zářením IL-4 statisticky signifikantně potencoval inhibici klonogenního růstu vyvolanou radiací (*p < 0,05: 2 Gy versus 2 Gy+IL-4; **p < 0,05: 4 Gy versus 4 Gy+IL-4). Pic. 2. Cell proliferation potential monitoring showed that cultivation with various IL concentrations (A) 1 ng/ml, (B) 10 ng/ml, (C) 100 ng/ml , resulted in a minor inhibition of cell proliferation, which was statistically insignificant. A dose of 8 Gy resulted in a statistically significant inhibition of cell proliferation (*p<0.05), compared to a control. Combination of IL-4 and radiation facilitated the cell proliferation rate inhibition (*p<0.05: shows a statistical significance compared to the control). (C) The highest of the tested IL-4 concentrations (100 ng/ml) resulted in a statistically significant potentiation of the radiation ihibitive effect, compared to the group with radiation only (**p<0.05). 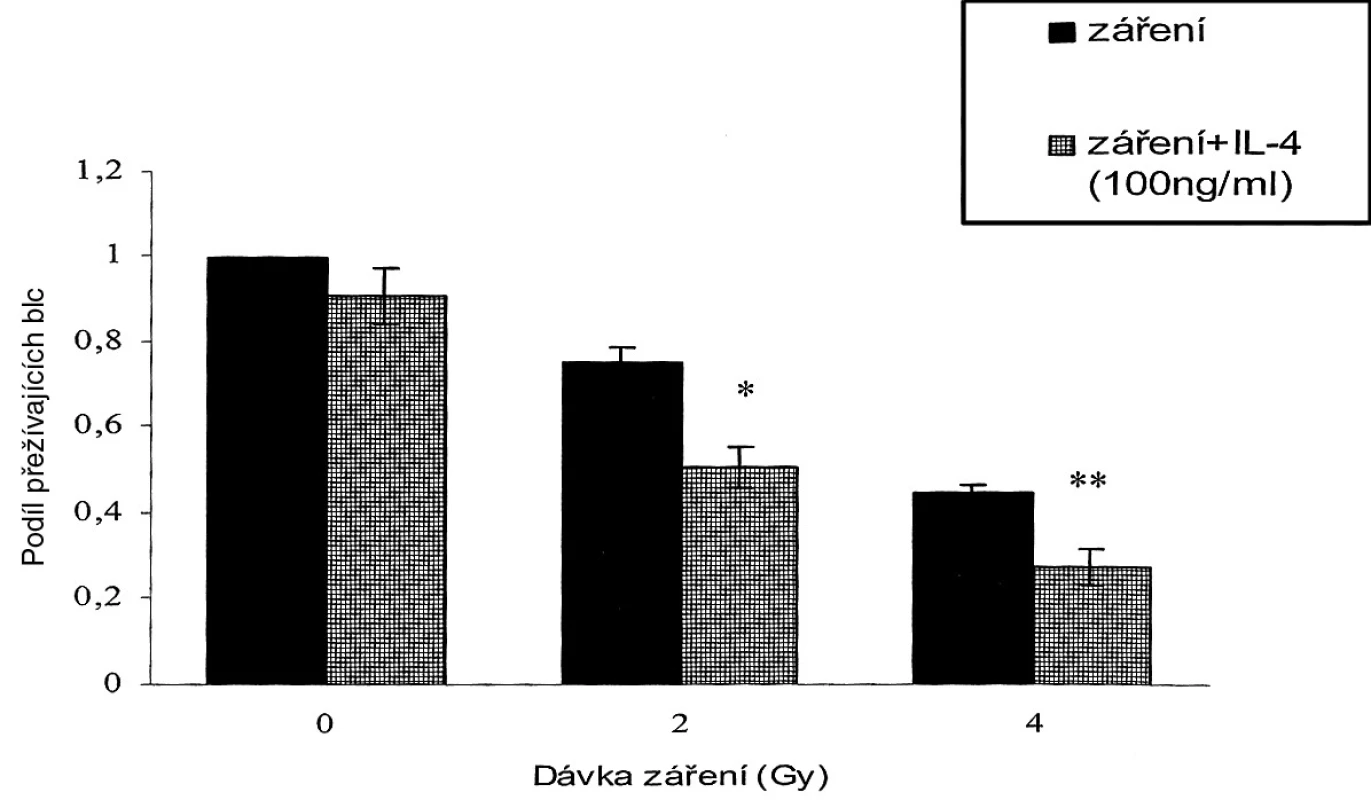
IL-4 snižuje aktivitu p65 vyvolanou zářením
Abychom určili, zda tato radiosenzitizace je spojena s ovlivněním aktivace p65, otestovali jsme změny aktivity p65 v jaderném extraktu buněk SW620. Buňky SW620 byly kultivovány s IL-4 (100 ng/ml) po dobu 6 hod a/nebo ozářeny 8 Gy. Obrázek 3 ukazuje, že dávka 8 Gy statisticky významně aktivuje p65 ve srovnání s kontrolní skupinou. Míra této aktivace je statisticky významně tlumena při kombinaci záření a IL-4. Samotný IL-4 aktivaci p65 neovlivňuje. Výsledky tohoto pokusu ukázaly, že radiosenzitizace pomocí IL-4 je spojena s inhibicí aktivity p65 vyvolané zářením.
Image 3. IL-4 (100 ng/ml) aktivaci p65 neovlivňuje. Dávka 8 Gy statisticky významně aktivuje p65 ve srovnání s kontrolní skupinou (*p<0,05). Míra této aktivace je statisticky významně tlumena IL-4 (**p<0,05: 8 Gy versus 8 Gy+IL-4). Pic. 3. IL-4 (100 ng/ml) on its own, without radiation, resulted in a moderate inhibition of the SW620 clonogenic cell growth, which was statistically insignificant. However, when combined with radiation, IL-4 had a statistically significant inhibition potentiation effect on the radiation-induced clonogenic growth: at the dose of 2 Gy , IL-4 reduced the clonogenic growth potential cell fraction from 0.75 0,04 down to 0.51 0,05 and at the dose of 4 Gy from 0.45 0.02 down to 0.27 0.04. (*p<0.05: 2 Gy versus 2 Gy+IL-4; **p<0,05: 4 Gy versus 4 Gy+IL-4). 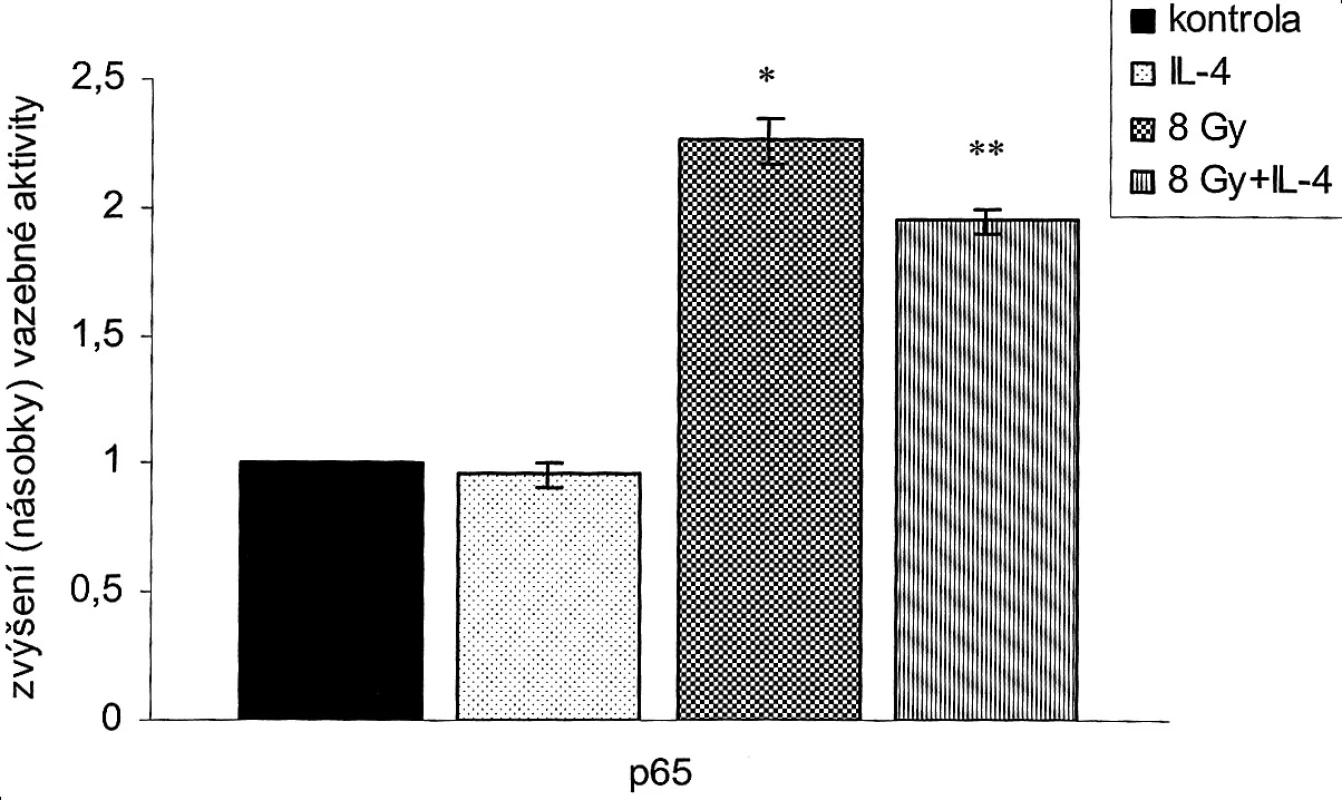
DISKUSE
V naší studii jsme se zaměřili na aktivitu p65 v buňkách kolorektálního karcinomu. Výsledky klinické části ukazují, že p65 je exprimován pouze v nádorové tkáni. Byla pozorována cytoplazmatická pozitivita p65 v nádorových buňkách a jaderná pozitivita v lymfocytech nádorového stromatu. Překvapením bylo, že ve vlastních nádorových buňkách jsme jadernou pozitivitu p65 nenalezli. Naše výsledky ale nejsou v rozporu s literaturou. Ellis et al. [10] detekoval imunohistochemicky p65 ve vzorcích tkáně tlustého střeva. Jaderná pozitivita byla nalezena pouze u makrofágů a lymfocytů, ne u epiteliálních buněk. U dalších studií byla sice nalezena jaderná pozitivita p65 v nádorových buňkách, procento pozitivních buněk však bylo nižší než 10 % [11, 12]. Různé pracovní postupy zintenzívnily cytoplazmatickou pozitivitu, míru jaderné pozitivity ale neovlivnily [13]. K totožným výsledkům jsme došli i my v procesu optimalizace metodiky; při použití různých pracovních postupů jsme vždy detekovali více či méně intenzivní cytoplazmatickou pozitivitu v nádorových buňkách, nikdy jsme nedospěli k pozitivitě jaderné.
Abychom zjistili možnou prediktivní hodnotu cytoplazmatické exprese p65 pro další osud pacienta, vyhodnotili jsme její asociaci s délkou přežití a s disease free intervalem. Zjistili jsme existenci trendu ukazujícího, že pacienti s nízkou cytoplazmatickou expresí p65 mají lepší prognózu vyjádřenou delší dobou přežití (p = 0,063) a delším disease free intervalem (p = 0,228). Jedná se však o pilotní výsledky z prvních 25 pacientů naší studie. Statistické signifikance sice nebylo dosaženo, avšak pozorovaný trend je poměrně silný. Výsledky chceme ještě ověřit a zpřesnit na větším souboru pacientů.
V experimentu in vitro jsme zjistili, že IL-4 zvyšuje účinek záření na klonogenní růst a dále potom, že IL-4 snižuje aktivitu p65 vyvolanou zářením. IL-4 byl zvolen proto, že se předpokládá jeho inhibiční působení na formování nádorového stromatu [14], konkrétně fibroblastů účastnících se nádorové angiogeneze [15] a tím jeho protinádorový účinek. My jsme však prokázali i přímé působení IL-4 na nádorové buňky. Náš nález je podpořen i výsledky jiných studií popisujících receptory pro IL-4 přímo na nádorových buňkách [16, 17]. Výsledky našich experimentů dále zapadají do širšího konceptu předpokládajícího, že chování nádoru je dáno nejenom samotnými změnami uvnitř nádorových buněk, ale také mikroprostředím reprezentovaným především nádorovým stromatem [18].
Shrneme-li naše poznatky ohledně p65 získané z experimentální a klinické části, uzavíráme, že NF - κB, konkrétně jeho podjednotka p65 hraje důležitou roli v reakci nádorů na radioterapii. Je však nezbytné doplnit testování i ostatních známých podjednotek NF-κB a zjistit jejich roli v tomto procesu.
PODĚKOVÁNÍ
Projekt vznikl za podpory grantem Interní grantové agentury Ministerstva zdravotnictví ČR číslo NR/8053-3/2004.
as. MUDr. R. Vobořil, PhD.
Chirurgická klinika 3. lékařská fakulta UK
Ruská 87
100 00 Praha 10
e-mail: rene.voboril@seznam.cz
Sources
1. Taylor, W. E., Donohue, J. H., Gunderson, L. L., Nelson, H., Nagorney, D. M., Devine, R. M., Haddock, M. G., Larson, D. R., Rubin, J., O‘Connell, M. J. The Mayo Clinic experience with multimodality treatment of locally advanced or recurrent colon cancer. Ann. Surg. Oncol., 2002; 9 : 177–185.
2. Leith, J., Faulkner, G., Papa, P., Michelson, S. In vitro radiation survival parameters of human colon tumour cells. Int. J. Radiat. Oncol. Biol. Phys., 1991; 20 : 203–206.
3. Chapman, J. D., Anderson, P. R. Predicting and overcoming the radioresistance of individual tumors. Int. J. Radiat. Oncol. Biol. Phys., 1999; 44 : 477–479.
4. Pahl, H. L. Activators and target genes of Rel/NF-kappaB transcription factors. Oncogene, 1999; 18 : 6853–6866.
5. Karin, M., Cao, Y., Greten, F. R., Li, Z. W. NF-κB in cancer: from innocent bystander to major culprit. Nat. Rev. Cancer, 2002; 2 : 301–310.
6. Karin, M., Ben-Neriah, Y. Phosphorylation meets ubiquitination: the control of NF-κB activity. Ann. Rev. Immunol., 2000; 18 : 621–663.
7. Ghosh, S., May, M. J., Kopp, E. B. NF-κB and Rel proteins: Evolutionarily conserved mediators of immune responses. Ann. Rev. Immunol., 1998; 16 : 225–260.
8. Kim, K. M., Zhang, Y., Kim, B. Y., Jeong, S. J., Lee, S. A., Kim, G. D., Dritschilo, A., Jung, M. The p65 subunit of nuclear factor-kappaB is a molecular target for radiation sensitization of human squamous carcinoma cells. Mol. Cancer Ther., 2004; 3 : 693–698.
9. Vobořil, R., Weberova-Vobořilová, J. Constitutive NF-κB activity in colorectal cancer cells: impact on radiation-induced NF-κB activity, radiosensitivity, and apoptosis. Neoplasma, 2006; 53 : 518–523.
10. Ellis, R. D., Goodland, J. R., Limb, G. A., Powell, J. J., Thompson, R. P. H., Punchard, N. A. Activation of nuclear factor kappa B in Crohn‘s disease. Inflamm. Res., 1998; 47 : 440–445.
11. Yu, H. G., Yu, L. L., Yang, Y., Luo, H. S., Yu, J. P., Meier, J. J., Schrader, H., Bastian, A., Schmidt, W. E., Schmitz, F. Increased expression of RelA/Nuclear factor-kB protein correlates with colorectal tumorigenesis. Oncology, 2003; 65 : 37–45.
12. Yu, H. G., Zhong, X., Yang, Y. N., Luo, H. S., Yu, J. P., Meier, J. J., Schrader, H., Bastian, A., Schmidt, W. E., Schmitz, F. Increased expression of nuclear factor-kB/RelA is correlated with tumor angiogenesis in human colorectal cancer. Int. J. Colorectal Dis., 2004; 19 : 18–22.
13. Evertsson, S., Sun, X. F. Protein expression of NF-κB in human colorectal adenocarcinoma. Int. J. Mol. Med., 2002; 10 : 547–550.
14. Blankenstein, T. The role of tumor stroma in the interaction between tumor and immune systém. Curr. Opin. Immunol., 2005; 17 : 180-186.
15. Kammertoens, T., Schuler, T., Blankenstein, T. Immunotherapy: target the stroma to hit the tumor. Trends Mol. Med., 2005; 11 : 225–231.
16. Gooch, J. L., Lee, A., Yee, D. Interleukin 4 inhibits growth and induces apoptosis in human breast cancer cells. Cancer Res., 1998; 58 : 4199–4205.
17. Obiri, N. I., Hillman, G. G., Haas, G. P., Sud, S., Puri, R. K. Expression of high affinity interleukin-4 receptors on human renal cell carcinoma cells and inhibition of tumor cell growth in vitro by interleukin-4. J. Clin. Invest., 1993; 91 : 88–93.
18. Oosterling, S. J., van der Bij, G. J., Meijer, G. A., Tuk, C. W., van Garderen, E., van Rooijen, N., Meijer, S., van der Sijp, J. R. M., Beelen, R. H. J., van Egmond, M. Macrophages direct tumour histology and clinical outcome in a colon cancer model. J. Pathol. 2005 : 207 : 147–155.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2007 Issue 5-
All articles in this issue
- Poznámky k operační taktice a technice dekompresivní kraniotomie – přehledný referát
- Aorto-intestinální píštěl – závažná komplikace chirurgie aorty a pánevních tepen
- Radiofrekvenčně asistovaná resekce jater. Analýza skupiny pacientů operovaných v jednom centru
- Naše zkušenosti s léčbou pooperační bolesti u Crohnovy nemoci
- Cysta choledochu ako komplikácia gravidity
- Porovnání různých typů farmakologické prevence hluboké žilní trombózy dolních končetin u pacientů se zlomeninou proximální části stehenní kosti
- Súčasný trend liečby zlomenín krčka stehnovej kosti u seniorov
- Použití hřebu Targon PH long u etážových zlomenin a zlomenin metafýzy proximálního humeru
- Náhrada obratlového těla implantátem Synex
- NF- κB, kolorektální karcinom a radioterapie: výsledky klinické a experimentální studie
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Súčasný trend liečby zlomenín krčka stehnovej kosti u seniorov
- Použití hřebu Targon PH long u etážových zlomenin a zlomenin metafýzy proximálního humeru
- Náhrada obratlového těla implantátem Synex
- Poznámky k operační taktice a technice dekompresivní kraniotomie – přehledný referát
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

