-
Medical journals
- Career
Využití extrakorporální membránové oxygenace (ECMO) v léčbě kritického průběhu pneumonie
Authors: Samuel Genzor 1; Martin Šimek 2; Petr Jakubec 1; Pavol Pobeha 4; Jan Mizera 1; Martin Vykopal 1; Jakub Kiml 1; Milan Sova 1,3
Authors‘ workplace: Klinika plicních nemocí a tuberkulózy LF UP a FN Olomouc 1; Kardiochirurgická klinika LF UP a FN Olomouc 2; Klinika nemocí plicních a tuberkulózy LF MU a FN Brno 3; Klinika pneumológie a ftizeológie LF UPJŠ a UNLP Košice 4
Published in: Čas. Lék. čes. 2022; 161: 321-324
Category: Review Article
Overview
Mimotělní membránová oxygenace (ECMO) představuje nejvyšší formu resuscitační péče u pacientů s respiračním selháním. V případě syndromu akutní dechové tísně (ARDS – acute respiratory distress syndrome) je obvykle používán režim venovenózní ECMO podpory. Takto je umožněno překlenout nejkritičtější období v péči o pacienta se zcela selhavší funkcí plic – do doby nástupu účinku kauzální léčby nebo provedení transplantace plic. Mortalita pacientů na ECMO se různí dle vyvolávající příčiny a výskytu rizikových faktorů (věk, komplikace, komorbidity). Nástup pandemie COVID-19 vedl k výraznému zvýšení potřeby ECMO. Kvalita života pacientů po ECMO je signifikantně snížená, ale u většiny z nich nedochází k trvalé invaliditě.
Klíčová slova:
ECMO – dlouhodobé výsledky – COVID-19
ÚVOD
Extrakorporální membránová oxygenace (ECMO) poskytuje dočasnou náhradu funkce srdce a/nebo plic (1). Krev je odváděna z těla speciální kanylou z žíly (obvykle femorální či jugulární) a přiváděna zpět do arterie (v případě selhání srdce) nebo rovněž do žíly (2). Druhá zmiňovaná konfigurace je označována jako venovenózní ECMO (vv-ECMO) a může poskytnout po potřebnou dobu náhradu oxygenační funkce plic. Takto je umožněno překlenout nejkritičtější období v péči o pacienta se zcela selhavší funkcí plic – do doby nástupu účinku kauzální léčby (3).
Nejčastější indikací jsou extrémně těžké zápaly plic (včetně COVID-19), případně přemostění u pacientů čekajících na plicní transplantát při terminální fázi plicního onemocnění (4). V době pandemie COVID-19 se jeho použití vzhledem k velkému počtu kriticky probíhajících zápalů plic značně zvýšilo (5). Díky léčebným úspěchům, kdy významný podíl nemocných díky této terapii dlouhodobě přežívá, vznikla pro pneumology úplně nová výzva – péče o pacienty po kritických zápalech plic.
Tento přehledový článek je zaměřen na použití vv-ECMO u pacientů s kritickým průběhem pneumonií. Zvláštní pozornost je věnována onemocnění COVID-19.
EPIDEMIOLOGIE A INDIKACE VV-ECMO
Použití vv-ECMO bylo v době před pandemií COVID-19 i ve státech s vysokou úrovní zdravotní péče velmi nízké, například data z Německa (6) uváděla 3 případy na 100 000 obyvatel a rok. Pro arteriovenózní ECMO bylo použití na úrovni 3,5 případu na 100 000 obyvatel a rok. Nástupem pandemie COVID-19 bohužel přibylo velké množství případů kritických průběhů pneumonie, kdy ani při umělé plicní ventilaci nebylo možné dosáhnout adekvátní podpory dýchání (5). Dostupná data ukazují na několikanásobné navýšení potřeby této léčby. Podle epidemiologické studie, kterou publikovali Bergman et al. (7), dosahovala potřeba vv-ECMO u COVID-19-pozitivních pacientů 46 na 100 000. Téměř třetina obyvatel přitom v dané oblasti (Minnesota) za sledované období měla pozitivní test na COVID-19. U pacientů vyžadujících intenzivní péči se potom jednalo o 1,9 % (35 ze 1849). Pochopitelně část pacientů, kteří by byli potenciálně indikovaní k ECMO podpoře, ji pro momentální nedostupnost nemohla dostat.
Výběr pacientů pro vv-ECMO musí být podmíněn jednak splněním indikací pro tuto léčebnou modalitu (tedy selháním umělé plicní ventilace s pronací), nepřítomností kontraindikací k léčbě (zejména pokročilé nádorové onemocnění, krvácení do mozku a nemožnost obnovy funkce plic při kontraindikacích k plicní transplantaci) a dobrou prognózou pacienta z dlouhodobého hlediska (8).
PRINCIP VV-ECMO
Při připojování vv-ECMO je principiálně v jednom místě krev z těla odváděna a na místě druhém přiváděna po oxygenaci (a dekarbonylaci) v přístroji (1). Obvykle je využíván přístup femoro-jugulární/atriální. Při tomto zapojení je krev odváděna z těla femorální žílou a přiváděna zpátky přes v. jugularis interna kanylou do pravé síně. Druhá možnost je zapojení v opačném směru, kdy je krev odváděna přes v. jugularis do ECMO a posléze navrácena do těla pacienta femorální žílou. Tato varianta je spojena s potřebou vyššího průtoku, a proto je používána méně (9, 10). Ještě méně je využíván přístup femoro-femorální, který je možné využít u pacientů s komplikacemi či traumaty v místě krčních žil.
U pacientů s ECMO je obvykle současně pokračováno v umělé plicní ventilaci (v ultraprotektivním režimu s co nejnižšími dechovými objemy), současně je potřebná kontinuální infuze nefrakcionovaného heparinu (případně bivalirudinu) jako prevence trombotických komplikací. Část pracovišť dále uvádí pacienty i při ECMO podpoře nadále do pronační polohy a existují důkazy o benefitu tohoto přístupu ve smyslu redukce mortality ve srovnání s pacienty, u nichž pronace nebyla provedena (30 vs. 53 %; p = 0.0241) (11).
PROGNÓZA PACIENTŮ VYŽADUJÍCÍCH ECMO
V roce 1953 byla provedena první úspěšná operace na srdci s použitím mimotělního oběhu (12). První použití ECMO v intenzivní medicíně bylo publikováno v roce 1966 Kennedym (13), kdy bylo využito arteriovenózní ECMO jako součásti resuscitační péče u pacienta se srdeční zástavou. Z 8 nemocných přežilo hodiny až dny 7 z nich, ale pouze 1 zůstal při propuštění bez invalidizujícího neurologického deficitu. Gattinoni et al. (14) použili av-ECMO v managementu ARDS na skupině pacientů, přičemž dosáhli přibližně 50% přežití do doby propuštění. Posléze bylo publikováno několik prací s nejednoznačnými výsledky pro použití ECMO v léčbě ARDS. Jednoznačný benefit byl prokázán až studií CESAR v roce 2009 (15). Jednalo se o multicentrickou randomizovanou studii, která zahrnovala 180 pacientů z 68 center. Indikace k ECMO byla těžká ARDS z důvodu chřipky H1N1. Hospitalizační mortalita dosahovala 23,7 % ve srovnání s 52,5 % bez ECMO (Peek et al. 2009). Obdobné výsledky prokázala studie EOLIA (16), kdy bylo nakonec z nemocnice propuštěno 62 % ze všech pacientů vyžadujících ECMO. Průměrná délka ECMO podpory v obou studiích dosahovala 14–16 dnů.
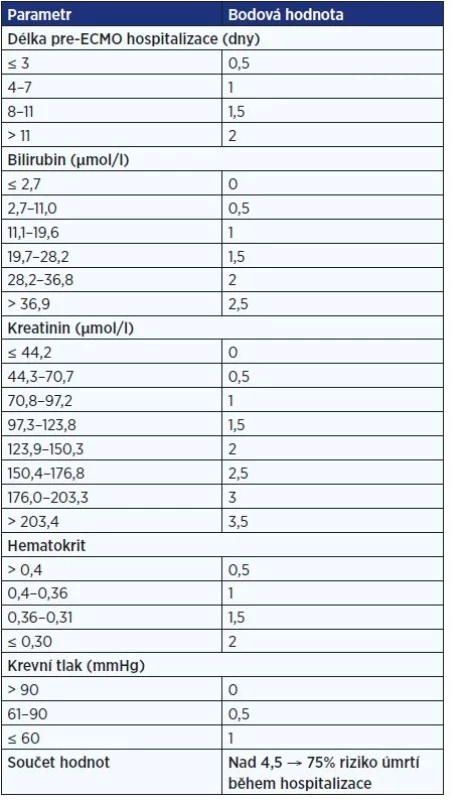
ECMOnet score (17) je pětifaktorové skóre, které velmi dobře koreluje s pravděpodobností přežití do dimise u pacientů vyžadujících ECMO. Zahrnutými proměnnými jsou délka pre-ECMO hospitalizace, hladina bilirubinu a kreatininu, hematokrit a střední krevní tlak při příjmu. Námi vytvořenou českou adaptaci skóre uvádí tab. 1. Toto skóre bylo původně vytvořeno na modelech analyzujících pacienty s chřipkou H1N1, ale lze jej využít i u jiných stavů vedoucích k ARDS. Validace pro COVID-19 zatím není dostupná. Zcela jistě má vliv i obezita a výrazně snižuje pravděpodobnost přežití pacienta výskyt komplikací.
Paradoxně protektivní vliv vyššího BMI prokázala ambispektivní studie (tj. zahrnující jak část retrospektivní, tak prospektivní), kterou publikovali Daviet et al. (18). Pacienti s obezitou měli vyšší pravděpodobnost úspěšnosti vv-ECMO při léčbě kritického průběhu COVID-19 s ARDS (poměr šancí [OR] 0,775; 95% interval spolehlivosti [CI] 0,644–0,934). Autoři postulovali teorii, že obézní pacient dospěje k těžkému refrakternímu selhání plic dříve než pacient neobézní, a proto je mu poskytnuta maximální antivirotická a podpůrná léčba dříve než neobéznímu. Lepší prognózu v souboru měli rovněž pacienti s nižším věkem.
Podle práce, kterou publikovali Herrmann et al. (19), je dále výrazně lepší prognóza pacientů v centrech s velkým objemem péče, kde bylo z nemocnice propuštěno 38 % osob ve srovnání s nízkoobjemovými centry, kde bylo přežití pouze 20 %. Obdobně jako Daviet et al. i tito autoři prokázali lepší přežívání pacientů s obezitou 2. a vyššího stupně (tj. BMI > 35) ve srovnání s pacienty s normální hmotností a podváhou (BMI < 25). Rizikovými faktory pro úmrtnost byly dále potřeba kontinuální dialýzy a výskyt krvácivých i trombotických komplikací.
V případě dlouhodobého přežívání po ECMO při kritickém průběhu COVID-19 jsou k dispozici pouze limitovaná data. Steinbeis et al. ve své observační studii (20) prokázali, že ještě 1 rok po akutní fázi onemocnění (16 pacientů) jsou přítomné významné deficity ve funkčním vyšetření plic. Pravděpodobnost vzniku respirační ventilační poruchy byla dokonce o něco vyšší než v případě pacientů po invazivní ventilační podpoře bez ECMO (adjustované OR 7,8 pro ECMO vs. 10,5 pro UPV). Pochopitelně zde může být bias v podobě efektu přežívajících, kdy pacienty s nejhoršími výsledky není možné z důvodu jejich úmrtí vyšetřit. Kvalita života podle dotazníku SGRQ (St George’s Respiratory Questionnaire) byla ve 12. měsíci sledování signifikantně lepší než v 6. týdnu. Paradoxně pacienti po lehkém průběhu COVID-19 vykazovali prakticky neměnné potíže po celou dobu sledování.
Ego et al. (21) publikovali výsledky 9 pacientů po ECMO při kritickém průběhu COVID-19. Ve studované populaci bylo přežití do dimise popsáno u 34 % pacientů napojených na vv-ECMO (11 z celkových 32). U 7 z 9 pacientů schopných dalšího vyšetřování byl prokázán deficit difuzní kapacity plic pro oxid uhelnatý (medián DLCO činil 58 % predikované hodnoty). Medián vzdálenosti v 6minutovém testu chůzí (6MWT) byl 468 metrů, což představovalo 68 % predikované hodnoty. Žádný z pacientů ale nevykazoval latentní respirační nedostatečnost (saturace hemoglobinu kyslíkem po zátěži dosahovala 91–96 %).
Grasselli et al. (22) publikovali soubor pacientů po ARDS z jakékoliv příčiny, ve kterém 34 osob bylo indikováno k ECMO a 50 nikoliv, byli tedy pouze na umělé plicní ventilaci (UPV). Pacienti na ECMO měli vstupně těžší hypoxémii (medián Horowitzova indexu 72) ve srovnání s pacienty bez ECMO podpory, kde index dosahoval mediánu 114. Přežití ve 12. měsíci sledování dosahovalo 66 % u osob po ECMO podpoře a 59 % po samotné UPV, rozdíly nebyly signifikantní. Výsledky vyšetření plicních funkcí (spirometrie, bodypletysmografie i difuzní kapacita) byly po 12 měsících téměř v mezích normy a nebyly prokázané signifikantní rozdíly mezi skupinami. Paradoxně, ve skupině po UPV byla konzistentně po celou dobu sledování referována horší kvalita života.
DÉLKA PODPORY ECMO
Smysluplná délka náhrady oxygenace pomocí mimotělního oběhu je diskutovanou otázkou s dosud nejednoznačnou odpovědí. Nejdelší ECMO podpora po proběhlém ARDS s příznivým výsledkem (quod vitam) byla publikována čínskými autory (23) a jednalo se o 111 dnů. Celkem byl pacient hospitalizován až 218 dnů, avšak i půl roku po dimisi vyžadoval alespoň 12 hodin denně oxygenoterapii. Vznikla u něj terminální plicní fibróza, přičemž provedení plicní transplantace nebylo pro přítomnost kontraindikací možné.
V případě pacientů čekajících na plicní transplantaci lze někdy využít i ECMO podpory při plném vědomí pacienta. Nejdelší délka takové ECMO podpory bez technické komplikace byla 265 dnů, terminální selhání plic vzniklo opět jako komplikace těžkého ARDS, bohužel transplantace u pacientky nebyla provedena z důvodu vysokých protilátek PRA (panel-reactive antibodies) a opakovaných infekcí krevního řečiště (24) a pokus o dekanylaci z ECMO skončil po 5 dnech terminálním respiračním selháním, kdy již terapie nebyla dále rozšiřována. Ještě delší čas na vv-ECMO podpoře strávil pacient s terminální fází plicní fibrózy čekající na transplantát, kdy ovšem po 403 dnech bylo nutné z důvodu komplikované a rozsáhlé trombózy jugulární žíly léčbu ukončit (25).
KOMPLIKACE ECMO
Dostupná literatura uvádí vysoký výskyt komplikací ECMO a péče o pacienta v kritickém stavu, který ECMO vyžaduje (26–28). Pochopitelně pouze část těchto komplikací lze kauzálně přičítat mimotělnímu oběhu (komplikace v místě inzerce kanyl, trombotické komplikace). Jiné komplikace se mohou vyskytnout jako důsledek antikoagulační léčby (kontinuální infuze bivalirudinu či heparinu), která je při ECMO potřebná.
Pravděpodobnost prakticky všech komplikací se zvyšuje s délkou podpory (29). Souhrn nejčastějších komplikací a jejich výskytu je uveden v tab. 2.
Table 2. Výskyt komplikací ECMO (26–28) 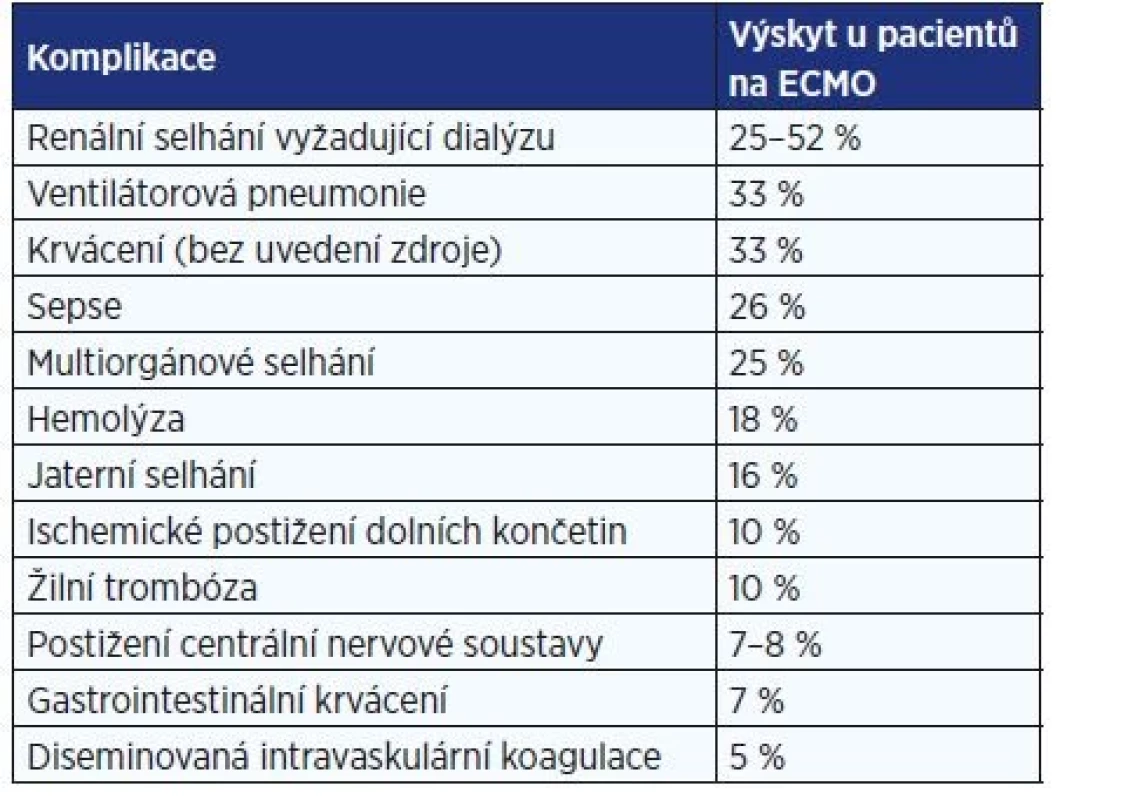
ZÁVĚR
Mimotělní membránová oxygenace (ECMO) představuje pokročilou formu péče u pacientů s refrakterním respiračním selháním, kde selhaly jiné léčebné modality včetně umělé plicní ventilace. Jejím prostřednictvím je umožněno překlenout nejkritičtější období v péči o nemocného se zcela selhavší funkcí plic. Při správném výběru pacienta (s ohledem na indikaci léčby a pravděpodobnost její efektivity dle skórovacích systémů) výrazně zvyšuje také terapeutické úspěchy při léčbě ARDS.
Mortalita pacientů se různí dle vyvolávající příčiny a výskytu rizikových faktorů (věk, komplikace, komorbidity). Efektivitu této léčby snižuje výskyt komplikací. Obezita se však paradoxně jeví jako „protektivní faktor“, což s vysokou pravděpodobností není vlivem obezity samotné. Působí zde nejspíš efekt včasněji podané terapie (včetně antivirotické) při rychlém nástupu respiračního selhání u obézních pacientů.
Kvalita života pacientů po ECMO je signifikantně snížená, ale u většiny z nich nedochází k trvalé invaliditě. Nástup pandemie COVID-19 vedl k výraznému zvýšení potřeby ECMO, což vedlo k nárůstu zkušeností anesteziologů a intenzivistů s použitím této léčby. Nyní je novým úkolem pneumologů adekvátně se postarat o pacienty, kteří dlouhodobě přežívají po ECMO.
Poděkování
Podpořeno MZ ČR – RVO (FNOL, 00098892).
Seznam použitých zkratek
6MWT 6minutový test chůzí (6-minute walk test)
ARDS syndrom akutní dechové tísně (acute respiratory distress syndrome)
av arteriovenózní
BMI body mass index
CI interval spolehlivosti (confidence interval)
COVID-19 coronavirus disease 2019
DLCO difuzní kapacita plic pro oxid uhelnatý
ECMO mimotělní membránová oxygenace (extracorporeal membrane oxygenation)
OR poměr šancí (odds ratio)
PRA panel-reactive antibodies
SGRQ St George’s Respiratory Questionnaire
UPV umělá plicní ventilace
vv venovenózní
Adresa pro korespondenci:
MUDr. Samuel Genzor, Ph.D.
Klinika plicních nemocí a TBC LF UP a FN Olomouc
I. P. Pavlova 6, 779 00 Olomouc
Tel.: 588 445 179, 3555 (4733)
e-mail: samuel.genzor@fnol.cz
Sources
- Allen S, Holena D, McCunn M et al. A review of the fundamental principles and evidence base in the use of extracorporeal membrane oxygenation (ECMO) in critically ill adult patients. J Intensive Care Med 2011; 26 : 13–26.
- Lim H. The physiology of extracorporeal membrane oxygenation: the Fick principle. Perfusion 2021 : 2676591211055971.
- Makdisi G, Wang IW. Extra corporeal membrane oxygenation (ECMO) review of a lifesaving technology. J Thorac Dis 2015; 7: E166–E176.
- Lee SH. Awakening in extracorporeal membrane oxygenation as a bridge to lung transplantation. Acute Crit Care 2022; 37 : 26–34.
- Supady A, Combes A, Barbaro RP et al. Respiratory indications for ECMO: focus on COVID-19. Intensive Care Med 2022; 48 : 1326–1337.
- Karagiannidis C, Brodie D, Strassmann S et al. Extracorporeal membrane oxygenation: evolving epidemiology and mortality. Intensive Care Med 2016; 42 : 889–896.
- Bergman ZR, Wothe JK, Alwan FS et al. The use of venovenous extracorporeal membrane oxygenation in COVID-19 infection: one region's comprehensive experience. ASAIO J 2021; 67 : 503–510.
- Harnisch LO, Moerer O. Contraindications to the initiation of veno-venous ECMO for severe acute respiratory failure in adults: a systematic review and practical approach based on the current literature. Membranes (Basel) 2021; 11 : 584.
- Rich PB, Awad SS, Crotti S et al. A prospective comparison of atrio-femoral and femoro-atrial flow in adult venovenous extracorporeal life support. J Thorac Cardiovasc Surg 1998; 116 : 628–632.
- Fisser C, Palmér O, Sallisalmi M et al. Recirculation in single lumen cannula venovenous extracorporeal membrane oxygenation: a non-randomized bi-centric trial. Front Med (Lausanne) 2022; 9 : 973240.
- Giani M, Martucci G, Madotto F et al. Prone positioning during venovenous extracorporeal membrane oxygenation in acute respiratory distress syndrome. A multicenter cohort study and propensity-matched analysis. Ann Am Thorac Soc 2021; 18 : 495–501.
- Gibbon JH. The artificial intracorporeal heart. Presidential address. Surgery 1996; 59 : 1–5.
- Kennedy JH. The role of assisted circulation in cardiac resuscitation. JAMA 1966; 197 : 615–618.
- Gattinoni L, Pesenti A, Mascheroni D et al. Low-frequency positive-pressure ventilation with extracorporeal CO2 removal in severe acute respiratory failure. JAMA 1986; 256 : 881–886.
- Peek GJ, Mugford M, Tiruvoipati R et al. Efficacy and economic assessment of conventional ventilatory support versus extracorporeal membrane oxygenation for severe adult respiratory failure (CESAR): a multicentre randomised controlled trial. Lancet 2009; 374 : 1351–1363.
- Combes A, Hajage D, Capellier G et al. Extracorporeal membrane oxygenation for severe acute respiratory distress syndrome. N Engl J Med 2018; 378 : 1965–1975.
- Pappalardo F, Pieri M, Greco T et al. Predicting mortality risk in patients undergoing venovenous ECMO for ARDS due to influenza A (H1N1) pneumonia: the ECMOnet score. Intensive Care Med 2013; 39 : 275–281.
- Daviet F, Guilloux P, Hraiech S et al. Impact of obesity on survival in COVID-19 ARDS patients receiving ECMO: results from an ambispective observational cohort. Ann Intensive Care 2021; 11 : 157.
- Herrmann J, Lotz C, Karagiannidis C et al. Key characteristics impacting survival of COVID-19 extracorporeal membrane oxygenation. Crit Care 2022; 26 : 190.
- Steinbeis F, Thibeault C, Doellinger F et al. Severity of respiratory failure and computed chest tomography in acute COVID-19 correlates with pulmonary function and respiratory symptoms after infection with SARS-CoV-2: an observational longitudinal study over 12 months. Respir Med 2022; 191 : 106709.
- Ego A, Taton O, Brasseur A et al. Six-month pulmonary function after venovenous extracorporeal membrane oxygenation for coronavirus disease 2019 patients. Crit Care Explor 2021; 3: e0494.
- Grasselli G, Scaravilli V, Tubiolo D et al. Quality of life and lung function in survivors of extracorporeal membrane oxygenation for acute respiratory distress syndrome. Anesthesiology 2019; 130 : 572-–580.
- Xu Z, Xu Y, Liu D et al. Case Report: Prolonged VV-ECMO (111 days) support in a patient with severe COVID-19. Front Med (Lausanne) 2021; 8 : 681548.
- Wiktor AJ, Haft JW, Bartlett RH et al. Prolonged VV ECMO (265 days) for ARDS without technical complications. ASAIO J 2015; 61 : 205–206.
- Umei N, Ichiba S, Sakamoto A. Idiopathic pulmonary fibrosis patient supported with extracorporeal membrane oxygenation for 403 days while waiting for a lung transplant: a case report. Respir Med Case Rep 2018; 24 : 86–88.
- Zangrillo A, Landoni G, Biondi-Zoccai G et al. A meta-analysis of complications and mortality of extracorporeal membrane oxygenation. Criti Care Resusc 2013; 15 : 172–178.
- Stulak JM, Dearani JA, Burkhart HM et al. ECMO cannulation controversies and complications. Semin Cardiothorac Vasc Anesth 2009; 13 : 176–182.
- Kim JH, Pieri M, Landoni G et al. Venovenous ECMO treatment, outcomes, and complications in adults according to large case series: a systematic review. Int J Artif Organs 2021; 44 : 481–488.
- Saeed O, Tatooles AJ, Farooq M et al. Characteristics and outcomes of patients with COVID-19 supported by extracorporeal membrane oxygenation: a retrospective multicenter study. J Thorac Cardiovasc Surg 2022; 163 : 2107.e6–2116.e6.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- ÚVODEM
- Mezinárodní kodex lékařské etiky Světové lékařské asociace
- V roce 2022 bylo Světovou lékařskou asociací (WMA) přijato nové znění etického kodexu – co nového přináší?
- Etické zásady pro používání a sdílení genomických dat z výzkumu
- Indikace metabolické a bariatrické chirurgie – ASMBS/IFSO 2022
- Nové bariatrické postupy a etika v bariatrické chirurgii – stanovisko IFSO
- Praktická doporučení pro péči o dětské pacienty po transplantaci ledviny a jater
- Permanentní močový katétr – dobrý sluha, zlý pán: Doporučení pro prevenci, diagnostiku a léčbu močových infekci spojených s katetrizací
- Pravidla výběru hormonální léčby v klimakteriu a její alternativy
- Nízké hladiny vitaminu D v populaci exponované významnému znečištění životního prostředí
- Využití extrakorporální membránové oxygenace (ECMO) v léčbě kritického průběhu pneumonie
- Imunita po koronavirové infekci jako podle učebnice
- Trendy lázeňství v době postkovidové, dopady a perspektivy
- Spolek českých lékařů v Praze a jeho činnost v posledních desetiletích
- 160 let české medicíny prizmatem 16 jubileí Spolku českých lékařů na stránkách Časopisu lékařů českých
- Zemřel profesor Miroslav Ryska
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Permanentní močový katétr – dobrý sluha, zlý pán: Doporučení pro prevenci, diagnostiku a léčbu močových infekci spojených s katetrizací
- Imunita po koronavirové infekci jako podle učebnice
- Pravidla výběru hormonální léčby v klimakteriu a její alternativy
- Využití extrakorporální membránové oxygenace (ECMO) v léčbě kritického průběhu pneumonie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career