-
Medical journals
- Career
Analýza sérových hladin Dickkopf-1 (DKK-1) u monoklonální gamapatie nejistého významu a mnohočetného myelomu
Authors: Vlastimil Ščudla 1; Pavla Petrová 2; Tomáš Pika 1; Pavel Lochman 2; Jiří Minařík 1; Jaroslav Bačovský 1; Karel Srovnalík 3
Authors‘ workplace: 3. interní klinika – nefrologická, revmatologická a endokrinologická LF UP a FN, Olomouc 1; Oddělení klinické biochemie FN, Olomouc 2; Hematologické oddělení, Nemocnice Vsetín 3
Published in: Čas. Lék. čes. 2015; 154: 181-188
Category: Original Article
Overview
Východisko.
Četné recentní studie se věnují rozpoznání biologických ukazatelů, jež by zpřesnily diagnostiku a stratifikaci monoklonální gamapatie nejistého významu a mnohočetného myelomu. Cílem předložené analýzy bylo zhodnocení potenciálního přínosu vyšetřování sérových hladin Dickkopf-1 (DKK-1) u MGNV a MM z hlediska spolehlivějšího odlišení obou stavů a zhodnocení vztahu k vybraným laboratorním ukazatelům, jednotlivým formám a klinickým stadiím.Metody a výsledky.
Analy-zovaná sestava zahrnovala soubor 46 jedinců s MGNV a 152 nemocných s MM vyšetřených při diagnóze před započetím léčby. K vyšetření koncentrace DKK-1 v krevním séru byla použita metoda ELISA, sérových hladin volných lehkých řetězců (VLŘ) κ a λ systém Freelite a β2-mikroglobulinu (β2-M) metoda Immulite 1000.Statistické testy:
Pearsonův χ2-test, U-test dle Manna-Whitneye a Kruskal-Wallisův test. Z analýzy vyplynulo, že v případě MGNV nebyla shledána rozdílnost hodnoty DKK-1 mezi rizikovými skupinami (0–3) a mezi stavy s rozdílnou koncentrací VLŘ včetně indexu monoklonality κ/λ. U mnohočetného myelomu byl rozpoznán vztah výše hladiny DKK-1 k hodnotě Hb (p < 0,008), nikoliv k hladinám VLŘ, kreatininu a β2-M v séru. V případě stážování MM dle Durieho-Salmona (D-S) byla zjištěna rozdílnost hladin DKK-1 pouze mezi stadii I vs. III (p = 0,001) a I vs. II + III (p = 0,002), při stratifikaci dle International Staging System (ISS) pouze mezi stadii 1 vs. 2 + 3 (p = 0,045). Přestože nebyla shledána významná rozdílnost mezi hladinami DKK-1 souborů MGNV vs. MM, byl zjištěn statisticky významný rozdíl mezi MGNV vs. stadium III (p = 0,001) a II + III dle D-S (p = 0,001), ale i MGNV vs. stadium 2 (p = 0,005) a vs. spojení stadií 2 + 3 (p = 0,012) dle ISS. Nebyla shledána rozdílnost koncentrací DKK-1 mezi MGNV vs. iniciální/asymptomatickou formou MM (stadium I).Závěr.
Přestože byla prokázána významná rozdílnost sérových hladin DKK-1 mezi MGNV a iniciální/asymptomatické fáze MM oproti pokročilým stadiím MM a mezi jedinci s normální vs. sníženou hodnotou Hb, nejeví se rutinní vyšetřování sérových hladin DKK-1 k odlišení MGNV od mnohočetného myelomu a ke zpřesnění současných stratifikačních systémů MGNV a MM v klinické praxi účelným.Klíčová slova:
monoklonální gamapatie nejistého významu – mnohočetný myelom – Dickkopf-1 (DKK-1) – volné lehké řetězce – stratifikace MGNV – stážování mnohočetného myelomuÚVOD
Mnohočetný myelom (MM), jedno z nejčastějších zhoubných onemocnění krvetvorného systému se vyznačuje monoklonální expanzí nádorově transformovaných plazmocytů v kostní dřeni vedoucí k útlaku normální krvetvorby a k rozvoji myelomové kostní nemoci (MKN), nejzávažnějšího klinického projevu MM. MKN se projevuje bolestmi v různých částech axiálního skeletu způsobených přítomností osteolytických lézí a/nebo komplikací osteoporózy a často i patologických zlomenin (1, 2). K rozvoji MKN dochází v důsledku dysbalance dynamické rovnováhy osteoklastické (OKL) resorpce a osteoblastické (OBL) kostní novotvorby, tj. v rámci zvýšené osteoklastické resorpce bez odpovídající kompenzace osteoblastickou kostní novotvorbou (2, 3). Uvedený děj je výsledkem komplexních vzájemných interakcí mezi myelomovými buňkami a elementy mikroprostředí kostní dřeně (KD). Ústřední roli v aktivaci OKL hraje aktivace systému RANK/RANKL/OPG (Receptor Activator of Nuclear Factor kappa-B/RANK ligand/osteoprotegerin), zatímco v inhibici OBL inhibitor kanonické Wnt (wingless) signální dráhy DKK-1 (4). U MM dochází v důsledku autokrinní a parakrinní stimulace k nadměrné expresi a sekreci inhibitorů Wnt signalizace Dickkopf 1–4 (DKK 1–4), významně se uplatňující v rozvoji osteolytického kostního procesu (5–10) a rovněž i v modulaci nádorové proliferace a disseminace. DKK-1, klíčový regulátor kostní remodelace a působek navozující supresi OBL, vytvářený v případě MKN zejména myelomovými buňkami je hlavním aktérem inhibice diferenciace OBL z jeho prekurzorů. Uplatňuje se rovněž v procesu proliferace, diferenciace a přežití OBL, inhibice tvorby a mineralizace kostní matrix, v podstatě tedy v útlumu kostní novotvorby a regenerace (11, 12). Z experimentálních studií vyplývá, že nízké hladiny DKK1 jsou provázeny zvýšením objemu trabekulární i kortikální kosti (13). DKK-1, provázený současným poklesem produkce OPG vede k inhibici OBL a nepřímo i k aktivaci OKL v důsledku vzestupu RANKL je v případě rozvinuté MKN v mikroprostředí KD významně exprimován, a má tedy v patogenezi MKN klíčovou úlohu (6, 7, 10, 12, 14–18).
Předložená studie se věnovala srovnání sérových hladin DKK-1 v souboru MGNV vs. MM v období rozpoznání nemoci, vyhodnocení vztahu výše DKK-1 k 4 rizikovým skupinám MGNV (19) a třem stadiím MM vyhodnocených s pomocí stratifikačních systémů podle Durieho-Salmona (D-S) a International Staging System (ISS) (20, 21). Zaměření studie vyplynulo ze závěrů studií prokazujících vysokou expresi inhibitoru Wnt DKK-1 v myelomových plazmocytech oproti plazmocytům u MGNV i zdravých jedinců, včetně průkazu mnohonásobně vyšší produkce DKK-1 v kolonii myelomových buněk než koloniích plazmocytů odebraných u MGNV a od zdravých dárců (5, 7). Podnětem byla i snaha o doplnění závěrů našich dřívějších studií, které prokázaly rozdílnost hladin řady biologických působků, tj. solubilní formy receptoru IL-6 (sIL-6R), inzulinu podobného růstového faktoru-1 (IGF-1), hepatocytárního růstového faktoru (HGF), syndecanu-1 (CD 138), zánětlivého makrofágovému faktoru -1α/β (MIP-1α/β), angiogeninu (ANG), endostatinu (ES) a markerů kostního metabolismu, tj. osteopontinu (OPN), osteokalcinu (OC), karboxy-terminálního telopetidu kolagenu typu-I (ICTP), osteoprotegerinu (OPG), aminokoncového propeptidu prokolagenu typu-I (PINP) u MGNV a v různých stadiích MM (22–24).
SOUBOR PACIENTŮ A POUŽITÉ METODY
Analyzovaná, 198členná sestava byla tvořena 46 jedinci s MGNV a 152 nemocnými s MM splňujícími IMWG kritéria, vyšetřené při diagnóze před zahájením terapie (25). Věkový medián MGNV byl 63 (31–82), nemocných s MM 65 (32–89) let, poměr mužů a žen a zastoupení imunochemických typů monoklonálního imunoglobulinu (MIg) popisuje tabulka 1. K rozvrstvení jedinců s MGNV byl použit stratifikační model predikce maligní transformace, dělící jedince do čtyř rizikových skupin (0 – low, 1 – low/intermediate,2 – high/intermediate a 3 – high risk), založený na hodnocení přítomnosti tří rizikových faktorů, tj. hladiny M-proteinu > 15 g/l, non-IgG typu M-proteinu a patologického indexu VLŘ κ/λ (19). Zastoupení jednotlivých rizikových skupin MGNV je uvedeno v tabulce 2. K vyšetření sérových hladin volných lehkých řetězců (VLŘ) κ a λ, včetně jejich poměru byl použit systém FreeliteTM firmy The Binding Site LTD (normální hladiny κ 3,3–19,4 mg/l, λ 5,5–26,3 mg/l, poměr κ/λ 0,26–1,65) (26). K vyšetření hladin DKK-1 v séru byla použita souprava ELISA firmy Enzo R Life Sciencies (normální rozmezí 295–2351 pg/ml). Hladina β2-M byla vyšetřována metodou Immulite 1000 Siemens Medical Solutions Diagnostic (normální rozmezí 0,1 až 2,5 mg/l) (tab. 3 a 4). Ke stratifikaci nemocných s MM do tří klinických stadií byl použit klasický model dle D-S a aktuální prognostický model ISS založený na výši sérových hladin albuminu a β2-M (tab. 5) (20, 21). Veškerá měření byla prováděna podle doporučení výrobce duplikátním způsobem a byla reprodukovatelná. Ke statistickému hodnocení byl použit Pearsonův χ2-test, neparametrický pořadový U-test dle Manna-Whitneye v Bonferiho modifikaci a test dle Kruskala-Wallise, s hranicí významnosti p < 0,05.
Table 1. Standardní charakteristiky analyzovaných souborů MGNV a mnohočetného myelomu v období diagnózy nemoci 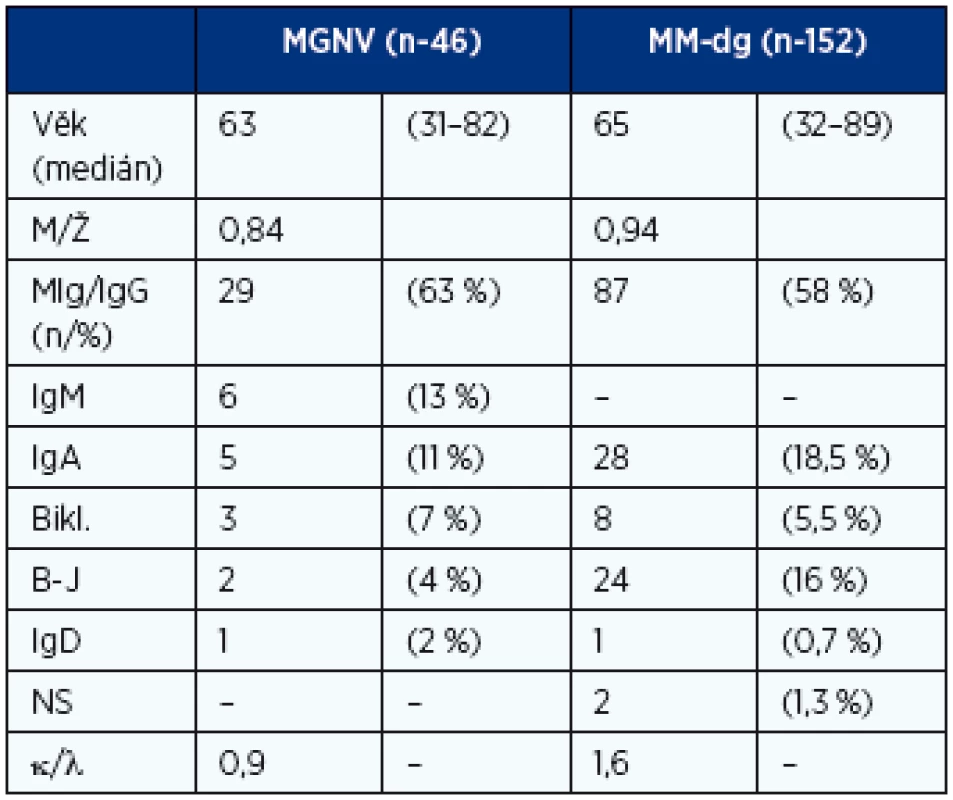
MGNV – monoklonální gamapatie nejistého významu, MM – mnohočetný myelom, M – muži, Ž – ženy, MIg – monoklonální imunoglobulin, Bikl. – biklonální typ, B-J – Bence-Jonesův typ, NS – nesekreční typ Table 2. Vztah hladin DKK-1 k rizikovým skupinám MGNV 0–3 (19) 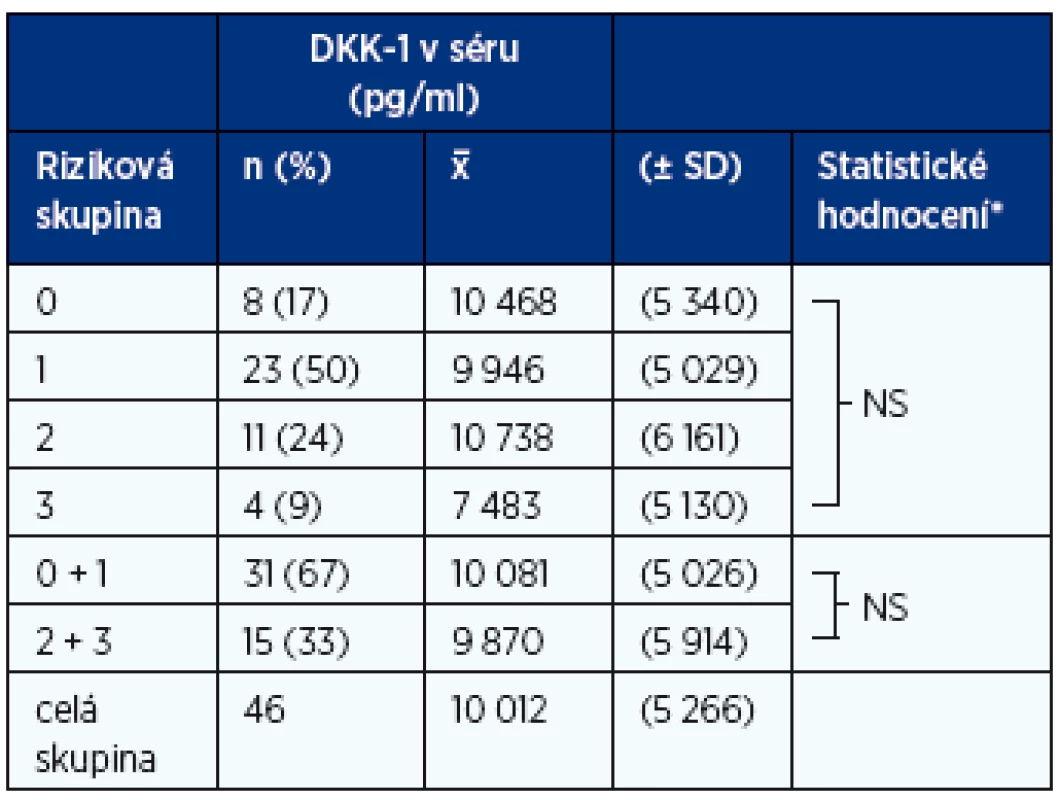
*Kruskalův-Wallisův a Mannův-Whitneyův U-test: NS (nesignifikantní rozdíly mezi jednotlivými rizikovými skupinami, p < 0,05) Table 3. Vztah hladin DKK-1 k hladinám volných lehkých řetězců κ, λ a poměru κ/λ v souboru MGNV (n-46) 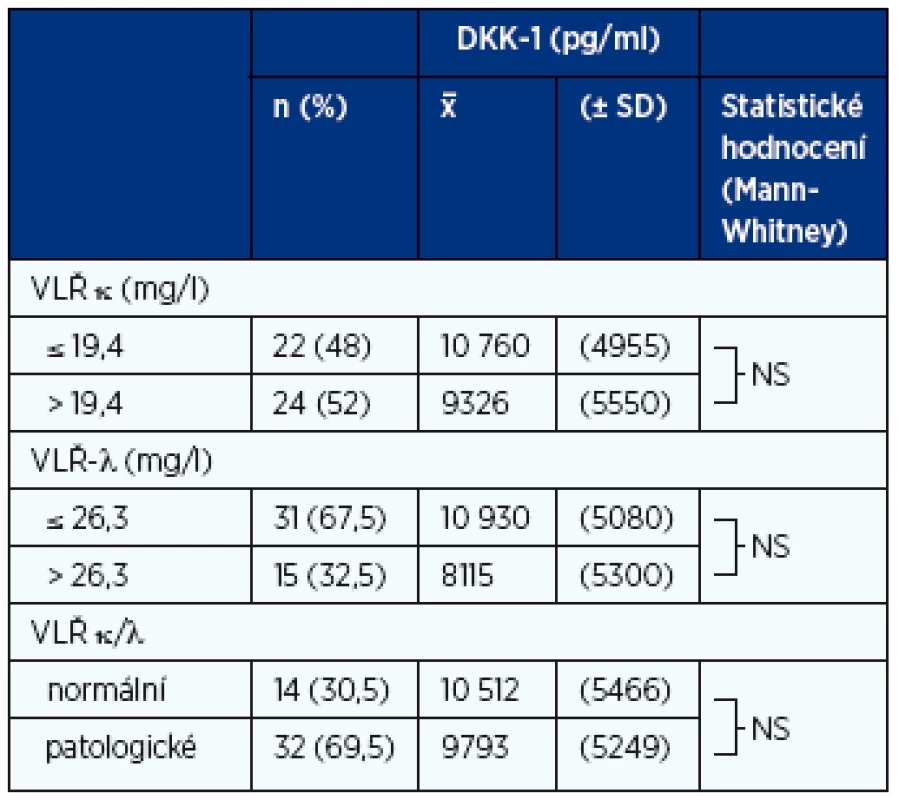
MGNV – monoklonální gamapatie nejistého významu, VLŘ – volné lehké řetězce imunoglobulinu v séru Table 4. Analýza vztahu sérových hladin DKK-1 k vybraným laboratorním ukazatelům mnohočetného myelomu vyhodnoceným při diagnóze nemoci (n-152) 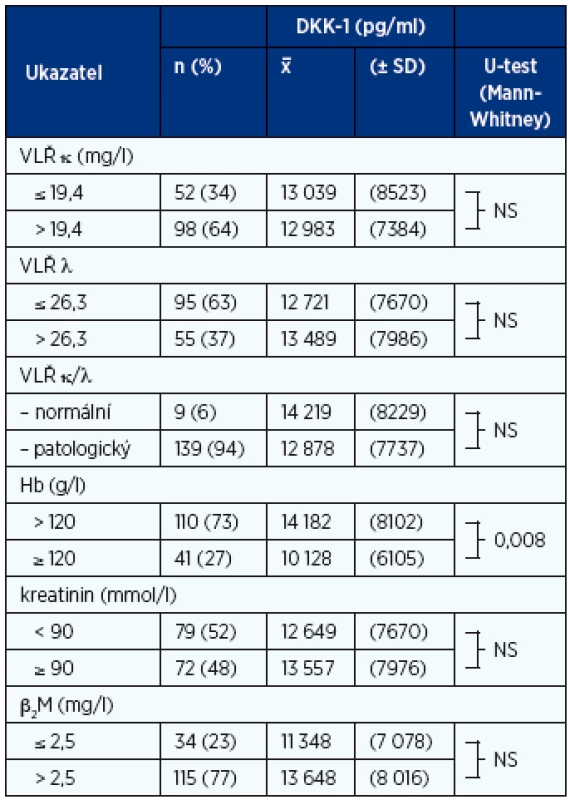
VLŘ – volné lehké řetězce v séru (FreeliteTM test), Hb – hemoglobin, β2M – β2-mikroglobulin Table 5. Analýza vztahu sérových hladin DKK-1 (pg/ml) ke stadiím MM dle Durieho-Salmona a International Staging System vyhodnocených při diagnóze nemoci (n = 152) 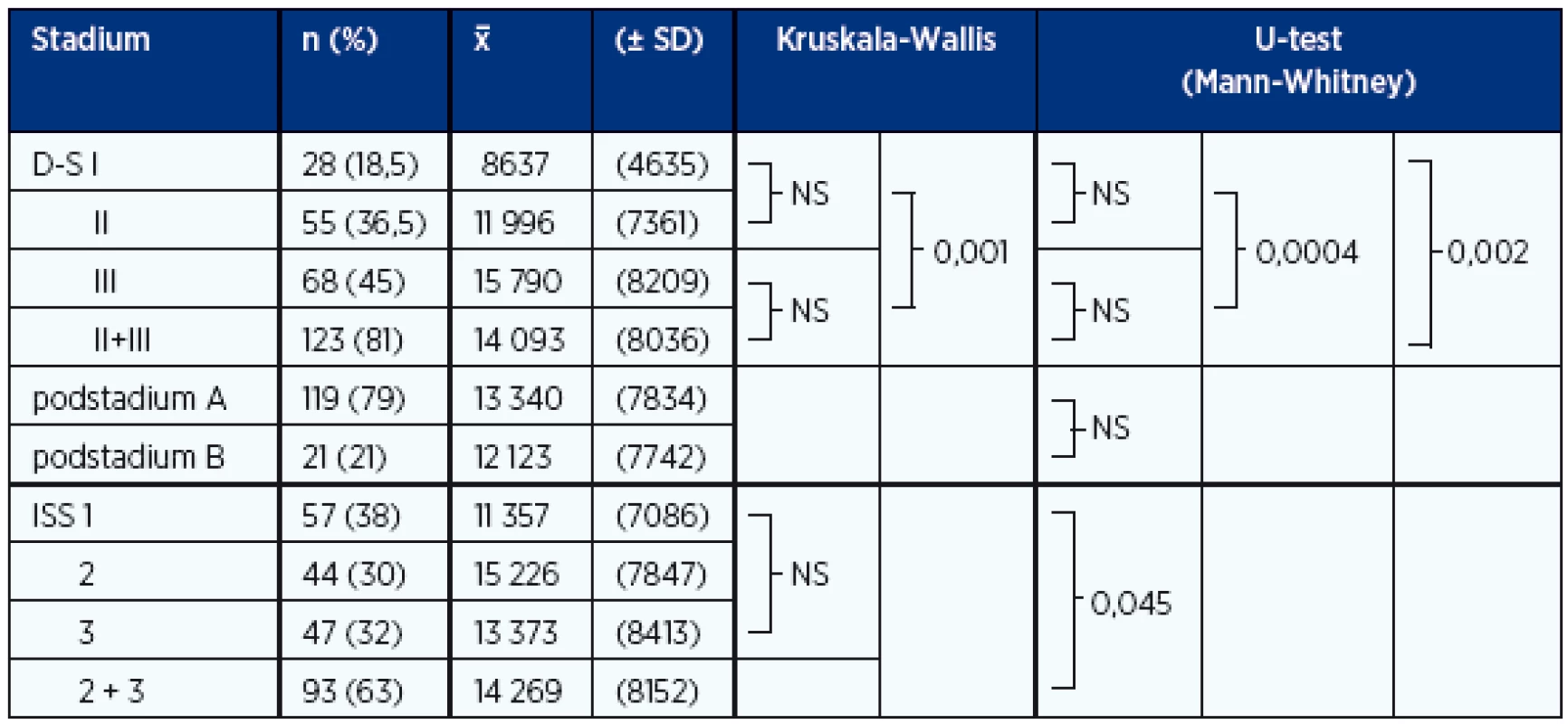
D-S – stadia dle Durieho-Salmona, ISS – stadia dle International Staging System VÝSLEDKY
Z analýzy souboru 46 nemocných s MGNV vyplynulo, že hladiny DKK-1 v séru se mezi skupinami jedinců zařazených do jedné ze čtyř rizikových skupin (0–3) neliší, a to ani v případě spojení nemocných pouze do dvou skupin s nízkým (skupina 0–1) a vysokým rizikem (skupina 2–3) maligní transformace v MM nebo jinou zhoubnou monoklonální gamapatii (tab. 2, graf 1A). Nebyla zjištěna rozdílnost výše hladin DKK-1 v séru mezi skupinami s normální a patologicky zvýšenou hladinou dominantního VLŘ κ nebo λ a normální nebo patologickou hodnotou indexu κ/λ (tab. 3).
Analýza nemocných s MM neprokázala významně odlišné hladiny DKK-1 ve skupinách s normální vs. patologickou hodnotou sérových hladin VLŘ κ a λ včetně patologických hodnot indexu κ/λ, kreatininu a β2-M. Pozitivně vyznělo pouze vyhodnocení vztahu DKK-1 k hodnotám Hb s použitím diskriminační hranice pro detekci chudokrevnosti 120 g/l (tab. 4, graf 1B).
Analýza vztahu výše hladiny DKK-1 v séru ke stadiím MM vyhodnocených podle D-S prokázala statistickou rozdílnost pouze mezi stadiem I vs. III (stadium s nízkou vs. velkou myelomovou masou) a mezi stadii I vs. II + III (stadium s nízkou vs. střední a velkou myelomovou masou), nikoliv ale mezi stadii I vs. II, II vs. IIII. a podstadii A vs. B, tj. mezi nemocnými s dobrou vs. patologickou funkcí ledvin (tab. 5, graf 1C). Při použití stratifikace MM podle ISS byla shledána statisticky významná rozdílnost hladin DKK-1 pouze při porovnání nemocných ve stadiu 1 vs. 2 + 3 (tab. 5, graf 1D).
Souhrnný rozbor hladin DKK-1 jedinců s MGNV a nemocných vyšetřených při rozpoznání MM neprokázal mezi oběma soubory statistickou rozdílnost (tab. 6, graf 1E). Hlubší analýza ovšem ukázala, že významná odlišnost hladin DKK-1 byla vázána pouze na srovnání MGNV se symptomatickou, nejpokročilejší formou MM, tj. skupinou nemocných ve stadiu III dle D-S, případně skupinou se sloučením stadií II a III, nikoliv ale s inciální, asymptomatickou formou nemoci (stadium I) a se skupinou se středním rozsahem nádorové masy, tj. stadia II (tab. 6, graf. 1F). Jak je patrné, nebyl zaznamenán statisticky významný rozdíl mezi MGNV a oběma podstadii, tj. A a B dle D-S. Při použití stratifikace dle ISS byl při analýze vztahu hladin DKK-1 u MGNV a jednotlivých stadií MM zjištěn statisticky významný rozdíl pouze při srovnání se stadiem 2, nikoliv k iniciální, asymptomatické fázi MM (stadium 1) i ke stadiu 3. Statisticky významně vyznělo srovnání MGNV se skupinou sdružující stadia 2 a 3 (tab. 6, graf. 1G).
Graph 1. Grafické vyjádření naměřených hladin DKK-1 v jednotlivých rizikových skupinách monoklonální gamapatie nejistého významu (n-46) a stadiích mnohočetného myelomu v období diagnózy nemoci (n-152) MGNV – monoklonální gamapatie nejistého významu, Hb – hemoglobin, MM – mnohočetný myelom, D-S – stadia myelomu podle Durieho-Salmona, ISS – stratifikace myelomu podle International Staging System, x– aritmetický průměr A – sérové hladiny DKK-1 v jednotlivých rizikových skupinách (0–3) MGNV, B – sérové hladiny DKK-1 podle hodnoty Hb, C – sérové hladiny DKK-1 v jednotlivých stadiích (I–III) MM dle D-S, D – sérové hladiny DKK-1 v jednotlivých stadiích (1–3) dle ISS, E – sérové hladiny DKK-1 u MGNV a MM, F – sérové hladiny DKK-1 u MGNV a stadiích MM (I–III) dle D-S, G – sérové hladiny DKK-1 u MGNV a v jednotlivých stadiích (1–3) dle ISS 
Table 6. Analýza vztahu sérových hladin DKK-1 (pg/ml) jedinců s MGNV (n = 46) a jednotlivých stadií MM (n = 152) vyhodnocených při diagnóze nemoci 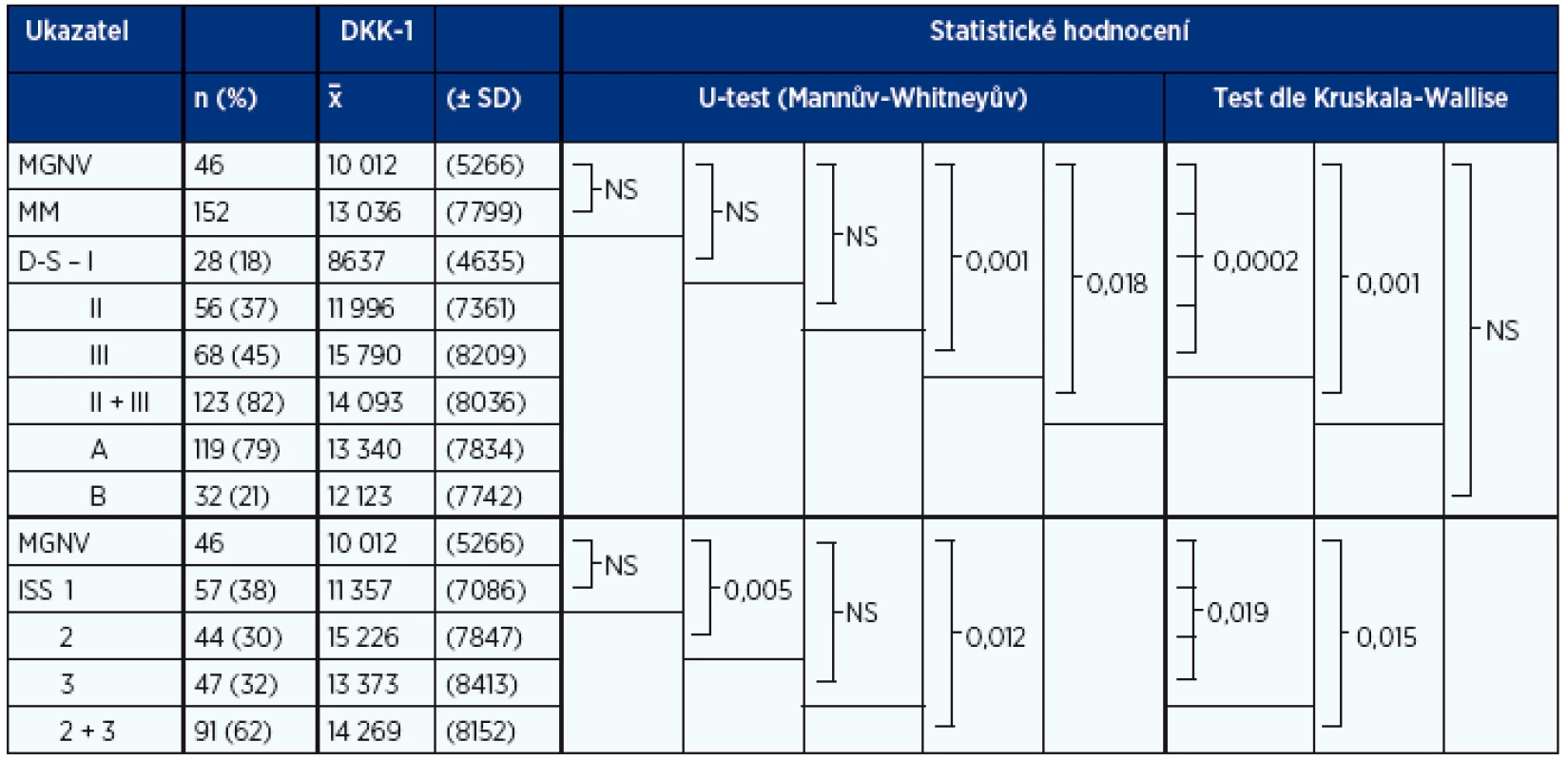
MGNV – monoklonální gamapatie nejistého významu, MM – mnohočetný myelom, D-S – stážovací systém dle Durieho-Salmona, ISS – stážovací systém dle International Staging System DISKUZE
V klinické praxi bývá rozlišení MGNV od MM, zejména od jeho iniciální, asymptomatické fáze někdy obtížné, neboť není znám samostatný ukazatel, který by tyto, z hlediska léčby diametrálně odlišné stavy, spolehlivě odlišil. V řadě studií bylo prokázáno, že zvýšené hladiny DKK-1 v kostní dřeni a v periferní krvi jsou u MM provázeny rozvojem osteolytických lézí (6, 7, 10, 12, 15–17, 27). V pilotní, široce koncipované studii věnované této problematice bylo zjištěno, že u MM korelují hladiny DKK-1 v plazmě KD a v krevním séru nejen navzájem, ale i s expresí genu pro DKK-1 a s počtem ložiskových kostních lézí (7). Hladiny DKK-1 u nemocných s jednou a více lézemi zobrazenými MRI se významně liší od stavů s MRI a RTG negativitou (7), což je v souladu s poznatkem, že zvýšená exprese DKK-1 v myelomových buňkách významně koreluje s tíží osteolytického postižení skeletu (9), což ale nebylo potvrzeno při použití hladin DKK-1 v plazmě KD (4). DKK-1 není zřejmě jedinou příčinou rozvoje MKN, neboť 40 % nemocných s pokročilým osteolytickým postižením skeletu neexprimovalo DKK-1 (9). Z imunohistochemické analýzy vyplynulo, že detekovatelnou pozitivitou DKK-1 se vyznačují pouze myelomové plazmocyty, nikoliv plazmocyty zdravých jedinců a nemocných s Waldenströmovou makroglobulinémií. U MGNV byla v 15 z 16 vyšetření intenzita plazmocelulární exprese DKK-1 obdobná jako u MM bez MRI a RTG přítomnosti ložiskových lézí (7). Glykoprotein DKK-1 je na rozdíl od normální tkáně výrazně exprimován v myelomových buňkách (28), přičemž gen odpovídající za jeho produkci je umístěn na 10. chromozomu (29). DKK-1 produkovaný nejen myelomovými, ale i kmenovými mezenchymálními buňkami KD je hlavním působkem inhibující prekurzory OBL v procesu preosteoblastické diferenciace (10, 12). Experimentální i preklinické studie potvrdily, že vysoká hladina DKK-1 v mikroprostředí KD spojená s inhibicí osteoblastogeneze je provázena snížením počtu a viability OBL, což spolu s aktivací OKL vede k disharmonii kostní homeostázy, a tím i kostní regenerace (9, 11). V průběhu progrese MM provázeným rozvojem MKN dochází k posunu poměru mezi OBL a OKL ve prospěch OKL, a tím i k potlačení osteoformace ve prospěch osteoresorpce a rozvoje osteolytických lézí. DKK-1 ruší účinek kostního morfogenetického proteinu-2 (BMP-2) uplatňujícího se při diferenciaci OBL (10, 12), narušuje expresi Wnt3a-regulujího OPG a receptoru RANKL v OBL, a tím i nepřímo funkci OKL (28). DKK-1 jako klíčový působek v biologii kosti spolu s dalšími inhibitory Wnt-signální dráhy, tj.FRP-2 a FRP-3 (frizzled related protein), sclerostinem a Wnt inhibičním faktorem-1 se uplatňují jako hlavní řídící síly v patogenezi MKN (4). Zatímco v případě výrazné expreseFRP-2 a -3 svou přímou vazbou na Wnt blokují Wnt dráhy, DKK-1 blokuje pouze LRP5/6 β-catenin-dependentní kanonickou Wnt dráhu, a to v přímé závislosti na množství myelomové masy (4, 28, 30). Nadměrná exprese DKK-1 v OBL vede nejen k osteopenii, ale i k inhibici hematopoetických kmenových buněk a obtížnému hojení kostních fraktur. Primární postižení linie OBL v rámci aktivní formy MKN je provázeno snížením hodnoty kostní frakce alkalické fosfatázy (bALP), osteokalcinu, NTX a osteoprotegerinu (31, 32).
Z analýzy naší sestavy vyznělo, že pouze tři ze 46 jedinců s MGNV mělo normální hodnotu DKK-1 v séru, což do jisté míry odpovídá závěrům studií prokazujícím produkci DKK-1 již v období transformace do časných stadií MM (29, 33). Alterace elementů mikroprostředí KD u MGNV vede k vzestupu DKK-1 provázenému redukcí trabekulární kosti (29, 33, 34). S pomocí kvantitativní počítačové tomografie s vysokým rozlišením bylo v kostních vzorcích odebraných u MGNV pozorována porucha osteoformace projevující se snížením hustoty minerální složky a ztenčením kortikální i trabekulární kosti, a to v korelaci se současným výrazným zvýšením sérové hodnoty DKK-1 a vysokou hladinou MIP-1α uplatňující se v aktivaci OKL (33). Zvýšená hodnota DKK-1 v séru u MGNV nasvědčuje inhibici funkce OBL již u tohoto premaligního stavu a vysvětluje prokázané zvýšené riziko zlomenin (33). O složitosti této problematiky nasvědčuje i závěr studie Politoua, která neprokázala významnou rozdílnost hladin DKK-1 u jedinců s MGNV a kontrolní skupinou, avšak na rozdíl od závěru naší analýzy významnou rozdílnost oproti pacientům s MM vyšetřených při diagnóze nemoci (35). Příčinou může být nejen heterogenita MGNV, ale i rozdílnost použité analytické techniky, tj. v naší studii metody ELISA vs. R§D systém Abingdon s použitím antihumánní kozí protilátky proti DKK-1 se zcela rozdílným rozmezím normálních hodnot, anebo analýza rozdílných tkáňových substrátů, tj. krevního séra nebo plazmy vs. plazmy aspirátu kostní dřeně (7). Výsledky naší studie nepotvrdily náš úvodní, doposud nezkoumaný předpoklad, že sérové hladiny DKK-1 by měly být vyšší ve skupině nemocných s MGNV s vysokým rizikem přechodu v maligní MG, tj. ve skupině 2 a 3 („high/intermediate“ a „high risk“) než ve skupině 1 a 2 („low“ a „low/intermediate risk“). Toto zjištění svědčí pro chybění vztahu mezi produkcí DKK-1 v plazmocytech, případně elementech mikroprostředí KD ke stratifikačním kritériím, tj. k výši a typu MIg a k hladinám VLŘ u MGNV. Pro nezávislost syntézy DKK-1 plazmatickými buňkami u MGNV na syntéze lehkých řetězců κ a λ, včetně jejich poměru (index monoklonality κ/λ) nasvědčuje i nepřítomnost jakéhokoliv vzájemného statisticky významného vztahu.
Analýza nemocných s MM, vyšetřených při rozpoznání nemoci před nasazením terapie neprokázala vztah sérové koncentrace DKK-1 k hladinám VLŘ κ, λ a jejich vzájemnému poměru (index κ/λ), hodnotě β2M v séru a stejně jako v předchozí studii k hodnotě kreatininu v séru (27). Byl ale odhalen vztah DKK-1 k hodnotě Hb s přítomností významně vyšších hladin u anemických jedinců (Hb < 120 g/l). Toto zjištění, vysvětlitelné závislostí proliferace kmenových krvetvorných buněk na niche KD modulované OBL, neboť kapacita hematopoézy je mj. regulována impulzy kanonické Wnt signální dráhy. Již dřívější studie odhalily, že vysoké hodnoty DKK-1 disponují k imunosupresi a anémii a v průběhu autologní transplantace negativně ovlivňují mobilizaci, přichycení a proliferaci kmenových krvetvorných buněk (7).
Při rozboru vztahu sérových hladin DKK-1 ke stupni pokročilosti MM vyhodnocené podle D-S (stadium I-III) byl zjištěn pozitivní trend k nárůstu hladin DKK-1 s pokročilostí MM. V souladu se závěry předchozích studií (27, 35) byla zjištěna významná rozdílnost mezi iniciální, asymptomatickou fází MM (stadium I) a stadiem III a spojením stadií II + III, na rozdíl od studie Kaisera, ale nikoliv mezi nemocnými s malou (stadium I) a střední (stadium II) nádorovou masou. V souladu s chyběním vztahu hladin DKK-1 k výši sérového kreatininu vyzněla negativně i analýza podstadií A vs. B dle D-S. Při použití stratifikace MM dle ISS nebyla zjištěna na rozdíl od předchozích studií významná rozdílnost sérových hladin DKK-1 mezi stadii 1–3 (10). V souladu se závěrem Politoua byl zaznamenán významný rozdíl hladin DKK-1 pouze mezi stadiem 1 vs. spojení stadií 2 + 3 (35). O platnosti vztahu hladin DKK-1 ke stupni pokročilosti MM nasvědčuje zjištění, že po VDT/ATKB dochází současně ke snížení klinického stadia MM dle ISS, k poklesu hladiny DKK-1 a k vzestupu hladin osteoformačních ukazatelů jako projevu zlepšení funkce OBL (35). Uvedená zjištění odpovídají znalosti o klesající úrovni osteoformace včetně snížení počtu OBL v souladu s pokročilostí MM dokumentovanou narůstající infiltrací KD myelomovými plazmocyty (3, 10, 12). Je zajímavé, že analýza vztahu hladin DKK-1 k rozsahu MKN vyzněla v řadě studií dosti rozporuplně. Většina autorů uvádí, že nemocní s nepřítomností osteolytického postižení skeletu se vyznačují nižší hladinou DKK-1 než pacienti s osteolytickou formou MKN, rovněž nález RTG a MRI zřejmých osteolytických lézí je provázen významným vzestupem hladin DKK-1 (7, 27, 36). O významnosti role DKK-1 v patogenezi osteolytické formy MKN nasvědčuje zjištění, že u nemocných s vysokým stupněm exprese DKK-1 dochází k progresi osteolytických lézí i přes intenzivní terapii bisfosfonátem (37). Nelze ale nezmínit závěry studií, které vztah hladin DKK-1 ke stupni osteolytického postižení skeletu a k hladinám markerů remodelace skeletu neprokázaly, což odpovídá poznání, že možným zdrojem DKK-1 nejsou vždy myelomové plazmocyty, ale i OBL a další elementy stromatu (35). O proměnlivosti exprese DKK-1 v myelomových plazmocytech a hladinách v plazmě KD nebo v krevním séru vypovídá důležitý poznatek, že v konečných fázích průběhu MM, v rámci extramedulární progrese s přítomností pleurálních infiltrátů, v období druhotné leukemizace myelomového procesu a v případě „high-grade“ MM s plazmoblastickou morfologií a nodulárním typem myelomových infiltrátů v KD dochází ke ztrátě detekce DKK-1 (7). Nízká úroveň exprese DKK-1 v těchto situacích může být výrazem snížené reakce buněk na oxidativní stres (36). Je zřejmé, že vysoká exprese DKK-1 je vázána na specifická stadia MM a závisí na řadě dalších faktorů, včetně interakce myelomových buněk s OKL a uplatnění dalších, doposud ne zcela objasněných patogenetických mechanismů včetně specifických biologických signálních cest uplatňujících se v rozvoji MKN (7, 9).
Překvapivým zjištěním neodpovídajícím většině předchozích studií (4, 10, 11, 27, 35, 38) je nepřítomnost statisticky významného rozdílu sérových hladin jedinců s MGNV a nemocných s MM v naší sestavě, i když např. ve studii Tiana bylo zvýšení hladiny DKK-1, a to v plazmě kostní dřeně u MGNV stejně jako v krevním séru v naší studii rovněž zjištěno (7). Vyšší hladiny DKK-1 u některých jedinců anebo i souborech s MGNV nasvědčují potenciální roli DKK-1 a zřejmě i dalších cytokinů na ztrátě kostní hmoty u MGNV v přechodu do časné fáze MM (33, 34). Hlubší rozbor odhalil, že vyšetření sérové hladiny DKK-1 rovněž nepřispívá vzhledem k výraznému překrývání hodnot k odlišení MGNV od iniciální, asymptomatické fáze MM (stadium I dle D-S a 1 dle ISS), což koresponduje s předchozími závěry (27, 38). V souladu s očekáváním byly ale výrazné rozdíly hladin DKK-1 jedinců s MGNV a nemocnými v pokročilých fázích MM, tj. stadiích dle D-S III případně II + III i stadiu 2, případně 2 + 3 dle ISS. Z uvedeného vyplývá, že vyšetřování DKK-1 nerozšiřuje paletu ukazatelů doplňujících standardní kritéria IMWG k odlišení MGNV od iniciální fáze MM, jeho vyšetřování není v této indikaci v klinické praxi přínosné (22–24).
DKK-1 je v experimentálních podmínkách testován jako terčová molekula aktivní imunoterapie MM. DKK1-DNA vakcína nebo anti-human DKK-1 neutralizační protilátka (BhQ880) se testuje v prevenci a v terapii rozvinutého myelomu (39, 40). Pokles sérových hladin DKK-1 a RANKL byl pozorován jako součást úpravy kostní remodelace v rámci kompletní nebo alespoň parciální remise po léčbě relapsu MM bortezomibem, lenalidomidem, dexametasonem a/nebo VDT/ATKB (41, 42). Léčebná inhibice DKK-1 jako klíčového působku rozvoje MKN vede restauraci diferenciace a funkce OBL, a tím ke snížení kostních ztrát, potlačení kostní resorpce, k stimulaci kostní novotvorby a k omezení nádorového růstu (37, 43).
Seznam použitých zkratek
ANG angiogenin
ATKB autologní transplantace kmenových buněk
bALP kostní frakce alkalické fosfatázy
β2M β2-mikroglobulin
CD-138 syndecan-1
DKK-1 Dickkopf-1
D-S stážování dle Durieho-Salmona
ELISA analýza s pomocí enzymo-imunoeseje
ES endostatin
FRP-2/3 „frizzled related protein“-2/3
Hb hemoglobin
HGF hepatocytární růstový faktor
ICTP karboxy-terminální telopeptid kolagenu typu I
IMWG International Myeloma Working Group
ISS stratifikace dle „International StagingSystem“
KD kostní dřeň
MGNV monoklonální gamapatie nejistého významu
MG monoklonální gamapatie
Mig monoklonální imunoglobulin
MIP-1 α/β zánětlivý makrofágový faktor-1 α/β
MKN myelomová kostní nemoc
MM mnohočetný myelom
M-protein monoklonální protein
MRI magnetic resonance imaging
NTX N-terminal cross links telopeptide of type-1 collagen
OBL osteoblast
OC osteokalcin
OKL osteoklast
OPG osteoprotegerin
OPN osteopontin
PINP aminokoncový propetid prokolagenu typu I
RANK receptor activator of nuclear factor kappa-B
RANKL receptor activator of nuclear factor kappa-B ligand
sIL-6R solubilní receptor interleukinu-6
VDT vysokodávkovaná terapie
VLŘ volné lehké řetězce
Wnt wingless
Podpora grantové studie IGA ČR NT 12451-5 a NT 14393.
Konflikt zájmů: žádný.
ADRESA PRO KORESPONDENCI:
prof. MUDr. Vlastimil Ščudla, CSc.
3. interní klinika – nefrologická, revmatologická a endokrinologická LF UP a FN
I. P. Pavlova 6, 775 20 Olomouc
e-mail: vlastimil.scudla@fnol.cz
Sources
1. Hájek R, Adam Z, Maisnar V, et al. Diagnostika a léčba mnohočetného myelomu. Doporučení České myelomové skupiny 2012. Transfuze Hematol Dnes 2012; 18(Suppl 1): 3–90.
2. Kocemba KA, Groen RW, VanAndel H, et al. Transcriptional silencing of the Wnt-antagonist DKK-1 by promoter methylation is associated with enhanced Wnt signaling in advanced multiple myeloma.PloS ONE 7(2): e30359. doi:10.1371/journal.pone 0030359.
3. Bataille R, Chappard D, Marcelli C, et al. Mechanisms of bone destruction in multiple myeloma: the importace of unbalanced process in determining the severity of lytic bone disease. J Clin Oncol 1989; 7 : 1909–1914.
4. Kristensen IB, Christensen JH, Lyng MB, et al. Expression of osteoblast and osteoclast regulatory genes in the bone marrow microenviroment in multiple myeloma: only up-regulation of Wnt inhibitors SFRP3 and DKK-1 is associated with lytic bone disease. Leukemia§Lymphoma 2013: Early Online: 1–9. doi: 10.3109/10428194.2013.820288.
5. Giuliani N, Morandi F, Tagliaferri S, et al. Production of Wnt inhibitors by myeloma cells: potential effects on canonical Wnt pathway in the bone microenvironment. Cancer Res 2007; 67 : 7665–7674.
6. Oshima T, Abe M, Asano J, et al. Myeloma cells supress bone formation by secreting a soluble Wnt inhibitor, sFRP-2. Blood 2005; 106 : 3160–3165.
7. Tian E, Zhan F, Walker R, et al. The role of the Wnt-signaling antagonist DKK-1 in the development of osteolytic lesions in multiple myeloma. New Engl J Med 2003; 349 : 2483–2494.
8. Niehrs C. Function and biological role sof the Dickkopf family of Wnt modulators. Oncogene 2006; 25 : 7469–7481.
9. Haaber J, Abildgaar N, Knudsen LM, et al. Myeloma cell expression of 10 candidate genes for osteolytic bone disease. Only everexpression of DKK-1 correlates with clinical bone involvement at diagnosis. Brit J Haematol 2007; 140 : 25–35.
10. Qiang YW, Barlogie B, Rudikoff S, et al. DKK-1 induced inhibition of Wnt signaling in osteoblast differentiation is an underlying mechanism of bone loss in multiple myeloma. Bone 2008; 42 : 669–680.
11. Heider U, Kaiser M, Mieth M, et al. Serum concentrations of DKK-1 decrease in patiens with multiple myeloma responding to anti-myeloma treatment. Eur J Haematol 2009; 82 : 31–38.
12. Qiang YW, Chen Y, Stephens O, et al. Myeloma-derived Dickkopf-1 disrupts Wnt-regulated osteoprotegerin and RANKL production by osteoblasts: a potential mechanism underlying osteolytic bone lesions in multiple myeloma. Blood 2008; 112 : 196–207.
13. McDonald BT, Joiner DM,Oyserman SM, et al. Bone mass is inversely proportional to DKK-1 levels in mice. Bone 2007; 41 : 331–339.
14. Manier S, Sacco A, Leleu X, et al. Bone marrow microenvironment in multiple myeloma progression. J Biomed Biotechnol. doi:10.1155/2012/157496.
15. Klaus A, Birchmeier W. Wnt signalling and its impact on development and cancer. Nat Rev Cancer 2008; 8 : 387–398.
16. Edwards CM, Edwards JR, Lwin ST, et al. Increaseing Wnt signaling in the bone marrow microenvironment inhibite the development of myeloma bone disease and reduces tumor burden in bone in vivo. Blood 2008; 111 : 2832–2842.
17. Cianferotti L, Demay MB. VDR-mediated inhibition of DKK-1 a SFRP-2 supresses adipogenic differentiation of murine bone marrow stromal cells. J Cell Biochem 2007; 101 : 80–88.
18. Robbiani DF, Chesi M, Bergsagel PL, et al. Bone lesions in molecular subtypes of multiple myeloma. New Engl J Med 2004; 351 : 197–198.
19. Rajkumar SV, Kyle RA, Therneau (tm), et al. Serum free light chain ratio in an independent risk factor for progression in monoclonal gammopathy of undetermined significance. Blood 2005; 106 : 812–817.
20. Durie BGM, Salmon SE. A clinical staging system for multiple myeloma. Cancer 1975; 36 : 842–854.
21. Greipp PR, San Miguel J, Durie BGM, et al. International Staging System for multiple myeloma. J Clin Oncol 2005; 23 : 3412–3420.
22. Ščudla V, Budíková M, Pika T, et al. Srovnání sérových hladin vybraných biologických působků u monoklonální gamapatie nejistého významu a mnohočetného myelomu. Čas Lék čes 2009; 148 : 315–322.
23. Ščudla V, Budíková M, Petrová P, et al. Analýza sérových hladin vybraných biologických ukazatelů u monoklonální gamapatie nejistého významu a mnohočetného myelomu. Klin Onkol 2010; 23 : 171–181.
24. Scudla V, Petrova P, Minarik J, et al. Analysis of the serum levels of selected biological parameters in monoclonal gammopathy of undetermined significance and different stages of multiple myeloma. Neoplasma 2011; 58 : 499–506.
25. International Myeloma Working Group. Criteria for the classification of monoclonal gammopathies, multiple myeloma and related disorders: a report of the International Myeloma Working Group. Brit J Haematol 2003; 121 : 749–757.
26. Bradwell AR. Serum free light chain analysis (plus Hevylite). 6th. ed. Birmingham: The Binding Site Ltd. 2010; 350.
27. Kaiser M, Mieth M, Liebisch P, et al. Serum concentrations of DKK-1 correlate with the extent of bone disease in patiens with multiple myeloma. Eur J Haematol 2008; 80 : 490–494.
28. Zhou F, Meng S, Song H, et al. Dickkopf-1 is a key regulator of myeloma bone disease: opportunities and challenges for therapeutic intervention. Blood Rev 2013; 27 : 261–267.
29. Fowler JA, Mundy GM, Lwin ST, et al. Bone marrow stromal cells create a permissive microenvironment for myeloma development: a new stromal role for Wnt inhibitor. Cancer Res 2012; 72 : 2183–2189.
30. Ling L, Nurcombe V, Cool SM. Wnt signaling controls the face of mesenchymal stem cells. Gene 2009; 433 : 1–7.
31. Silvestris F, Lombardi L, De Matteo M, et al. Myeloma bone disease: pathogenetic mechanisms and clinical assessment. Leuk Res 2007; 31 : 129–138.
32. Pinzone IJ, Hall BM, Thudi NK, et al. The role of Dickkopf-1 in bone development, homeostasis, and disease. Blood 2009; 113 : 517–525.
33. Ng AC, Khosla S, Charatcharoenwitthaya N, et al. Bone microstructural changes revealed by high-resolution peripheral quantitative computed tomography and elevated DKK-1 and MIP-1alpha levels in patiens with MGUS. Blood 2011; 118 : 6529–6534.
34. Todoerti K, Lisignoli G, Storti P, et al. Distinct transcriptional profiles characterize bone microenvironment mesenchymal cells another than osteoblasts relationship with multiple myeloma bone disease. Exp Hematol 2010; 38 : 141–153.
35. Politou MC, Heath DJ, Rahemtulla A, et al. Serum concentrations of Dickkopf-1 protein are increased in patiens with multiple myeloma and reduced after autologous stem cell transplantation. Int J Cancer 2006; 119 : 1728–1731.
36. Colla S, Zhan F, Xiong W, et al. The oxidative stress response regulates DKK-1 expression through the JNK signaling cascade in multiple myeloma plasma cells. Blood 2007; 109 : 4470–4477.
37. Wu P, Walker BA, Brewer D, et al. A gene expression-based predictor for myeloma patiens at high risk of developing bone disease on bisphonate treatment. Clin Cancer Res 2011; 17 : 6347–6355.
38. Kristinsson SY,Tang M, Pfeiffer RM, et al. Monoclonal gammopathy of undetermined significance and risk of skeletal fractures: a population-based study. Blood 2010; 116 : 2651–2655.
39. Quian J, Zheng Y, Zheng C, et al. Active vaccination with Dickkopf-1 induces protective and therapeutic antitumor imunity in murine multiple myeloma. Blood 2012; 119 : 161–169.
40. Pozzi S, Fulciniti M, Yan H, et al. In vivo and in vitro effects of a novel anti DKK-1 neutralizing antibody in multiple myeloma. Bone 2013; 53 : 487–496.
41. Zangari M, Terpos E, Zhan F, et al. Impact of bortezomib on bone health in myeloma: a review of current evidence. Cancer Trat Rev 2012; 38 : 968–980.
42. Terpos E, Heath DJ, Rahemptulla A, et al. Bortezomib reduces serum dickkopf-1 and receptor activator of nuclear factor kappaB ligand concentrations and normalises indices of bone remodelling in patiens with relapsed multiple myeloma. Brit J Haematol 2006; 135 : 688–692.
43. Yaccoby S, Ling W, Zhan F, et al. Antibody-based inhibition of DKK-1 supresses tumor-induced bone resorption and multiple myeloma growth in vivo. Blood 2007; 109 : 2106-2111.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Příběh apendixu
- Dna a její výskyt, popisy a léčení ve starověku
- Malá historie infekčních nemocí od padesátých let minulého století a význam očkování
- Nové možnosti terapeutické revaskularizace u ischemické choroby dolních končetin v rámci syndromu diabetické nohy autologní transplantací kmenových buněk
- IgA nefropatie – jistoty, pochybnosti a výhledy kauzální léčby
- Výplach žaludku při perorální intoxikaci – sporné pohledy na problematiku
- Vliv ultrajemných prachových částic na zdraví – projekt UFIREG
- Analýza sérových hladin Dickkopf-1 (DKK-1) u monoklonální gamapatie nejistého významu a mnohočetného myelomu
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Výplach žaludku při perorální intoxikaci – sporné pohledy na problematiku
- Příběh apendixu
- Malá historie infekčních nemocí od padesátých let minulého století a význam očkování
- IgA nefropatie – jistoty, pochybnosti a výhledy kauzální léčby
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

