-
Medical journals
- Career
Léčba diabetu transplantací izolovaných Langerhansových ostrůvků
Authors: František Saudek; Peter Girman; Jan Kříž; Zuzana Berková; Klára Zacharovová; Tomáš Koblas; Lenka Pektorová; Ema Vávrová; Martina Mindlová; David Habart; Jan Peregrin; Květoslav Lipár; Martin Oliverius; Eva Dovolilová; Evžena Číhalová; Vít Bobek
Authors‘ workplace: Institut klinické a experimentální medicíny Praha, Klinika diabetologie, Centrum diabetologie
Published in: Čas. Lék. čes. 2011; 150: 49-55
Category: Original Article
Overview
Východisko:
Orgánová transplantace pankreatu představuje zatím jedinou metodou umožňující dlouhodobou normalizaci glukózového metabolismu u diabetiků 1. typu. Je však často provázena chirurgickými komplikacemi. Jako bezpečnější alternativa byla v IKEM v roce 2005 v rámci klinického experimentu zavedena metoda transplantace izolovaných Langerhansových ostrůvků.Metody a výsledky:
Ostrůvky jsme izolovali z pankreatů dárců s mozkovou smrtí, které nesplňovaly kritéria pro provedení orgánové transplantace. Do srpna 2010 bylo provedeno celkem 36 implantací ostrůvků u 28 C-peptid negativních pacientů s diabetem 1. typu. U 15 osob (21 implantací) byl hlavní indikací mimořádně labilní průběh diabetu, provázený syndromem porušeného vnímání hypoglykémie při intenzifikované inzulinové terapii. V osmi případech byla provedena kombinovaná transplantace, a to 5× současně s ledvinou a 3× současně s játry. U pěti pacientů podstupujících pankreatektomii jsme provedli autologní transplantaci ostrůvků. S výjimkou jedné primární afunkce vedla transplantace ostrůvků ke kompletní úpravě syndromu porušeného vnímání hypoglykémie. Jedenáct pacientů z 15 v této skupině mělo po jednom roce signifikantní produkci C-peptidu (> 0,2 pmol/ml). Žádný pacient v průběhu jednoročního sledování nezemřel. Průměrná dávka inzulinu po allotransplantaci klesla z 37 na 14 j. inzulinu denně a celkem tři osoby mohly přerušit podávání inzulinu. U šesti osob se vyskytly závažné technické komplikace, jež pouze 2× vyžadovaly chirurgickou revizi a neměly dlouhodobé následky.Závěry:
Transplantace Langerhansových ostrůvků představuje oproti orgánové transplantaci pankreatu podstatně bezpečnější metodu obnovy endogenní sekrece inzulinu. U labilního diabetu eliminuje závažné hypoglykémie, ale k ukončení inzulinové léčby vede zatím zřídka. Díky pokrokům v laboratorní přípravě i v samotné transplantaci se však výsledky postupně zlepšují.Klíčová slova:
diabetes mellitus 1. typu, transplantace, Langerhansovy ostrůvky, slinivka břišní, inzulin, imunosuprese, komplikace diabetu.ÚVOD
Zavedení inzulinové léčby v roce 1922 znamenalo zásadní přelom pro osud pacientů, kteří onemocněli diabetes mellitus 1. typu (1). Ani dnes se však nepodařilo pomocí intenzifikované inzulinové léčby zabránit vzniku pozdních komplikací diabetu, jejichž příčinou je dlouhodobá hyperglykémie. Hlavní limit pro dosažení normálních hodnot krevního cukru při inzulinové léčbě představuje riziko hypoglykémií (2). Dosáhnout trvale normálních hodnot glykémie se podařilo teprve pomocí orgánové transplantace pankreatu, jež se postupně stala v kombinaci se současnou transplantací ledviny metodou volby pro léčbu pacientů s diabetem 1. typu a chronickou nedostatečností ledvin.
V České republice se transplantace pankreatu provádějí od roku 1983 (3) a do současné doby bylo tímto způsobem léčeno více než 380 osob. Kromě pacientů, kteří současně podstupují transplantaci ledviny, nebo kteří ji podstoupili již dříve, může být transplantace pankreatu indikována také u nemocných s mimořádně nestabilním průběhem, kteří trpí tzv. syndromem porušeného vnímání hypoglykémie, případně u kterých překotně progredují mikroangiopatické komplikace navzdory dostupným konzervativním opatřením (4).
Kromě nutnosti trvale užívat imunosupresivní léčbu spočívá hlavní nevýhoda orgánové transplantace pankreatu v její technické obtížnosti a nezanedbatelném riziku chirurgických komplikací (5, 6). Proto se postupně vyvíjela metoda transplantace izolovaných Langerhansových ostrůvků, při které se ostrůvky nejprve oddělí od exokrinní tkáně a pak jsou teprve implantovány cestou vrátnicové žíly do jater (7, 8). Zatímco samotná implantace je oproti orgánové transplantaci pro pacienta poměrně jednoduchá, hlavní technický problém představuje získání dostatečného množství vitálních ostrůvků, které jsou schopné se v jaterním řečišti přihojit a obnovit v nepřirozeném prostředí chybějící sekreci inzulinu.
První série klinicky úspěšných výkonů byla hlášena teprve v roce 2000 v kanadském Edmontonu (9), kdy u sedmi po sobě následujících pacientů, kteří podstoupili 2–3 transplantace ostrůvků, bylo možné přerušit inzulinovou léčbu. Úspěch, který spočíval ve volbě optimálních orgánů pro transplantaci, vylepšené izolační technice a použití imunosupresivní léčby bez kortikosteroidů, se v prospektivní mezinárodní studii podařilo reprodukovat jen obtížně (10) a jen u části zařazených pacientů bylo možné inzulinovou léčbu přerušit. Podle obdobného protokolu bylo od roku 2000 provedeno v různých centrech asi 1000 ostrůvkových transplantací s různým úspěchem. Ukázalo se, že i když se ve většině případů nepodařilo dosáhnout robustní normalizace glykémií, u většiny pacientů s obnovenou endogenní produkcí inzulinu se výrazně zlepšila řada krátkodobých i dlouhodobých ukazatelů. Hlavním přínosem byla praktická eliminace těžkých hypoglykemických epizod a zlepšení kompenzace diabetu. Další sledování však také ukázalo celkové zlepšení kvality života, úpravu kardiovaskulárních rizikových faktorů a oproti srovnatelné skupině pacientů léčených konzervativně stabilizaci nebo dokonce i zlepšení diabetické retinopatie (11).
V Institutu klinické a experimentální medicíny byla po systematické experimentální přípravě metoda transplantace izolovaných Langerhansových ostrůvků zavedena do klinické praxe v roce 2005, a to jako alternativa pro klinicky již osvědčenou orgánovou transplantaci pankreatu. Léčba byla na prvním místě nabídnuta pacientům s dlouhodobě nestabilním diabetem 1. typu, jenž byl provázen těžkými hypoglykemickými stavy s poruchou vědomí a nezbytnosti zásahu další osoby. Další kategorii příjemců pak představovali nemocní s diabetem 1. typu, kteří současně podstupovali transplantaci jater nebo ledviny a u nichž tedy byla v každém případě zahajována imunosupresivní léčba. Zvládnutí techniky izolace ostrůvků pak dovolilo provést autotransplantaci ostrůvků u pacientů, kteří podstupovali totální či reziduální pankreatektomii pro nemaligní onemocnění pankreatu.
Použité metody
Program izolace a transplantace lidských Langerhansových ostrůvků od kadaverózních dárců s mozkovou smrtí byl zahájen v roce 2005 po předchozím souhlasu Etické komise Institutu klinické a experimentální medicíny a Fakultní Thomayerovy nemocnice. Hlavními kritérii pro odběr slinivky břišní za účelem izolace ostrůvků byla nepřítomnost diabetu v anamnéze, věk od 18 do 65 let a makroskopicky neporušená struktura orgánu. Orgány dárců s věkem do 45 let a body mass indexem pod 30 kg/m2 byly přednostně alokovány pro orgánovou transplantaci pankreatu. Ke konzervaci byl ve většině případů použit roztok HTK. Cílem bylo dodržet maximální dobu studené ischémie (od perfuze konzervačním roztokem do zahájení izolace) pod 10 hodin.
Odebraná slinivka byla spolu se slezinou a přilehlým segmentem duodena uložena v roztoku HTK při teplotě tajícího ledu a transportována izolačnímu týmu, který tvořily 3 až 4 osoby. Izolace probíhala za sterilních podmínek v místnosti opatřené filtrací vzduchu a vybavené laminárními boxy splňujícími stupeň čistoty A. Po několikastupňové dekontaminaci roztokem obsahujícím antibiotika, antimykotika a iodisol byl nejprve podvázán pankreatický vývod a byly odpreparovány duodenum a slezina. Po odstranění většiny tuku při zachování integrity pankreatické kapsuly jsme přes incizi v oblasti hlavy a těla pankreatu kanylovali oboustranně pankreatický vývod a injikovali enzym kolagenázu (Liberase Roche nebo Collagenase Serva) v 250 ml roztoku pomocí peristaltických pump při udržování tlaku 80 mm Hg a teplotě roztoku 4 °C. Při použití přípravku Collagenase jsme současně použili neutrální proteázu (Serva Electrophoresis GmbH, Heidelberg, Germany) v množství 100 ml. Po dokonalé distenzi žlázy jsme na chlazené podložce odpreparovali cévní struktury, kapsulu a zbývající tuk. Poté byla slinivka rozdělena do 10–14 částí a umístěna v izolační komoře, napojené na recirkulační systém s řízenou teplotou. Izolační komora byla vybavena sítem o velikosti otvorů 0,4 mm a skleněnými kuličkami pro lepší míchání. V systému cirkuloval roztok Hank’s balanced salt solution, do kterého jsme přidali zbývající roztok kolagenázy, který se uvolnil v průběhu distenze. Systém byl za kontinuálního řízeného kmitání postupně ohříván na 37 °C. Schéma izolačního zařízení, které bylo vyrobeno v několika prototypech, ukazuje obrázek 1.
Image 1. Schéma izolačního zařízení 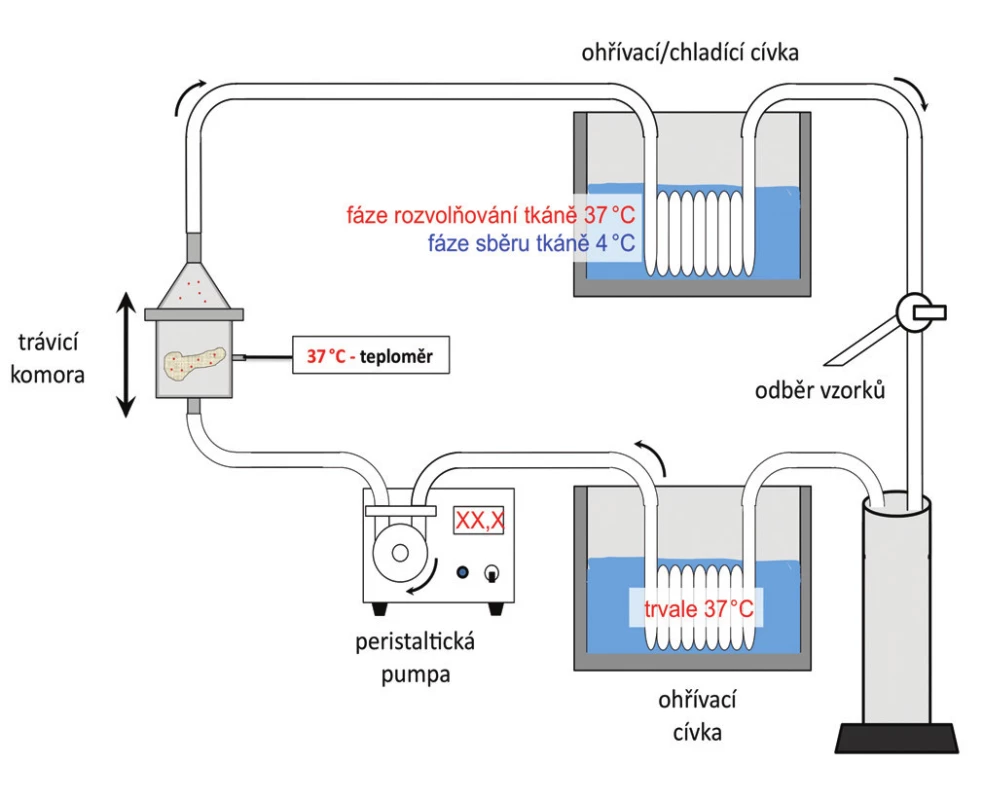
Účinkem kolagenázy se postupně uvolňují fragmenty tkáně pankreatu, které procházejí sítkem v izolační komoře. Jakmile se objeví ve vzorcích roztoku izolované ostrůvky v dostatečném množství, je ukončena recirkulace, zahájeno chlazení a ředěný roztok s tkání pankreatu je sbírán a centrifugován. Po ukončené digesci zůstávají v izolační komoře pouze zbytky vaziva a cév, zatímco v nasbíraném roztoku by ostrůvky neměly být účinkem kolagenázy destruovány.
Průběh digesce byl kontrolován pomocí stereomikroskopu. Vzorky tkáně uvolňující se z pankreatu byly označeny inzulin specifickým barvivem (dithizon), které umožňuje jednoznačně odlišit ostrůvky od exokrinní tkáně. V okamžiku, kdy byla většina ostrůvků uvolněna, jsme zahájili sběr rozvolněné tkáně a současně jsme inaktivovali kolagenázu postupným chlazením a ředěním pomocí vymývacího roztoku. Tkáň jsme sbírali do vychlazeného roztoku lidského albuminu.
Po několikanásobném promytí činil objem nepurifikované tkáně 30–60 ml. Následně byla peleta tkáně postupně infundována do buněčného separátoru COBE 2991, ve kterém byl připraven kontinuální denzitní gradient pomocí roztoku fikolu (Biocoll, Biochrom, Německo) s rozpětím specifické hmotnosti od 1066 do 1090 g/l. V případě úspěšné izolace sedimentovala v průběhu centrifugace převážná část exokrinní tkáně do periferie rotujícího vaku, zatím většinu ostrůvků jsme identifikovali v oddělené vrstvě, kterou jsme separátně odebrali. Ostrůvky byly dále promyty a kvantifikovány (12). V případě autotransplantace nebyla purifikace ostrůvků pomocí buněčného separátoru prováděna. Sterilita byla testována mikrobiologickým vyšetřením odebraného orgánu, tkáně získané na konci izolace a finálního přípravku před transplantací. Vitalita tkáně byla testována intravitálním barvení akridinovou oranží a propidium jodidem. Vzorky ostrůvků byly odebírány pro ex post testování sekrece inzulinu in vitro při různých koncentracích glukózy.
Před transplantací byly ostrůvky po dobu 4–48 hodin uchovávány v suplementovaném CMRL médiu (13). V některých případech byly ostrůvky značené v kultuře pomocí nanočástic železa za účelem následného zobrazení po transplantaci pomocí magnetické rezonance (14). K transplantačním účelům byly ostrůvky použity v případě, jestliže jejich celkový počet, přepočítaný na tzv. ostrůvkové ekvivalenty (ostrůvky o průměru 0,15 mm) činil v případě allotransplantace alespoň 250 000. Při autotransplantaci jsme byli připraveni transplantovat intaktní ostrůvky bez ohledu na jejich celkový počet. Výsledky mikrobiologických vyšetření byly zpravidla k dispozici teprve ex post po provedené transplantaci. Byly nicméně ve všech případech negativní a opravňovaly tedy pokračovat v zavedeném postupu.
Transplantační výkon byl ve všech případech samostatné transplantace ostrůvků proveden metodou gravitační infuze do vena portae. Kanylace vena portae proběhla transkutánně pod radiologickou kontrolou v místním znecitlivění. V průběhu implantace byl přímou metodou měřen portální tlak. Typicky byly ostrůvky podány ve dvou vacích s 250 ml roztoku, z nichž každý obsahoval 35 j. heparinu na 1 kg hmotnosti příjemce. Při vytahování implantační kanyly byl kanylační trakt plněn hemostatickou zátkou (15). Schéma implantace ostrůvků ukazuje obrázek 2.
Image 2. Schéma transplantace izolovaných Langerhansových ostrůvků 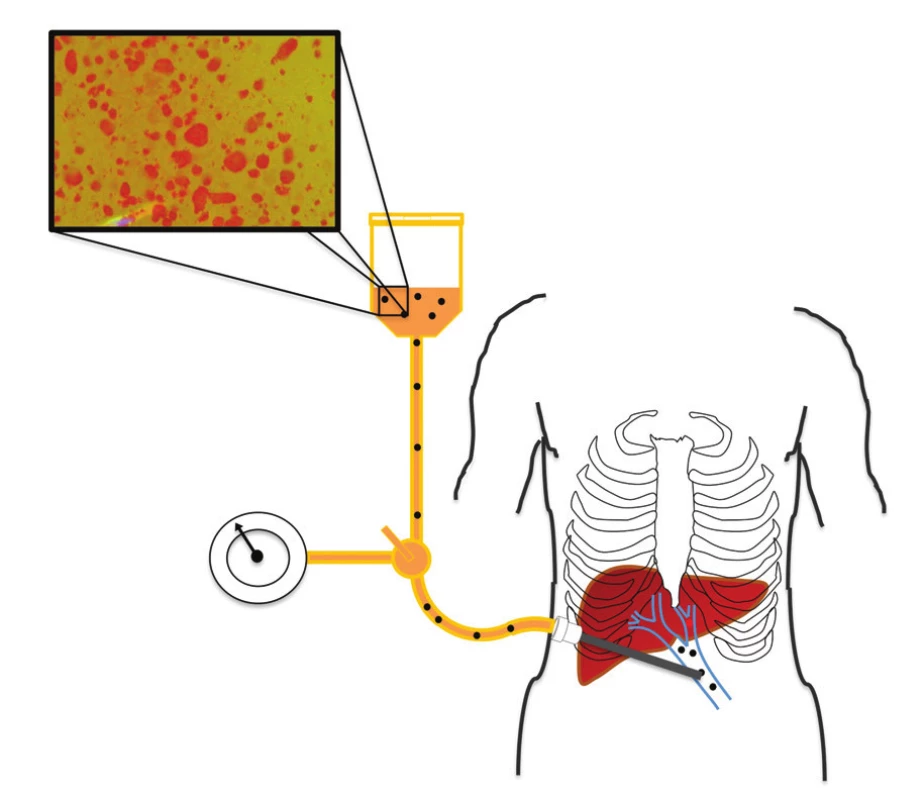
Při současné transplantaci izolovaných ostrůvků spolu s játry (tři případy) či spolu s ledvinou od stejného dárce byla implantace ostrůvků provedena přímou kanylací mesenterické žíly po ukončení transplantace orgánu (jater či ledviny) a místo punkce bylo po vytažení kanyly ošetřeno stehem.
Imunosupresivní léčba po allotransplantaci samotných ostrůvků či ostrůvků a ledviny odpovídala původnímu Edmontonskému protokolu a spočívala v indukčním podání daclizumabu či anti-T-lymfocytárního globulinu (ATG Fresenius) před transplantací spolu s jednou dávkou methylprednisolonu (500 mg). Indukční léčba byla podána co nejdříve od okamžiku, kdy byla indikace v konkrétním případě potvrzena podle aktuálního vyšetření příjemce, ověření množství a kvality izolovaných ostrůvků a negativity vyšetření cross-match. Důvodem bylo předejít maximálnímu diabetogennímu působení methylprednisolonu a případné cytokinové reakci po podání ATG v době aplikace ostrůvků. Dávku daclizumabu či ATG jsme ještě 1× opakovali. Udržovací léčba spočívala v podávání rapamycinu (cílové koncentrace 5–10, po 3 měsících 3–6 ng/ml) a tacrolimu (cílové koncentrace 2–8 ng/ml, od 3 měsíců 2–5 ng/ml). Steroidy nebyly podávány.
Výsledky
Od roku 2005 bylo na našem pracovišti provedeno celkem 36 implantací u 28 pacientů. Z hlediska indikace a techniky transplantace se jedná o heterogenní skupinu příjemců, kterou je vhodné hodnotit v jednotlivých kategoriích (tab. 1).
Table 1. Kategorie příjemců a přehled výsledků léčby 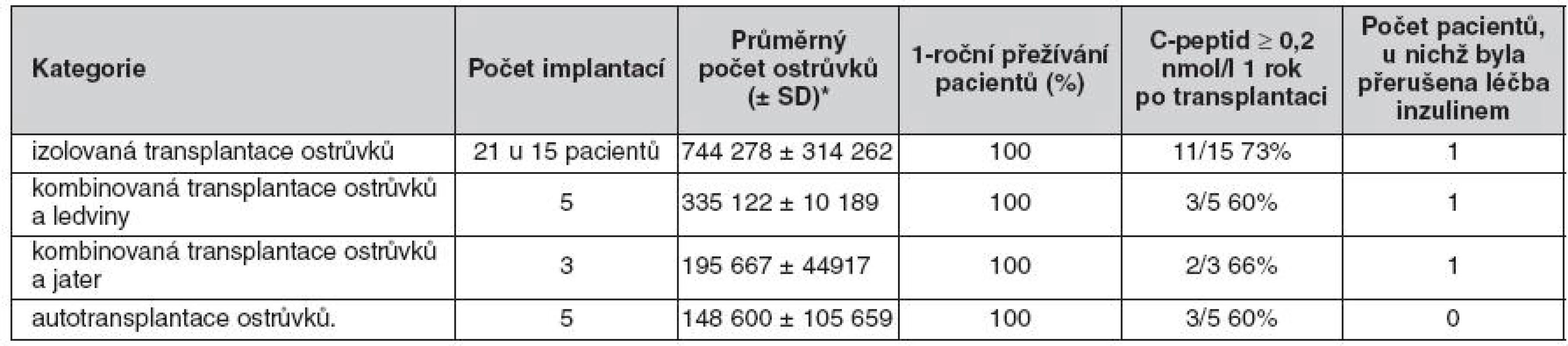
* Počet tzv. ostrůvkových ekvivalentů, jež odpovídají objemu ostrůvků o průměru 0,15 mm. Průměrný počet ostrůvků (± SD)
První kategorii představují příjemci izolovaných alogenních ostrůvků. Hlavním indikačním kritériem byl dlouhodobě nestabilní diabetes mellitus 1. typu provázený syndromem porušeného vnímání hypoglykémie (16) s alespoň čtyřmi těžkými hypoglykemickými epizodami v posledním roce (vyžadující pomoc zdravotníka nebo jiné osoby), a to navzdory prokazatelně kvalifikované edukaci pacienta a použití dostupných technických prostředků, jako jsou inzulinové pumpy a frekventní monitorace glykémií. Předtransplantační vyšetření vyloučilo závažné rizikové faktory transplantace, zejména kardiovaskulární postižení, aktivní syndrom diabetické nohy a infekční onemocnění. Všichni pacienti byli podrobně seznámeni s průběhem a možným rizikem léčby a vyjádřili písemně svůj souhlas s jejím provedením. Základní charakteristiky souboru jsou uvedeny v tabulce 2.
Table 2. Základní charakteristiky příjemců samotných Langerhansových ostrůvků (průměr ± SD) 
U čtyř pacientů byly ostrůvky transplantovány celkem 3×, u šesti pacientů 2× a u ostatních pouze 1×. U jednoho příjemce nedošlo vůbec k obnově sekrece inzulinu a imunosupresivní léčba byla záhy ukončena. V jedenácti případech trvala významná produkce C-peptidu minimálně jeden rok. Průměrné koncentrace C-peptidu, průměrné denní dávky inzulinu a průměrné hodnoty glykovaného hemoglobinu ukazují obrázky 3, 4 a 5.
Image 3. Průměrné hladiny C-peptidu (± SD) na lačno u příjemců v kategorii 1 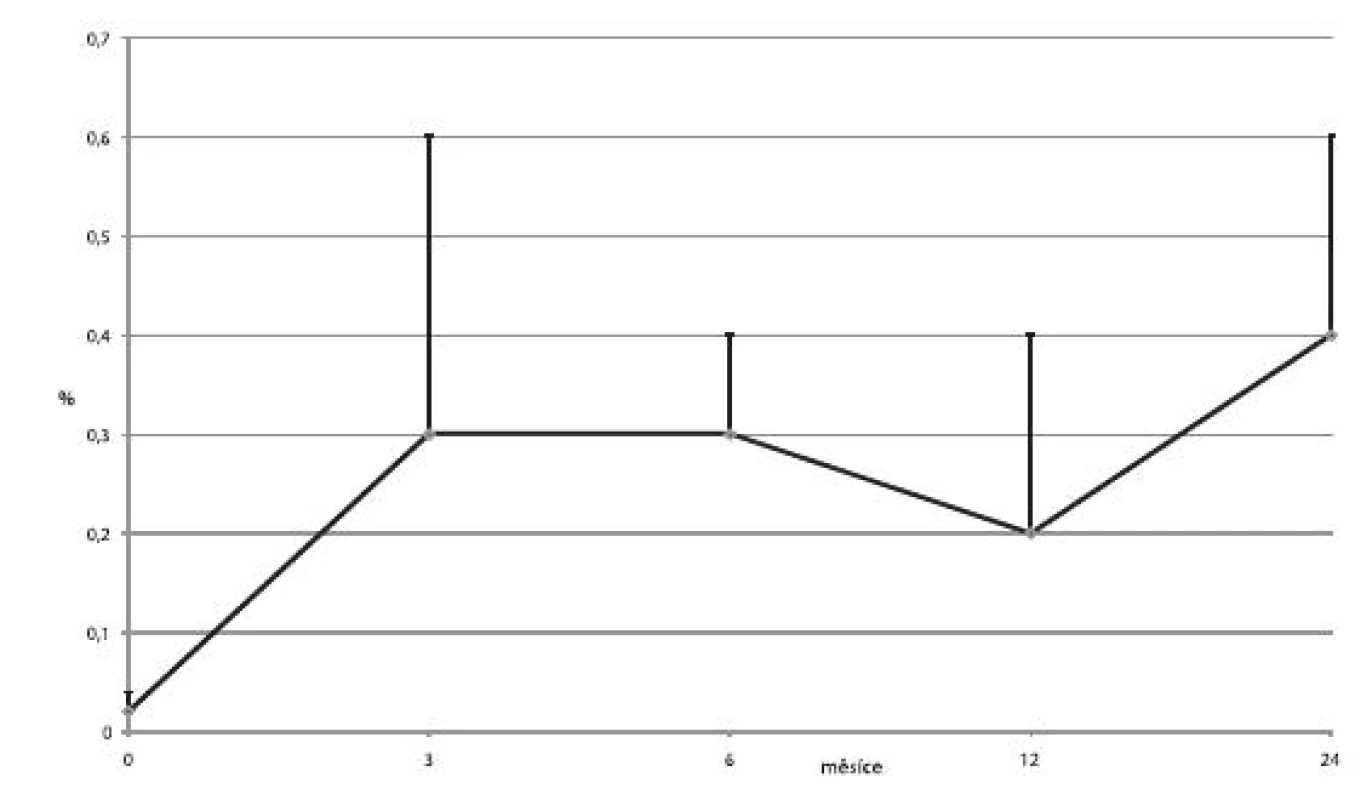
Image 4. Průměrné denní dávky inzulinu (± SD) na lačno u příjemců v kategorii 1 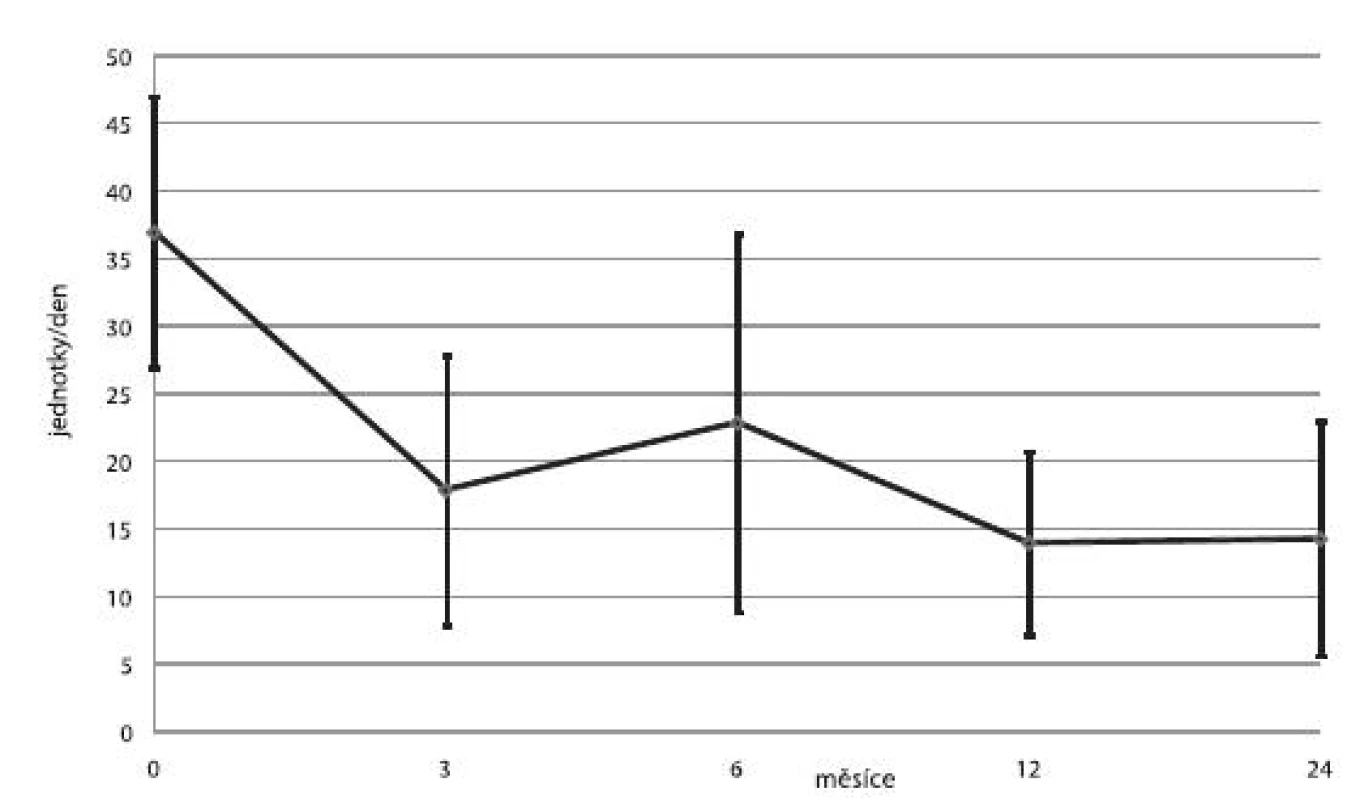
Image 5. Průměrné hodnoty (± SD) glykovaného hemoglobinu (HbA1c) v kategorii 1 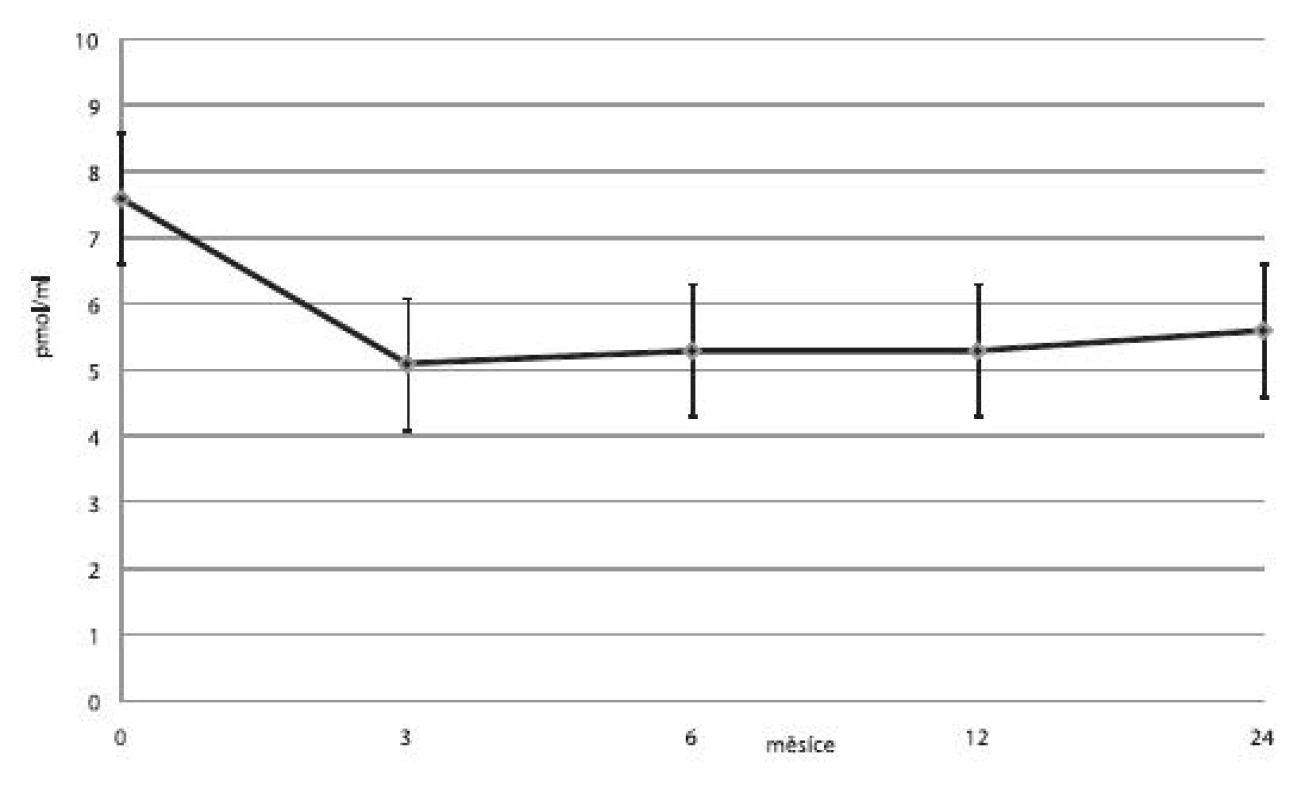
Hospitalizace k provedení transplantace trvala zpravidla 7 dní. Po provedení výkonu v místním znecitlivění mohli pacienti přijímat potravu a zůstávali 12 hodin na lůžku. Po dobu 1 týdne byl podáván nízkomolekulární heparin. Inzulin byl podáván tak, aby pokud možno byly udrženy hodnoty glykémie v normálním rozmezí. Samotná implantace probíhala u většiny pacientů bez komplikací, pouze s přechodným vzestupem aktivity jaterních transamináz (troj - až čtyřnásobek normální hodnoty se spontánní úpravou). U čtyř příjemců se implantace komplikovala krvácením do jater nebo okolí. Později jsme se riziko krvácení snažili omezit použitím hemostatické zátky pří odstraňování portálního katétru. Ve dvou případech si situace vyžádala chirurgický zákrok. U jedné pacientky došlo po aplikace ostrůvků k symptomatické bradykardii, která byla pravděpodobně způsobena podrážděním peritonea při punkci portální žíly. V jednom případě byla transplantace komplikována punkcí žlučových cest a následním cholestatickým ikterem, který však spontánně ustoupil bez následků. Přehled závažných nežádoucích účinku ukazuje tabulka 3.
Table 3. Výskyt závažných nežádoucích účinků po transplantaci samotných ostrůvků 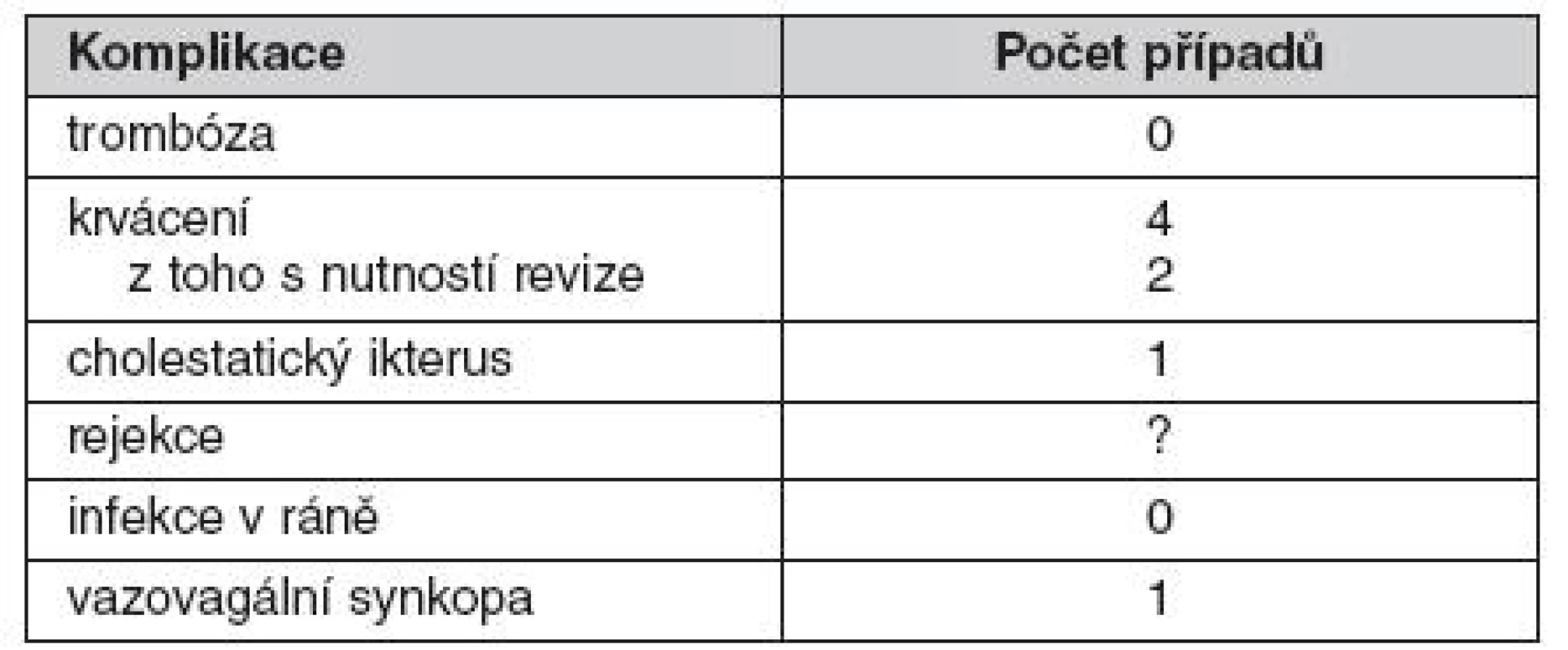
U čtyř příjemců selhala funkce transplantovaných ostrůvků do 12 měsíců od implantace a potřeba inzulinu se vrátila k původním dávkám. Koncentrace C-peptidu v krvi byla detekovatelná a imunosupresivní léčba byla ukončena. Jedna pacientka byla na více než 3 roky zcela zbavena aplikace exogenního inzulinu. Její případ popisujeme podrobněji.
Kazuistika 1
Jednatřicetiletá žena s trváním diabetu od 3 let věku podstoupila transplantaci ostrůvků kvůli rychle progredujícím, zejména očním mikroangiopatickým komplikacím a syndromu porušeného vnímání hypoglykémie. Závažnější hypoglykémie se v poslední době vyskytovaly téměř každý týden. Proliferativní retinopatie byla na obou očích ošetřena laserovou fotokoagulací a vitrektomie zakaleného sklivce se zatím odkládala pro nestabilitu diabetu. Pacientku dále obtěžovala těžká forma senzomotorické a autonomní diabetické polyneuropatie. Denní dávka inzulinu se při léčbě inzulinovou pumpou pohybovala okolo 30 j. denně, bazální i stimulovaná hladina C-peptidu byly pod detekčním limitem a hodnota glykovaného hemoglobinu byla 6,4 %. Hmotnost pacientky byla 50 kg.
První implantace ostrůvků (celkový počet 367 930) proběhla nekomplikovaně v září 2006. Třetí den po transplantaci se funkce ostrůvků projevila snížením potřeby inzulinu a stabilizací glykemického profilu. Po týdnu byla pacientka opět zařazena do čekací listiny a další transplantace proběhla za 3 měsíce, kdy průměrná denní dávka inzulinu činila 19 j. Tentokrát bylo podáno 627 000 ostrůvků (ekvivalentů), které se podařilo získat od dvou dárců. Dvě hodiny po implantaci si pacientka začala stěžovat na bolesti břicha v oblasti vpichu. Sonografické vyšetření svědčilo pro krvácení a hematom v podjaterní oblasti, které při následné revizi již nepokračovalo, ale bylo nutné odstranit rozsáhlý hematom a podat dvě krevní transfuze. Další průběh byl již bez komplikací a pacientka byla propuštěna 10 dní po transplantaci prakticky normoglykemická a jenom s minimální potřebou inzulinu, který byl postupně na dobu 3 let vysazen. Stabilní stav dovolil provést oboustrannou vitrektomii, takže visus nyní dovoluje čtení s pomocí televizní lupy. Pacientka pracovala na částečný úvazek a nyní je na mateřské dovolené s dítětem, které adoptovala. Zahájila studium na vysoké škole. Její diabetes je velmi dobře kompenzován při potřebě 12 j. inzulinu denně, hypoglykémie se prakticky nevyskytují a glykovaný hemoglobin se pohybuje okolo 4,5 %. Pacientka je léčena tacrolimem a rapamycinem, které dobře toleruje. Během sledování se nezhoršila renální funkce a neobjevila se mikroalbuminurie.
Druhou kategorii příjemců představuje pět pacientů s diabetem 1. typu a diabetickou nefropatií ve stadiu chronického selhání ledvin, u kterých byla provedena současná transplantace ostrůvků a ledviny od stejného dárce. Štěp ledviny byl standardní metodou napojen na pánevní cévy, zatímco ostrůvky byly ze stejného kožního řezu infundovány intraperitoneálním přístupem přes větev vena mesenterica inferior do portálního řečiště. Všech pět kombinovaných transplantací proběhlo bez chirurgické komplikace. U tří pacientů po jednom roce trvala pozitivita C-peptidu (> 0,2 nmol/l) po jednom roce a jeden z nich zcela ukončil inzulinovou léčbu. U jedné pacientky se funkce štěpu ledviny ani ostrůvků nerozvinuly pro intenzivní humorální rejekci a u dalšího příjemce funkce ostrůvků zanikla v průběhu léčby akutní rejekce štěpu ledviny. Podrobněji popisujeme případ pacienta, který 10 měsíců po transplantaci zůstává bez potřeby inzulinu.
Kazuistika 2
U 61letého pacienta s pokročilými komplikacemi diabetu, po prodělaném infarktu myokardu, jenž byl léčen pravidelnou hemodialýzou, považoval kardiolog léčbu kombinovanou transplantací ledviny a pankreatu za příliš riskantní. Proto byl pacient v dubnu 2009 zařazen do čekací listiny pro transplantaci ledviny a ostrůvků. Výsledky inzulinové léčby byly dlouhodobě neuspokojivé (glykovaný hemoglobin 10,1 %), průměrná denní potřeba inzulinu byla 63 j. a hladina C-peptidu byl pod detekčním limitem. V prosinci 2009 tento pacient podstoupil bez větších komplikací kombinovanou transplantaci ledviny a ostrůvků (325 000 ekvivalentů). Bezprostředně po transplantaci se rozvinula funkce štěpu ledviny, byla ukončena léčba hemodialýzou a postupně se snižovala dávka inzulinu. V říjnu 2010 je pacient již 8 měsíců zcela bez potřeby exogenního inzulinu a výbornou kompenzaci diabetu potvrzuje nejen téměř normální hodnota glykovaného hemoglobinu (4,2 %), ale také záznam kontinuálního senzoru koncentrací krevního cukru v podkoží (obr. 6).
Image 6. Kontinuální záznam koncentrací glukózy v podkoží po dobu 4 dnů u pacienta 10 měsíců po kombinované transplantaci ledviny a Langerhansových ostrůvků (Počítačový záznam hodnot měřených pomocí sensoru Medtronic; pacient je bez terapie inzulinem.) 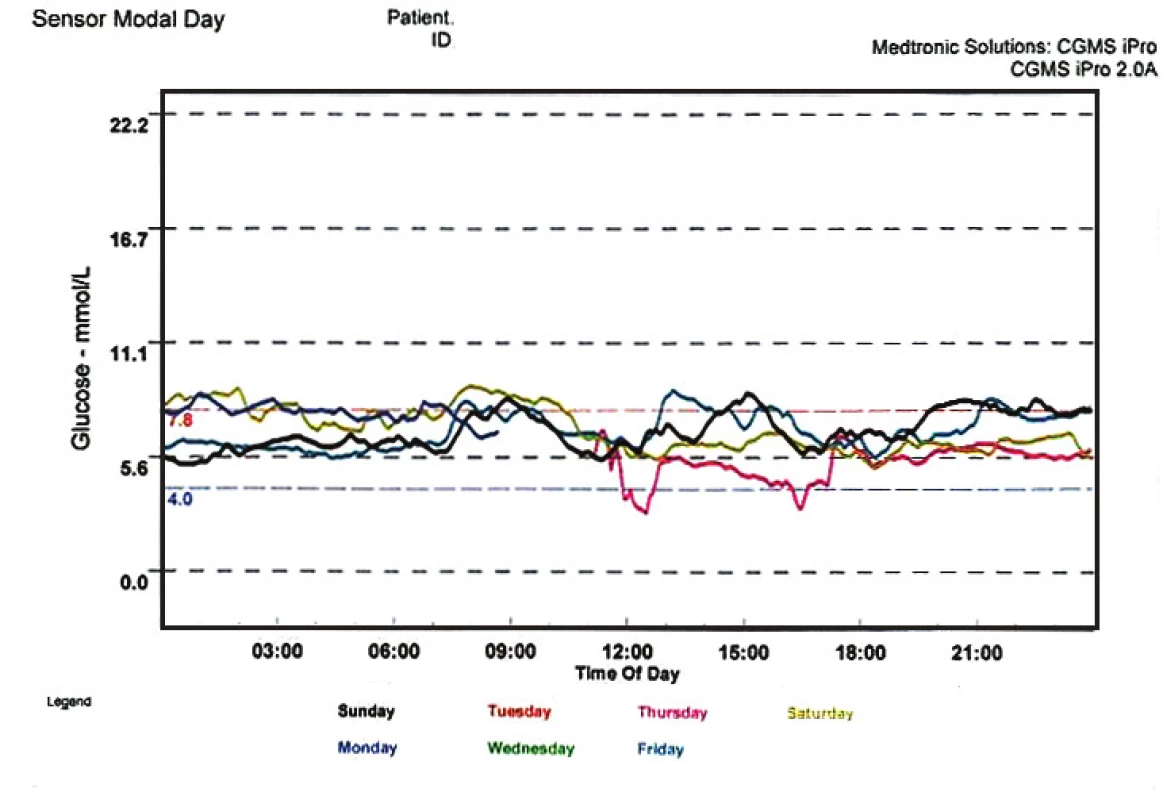
Ve třetí kategorii podstoupili tři pacienti kombinovanou transplantaci jater a ostrůvků od stejného dárce. Ostrůvky byly po ukončené transplantaci jater infundovány přímo do portální žíly. Základní indikací k tomuto výkonu u dvou pacientů s diabetem 1. typu bylo jaterní selhání ve stadiu Child Pugh C v důsledku primární sklerozující cholangitidy. U obou pacientů zůstává po 3 letech detekovatelná produkce C-peptidu, nicméně oba potřebují standardní intenzifikovanou inzulinovou léčbu.
Kazuistika 3
Třetí pacientka je specifická z pohledu diagnózy, operačního postupu i výsledku transplantace. Jde o padesátiletou ženu, u které byl diagnostikován insulinom pankreatu metastazující do jater. Tato pacientka podstoupila v jedné době odstranění jater, pankreatu (s následnou negativitou C-peptidu), sleziny a duodena a poté byla provedena transplantace jater a ostrůvků. Po 5 měsících je pacientka bez potřeby exogenního inzulinu, bez hypoglykémií a bez průkazu diseminace primárního nádoru. Hodnota glykovaného hemoglobinu činí 4,1 %.
Poslední, čtvrtou kategorii, zastupuje pět pacientů, u kterých vznikl diabetes sekundárně po totální pankreatektomii. V jednom případě se jednalo o bolestivou formu chronické hereditární pankreatitidy, u ostatních byla provedena reziduální pankreatektomie pro pankreatickou píštěl po předchozí resekci hlavy pankreatu a duodena pro expanzivní procesy. Ve všech případech byla k izolaci dodána jen část kaudy pankreatu, která navíc byla postižena chronickým zánětem a fibrózou. Počet izolovaných ostrůvků u tří pacientů proto činil pouze 60 000–170 000 ostrůvkových ekvivalentů a jen v jednom případě byl 310 000. Na rozdíl od všech ostatních kategorií nebyly v těchto případech ostrůvky purifikované a tkáň o objemu 10–25 ml byla pooperačně přímo infundována do vena portae. Implantace ostrůvků proběhla bez komplikací a bez nápadnějšího vzestupu portálního tlaku během implantace. Za 6 měsíců po výkonu byla kompenzace diabetu u všech operovaných sice uspokojivá (glykovaný hemoglobin v průměru 5,2 ± 0,5 %), ale všichni potřebovali 18 až 40 j. inzulinu denně.
Diskuze
První klinické transplantace ostrůvků byly provedeny v sedmdesátých letech 20. století, nicméně až do roku 2000 byla úspěšnost velmi nízká. Zavedení semiautomatické kontrolované digesce po intraduktální injekci kolagenázy do pankreatického vývodu metodou podle Ricordiho (7), zdokonalení purifikace pomocí buněčného separátoru Cobe a konečně vypracování specifické metody implantace a imunosuprese na přelomu století přinesly první technicky úspěšné série pacientů a s nimi také velký optimismus. Transplantace ostrůvků však ještě i dnes zůstává spíše ojedinělou metodou, která může být prováděna pouze na pracovištích s velkou transplantační zkušeností a personálním i přístrojovým vybavením. Podmínkou jsou úzká spolupráce chirurgů provádějících multiorgánový odběr a konzervaci, diabetologů zaměřených na transplantační péči, vyškoleného týmu lékařů a biologů zvládajících techniku izolace a purifikace ostrůvků a konečně radiologů zvládajících bezpečnou kanylaci portální žíly.
Ani samotná izolace stále není standardní metodou a na základě mezinárodní spolupráce se postupně zlepšuje. Pracuje se převážně s místně vyrobenými prototypy přístrojů a pomůcek, jako jsou například třepací zařízení, izolační komory a termoregulační aparát. Rovněž složení izolačních roztoků se na různých pracovištích liší. Předvídatelnost výsledku izolace ostrůvků komplikují zatím stále veliké rozdíly v aktivitě různých šarží kolagenázy a nestejná kvalita odebraných orgánů, jež je závislá na věku a tělesném habitu dárce.
Dlouhodobým cílem transplantace ostrůvků je navození stabilní normoglykémie, která povede nejen k bezprostřednímu zlepšení kvality života, ale dokáže navíc předejít vzniku nebo další progresi mikroangiopatických komplikací diabetu. Za podmínku úspěchu se nyní považuje získání dostatečného množství kvalitních ostrůvků v celkovém množství asi 10 000 na 1 kg hmotnosti příjemce. Kromě toho je však nutné bezprostředně zabránit zániku ostrůvků z důvodu místní koagulace a ischémie a z dlouhodobého hlediska předejít jejich poškození nejen rejekčním, ale také autoimunitním procesem, který je charakteristický pro diabetes mellitus 1. typu.
Uvedené podmínky se zatím daří splnit pouze částečně. Odhaduje se, že od roku 2000 bylo ve světě léčeno transplantací ostrůvků asi 1000 pacientů. Alespoň přechodné nezávislosti na exogenním inzulinu se podařilo dosáhnout asi v 15–80 % případů. Například na v současné době nejlépe renomovaném pracovišti v Edmontonu nepotřebovalo téměř 80 % osob léčených jednou až čtyřmi transplantacemi přechodně inzulin. Po 5 letech však toto číslo pokleslo na 15 % (17). V mezinárodní prospektivní studii vyhodnocující tzv. Edmontonský protokol bylo možné přerušit léčbu inzulinem u 52 % případů, ale po 2 letech zůstávalo bez inzulinu pouze 15 % léčených (10). Přitom se jedná o pracoviště, které ostrůvkové transplantace upřednostňuje před orgánovou transplantací, a tudíž kvalita použitých orgánů je evidentně vysoká. Existují však také pracoviště, která u malých sérií osob s dobrými předpoklady úspěchu (nízká potřeba inzulinu, nízká hmotnost) a při použití specifické imunosupresivní a další doprovodné léčby dosahují vysoké úspěšnosti i po provedení jediné implantace (18). To nasvědčuje, že potenciál metody je velký. Kromě toho se ale ukazuje, že byť jen částečné obnovení endogenní sekrece inzulinu znamená pro pacienty přínos. Téměř pravidelně se totiž stabilizují glykemické profily a zejména jsou eliminovány těžké hypoglykemické příhody u osob trpících syndromem porušeného vnímání hypoglykémie. Samotné dosažení nezávislosti na inzulinu není tedy ještě v současné době hlavním cílem léčby a ve většině center se ostrůvkové transplantace indikují právě u pacientů s touto poruchou.
V Institutu klinické a experimentální medicíny nyní existuje komplexní organizace transplantační péče o nemocné s diabetem. Při náhradě chybějící inzulinotvorné tkáně je dávána přednost orgánové transplantaci pankreatu a pouze orgány, které nesplňují kritéria pro tento typ transplantace, jsou poskytovány pro izolaci a případnou transplantaci ostrůvků. Rovnocenný výběr pro ostrůvkovou transplantaci by se mohl umožnit pouze tehdy, pokud by se prokázalo, že transplantace ostrůvků poskytne obdobné dlouhodobé výsledky.
Naše zkušenosti prozatím prokázaly, že transplantace ostrůvků může mít pro pacienty s nestabilním diabetem jednoznačný přínos. Riziko závažných komplikací je nesrovnatelně nižší než při transplantaci orgánové. Ve většině případů je obnovena endogenní sekrece inzulinu, zlepšuje se kompenzace diabetu, klesá potřeba inzulinu a především nedochází k závažným hypoglykemickým epizodám u osob, které předtím trpěly syndromem porušeného vnímání hypoglykémie se závažnými projevy. Metoda je kromě toho vhodná také pro diabetické příjemce, kteří současně podstupují transplantaci ledviny nebo jater. Zatím jednotlivé případy ukázaly, že po transplantaci ostrůvků je možné ukončit léčbu inzulinem a zajistit téměř normální hodnoty glykémií.
Zvládnutí techniky izolace ostrůvků je možné využít také v jiné oblasti. Totální pankreatektomie vede nevyhnutelně ke vzniku diabetu. Metabolická kontrola je často špatná, protože zcela chybí sekrece nejen inzulinu, ale také kontraregulačního hormonu glukagonu. Autotransplantací ostrůvků lze předejít vzniku diabetu až u 1/3 případů a u další 1/3 přispěje autotransplantace k lepšímu vyrovnání diabetu. Úspěch izolace ostrůvků ale závisí na stupni poškození pankreatu předchozí chorobou. Nejtypičtější diagnózou je bolestivá forma chronické pankreatitidy nebo chirurgicky již neléčitelná pankreatická píštěl po předchozích resekcích (19). Vzhledem k tomu, že při autotransplantaci není potřebná imunosupresivní léčba a implantace během operačního výkonu je poměrně jednoduchá, odpadá hlavní námitka proti tomuto způsobu léčby. Naše výsledky ukázaly, že i z poměrně malé části odebraného pankreatu, který je zánětlivě postižen, je možné získat významné množství inzulin produkující tkáně, která přispěje k udržování dobrého vyrovnání diabetu. Domníváme se proto, že možnost autotransplantace ostrůvků by neměla být opomenuta v žádném případě elektivní pankreatektomie, u které nepředpokládáme přítomnost maligního nádoru v odebrané tkáni a diabetes není přítomen již před samotnou pankreatektomií.
Transplantace alogenních ostrůvků izolovaných z pankreatu multiorgánových dárců orgánů nemůže ani v budoucnu představovat standardně používaný způsob léčby diabetu 1. typu, protože počet případných příjemců enormně převyšuje orgánovou nabídku. Bezprostřední perspektiva metody spočívá v dalším zdokonalení izolační techniky a vypracovaní postupů, které zlepší přežívání ostrůvků bezprostředně po implantaci. To může spočívat například například v lokální inhibici koagulační kaskády, zlepšení odolnosti ostrůvků proti hypoxii a ve stimulaci revaskularizačních procesů. Naděje se rovněž vkládá ve stimulaci regenerace transplantovaných beta-buněk, např. účinkem inkretinů, které se nyní používají v léčbě diabetu 2. typu. Používat by se mohly také jiné imunosupresivní léky, které by na rozdíl od dosud používaného takrolimu a sirolimu neměly inhibiční efekt na produkci inzulinu a nebránily diferenciaci kmenových buněk. Testována jsou také alternativní místa implantace ostrůvků, jako jsou například kostní dřeň a vaskularizované implantovatelné komůrky. Uvedené postupy se mohou uplatnit v nejbližších letech a přispět tak k tomu, aby se efektivita ostrůvkové transplantaci vyrovnala orgánové transplantaci pankreatu, oproti níž by ale byla pro pacienta podstatně bezpečnější (20). Zkušenosti získané při léčbě zatím vysoce selektovaných pacientů s nestabilním diabetem 1. typu se v budoucnu nepochybně uplatní také při využití alternativních zdrojů inzulin produkující tkáně, jako jsou kmenové či indukované pluripotentní prekurzorové buňky, jež by v nepříliš vzdálené budoucnosti mohly být dostupné pro širší okruh příjemců.
Transplantace alogenních ostrůvků zůstává zatím indikovaná zejména pro pacienty se syndromem porušeného vnímání hypoglykémie a rychlou progresí mikrovaskulárních komplikací. Další indikaci odstavuje kombinovaná transplantace ledviny a ostrůvků, zejména u osob s vyšším rizikem náročného chirurgického zákroku. V Institutu klinické a experimentální medicíny jsou nyní dostupné různé varianty transplantační péče, které dovolují pro pacienty s diabetem volit optimální postup a využít přitom nejvhodnějším způsobem nabídku kadaverózních orgánů. Probíhá rovněž výzkum alternativních zdrojů tkáně, které by mohly být využity v budoucnosti.
Zkratky
- CMRL – Connaught Medical Research Laboratories Medium
Práce vznikla s podporou grantu „Výzkumný záměr IKEM“ MZO 00023001.
Adresa pro korespondenci:
prof. MUDr. František Saudek, DrSc.
Klinika diabetologie, Centrum diabetologie IKEM
Vídeňská 1958/9, 140 21 Praha 4
fax: +420 261 362 280, e-mail: frsa@medicon.cz
Sources
1. Kopecký A. Dějiny cukrovky. Praha: Sdružení rodičů a přátel diabetických dětí v ČR 2000.
2. The DCCT Study Group. Adverse events and their association with treatment regimens in the diabetes control and complications trial. Diabetes Care 1995; 18(11): 1415–1427.
3. Kočandrle V, Bartoš V, Vaněk I, Neuwirtová K, Vondra K. Transplantation of the pancreas and kidney in a patient with diabetic microangiopathy. Čas Lék čes 1984; 123(5): 118–120.
4. Saudek F, Bouček P, Adamec M. Pancreas transplantation: who and when? Čas Lék čes 2001; 140(7): 195–199.
5. Adamec M, Saudek F. Transplantace sliivky břišní a diabetes mellitus. Praha: Karolinum, Galén 2005.
6. Troppmann C, Gruessner AC, Dunn DL, Sutherland DE, Gruessner RW. Surgical complications requiring early relaparotomy after pancreas transplantation: a multivariate risk factor and economic impact analysis of the cyclosporine era. Ann Surg 1998; 227(2): 255–268.
7. Saudek F. Léčba diabetu transplantací. Praha: Maxdorf 2003.
8. Harlan DM, Kenyon NS, Korsgren O, Roep BO. Current advances and travails in islet transplantation. Diabetes 2009; 58(10): 2175–2184.
9. Shapiro AM, Lakey JR, Ryan EA, et al. Islet transplantation in seven patients with type 1 diabetes mellitus using a glucocorticoid-free immunosuppressive regimen. N Engl J Med 2000; 343(4): 230–238.
10. Shapiro AM, Ricordi C, Hering BJ, et al. International trial of the Edmonton protocol for islet transplantation. N Engl J Med 2006; 355(13): 1318–1330.
11. Fiorina P, Shapiro AM, Ricordi C, Secchi A. The clinical impact of islet transplantation. Am J Transplant 2008; 8(10): 1990–1997.
12. Girman P, Berkova Z, Dobolilova E, Saudek F. How to use image analysis for islet counting. Rev Diabet Stud 2008; 5(1): 38–46.
13. Froud T, Ricordi C, Baidal DA, et al. Islet transplantation in type 1 diabetes mellitus using cultured islets and steroid-free immunosuppression: Miami experience. Am J Transplant 2005; 5(8): 2037–2046.
14. Saudek F, Jirák D, Girman P, Herynek V, Dezortová M, Kříž J, Peregrin J, Berková Z, Zacharovová K, Hájek M. Magnetic resonance imaging of pancreatic islets transplanted into the liver in humans. Transplantation 2010; 90 : 1602–1606.
15. Villiger P, Ryan EA, Owen R, et al. Prevention of bleeding after islet transplantation: lessons learned from a multivariate analysis of 132 cases at a single institution. Am J Transplant 2005; 5(12): 2992–2998.
16. Mindlová M, Saudek F. Autonomní selhání způsobené recidivujícími hypoglykémiemi, jeho klinické hodnocení a terapie. Prakt Lék 2007; 87 : 52–57.
17. Ryan EA, Paty BW, Senior PA, et al. Five-year follow-up after clinical islet transplantation. Diabetes 2005; 54(7): 2060–2069.
18. Hering BJ, Kandaswamy R, Harmon JV, et al. Transplantation of cultured islets from two-layer preserved pancreases in type 1 diabetes with anti-CD3 antibody. Am J Transplant 2004; 4(3): 390–401.
19. Blondet JJ, Carlson AM, Kobayashi T, et al. The role of total pancreatectomy and islet autotransplantation for chronic pancreatitis. Surg Clin North Am 2007; 87(6): 1477–1501.
20. Robertson RP. Islet transplantation a decade later and strategies for filling a half-full glass. Diabetes 2010; 59(6): 1285–1291.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Léčba diabetu transplantací izolovaných Langerhansových ostrůvků
- Transplantace ledviny v IKEM
- Výsledky dlouhodobého sledování prvních 500 pacientů po transplantaci jater provedených v Institutu klinické a experimentální medicíny v Praze
- Stanovení obsahu jaterního tuku metodou 1H MR spektroskopie
- Transplantace jater u pacientů s trombózou v. portae
- Vliv chirurgických komplikací na funkci transplantované ledviny
- Molekulární diagnostika dědičných forem intrahepatální cholestázy a familiárních hyperbilirubinémií
- Katetrizační ablace fibrilace síní
- Hyperglykémie a její kontrola u dospělých pacientů v intenzivní péči
- Akutní selhání jater: současná doporučení
- Specifika perioperační péče o pediatrické pacienty podstupující transplantaci jater
- Zemřelí dárci orgánů k transplantacím
- Everzní endarterektomie arterie carotis interna: hodnocení výsledků po změně operační techniky
- Přínos dlouhodobé pulzatilní mechanické srdeční podpory u multiorgánově selhávajících pacientů v terminálním srdečním selhání
- Imunohistochemická detekce glypicanu-3 zpřesňuje diagnózu hepatocelulárního karcinomu
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Akutní selhání jater: současná doporučení
- Hyperglykémie a její kontrola u dospělých pacientů v intenzivní péči
- Everzní endarterektomie arterie carotis interna: hodnocení výsledků po změně operační techniky
- Transplantace ledviny v IKEM
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

