-
Medical journals
- Career
Stanovení obsahu jaterního tuku metodou 1H MR spektroskopie
Authors: Milan Hájek 1; Monika Dezortová 1; Dita Wagnerová 1; Luděk Voska 2; Irena Hejlová 3; Pavel Trunečka 3
Authors‘ workplace: Institut klinické a experimentální medicíny Praha, MR spektroskopie, Základna radiodiagnostiky a intervenční radiologie 1; Institut klinické a experimentální medicíny Praha, Pracoviště klinické a transplantační patologie 2; Institut klinické a experimentální medicíny Praha, Klinika hepatogastroenterologie 3
Published in: Čas. Lék. čes. 2011; 150: 68-71
Category: Original Article
Overview
Východisko:
Metabolický syndrom se mimo jiné projevuje zvyšováním obsahu tuku v játrech. Mezi neinvazivními metodami stanovení tuku v játrech hraje nejvýznamnější roli magnetická rezonance (MR), a to jak MR zobrazování (MRI), tak MR spektroskopie (MRS). Tato práce je věnována metodickým výsledkům pilotní studie stanovení obsahu triglyceridů u pacientů s transplantovanými játry MR spektroskopií při 3T.Metoda a výsledky:
V pilotní studii bylo vyšetřeno 38 pacientů (12 žen, 27 mužů, věkový rozsah 19–71 let), kteří podstoupili pravidelnou preventivní prohlídku po transplantaci jater v IKEM. U těchto pacientů byly k dispozici výsledky jaterní biopsie s počtem poškozených hepatocytů HIS. Skupinu podle klasifikace poškození hepatocytů tvořilo 20 pacientů se steatózou stupně S0, 15 pacientů se steatózou stupně S1, dva pacienti S2 a jeden pacient S3. 1H MR spektra jaterní tkáně byla měřena ze tří míst v játrech a ze získaných hodnot intenzit signálů triglyceridů a vody byly vypočteny koncentrace tuku φfat podle metody navržené Longem et al. Závislost mezi počtem poškozených hepatocytů a množstvím tuku byla popsána lineární funkcí: HIS = 6,4 φfat –2,1; r2 = 0,85; p = 0,001.Závěry:
Pilotní studie ukázala, že vyšetřování jater 1H MRS při 3T je pacienty dobře tolerováno, a byla prokázána významná korelace mezi histologickým a 1H MRS stanovením tuku v játrech. Metoda je vhodná pro opakovaná vyšetření a screeningová vyšetření pro neinvazivní stanovení obsahu tuku v játrech.Klíčová slova:
metabolický syndrom, jaterní steatóza, stanovení triglyceridů, 1H MR spektroskopie.Úvod
V současné době věnuje odborná i laická veřejnost stále větší pozornost skupině onemocnění, která jsou souhrnně popisována jako metabolický syndrom (1). Metabolický syndrom souvisí s celkovou obezitou, poruchou glukózového metabolismu (diabetes 2. typu aj.), dyslipidémií, pozánětlivými stavy apod. Je známá významná souvislost metabolického syndromu s kardiovaskulárními chorobami či nádory a depresemi. V případě jaterních onemocnění se metabolický syndrom projevuje jaterní steatózou, která je charakterizována zvýšeným obsahem tuku v játrech. Zvyšování množství tuku v játrech může vést od běžné nealkoholové jaterní choroby (NAFLD) k nealkoholické steatohepatitidě (NASH), která se často přeměňuje přes fibrózu a cirhózu někdy až k hepatocelulárnímu karcinomu. Zjištění steatózy nepředstavuje pro moderní radiologické zobrazovací metody, jako je ultrasonografie, výpočetní tomografie (CT) nebo magnetická rezonance (MR) velký problém (2, 3). Ten nastává teprve při kvantifikaci tohoto onemocnění a při sledování průběžných změn obsahu tuku v játrech v případě léčby nebo progrese onemocnění. Jaterní biopsie, dosud považovaná za nejlepší způsob zjištění množství tuku v játrech, je invazivní metoda, která by neměla být aplikována často. Navíc u jinak zdravé populace je její použití omezeno z etických důvodů. Ultrasonografie je nepřesná metoda a CT je zatížena mimo jiné nepříznivými ionizačními účinky. Jako optimální se jeví metody magnetické rezonance – MR zobrazování (MRI) a MR spektroskopie (MRS). Obě MR metody mají své výhody a nevýhody. Výhodou MR spektroskopie je stanovení zastoupení tuku v játrech na základě přímého porovnání intenzit signálů vody a tuků. Nevýhodou je nutnost dodatečného vybavení MR tomografu. Výhodou MR zobrazovacích metod je rychlé měření, ale nevýhodou nutnost kalibrace metody.
Jaterní steatóza je charakterizována zvýšenou akumulací triglyceridů v cytoplazmě hepatocytů. V cytoplazmě jsou triglyceridy soustředěny ve vakuolách, a pokud je vakuol velké množství nebo jsou příliš veliké, mohou hepatocyty poškodit anebo i zničit. Na sledování počtu poškozených hepatocytů jsou založeny histologické metody (4). Protonová (1H) MR spektroskopie využívá možnosti přímého měření signálů vodíkových atomů sloučenin přítomných v játrech. Jedná se především o signály triglyceridů a vody. Triglyceridy představují směs derivátů mastných kyselin s relativně dlouhými řetězci, pro které je charakteristické velké množství CH2, CH3 a CH skupin. Tyto skupiny jsou velmi dobře viditelné v in vivo 1H MR spektrech a jejich intenzita je přímo úměrná jejich koncentraci. Toho využili Longo et al. (5) a již před řadou let navrhli metodu stanovení triglyceridů v játrech na základě porovnání intenzit jejich signálů s intenzitou signálu vody. Kvantitativní výpočet založili na předpokladu, že průměrná molarita triglyceridů je 110 mol/l. Tento postup MR spektroskopického vyšetřování při magnetickém poli 1,5T byl použit v řadě prací a MR spektroskopie slouží jako referenční metoda pro kalibraci dalších MR zobrazovacích postupů stanovení tuku v játrech (6–8).
Naše pracoviště se tradičně věnuje metodě MR spektroskopie více než 20 let a navrhli jsme celou řadu vyšetřovacích 1H MR postupů, které se používají pro klinické experimenty i rutinní vyšetření (9, 10). V práci prezentujeme pilotní studii zaměřenou na stanovení tuku v játrech u pacientů s transplantovanými játry pomocí 1H MR spektroskopie při 3T a porovnání těchto výsledků s histologickými nálezy.
SOUBOR NEMOCNÝCH A POUŽITÉ METODY
Subjekty
Skupinu pacientů tvořili pacienti po transplantaci jater, kteří podstoupili pravidelnou preventivní prohlídku v IKEM, jejíž součástí je klinické vyšetření, laboratorní testy, jaterní biopsie a MR vyšetření. Pacienti byli informováni o průběhu a účelu vyšetření a podepsali písemný souhlas s vyšetřením podle normy ISO 9001 : 2008. Vyšetření probíhala v souladu s pravidly etické komise IKEM.
Celkem bylo v pilotní studii vyšetřeno 38 pacientů (12 žen, 27 mužů, věkový rozsah 19–71 let).
Histologické vyšetření
Bioptické vzorky byly získány standardní Menghiniho technikou na klinice hepatogastroenterologie IKEM. Pro odběry byl použit set HEPAFIX set G16/1.6x88 (B. Braun Melsungen AG). Vzorky fixované 10% formolem byly zality do parafínu a krájeny na 2–3 μm silné řezy, které pak byly obarveny hematoxylinem a eosinem, metodou PAS (Periodic Acid-Schiff), orceinem, Van Giesonem s elastikou, berlínskou modří a Schmorlovou reakcí.
Histologické preparáty byly vyhodnoceny s použitím mikroskopu Olympus BX51. Počet poškozených hepatocytů byl vypočten semikvantitativně. Standardní histologické vyšetření bylo provedeno dvěma zkušenými histopatology a všechna data pro charakterizaci souboru byla získána z rutinních histologických vyšetření.
Steatóza a fibróza byly hodnoceny stupnicí podle Kleinera (4, 11): stupeň S0 – bez steatózy (do 5 % poškozených hepatocytů); stupeň S1 – mírná steatóza (5–33 % poškozených hepatocytů); stupeň S2 – zvýšená steatóza (33–66 % poškozených hepatocytů); stupeň 3 – těžká steatóza (více než 66 % poškozených hepatocytů). Fibróza: stupeň F1: perisinusoidální nebo periportální (1A – mírná, zóna 3, perisinusoidální; 1B – střední, zóna 3, perisinusoidální, 1C – pouze portální/periportální); F2 – perisinusoidální a portální/periportální; F3 – septální (bridging) fibróza, F4 – cirhóza.
Obsah železa byl popsán čtyřstupňovou stupnicí podle Scheuera et al. (12).
MR spektroskopie
1H MR spektra byla měřena minimálně šest hodin po provedené jaterní biopsii na MR tomografu Magnetom Trio 3T povrchovou 8-kanálovou cívkou. V první části vyšetřovacího protokolu byly získány MR obrazy ve třech rovinách sekvencí HASTE (Half fourier Acquired Single shot Turbo spin Echo) se zadržením dechu (max. 15 s) pro nalezení nejvhodnější polohy voxelu (VOI – volume of interest) pro měření 1H MR spekter. 1H MR spektra byla získána sekvencí PRESS (TE = 30 ms) se zadržením dechu na 13 s. Spektra byla měřena ze třech objemů 27 ml jednou akvizicí a VOI byl umístěn nejčastěji do jaterních segmentů IV, V a VII tak, aby byly co nejvíce eliminovány příspěvky signálů z cévního řečiště (obr. 1). Homogenita magnetického pole ve VOI byla nastavena automaticky a v některých případech korigována interaktivně tak, aby pološířka signálu vody byla < 35 Hz. Opakovatelnost stanovení obsahu tuku ve VOI se pohybovala kolem 1 %, rozdíl mezi obsahem tuku ve třech segmentech jater byl do 30 %. Celková doba vyšetření byla 30 minut.
Image 1. Umístění tří vyšetřovaných objemů VOI (27 ml) pro stanovení obsahu tuků v játrech 1H MR spektroskopií (pacient s nízkým obsahem tuku – stupeň S0) 
Interpretace MR spekter a stanovení obsahu tuku
Naměřená MR spektra (obr. 2) byla zpracována technikou LCModel 6.1 (13) a získané hodnoty intenzit signálů vody a alifatických protonů CH2 a CH3 skupin byly použity pro výpočet množství tuku v každém jednotlivém VOI metodou podle Longo et al. (5). Koncentrace tuku φtuk vyjádřená v objemových % byla vypočtena pomocí vztahu:
φtuk = 100 FTSA/(1,138–0,339 FTSA),
kde FTSA = Sa/(Sa + Sb) = Sa/St, Sa je intenzita signálů v alifatické časti spektra mezi 0,5–3 ppm a Sb je intenzita signálů vody (případně CH2 a CH signálů překrytých signálem vody) a FTSA zastoupení alifatických protonů v celkové intenzitě spektra.
Image 2. Typické 1H MR spektrum z objemu 27 ml naměřené sekvencí PRESS (TE = 30 ms) pacienta zařazeného do skupiny S0 (počet poškozených hepatocytů 2 %, φ<sub>tuk</sub> = 0,7) S<sub>a</sub> a S<sub>b</sub> jsou hodnoty intenzit signálů alifatických vodíkových atomů a vody. 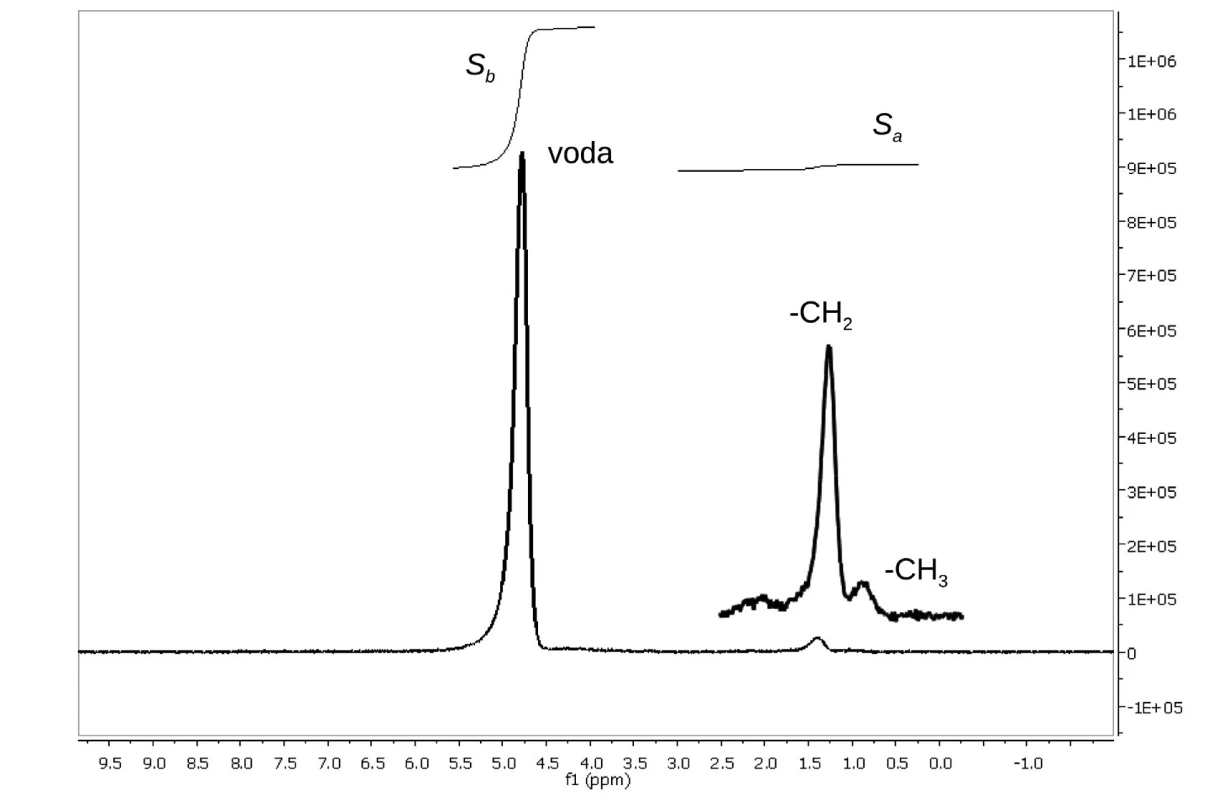
Naměřené intenzity signálů byly korigovány na vliv T2 relaxačních časů. Korekce byly vypočteny pro T2 relaxační čas vody 26 ms a T2 relaxační čas alifatických protonů 60 ms podle literatury (7, 8).
Statistická analýza
Statistická analýza byla provedena pomocí programu Excel (Microsoft) a GraphPad PRISM (GraphPad Software Inc.).
Výsledky
Výsledky histologického vyšetření ukázaly, že ve vyšetřované pilotní skupině převažují pacienti s velmi nízkým stupněm steatózy, převážně se stupněm S0 a S1. Stupeň S2 a S3 vykazovali ve skupině pouze tři pacienti.
U devíti pacientů byla popsána fibróza stupně F2–F4. Přítomnost železa nebyla prokázána u žádného pacienta.
Výsledky jsou uvedeny v tabulce 1, kde je k příslušnému stupni steatózy vypočtena průměrná hodnota koncentrace tuku φtuk.
Table 1. Stupeň steatózy ve vyšetřované skupině (hodnota v závorce je směrodatná odchylka) 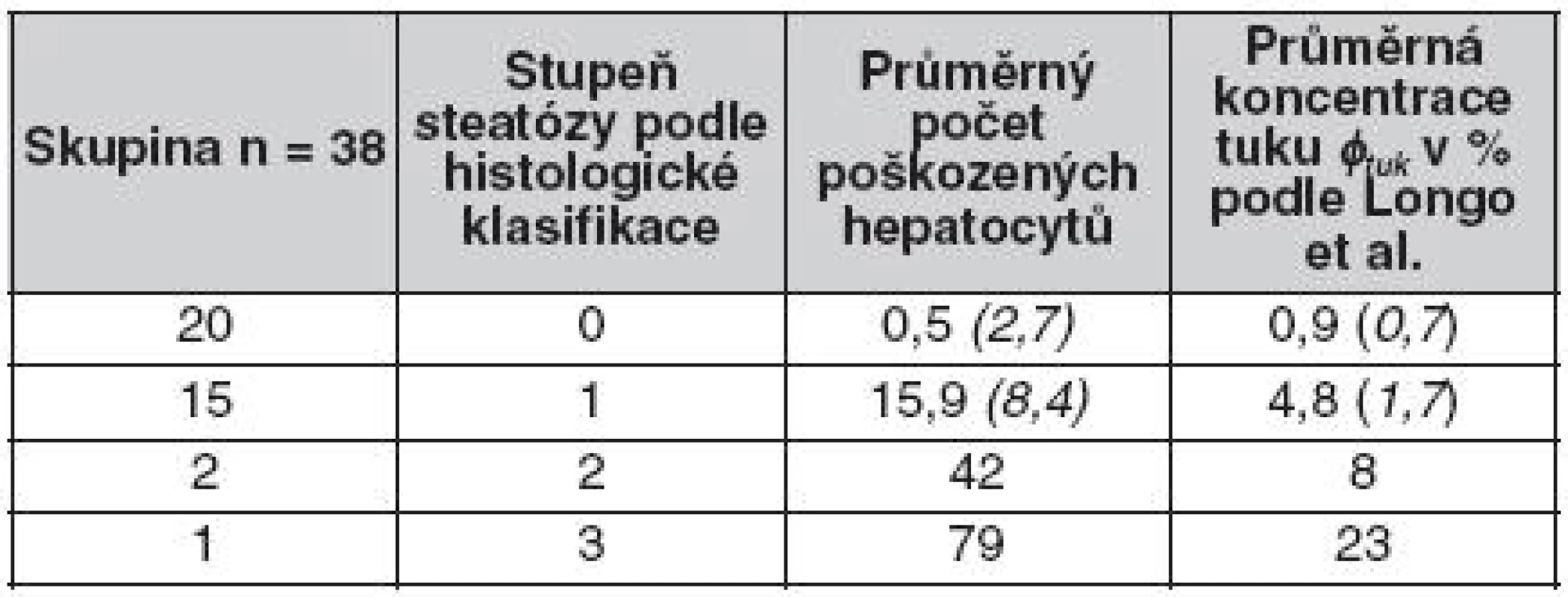
Souvislost mezi množstvím postižených hepatocytů a hodnotou koncentrace tuku byla testována lineární regresí. Byla nalezena vysoká korelace mezi těmito dvěma veličinami charakterizovaná r2 = 0,85 (p = 0,001), takže tuto závislost můžeme považovat za lineární, viz obrázek 3.
Image 3. Závislost zastoupení tuku φ<sub>tuk</sub> (%) na počtu poškozených hepatocytů histologie (HIS) Počet bodů pro výpočet závislosti n = 38. Lineární závislost je popsána rovnicí HIS = 6,4 φ<sub>tuk</sub> – 2,1; r<sup>2</sup> = 0,85; přerušovaná čára ukazuje na 95% interval spolehlivosti. 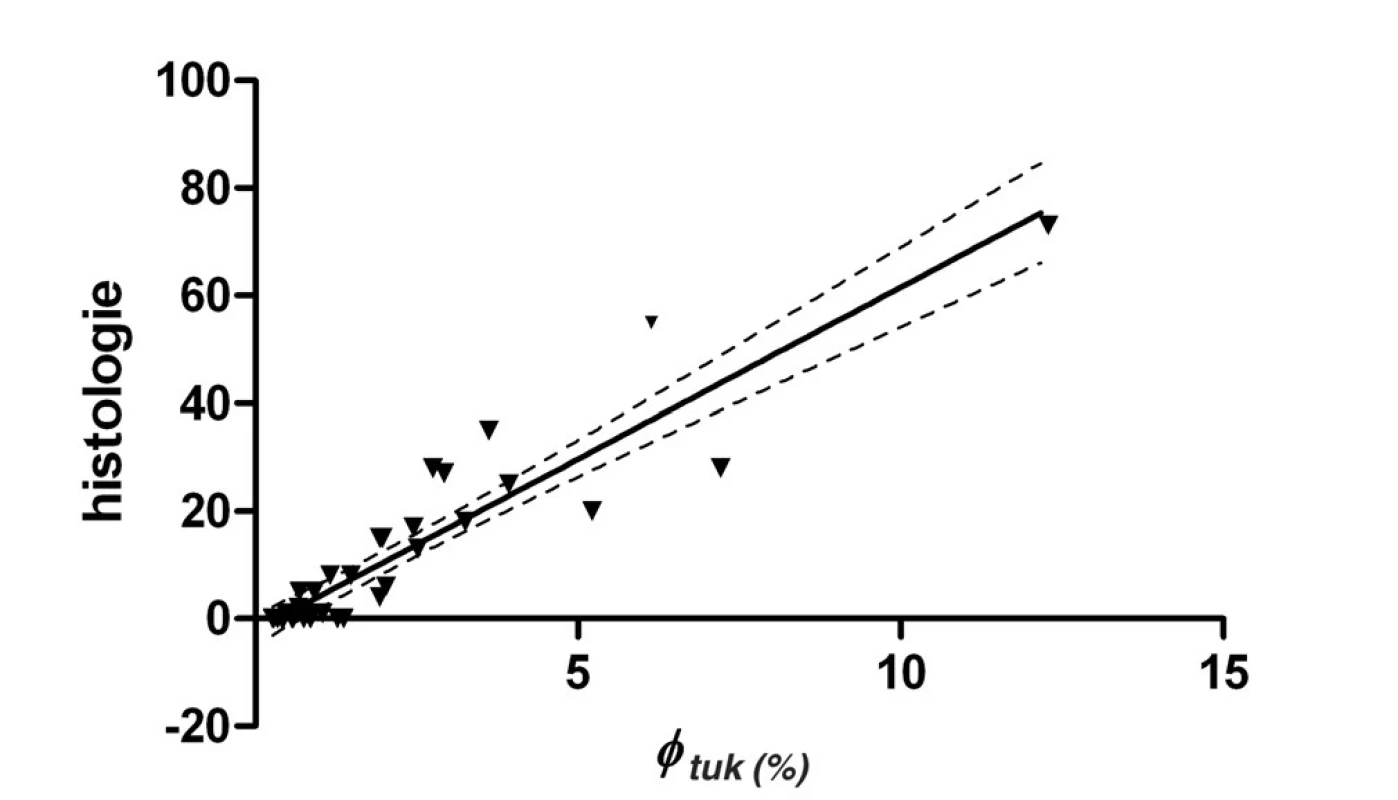
Diskuze
Neinvazivní 1H MRS vyšetření poskytuje dostatek informací pro určení množství tuku v játrech. Vyšetření se zadržením dechu bylo všemi pacienty velmi dobře tolerováno a získaná spektra měla vysoký poměr signál/šum, který umožnil bezpečné automatické zpracování spekter technikou LCModel.
V literatuře není mnoho prací, ve kterých jsou popsány korelace mezi MR a histologickými výsledky, zvláště pak vyšetření při 3T. Nicméně se ukazuje, že MR spektroskopie je velmi citlivá metoda. Na rozdíl od výsledků histologického vyšetření byl u všech našich vyšetřovaných subjektů se steatózou S0 nalezen signál triglyceridů (přítomnost tukových jader pouze v 30 % histologických vzorků). Je to dáno především velkým objemem jaterní tkáně, ve kterém byl signál tuků metodou MRS získán (VOI = 27 ml tkáně, objem tkáně při biopsii kolem 5 μl). Tento velký objem pro MRS analýzu umožňuje zachytit i velmi nízké koncentrace CH2 skupin triglyceridů. Je to v souladu s literárními nálezy (2, 5).
Ve vyšetřované skupině pacientů byla potvrzena lineární závislost mezi histologicky zjištěným počtem poškozených hepatocytů a obsahem tuku. Korelační koeficient r2 = 0,85 (p < 0,001) ukazuje, že tato korelace je velmi silná, viz obrázek 3. Přestože obě metody charakterizující steatózu jsou svým principem odlišné, získaná lineární závislost ukazuje na velmi dobrou shodu obou výsledků, zvláště při malém poškození hepatocytů, tj. i nízké koncentraci tuku v játrech. Již Longo et al. (5) popsali tuto významnou lineární závislost (r = 0,7) a současně nalezli velmi dobrou shodu s výsledky CT ve skupině 29 pacientů. Studie McPherson et al. (14) uvádí podobnou velmi silnou korelaci mezi histologickým nálezem a výsledky MR spektroskopie (r2 = 0,88, p = 0,001). V této skupině bylo zastoupení pacientů se steatózou druhého a třetího stupně 29 %, tj. značně vyšší zastoupení než v naší pilotní skupině, kde zastoupení stupně S2 a S3 je pouze 7 %.
Krššák et al. (15) popsali lineární závislost mezi histologickým stupněm steatózy a MRS výsledky ve skupině 29 pacientů s chronickou hepatitidou (r = 0,70, p = 0,001) a potvrdili vyšší prevalenci steatózy u pacientů s hepatitidou C (genotyp 3).
D’Assignies et al. (16) porovnávali různé metody stanovení tuku v játrech s výsledky MR spektroskopie. Velmi silnou lineární korelaci nalezli ve skupině 20 pacientů s histologickými výsledky získanými jak vizuálním hodnocením, tak semiautomatickým postupem) (r = 0,58–0,77, p < 0,007).
MR spektroskopie při 3T se ukázala jako vhodná metoda stanovení triglyceridů v játrech u našich pacientů. Navržený postup vyšetření může být rozšířen i pro další studie zaměřené na širší populaci (17). MRS vyšetření je vhodné především pro screeningová vyšetření a vhodným způsobem doplňuje výsledky histologie.
Zkratky
- CT – výpočetní tomografie
- HIS – histologie
- MR – magnetická rezonance
- MRI – MR zobrazování
- MRS – MR spektroskopie
- NAFLD – nealkoholová jaterní choroba
- VOI – volume of interest
Studie byla podporována granty: ENCITE grant 7FW EU HEALTH-F5-2008 - 201842 a IGA grant č. NS9707-3.
Adresa pro korespondenci:
MUDr. Milan Hájek
MR spektroskopie, Základna radiodiagnostiky a intervenční radiologie IKEM
Vídeňská 1958/9, 140 21 Praha 4
e-mail: miha@medicon.cz
Sources
1. Hůlek P, Dresslerová I. Metabolický syndrom a játra (NAFLD/NASH). Vnitř Lék 2009; 55(7/8): 646–649.
2. Springer F, Machann J, Claussen CD, Schick F, Schwenzer NF. Liver fat content determined by magnetic resonance imaging and spectroscopy. World J Gastroenterol 2010; 16(13): 1560–1566.
3. Schwenzer NF, Springer F, Schraml C, Stefan N, Machann J, Schick F. Non-invasive assessment and quantification of liver steatosis by ultrasound, computed tomography and magnetic resonance. J Hepatol 2009; 51(3): 433–445.
4. Hübscher SG. Histological assessment of non-alcoholic fatty liver disease. Histopathology 2006; 49(5): 450–465.
5. Longo R, Pollesello P, Ricci C, Masutti F, Kvam BJ, Bercich L, CrocŹ LS, Grigolato P, Paoletti S, de Bernard B, et al. Proton MR spectroscopy in quantitative in vivo determination of fat content in human liver steatosis. J Magn Reson Imaging 1995; 5(3): 281–285.
6. Hu HH, Kim H-W, Batak KS, Nayak KS, Goran MI. Comparison of fat-water MRI and single-voxel MRS in the assessment of hepatic and pancreatic fat fractions in humans. Obesity (Silver Spring) 2010; 18(4): 841–847.
7. Guiu B, Petit JM, Loffroy R, Salem DB, Aho S, Masson D, Hillon P, Krause D, Cercueil JP. Quantification of liver fat content: comparison of triple-echo chemical shift gradient-echo imaging and in vivo proton MR spectroscopy. Radiology 2009; 250(1): 95–102.
8. Guiu B, Loffroy R, Petit JM, Aho S, Salem DB, Masson D, Hillon P, Cercueil JP, Krause D. Mapping of liver fat with triple-echo gradient echo imaging. validation against 3.0 T proton MR spectroscopy. Eur Radiol 2009; 19(7): 1786–1793.
9. Hájek M, Horská A, Belán A, Táborský P, Grosmanová A. Využití 31P MR spektroskopie při studiu kosterního svalstva člověka. Prakt Lek 1990; 70 : 538–544.
10. Hajek M. (guest editor) Clinical 1H MR Spectroscopy. Eur J Radiol 2008; 67(2): 183–275.
11. Kleiner DE, Brunt EM, Van Natta M, Behling C, Contos MJ, Cummings OW, Ferrell LD, Liu YC, Torbenson MS, Unalp-Arida A, Yeh M, McCullough AJ, Sanyal AJ. Nonalcoholic Steatohepatitis Clinical Research Network. Design and validation of a histological scoring system for nonalcoholic fatty liver disease. Hepatology 2005; 41(6): 1313–1321.
12. Searle JW, Kerr JFR, Halliday JW, Powel LW. Iron storage disease. MacSween RNM, Anthony PP, Scheuer PJ. (eds.) Pathology of the liver, 2nd edn. Edinburgh: Churchill Livingstone 1987.
13. Provencher SW. Estimation of metabolite concentrations from localized in vivo proton NMR spectra. Magn Reson Med 1993; 30(6): 672–679.
14. McPherson S, Jonsson JR, Cowin GJ, O’Rourke P, Clouston AD, Volp A, Horsfall L, Jothimani D, Fawcett J, Galloway GJ, Benson M, Powell EE. Magnetic resonance imaging and spectroscopy accurately estimate the severity of steatosis provided the stage of fibrosis is considered. J Hepatol 2009; 51(2): 389–397.
15. Krššák M, Hofer H, Wrba F, Meyerspeer M, Brehm A, Lohninger A, Steindl-Munda P, Moser E, Ferenci P, Roden M. Non-invasive assessment of hepatic fat accumulation in chronic hepatitis C by 1H magnetic resonance spectroscopy. Eur J Radiol 2010; 74(3): e60–66.
16. d’Assignies G, Ruel M, Khiat A, Lepanto L, Chagnon M, Kauffmann C, Tang A, Gaboury L, Boulanger Y. Noninvasive quantitation of human liver steatosis using magnetic resonance and bioassay methods. Eur Radiol 2009; 19(8): 2033–2040.
17. Szczepaniak LS, Nurenberg P, Leonard D, Browning JD, Reingold JS, Grundy S, Hobbs HH, Dobbins RL. Magnetic resonance spectroscopy to measure hepatic triglyceride content. prevalence of hepatic steatosis in the general population. Am J Physiol Endocrinol Metab 2005; 288(2): E462–468.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Léčba diabetu transplantací izolovaných Langerhansových ostrůvků
- Transplantace ledviny v IKEM
- Výsledky dlouhodobého sledování prvních 500 pacientů po transplantaci jater provedených v Institutu klinické a experimentální medicíny v Praze
- Stanovení obsahu jaterního tuku metodou 1H MR spektroskopie
- Transplantace jater u pacientů s trombózou v. portae
- Vliv chirurgických komplikací na funkci transplantované ledviny
- Molekulární diagnostika dědičných forem intrahepatální cholestázy a familiárních hyperbilirubinémií
- Katetrizační ablace fibrilace síní
- Hyperglykémie a její kontrola u dospělých pacientů v intenzivní péči
- Akutní selhání jater: současná doporučení
- Specifika perioperační péče o pediatrické pacienty podstupující transplantaci jater
- Zemřelí dárci orgánů k transplantacím
- Everzní endarterektomie arterie carotis interna: hodnocení výsledků po změně operační techniky
- Přínos dlouhodobé pulzatilní mechanické srdeční podpory u multiorgánově selhávajících pacientů v terminálním srdečním selhání
- Imunohistochemická detekce glypicanu-3 zpřesňuje diagnózu hepatocelulárního karcinomu
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Akutní selhání jater: současná doporučení
- Hyperglykémie a její kontrola u dospělých pacientů v intenzivní péči
- Everzní endarterektomie arterie carotis interna: hodnocení výsledků po změně operační techniky
- Transplantace ledviny v IKEM
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

