-
Medical journals
- Career
Role mikroRNA v imunitním systému
Authors: Petra Faltejsková 1; prof. RNDr. Ondřej Slabý, Ph.D. 1,2; Renata Héžová 1; Jaroslav Michálek 1
Authors‘ workplace: Masarykova univerzita Brno, Univerzitní centrum buněčné imunoterapie 1; Masarykův onkologický ústav Brno, Klinika komplexní onkologické péče 2
Published in: Čas. Lék. čes. 2010; 149: 10-15
Category: Review Article
Overview
MikroRNA jsou krátké nekódující molekuly RNA regulující expresi genů na posttranskripční úrovni. Nacházejí se jak u živočichů, tak i u rostlin a virů a mají nezastupitelnou roli v biologických procesech, jakými jsou embryogeneze, diferenciace a proliferace buněk, produkce cytokinů či apoptóza. V současné době je známo více než 700 savčích mikroRNA, které regulují několik tisíc genů. Je odhadováno, že až jedna třetina všech genů kódujících proteiny může být ovlivněna těmito malými molekulami. Vzhledem k charakteru těchto cílových mRNA je již zjevné, že poruchy v expresi mikroRNA mohou vést nejen ke vzniku nádorových onemocnění, ale i k závažným poškozením imunitního systému. Cílem tohoto přehledového článku je shrnout základní poznatky z oblasti biogeneze a funkce mikroRNA a poukázat na roli těchto molekul v regulaci ontogeneze imunitního systému, hematopoézy, imunitní odpovědi a virové infekce. Diskutováno je i možné využití mikroRNA v terapii virových infekcí.
Klíčová slova:
mikroRNA, RNA interference, imunitní systém, hematopoéza, virová infekce.Úvod
MikroRNA (miRNA) jsou nekódující jednořetězcové RNA o délce 18–25 nukleotidů tvořící nedávno objevenou skupinu regulátorů genové exprese vyskytující se jak v rostlinných, tak v živočišných buňkách. Poslední verze internetové databáze miRBase (verze 13.0, březen 2009) obsahuje přes 700 popsaných sekvencí miRNA v lidském genomu. Podle současných odhadů bioinformatiků jsou miRNA schopny regulovat až jednu třetinu lidských genů. miRNA byly objeveny počátkem devadesátých let 20. století týmem Victora Ambrose, který popsal, že gen lin-4 zahrnutý do regulace vývoje hlísta Caenorhabditis elegans nekóduje protein, ale je původcem krátké 22 nukleotidů dlouhé RNA, u které byla následně popsána schopnost interagovat s mRNA genu lin-14 a reprimovat její translaci (1). Tento způsob regulace genové exprese – kdy se jedna RNA váže na druhou RNA – byl přehlížen více než 30 let. miRNA unikaly svému objevení především díky své délce, která molekulární biology vedla k domněnce, že se jedná o degradační produkty jiných RNA. Studium funkce a významu miRNA probíhá od jejich objevu dodnes s vysokou intenzitou, což nejlépe dokládá skutečnost, že v roce 2006 obdrželi Andrew Z. Fire a Craig C. Mello Nobelovu cenu za fyziologii a medicínu za práci zaměřenou na popis jevu RNA interference a mechanismů, jakým miRNA regulují genovou expresi. Sekvence miRNA jsou napříč organismy vysoce konzervované, což naznačuje jejich zapojení do esenciálních biologických procesů. Dnes už je zřejmé, že miRNA mají důležité regulační funkce v procesech, jako jsou diferenciace, proliferace a apoptóza, a ovlivňují tak komplexní biologické systémy, jako jsou embryogeneze, onkogeneze či imunita.
Biogeneze a funkce mikroRNA
Většina genů pro mikroRNA (miRNA) se nachází uvnitř kódujících či nekódujících oblastí transkripčních jednotek, a je proto přepisována současně s ostatními genyza účasti RNA polymerázy II. Výsledkem transkripce jsou primární transkripty označované jako primární miRNA (pri-miRNA), které se skládají ze 100–1000 nukleotidů a podobně jako ostatní transkripty obsahují polyadenylovaný konec a čepičku (CAP) (2). Pri-miRNA je dále rozpoznávána enzymatickým komplexem Drosha/DGCR8 a štěpena na prekurzorovou miRNA (pre-miRNA) o délce ~70 nukleotidů (3). Charakteristická vlásenková struktura pre-miRNA je následně specificky rozpoznána komplexem Exportin 5/RanGTP a transportována z jádra do cytoplazmy, kde je štěpena ribonukleázou Dicer ve spolupráci s proteinem TRBP (trans-activator RNA binding protein) na dvouřetězcovou miRNA o délce ~22 nukleotidů (4). Zatímco jeden řetězec je okamžitě degradován, druhý (vedoucí) je navázán na RISC (RNA-induced silencing complex), a stává se tak zralou miRNA. Klíčovou složkou RISC jsou proteiny z argonautové rodiny (Ago). Zatímco Ago1–4 se podílí na potlačení translace cílové mRNA, pouze Ago2 je schopen rozštěpit cílovou mRNA, a je proto označován jako katalytický enzym RNA interference (RNAi) (5). K interakci s cílovou mRNA dochází na základě komplementárního párování bází mezi zralou miRNA a 3’UTR (3‘-untranslated region) mRNA. Míra homologie mezi těmito molekulami následně určí, zda bude cílová mRNA degradována, či zda bude pouze potlačena její translace (1). Bylo pozorováno, že za zcela speciálních podmínek, nachází-li se buňka ve stresu, nebo je vystavena podmínkám hladovění, může miRNA působit v opačném směru a dochází ke zvýšené translaci příslušné mRNA (6).
Nedávné studie popsaly alternativní cestu biogeneze miRNA u Caenorhabditis elegans, Drosophila melanogaster a savců, která je nezávislá na enzymu Drosha. V tomto případě je pre-miRNA získána sestřihem vlásenkovitých intronových oblastí pre-mRNA, které jsou označovány jako mirtrony (pre-miRNA/introns) (7). Celý proces biogeneze a následné funkce miRNA je patrný z obrázku 1.
Image 1. Biogeneze a funkce miRNA 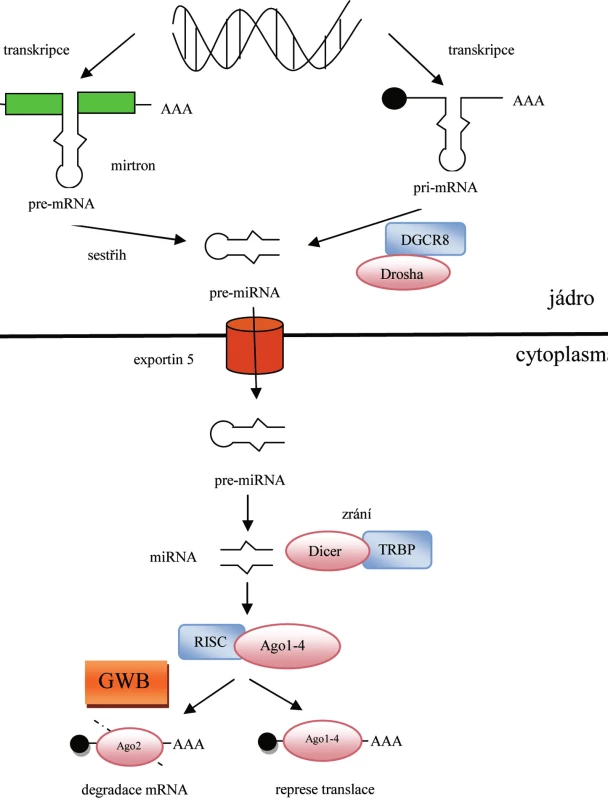
K RNA interferenci (RNAi) dochází v oblastech označovaných jako GWB (GW body). Tyto oblasti, objevené v roce 2002, byly pojmenovány podle hlavního markeru, který se zde nachází – proteinu GW182. Vyskytují se u savčích buněk a významně se liší od ostatních organel nacházejících se v cytoplazmě. Jejich velikost se liší v závislosti na fázi buněčného cyklu, avšak největší GWB byly pozorovány u proliferujících buněk (8). Zahrnutí GWB v biogenezi miRNA poukazuje na možnost využití těchto oblastí jako užitečného markeru pro stanovení miRNA aktivity.
MikroRNA v regulaci ontogeneze imunitního systému a hematopoézy
První popsanou miRNA v souvislosti s regulací ontogeneze imunitního systému a hematopoézy byla miR-181a, která je přednostně exprimována v tkáni tymu, v nižší míře potom v kostní dřeni a lymfatických uzlinách (9). Další studie prokázaly zvýšenou hladinu miR-181a u diferencovaných B-lymfocytů, zatímco hladina exprese v progenitorových buňkách byla signifikantně nižší, což svědčí o pozitivním vlivu této miRNA na vývoj B-lymfocytů. Opačná situace byla pozorována u T-lymfocytů, kdy zvýšená exprese miR-181a u progenitorových buněk vedla k 90% úbytku CD8+ buněk v periferii, zatímco počet CD4+ T-lymfocytů klesl na polovinu. Protože vývoj B - a T-lymfocytů probíhá dvěma na sobě nezávislými cestami, zdá se pravděpodobné, že miR-181a působí v závislosti na podmínkách na několik odlišných cílových genů (10). V kontrastu k T-buněčné diferenciaci bylo prokázáno, že miR-181a tlumí expresi některých fosfatáz, v důsledku čehož dochází k pozitivnímu ovlivnění TCR signální kaskády, jak naznačuje obrázek 2. Vzhledem ke skutečnosti, že citlivost TCR hraje klíčovou roli v pozitivní a negativní selekci, předpokládá se zásadní význam této miRNA při navozování autotolerance (10).
Image 2. Role miRNA v regulaci hematopoézy a imunitní odpovědi T-lymfocytů 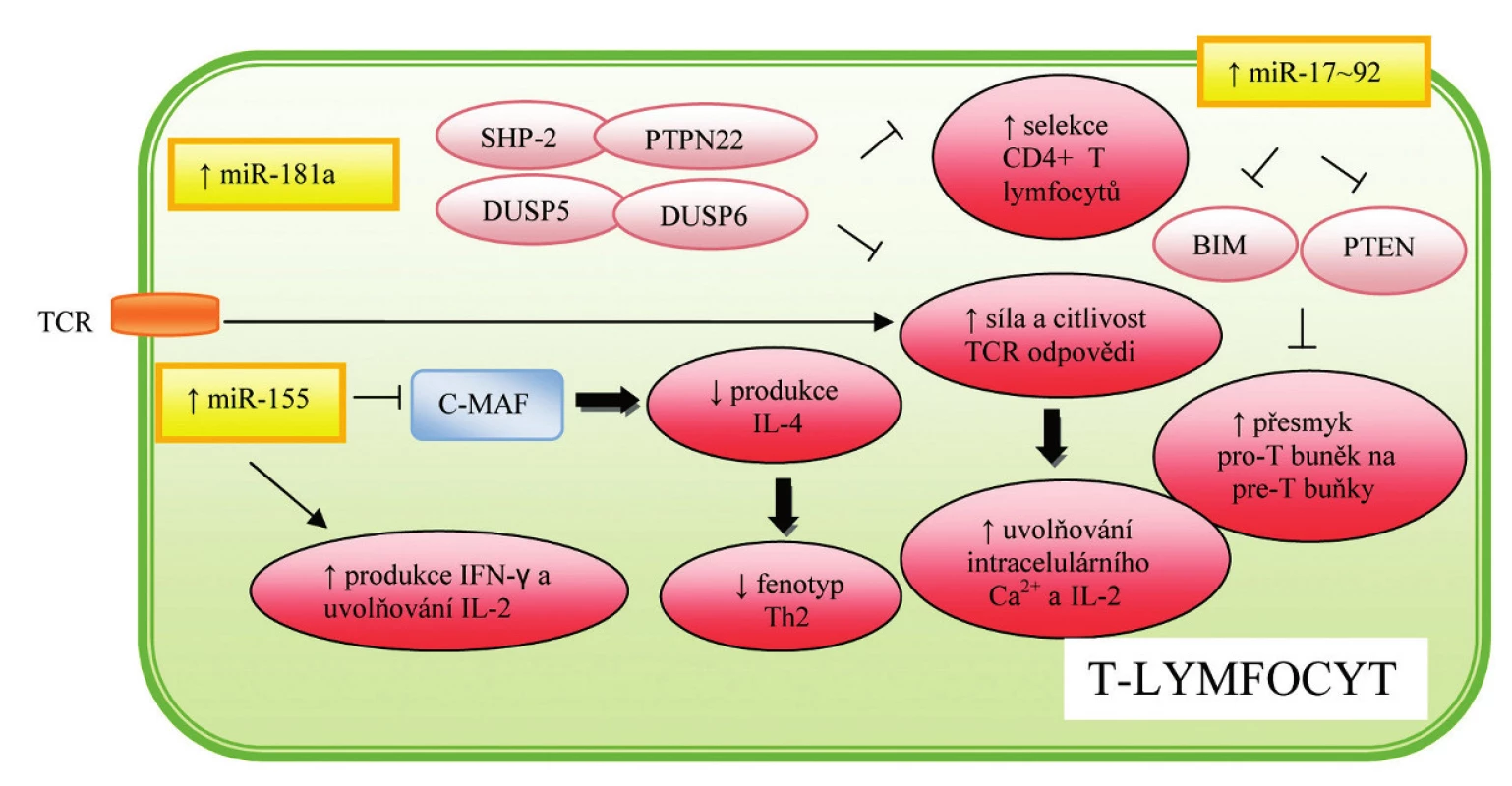
Další miRNA podílející se na vývoji lymfocytů je miR-150, jejíž zvýšená exprese byla pozorována v průběhu dozrávání B - i T-lymfocytů, avšak po aktivaci těchto buněk antigenem došlo k opětovnému snížení. Zároveň byla prokázána výrazně vyšší exprese této miRNA u CD8+ buněk ve srovnání s CD4+ buňkami (11). Lodish et al. (12) ukázal, že zvýšená exprese miR-150 u progenitorových buněk vedla ke sníženému počtu B-buněk ve slezině, lymfatických uzlinách i v periferii, zatímco počty T-lymfocytů a myeloidních buněk zůstaly nezměněny. Následné studie potvrdily, že v důsledku zvýšené exprese této miRNA dochází k zablokování přeměny pro-B buněk na pre-B buňky (12). Naopak snížená či žádná exprese miR-150 byla pozorována u pacientů s CLL (chronická lymfocytární leukémie). Současně bylo prokázáno, že exprese FoxP3 (forkhead box protein 3) u regulačních a aktivovaných T-lymfocytů negativně ovlivňuje expresi této miRNA (13). Přestože je zjevný význam miR-150 ve vývoji buněk imunitního systému, přesný mechanismus působení této molekuly není dosud znám. Hlavním předpokládaným cílem však zůstává transkripční faktor C-MYB, jehož hladiny vykazují ve vztahu k miR-150 opačný trend (14).
Významnou roli ve vývoji buněk imunitního systému hraje klastr sedmi různých miRNA – miR-17-5p, miR-17-3p, miR-18a, miR-19a, miR-20a, miR-19b-1 a miR-92-1, který je označován jako miR-17~92 a je lokalizován na chromozómu 13. Exprese miR-17~92 je maximální u pre-B buněk, kde zodpovídá za inhibici buněčné smrti prostřednictvím suprese pro-apoptotického proteinu BIM, a umožňuje tak přeměnu těchto buněk v pro-B-buňky (15),jak naznačuje obrázek 3. Zároveň bylo popsáno, že zvýšená exprese miR-17~92 vede nejen k nadměrné aktivaci B-buněk, ale i expanzi CD4+ T-buněk a poruchám periferní tolerance, následkem čehož vznikají lymfoproliferativní a autoimunitní onemocnění (16). MiR-17-5p a miR-20a se zároveň podílí na diferenciaci a dozrávání monocytů. Mechanismus účinku spočívá v aktivaci cílového proteinu AML-1, což vede k zvýšené expresi receptorů pro IL 3, M-CSF a GM-CSF (granulocyto-makrofágový kolonie stimulující faktor). Zároveň byla prokázána schopnost AML-1 vázat se na promotor miR-17-5p a miR-20a, čímž je zajištěna regulace celého procesu prostřednictvím negativní zpětné vazby (17), jak je patrné z obrázku 4.
Image 3. Role miRNA v regulaci hematopoézy a imunitní odpovědi B-lymfocytů 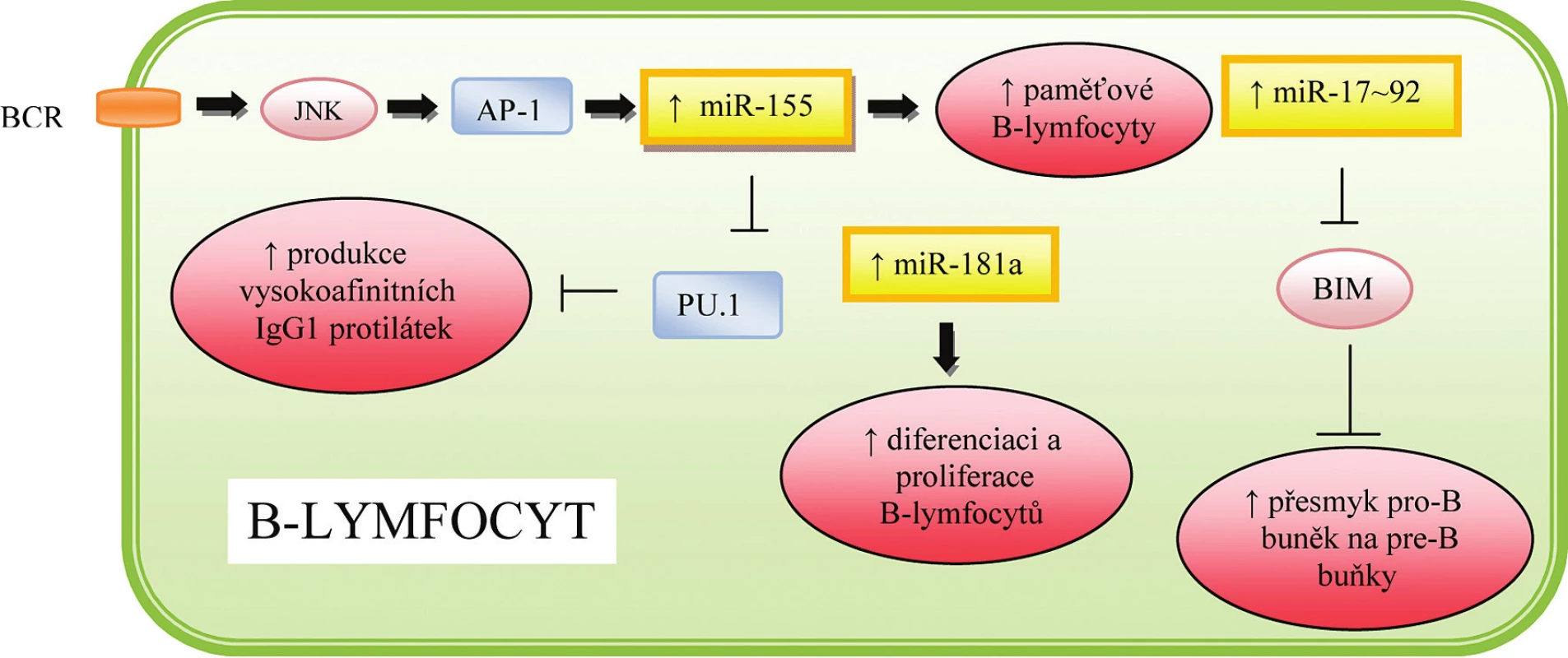
Image 4. Role miRNA v regulaci hematopoézy a imunitní odpovědi monocytů 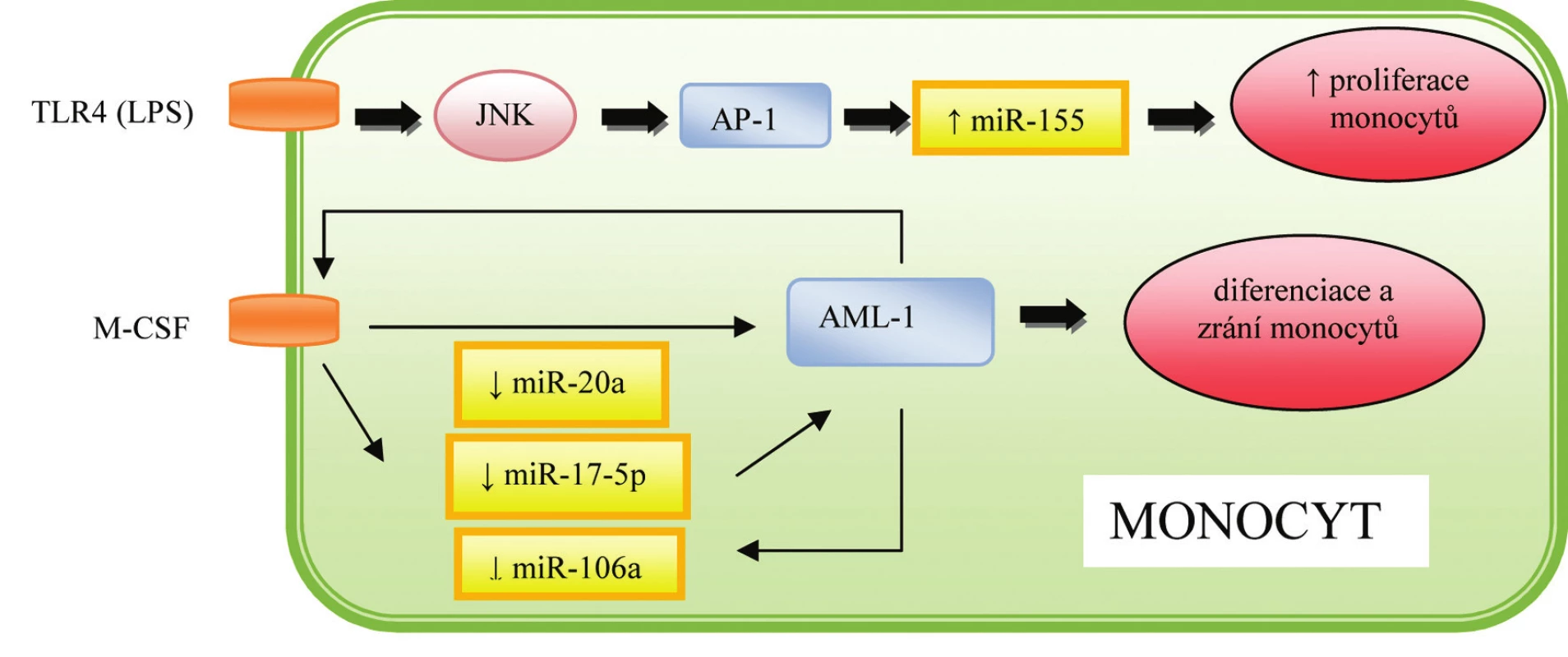
Jednou z prvních miRNA asociovaných s nádorovým onemocněním byla miR-155, jejíž zvýšená exprese byla prokazatelná u B buněčných lymfomů (18). V současné době je tato miRNA považována za jednu z nejvýznamnějších miRNA podílejících se na správné funkci imunitního systému. Rodriguez et al. (19) popsal vazbu miR-155 na transkripční faktor C-MAF, který pozitivně ovlivňuje produkci IL-4, a směřuje tak vývoj T-lymfocytů ve prospěch TH2 dráhy, jak naznačuje obrázek 2. Zdá se tedy, že miR-155 se podílí na regulaci diferenciace T-lymfocytů, a udržuje tak rovnováhu mezi populacemi TH1 a TH2 lymfocytů.
Na vývoji T-lymfocytů a granulocytů se podílí miR-223, která je přednostně exprimována u buněk myeloidní linie. Přestože výzkum využívající myší modely neprokázal vliv této miRNA na diferenciaci myeloidních buněk, pozdější studie potvrdily její roli při regulaci diferenciace a proliferace těchto buněk u lidí. Současně byla zaznamenána zvýšená míra diferenciace T-lymfocytů, což vedlo k názoru, že miR-223 plní různé funkce v závislosti na buněčném typu (11). Fazi et al. (20) popsal zajímavou regulační smyčku vedoucí ke zvýšené diferenciaci granulocytů, která byla pozorována u pacientů s APL (akutní promyeloidní leukémie) léčených kyselinou retinovou. Tato dráha zahrnuje dva známé transkripční faktory – C/EBPα a NFI-A, které se vzájemně střídají ve vazbě na promotor miR-223. Před zahájením diferenciace navázaný NFI-A dovoluje pouze nízkou expresi této miRNA, následně je však vytěsněn druhým transkripčním faktorem – C/EBPα, čímž dochází ke zvýšení celkové exprese a zároveň k zpětnému potlačení exprese NFI-A. Některé studie naznačují, že exprese miR-223 může být rovněž regulována transkripčním faktorem PU.1. Johnnidis et al. (21) dále prokázal negativní roli této miRNA na dozrávání granulocytů. Mechanismus účinku spočívá v supresi IGFR (insulin like growth factor) nebo transkripčního faktoru MEF2C, který zajišťuje proliferaci myeloidních buněk. Funkční studie provedené v roce 2007 v Londýně ukázaly, že se miR-223 nepodílí na fagocytóze, avšak snížená exprese této miRNA vedla k zvýšenému oxidativnímu vzplanutí buněk po kontaktu s antigenem, následkem čehož došlo k vzniku zánětu a destrukci tkání (22). Jednotlivé mechanismy působení miR-223 jsou patrné z obrázku 5.
Image 5. Role miRNA v regulaci hematopoézy a imunitní odpovědi neutrofilů 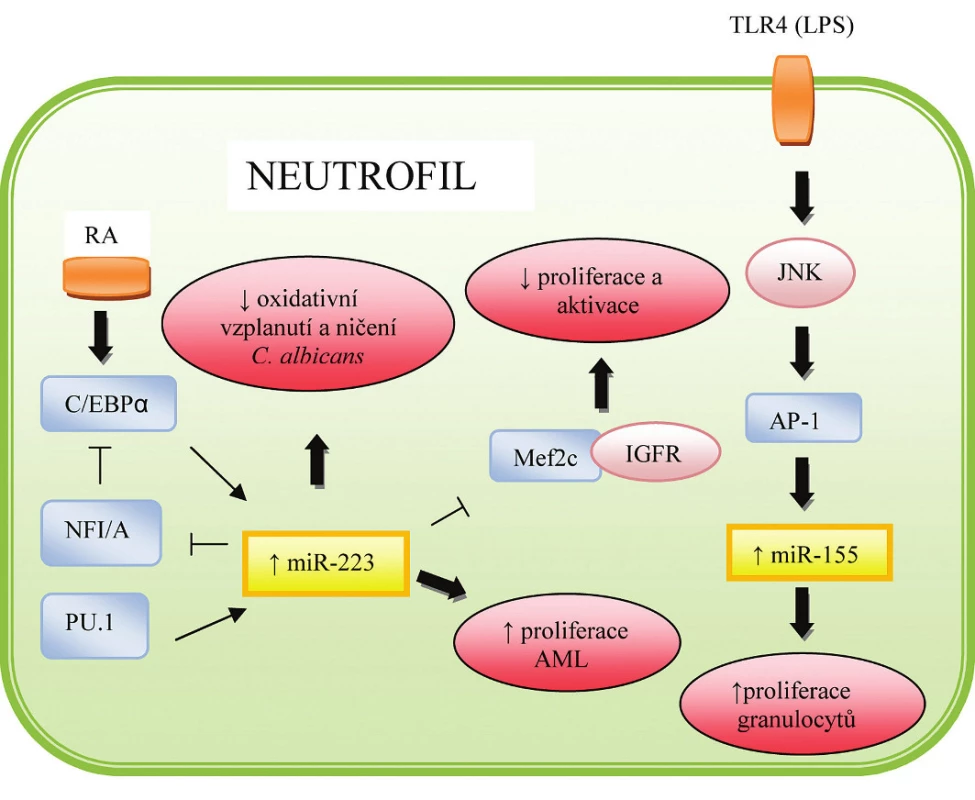
Na regulaci hematopoézy se podílí i mnohé další miRNA, avšak jejich specifická funkce není v současné době známa. Zatímco u dvojitě pozitivních CD4+CD8+ thymocytů byly zaznamenány vysoké hladiny miR-350 a miR-92, u zralých T lymfocytů byla exprese těchto miRNA snížená. Zvýšená exprese miR-669c a miR-297 byla pozorována u CD4+ T buněk, naopak u CD8+ T-buněk byla naměřena významná exprese miR-15b, miR-150, miR-24 a miR-27a. Předpokládá se tedy, že na vývoji efektorových funkcí jednotlivých buněčných typů se podílí odlišné miRNA (23).
MikroRNA a regulace imunitní odpovědi
Procesy vrozené i získané imunitní odpovědi jsou přísně regulovány a podílí se na nich stovky různých genů. První obrannou linií proti patogenům jsou mechanismy nespecifické imunity. Buňky nespecifické imunity rozeznávají patogen prostřednictvím receptorů pro patogenní vzory, mezi něž patří i TLR (Toll-like receptor), jak je znázorněno na obrázku 6. Taganov et al.(24), který pozoroval změny v expresi miRNA u makrofágů vystavených působení LPS (lipopolysacharid), zjistil, že exprese tří miRNA – miR-146, miR-155 a miR-132 – byla výrazně zvýšená.
Image 6. Role miRNA v regulaci imunitní odpovědi makrofágů 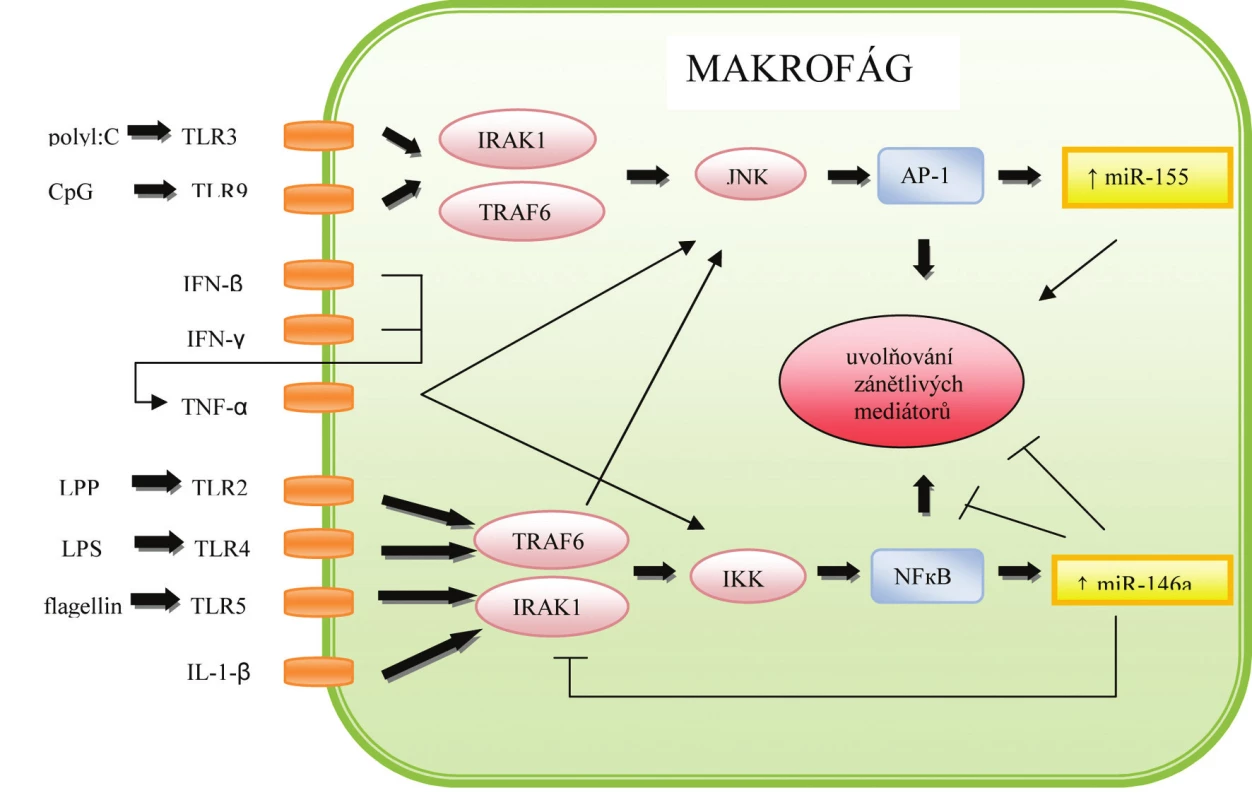
Rodina miR-146 zahrnuje dva členy – miR-146a lokalizovanou na chromozómu 5 a miR-146b na chromozómu 10. Aktivace buněk myeloidní linie některými složkami bakterií a hub, nebo cytokiny TNF-α a IL-1ß přes TLR-2, -4 nebo -5 vedla k zvýšené expresi těchto miRNA. Jako potenciální cíle miR-146a/b byly označeny dva receptory – IRAK1 (IL-1 receptor-associated kinase 1) a TRAF6 (TNF receptor-associated factor 6), které ovlivňují aktivaci molekuly NF-κB a následné uvolňování prozánětlivých cytokinů. Ani v tomto případě není přesný mechanismus působení znám, avšak nejnovější studie předpokládají, že vazba miR-146a/b na tyto receptory umožňuje regulovat TLR signalizaci ve smyslu negativní zpětné vazby, a chrání tak před vznikem nadměrné zánětlivé odpovědi (24).
Opačná situace byla pozorována u již zmiňované miR-155, jejíž exprese byla zvýšená po aktivaci TLR-3, TLR-7 a TLR-9 virovými a bakteriálními produkty, nebo cytokiny s antivirovým účinkem IFN-ß, IFN-γ ve spolupráci s TNF-α. MiR-155 tlumí expresi genů TLR signální kaskády (FADD, IKKε, Ripk1) (25), zároveň však umožňuje zvýšenou translaci TNF α, z čehož vyplývá, že tato miRNA působí jako pozitivní i negativní regulátor vrozené imunitní odpovědi.
MiR-155 ovlivňuje nejen vrozenou, ale i získanou imunitní odpověď, jak je patrné z obrázku 3. Vigorito et al. (26) popsal vliv této miRNA na regulaci izotopového přesmyku a vznik vysokoafinní protilátky IgG1. Mechanismus účinku spočívá v supresi transkripčního faktoru PU.1, který negativně ovlivňuje produkci této protilátky. Zároveň bylo prokázáno, že zvýšená exprese miR-155 podporuje tvorbu paměťových B-buněk, produkci IL-2, IFN-γ a zlepšuje schopnost DC prezentovat antigen T-lymfocytům.
V kontrastu s miR-155, miR-146 a miR-132, Tili et al. (25) popsal sníženou expresi miR-125b u makrofágů vystavených působení LPS. Cílovou molekulou této miRNA je TNF-α. Předpokládá se tedy, že hlavní rolí miR-125b je tlumit produkci tohoto cytokinu v nepřítomnosti mikrobiální infekce.
Hlavní miRNA regulující zánětlivou odpověď je fylogeneticky rozšířená miR-16 nacházející se u monocytů, neutrofilů, B-buněk, CD4+ i CD8+ T-buněk. Jing et al. (27) prokázal, že tato miRNA zodpovídá za rychlou degradaci cytokinů TNF-α, IL-8 a IL-6, u kterých se vyskytují AU sekvence (AREs) v 3‘ nepřekládané oblasti.
Přesné mechanismy účinku většiny miRNA nejsou známy, avšak mnohé studie potvrdily, že hlavními cíli těchto malých molekul jsou transkripční faktory, kofaktory a modifikátory chromatinu, spíše než receptory a jejich ligandy, či zánětlivé mediátory (34). Současné studie hledají transkripční faktory zodpovědné za expresi miRNA, zároveň však usilují o nalezení dalších cílových genů ovlivňovaných těmito molekulami. Krützfeldt et al. (35) prokázal, že inhibitory jednotlivých miRNA, případně jejich náhražky, lze injekčně dopravit do většiny tkání, což vede k novým možnostem v terapii zánětlivých onemocnění, nádorových onemocnění a autoimunitních chorob.
mikroRNA a antivirová imunita
Zatímco některé miRNA chrání před virovými infekcemi, byla potvrzena schopnost některých virů produkovat své vlastní miRNA, které jim poskytují ochranu před imunitním systémem hostitele, zvyšují replikaci, a zajišťují tak jejich celkové přežívání.
V roce 2005 bylo zveřejněno, že miR-32 brání rozvinutí PFV1 infekce prostřednictvím suprese několika různých mRNA tohoto viru (28). Jiné studie prokázaly, že miR-122 nacházející se ve střevních buňkách je nezbytná pro replikaci HCV (viru hepatitidy C). Toto zjištění vedlo také k vývoji terapie založené na inhibici této miRNA (preparát SPC3649). Pedersen et al. (29) ukázal, že pomocí stimulace jaterních buněk IFN-γ dochází k aktivaci 8 různých miRNA (miR-1, miR-30, miR-128, miR-196, miR-296, miR-351, miR-431 a miR-448), které dokáží potlačit replikaci HCV a zároveň snížují expresi miR-122.
Mezi viry produkující své vlastní miRNA jsou řazeny EBV (Epstein-Barr virus), HCMV (lidský cytomegalovirus), HSV-1 (herpes simplex virus 1) a HIV-1(virus lidské imunodeficience typu 1). Zatímco miR-BART2 exprimovaná u EBV podporuje přežívání tohoto viru v latentní formě (30), miR-UL112 produkovaná HCMV snižuje expresi MICB (major histocompatibility complex class-I-polypeptide-related sequence B), která je nezbytná pro rozpoznání infekce NK-buňkami (31). MiR-LAT kódovaná v genomu HSV-1 ovlivňuje funkci TGF-ß a SMAD-3, čímž inhibuje apoptózu a udržuje infekci v latentní formě (32). Triboulet et al. (33) prokázal sníženou expresi miR-17~92 u infekce HIV-1, která je způsobena nedostatečnou funkcí enzymů Dicer a Drosha.
Shrnutí
Přestože byly miRNA objeveny teprve před 15 lety, jejich zapojení do regulace imunitního systému je již dnes zcela prokazatelná.Byla identifikována řada miRNA hrajících významnou roli nejen během vývoje a diferenciace imunocytů, ale i při regulaci vrozené a získané imunitní odpovědi. Vzhledem k metodické obtížnosti genetických modifikací buněk imunitního systému je však v současné době známo pouze malé množství miRNA (miR-181, miR-150, miR-155, miR-223, miR-17~92), u nichž byla mechanisticky prokázána přímá souvislost s regulací hematopoézy a imunitní odpovědi. Význam miRNA v průběhu virové infekce nejlépe dokazuje klinická studie ověřující účinnost preparátu SPC3649, což je anti-miR-122, v terapii HCV. Intenzivní výzkum v oblasti miRNA, který v současné době probíhá, je spojen také s exponenciálním nárůstem počtu odborných sdělení, které snad poskytnou nejen hlubší náhled do jedné z dalších úrovní molekulární podstaty imunitního systému, ale potenciálně také nový terapeutický přístup k léčbě zánětlivých onemocnění, autoimunitních chorob, virových infekcí, vybraných leukémií a hematologických onemocnění.
Zkratky
miRNA / miR – mikroRNA
pri-miRNA – primární mikroRNA
pre-miRNA – prekursorová mikroRNA
TRBP – trans-induced silencing complex
RISC – RNA-induced silencing komplex
Ago – proteiny Argonautové rodiny
3‘ UTR – 3‘ netranslatovaná oblast
RNAi – RNA interference
GWB – GW body
CLL – chronická lymfocytární leukémie
FoxP3 – forkhead box protein 3
GM-CSP – granulocyto-makrofágový kolonie stimulující faktor
APL – akutní promyeloidní leukémie
IGFR – růstový faktor podobný insulinu 1
TLR – Toll-like receptor
LPS – lipopolysacharid
IRAK1 – kináza spojená s receptorem pro IL-1
IL – interleukin
TRAF6 – TNF receptor associated factor 6
TNF – tumor nekrotizující faktor alfa
HCV – virus hepatitidy C
PVF1 – primate foamy virus 1
EBV – virus Epstein-Baarové
HCMV – lidský cytomegalovirus
HSV-1 – herpes simplex virus 1
HIV-1 – virus lidské imunodeficience typu 1
MICB – major histocompatibility complex class-I-polypeptide-related sequence B
Práce byla podpořena projekty MŠMT NPV II 2B06058 a MŠMT NPV II 2B08066.
Autor pro korespondenci:
RNDr. Ondřej Slabý, Ph.D.
Univerzitní centrum buněčné imunoterapie
Kamenice 5, 625 00 Brno
e-mail: oslaby@med.muni.cz
Sources
1. Lee RC, Feinbaum RL, Ambros V. The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14. Cell 1993; 75 : 843–854.
2. Rodriguez A, Griffiths-Jones S, Ashurst JL, Bradley A. Identification of mammalian microRNA host genes and transcription units. Genome Res 2004; 14 : 1902–1910.
3. Lee Y, Ahn C, Han J, et al. The nuclear RNase III Drosha initiates microRNA processing. Nature 2003; 425 : 415–419.
4. Bohnsack MT, Czaplinski K, Gorlich D. Exportin 5 is a RanGTP-dependent dsRNAbinding protein that mediates nuclear export of pre-miRNAs. RNA (NY) 2004; 10 : 185–191.
5. Meister G, Landthaler M, Patkaniowska A, et al. Human Argonaute2 mediates RNA cleavage targeted by miRNAs and siRNAs. Mol Cell 2004; 15 : 185–197.
6. Vasudevan S, Tong Y, Steitz JA. Switching from repression to activation: microRNAs can up-regulate translation. Science (NY) 2007; 318 : 1931–1934.
7. Okamura K, Hagen JW, Duan H, et al. The mirtron pathway generatesmicroRNA class regulatory RNAs in Drosophila. Cell 2007; 130 : 89–100.
8. Yang Z, Jakymiw A, Wood MR, et al. GW182 is critical for the stability of GWbodies expressed during the cell cycle and cell proliferation. J Cell Sci 2004; 117 : 5567–5578.
9. Li QJ, et al. MiR-181a is an intrinsic modulator of T cell sensitivity and selection. Cell 2007; 129, 147–161.
10. Chen CZ, Li L, Lodish HF, Bartel DP. MicroRNAs modulate hematopoietic lineage differentiation. Science (NY) 2004; 303 : 83–86.
11. Cobb BS, Hertweck A, Smith J, O’Connor E, et al. A role for Dicer in immune regulation. J Exp Med 2006; 203 : 2519–2527.
12. Zhou B, Wang S, Mayr C, Bartel DP, Lodish HF. MiR-150, a microRNA expressed in mature B and T cells, blocks early B cell development when expressed prematurely. Proc Natl Acad Sci USA 2007; 104 : 7080–7085.
13. Pillai V, Ortega SB, Wang CK, Karandikar NJ. Transient regulatory T-cells: a state attained by all activated human T-cells. Clin Immunol 2007; 123 : 18–29.
14. Xiao C, Calado DP, Galler G, Thai TH, Patterson HC, Wang J, et al. MiR-150 controls B cell differentiation by targeting the transcription factor c-Myb. Cell 2007; 131 : 146–159.
15. Ventura A, et al. Targeted deletion reveals essential and overlapping functions of the miR-17 through 92 family of miRNA clusters. Cell 2008; 132 : 875–886.
16. Xiao C, Srinivasan L, Balado DP, et al. Lymphoproliferative disease and autoimmunity in mice with increased miR-17-92 expression in lymphocytes. Nat Immunol 2008; 9 : 405–414.
17. Fontana L, et al. MicroRNAs 17-5p-20a-106a control monocytopoiesis through AML1 targeting and M-CSF receptor upregulation. Nat Cell Biol 2007; 9 : 775–787.
18. Kluiver J, et al. BIC and miR-155 are highly expressed in Hodgkin, primary mediastinal and diffuse large B cell lymphomas. J Pathol 2005; 207” 243–249.
19. Rodriguez A, et al. Requirement of bic/microRNA-155 for normal immune function. Science (NY) 2007; 316 : 608–611.
20. Fazi F, et al. A minicircuitry comprised of microRNA-223 and transcription factors NFI-A and C/EBPalpha regulated human granulopoiesis. Cell 2005; 123 : 819–831.
21. Johnnidis JB, et al. Regulation of progenitor cell proliferation and granulocyte function by microRNA-223. Nature 2008; 451 : 1125–1129.
22. Moschos SA, et al. Expression profiling in vivo demonstrates rapid changes in lung microRNA levels following lipopolysaccharideinduced inflammation but not in the anti inflammatory action of glucocorticoids. BMC Genomics 2007; 8 : 240.
23. Neilson JR, Zheng GX, Burge CB, Sharp PA. Dynamic regulation of miRNA expression in ordered stages of cellular development. Genes Dev 2007; 21 : 578–589.
24. Taganov KD, et al. NF-kappaB-dependent induction of microRNAmiR-146, an inhibitor targeted to signaling proteins of innate immune responses. Proc Natl Acad Sci USA 2006; 103 : 12481–12486.
25. Tili E, et al. Modulation of miR-155 and miR-125b levels following lipopolysaccharide/TNF-alpha stimulation and their possible roles in regulating the response to endotoxin shock. J Immunol 2007; 179 : 5082–5089.
26. Vigorito E, et al. MicroRNA-155 regulates the generation of immunoglobulin class-switched plasma cells. Immunity 2007; 27 : 847–859.
27. Jing Q, et al. Involvement of microRNA in AU-rich elementmediated mRNA instability. Cell 2005; 120 : 623–634.
28. Lecellier CH, Dunoyer P, Arar K, et al. A cellular microRNA mediates antiviral defense in human cells. Science 2005; 308 : 557–560.
29. Pedersen IM, Cheby G, Wieland S, et al. Interferon modulation of cellular microRNAs as an antiviral mechanism. Nature 2007; 449 : 919–922.
30. Pfeffer S, et al. Identification of microRNAs of the herpesvirus family. Nat. Methods 2005; 2 : 269–276.
31. Stern-Ginossar N, et al. Host immune system gene targeting by a viral miRNA. Science 2007; 317 : 376–381.
32. Gupta A, et al. Anti-apoptotic function of a microRNA encoded by the HSV-1 latencyassociated transcript. Nature 2006; 442 : 82–85.
33. Triboulet R, et al. Suppression of microRNA-silencing pathway by HIV-1 during virus replication. Science 2007; 315 : 1579–1582.
34. Asirvatham AJ, et al. MicroRNA targets in immune genes and the Dicer/Argonaute and ARE machinery components. Mol. Immunol. 2008; 45 : 1995–2006.
35. Krützfeldt J, et al. Silencing of microRNAs in vivo with antagomirs. Nature 2005; 438 : 685–689.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Zadluženost lidí s návykovými nemocemi je zdravotní i společenský problém
- HOX geny a vývoj končetin v klinické medicíně i v experimentu
- Role mikroRNA v imunitním systému
- Mužská plodnost a onkologická léčba
- Edukace u schizofrenie: Jak pacienti a příbuzní hodnotí program prevence relapsu PREDUKA
- Posuzování zdravotního stavu a pracovní schopnosti u duševních poruch a poruch chování
- Globální evropská síť pro léčbu alergií a astmatu (GA2LEN) se zabývá epidemií alergií a astmatu
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Mužská plodnost a onkologická léčba
- Edukace u schizofrenie: Jak pacienti a příbuzní hodnotí program prevence relapsu PREDUKA
- Posuzování zdravotního stavu a pracovní schopnosti u duševních poruch a poruch chování
- HOX geny a vývoj končetin v klinické medicíně i v experimentu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

