-
Medical journals
- Career
Je stanovení sérového kreatininu vždy věrohodné? Úskalí preanalytické fáze
Authors: K. Kotaška; B. Jedličková; R. Průša
Authors‘ workplace: Ústav klinické biochemie a patobiochemie 2. LF UK a FNM, Praha
Published in: Čas. Lék. čes. 2008; 147: 392-395
Category: Case Report
Overview
Kreatinin je stanovován v séru a v moči chemickými a enzymovými metodami. Chemické metody jsou založené na reakci kreatininu s kyselinou pikrovou v alkalickém prostředí (Jaffého reakce). Stanovení ruší řada interferujících látek (kyselina askorbová, bilirubin, bílkoviny, ketony, cefalosporiny a jiné léky). Chemické i enzymatické metody stanovení mají srovnatelnou přesnost. Enzymatické metody mohou pracovat s menším objemem vzorku, jsou dražší než chemické metody a nejsou tak náchylné k interferencím. Kazuistika popisuje neobvyklý případ lékové interference s enzymatickou kreatindeaminázovou metodou. Významnou roli při stanovení kreatininu hrají biologické vlivy (denní rytmus, těhotenství, hemodialýza, transplantace, stres, nadměrné cvičení), analytické a preanalytické interference (pH, glukóza, pyruvát, bilirubin, mastné kyseliny, vliv skladování a gelových separátorů). Velký význam hraje i biologická variabilita samotného kreatininu.
Klíčová slova:
kreatinin, biologická variabilita, interference.Kreatinin (2-imino-1-metylimidazolin-4-on) vzniká dehydratací kreatinu, který je uvolňován z kreatinfosfátu při svalové činnosti. Koncentrace v krvi je úměrná svalové hmotě a nepodléhá větším změnám s výjimkou onemocnění ledvin, kdy vzrůstá. Kreatinin je bezprahově vylučován močí, a je tedy využíván k vyšetření funkce ledvin (kreatininová clearance). Kreatinin je stanovován v séru a v moči prakticky výhradně chemickými a enzymovými metodami. Metody chemické jsou založeny na modifikacích Jaffého reakce vycházející s reakce kreatininu s kyselinou pikrovou v alkalickém prostředí. Po deproteinaci vzniká červený reakční produkt, jehož absorbance se měří při 510 nm. Problémem Jaffého reakce je nespecifita. Stanovení ruší řada interferujících látek (bílkoviny, ketony, ketokyseliny, glukóza, bilirubin, cefalosporiny, mastné kyseliny, pyruvát, kyselina askorbová), významnou roli hrají také vliv pH (v silně alkalickém prostředí reaguje hydroxylový anion s kreatininem i s pikrátem, což vede k rychlejší reakci, ale zároveň k rychlejšímu rozpadu barevného komplexu), teplota (reakční rychlost v intervalu 20–40 °C o 30–60 %/10 °C, termochromní odezva je při 490 nm 3× vyšší než při 500 nm a 15× vyšší než při 520 nm) a časový interval měření (interferenty zvyšují nebo snižují rychlost vzniku Janovského komplexu). Obecně se doporučuje měřit 20–80 sekund od startu reakce. Délka měření nesmí být příliš krátká, protože přírůstek absorbance je malý (1).
Enzymatické metody jsou založeny na kaskádě enzymových reakcí. V prvním kroku je kreatinin převeden na kreatin, který je pak převáděn sledem enzymatických reakcí na konečné produkty (NAD, peroxid vodíku), které jsou pak stanoveny fotometrickou reakcí (1).
Chemické metody založené na Jaffého reakci i enzymatické metody vykazují srovnatelnou přesnost (analytický variační koeficient 2 %, přesnost mezi sériemi 3–5 %). Jaffého metoda je levnější oproti enzymatickým metodám. Enzymatické metody mohou pracovat s menším množstvím vzorku a nejsou tolik ovlivněny analytickými interferencemi jako metody chemické (1).
Kazuistika
Muž, 73 let, u kterého byla před 5 lety provedena jednostranná nefrektomie, byl přijat na chirurgické oddělení s bolestmi břicha a byla diagnostikována akutní pankreatitida. Laboratorní vyšetření séra ukázalo při diuréze 2600 ml/24 hodin vysoké hodnoty urey (22,5 mmol/l) a významně sníženou hladinu sérového kreatininu stanoveného enzymatickou metodou využívající technologii suché chemie na principu kreatindeaminázové reakce (22 μmol/l), což neodpovídalo klinickému stavu pacienta. Vzhledem k tomu, že pacient byl po nefrektomii, předpokládala se spíše zvýšená hladina sérového kreatininu. Sérový kreatinin byl opakovaně vyšetřen Jaffého chemickou metodou a byla stanovena hodnota 176 μmol/l, která korelovala s klinickým stavem pacienta. Pacient dostával vysoké dávky 3 × 5 ml i.v. v pomalé infuzi spazmoanalgetika Algifen (BB Pharma, a.s.) obsahujícího 500 mg/ml metamizolu. Vzhledem k významně odlišným hodnotám sérového kreatininu stanoveného Jaffého chemickou a enzymatickou metodou bylo vysloveno podezření na interferenci metamizolu při stanovení kreatininu enzymatickou metodou. Podobně odlišné výsledky koncentrací sérového kreatininu stanoveného enzymatickou kreatindeaminázovou metodou a chemickou metodou byly nalezeny i u několika dalších pacientů, kterým byl podáván metamizol (pacient 1: enzymatický kreatinin 7 μmol/l vs. kreatinin Jaffé 45 μmol/l; pacient 2: enzymatický kreatinin 22 μmol/l vs. kreatinin Jaffé 176 μmol/l; pacient 3: enzymatický kreatinin 36 μmol/l vs. kreatinin Jaffé 111 μmol/l; pacient 4: enzymatický kreatinin 26 μmol/l vs. kreatinin Jaffé 96 μmol/l; pacient 5: enzymatický kreatinin 52 μmol/l vs. kreatinin Jaffé 101 μmol/l).
Interference vysokých dávek metamizolu s enzymatickým stanovením kreatininu byla potvrzena přidáváním metamizolu o různých koncentracích do vzorku o známé koncentraci sérového kreatininu stanovené chemickou a enzymatickou metodou. Bylo zjištěno, že se vzrůstající koncentrací metamizolu přidávanou do vzorku o známé koncentraci sérového kreatininu dochází u kreatininu stanovovaného enzymatickou metodou k významnému poklesu hodnot (tab. 1).
Table 1. Přehled přidaných koncentrací metamizolu do vzorku o známé koncentraci kreatininu 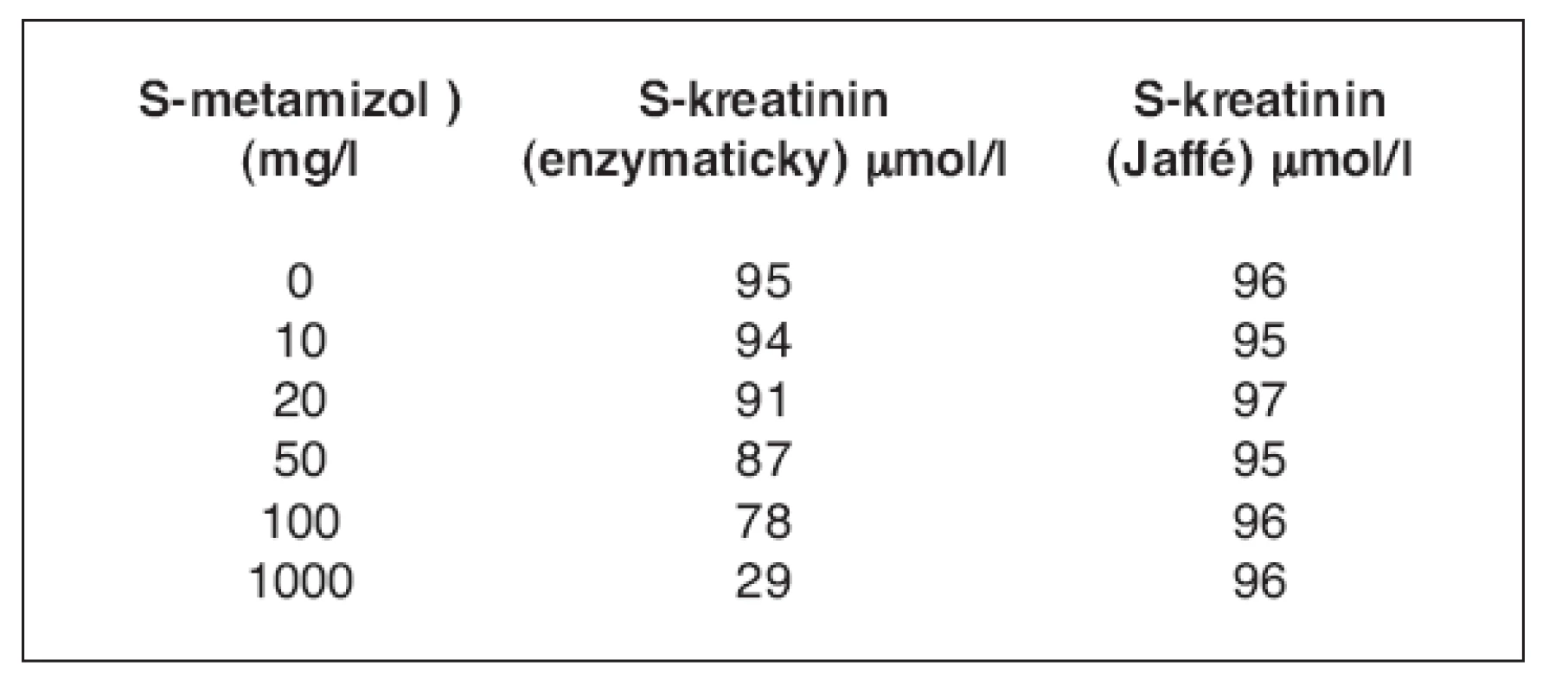
Diskuze
Kazuistika popisuje neobvyklý případ interference léčiva (metamizol) s enzymatickým stanovením sérového kreatininu kreatindeaminázovou reakcí. V praxi jsou významně častější lékové interference při stanovení kreatininu Jaffého metodou. Přehled lékových interferencí popsaných u Jaffého metody je shrnut v tabulce 2.
Table 2. Přehled lékových interferencí u kreatininu stanovovaného Jaffého metodou (4) 
Stanovení kreatininu je zatíženo řadou biologických a preanalytických faktorů. Biologické faktory mající významný vliv na stanovení kreatininu jsou shrnuty v tabulce 3. Přehled preanalytických faktorů je shrnut v tabulce 4.
Table 3. Biologické faktory ovlivňující stanovení kreatininu (1, 5) 
Table 4. Preanalytické faktory stanovení kreatininu (1, 5) 
Biologická variabilita kreatininu je významným faktorem majícím vliv na stanovení. Celková biologická variabilita kreatininu (CVc) vypočtená jako druhá odmocnina kovariance intraidividuální (CVi)a biologické variability (CVG) je:
CVC = √(CVi2 + CVG2) = 13,6 %.
Hodnoty CVi a CVG jsou převzaty z analytických kritérií klinické použitelnosti pro stanovení kreatininu v krevním séru publikovaných ve studiích (2, 3), kde CVi je 4,3 % a CVG je 12,9 %.
Významnou charakteristikou biologické variability kreatininu je kritická diference dvou po sobě následujících stanovení kreatininu, o nichž předpokládáme, že pochází z normálního rozložení dat. Kritická diference (KD) je definována jako ještě analyticky definovatelné minimální množství, které způsobí významné klinické rozdíly na hladině pravděpodobnosti 95 %. KD se vypočte podle vztahu:
KD = 2,77 √(CVa2 + CVi2),
kde CVa je analytický variační koeficient a CVi je intraindividuální biologická variabilita. Hodnota CVa pro kreatinin vychází z výsledků ve studiích (2, 3),kde CVa = 2,2 %.
Dosadíme-li do vztahu pro KD hodnoty CVa a CVi, pak pro kreatinin dostaneme hodnotu 13,4 %. To znamená, že například stanovíme-li hladinu kreatininu v prvním měření 100 μmol/l a ve druhém měření 110 μmol/l (nárůst koncentrace o 10 %), pak lze říci, že nedošlo ke klinicky významné změně, protože nárůst koncentrace o 10 % nepředstavuje klinicky významnou změnu. Klinicky významnou změnu by představovala koncentrace kreatininu lišící se od původní hodnoty o hodnotu větší, než je KD, tedy o 13,4 %.
Závěr
Při stanovení koncentrací kreatininu v séru a v moči hraje významnou roli řada analytických, preanalytických a biologických faktorů, které mohou mít vliv na konečnou koncentraci kreatininu. Významnou roli hraje i biologická variabilita samotného kreatininu.
Zkratky
CVa – analytický variační koeficient
CVi – intraindividuální variační koeficient
CVG – interindividuální variační koeficient
CVC – celková biologická variabilita
EDTA – etylendiamintetraoctová kyselina
HD – hemodialýza
KD – kritická diference
NAD – nikotinamidadenindinukleotid
Ing. Karel Kotaška, Ph.D.
Ústav klinické biochemie a patobiochemie 2. LF UK a FNM
V Úvalu 84, 150 06 Praha 5
fax: +420 224 435 320, email: kotaska@email.cz
Sources
1. Burtis, C. A., Ashwood E. R.: Tietz Textbook of Clinical Chemistry, 3rd Edition, WB Saunders, Philadelphia, 1997, 1900 s.
2. Ricós C., Alvarez V., Cava F. et al.: Current databases on biologic variation pros, cons, and progress. Scand. J. Clin. Lab. Invest., 1999, 59, s. 491–500.
3. Fraser C. G.: Biological Variation from principles to practice. AACC Press© 2001.
4. Chronolab, The Quality of Diagnostic Samples, Chronolab AG, Switzerland 2000–2007 (CD-ROM).
5. Young, D. S.: Effects of Preanalytical Variables on Clinical Laboratory Tests, 2nd Edition, AACC Press©, 1997.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Je stanovení sérového kreatininu vždy věrohodné? Úskalí preanalytické fáze
- Expoziční test ve stanovení diagnózy potravinové alergie – orální alergický syndrom
- Změny v genové expresi během inzulínové rezistence a „diabezity“ v inzulín-senzitivních tkánícha možnosti jejich regulace
- Biologická a nebiologická eliminační léčba akutního selhání jater Experimentální práce na velkém laboratorním zvířeti
- Vztah inzulínové rezistence a množství viscerálního tuku
- Využitie profilov génovej expresie k stanoveniu odpovedi k neoadjuvantnej konkomitantnej chemorádioterapii u pacientov s karcinómom rekta: pilotná štúdia
- Poruchy chování u sedmiletých dětí – výsledky studie ELSPAC3. Vývoj v období po narození*
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Expoziční test ve stanovení diagnózy potravinové alergie – orální alergický syndrom
- Je stanovení sérového kreatininu vždy věrohodné? Úskalí preanalytické fáze
- Vztah inzulínové rezistence a množství viscerálního tuku
- Poruchy chování u sedmiletých dětí – výsledky studie ELSPAC3. Vývoj v období po narození*
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

