-
Medical journals
- Career
Gastrointestinální a jaterní projevy nemocí přenášených klíšťaty
Authors: Mária Budzáková 1; Jan Trna 1,2
Authors‘ workplace: Interní oddělení Nemocnice Boskovice 1; Gastroenterologické oddělení MOÚ Brno 2
Published in: Vnitř Lék 2020; 66(4): 232-235
Category:
Overview
V rámci diferenciální diagnostiky gastrointestinálních (GIT) a jaterních potíží je pouze výjimečně zvažována jejich příčinná souvislost s chorobami přenášenými klíšťaty. Vzhledem k tomu, že Česká republika patří pro řadu těchto chorob mezi endemické oblasti, je nutné při GIT potížích nejasné etiologie zvažovat i tuto možnost. Tento článek popisuje GIT a jaterní projevy chorob v České republice častých (především lymeská borrelióza, méně ehrlichióza a tularémie) a dále zmiňuje i choroby typické spíše pro jiné geografické oblasti (horečka Skalistých hor, Koloradská klíšťová horečka, recidivující horečka přenášená klíšťaty, Q horečka a babesióza). Lymeská borrelióza vyvolává nespecifické GIT potíže relativně často, často též vede k elevaci funkčních jaterních testů (JT). Jak GIT, tak jaterní postižení může výjimečně probíhat dramaticky, obecně je však prognóza při antibiotické terapii dobrá. Lymeská borrelióza by tudíž měla být součástí diferenciální diagnózy u pacientů z endemických oblastí výskytu klíšťat, s elevací JT, nevysvětlitelných dyspeptických potíží, a to bez ohledu na přítomnost erythema migrans. Ehrlichióza by měla být zvažována především v rámci diferenciální diagnostiky akutního febrilního onemocnění s GIT symptomy (především průjmy), zejména pokud je přítomna leukopenie/trombocytopenie a/nebo elevace aminotransferáz. Na tularémii je potřeba pomýšlet jako vzácnou příčinu nejasné cholestatické hepatopatie, zvláště u pacientů s anamnézou přisátí klíštěte. Obecně lze poukázat na nutnost důkladného odběru anamnézy, včetně cíleného dotazu na přisátí klíštěte, i v případě tak zdánlivě nesouvisejících potíží, jako jsou GIT a jaterní symptomy.
Klíčová slova:
babesióza – Koloradská klíšťová horečka – ehrlichióza – horečka Skalistých hor – jaterní choroby – lymeská borrelióza – příznaky – Q horečka – recidivující horečka přenášená klíšťaty – trávicí trubice – tularémie – symptomy
Úvod
V rámci diferenciální diagnostiky gastrointestinálních (GIT) a jaterních potíží etiologicky obvykle zvažujeme běžná infekční agens, idiopatické střevní záněty, malabsorpční stavy, nádory, komplikace léčby antibiotiky či jinými léky a řadu dalších možností. Existují však infekční onemocnění, která primárně nejsou spojena s postižením gastrointestinálního traktu, ale přesto jej relativně často negativně ovlivňují. Mezi tyto choroby, které bývají při diferenciální diagnostice GIT potíží opomíjeny, patří i nemoci přenášené klíšťaty. Tímto přehledovým článkem bychom chtěli připomenout, že v případě nejasných GIT potíží u lidí žijících nebo procházejících endemickými oblastmi (zejména s anamnézou přisátí klíštěte), bychom měli zvažovat i možnost nemocí přenášených klíšťaty. Pokud jsou tyto potenciálně závažné nemoci zjištěny brzy, lze je účinně léčit a předejít chronickým potížím a případně i smrti.
Klíšťata prokazatelně přenáší celou řadu virových, protozoálních a bakteriálních chorob. V této publikaci se zmíníme o 8 z nich, které jsou v různé míře spojeny s GIT či jaterními projevy. Blíže tak budou popsány GIT a jaterní projevy lymeské borreliózy, ehrlichiózy, horečky Skalistých hor (Rocky mountain spotted fever – RMSF), tularémie, Koloradské klíšťové horečky (Colorado tick fever – CTF), recidivující horečky přenášené klíšťaty (tick‑borne relapsing fever – TBRF), Q horečky a babesiózy. Souhrn četností GIT a jaterních symptomů u jednotlivých chorob je uveden v Tab. 1.
Table 1. Souhrn četnosti GIT a jaterních symptomů u jednotlivých chorob, upraveno podle (20) 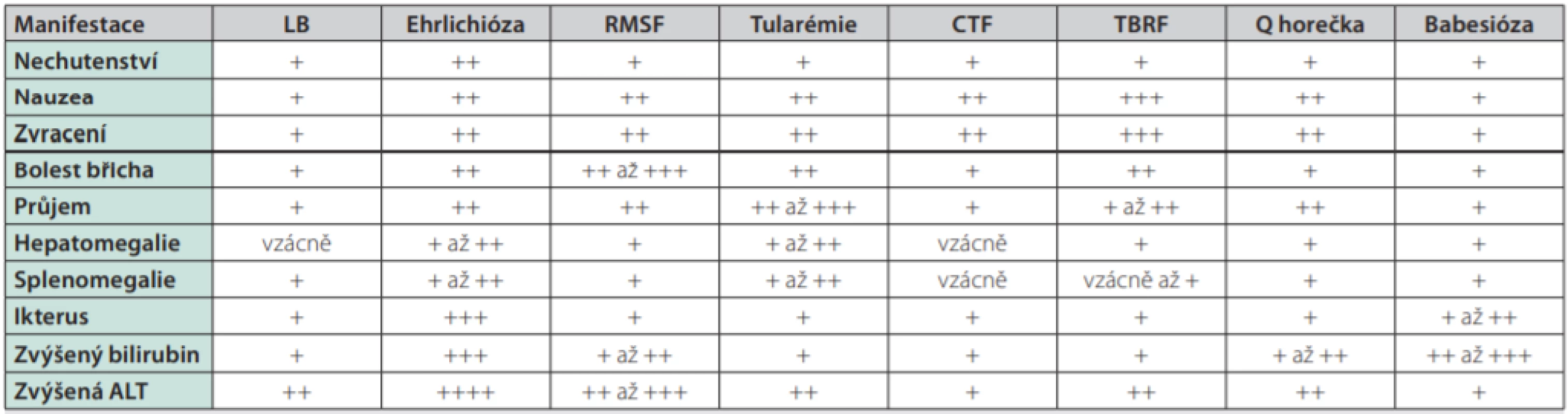
( LB – lymeská borrelióza, RMSF – horečka Skalistých hor , CTF – Koloradská horečka, TBRF – Recidivující horečka přenášená klíšťaty), upraveno podle (13, 20) Lymeská borrelióza
Jedná se o onemocnění, jehož původcem jsou bakterie rodu Borrelia. Vyskytuje se především v oblasti mírného pásma severní polokoule. Česká republika (ČR) je svým geografickým charakterem velmi vhodným biotopem pro výskyt nejčastějšího typu přenašeče – klíštěte Ixodes ricinus. Z onemocnění přenášených klíšťaty proto dominuje právě lymeská borrelióza (LB), jejíž výskyt navíc dle některých zdrojů stoupá (1).
Zastoupení gastrointestinálních příznaků u LB je variabilní, údaje z ČR nejsou k dispozici, jejich četnost a souvislost s LB je navíc v běžné klinické praxi pravděpodobně podceňována. Dle údajů získaných ve Spojených státech amerických (USA) (studie zahrnující 314 pacientů v časném stadiu borreliózy) jsou nespecifické GIT potíže časté – anorexie byla přítomna u 23 % pacientů, nauzea u 17 %, vomitus u 10 %, bolesti břicha u 8 %, hepatomegalie byla detekována u 5 % pacientů s časnou LB, splenomegalie pak u 6 % a průjmem trpěla 2 % pacientů s LB (2). Kazuisticky jsou popsány i případy poruchy pasáže charakteru pseudoobstrukce refrakterní ke konzervativní léčbě, kdy po komplexním vyšetření byla diagnostikována lymeská neuroborrelióza a stav odezněl po cílené antibiotické terapii (3).
Relativně často nacházíme při LB laboratorní známky hepatopatie. Elevace JT bývá přítomna dle některých studií u 10–27 % pacientů (4). V další studii hodnotící 115 pacientů s LB mělo gastrointestinální symptomy 30 % pacientů, elevaci alespoň jednoho JT 40 % pacientů, s nejčastější elevací gamaglutamyltransferázy (GGT) (28 % pacientů) a alaninaminotransferázy (ALT) (27 % pacientů) (5). Podobně vysoké procento (43,2 %) pacientů s LB a elevovanými JT prokázala i studie publikovaná v roce 2014 (6). Abnormální nálezy JT jsou spojené spíše s diseminovanou formou LB než u lokalizované formy (66 % vs. 34 %) (5). Prognóza těchto pacientů je při správné antibiotické terapii dobrá. JT dle studií s follow‑up pacientů klesají během 2–4 týdnů od zahájení léčby (5, 7). Nicméně byly popsány i případy těžkého fatálního poškození jater (8).
Použitelnost výše uvedeného v podmínkách ČR je komplikovaná nedostatkem recentních dat a především dat z Evropy. Zatímco v USA je původcem LB především Borrelia burgdorferi sensu stricto, tak v Evropě jsou nejčastějšími původci Borrelia garinii a Borrelia afzelii. Borrelia burgdorferi sensu stricto je ve studiích z Evropy uváděna většinou jako 3. nejčastější (9, 10). Řada studií prokazuje poněkud odlišný klinický obraz LB v závislosti na vyvolávajícím agens, nicméně klinické projevy se mezi jednotlivými podtypy výrazně překrývají (11, 12). Data zabývající se rozdíly v četnosti postižení GIT a jater mezi jednotlivými podtypy borrelií pak v moderní literatuře chybí úplně a tato oblast je tudíž potenciální vhodnou oblastí výzkumu. Dalším teoreticky možným vysvětlením rozdílů v četnosti GIT a jaterních projevů mezi USA a Evropou by mohla být koinfekce borreliemi a ehrlichiemi. Nicméně množství klíšťat infikovaných ehrlichiemi a stejně tak množství klíšťat s duální a vícečetnou nákazou kolísá jak v Evropě, tak v USA v jednotlivých studiích ve velmi širokém rozmezí a nelze jednoznačně říci, že by tato situace byla zásadně častější v USA (13–15).
Patogeneze poškození jater u pacientů s LB představuje souhru přímé jaterní invaze spirochetou a imunologických odpovědí. Bylo prokázáno, že Borrelia burgdorferi proniká cévními endotelovými buňkami in vitro (16), spirochety byly prokázané v jaterních sinusoidách a parenchymu jater (17). K pokračujícímu jaternímu poškození může vést zkřížená imunologická reakce mezi antigenními komponentami borrelií a hepatocytů (18). Vzácně může LB vyústit v granulomatózní hepatitidu (19). Popsaný případ dokumentuje rozvoj dyspepsií a histologicky verifikované granulomatózní hepatitidy s nálezem spirochet v jaterní tkáni u pacientky s dlouhodobě neléčenou LB. Podle některých autorů je zapříčiněno borreliovou infekcí asi 10 % všech hepatocelulárních lézí, považovaných za infekční hepatitidy sérologicky nezařaditelné.
Diagnóza LB by měla být součástí diferenciální diagnózy u pacientů z endemických oblastí výskytu klíšťat a s elevací JT, nevysvětlitelných dyspeptických potíží, a to bez ohledu na přítomnost nebo nepřítomnost erythema migrans (20).
Ehrlichióza
Do diferenciální diagnostiky nemocí přenášených klíšťaty přibyla v ČR v posledních letech ehrlichióza. Je způsobená dvěma typy bakterií‑rickettsií. Jednou z nich je Ehrlichia chaffeensis, která vede k postižení monocytů, hovoříme pak o lidské monocytární ehrlichióze, a druhou je Anaplasma (dříve Ehrlichia) phagocytophila vyvolávající lidskou granulocytární ehrlichiózu. Jsou zaznamenány případy pacientů se souběžným nálezem borrelií a ehrlichií. Onemocnění se projevuje chřipkovými příznaky, artralgiemi, myalgiemi, někdy kožními projevy, případně průjmem či lymfadenopatií (21). Laboratorně bývají zvýšené sérové aminotransferázy (přítomno až u 80 % pacientů) a pancytopenie (22). GIT potíže jsou většinou nespecifické a zahrnují nauzeu, zvracení, průjmy (u asi 10 % pacientů, může být i primárním projevem) a bolesti břicha (20, 23). Potíže většinou odeznívají bez následků, nicméně byly popsány i případy s vážným GIT krvácením a úmrtím v souvislosti s trombocytopenií (24). Též byly popsány případy hepatopatie progredující až do stadia jaterního selhání, upravujícího se až po cílené antibiotické terapii (25).
Na patogenezi poškození jater se podílí proliferace bakterií v hepatocytech vedoucí k přímému poškození a sekundárně též další poškození stimulací imunologických a nespecifických zánětlivých mechanismů. Spektrum histologického poškození kolísá od fokální jaterní nekrózy až po tvorbu granulomů a cholestatickou hepatitidu (26).
V endemických oblastech by ehrlichióza měla být součástí diferenciální diagnostiky akutního febrilního onemocnění s GIT symptomy (především průjmy), zejména pokud je přítomna leukopenie/trombocytopenie a/nebo elevace aminotransferáz. Progresi k multiorgánovému selhání a smrti lze předejít včasným klinickým podezřením a včasnou léčbou doxycyklinem (20).
Horečka Skalistých hor (Rocky mountain spotted fever – RMSF)
RMSF je nejčastější rickettsiální onemocnění v Severní a Střední Americe (27). Původcem je bakterie Rickettsia rickettsii a přenášečem jsou klíštata Dermacentor variabilis a Dermacentor andersoni. Bývá považována za rickettsiální chorobu s nejtěžším průběhem, která může končit fatálně (28). Choroba se v prvních dnech manifestuje dokonce častěji gastrointestinálními symptomy, než typickou vyrážkou (tmavá, někdy až krvavá, začínající na zápěstích a kolem kotníků a postupně se šířící po celém těle), která dala chorobě jméno. GIT obtíže jsou přítomny u asi 80 % pacientů a zahrnují nevolnost, zvracení, průjem (asi u 1/3 případů, může se jednat o první příznak) a bolest břicha. Potíže bývají výrazné a náhlé, a jsou proto popsány i případy, kdy došlo k záměně za akutní apendicitidu či akutní cholecystitidu (29). U některých pacientů došlo k masivnímu krvácení do horního GIT (30). Laboratorně bývá přítomna elevace aminotransferáz a ojediněle ikterus, který lze považovat za prediktor nepříznivého průběhu choroby (31). Prokazatelné bývá i postižení pankreatu a projevy vaskulitidy (32).
Nejpravděpodobnějším patofyziologickým mechanismem, kterým RMSF vede k poškození GIT, je poškození nervových zakončení v GIT a vaskulitida vedoucí k ischemizaci tkání GIT (33). V játrech mohou rickettsie infikovat endoteliální výstelku, jaterní sinusoidy a portální systém, ale neinvadují do hepatocytů – histologický nález pak odpovídá mírné fokální hepatitidě a periportálnímu zánětu. V případech fulminantní RMSF může aktivně rostoucí rickettsie vést k rozsáhlé destrukci jaterního vaskulárního systému vedoucí až k jaternímu selhání (34).
Na RMSF nutno myslet u febrilních pacientů z endemické oblasti, s cefaleou a GIT potížemi a též u pacientů se symptomy náhlé příhody břišní, u kterých není nalezena její jasná příčina. Pacient si nemusí být vědom přisátí klíštětem a v prvních dnech nemusí být přítomna vyrážka. Podezření na tuto diagnózu může podpořit nález suspektní z vaskulitidy. Pro zlepšení prognózy pacientů je zásadní včasné zahájení antibiotické terapie v průběhu prvních dnů, kdy však není na tuto chorobu často pomýšleno (35). Úmrtnost je i při včasné terapii signifikantní – udávaná okolo 7 % (28).
Tularémie
Tularémie je choroba způsobená bakterií Francisella tularensis. Nemoc je rozšířena po celé severní polokouli mezi 30. a 70. rovnoběžkou a cesty nákazy pro člověka představují jednak klíšťata a jednak kontakt se zvířaty – především zajíci (36). Z GIT příznaků této nemoci mohou být přítomny anorexie, nevolnost, zvracení, průjmy, vzácně krvavé s dokumentovaným fatálním průběhem na podkladě střevní nekrózy (37). Hepatopatie je vcelku častá – v 75 % jsou mírně až středně zvýšené hladiny aminotransferáz, v průběhu času se může rozvíjet hepatosplenomegalie (20). V těžších případech může být přítomen ikterus (38), vzácně ascites, cholangoitida a jaterní absces (39).
Histologicky bývají nalézány nekrotické změny s dilatací sinusoidů a smíšeným zánětlivým infiltrátem (38).
Na tularémii by se mělo pomýšlet jako na vzácnou příčinu nejasné cholestatické hepatopatie především u pacientů z endemických oblastí a s anamnézou přisátí klíštěte. Postižení jater při tularémii je obecně nejspíše poddiagnostikováno.
Koloradská klíšťová horečka (Colorado Tick Fever – CTF)
Jedná se o febrilní onemocnění způsobené virem rodu Coltivirus. Endemická oblast je v západní části USA a přilehlých částech Kanady (40). Gastrointestinální projevy Koloradské klíšťové horečky nejsou výrazné. Pacienti si stěžují na nauzeu, zvracení, bolesti břicha. V souboru 228 pacientů představovaly tyto dyspeptické potíže 20 % (41). V pozdním stadiu choroby se jako další komplikace může rozvinout jaterní poškození, nejspíše sekundárně ukládáním imunokomplexů (42). Celkově má většinou choroba benigní průběh s kompletní úpravou symptomů při podpůrné léčbě.
Recidivující horečka přenášená klíšťaty (tick‑borne relapsing fever – TBRF)
TBRF je způsobena spirochetami rodu Borrelia. Jedná se o odlišné druhy od těch, které způsobují lymeskou borreliózu. Endemickými oblastmi jsou Severní a Jižní Amerika, vzácně je však onemocnění hlášeno téměř celosvětově (20). Nespecifické gastrointestinální symptomy jsou časté – více než 70 % pacientů udávalo nauzeu a zvracení, v menší míře byly zastoupené průjmy, žloutenka, hepatosplenomegalie (43). Laboratorně je relativně častá trombocytopenie s krvácivými komplikacemi, které však nebývají život ohrožující (44). Borrelie se množí v játrech a způsobují fokální nekrózu, která může progredovat až do fatálního jaterního selhání. U těhotných žen může být tato choroba příčinou potratu (45). Je nutné mít na paměti, že kvůli zkřížené sérologické reaktivitě může být TBRF falešně diagnostikována jako lymeská borrelióza (46).
Q horečka
Toto onemocnění se nepřenáší přímo přisátím klíštěte, ale kontaktem s mlékem, močí nebo plodovou vodou infikovaných zvířat, požitím nebo vdechnutím aerosolů, které obsahují původce této choroby – kokobacil Coxiella burnetti.
Typickým gastrointestinálním projevem je jaterní poškození, často subklinické. Naopak leukopenie a trombocytopenie časté nejsou (47). Antibiotická terapie obvykle vede k normalizaci JT.
Histologicky je přítomna fokální hepatocelulární nekróza, v závažných případech i rozsáhlá nekróza a granulomy (48). Zvláštní histologický nález granulomů s fibrinovým kruhem a lipidovým centrem je relativně typický pro Q horečku, ačkoliv podobný obraz může být přítomen i u dalších chorob, jako např. infekční mononukleóza či Hodgkinův lymfom (49).
Babesióza
Onemocnění s celosvětovým výskytem včetně České republiky je způsobené parazitem rodu Babesia (50). Projevuje se nespecifickými dyspeptickými potížemi jako nauzea, vomitus, anorexie, bolesti břicha, ojedinělý je výskyt hepatosplenomegalie či lehké hyperbilirubinemie při hemolýze. U pacientů po splenektomii nebo jinak imunokompromitovaných pacientů je průběh závažnější včetně rozvoje multiorgánového selhání (51).
KORESPONDENČNÍ ADRESA AUTORA:
doc. MUDr. Jan Trna, Ph.D.,
Gastroenterologické oddělení MOÚ,
Žlutý kopec 543/7,
602 00 Brno
Cit. zkr: Vnitř Lék 2020; 66(4): 232–235
Článek přijat redakcí: 15. 7. 2019
Článek přijat k publikaci: 10. 9. 2019
Sources
1. Janovská D Epidemiologická situace v České republice. In: Bartůněk P (ed). Lymeská borelióza. 4. vydání. Praha: Grada Publishing 2013, 25–43.
2. Steere AC, Bartenhagen NH, Craft JE et al. The Early Clinical Manifestations of Lyme Disease. Ann Intern Med 1983; 99 : 76–82.
3. Schefte DF, Nordentoft T Intestinal Pseudoobstruction Caused by Chronic Lyme Neuroborreliosis. A Case Report. J Neurogastroenterol Motil 2015; 21 : 440–442.
4. Kazakoff MA, Sinusas K, Macchia C Liver function test abnormalities in early Lyme disease. Arch Fam Med 1993; 2 : 409–413.
5. Horowitz HW, Dworkin B, Forseter G et al. Liver function in early Lyme disease. Hepatology 1996; 23 : 1412–1417.
6. Soloski MJ, Crowder LA, Lahey LJ et al. Serum inflammatory mediators as markers of human Lyme disease activity. PLoS One 2014; 9: e93243.
7. Massaroti EM, Luger SW Rahn DW et al. Treatment of early Lyme disease. Am J Med 1992; 92 : 396–403.
8. Zanchi AC, Gingold AR, Theise ND et al. Necrotizing granulomatous hepatitis as an unusual manifestation of Lyme disease. Dig Dis Sci 2007; 52 : 2629–2632.
9. Stanek G, Strle F Lyme borreliosis‑from tick bite to diagnosis and treatment. FEMS Micro ‑ biol Rev 2018; 42 : 233–258.
10. Derdáková M, Lencáková D Association of genetic variability within the Borrelia burgdorferi sensu lato with the ecology, epidemiology of Lyme borreliosis in Europe. Ann Agric Environ Med 2005; 12 : 165–172.
11. Wang G, van Dam AP, Schwartz I et al. Molecular typing of Borrelia burgdorferi sensu lato: taxonomic, epidemiological, and clinical implications. Clin Microbiol Rev 1999; 12 : 633–653.
12. Stanek G, Reiter M The expanding Lyme Borrelia complex – clinical significance of genomic species? Clin Microbiol Infect 2011; 17 : 487–493.
13. Swanson SJ, Neitzel D, Reed KD et al. Coinfections acquired from ixodes ticks. Clin Microbiol Rev 2006; 19 : 708–727.
14. Moutailler S, Valiente Moro C, Vaumourin E et al. Co‑infection of Ticks: The Rule Rather Than the Exception. PLoS Negl Trop Dis 2016; 10: e0004539.
15. Stuen S, Granquist EG, Silaghi C Anaplasma phagocytophilum – a widespread multi‑host pathogen with highly adaptive strategies. Front Cell Infect Microbiol. 2013; 3 : 31.
16. Comstock LE, Thomas DD Penetration of endothelial cell monolayers by Borrelia burgdorferi. Infect Immun 1989; 57 : 1626–1628.
17. Duray PH, Steere AC Clinical pathologic correlations of Lyme disease by stage. Ann NY Acad Sci 1988; 539 : 65–79.
18. Aberer E, Brunner C, Suchanek G et al. Molecular mimicry and Lyme borreliosis: a shared antigenic determinant between Borrelia burgdorferi and human tissue. Ann Neurol 1989; 26 : 732–737.
19. Middelveen MJ, McClain SA, Bandoski C et al. Granulomatous hepatitis associated with chronic Borrelia burgdorferi infection: a case report. Research 2014; 1 : 875.
20. Zaidi SA, Singer C Gastrointestinal and hepatic manifestations of tickborne diseases in the United States. Clin Infect Dis 2002; 34 : 1206–1212.
21. Olano JP, Hogrefe W, Seaton B et al. Clinical manifestations, epidemiology, and laboratory diagnosis of human monocytotropic ehrlichiosis in a commercial laboratory setting. Clin Diagn Lab Immunol 2003; 10 : 891–896.
22. Nutt AK, Raufman J Gastrointestinal and hepatic manifestations of human ehrlichiosis: 8 cases and a review of the literature. Dig Dis 1999; 17 : 37–43.
23. Gershel JC Human granulocytic ehrlichiosis presenting as abdominal pain. Pediatrics 2000; 106 : 602–604.
24. Wallace BJ, Brady G, Ackman DM et al. Human Granulocytic Ehrlichiosis in New York. Arch Intern Med 1998; 158 : 769–773.
25. Schiffman J, Haq M, Procopio F et al. Ehrlichiosis infection in a 5-year‑old boy with neutropenia, anemia, thrombocytopenia, and hepatosplenomegaly. J Pediatr Hematol Oncol 2001; 23 : 324–327.
26. Ismail N, McBride JW Tick‑Borne Emerging Infections: Ehrlichiosis and Anaplasmosis. Clin Lab Med 2017; 37 : 317–340.
27. Parola P, Paddock CD, Socolovschi C et al. Update on Tick‑Borne Rickettsioses around the World: a Geographic Approach. Clin Microbiol Rev 2013; 26 : 657–702.
28. Dahlgren FS, Holman RC, Paddock CD et al. Fatal Rocky Mountain Spotted Fever in the United States, 1999-2007. Am J Trop Med Hyg 2012; 86 : 713–719.
29. Walker DH, Henderson FW, Hutchins GM Rocky Mountain spotted fever: mimicry of appendicitis or acute surgical abdomen? Am J Dis Child 1986; 140 : 742–744.
30. Middleton DB Rocky Mountain spotted fever: gastrointestinal and laboratory manifestations. South Med J 1978; 71 : 629–632.
31. Regan JJ, Traeger MS, Humpherys D et al. Risk factors for fatal outcome from rocky mountain spotted fever in a highly endemic area‑Arizona, 2002-2011. Clin Infect Dis 2015; 60 : 1659–1666.
32. Gottlieb M, Long B, Koyfman A The Evaluation and Management of Rocky Mountain Spotted Fever in the Emergency Department: a Review of the Literature. J Emerg Med 2018; 55 : 42–50.
33. Randall MB, Walker DH Rocky Mountain spotted fever: gastrointestinal and pancreatic lesions and rickettsial infection. Arch Pathol Lab Med 1984; 108 : 963–967.
34. Sahni A, Fang R, Sahni SK et al. Pathogenesis of Rickettsial Diseases: Pathogenic and Immune Mechanisms of an Endotheliotropic Infection. Annu Rev Pathol 2019; 14 : 127–152.
35. Kirkland KB, Wilkinson WE, Sexton DJ Therapeutic delay and mortality in cases of Rocky Mountain spotted fever. Clin Infect Dis 1995; 20 : 1118–1121.
36. Zellner B, Huntley JF Ticks and Tularemia: Do We Know What We Don’t Know? Front Cell Infect Microbiol 2019; 9 : 146.
37. Dienst FT Tularemia: a perusal of three hundred thirty‑nine cases. J La State Med Soc 1963; 115 : 114–1127
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2020 Issue 4-
All articles in this issue
- Súčasné možnosti liečby BCR‑ABL1 pozitívnej chronickej myelocytovej leukémie u dospelých pacientov
- Antikoagulační léčba tromboembolie u malignit – nové studie, nová doporučení
- Gastrointestinální a jaterní projevy nemocí přenášených klíšťaty
- Sekundárna prevencia po akútnom koronárnom syndróme
- Krvácení do GIT při portální hypertenzi
- Pacient po transplantaci ledviny v ambulanci internisty
- Plicní onemocnění a autoimunitní hemolytická anémie asociovaná s IgG4
- Problematika nezahájení dialýzy u geriatrických pacientů s pokročilým chronickým onemocněním ledvin
- Jaterní fibróza
- Jsou změny krevního obrazu použitelným ukazatelem velikosti dávky azathioprinu?
- Heparinem indukovaná trombocytopenie: kazuistika a přehled literatury
- Mikroskopická polyangiitída
- Srdcové zlyhávanie ako prejav akromegálie
- Dlouhodobé využití telemonitorovacího systému Diani v léčbě diabetes mellitus 1. typu
- Hyperurikemie z perspektivy nefrologického pacienta
- Hodnocení operačního rizika u pacientů s jaterní cirhózou
- 20 let klinických zkušeností s léčbou chronické myeloidní leukemie inhibitory tyrosinové kinázy
- Léčba pacientů s chronickou myeloidní leukemií – nečekaný anebo očekávaný průnik onkologie a vnitřního lékařství?
- Stanovisko Angiologickej sekcie Slovenskej lekárskej komory (AS SLK) k užívaniu antagonistov renín-angiotenzínaldosterónového systému
- K životnímu jubileu prof. MUDr. Jindřicha Špinara, CSc., FESC
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Jaterní fibróza
- Hodnocení operačního rizika u pacientů s jaterní cirhózou
- Mikroskopická polyangiitída
- Hyperurikemie z perspektivy nefrologického pacienta
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

