-
Medical journals
- Career
Hypoxemie/hypoxie a nové koncepty oxygenoterapie v intenzivní péči
Authors: Jan Máca 1,2; Marcela Káňová 1,2; Roman Kula 1,2; Pavel Ševčík 1,2
Authors‘ workplace: Klinika anesteziologie, resuscitace a intenzivní medicíny LF OU a FN Ostrava 1; Katedra intenzivní medicíny a forenzních oborů LF OU Ostrava 2
Published in: Vnitř Lék 2020; 66(2): 63-70
Category:
Overview
Kyslík je biologicky stěžejní prvek k zajištění života a jeho dodávka do tkání je proto precizně regulována. Míra tkáňové oxygenace je v současné klinické praxi odhadována na podkladě měření hladiny kyslíku v krvi. Nedostatek kyslíku na buněčné a tkáňové úrovni může vést k orgánovému selhávání a ohrožení života. Při subletální hypoxii dochází k aktivaci významných adaptačních procesů s cílem zachování funkce buňky i tkání. Neadekvátní snaha o korekci hypoxie může vést k narušení této adaptace a riziku nežádoucí tkáňové hyperoxie. Tento fakt se snaží respektovat dva v současnosti navržené koncepty oxygenoterapie: (1) úzká kontrola arteriální oxemie a (2) permisivní hypoxemie. Recentní literatura podporuje spíše užití restriktivního cíle oxygenoterapie v intenzivní péči.
Klíčová slova:
buněčná adaptace – hypoxemie – hypoxie – intenzivní péče – oxygenoterapie
Úvod
Kyslík (O2 ) je druhým nejvíce zastoupeným prvkem atmosféry. Jeho přítomnost je vitální pro téměř všechny organismy naší planety od jednobuněčných až po mnohobuněčné. Kyslík je z biologického hlediska nepostradatelný pro aerobní produkci makroergních fosfátových sloučenin (adenozintrifosfát – ATP) vznikajících při oxidaci základních živin. Dále je jako jeden ze základních strukturálních prvků v organismu obsažen v organických a anorganických sloučeninách a podílí se na redoxní signalizaci. Klidová denní spotřeba kyslíku je u člověka přibližně 250 ml/min (350 l/den). V těle nejsou trvale přítomny zásoby O2 , a proto musí být jeho přísun k buňkám tkání zajištěn nepřetržitým procesem. Precizní kontrola hladiny O2 na úrovni tkání je zajišťována komplexním systémem skládající se z:
- respirace, která zahrnuje zevní (plicní) a vnitřní (tkáňové) dýchání,
- transportu kyslíku krví cestou kardiovaskulárního aparátu a
- neuroendokrinní regulace výše uvedených procesů.
Rutinní měření tkáňové a buněčné hladiny O2 je v klinické praxi prozatím nedostupné. Základní veličinou charakterizující velikost distribuce O2 do tkání je kromě srdečního výdeje především arteriální obsah O2 (CaO2 ). CaO2 je dána součtem molekul navázaných na hemoglobin tzv. saturace hemoglobinu kyslíkem v arteriální krvi (SaO2 ), a volně rozpuštěných molekul v krvi, vyjádřených parametrem parciální tlak O2 v arteriální krvi (PaO2 ):
CaO2 = (1,34 × Hb × SaO2 ) + (0,003 × PaO2 ) {1}
kde CaO2 je arteriální obsah O2 (ml/l); Hb je hladina hemoglobinu (g.l-1); SaO2 je saturace hemoglobinu O2 v arteriální krvi (%); PaO2 je parciální tlak O2 v arteriální krvi (kPa)
Za normálního fyziologického stavu činí SaO2 až 97 % všech molekul O2 v krvi a její hodnota je závislá na hladině PaO2 . Tuto nelineární závislost popisuje tzv. disociační křivka hemoglobinu pro O2 . CaO2 a srdeční výdej (CO) pak určuje tzv. dodávku O2 do tkání (DO2), kterou lze vypočítat pomocí rovnice:
DO2 = CaO2 × CO {2}
kde DO2 je dodávka O2 (ml.min-1); CaO2 je arteriální obsah O2 (ml/l); CO je srdeční výdej (l.min-1)
V normobaroxických podmínkách jsou normální hodnoty PaO2 udávány v rozmezí 71–104 mm Hg (9,9-14,4 kPa), SaO2 nad 94 %, CaO2 160–220 ml.l-1 a DO2 950–1150 ml.min-1 (1). Snížené množství O2 v arteriální krvi se obvykle označuje jako hypoxemie a nedostatek O2 na úrovni tkáni jako hypoxie.
Klinicky významným patologickým stavem je nepoměr mezi DO2 a tkáňovou spotřebou kyslíku (VO2 ), kdy může dojít k až rozvoji šoku. V takové situaci dochází dle stupně závažnosti DO2 /VO2 nepoměru v intervalu několika minut až hodin k narušení buněčné homeostázy a rozvíjí se celulární dysfunkce a multiorgánové selhávání, což je stav spojený s rizikem smrti. V situaci, kdy nepoměr mezi DO2 a VO2 není letální, nebo je jeho rozvoj pozvolný jsou zahájeny adaptační procesy.
U kriticky nemocných pacientů patřila v minulosti k rutinní praxi snaha o striktní dosažení normoxemie, často bez ohledu na typ a fázi základního onemocnění. Cílem bylo, na jednu stranu, co nejrychlejší řešení patologického procesu a, na druhou stranu, prevence vzniku či progrese orgánových dysfunkcí na podkladě protrahované závažné tkáňové hypoxie.
V současnosti je tento koncept striktní normoxemie opouštěn, především z důvodu rozšiřujícího se povědomí o fyziologické adaptaci na subletální hypoxii. Tato adaptace je z evolučního hlediska jedním z nejstarších procesů a slouží zejména ke zmírnění následků plynoucích z nedostatku O2 a zajištění přežití jednobuněčných i mnohobuněčných organismů. Agresivní korekce hypoxemie již v současnosti není u celé řady onemocnění doporučena. Důvodem je nejen potenciálně nepříznivé ovlivnění zmíněné fyziologické adaptace, ale i riziko navození tkáňové hyperoxie, která je ve srovnání s hypoxií v mnoha aspektech pro tkáně více nebezpečná (2–4).
Cílem tohoto článku je:
- popis patofyziologie rozvoje arteriální hypoxemie a tkáňové hypoxie,
- popis charakteru adaptačních procesů provázejících subletální hypoxii,
- charakteristika aktuálních konceptů oxygenoterapie v intenzivní péči, tzn. koncept úzké kontroly oxemie a koncept permisivní hypoxemie,
- stručný popis nejdůležitějších recentních prací medicíny založené na důkazech týkajících se pacientů v intenzivní péči.
Hypoxemie
Hypoxemii lze definovat jako patologicky sníženou hodnotu CaO2 , tedy snížené množství O2 v arteriální krvi. Klinicky je za hypoxemii nejčastěji považován pokles SpO2 pod 88 % a/nebo přítomnost PaO2 pod 72mm Hg (10 kPa). U pacientů bez chronického respiračního onemocnění jsou za život ohrožující obvykle považovány hodnoty PaO2 pod 60mm Hg (8 kPa). Podle disociační křivky hemoglobinu pro O2 dochází pod touto hranicí k situaci, kdy i malý pokles PaO2 může vést ke kritické hypoxii tkání tím, že dochází k významnému snížení SaO2 . Protože na hemoglobin je v arteriální krvi navázáno až 97 % všech molekul O2 , pokles SaO2 se významně odrazí na výsledné hladině CaO2 ,tzn. jedné z hlavních determinant DO2 (Obr. 1). Přítomnost hypoxemie patří k základním diagnostickým kritériím respiračního selhání (acute respiratory failure – ARF).
Image 1. Disociační křivka hemoglobinu pro O2 a koncentrace O2 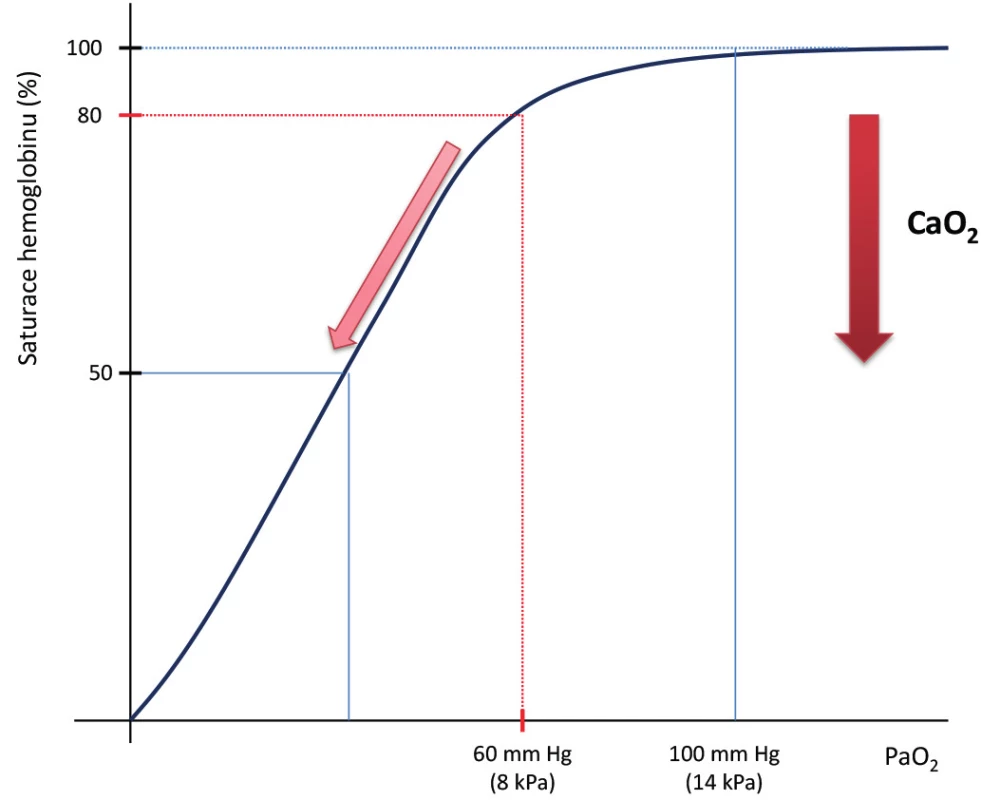
Kritická hodnota parciálního tlaku O2 v arteriální krvi (PaO2 ) je přibližně 60 mm Hg (8 kPa), pod touto hodnotou strmě klesá saturace hemoglobinu kyslíkem, a tudíž i celková koncentrace O2 v krvi (CaO2 ). Dalším významným parametrem popisujícím závažnost ARF, a zejména jeho nejzávažnější formy, tzv. syndromu akutní dechové tísně (acute respiratory distress syndrome – ARDS), je index PaO2 /FiO2 (P/F), jinými názvy tzv. hypoxemický nebo Horowitzův index. FiO2 je označení pro koncentraci kyslíku ve vdechované směsi plynů. P/F index je užíván především ke stratifikaci tíže respirační insuficience v rámci ARDS. Hodnoty P/F < 300mm Hg jsou považovány za patologické, hodnoty < 100mm Hg za život ohrožující.
Na míru tkáňové oxygenace se tedy v klinické praxi usuzuje, kromě monitorace parametrů arteriální oxemie, také měřením několika dalších parametrů, jako např. arteriální hladiny laktátu, hodnoty saturace O2 ve smíšené venózní krvi v plicní arterii (SvO2 ) anebo centrální žilní krvi před pravou srdeční síní (ScvO2 ).
V podmínkách atmosférického tlaku na úrovni moře (normobaroxie) vede k hypoxemii několik možných mechanismů:
- alveolární hypoventilace,
- patologie alveolokapilární membrány (AKM),
- porucha plicního ventilačně perfuzního poměru (V/Q),
- plicní zkrat, který, přestože jde v principu o mezní poruchou V/Q poměru, se obvykle popisuje zvlášť.
Poměrné zastoupení jednotlivých mechanismů, jejich míra a vliv na vznik hypoxemie je u různých plicních patologií odlišný. Rozpoznání převažujícího mechanismu je důležité pro klinickou praxi z důvodu rozdílné reaktivity na intervence prováděné za účelem korekce hypoxemie (5), více viz Tab. 1.
Table 1. Mechanismy vzniku hypoxemie za normobarických podmínek a jejich ovlivnění oxygenoterapií a umělou plicní ventilací pozitivním přetlakem a pronací 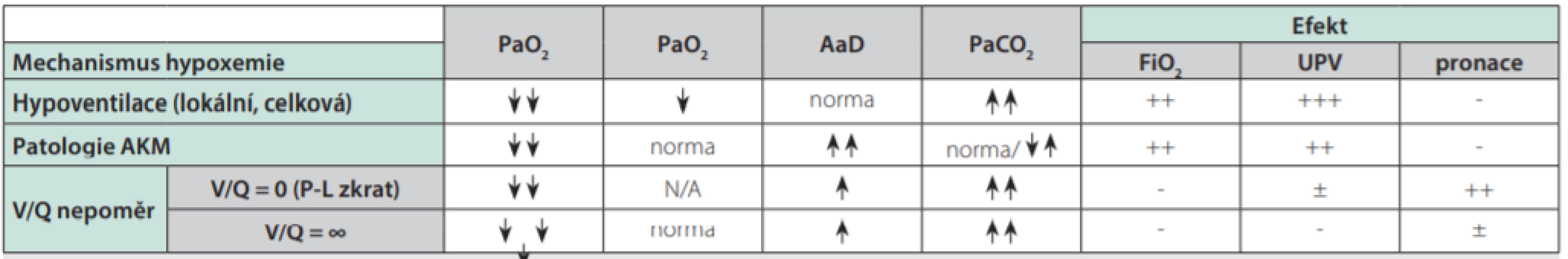
AKM – alveolokapilární membrána, PaO2 – parciální arteriální tlak O2, PAO2 – parciální alveolární tlak O2, AaD – alveoloarteriální diference O2 – norma do 20 mm Hg (2,8 kPa), PaCO2 – parciální arteriální tlak CO2, FiO2 – inspirační frakce O2 , UPV – umělá plicní ventilace, N/A – nelze hodnotit Z časového hlediska lze hypoxemii rozdělit na:
- akutní (rozvoj v intervalu méně než 6 hod),
- subakutní (6 hod až 7 dní),
- protrahovanou (7 dní až 90 dní),
- chronickou (více než 90 dní) (1).
V intenzivní péči se setkáváme nejčastěji se subakutní formou hypoxemie, která se vyznačuje výše zmíněnou aktivací adaptačních procesů na systémové i buněčné úrovni, jejichž cílem je prevence vzniku nerovnováhy mezi DO2 a VO2 a vzniku hypoxie. Tato adaptace se ovšem může uplatnit pouze v situacích, kdy je nástup hypoxemie pozvolný a nevede ke kritické hypoxii tkání.
Hypoxie
Hypoxie je snížená hladina tkáňového parciálního tlaku O2 (PtO2 ), tedy tlak tvořený volně rozpuštěnými molekulami O2 lokalizovanými v mezibuněčném prostoru tkáně. Míra PtO2 je dána na jedné straně velikostí přísunu O2 do tkání (DO2 ) a na druhé straně velikostí spotřeby O2 ve tkáních (VO2 ). Průměrná hodnota PtO2 bývá udávána přibližně 23 mm Hg (3,2 kPa).
VO2 je za fyziologických podmínek ovlivněna pouze energetickou potřebou buněk (koncentrací adenozindifosfátu – ADP). K zajištění normálního průběhu oxidativních procesů na intracelulární (cytosolické) úrovni stačí parciální tlaky vyšší než do 3mm Hg. Za patologického stavu v případě poklesu intracelulárního tlaku O2 pod 1mm Hg se narušuje spotřeba O2 (6).
Z patofyziologického hlediska lze hypoxii rozdělit na 4 základní podskupiny:
- hypoxemická hypoxie (nízká koncentrace nebo parciální tlak O2 ve vdechované směsi a respirační insuficience, téma tohoto textu),
- stagnační (cirkulační) hypoxie (lokální nebo celkové zpomalení průtoku krve cévním systémem, např. při srdečním selhání),
- anemická hypoxie (snížení hladiny nebo porucha funkce hemoglobinu),
- histotoxická (porucha utilizace O2 až na tkáňové úrovni, např. otrava kyanovodíkem).
Hypoxie může vést k poruše funkce buňky, popřípadě až její smrti, nejen vlivem energetického selhání. Dochází při ní také, zdánlivě paradoxně, i ke zvýšené tvorbě reaktivních kyslíkových sloučenin (ROS). Za aerobních podmínek jsou totiž elektrony v rámci dýchacího řetězce přenášeny pomocí dvou koenzymů nikotinamid adenin dinukleotid (NADH) a flavinadenin dinukleotid (FADH2) přes mitochondriální komplexy I -IV a následně, po jejich reakci s kyslíkem a vodíkem, vzniká H2 O (Obr. 2). V podmínkách hypoxie se elektrony uvolňují před komplexem IV a dochází k tvorbě superoxidu (O2 .-) a jeho následné konverzi na peroxid vodíku, případě na další ROS. Může tak dojít k poruše buněčné redoxní rovnováhy a oxidativnímu poškození důležitých buněčných molekul (proteinové enzymatické systémy, DNA, proteiny cytoskeletu, lipidy biomembrán apod.), což také může vést ke smrti buňky.
Image 2. Dýchací řetězec, schéma transportů elektronů přes vnitřní mitochondriální membránu 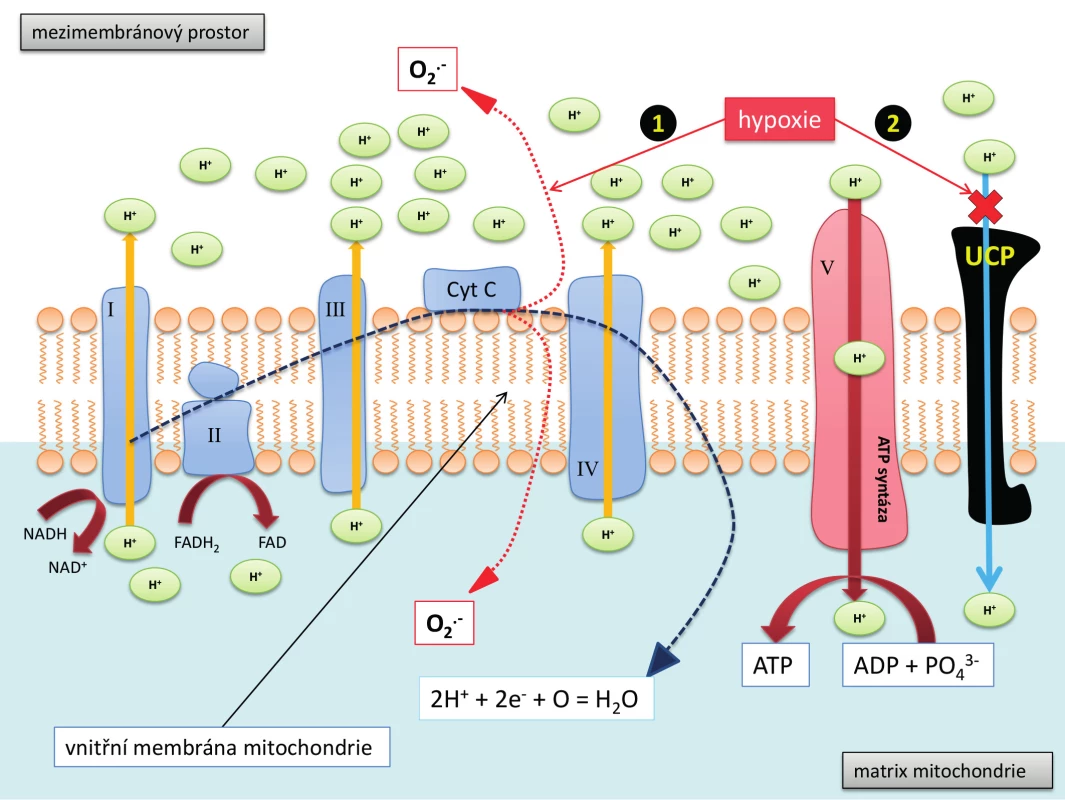
Elektrony pocházející ze 2 základních kofaktorů (NAD a FAD) jsou směřovány přes 4 membránové proteinové komplexy (I, II, III, IV), při tomto procesu vzniká protonový (H+) gradient mezi matrix a mezimembránovým prostorem mitochondrie. Tento elektrochemický gradient je pak pomocí ATP syntázy (komplex V) využit k produkci ATP. Z elektronů, které prošly řetězcem, vzniká po sloučení s kyslíkem a protony v závěrečné fázi procesu H2O. 1. Hypoxie a geneze reaktivních kyslíkových sloučenin (ROS). Při hypoxii dochází k odklonu elektronů před komplexem IV s následnou tvorbou superoxidového radikálu a dalších ROS. 2. Elektronový uncoupling je proces, při němž je protonový gradient pomocí specifických proteinů, tzv. uncoupling proteins (UCP), redukován („rozpuštěn“) a takto vznikající energie je pak využita místo vzniku ATP k produkci tepla. Buněčná hypoxie redukuje elektronový uncoupling a tím zvyšuje efektivitu produkce ATP. NADH – nikotinamid adenin dinukleotid, FADH2 – flavin adenin dinukleotid, Cyt C – cytochrom C, ATP – adenozin trifosfát, ADP – adenozin difosfát, UCP – uncoupling protein, ROS – reaktivní kyslíkové sloučeniny Na druhou stranu existují i názory, že kromě negativního vlivu může hypoxie sehrávat protektivní antiapoptotickou roli (7, 8).
Z klinického hlediska je významné, že arteriální hypoxemie nemusí být vždy podkladem pro vznik tkáňové hypoxie (hypoxemická hypoxie). Hypoxie pak vzniká zejména v situaci snížené kardiovaskulární adaptability, především ve smyslu omezené schopnosti navýšení srdečního výdeje ke korekci DO2
Přímá monitorace tkáňové oxemie je v současné době prozatím využívána spíše v rámci výzkumné činnosti (9).
Adaptace na hypoxii
Při subletální hypoxii jsou aktivovány adaptační procesy, jejichž cílem je především zajistit adekvátní přísun O2 do tkání, udržet buněčnou homeostázu a případně pozitivně ovlivnit schopnost buňky přežít nepříznivý stav. Všechny jaderné buňky v lidském organismu mají schopnost detekovat hypoxii speciálními receptory, které jsou funkčně spřaženy se specifickými iontovými kanály (tzv. O2 senzitivními K+ kanály). Buněčná reakce na přítomnost hypoxie je časná (minuty) v podobě aktivace již preformovaných proteinů, nebo pozdní (hodiny) pomocí zvýšení genové transkripce příslušných genů (8). Na systémové úrovni existují dále specializované chemoreceptory lokalizované v kardiovaskulárním systému a bronchiálním stromu. V bezprostředním kontaktu s cévním řečištěm se nachází vysoce vaskularizované orgány, karotická tělíska (glomus caroticum), která jsou lokalizována v oblasti bifurkace a. carotis communis, a detekují přítomnost hypoxemie. Neuroepiteliální buňky v bronchiálním stromu jsou lokalizovány v bifurkacích bronchů a monitorují inspirační frakci O2 . Adaptační procesy na přítomnost hypoxie v závislosti na čase a lokalizaci shrnuje Tab. 2.
Table 2. Adaptace na hypoxie v závislosti na čase a lokalizaci 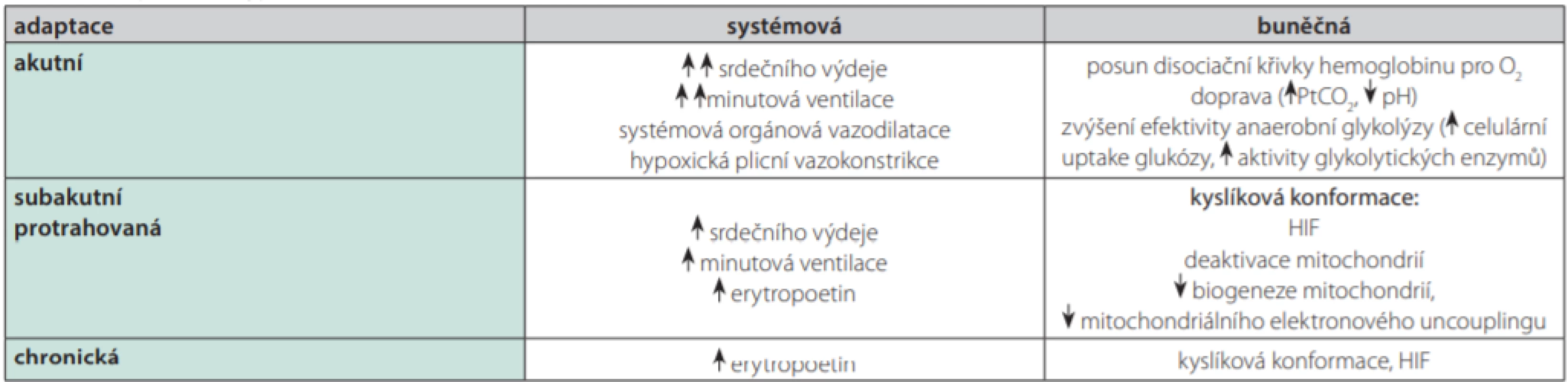
HIF-1 – hypoxia indicible factor 1, PtCO2 – tkáňový parciální tlak CO2 Systémová reakce na hypoxii je rychlou adaptací, která je aktivována v průběhu několika minut. Jejími hlavními komponenty jsou zvýšení minutového srdečního výdeje a minutové alveolární ventilace. Cílem je především snaha o udržení adekvátní DO2 do tkání. U protrahované hypoxemie se dále zvyšuje produkce erytropoetinu, hlavního humorálního stimulátoru erytropoézy. Zvýšení počtu erytrocytů vede ke zvýšení kapacity krve pro přenos O2 a tím vyššímu DO2 .
V rámci kardiovaskulární adaptace na hypoxii v systémovém cévním řečišti dochází převážně k vazodilataci rezistenčních arteriol s cílem zvýšení orgánové perfuze a tím zajištění adekvátní DO2 , tzv. hypoxická vazodilatace. Ta je patrná zejména v orgánech nejvíce citlivých na nedostatek O2 , tzn. myokardu a centrální nervové soustavě (CNS).
V plicním řečišti naopak dochází na podkladě hypoxie k intenzivní vazokonstrikci především malých rezistenčních arterií, tzv. hypoxické plicní vazokonstrikci (HPV), která má za cíl lokální redistribuci krve v plicním řečišti směrem od špatně ventilovaných (hypoxických) plicních jednotek k lépe ventilovaným, a tím zlepšit V/Q nepoměr (10). Dává se tím přednost snížení nežádoucího efektu V/Q nepoměru před rizikem redukovaného průtoku plicními kapilárami při plicní vazokonstrikci. Při alveolární hypoventilaci velkého rozsahu, např. u ARDS, tak může HPV vést až k nadměrné zátěži pravostranných srdečních oddílů vlivem zvýšení plicní vaskulární rezistence. Dochází tak k rozvoji plicní hypertenze a vzniku akutního cor pulmonale.
Podle klasického vysvětlení je ovlivnění plicních cév při HPV vyvoláno přímou aktivací buněk hladkého svalstva, konkrétně útlumem funkce K+ kanálů. To pak vede k depolarizaci, následné aktivaci Ca2+ kanálů s výsledným zvýšením intracelulární koncentrace vápníku a svalovému stahu (11). V posledních letech byl prezentován odlišný pohled. Hypoxie plicní tkáně je pravděpodobně rozpoznána na úrovni alveolokapilární membrány a následně je generován elektrický signál přenesený směrem k arteriolám cestou tzv. skulinových spojení (gap junctions) v plicním epitelu (12). Intenzita HPV se snižuje např. při zvýšeném srdečním výdeji, hypokapnii, hypotermii, při výkyvech acidobazické rovnováhy, z léků ji pak snižují inhalační anestetika, blokátory kalciového kanálu a inhalační podání oxidu dusnatého (iNO). HPV je dále ovlivněna i mechanicky, nastavením pozitivního end -exspiračního tlaku (PEEP) v dýchacích cestách v rámci umělé plicní ventilace (UPV).
Buněčná odpověď na hypoxii je značně různorodá. Dominuje snaha o udržení aerobní produkce adenozintrifosfátu (ATP). ATP je donorem energie pro téměř všechny základní buněčné procesy, především zajištění transmembránového transportu iontů (Na+/K+ ATPáza), adekvátní funkci enzymatických systémů, proteogenezi, transmembránovou a intracelulární signalizaci apod. Při hypoxii dochází následkem snížené dostupnosti O2 k nedostatku ATP.
V rámci rychlé odpovědi na hypoxii buňka preferuje procesy vedoucí k produkci energie a omezuje procesy, které energii spotřebovávají. Zvyšuje se efektivita anaerobního metabolismu zvýšením aktivity některých glykolytických enzymů, např. fosforylací jednoho z centrálních enzymů glykolýzy fosfofruktokinázy cestou AMP-aktivované protein kinázy (AMPK) (13). AMPK se podílí i na zvýšení přísunu glukózy do buňky, např. translokací Glut-4 transportéru do plazmatické membrány (14).
Vyprodukovaná energie je využita především k zajištění funkce iontových pump k udržení membránového potenciálu a homeostázy Ca2+. Snižuje se anabolismus a omezuje syntéza nových molekul (především proteosyntéza). Bylo popsáno, že ATP dependentní iontové kanály dokážou spotřebovat 20–80 % klidové produkce ATP. To vysvětluje skutečnost, že buňky, pro jejichž funkci je dominantní udržení membránového potenciálu iontovými transporty, např. při elektrické aktivitě neuronů, podléhají nejrychleji buněčné smrti vyvolané hypoxií, tzv. hypoxia -induced cell death (15).
Z dalších mechanismů jde o zvýšení efektivity oxidativní fosforylace v mitochondriích. Jak bylo již zmíněno, při oxidativní fosforylaci prochází elektrony, pocházející z NADH a FADH2, systémem redoxních membránových proteinových komplexů, které pumpují protony (H+) do mezimembránového prostoru mitochondrie. Vzniká tak protonový gradient, který je pak využit k syntéze ATP. Transport elektronu je tzv. spřažen (coupling) s tvorbou ATP. Efektivita tvorby ATP je regulována tzv. uncoupling proteinem (UCP), který redukuje vzniklý protonový gradient a nahromaděná energie je místo tvorby ATP částečně přeměněna na teplo. Při hypoxii dochází ke snížení elektronového „uncouplingu“, což vede ke zvýšení efektivity elektronového transportu v mitochondriích a zlepšení produkce ATP (Obr. 2).
Pokud je dostupnost ATP v buňce i přes všechny popsané rychlé metabolické adaptační změny kriticky nižší, než je jeho potřeba k zajištění iontové a metabolické homeostázy, dochází k membránové depolarizaci, nekontrolovanému influxu Ca2+ intracelulárně s následnou aktivací cytoplazmatických fosfolipáz a proteáz. Tyto procesy pak vedou k otoku buňky, destrukci intracelulárních komponent a nekróze buňky (8).
V situaci protrahované hypoxie jsou zahájeny další adaptivní procesy, které přetrvávají i řadu měsíců, dokud příčina hypoxie není dořešena nebo buňka nezanikne. Subakutní a chronická adaptace, která snižuje citlivost buněk k hypoxii redukcí metabolické aktivity buněk a omezením produkce ATP, se nazývá kyslíkové přizpůsobení (anglicky oxygen conformation). Vede ke snížení původní kyslíkové potřeby na 40–60 % (16).
Jedním z nejvíce prozkoumaných procesů je exprese tzv. faktoru indukovaného hypoxií 1 (hypoxia -induced factor 1 – HIF-1). Tento transkripční faktor reguluje expresi stovek cílových genů v rámci buňky.
HIF-1 skládá ze dvou podjednotek:
- konstitutivně exprimované podjednotky (HIF-1β) a,
- kyslíkem regulované podjednotky (HIF-1α).
Za fyziologického stavu, v aerobních podmínkách, je HIF-1α hydroxylován enzymem prolylhydroxylázou (PDH), což umožňuje jeho vazbu na tzv. Von Hippel Lindau protein (VHL). To vede k proteázomové degradaci HIF-1α (Obr. 3). Za aerobních podmínek se tedy podjednotka HIF-1α v cytoplazmě buňky téměř nevyskytuje (4).
Image 3. Adaptace na hypoxii cestou hypoxií indukovaného fakrotu 1 (HIF-1) 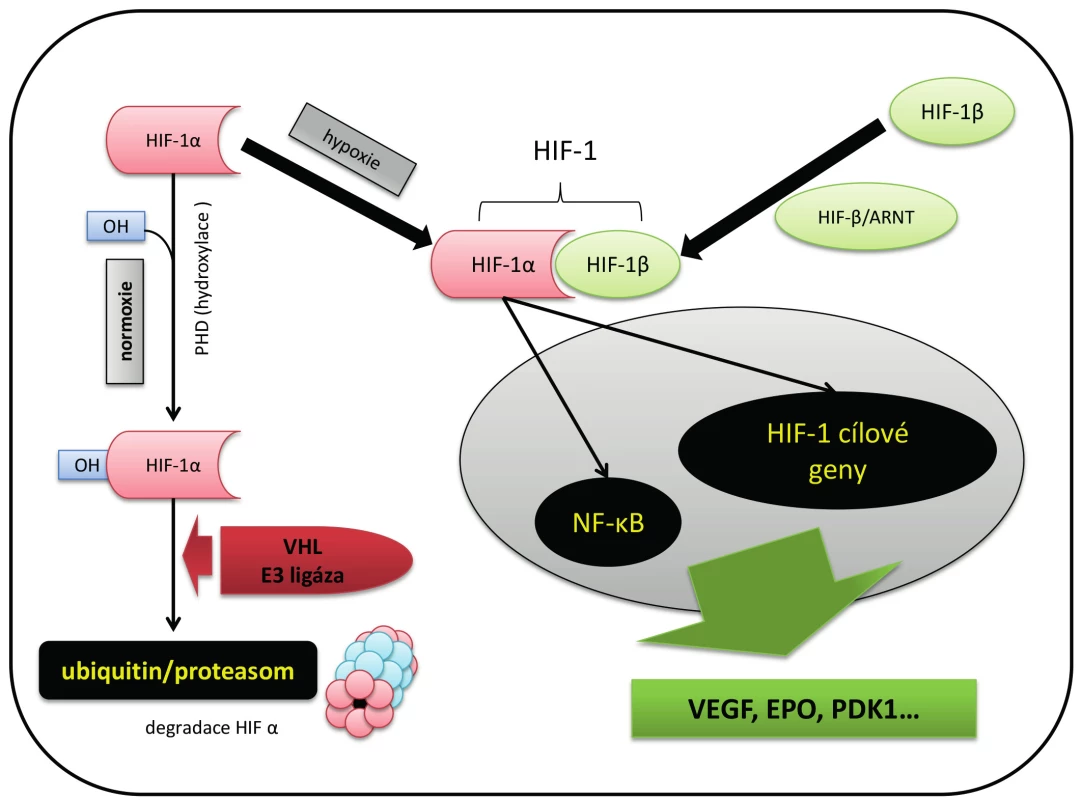
HIF-1 je komplexem 2 podjednotek: podjednotky (HIF-1α), jejíž tvorba je regulována hladinou kyslíku, a konstitutivně produkované podjednotky (HIF-1β). V aerobních podmínkách je HIF-1α po hydroxylaci prolylhydroxylázou (PHD) degradována v ubiquitinovém protein-ligázovém komplexu, tzn. v cytoplazmě buňky se téměř nevyskytuje. Při hypoxii k hydroxylaci nedochází, HIF-1α se hromadí a spojuje se s HIF-1β za vzniku HIF-1. HIF-1 pak ovlivňuje expresi řady genů vedoucí k produkci růstových faktorů, a dalších bioaktivních látek v rámci adaptace na hypoxii. HIF – hypoxií indukovaný faktor, VEGF – vaskulární endoteliální růstový faktor, EPO – erytropoetin, PDK1 – pyruvát dehydrogenáza 1, PHD – prolylhydroxyláza, ARNT – aryl hydrokarbon receptorový nukleární transfokátor, NF-κB – nukleární faktor κ B V anaerobních podmínkách k hydroxylaci HIF-1α nedochází, což vede k jeho snížené degradaci, akumulaci a následně vzniku bioaktivního komplexu HIF-1 (HIF-1α/HIF-1β). Poločas života HIF-1α je prodloužen nejen sníženou aktivitou PDH (např. inhibicí katalytického centra cestou ROS), ale také kompetitivně vazbou s heat -shock proteinem 90, který HIF-1α stabilizuje. Naopak např. protein RACK1 zvyšuje degradaci HIF-1α usnadněním proteázomové degradace proteinu (9, 17).
HIF-1 iniciuje řadu transkripčních procesů genomu buňky. Dochází k produkci různých růstových faktorů ovlivňujících řadu fyziologických procesů (Tab. 3) (18). Zjednodušeně řečeno, HIF-1 sehrává stěžejní roli ve fyziologických procesech (vývoj cévní sítě pro distribuci O2 ) i v patologických stavech (adaptace na hypoxii).
Table 3. Role HIF-1 ve vybraných fyziologických (vývoj cévní sítě pro distribuci O2 ) a patologických stavech (adaptace na hypoxii) 
VEGF – vascular endothelial growth factor, PDGF – platelet derived growth factor Je velice pravděpodobné, že liberální podávání vysoké FiO2 u pacientů se subakutní hypoxemií může narušit přirozenou adaptaci buněk na hypoxii, a tím zhoršit průběh patologického procesu. HIF-1 adaptace je nepříznivě ovlivněna také věkem, aterosklerózou, kouřením, přítomností diabetes mellitus a arteriální systémové hypertenze (18).
Koncepty oxygenoterapie
Klinické cíle dodržované u pacientů na UPV v intenzivní péči v 60. –80. letech minulého století měly za cíl striktní dosažení normální hladiny O2 a CO2 . V 90. letech 20. století došlo vlivem narůstajícího množství klinických a patofyziologických poznatků postupně k akceptování vyšší hladiny CO2 (koncept permisivní hyperkapnie), která je často nezbytná k zajištění adekvátní protektivity UPV. Dosažení striktní normokapnie by v těchto případech vedlo k nutnosti nastavení agresivních ventilačních parametrů s rizikem rozvoje ventilátorem indukovaného plicního poškození (VILI). Za další významný posun v paradigmatu lze považovat relativně recentně definovanou strategii precizní kontroly arteriální oxemie (precize kontrol of arterial oxygenation – PCAO), jejímž cílem je snaha o redukci rizika hypoxemie a zároveň rovněž hyperoxemie. Nejnověji je diskutován koncept permisivní hypoxemie (permisive hypoxemia – PH) u pacientů, u kterých patologické hodnoty O2 již vedly k rozvoji adaptačních mechanismů na celulární a subcelulární úrovni, a u nichž by normalizace hladiny O2 mohla vést k nežádoucímu oxygenačnímu stresu. V dalších 2 odstavcích jsou stručně charakterizovány oba uvedené koncepty.
Koncept precizní kontroly arteriální oxemie
V klinické praxi je již všeobecně akceptováno, že kromě hypoxie buněk může k jejich poškození vést i hyperoxie, nadměrná zátěž kyslíkem (3).
Nejčastěji používaný parametr, na jehož podkladě lze odhadnout míru arteriální oxemie, je v současnosti pulzní oxymetrie (SpO2 ).se používají zařízení umístěná na dobře prokrvené periferní části těla, nejčastěji akrálním článku prstu horní nebo dolní končetiny, popřípadě ušní m lalůčku nebo laterálním kožním okraji vstupu do nosní dutiny. Měření SpO2 je všeobecně dostupné, jednoduché a levné. Na jeho podkladě lze ovšem velice přesně odhadnout pouze pokles arteriální hladiny O2 vázaného na Hb, bez možnosti monitorace PaO2 . Další nevýhodou metody je, že není možné posoudit míru hyperoxemie díky stropovému efektu, protože horní měřitelná hranice SpO2 (100% saturace hemoglobinu) nezohledňuje možnou zvýšenou hladinu PaO2 . Z toho plyne riziko podhodnocení hyperoxické zátěže organismu. Vhodnějším parametrem v posuzování oxemie (včetně hyperoxemie) se tak v klinické praxi u kriticky nemocných jeví sledování PaO2 (19).
Hlavním cílem konceptu precizní kontroly arteriální oxemie je zabránění nežádoucím výkyvům oxemie, jak ve smyslu hypoxemie, tak i hyperoxemie, do hodnot, u nichž se již přepokládá negativní vliv na funkci tkání a tak na klinický stav pacienta (1, 20) (Obr. 4). Na stanovení nejvhodnějšího rozmezí oxemie se podílí nejen povaha a dynamika vývoje základního onemocnění, ale i věk a komorbidity. Je možné stanovit některé kohorty pacientů podle typu akutního stavu, s přihlédnutím ke komorbiditám, kteří budou profitovat z určitého konkrétního rozmezí oxemie, např. pacienti s akutním koronárním syndromem, pacienti s akutní ischemickou mozkovou příhodou apod. Klinická aplikace tohoto konceptu pak bude formou preskripce požadovaného intervalu oxemie, např. cíl PaO2 70–90 mm Hg (9,8-12,6 kPa) a SpO2 90–94 %.
Image 4. Koncept precizní kontroly arteriální oxemie (volně dle (1)) 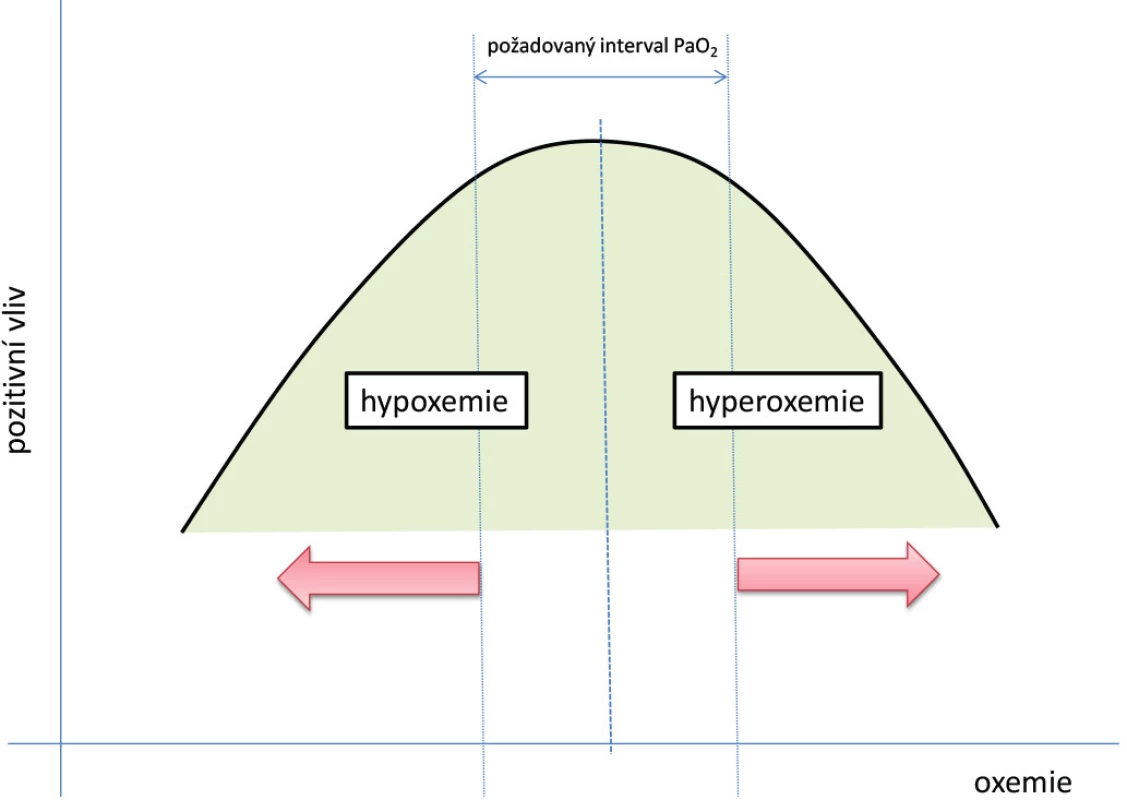
Koncept permisivní hypoxemie
Tolerance hladiny oxemie nižší, než je obecně akceptovaná dolní hranice normy (PaO2 pod 8 kPa), se nazývá permisivní hypoxemie. Smyslem tohoto konceptu je minimalizace rizik spojených se snahou o dosažení normoxemie. Jde zejména o situace, kdy jsou již plně rozvinuty adaptační mechanismy (Tab. 2) a dále na stavy, kdy je k normalizaci oxemie nutno navyšovat inspirační frakci O2 nad tolerovatelnou mez (obvykle udávána hranice 50–60 %), což je spojeno s rizikem rozvoje plicního poškození, tzv. hyperoxic acute lung injury (HALI) (1, 3). Podmínkou je zajištění a udržení tkáňové oxygenace. Jako vhodná se jeví např. skupina pacientů se subakutní nebo chronickou subkritickou hypoxemií. Tato strategie s nejvyšší pravděpodobností povede k nutnosti manipulace s hladinou hemoglobinu a hodnotou srdečního výdeje, a také k potřebě ovlivnění spotřeby O2 tkáněmi (sedace, svalová relaxace, iatrogenní terapeutická hypotermie apod.). Tento koncept je v souladu se současným trendem k individualizaci péče o pacienta s těžkou refrakterní život ohrožující hypoxemií.
Jednalo by se především o stavy:
- kdy je kontraindikována podpora extrakorporální membránou oxygenací (ECMO), nebo
- kdy je, i přes použití kombinace ECMO a protektivní UPV (myšleno především FiO2 < 0,5), nadále alterovaná výměna krevních plynů.
Tento koncept je prozatím pouze na experimentální úrovni. Další technologický pokrok a zavedení přímé nebo nepřímé monitorace tkáňové oxemie, společně s identifikací spolehlivých biomarkerů hypoxie tkání, by mohlo přinést možnost stanovit nejvhodnější kohortu pacientů, kteří by mohli z permisivní hypoxemie profitovat. Použití tohoto konceptu v klinické praxi zatím není doporučeno (1).
Stručná charakteristika vybraných recentních prací založených na důkazech
Ve všeobecné intenzivní péči je z pohledu medicíny založené na důkazech jen velmi malé množství humánních prací týkajících se oxemie jako hlavního sledovaného klinického cíle. Bylo opakovaně pozorováno, že oxygenace, především index P/F, není optimální prediktorem mortality. Zhoršení oxygenace nemusí vést ke zhoršení klinického výsledku ve sledované skupině pacientů (21), nezměněná oxygenace ve studijní skupině nevylučuje lepší klinický výsledek (22), a naopak zlepšení oxygenace nevedlo ke zlepšení klinického výsledku pacientů (23–25). Např. v jedné z nejvýznamnějších studií týkající se protektivní umělé plicní ventilace u pacientů s ARDS z roku 2000, tzn. dechový objem 6 ml vs. 12 ml.kg-1 predikované váhy, měla dokonce studijní skupina (6 ml/kg) signifikantně horší oxygenaci než kontrolní skupina (12 ml.kg-1). Přesto byl prokázán statisticky významný mortalitní benefit u pacientů s této skupiny s nižším dechovým objemem (21).
Za významnou lze považovat prospektivní, randomizovanou, monocentrickou studii milánských autorů publikovanou v roce 2016. Smíšená skupina pacientů (n = 480) intenzivní péče byla rozdělena na konvenční skupinu (n = 218), u které byl cíl dosažení SpO2 v rozmezí 97–100 %, a konzervativní skupinu (n = 216), u které bylo cílem dosažení SpO2 93–98 %. Studie byla předčasně ukončena kvůli vynucenému uzavření části lůžkové kapacity z důvodu zemětřesení. Přesto autoři prokázali signifikantní mortalitní benefit (mortalita na jednotce intenzivní péče 11,6 vs. 20,2 %, p = 0,01; hospitalizační mortalita 24,2 vs. 33,9 %, p = 0,03) u konzervativní skupiny oproti konvenční skupině pacientů. Dále byl prokázán signifikantně větší počet dní bez ventilace (ventilator free days – VFD) u konzervativní skupiny (72 vs. 24 dní, p = 0,02) (26).
Druhou prací je metaanalýza všech randomizovaných studií v databázích Cochrane Central Register of Controlled Trials, MEDLINE, Embase, HealthSTAR, LILACS, PapersFirst a WHO International Clinical Trials Registry, které se do roku 2017 zabývaly srovnání liberální vs. konzervativní oxygenoterapie u akutních stavů. Bylo zařazeno celkem 25 randomizovaných studií (celkem n = 16 037 pacientů) zabývajících se akutními a kritickými klinickými stavy, jako je sepse, cévní mozková příhoda, trauma, infarkt myokardu, srdeční zástava, urgentní chirurgie, a dále i práce týkající se obecné populace intenzívní péče. Liberální strategie oxygenoterapie byla definována jako SpO2 94–99 %. Bylo prokázáno, že pacienti s touto strategií měli signifikantně vyšší hospitalizační a 30denní mortalitu. Doporučená hranice SpO2 , nad kterou již byly pozorovány nepříznivé výsledky plynoucí s nadměrné kyslíkové zátěže, byla autory stanovena SpO2 nad 94–96 % (27).
Závěr
Oxygenoterapie v intenzivní péči je pouze podpůrná intervence, která obvykle neřeší základní onemocnění, ale pouze koriguje jeden z jeho symptomů. Kritická akutní hypoxie vede obvykle ke smrti buňky a normalizace oxemie je v takovýchto případech nezbytná. Subletální protrahovaná hypoxie, která je častou variantou vyskytující se v intenzivní péči, ovšem vede k rozvoji celého spektra adaptačních procesů na systémové a celulární úrovni. Snaha o nekritickou normalizaci oxemie může tyto adaptační procesy narušit. Liberální podávání kyslíku také často vede k riziku nežádoucí. Z tohoto důvodu byly definovány dva relativně recentní koncepty oxygenoterapie:
- precizní kontrole arteriální oxemie,
- permisivní hypoxemii.
První z konceptů má díky svému patofyziologickému opodstatnění reálnou perspektivu využití v klinické praxi, zatímco druhý koncept je diskutován zatím pouze na experimentální úrovni. Klinické studie v posledních letech začínají přinášet důkazy, že tolerance nižších hladin oxemie a redukce nadměrného přívodu kyslíku do organismu má pozitivní efekt na klinický výsledek pacientů nejen v intenzivní péči.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Jan Máca, Ph.D.,
Klinika anesteziologie, resuscitace a intenzivní medicíny LF OU a FN,
17. listopadu 1790,
708 52 Ostrava - Poruba
Cit. zkr: Vnitř Lék 2020; 66(E-2): e29–e36
Článek přijat redakcí: 22. 1. 2019
Článek přijat k publikaci: 14. 3. 2019
Sources
1. Martin DS, Grocott MP. Oxygen therapy in critical illness: precise control of arterial oxygenation and permissive hypoxemia. Crit Care Med 2013; 41 : 423–432.
2. Stub D, Smith K, Bernard S, et al. AVOID Study. A randomized controlled trial of oxygen therapy in acute myocardial infarction Air Verses Oxygen In myocardial infarction study (AVOID Study). Am Heart J 2012; 163 : 339–345.
3. Kallet RH, Matthay MA. Hyperoxic acute lung injury. Respir Care 2013; 58 : 123-141.
4. del Portillo IP, Vázquez ST, Mendoza JB, et al. Oxygen Therapy in Critical Care: A Double Edged Sword. Health 2014; 6 : 2035–2046.
5. Combes A, Bréchot N, Luyt CE, et al. Indications for extracorporeal support: why do we need the results of the EOLIA trial? Med Klin Intensivmed Notfmed 2018; 113: (Suppl. 1): 21–25.
6. Barret K, Brooks H, Biotano S et al. Ganong’s Review of Medical Physiology. 23th ed., New York: The McGraw -Hill Companies, Inc; 2010.
7. Michiels C. Physiological and Pathological Responses to Hypoxia. Am J Pathol 2004; 164 : 1875–1882.
8. Semenza GL. Hypoxia -Inducible Factors in Physiology and Medicine. Cell 2012; 148 : 399–408.
9. Burša F, Pleva L, Máca J, et al. Tissue ischemia microdialysis assessments following severe traumatic haemorrhagic shock: lactate/pyruvate ratio as a new resuscitation end point? BMC Anesthesiol 2014; 14 : 118.
10. Sylvester JT, Shimoda LA, Aaronson PI, et al. Hypoxic pulmonary vasoconstriction. Phys Rev 2012; 92 : 367–520.
11. Post JM, Hume JR, Archer SL, et al. Direct role for potassium channel inhibition in hypoxic pulmonary vasoconstriction. Am J of Phys 1992; 262: C882–C890.
12. Wang L, Yin J, Nickles HT, et al. Hypoxic pulmonary vasoconstriction requires connexin 40-mediated endothelial signal conduction. J of Clin Invest 2012; 122 : 4218–4230.
13. Marsin AS, Bertrand L, Rider MH, et al. Phosphorylation and activation of heart PFK2 by AMPK has a role in the stimulation of glycolysis during ischaemia. Curr Biol 2000; 10 : 1247–1255.
14. Hardie DG, Hawley SA. AMP -activated protein kinase: the energy charge hypothesis revisited. Bioessays 2001; 23 : 1112–1119.
15. Boutilier RG, St -Pierre J. Surviving hypoxia without really dying. Comp Biochem Physiol 2000; 126 : 481–490.
16. Schumacker PT, Chandel N, Agusti AG. Oxygen conformance of cellular respiration in hepatocytes. Am J Physiol 1993; 265: L395–L402.
17. Semenza GL. Life with Oxygen. Science 2007; 318 : 62–64.
18. Eltzschig HK, Carmeliet P. Hypoxia and inflammation. N Engl J Med 2011; 364 : 656–665.
19. Schjørring OL, Rasmussen BS. The paramount parameter: arterial oxygen tension versus arterial oxygen saturation as target in trials on oxygenation in intensive care. Critical Care 2018; 22 : 324.
20. Abdelsalam M, Cheifetz IM. Goal -directed therapy for severely hypoxic patients with acute respiratory distress syndrome: permissive hypoxemia. Respir Care 2010; 55 : 1483–1490.
21. The Acute Respiratory Distress Syndrome Network. Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome. N Engl J Med 2000; 342 : 1301–1308.
22. Guérin C, Reignier J, Richard JC, et al. PROSEVA Study Group. Prone positioning in severe acute respiratory distress syndrome. N Engl J Med 2013; 368 : 2159–2168.
23. Akmal AH, Hasan M. Role of nitric oxide in management of acute respiratory distress syndrome. Ann Thorac Med 2008; 3 : 100–103.
24. Ferguson N, Cook D, Guyatt H, et al. High -frequency oscillation in early acute respiratory distress syndrome. N Engl J Med 2013; 368 : 795–805.
25. Combes A, Hajage D, Capellier G, et al. EOLIA Trial Group, REVA, and ECMONet. Extracorporeal Membrane Oxygenation for Severe Acute Respiratory Distress Syndrome. N Engl J Med 2018; 378 : 1965–1975.
26. Girardis M, Busani S, Damiani E, et al. Effect of Conservative vs Conventional Oxygen Therapy on Mortality Among Patients in an Intensive Care Unit: The Oxygen -ICU Randomized Clinical Trial. JAMA 2016; 316 : 1583–1589.
27. Chu DK, Kim LH, Young PJ, et al. Mortality and morbidity in acutely ill adults treated with liberal versus conservative oxygen therapy (IOTA): a systematic review and meta - -analysis. Lancet 2018; 391 : 1693–1705.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2020 Issue 2-
All articles in this issue
- Inkretinová léčba diabetu a kardiovaskulární komplikace
- SGLT-2 inhibitory a jejich postavení v současné medicíně
- Obezita a kardiovaskulární onemocnění
- Diabetická noha
- Diosmin/hesperidin – spolupracující tandem nebo je diosmin klíčový a hesperidin jen neúčinnou příměsí?
- Stárnutí cév a vaskulární paměť
- Klinické aspekty depozice tuku v epikardu
- Adipocytokíny a tyreopatie
- Thymom – možnosti diagnostiky
- Aktuality v léčbě a prevenci klostridiové kolitidy
- Hypoxemie/hypoxie a nové koncepty oxygenoterapie v intenzivní péči
- Celiakie dospělých
- Cushingov syndróm a akromegália na podklade pikoadenómu hypofýzy
- Vrozený deficit C2 složky komplementu – variabilní klinická manifestace (kazuistiky a přehled problematiky)
- Diferenciální diagnostika hypoglykemie
- Co přináší internistům nové doporučení ESC – diabetes?
- Diabetes a kardiovaskulární onemocnění
- Epidemiologie infekcí vyvolaných Clostridium difficile (CDI) v České republice
- Extraintestinální projevy celiakie
- RECENZE KNIHY ÚVOD DO VNITŘNÍHO LÉKAŘSTVÍ – doc. MUDr. Jitka Mlíková Seidlerová, Ph.D., a kol.
- Pioglitazon
- Relation between testosterone levels and body composition, physical functioning and selected biochemical parameters in adult males
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Diferenciální diagnostika hypoglykemie
- Hypoxemie/hypoxie a nové koncepty oxygenoterapie v intenzivní péči
- Thymom – možnosti diagnostiky
- Diosmin/hesperidin – spolupracující tandem nebo je diosmin klíčový a hesperidin jen neúčinnou příměsí?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

