-
Medical journals
- Career
Stárnutí cév a vaskulární paměť
Authors: Jan Václavík
Authors‘ workplace: Centrum pro hypertenzi, I. interní klinika – kardiologická, FN a LF UP Olomouc
Published in: Vnitř Lék 2020; 66(2): 104-110
Category:
Overview
Při stárnutí cév dochází k postupným změnám jejich struktury a funkce. Tento proces ovlivňuje životospráva a přítomnost modifikovatelných rizikových faktorů. Stav cév lze klinicky hodnotit měřením arteriální tuhosti nebo indexu kotník‑paže. Vaskulární věk pacienta je možné kalkulovat pomocí projektu SCORE a udává, jaký věk by měl člověk se stejným vypočteným kardiovaskulárním rizikem, jehož rizikové faktory byly všechny v normálním rozmezí. Pozitivně lze vaskulární věk ovlivnit režimovými opatřeními, hypolipidemickou léčbou statiny a také farmakoterapií hypertenze, zejména inhibitory systému renin‑angiotenzin‑aldosteron. Dlouhodobé sledování pacientů v minulosti zařazených v klinických studiích s antihypertenzivy a hypolipidemiky svědčí pro existenci tzv. vaskulární paměti organismu, neboť příznivé účinky těchto intervencí na ovlivnění kardiovaskulární morbidity a mortality přetrvávají ještě řadu let po ukončení těchto studií. Včasné zahájení preventivních opatření má výraznější efekt.
Klíčová slova:
stárnutí cév – vaskulární věk – kardiovaskulární rizikové faktory – intervence – metabolická paměť – vaskulární paměť
Fyziologické stárnutí cév
Při stárnutí organismu dochází také k postupným změnám struktury a funkce tepen (1). Tyto změny vedou ke snižování poddajnosti tepen, nárůstu tuhosti a kalcifikaci jejich stěny, poklesu schopnosti endotelem zprostředkované vazodilatace a fibrinolýzy. Následkem těchto změn je zvýšení arteriálního a pulzního tlaku a aktivace sympatiku.
Mechanismy vedoucí ke stárnutí cév jsou znázorněny na Obr. 1. V průběhu života v cévách postupně začínají převažovat vazokonstrikční a zánětlivé faktory nad vazodilatačními. S narůstajícím věkem se postupně zvyšuje tvorba angiotenzinu II, endothelinu-1 a vaskulární NADPH oxidázy (1). Výsledný oxidační stres urychluje proces cévního stárnutí prostřednictvím několika mechanismů, které zahrnují chronickou zánětlivou aktivaci, fibrózu cév, arteriální tuhnutí a kalcifikaci. Dochází také k molekulárním změnám – zkracování telomer DNA, poškození DNA a epigenetickým modifikacím genů vedoucím ke změnám ve funkcích kódovacích proteinů.
Image 1. Molekulární mechanismy vaskulárního stárnutí (Upraveno dle Barton M et al. http://dx.doi.org/10.1016/j.cjca.2016.02.062) 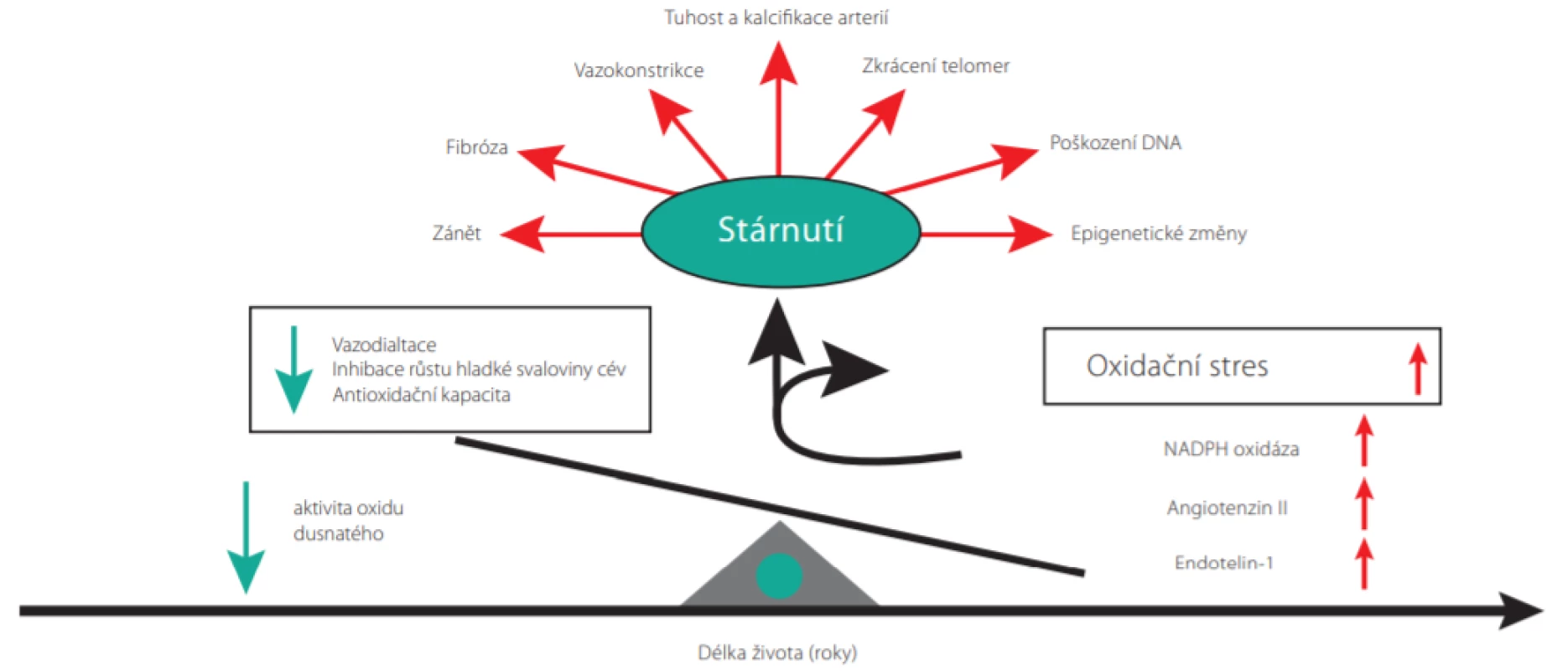
V procesu vaskulárního stárnutí hraje také významnou roli systém renin -angiotenzin -aldosteron (RAAS) (2, 3). Angiotenzin II indukuje aktivaci jaderného faktoru kappa B (NF -κB), expresi interleukinu 6 (IL6), monocytárního chemoatraktantního proteinu-1 (MCP-1) a tumor necrosis faktoru α (TNF -α) v monocytech a hraje významnou roli v iniciaci a progresi zánětu a aterogeneze. Zvýšená koncentrace angiotenzinu II ve stáří také zvýšením aktivity NADPH oxidázy zvyšuje produkci reaktivních forem kyslíku a přispívá k vyššímu oxidativnímu stresu. Prozánětlivé a profibrotické účinky aldosteronu přispívají k rozvoji tkáňové ischemie a fibrózy orgánů a ve spojení s makrofágy indukují myokardiální fibrózu a remodelaci cév (Obr. 2.) (2).
Image 2. Role angiotenzinu II a aldosteronu v procesu vaskulárního stárnutí. Rozvoj zánětu a remodelace cévní stěny vede k narůstající tuhosti tepen. NF-αB – jaderný faktor kappa B, IL-6 – interleukin 6, MCP-1 – monocytární chemoatraktantní protein-1, TNF-α – tumor necrosis faktor α (Upraveno dle Neves MA et al. 2017. https://doi.org/10.1007/s40292-018-0252-5) 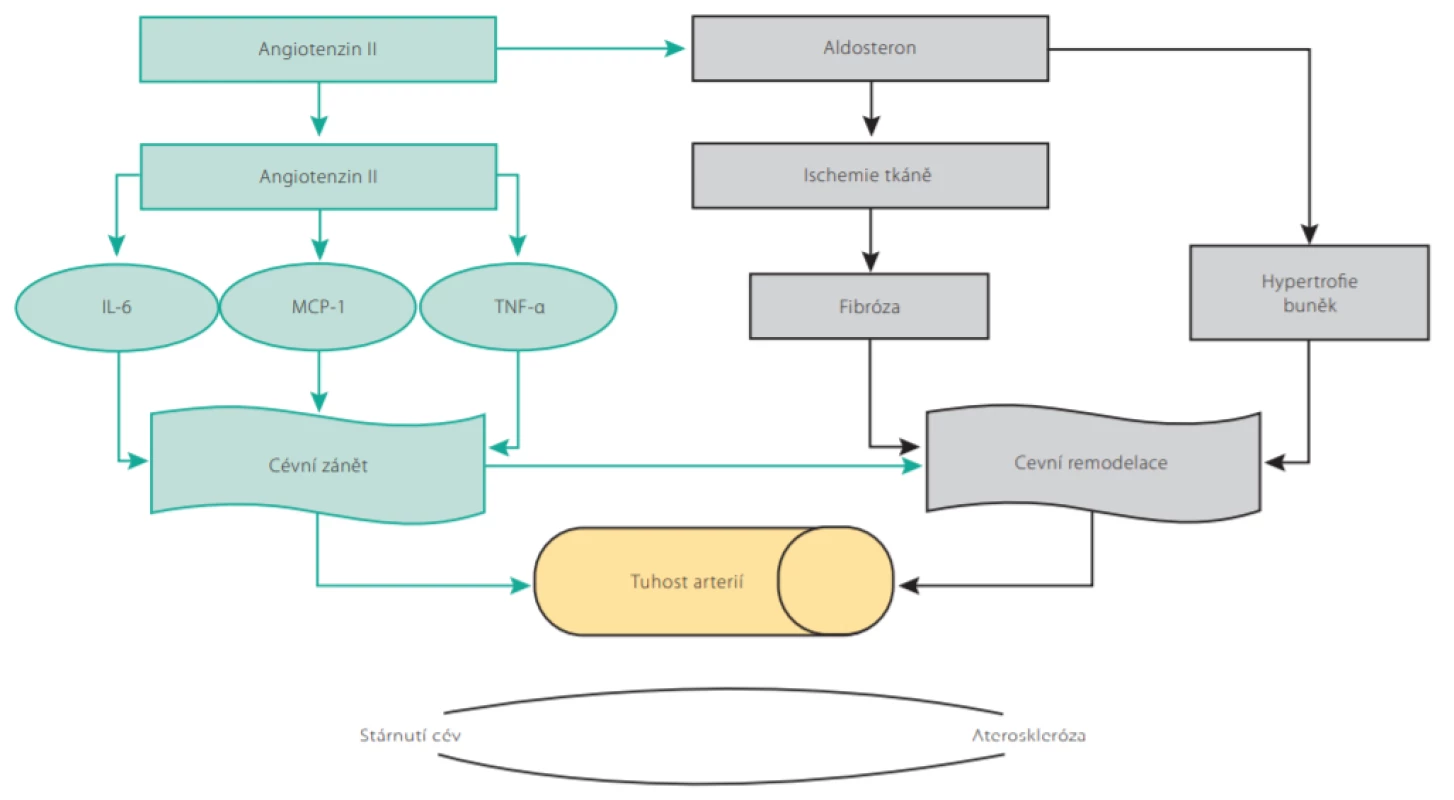
Proces stárnutí cév je velmi zásadně ovlivněn nepřítomností, nebo naopak přítomností či přetrváváním modifikovatelných rizikových faktorů. Kouření, přítomnost obezity, hypertenze, dyslipidemie, diabetu mellitu nebo např. chronického onemocnění ledvin tento proces výrazně urychluje. Terapeutické ovlivnění těchto rizikových faktorů, ať již farmakologicky nebo změnami životosprávy, může proces cévního stárnutí a aterosklerózy zpomalit, zastavit, nebo dokonce částečně zvrátit.
Klinické hodnocení vaskulárního věku
Vaskulární věk můžeme klinicky hodnotit měřením arteriální tuhosti (na základě karoticko-femorální nebo pažně-kotníkové rychlosti pulzní vlny) nebo indexu kotník-paže (ABI, ankle -brachial index).
Při stárnutí stěny velké tepny dochází k postupnému snižování obsahu elastinu, které souběžně se zvyšováním množství kolagenu a změnami mezibuněčné matrix vede ke zvýšené tuhosti tepny. Toho je využíváno při měření karotidofemorální rychlosti pulzní vlny (PWV, pulse wave velocity), která je v současnosti považována za zlatý standard v měření tuhosti tepen (4). Jelikož tužší cévní stěna vede pulzní vlnu rychleji, PWV > 10 m/s je považována za patologickou a je také nezávislým prediktorem KV příhod u hypertoniků. V praxi se provádí měření vzdálenosti mezi místem bifurkace karotických tepen a femorální tepnou v třísle (násobené koeficientem 0,8), a dále časového zpoždění mezi začátkem pulzní vlny v karotické tepně a femorální tepně (viz Obr. 3.). Tradičně se k tomuto účelu používaly přístroje s tlakovými čidly (např. přístroje Sphygmocor, Complior) nebo manžetové přístroje (brachial -ankle PWV – Omron VP 1000, cardio -ankle PWW – CAVI -Vasera). Širší rozšíření měření PWV v praxi by mohly přinést metody využívající běžnou cévní ultrazvukovou sondu s cyklováním pomocí EKG (čas od vrcholu kmitu R k začátku dopplerovského toku v tepně), jejichž první výsledky jsou velmi slibné.
Image 3. Měření rychlosti karotido-femorální pulzní vlny hodnotící časové zpoždění mezi začátkem systolické vlny v oblasti karotické a femorální tepny a vzdálenosti obou registrovaných míst (Upraveno podle: Laurent S et. al. Eur Heart J 2006; 27: 2588–2605.) 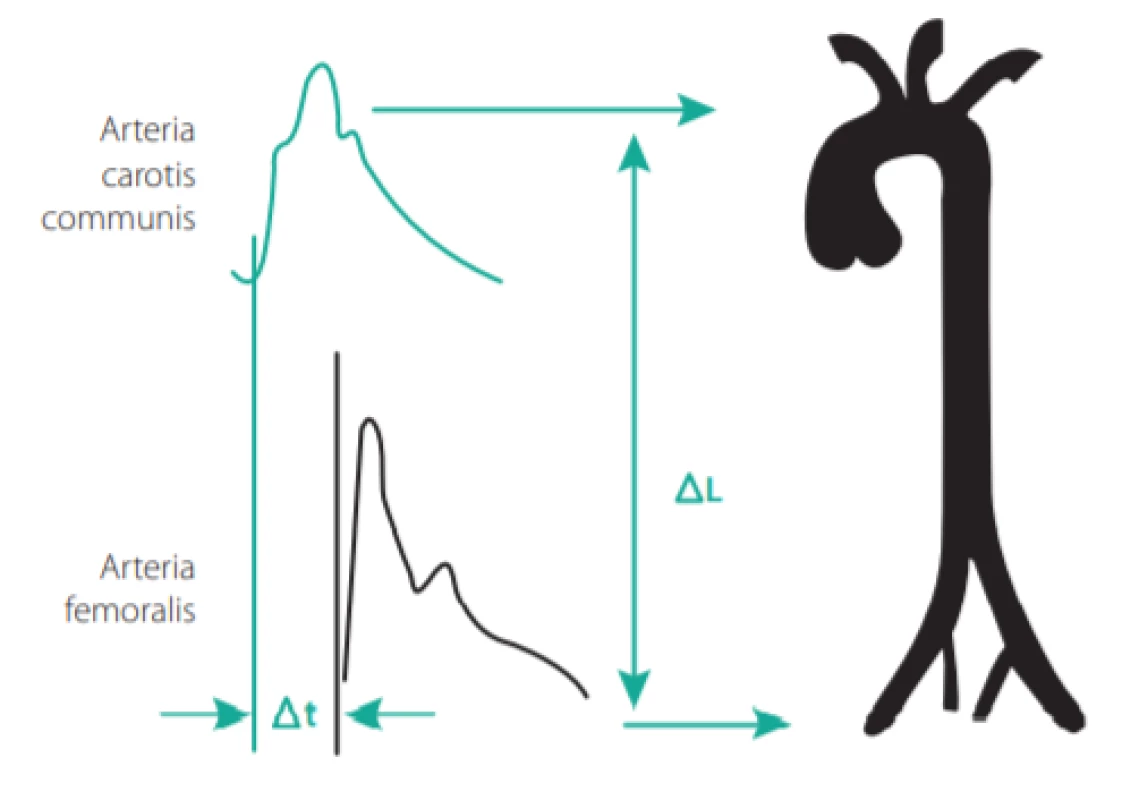
Řada studií i metanalýz prokázala, že aortální tuhost je nezávislým prediktorem celkové i kardiovaskulární (KV) mortality, koronárních příhod i CMP. Vysoká rychlost pulzní vlny tedy představuje poškození cílového orgánu. Výhodou stanovení aortální tuhosti je, že integruje kumulativní poškození aortální stěny KV rizikovými faktory za dlouhé období, zatímco jednotlivé rizikové faktory, jako je krevní tlak, glykemie a hladiny lipidů, v průběhu času kolísají a jejich aktuální hodnoty nemusí odrážet skutečný rozsah cévního poškození.
Index kotník -paže (ankle -brachial index, ABI) je definován jako poměr systolického TK naměřeného na kotníku k systolickému tlaku na paži (vyšší naměřená hodnota z měření TK na levé a pravé paži). Jeho nízká hodnota < 0,9 svědčí pro přítomnost hemodynamicky významné stenózy v tepnách dolních končetin a obecně pro pokročilou aterosklerózu, a signalizuje dvojnásobně zvýšené desetileté riziko KV příhod a úmrtí. Při výrazných kalcifikacích periferních tepen při pokročilé ischemické chorobě dolních končetin jsou tepny špatně stlačitelné, hodnota ABI > 1,4 je proto rovněž považována za patologickou a měla by být indikací k podrobnějšímu vyšetření periferních tepen (5). Krevní tlak na kotníku je doporučováno měřit pomocí rtuťového sfygmomanometru a kontinuálního dopplerovského vyšetření (tužkové sondy), ale v naší praxi většinou používáme poloautomatický oscilometrický tonometr nasazený na kotník s čidlem v manžetě umístěným za vnitřním kotníkem.
Výpočet vaskulárního věku pomocí projektu SCORE
Jelikož měření tuhosti tepen není v České Republice v současnosti příliš rozšířeno, nabízí se pro využití v klinické praxi mnohem jednodušší výpočet vaskulárního rizika z tabulek SCORE.
Vaskulární věk dané osoby je definován jako věk, který by měl člověk se stejným vypočteným kardiovaskulárním rizikem, ale jehož rizikové faktory by byly všechny v normálním rozmezí, tj. s rizikem pouze kvůli věku a pohlaví (6). Zvažovanými rizikovými faktory jsou věk, pohlaví, kouření, hladina celkového cholesterolu, systolický krevní tlak a diabetes.
Máme -li např. 50letého pacienta, kuřáka, se systolickým tlakem 160 mm Hg a celkovým cholesterolem 7,0 mmol/l, jeho 10leté riziko úmrtí dle tabulek SCORE je 10%. Jeho vaskulární věk pak můžeme odečíst z Obr. 4., je roven 74 letům. Je možné jej také přímo odečíst z modifikovaných tabulek SCORE (Obr. 5.). Tento pacient má tedy stejnou pravděpodobnost zemřít na KV příhodu jako zdravý 74letý člověk (7). Jinými slovy, pokud nezmění své návyky a rizikové faktory, mohl by ztratit 24 let kardiovaskulárního života.
Image 4. Vaskulární věk u mužů a žen podle absolutního rizika fatálního kardiovaskulárního onemocnění v projektu SCORE pro vysoce rizikové země (Upraveno dle: Cuende JI et al. European Heart Journal (2010) 31, 2351–2358. doi:10.1093/eurheartj/ehq205) 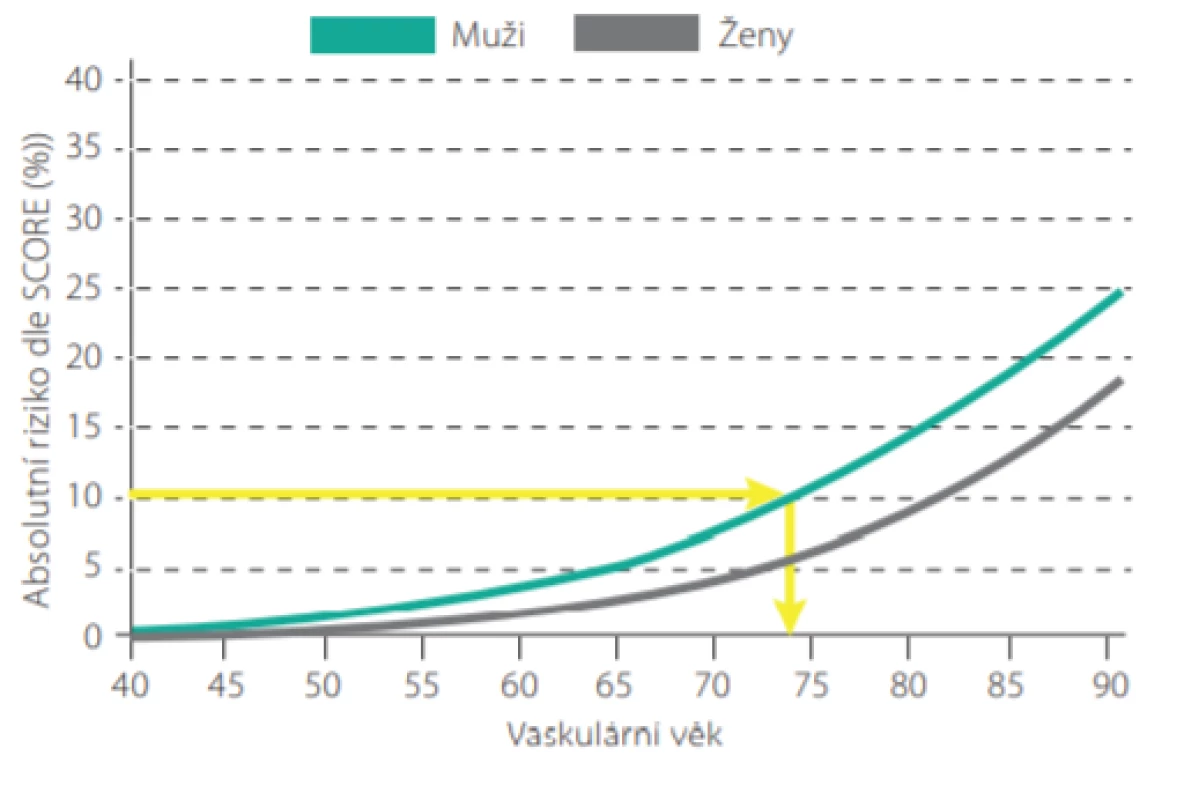
Image 5. Barevná tabulka cévního věku. Každý obdélník obsahuje číslo odpovídající vaskulárnímu věku a barvu odpovídající celkovému absolutnímu riziku fatálního kardiovaskulárního onemocnění podle projektu SCORE pro vysoce rizikové země. SBP – systolický krevní tlak (Upraveno dle: Cuende JI et al. European Heart Journal (2010) 31, 2351–2358. doi:10.1093/eurheartj/ehq205) 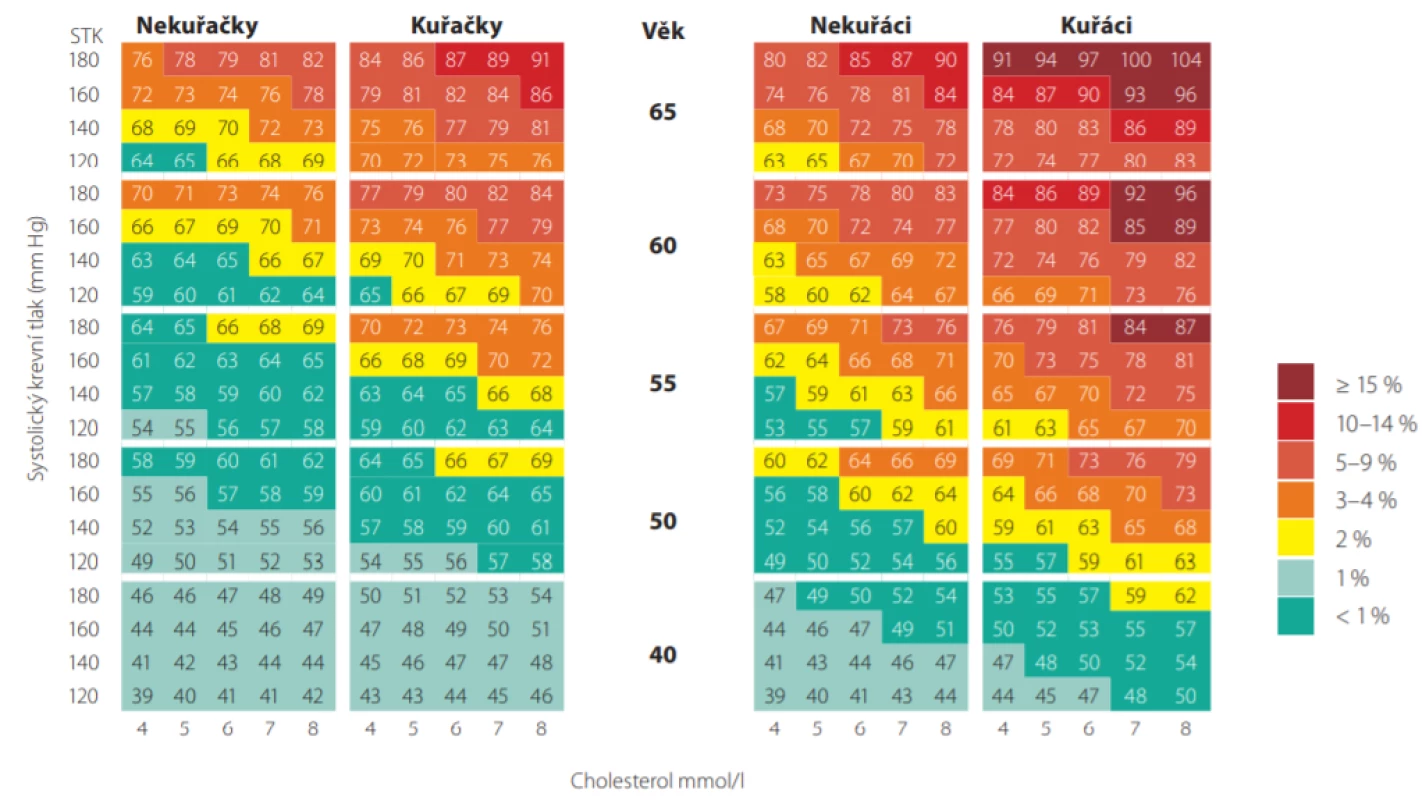
Téměř všichni mladší pacienti kolem 40. roku věku mají absolutní riziko SCORE (10leté úmrtí na KV příhody) nízké. Dle doporučených postupů je proto u mladších pacientů vhodnější provádět stanovení relativního rizika nebo stanovení tzv. vaskulárního věku (srovnání věku vyšetřovaného s věkem osoby se stejným vypočteným rizikem dle SCORE při optimální konstelaci rizikových faktorů) (8).
Může cévní věk usnadnit naši komunikaci s pacienty a zvýšit jejich motivaci k léčbě?
Jelikož jsou pacienti s KV rizikovými faktory zpravidla asymptomatičtí, jejich adherence k lékům a režimovým či dietním opatřením bývá často nízká. Koncept vaskulárního věku je poměrně jednoduchý a pro pacienty srozumitelný, je výhodné jej proto používat k edukaci pacientů a potenciálnímu zlepšení jejich adherence k léčbě.
Pro výše zmíněného pacienta nemusí být sdělení, že jeho riziko úmrtí na KV příhodu během následujících 10 let je 10%, vůbec alarmující, protože stále má „90% šanci, že dané období přežije“. Sdělení, že jeho tepny jsou ve stavu jako u 74letého člověka, ačkoliv v občanském průkazu má věk 50 let, jej bude pravděpodobně k léčbě motivovat více.
Skutečnost, že cévní věk může být účinným pomocníkem při komunikaci s pacienty, potvrdila studie španělských lékařů, kteří randomizovali více než 3 000 pacientů do tří skupin: jedné poskytli standardní lékařské doporučení ohledně režimových opatření, druhé skupině byla sdělena hodnota jejich KV rizika a třetí skupina byla informována o svém cévním věku. Pokles jednotlivých rizikových faktorů po 12 měsících byl výraznější u skupiny informované o KV riziku a nejvýraznější u skupiny informované o cévním věku (Tab. 1.). U skupiny, která byla informována o svém vaskulárním věku, došlo k nejvýraznějšímu poklesu celkového KV rizika (Obr. 6.) (9).
Image 6. Změna KV rizika po 12 měsících od edukace v závislosti na typu edukace pacienta (Upraveno dle Lopez-Gonzalez AA et al. Eur J Prev Cardiol. 2015; 22(3): 389–396.) 
Table 1. Změna charakteristik účastníků studie po 12 měsících od edukace 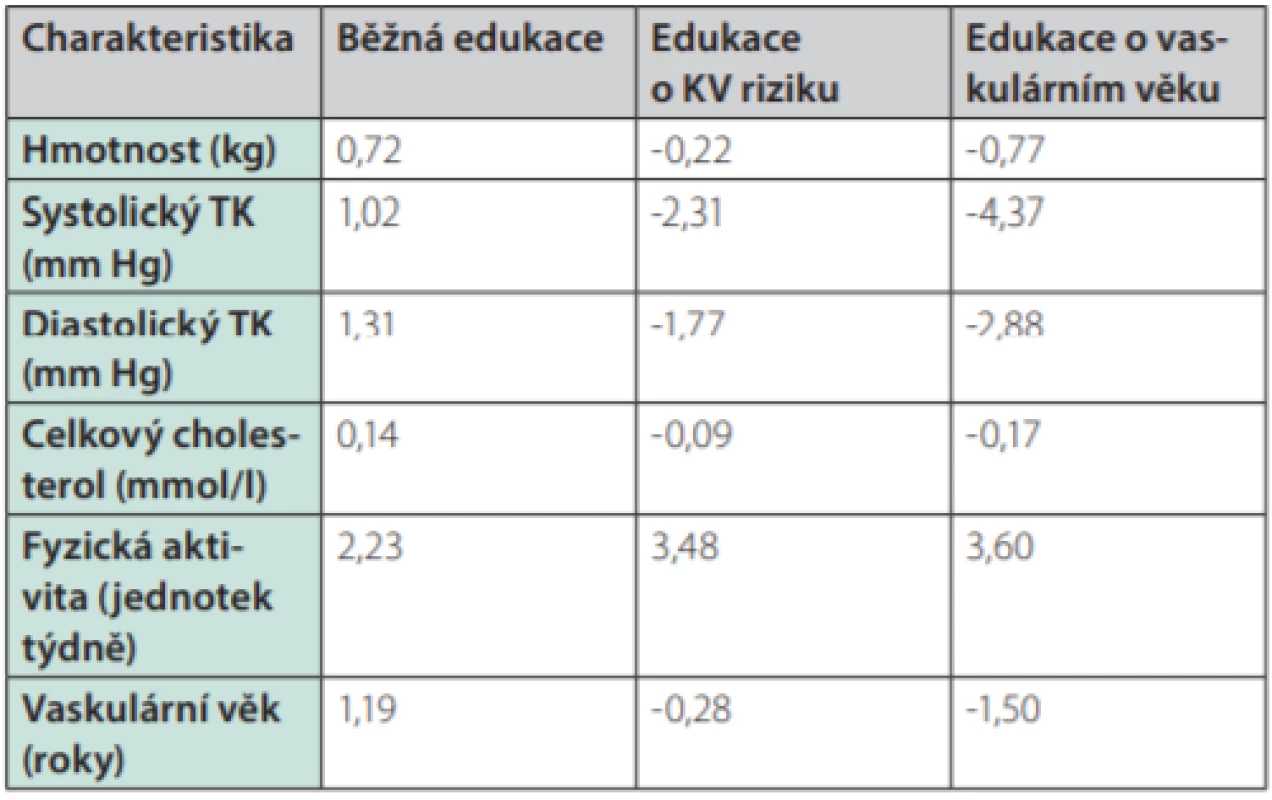
Jak můžeme ovlivnit vaskulární věk našich pacientů?
Recept se zdá být jednoduchý: nalézt, intervenovat a dobře kontrolovat všechny ovlivnitelné rizikové faktory…
Pro všechny věkové skupiny jsou zásadní změny životního stylu. Pacienti by měli v případě nadváhy či obezity redukovat svoji hmotnost a optimálně dosáhnout normální váhy, ať již prostou restrikcí kalorického příjmu nebo středomořskou dietou. Měli by přestat kouřit a pravidelně cvičit, optimálně každodenně. Nadměrný přísun soli přispívá k nárůstu tuhosti tepen několika různými mechanismy (rozvoj hypertrofie cévní stěny, změny metabolismu kolagenu a produkce NO, aktivace sympatiku a RAAS) a měl by být rovněž omezen (1, 10).
Jelikož v dlouhodobých studiích vedlo snížení krevního tlaku všemi dostupnými skupinami antihypertenziv ke snížení tuhosti tepen, je pravděpodobné, že tuhost tepen je příznivě ovlivněna samotným snížením krevního tlaku. Při srovnatelném poklesu krevního tlaku ale docházelo k výraznějšímu ovlivnění arteriální tuhosti při léčbě ACE -inhibitory a sartany, což nasvědčuje na krevním tlaku nezávislému mechanismu působení inhibitorů RAS (11).
V současnosti se většina expertů shoduje, že inhibice RAS je nejlepším farmakologickým přístupem ke zmírnění cévního stárnutí. Metaanalýzy prokázaly, že ACE inhibitory dokážou zmírnit cévní stárnutí hodnocené PWV a zlepšit odrazy arteriální vlny u pacientů se zvýšenou arteriální tuhostí zapříčiněnou různými patologickými stavy (1).
Významnou roli u ACE inhibitorů hraje také podávaná dávka. V randomizované studii po 7 měsících užívání perindoprilu při nevýznamném rozdílu v poklesu krevního tlaku došlo k významně většímu poklesu průměru karotické tepny a nárůstu její roztažitelosti při užívání dávky 8 mg perindoprilu denně oproti 4 mg (12). Ovlivnění tuhosti karotické tepny tedy bylo nezávislé na krevním tlaku, ale závislé na podávané dávce ACE -inhibitoru.
Statiny rovněž dokážou zpomalit vaskulární stárnutí, a to jak snížením lipidů, tak i účinky nezávislými na snížení lipidů: snižují oxidativní stres inhibicí NADPH -oxidázy, zvyšují aktivitu NO -syntázy a tím i dostupnost NO v endotelu a inhibují zánětlivé procesy v cévní stěně. Schopnost statinů snižovat arteriální tuhost byla prokázána v řadě klinických studií. U hypertoniků vedlo užívání atorvastatinu v dávce 10 mg denně po dobu 6 měsíců oproti placebu k významnému poklesu rychlosti pulzní vlny (o 25 %) (13). U pacientů s ICHS snížil atorvastatin v dávce 10 mg denně po půlročním užívání tuhost tepen hodnocenou PWV výrazně více, než by odpovídalo poklesu sérových lipidů (14). U pacientů s obezitou postačilo pouhých 12 týdnů užívání atorvastatinu k významnému poklesu aortální PWV (15).
Ve studii EASY -FIT vedla během 12 měsíců sledování vyšší dávka atorvastatinu 20 mg denně oproti kontrolní skupině užívající 5 mg denně kromě vyššího poklesu hladiny aterogenních lipoproteinů v séru a zánětlivých biomarkerů také k výraznějšímu nárůstu tloušťky fibrózní čepičky aterosklerotického plátu koronárních arterií hodnocenému optickou koherentní tomografií (o 69 % vs. 17 % u pacientů užívajících 5 mg, p < 0,001) (16).
Z dalších lékových skupin, které příznivě ovlivňují arteriální tuhost a stárnutí, lze jmenovat ještě antagonisty aldosteronových receptorů (spironolakton a eplerenon), přímé inhibitory reninu, protizánětlivé léky (kortikoidy, anti -TNFα léčba) inhibitory fosfodiesterázy-5 nebo antidiabetika (thiazolidindiony) (1). Řada dalších lékových skupin potenciálně ovlivňujících arteriální tuhost je momentálně ve vývoji.
Metabolická a vaskulární paměť
O fenoménu tzv. metabolické paměti u diabetiků se začalo hovořit po uveřejnění výsledků studie DCCT/EDIC v roce 2005. V iniciální aktivní části studie (průměrně 6,5 let) došlo u pacientů léčených intenzivní inzulinovou léčbou oproti standardní pouze k významné redukci mikrovaskulárních komplikací (retinopatie, albuminurie a neuropatie), nikoliv makrovaskulárních. V dalším sledování měly obě skupiny srovnatelnou léčbu a hodnoty glykovaného hemoglobinu se vyrovnaly v 11. roce, přesto v dlouhodobém sledování po 17 letech od začátku studie bylo zjištěno významné snížení výskytu kardiovaskulárních příhod (infarktů myokardu, CMP nebo KV úmrtí) o 57 % u pacientů iniciálně léčených intenzivně (17). Obdobný pozitivní pozdní efekt intenzivní léčby diabetu se projevil v dlouhodobém sledování pacientů 8,5 let po ukončení studie UKPDS významným snížením výskytu infarktů myokardu o 15 % a celkové úmrtnosti o 13 % (18).
Následně byl podobný pozdní efekt pozorován i při dlouhodobém sledování pacientů zařazených ve statinových studiích (19). U pacientů ze studie 4S užívajících simvastatin po dobu 5,4 let přetrvával příznivý efekt na ovlivnění mortality oproti pacientům zařazeným v placebové skupině ještě následujících 5 let. Podobně ve studiích Heart Protection Study (HPS) a WOSCOPS přetrvávalo snížení výskytu vaskulárních příhod u pacientů léčených statiny ještě následujících 6, 7, respektive 10 let po ukončení aktivní fáze studie.
Do studie ASCOT -LLA k hodnocení účinků atorvastatinu 10 mg denně v primární prevenci byli zařazeni pacienti s hypertenzí a hladinou celkového cholesterolu < 6,5 mmol/l. Studie byla předčasně ukončena po 3,3 letech pro jednoznačný přínos atorvastatinu na redukci primárního cíle studie (36% snížení výskytu nefatálních a fatálních koronárních příhod). I přes následnou aktivní léčbu obou skupin přetrvávalo ještě 8 let po ukončení studie významné snížení celkové mortality o 16 % u pacientů iniciálně užívajících atorvastatin (20).
Pozdní efekty se také projevují u antihypertenzní léčby. Ve studii HOPE vedlo u pacientů s vysokým rizikem KV příhod podávání 10 mg ramiprilu denně po dobu 4,5 let k významnému snížení výskytu KV příhod o 22 %. I během následného sledování po dobu dalších 7,2 let ve studii HOPE - -TOO přetrvávala významná redukce KV příhod o 17 % (21). Obdobně pozdní přínosy antihypertenzní léčby přetrvávaly po léčbě trandolaprilem (TRACE), enalaprilem (SOLVD) nebo nitrendipinem (SYST -EUR).
Recentně byla publikována analýza dokonce 16letého sledování pacientů zařazených původně ve studii ASCOT. Pacienti přiřazení v antihypertenzní větvi (ASCOT -BPLA) k léčbě založené na amlodipinu (s přidáním perindoprilu podle potřeby) měli oproti pacientům v atenololové větvi i po 16 letech sledování významně o 29 % snížený počet úmrtí na cévní mozkovou příhodu (viz Obr. 8a) (22). U pacientů dostávajících atorvastatin v lipidové větvi (ASCOT -LLA) přetrvávalo oproti pacientům dostávajícím placebo i při dlouhodobém sledování (více než 10 let po ukončení studie) významné snížení kardiovaskulární úmrtnosti o 15 % (Obr. 8b). Tato studie tedy prokazuje, že pozitivní „paměťový efekt“ antihypertenzní a hypolipidemické léčby v klinické studii může přetrvávat až 20 let.
Image 7. Změny rychlosti pulzních vln podle třídy hypertenzních léků v dlouhodobých studiích. P < 0,05 ve srovnání s placebem. ACEI – inhibitor angiotenzin konvertujícího enzymu; BB – betablokátor; CCB – blokátor vápníkových kanálů; DIUR – diuretikum (upraveno dle Ong KT et al. Journal of Hypertension 2011, 29: 1034–1042.) 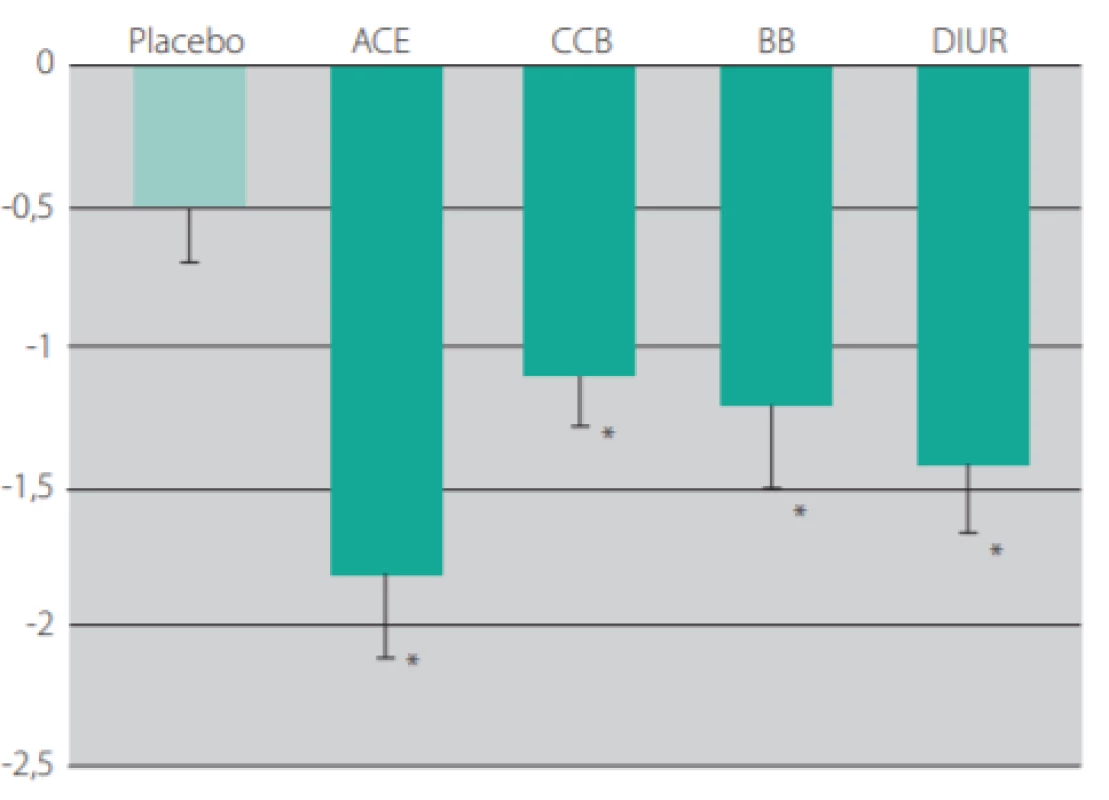
Image 8. a: Kumulativní incidence cévní mozkové příhody u pacientů ve studii ASCOT-BPLA s léčbou založenou na amlodipinu v porovnání atenololovou větví během 16letého sledování kohorty ASCOT-Legacy. b: Kumulativní incidence úmrtí z kardiovaskulárních příčin u pacientů s atorvastatinem přiděleným ve studii ASCOT-LLA oproti těm, kterým bylo přiděleno placebo během 16letého sledování kohorty ASCOT Legacy. BPLA – rameno snižující krevní tlak, LLA – rameno snižující cholesterol 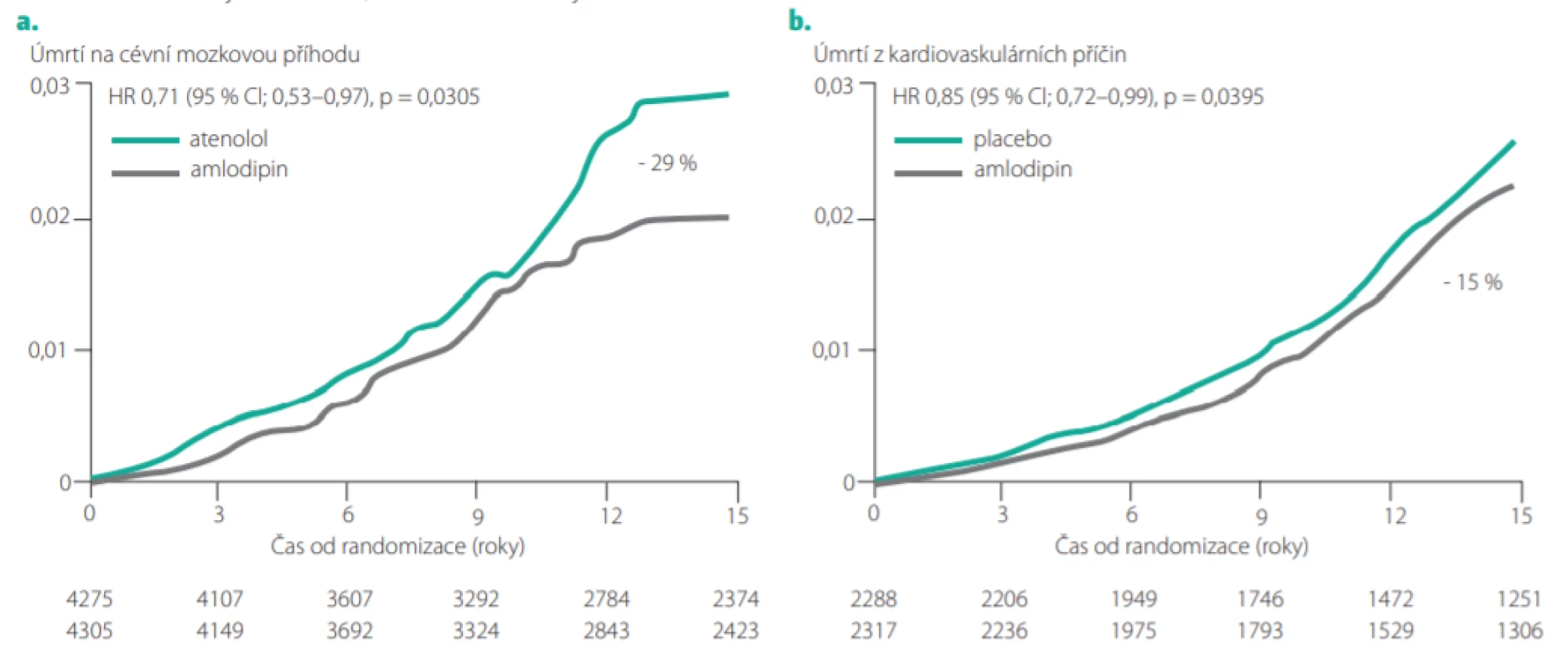
Všechny výše uvedené studie podporují hypotézu, že pozitivní terapeutické ovlivnění krevního tlaku a cholesterolu je spojeno s dlouhodobými přínosy a snížením výskytu kardiovaskulárních příhod a úmrtí přetrvávajícím ještě dlouhou dobu po ukončení intervence v klinických studiích. Můžeme v tomto smyslu hovořit o „vaskulární paměti“.
Včasná intervence a ovlivnění celkového rizika
Rozvoj subklinického poškození cév a orgánů a následný vznik manifestního kardiovaskulárního onemocnění závisí na celoživotní expozici kardiovaskulárním rizikovým faktorům (Obr. 9.) (23). Cílem preventivních opatření je zabránit předčasné manifestaci KV příhod, vedoucím k fyzickému a kognitivnímu postižení, ztrátě autonomie a snížení kvality života.
Image 9. Účinky preventivních opatření v ovlivnění celkového KV rizika. U jedinců s časným cévním stárnutím (zelená čára) dojde k rozvoji KV komplikací dříve v životě. Zelená čára představuje optimální nebo ideální životní cyklus u jedinců, u kterých nedojde ke vzniku KV komplikací vůbec nebo tak pozdě, že nevedou k podstatnému ovlivnění kvality života. Preventivní opatření vedou k posunu křivky v průběhu života směrem dolů a doprava (šedé šipky). Zahájení preventivních opatření v nižším věku (časná intervence, modrá přerušovaná čára) je účinnější než pozdní intervence (šedá přerušovaná čára) (Upraveno dle: Olsen MH et al. Lancet 2016; 388: 2665–2712.) 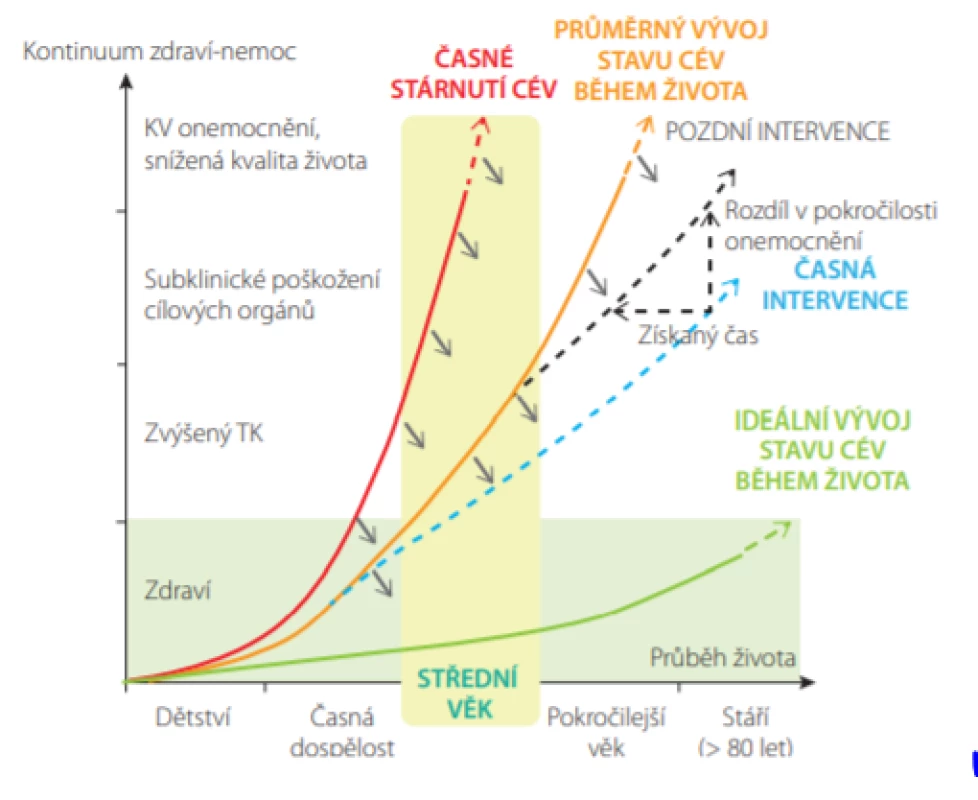
V průběhu života je možná intervence v různých stadiích – primordiální (před zvýšením jakéhokoliv rizikového faktoru), v primární nebo sekundární prevenci, a to zlepšením životního prostředí, změnami životního stylu, farmakologickou léčbou nebo kombinací těchto přístupů (23). V dnešní době již klinická data jednoznačně potvrzují, že čím dříve intervenci zahájíme, tím bude účinnější (Obr. 9.) (23).
KORESPONDENČNÍ ADRESA AUTORA:
prof. MUDr. Jan Václavík, Ph.D., FESC,
Centrum pro hypertenzi,
I. interní klinika – kardiologická, FN a LF UP Olomouc
Cit. zkr: Vnitř Lék 2020; 66(2): 104–110
Článek přijat redakcí: 2. 3. 2020
Článek přijat k publikaci: 9. 3. 2020
Sources
1. Barton M, Husmann M, Meyer MR. Accelerated Vascular Aging as a Paradigm for Hypertensive Vascular Disease: Prevention and Therapy. Can J Cardiol. 2016; 32(5): 680–686. e4. doi:10.1016/j.cjca.2016. 02. 062.
2. Neves MF, Cunha AR, Cunha MR, Gismondi RA, Oigman W. The Role of Renin–Angiotensin–Aldosterone System and Its New Components in Arterial Stiffness and Vascular Aging. High Blood Press Cardiovasc Prev. 2018; 25(2): 137–145. doi: 10.1007/s40292-018-0252-5.
3. Vlachopoulos C, Xaplanteris P, Aboyans V, et al. The role of vascular biomarkers for primary and secondary prevention. A position paper from the European Society of Cardiology Working Group on peripheral circulation. Atherosclerosis. 2015; 241(2): 507–532. doi:10.1016/j.atherosclerosis.2015. 05. 007.
4. Laurent S, Marais L, Boutouyrie P. The Noninvasive Assessment of Vascular Aging. Can J Cardiol. 2016; 32(5): 669–679. doi: 10.1016/j.cjca.2016. 01. 039.
5. Task A, Members F, Tendera M, et al. ESC GUIDELINES ESC Guidelines on the diagnosis and treatment of peripheral artery diseases. Document covering atherosclerotic disease of extracranial carotid The Task Force on the Diagnosis and Treatment of Peripheral Artery Diseases of the European Societ. 2011 : 2851–2906. doi: 10.1093/eurheartj/ehr211.
6. Cuende JI, Cuende N, Calaveras -Lagartos J. How to calculate vascular age with the SCORE project scales: A new method of cardiovascular risk evaluation. Eur Heart J. 2010; 31(19): 2351–2358. doi: 10.1093/eurheartj/ehq205.
7. Cuende JI. La edad vascular frente al riesgo cardiovascular: aclarando conceptos. Rev Española Cardiol. 2016; 69(3): 243–246. doi: 10.1016/j.recesp.2015. 10. 022.
8. Vráblík M, Piťha J, Blaha V, et al. Stanovisko výboru České společnosti pro aterosklerózu k doporučením ESC/EAS pro diagnostiku a léčbu dyslipidemií z roku 2019. Hypertenze a KV prevence 2019; 2 : 68–77.
9. Lopez -Gonzalez AA, Aguilo A, Frontera M, et al. Effectiveness of the Heart Age tool for improving modifiable cardiovascular risk factors in a Southern European population: A randomized trial. Eur J Prev Cardiol. 2015; 22(3): 389–396. doi:10.1177/2047487313518479.
10. Papakatsika S, Stabouli S, Antza C, Kotsis V. Early Vascular Aging: A New Target for Hypertension Treatment. Curr Pharm Des. 2015; 22(1): 122–126. doi: 10.2174/1381612822666151109112813.
11. Ong KT, Delerme S, Pannier B, et al. Aortic stiffness is reduced beyond blood pressure lowering by short -term and long -term antihypertensive treatment: A meta -analysis of individual data in 294 patients. J Hypertens. 2011; 29(6): 1034–1042. doi: 10.1097/ HJH.0b013e328346a583.
12. Tropeano AI, Boutouyrie P, Pannier B, et al. Brachial pressure -independent reduction in carotid stiffness after long -term angiotensin -converting enzyme inhibition in diabetic hypertensives. Hypertension. 2006; 48(1): 80–86. doi: 10.1161/01.HYP.0000224283.76347.8c.
13. Kanaki AI, Sarafidis PA, Georgianos PI, et al. Effects of low -dose atorvastatin on arterial stiffness and central aortic pressure augmentation in patients with hypertension and hypercholesterolemia. Am J Hypertens. 2013; 26(5): 608–616. doi:10.1093/ajh/hps098.
14. Meng X, Qie L, Wang Y, Zhong M, Li L. Assessment of arterial stiffness affected by atorvastatin in coronary artery disease using pulse wave velocity. Clin Investig Med. 2009; 32(6): 238–243.
15. Ballard KD, Taylor BA, Capizzi JA, Grimaldi AS, White CM, Thompson PD. Atorvastatin Treatment Does Not Alter Pulse Wave Velocity in Healthy Adults. Int Sch Res Not. 2014; 2014 : 1–5. doi: 10.1155/2014/239575.
16. Komukai K, Kubo T, Kitabata H, et al. Effect of atorvastatin therapy on fibrous cap thickness in coronary atherosclerotic plaque as assessed by optical coherence tomography: the EASY -FIT study. J Am Coll Cardiol. 2014; 64(21): 2207–2217.
17. Nathan DM, Cleary PA, Backlund JYC, et al. Intensive diabetes treatment and cardiovascular disease in patients with type 1 diabetes. N Engl J Med. 2005; 353(25): 2643–2653. doi: 10.1056/NEJMoa052187.
18. Holman RR, Paul SK, Bethel MA, Matthews DR, Neil HAW. 10-Year follow -up of intensive glucose control in type 2 diabetes. N Engl J Med. 2008; 359(15): 1577–1589. doi: 10.1056/ NEJMoa0806470.
19. Simes J, Simes RJ, Hunt D, et al. Long -term effectiveness and safety of pravastatin in 9014 patients with coronary heart disease and average cholesterol concentrations: The LIPID trial follow -up. Lancet. 2002; 359(9315): 1379–1387. doi: 10.1016/ S0140-6736(02)08351-4.
20. Sever PS, Chang CL, Gupta AK, Whitehouse A, Poulter NR. The Anglo -Scandinavian Cardiac Outcomes Trial: 11-year mortality follow -up of the lipid -lowering arm in the UK. Eur Heart J. 2011; 32(20): 2525–2532. doi: 10.1093/eurheartj/ehr333.
21. Bosch J, Lonn E, Pogue J, Arnold JMO, Dagenais GR, Yusuf S. Long -term effects of Ramipril on cardiovascular events and on diabetes: Results of the HOPE study extension. Circulation. 2005; 112(9): 1339–1346. doi: 10.1161/CIRCULATIONAHA.105.548461.
22. Gupta A, Mackay J, Whitehouse A, et al. Long -term mortality after blood pressure-lowering and lipid -lowering treatment in patients with hypertension in the Anglo-Scandinavian Cardiac Outcomes Trial (ASCOT) Legacy study: 16-year follow -up results of a randomised factorial trial. Lancet. 2018; 392(10153): 1127–1137. doi: 10.1016/S0140 - 6736(18)31776-8.
23. Olsen MH, Angell SY, Asma S, et al. A call to action and a lifecourse strategy to address the global burden of raised blood pressure on current and future generations: the Lancet Commission on hypertension. Lancet 2016; 388 : 2665–2712.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2020 Issue 2-
All articles in this issue
- Inkretinová léčba diabetu a kardiovaskulární komplikace
- SGLT-2 inhibitory a jejich postavení v současné medicíně
- Obezita a kardiovaskulární onemocnění
- Diabetická noha
- Diosmin/hesperidin – spolupracující tandem nebo je diosmin klíčový a hesperidin jen neúčinnou příměsí?
- Stárnutí cév a vaskulární paměť
- Klinické aspekty depozice tuku v epikardu
- Adipocytokíny a tyreopatie
- Thymom – možnosti diagnostiky
- Aktuality v léčbě a prevenci klostridiové kolitidy
- Hypoxemie/hypoxie a nové koncepty oxygenoterapie v intenzivní péči
- Celiakie dospělých
- Cushingov syndróm a akromegália na podklade pikoadenómu hypofýzy
- Vrozený deficit C2 složky komplementu – variabilní klinická manifestace (kazuistiky a přehled problematiky)
- Diferenciální diagnostika hypoglykemie
- Co přináší internistům nové doporučení ESC – diabetes?
- Diabetes a kardiovaskulární onemocnění
- Epidemiologie infekcí vyvolaných Clostridium difficile (CDI) v České republice
- Extraintestinální projevy celiakie
- RECENZE KNIHY ÚVOD DO VNITŘNÍHO LÉKAŘSTVÍ – doc. MUDr. Jitka Mlíková Seidlerová, Ph.D., a kol.
- Pioglitazon
- Relation between testosterone levels and body composition, physical functioning and selected biochemical parameters in adult males
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Diferenciální diagnostika hypoglykemie
- Hypoxemie/hypoxie a nové koncepty oxygenoterapie v intenzivní péči
- Thymom – možnosti diagnostiky
- Diosmin/hesperidin – spolupracující tandem nebo je diosmin klíčový a hesperidin jen neúčinnou příměsí?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

