-
Medical journals
- Career
Markery oxidačného a karbonylového stresu v plazme a slinách u chorých s akútnou intermitentnou porfýriou
Authors: Miroslav Mydlík 1,2; Katarína Derzsiová 1; Ivana Koborová 3; Katarína Šebeková 3
Authors‘ workplace: IV. interná klinika LF UPJŠ v Košiciach a UN L. Pasteura Košice, Slovenská republika 1; Ústav experimentálnej medicíny LF UPJŠ v Košiciach, Slovenská republika 2; Ústav molekulárnej biomedicíny LF UK v Bratislave, Slovenská republika 3
Published in: Vnitř Lék 2016; 62(Suppl 6): 25-29
Category: Original Contributions
Overview
Úvod:
Akútna intermitentná porfýria (AIP) je autozomálna dedičná choroba spôsobená deficitom 3. enzýmu v metabolickej ceste biosyntézy hemu, porfobilinogén deaminázy. Klinický priebeh tejto choroby je charakterizovaný akútnymi záchvatmi, najčastejšie s bolesťou brucha.
Cieľom našej štúdie bolo vyšetriť niektoré markery oxidačného a karbonylového stresu v plazme a slinách u chorých s AIP a zistiť, či sliny by mohli byť použité na sledovanie progresie choroby. Sliny sú atraktívnou biologickou tekutinou na stanovenie biochemických ukazovateľov za rôznych patologických podmienok. Výhodou je, že odber slín sa uskutočňuje neinvazívne a na vyšetrenie je potrebné iba malé množstvo.Metódy:
Krv a celkové nestimulované sliny boli odobraté od 16 chorých s AIP v štádiu remisie a od 20 zdravých jedincov. Markery oxidačného a karbonylového stresu – koncové produkty pokročilej glykácie (AGEs) a látky reaktívne s kyselinou tiobarbitúrovou (TBARS) boli vyšetrené spektrofluorometrickou metódou, produkty pokročilej oxidácie bielkovín (AOPPs), celková antioxidačná kapacita (TAC) a schopnosť plazmy/slín redukovať železité ióny (FRAP/FRAS) boli vyšetrené spektrofotometrickými metódami u vyššie uvedených skupín.Výsledky:
Koncové produkty pokročilej glykácie a látky reaktívne s kyselinou tiobarbitúrovou v plazme aj slinách boli významne vyššie u chorých s AIP v porovnaní s kontrolnou skupinou (p < 0,001), resp. p < 0,05. Produkty pokročilej oxidácie proteínov v plazme u AIP v porovnaní s kontrolnou skupinou nevykazovali štatistickú významnosť (p > 0,05), ale v slinách boli významne nižšie (p < 0,001). Koncentrácie ukazovateľov antioxidačného statusu v plazme aj slinách boli signifikantne nižšie v porovnaní s kontrolnou skupinou (p < 0,001).Záver:
Podľa nášho najlepšieho vedomia toto je prvá štúdia, ktorá poukázala na zvýšené koncentrácie markerov oxidačného a karbonylového stresu a na znížený antioxidačný status v plazme a slinách u pacientov s AIP. Okrem toho, štúdia potvrdzuje, že sliny môžu byť sľubnou tekutinou na štúdium príslušných biomarkerov v širokom spektre ľudských biomedicínskych podmienok.Kľúčové slová:
akútna intermitentná porfýria – biomarkery – oxidačný a karbonylový stres – sliny a plazmaÚvod
Porfýrie tvoria skupinu hereditárnych metabolických defektov biosyntézy hemu, ktoré sa prejavujú nadprodukciou a akumuláciou prekurzorov hemu – porfyrínov. Akútna intermitentná porfýria (AIP) je z nich najčastejšia autozomálna dedičná choroba spôsobená deficitom 3. enzýmu v metabolickej ceste biosyntézy hemu, porfobilinogén deaminázy. Choroba je charakterizovaná akútnymi záchvatmi spojenými so symptómami autonómneho, periférneho a centrálneho nervového systému. Prudké bolesti brucha bez peritonitídy a so sprievodnými príznakmi, ako je nauzea alebo vracanie, hypertenzia a tachykardia, sú základné najdôležitejšie symptómy akútneho záchvatu. Okrem toho môžu byť prítomné aj ďalšie príznaky, ako je periférna neuropatia, bolesti svalov alebo parézy, mentálne poruchy, napr. depresia, insomnia, agitovanosť a iné. Akútny záchvat môžu vyvolať aj niektoré bežne používané lieky. Z toho dôvodu je potrebné posúdiť prostredníctvom webovej stránky spoločnosti European Porphyria Network (EPNET), či liek je bezpečný alebo nebezpečný pre chorých s AIP. Počas akútneho záchvatu prekurzory porfyrínu, porfobilinogén a δ-aminolevulová kyselina (D-ALA), sa vylučujú vo veľkom množstve do moču. V štádiu remisie, keď pacienti sú asymptomatickí, väčšina z nich má stále zvýšenú koncentráciu porfoboilinogénu a D-ALA v moči. Liečba AIP v akútnom záchvate spočíva v i.v. podaní hemarginátu v 5% glukóze počas 4–5 dní, ktorý blokuje nadprodukciu prekurzorov hemu a ich následné vylučovanie do moču. Okrem toho je potrebné podávať i.v. infúzie 5% glukózy, fenotiazíny, pyridoxín a iné [1–4].
Oxidačný stres je výsledkom nerovnováhy medzi antioxidačným obranným mechanizmom a nadmernou tvorbou oxidantov, čo vedie k poškodeniu buniek a tkanív. Poškodenie tkaniva je spôsobené množstvom enzymatických a neenzymatických biochemických reakcií, ktoré produkujú vysoko reaktívne medziprodukty, tzv. voľné radikály. Tieto voľné radikály vznikajú endogénne alebo exogénne. Mnohé štúdie poukázali na súvislosť medzi oxidačným poškodením molekúl a patofyziologickým mechanizmom rôznych závažných chorôb [5–9].
Sliny predstavujú vhodnú diagnostickú tekutinu na stanovenie biochemických ukazovateľov za rôznych patologických podmienok. Výhodou je, že odber slín sa uskutočňuje neinvazívne a na vyšetrenie je potrebný iba malý objem. Okrem toho opakované vyšetrenie markerov v slinách môže byť vhodné aj na dlhodobé monitorovanie liečebnej odpovede v priebehu choroby. Posledné 2–3 desaťročia sa rozšírila štúdia slín ako diagnostického biomarkera pre rôzne systémové a iné choroby [6,7].
Cieľom našej štúdie bolo vyšetriť niektoré vybrané markery oxidačného a karbonylového stresu v plazme a slinách u chorých s akútnou intermitentnou porfýriou.
Skupina vyšetrených chorých a metódy
V štúdii sme vyšetrili 16 chorých s AIP (12 žien, 4 muži), priemerného veku 48,3 ± 7 rokov. U týchto chorých boli vyšetrené okrem laboratórnych ukazovateľov pre AIP (δ-aminolevulová kyselina a porfobilinogén v moči) aj niektoré markery oxidačného a karbonylového stresu v plazme a slinách. Porfobilinogén a D-ALA v moči boli vyšetrené chromatografickou a spektrofotometrickou metódou s použitím komerčnej súpravy ClinRep® Complete Kit for δ-Aminolevulinic Acid and Porphobilinogen in Urine (Column Test), (RECIPE, Germany)“ [10,11]. Marker karbonylového stresu, koncové produkty pokročilej glykácie (advanced glycation end products – AGEs), v plazme a slinách bol vyšetrený spektrofluorometrickou metódou a hodnoty boli vyjadrené v arbitrálnych jednotkách na liter, resp. prepočítané na gram celkových bielkovín [12]. Marker oxidácie proteínov, produkty pokročilej oxidácie bielkovín (advanced oxidation protein products – AOPPs), bol vyšetrený spektrofotometrickou metódou [13,14]. Markery antioxidačného statusu, schopnosť plazmy redukovať železité ióny (ferric reducting ability of plasma – FRAP) a schopnosť slín redukovať železité ióny (ferric reducting ability of saliva – FRAS) [15] a celková antioxidačná kapacita (total antioxidant capacity – TAC) [16] v plazme a slinách boli vyšetrené spektrofotometrickými metódami. Látky reaktívne s kyselinou tiobarbitúrovou (thiobarbituric acid reactive substances – TBARS), tj. malondialdehyd (MDA), ukazovateľ peroxidácie lipidov počas oxidačného stresu, v plazme a slinách boli vyšetrené spekrofluorometrickou metódou [17]. Vyššie uvedené vyšetrenia boli uskutočnené u chorých v štádiu remisie, tj. vo veľmi dobrom klinickom stave. Kontrolnú skupinu pre ukazovatele v plazme tvorilo 70 probandov priemerného veku 45,8 ± 15,6 rokov a pre sliny 20 zdravých jedincov priemerného veku 38,5 ± 6 rokov. Odber krvi a slín bol uskutočnený nalačno medzi 8.30–9.45 hod, asi po 10-hodinovom hladovaní. Krv bola odobratá do skúmaviek K3EDTA a celková nestimulovaná slina do sterilnej skúmavky. Vzorky plazmy a sliny boli skladované až do spracovania pri -20 °C. Výsledky udávame ako priemer ± smerodajná odchýlka (standard deviation – SD). Dáta sme hodnotili nepárovým dvojstranným Studentovým t-testom a korelačnou analýzou (Pearsonov korelačný koeficient) použitím štatistického softvéru SPSS (v. 16 pre Windows, SPSS, Chicago, Illinois, USA). Za štatisticky významné sme považovali p < 0,05.
Výsledky
Koncentrácia porfobilinogénu v moči u chorých s AIP bola význame zvýšená (5,05 ± 2,8 mg/24 hod) v porovnaní s referenčným rozsahom (0,1–1,7 mg/24 hod; p < 0,001). Koncentrácia D-ALA prepočítaná na gram kreatinínu (Kr) v moči bola taktiež významne zvýšená (6,25 ± 3,1 mg/g Kr) v porovnaní s referenčným rozsahom (< 4,0 mg/g Kr; p < 0,01). Hodnoty markera karbonylového stresu, AGEs a oxidačního stresu TBARS v plazme boli významne vyššie v skupine chorých s AIP v porovnaní s našou kontrolnou skupinou (p < 0,001). Nezistili sme štatistickú významnosť v koncentrácii AOPPs v plazme medzi AIP a kontrolnou skupinou (p > 0,05). Koncentrácie celkovej antioxidačnej kapacity a schopnosti plazmy redukovať železité ióny boli významne nižšie u AIP chorých v porovnaní s kontrolnou skupinou (p < 0,001). Podobne aj v slinách sme zistili významne zvýšené hodnoty AGEs (p < 0,001) a TBARS (p < 0,05). Koncentrácie AOPPs, TAC a FRAS v slinách boli signifikantne nižšie u AIP chorých v porovnaní s kontrolnou skupinou (p < 0,001), tab. 1 a tab. 2. Okrem toho sa zistila priama závislosť medzi TAC v plazme a slinách (r = 0,494; p < 0,05) (graf 1) a medzi FRAP a FRAS (r = 0,571; p < 0,05) (graf 2).
Table 1. Markery oxidačného a karbonylového stresu v plazme a slinách u chorých s akútnou intermitentnou porfýriou (hodnoty sú uvedené ako priemer ± SD) 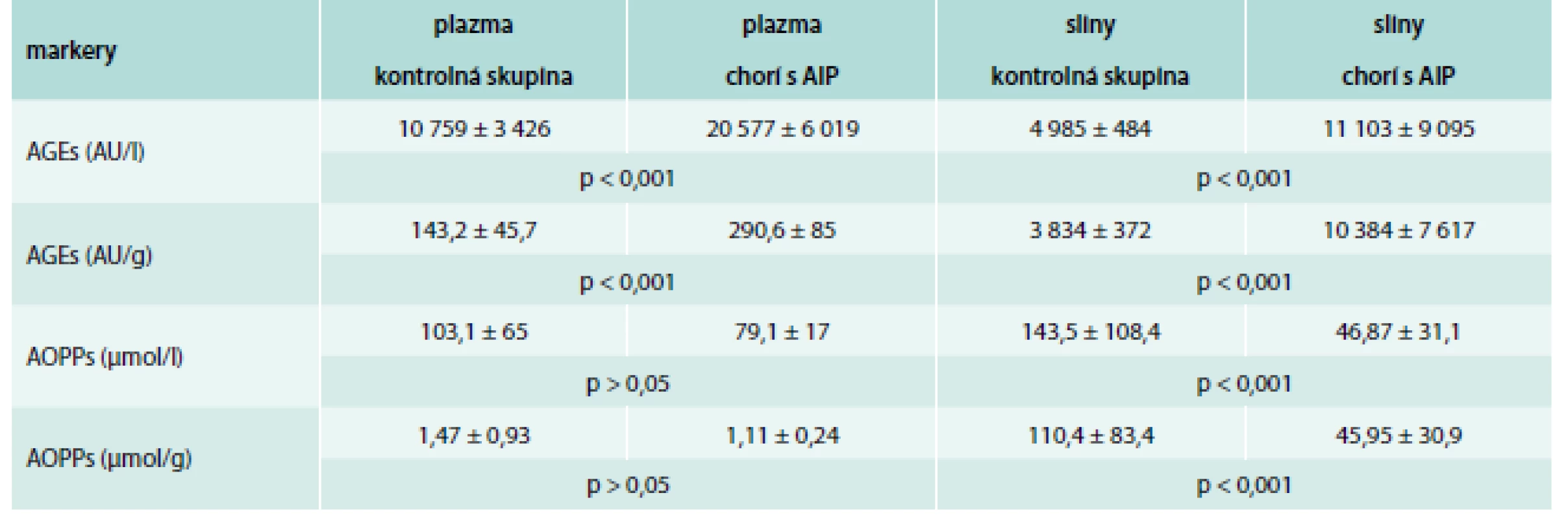
AIP – akútna intermitentná porfýria AGEs – koncové produkty pokročilej glykácie AOPPs – produkty pokročilej oxidácie bielkovín AU/g – arbitrálne jednotky prepočítané na gram bielkovín μmol/g – μmol prepočítaný na gram bielkovín Table 2. Markery oxidačného a karbonylového stresu v plazme a slinách u chorých s akútnou intermitentnou porfýriou (hodnoty sú uvedené ako priemer ± SD) 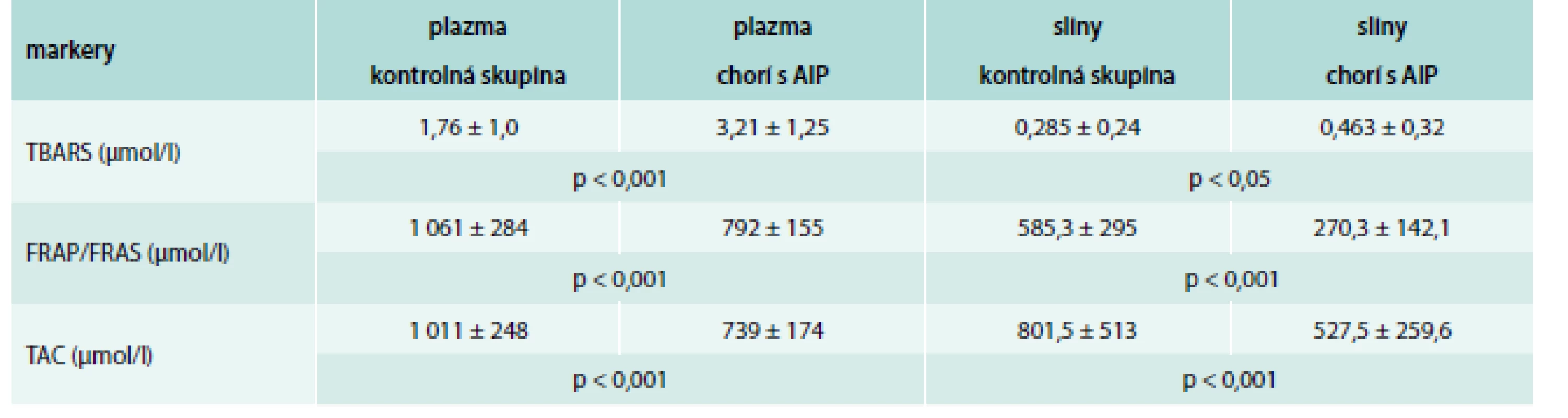
AIP – akútna intermitentná porfýria TBARS – látky reaktívne s kyselinou thiobarbiturovou FRAP – schopnosť plazmy redukovať železité ióny FRAS – schopnosť slín redukovať železité ióny TAC – celková antioxidačná kapacita Graph 1. Priama závislosť medzi celkovou antioxidačnou kapacitou (TAC) v plazme a slinách u chorých s akútnou intermitentnou porfýriou 
Graph 2. Priama závislosť medzi schopnosťou plazmy redukovať železité ióny (FRAP) a schopnosťou slín redukovať železité ióny (FRAS) u chorých s akútnou intermitentnou porfýriou 
Diskusia
Predložená štúdia, vyšetrenie markerov oxidačného a karbonylového stresu v slinách u chorých s AIP, je podľa našich vedomostí prvá v dostupnej literatúre. Charakteristiku vyšetrených markerov oxidačného a karbonylového stresu sme uviedli v inej práci [9]. V tejto štúdii sme zistili významne zvýšenú koncentráciu markerov oxidačného (TBARS) a karbonylového (AGEs) stresu v plazme aj slinách v skupine chorých s AIP v porovnaní s kontrolnou skupinou. Tieto markery boli zvýšené aj pri iných chorobách [6,7]. Nezistili sme rozdiel v koncentrácii markera oxidácie proteínov, produktov pokročilej oxidácie bielkovín (AOPPs) v plazme medzi AIP a kontrolnou skupinou, ale koncentrácia v slinách bola významne znížená. Antioxidačný stav u chorých s AIP sme vyšetrili dvomi spôsobmi: ako TAC a FRAP/FRAS. Koncentrácie obidvoch markerov v plazme aj slinách boli nižšie ako u kontrolnej skupiny. Zistili sme významné korelácie medzi ich koncentráciami v plazme a slinách, ale nezistili sme medzi MDA v plazme a slinách v protiklade s literárnym údajom pri inom ochorení [6]. V dostupnej literatúre sa diskutuje o vhodnosti použitia slín na detekciu biomarkerov za rôznych patologických podmienok. V našej prvej štúdii, v ktorej sme použili sliny ako biologický materiál, sme vyšetrili niektoré základné biochemické ukazovatele, ale naším cieľom bolo vyšetriť kyselinu oxalovú a askorbovú v slinách a plazme [18]. V posledných rokoch v mnohých laboratóriách skúmali použiteľnosť slinných biomarkerov oxidačného stresu pre ich potenciálnu klinickú aplikáciu a dokumentovali ich schopnosť rozlíšiť chorobný stav od fyziologického. Tieto tvrdenia sľubujú prevratný prístup k diagnóze, prevencii, liečbe, observácii a pochopenia tej ktorej choroby, ako aj pre sledovanie odpovede na liečbu. Sliny zostávajú sľubnou oblasťou pre objav biomarkerov v širokom spektre ľudských biomedicínskych podmienok. Nakoľko koncentrácia markerov oxidačného stresu v slinách závisí od cirkadialného rytmu, na prítomnosti alebo neprítomnosti orálneho ochorenia a iných faktoroch, bude potrebné vypracovať štandardizáciu slinných študijných protokolov, ktoré budú slúžiť pre výskum a aj pre klinické použitie biomarkerov v slinách [6–8].
Záver
Na základe našich výsledkov, zvýšené koncentrácie markerov oxidačného a karbonylového stresu v plazme a slinách u chorých s AIP, môžeme konštatovať, že oxidačný stres sa podieľa na patogenéze akútnej intermitentnej porfýrie. Je predpoklad, že po štandardizácii podmienok pre odber slín, budú sliny potenciálne vhodné ako biologická tekutina aj na monitorovanie akútnej intermitentnej porfýrie.
prof. MUDr. Miroslav Mydlík, DrSc.
miroslav.mydlik@unlp.sk
IV. interná klinika LF UPJŠ a UN L. Pasteura v Košiciach,
Slovenská republika
www.unlp.sk
Doručeno do redakce 16. 8. 2016
Přijato po recenzi 26. 9. 2016
Sources
1. Besur S, Schmeltzer P, Bonkovsky HL. Acute porphyrias. J Emergency Med 2015; 49(3): 305–312. Dostupné z DOI: <http://dx.doi.org/ 10.1016/j.jemermed.2015.04.034>. 2. Mydlík M, Derzsiová K, Legáth Ľ et al. Klinické a biochemické poruchy pri akútnej intermitentnej porfýrii a porfýrii variegata. Interná Med 2016; 16(2): 58–62. 3. Ventura P, Capellini MD, Rocchi E. The acute porphyrias: a diagnosis and therapeutic chalenge in internal and emergency medicine. Int Emerg Med 2009; 4(4): 297–308. Dostupné z DOI: <http://dx.doi. org/10.1007/s11739–009–0261–4>. 4. Sardh E, Harper P, Andersson Dan EH et al. Plasma porphobilinogen as a sensitive biomarker to monitor the clinical and therapeutic course of acute intermittent porphyria attacks. Europ J Intern Med 2009; 20(2): 201–207. Dostupné z DOI: <http://dx.doi.org/10.1016/j. ejim.2008.06.012>. 5. Kamodyová N, Tóthová Ľ, Celec P. Salivary markers of oxidative stress and antioxidant status: Influence of external factors. Disease Markers 2013; 34(5): 313–321. Dostupné z DOI: <http://dx.doi. org/10.3233/DMA-130975>. 6. Wang J, Schipper HM, Velly AM et al. Salivary biomarkers of oxidative stress: A critical review. Free Radic Biol Med 2015; 85 : 95–104. Dostupné z DOI: <http://dx.doi.org/104.10.1016 j.freeradbiomed.2015.04.005>. 7. Karlík M, Valkovič P, Hančinová V et al. Markers of oxidative stress in plasma and saliva in patients with multiple sclerosis. Clin Biochem 2015; 48(1–2): 24–28. Dostupné z DOI: <http://dx.doi.org/10.1016/j. clinbiochem.2014.09.023>. 8. Peluso I, Raguzzini A. Salivary and urinary total antioxidant capacity as biomarkers of oxidative stress in humans. Patholog Res Int 2016; 2016 : 5480267. Dostupné z DOI: <http://dx.doi. org/10.1155/2016/5480267>. 9. Mydlík M, Derzsiová K, Javorská K et al. Markery oxidačného a karbonylového stresu u hemodiafiltrovaných chorých. Interná Med 2015; 15(7–8): 324–328. 10. Mauzeral D, Granick S. The occurrence and determination of δ-aminolevulinic acid and porphobilinogen in urine. J Biol Chem 1956; 219(1): 435–446. 11. Kyselina 5-aminolevulová (ALA) / Porfobilinogén(PBG). Chromatografia – spektrofotometria. Biosystems Reagents & Instruments. Slovenský preklad: 2016. Dostupné z DOI: <http://www.jktrading.cz/mbfile - 11017-ala-pbg-1505.pdf> 12. Münch G, Keis R, Wesels A et al. Determination of advanced glycation end products in serum by fluorescence spectroscopy and competitive ELISA. Eur J Clin Chem Clin Biochem 1997; 35(9): 669–677. 13. Witko-Sarsat V, Friedlander M, Capeillere-Blandin C et al. Advanced oxidation protein products as a novel marker of oxidative stress in uremia. Kidney Int 1996; 49(5): 1304–1313. 14. Anderstam B, Ann-Christin BH, Valli A et al. Modification of the oxidative stress biomarker AOPP assay: application in uremic samples. Clin Chim Acta 2008; 393(2): 114–118. Dostupné z DOI: <http://dx.doi. org/10.1016/j.cca.2008.03.029>. 15. Benzie IF, Strain JJ. The ferric reducing ability of plasma (FRAP) as a measure of „antioxidant power“: the FRAP assay. Anal Biochem 1996; 239(1): 70–76. 16. Erel O. A novel automated direct measurement method for total antioxidant capacity using a new generation, more stable ABTS radical cation. Clin Biochem 2004; 37(4): 277–285. 17. Behuliak M, Palffy R, Gardlik R et al. Variability of thiobarbituric acid reacting substances in saliva. Dis Markers 2009; 26(2): 49–53. Dostupné z DOI: <http://dx.doi.org/10.3233/DMA-2009–0606>. 18. Mydlík M, Derzsiová K, Jenča A et al. Kyselina oxalová a askorbová v slinách pri chronickej renálnej insuficiencii. Akt Nefrol 2006; 12(2): 41–44.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2016 Issue Suppl 6-
All articles in this issue
- Bioimpedometrie a její využití v dialyzační léčbě
- Výsledky studie SPRINT z pohledu nefrologie
- Systémová a intraperitoneální inflamace u peritoneálně dialyzovaných pacientů
- Využitie salivárnych markerov v nefrológii
- IgA nefropatie – otázky, které nastolil výzkum
- Gitelmanův syndrom jako častá příčina hypokalemie a hypomagnezemie
- Osteoporóza – epidemiologie a patogeneze
- Suplementované restriktivní diety u nemocných vyššího věku s chronickým onemocněním ledvin
- Současné možnosti léčby hyponatremie
-
Chronická dysfunkce transplantované ledviny:
stále nevyřešený problém - Současné možnosti sledování efektivnosti terapie hyponatremie
- Theralite a mnohočetný myelom
- Rozdíl [Na+] – [Cl-] významně přispívá k acidemii pacientů s jaterní cirhózou
- Prevalence mikroalbuminurie u pacientů s diabetes mellitus v České republice: Projekt IDN-Micro
- Markery oxidačného a karbonylového stresu v plazme a slinách u chorých s akútnou intermitentnou porfýriou
- Metabolická acidóza u chronického onemocnění ledvin
- Suplementácia vitamínu D3 a bunková homeostáza vápnika u pacientov pri chronickej chorobe obličiek
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Metabolická acidóza u chronického onemocnění ledvin
- Současné možnosti léčby hyponatremie
- Gitelmanův syndrom jako častá příčina hypokalemie a hypomagnezemie
- Osteoporóza – epidemiologie a patogeneze
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

