-
Medical journals
- Career
Vrozený hyperinzulinizmus: když B-buňka ztratí sebekontrolu…
Authors: Jan Lebl; Klára Roženková; Štěpánka Průhová
Authors‘ workplace: Pediatrická klinika 2. LF UK a FN v Motole, Praha
Published in: Vnitř Lék 2016; 62(Suppl 4): 72-76
Category: Reviews
Overview
Vrozený hyperinzulinizmus je závažnou poruchou regulace glykemie, která ve svém důsledku narušuje vývoj mozku, vede k mentální retardaci, neurologickému postižení, sekundární epilepsii, v nejtěžších případech ohrožuje život. Příčinou vrozeného hyperinzulinizmu jsou geneticky podmíněné poruchy řízení sekrece inzulinu, které vedou zpravidla již in utero i postnatálně k jeho nadměrné sekreci. Ta vyvolá fetální makrosomii a následně novorozenecké a kojenecké hypoglykemie. Nejzávažnější hypoglykemie způsobují bialelické mutace v genech KCNJ11 a ABCC8, které kódují obě podjednotky draslíkového kanálu; k mírnějším projevům vedou heterozygotní mutace v těchto genech a enzymatické poruchy (GLUD1, HADH, GCK). Při poruše transkripčních faktorů HNF4A nebo HNF1A je hyperinzulinizmus přechodný, ale všichni nositelé mutace později v životě onemocní MODY diabetem – dysfunkce B-buněk má bifázický průběh od hyperfunkce přes eufunkci k hypofunkci. Včasná etiologická diagnostika a efektivní terapie vrozeného hyperinzulinizmu zásadním způsobem zlepšuje prognózu postižených dětí nejen z hlediska přežití, ale i z hlediska neurokongitivních funkcí.
Klíčová slova:
B-buňka – hypoglykemie – inzulin – vrozený hyperinzulinizmus (CHI)Regulace glykemie
Glukóza je rozhodujícím substrátem pro energetický metabolizmus a zdrojem pro ukládání energie ve formě glykogenu, tuků a bílkovin. Glukóza cirkulující v krvi představuje okamžitý zdroj energie, neboť oxidací 1 molu glukózy vzniká 38 molů ATP. Má zásadní význam v energetickém metabolizmu mozku [1]. Pokles transportu glukózy do mozku vede k hypoglykorachii a k energetickému deficitu neuronů, který ústí v edém mozku, bezvědomí, křeče a může mít rychlé fatální důsledky.
Mozek roste nejrychleji v 1. roce života. Pro rostoucí mozek je glukóza jak zdrojem energie, tak i substrátem pro syntézu membránových lipidů a proteinů, potřebných pro zrání mozku a myelinizaci. Trvalé nebo opakované hypoglykemie u kojenců a malých dětí proto ireverzibilně poškozují vývoj mozku a mozkových funkcí [2].
Dlouhodobými důsledky hypoglykemií jsou mentální retardace a sekundární epilepsie. Hypoglykemie mají zřejmě také vliv na utváření osobnosti, i když přesné údaje chybějí. Trvalé neurologické postižení lze prokázat alespoň u poloviny všech dětí, které prodělaly opakovaně hypoglykemie v prvním půlroce života. Při MRI zobrazení CNS mají tyto děti nedostatečnou gyrifikaci, sníženou myelinizaci bílé hmoty a atrofii mozkové kůry. I starším dětem mohou opakované těžké hypoglykemie způsobit trvalé neurologické a intelektové postižení a sekundární epilepsii. Těžká hypoglykemie v kterémkoliv věku bezprostředně ohrožuje život [3].
Pro zachování dostatečného přísunu glukózy do mozkových buněk je v organizmu vytvořen komplexní regulační systém, jehož cílem je udržení normální glykemie. Základem je jednoduchá zpětná vazba na úrovni B-buněk pankreatu. Čím více glukózy do B-buňky vstupuje, tím více je stimulována sekrece inzulinu. Naopak, pokud hladina glukózy klesá pod hranici 5 mmol/l, sekrece inzulinu se snižuje a následně téměř zastavuje. Díky tomu, že glukóza z okolí vstupuje rovnou do B-buňky GLUT2 transportérem a je ihned fosforylována enzymem glukokinázou, je B-buňka velmi přesně informována o aktuální glykemii. Správná funkce enzymu glukokinázy se tak zásadním způsobem podílí na spouštění nebo inhibici kaskády intracelulárních dějů, vedoucích následně k uvolnění inzulinu z intracelulárních granul do krevního oběhu (schéma 1) [4].
Schéma 1. Funkční schéma B-buňky s vyznačením možných příčin vrozeného hyperinzulinizmu 
Vrozený hyperinzulinizmus (congenital hyperinsulinism – CHI) může být způsoben mutacemi genu pro (1) Kir6.2 nebo (2) SUR1 podjednotku draslíkového kanálu, aktivačními mutacemi genu pro enzym (3) glutamát-dehydrogenázu (GLUD1), (4) L-3-hydroxyacyl-CoA dehydrogenázu (HADH) nebo (5) glukokinázu (GCK), geny pro transkripční faktory (6) HNF4A nebo (7) HNF1A či (8) genu pro membránový transportér SLC16A1 nebo (9) mitochondriální UCP2. B-buňka vyrábí inzulin trvale a skladuje jej v sekrečních granulích. K exocytóze inzulinu dochází podle výše a gradientu glykemie. Proces exocytózy inzulinu je zahájen aktivací cytoplazmatického enzymu glukokinázy glukózou vstupující do B-buňky. Glukokináza se proto nazývá „senzorem B-buňky pro glukózu“. Na další metabolizaci glukózy se podílejí mimo jiné mitochondriální enzymy GLUD1 a HADH. Jejím konečným důsledkem je změna poměru ATP : ADP, což přímo řídí prostupnost draslíkového kanálu reakcí s tzv. sulfonylureovým receptorem SUR1. Součástí kanálu je i podjednotka Kir6.2. Uzavření draslíkového kanálu depolarizuje buněčnou membránu, a tím indukuje otevření vápníkového kanálu. Zvýšení koncentrace intracelulárního vápníku stimuluje exocytózu inzulinu. Syntézu a sekreci inzulinu ovlivňují také transkripční faktory HNF4A a HNF1A v buněčném jádře. Vzácné formy CHI jsou způsobeny mutacemi v genu SLC16A1 pro membránový přenašeč MCT1 a v genu pro mitochondriální membránový přenašeč UCP2, který funguje jako negativní regulátor inzulinové sekrece z B-buněk pankreatu. Geneticky podmíněné poruchy regulace inzulinové sekrece
Závažnou příčinou hypoglykemií u novorozenců a kojenců je vrozený hyperinzulinizmus (congenital hyperinsulinism – CHI). Označujeme tak skupinu vzácných geneticky podmíněných poruch regulace sekrece inzulinu, které vedou zpravidla již in utero a časně postnatálně k nadměrné sekreci inzulinu. Ta může způsobit fetální makrosomii a následně novorozenecké a kojenecké hypoglykemie [5].
Prvotní diagnostika CHI je založena na paralelním stanovení glykemie a hladiny inzulinu ze vzorku krve odebraného při hypoglykemii („kritický vzorek“). Mezi glykemií (v mmol/l) a hladinou inzulinu (v mIU/l) existuje za fyziologických okolností vzájemná podmíněnost – při hypoglykemii by měla být sekrece inzulinu významně suprimována. Podle některých názorů by neměla číselně přesáhnout 3násobek aktuální glykemie, podle jiných názorů je při hypoglykemii každá hladina inzulinu > 2 mIU/l abnormálně vysoká. Tato kritéria se průběžně zpřesňují. Vyšší hladina inzulinu svědčí pro CHI, nižší hladina inzulinu pro jinou příčinu hypoglykemie [6].
Příčinou CHI jsou mutace některého z genů, které kódují proteiny B-buňky významné pro sekreci inzulinu. Schéma 1 znázorňuje kaskádu dějů, které řídí syntézu inzulinu a jeho uvolnění z B-buněk do krevního oběhu. Důsledkem nadměrné stimulace B-buněk k syntéze a sekreci inzulinu je jejich zmnožení vedoucí k hyperplazii a abnormální architektonice Langerhansových ostrůvků („nezidioblastóza“ v klasické histologické terminologii). Jednotlivé poruchy (tab. 1) se liší etiopatogenetickým mechanizmem na buněčné úrovni, ale také závažností, věkem při nástupu prvních klinických projevů i odpovědí na tzv. konzervativní (medikamentózní) léčbu [7].
Table 1. Geny a jejich produkty, které způsobují jednotlivé formy vrozeného hyperinzulinizmu 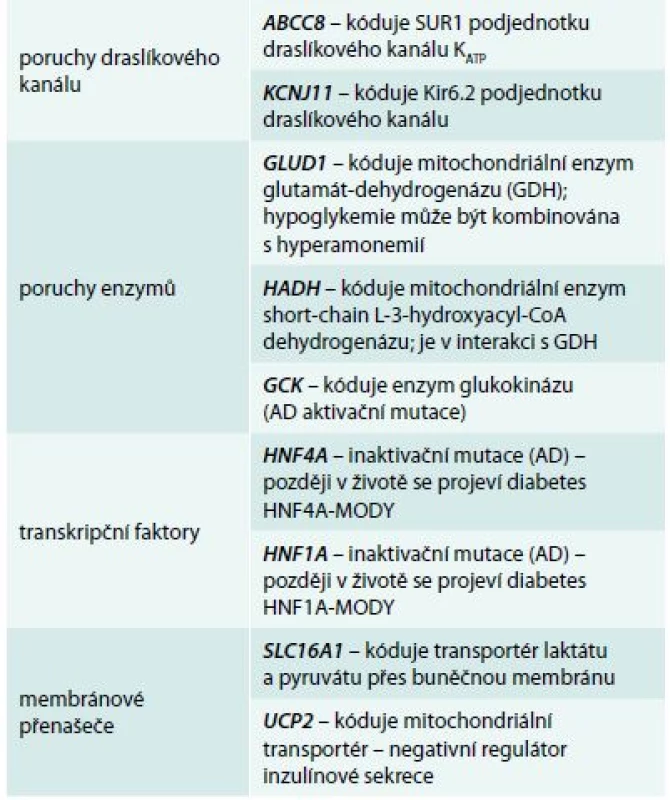
AD – autozomálně dominantní HNF – hepatocytární nukleární faktor MODY – maturity-onset diabetes of the young SUR1 – sulfonylureový receptor Závažnější průběh mají pacienti s homozygotními mutacemi v genech KCNJ11 a ABCC8, které kódují obě podjednotky draslíkového kanálu [8]; mírnější klinické projevy mívají děti s heterozygotními mutacemi v těchto genech a děti s enzymatickou poruchou (GLUD1, HADH, GCK). Při poruše transkripčních faktorů (HNF4A nebo HNF1A) je sice hyperinzulinizmus přechodný, ale všichni nositelé mutace v pozdějším životě onemocní MODY diabetem – dysfunkce B-buněk má v tomto případě dynamický bifazický průběh, od hyperfunkce (fetální makrosomie a diazoxid-responzivní hyperinzulinemické hypoglykemie v prvních týdnech života) přes eufunkci k hypofunkci (non-autoimunitní diabetes s prvními projevy v pozdním dětství, adolescenci nebo mladé dospělosti). Přesný mechanizmus této neobvyklé formy porušené inzulinové sekrece neznáme [9,10].
Diagnostika a léčba vrozeného hyperinzulinizmu
Těžké formy CHI vedou k závažným hypoglykemiím od prvních dnů života, které poškozují mozek a bezprostředně ohrožují život. CHI je proto nutné rychle diagnostikovat a okamžitě efektivně řešit. Paralelně se zvládáním hypoglykemií infuzí glukózy začínáme s medikamentózní léčbou. Přehled farmak pro léčbu hyperinzulinizmu (ke snížení sekrece inzulinu z B-buňky) shrnuje tab. 2 a mechanizmus jejich účinku na buněčné úrovni ukazuje schéma 2. Současně zahajujeme molekulárně-genetické vyšetření ve statim režimu s cílem objasnit urychleně podstatu poruchy a odhadnout prognózu. U CHI má výsledek molekulárně-genetického vyšetření bezprostřední význam pro volbu dalšího postupu [5].
Table 2. Farmaka používaná pro medikamentózní (konzervativní) léčbu hyperinzulinizmu (obchodní názvy v závorce) 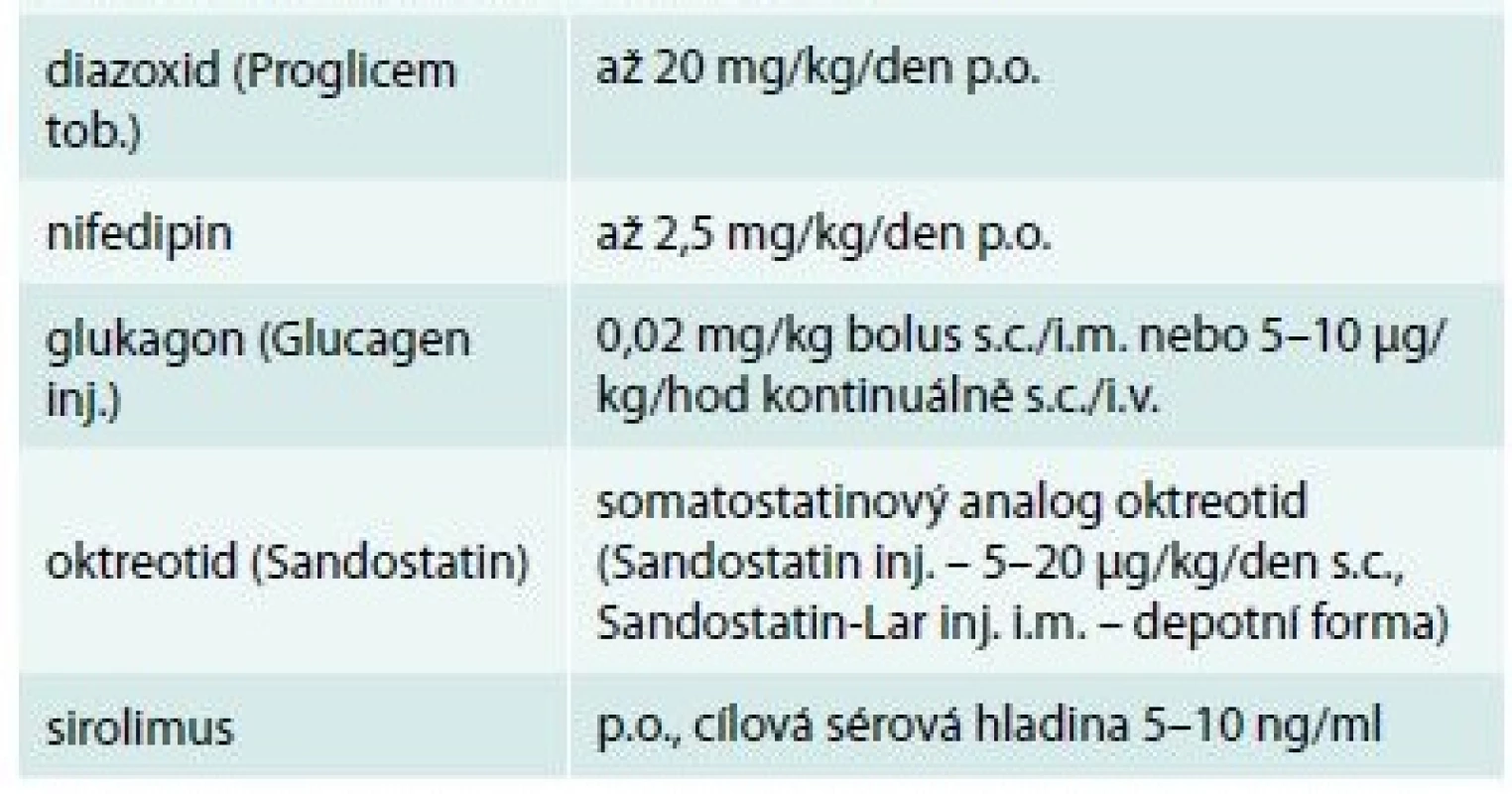
Terapie se zpravidla zahajuje diazoxidem, v případě nedostatečného účinku se přidává s.c. či přechodně i.v. oktreotid. Účinky nifedipinu jsou sporné, i když teoretické podklady pro jeho účinek na vápníkový kanál jsou evidentní. Glukagon má v léčbě okrajové místo, může pomoci zvládnout akutní hypoglykemii. Při závislosti na léčbě oktreotidem se v poslední době zkouší podání jeho depotní formy. Novinkou v léčbě farmakorezistentních forem je podávání cytostatika sirolimu, který působí komplexním mechanizmem zahrnujícím snížení proliferace B-buněk, zvýšení jejich apoptózy a významné zvýšení periferní inzulinové rezistence. Schéma 2. Funkční schéma B-buňky s vyznačením účinku farmak, která mohou snížit nadměrnou sekreci inzulinu: diazoxid působí přímo na draslíkový kanál B-buňky (prodlužuje dobu jeho otevření), oktreotid cestou somatostatinového receptoru také ovlivňuje draslíkový kanál, zatímco nifedipin mění prostupnost vápníkového kanálu 
Průběžně vyhodnocujeme odpověď dítěte na konzervativní léčbu (potřeba dodávky glukózy, průběh glykemií) a případně ji upravujeme (tab. 3). Pokud selhává konzervativní léčba diazoxidem a oktreotidem, je potřebné určit, zda se jedná o fokální či difuzní formu CHI. Fokální hyperplazie pankreatických B-buněk je důsledkem postzygotické (somatické) ztráty „zdravé“ alely v místě ložiskového postižení pankreatu u heterozygota pro mutaci v genu kódujícím SUR1 nebo Kir6.2 – vlivem rekombinace došlo k paternální uniparentální disomii.
Table 3. Parametry přiměřené odpovědi na konzervativní (medikamentózní) léčbu CHI 
Diagnostika fokální formy probíhá ve 2 krocích:
- pro odlišení fokální a difuzní léze je základem rychlá DNA diagnostika, která může prokázat typický genotyp – při fokální formě je při vyšetření DNA z leukocytů periferní krve prokázána heterozygocie pro mutaci v jednom z uvedených genů (vždy je přenesena od klinicky zdravého otce), při difuzní formě jsou mutace zpravidla nalezeny na obou alelách – paternální i maternální [5]
- druhým krokem je lokalizace fokální léze, využívá se pozitronová emisní tomografie (PET-CT) s podáním 18F-fluoro-L-DOPA, která se vychytává v postižené oblasti pankreatu (obr. 1) [11]
Image 1. 18F-DOPA PET/CT pankreatu u 5měsíčního děvčátka s vrozeným hyperinzulinizmem a heterozygotní mutací v genu ABCC8, který kóduje SUR1 podjednotku draslíkového kanálu B-buňky 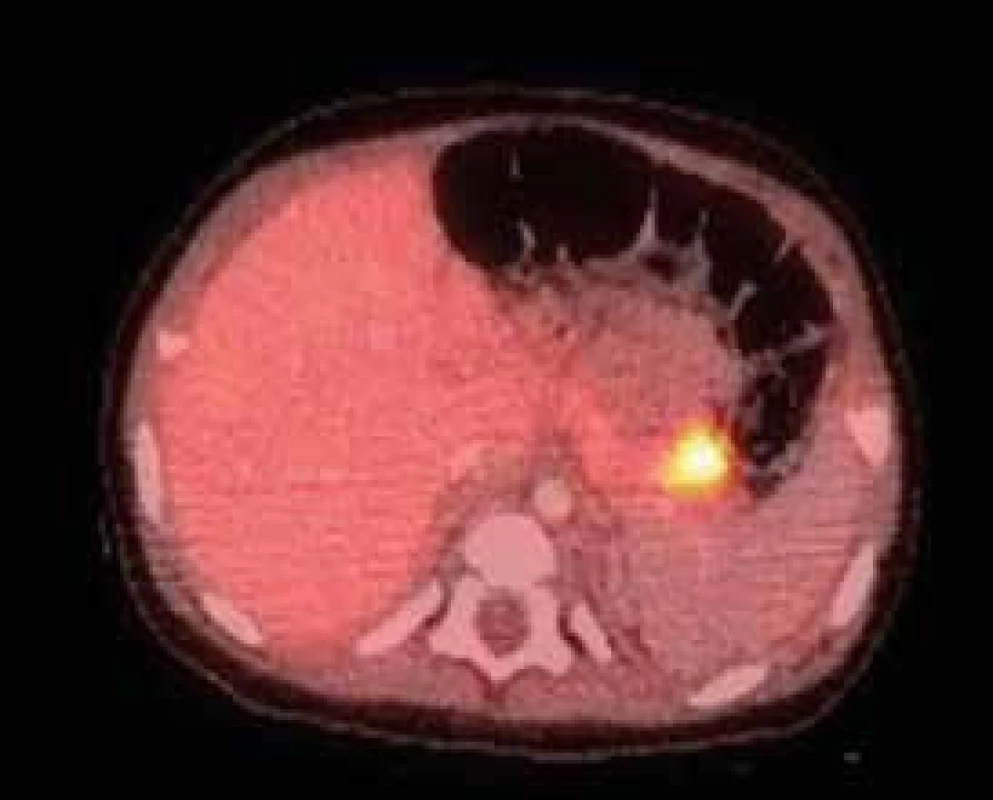
Nález ukazuje fokální lézi v kaudě pankreatu – jedná se tedy o fokální formu hyperinzulinizmu způsobenou somatickou mutací (paternální uniparentální disomií) v okrsku pankreatu. Hyperinzulinizmus se podařilo vyřešit chirurgickou resekcí kaudy pankreatu. Archiv MUDr. Barbory Obermannové, Ph.D. – použito se svolením autorky. V další fázi je možné zvolit formu chirurgického řešení. V případě fokální formy je metodou volby parciální resekce pankreatu, pokud to lokalizace ložiska dovoluje. Na některých pracovištích se provádí laparoskopicky za průběžné peroperační histologie. V tomto případě chirurg ukončuje resekci v okamžiku, kdy se prokazatelně dostal do zdravé tkáně pankreatu. V příznivém případě tak může dojít k úplnému vyléčení [12]. Pokud je ložisko uloženo v nepříznivé lokalizaci (např. v hlavě pankreatu), doporučuje se spíše vyčkávat za udržení příznivých glykemií pomocí farmakoterapie, protože je vysoká pravděpodobnost, že se v dalším průběhu tendence k hypoglykemiím zmírní a operace nakonec nebude potřeba vůbec nebo jen v menším rozsahu. Při difuzní formě je při selhání všech postupů konzervativní terapie a trvajícím ohrožení mozku těžkými hypoglykemiemi za jediné řešení považována subtotální pankreatektomie. Ta představuje velmi závažný výkon, který zpravidla vede k insuficienci zevní sekrece pankreatu a ke vzniku diabetes mellitus [13]. Díky současným možnostem dlouhodobé konzervativní terapie se ale od tohoto výkonu ustupuje [5].
Genetické příčiny CHI se v jednotlivých populacích liší. Zatímco v zemích s vyšší mírou konsanguinity (severní Afrika, Střední Východ) převažují těžké formy difuzního CHI na podkladě homozygotních mutací děděných autozomálně recesivně, v našich evropských podmínkách se častěji setkáváme s mírnějšími heterozygotními formami přenosu CHI, které mohou mít i autozomálně dominantní charakter [9].
Jiné formy vrozeného hyperinzulinizmu
Vrozený hyperinzulinizmus je příčinou hypoglykemií také u dětí s Beckwithovým-Wiedemannovým syndromem (podle hlavních zevních příznaků také zvaný syndrom EMG – exomphalos, makroglosie, gigantizmus; obr. 2). V tomto případě je příčinou nadměrná exprese inzulinového genu v souvislosti s chromozomálním imprintingem. Pokud se podaří překonat první rok života, závažnost hypoglykemií ustupuje. Tyto děti mají vysoké riziko vzniku embryonálních tumorů, a to zejména v prvních dvou letech života [14].
V širším slova smyslu je vrozený hyperinzulinizmus příčinou novorozeneckých hypoglykemií také u dětí s diabetickou fetopatií. U nich je hyperplazie B-buněk reaktivní, vyprovokovaná vyšší hladinou glykemie u diabetické matky. Po narození postupně odeznívá.
Image 2. Dvouměsíční děvčátko s Beckwithovým-Wiedemannovým syndromem (EMG syndromem) 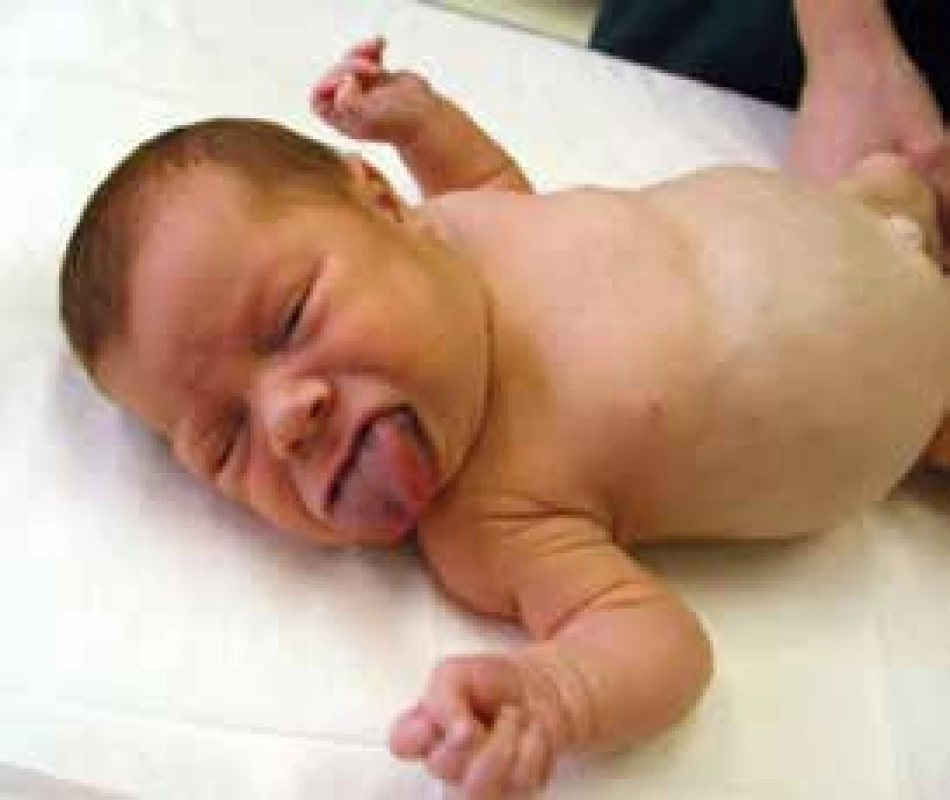
Všimněme si umbilikální hernie a makroglosie. Prominence bříška je podmíněna hepatosplenomegalií a nefromegalií. Hypoglykemie trvaly do 6 měsíců věku a bylo je nutné řešit podáváním oktreotidu s.c. 2–3krát denně. Archiv MUDr. Stanislavy Kolouškové, CSc. – použito se svolením autorky. Závěr
Pokrok v poznání genetické podmíněnosti sekrece inzulinu z B-buňky v posledních 20 letech zcela změnil osudy postižených dětí. Zatímco dříve umíraly, končily s těžkou mentální retardací nebo v nejlepším případě vstupovaly do dalšího života se závažným handicapem po téměř totální pankreatektomii, současná rychlá genetická a zobrazovací diagnostika a propracovaný systém terapie umožňuje většině dětí s vrozeným hyperinzulinizmem vést kvalitní život srovnatelný s jejich vrstevníky. Zásadním úkolem zůstává včasné rozpoznání postižených dětí neonatology a pediatry, které zpravidla umožní předejít nezvratnému postižení vyvíjejícího se mozku [3].
prof. MUDr. Jan Lebl, CSc., FCMA
jan.lebl@lfmotol.cuni.cz
Pediatrická klinika 2. LF UK a FN v Motole, Praha
www.fnmotol.cz
Doručeno do redakce 1. 8. 2016
Přijato po recenzi 4. 10. 2016
Sources
1. Dunne MJ, Cosgrove KE, Shepherd RM et al. Hyperinsulinism in infancy: from basic science to clinical disease. Physiol Rev 2004; 84(1): 239–275.
2. Menni F, Lonlay P de, Sevin C et al. Neurologic outcomes of 90 neonates and infants with persistent hyperinsulinemic hypoglycemia. Pediatrics 2001; 107(3): 476–479.
3. Aynsley-Green A, Hussain K, Hall J et al. Practical management of hyperinsulinism in infancy. Arch Dis Child Fetal Neonatal Ed 2000; 82: F98-F107.
4. Matschinsky FM. Regulation of pancreatic beta-cell glucokinase: from basics to therapeutics. Diabetes 2002; 51(Suppl 3): S394-S404.
5. Roženková K, Güemes M, Shah P et al. The Diagnosis and Management of Hyperinsulinaemic Hypoglycaemia. J Clin Res Pediatr Endocrinol 2015; 7(2): 86–97. Dostupné z DOI: <http://dx.doi.org/10.4274/jcrpe.1891>.
6. Arnoux JB, Verkarre V, Saint-Martin C et al. Congenital hyperinsulinism: current trends in diagnosis and therapy. Orphanet J Rare Dis 2011; 6 : 63. Dostupné z DOI: <http://dx.doi.org/10.1186/1750–1172–6-63>.
7. Nessa A, Rahman SA, Hussain K. Hyperinsulinemic Hypoglycemia – The Molecular Mechanisms. Front Endocrinol (Lausanne) 2016; 7 : 29. Dostupné z DOI: <http://dx.doi.org/10.3389/fendo.2016.00029>.
8. Charlotte Kane RMS, Squires PE, Johnson PR et al. Loss of functional KATP channels in pancreatic B-cells causes persistent hyperinsulinemic hypoglycemia of infancy. Nat Med 1996; 2(12): 1344–1347.
9. Rozenkova K, Malikova J, Nessa A at al. Incidence of Heterozygous ABCC8 and HNF1A Mutations in Czech Patients With Congenital Hyperinsulinism. J Clin Endocrinol Metab 2015; 100(12): E1540-E1549. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2015–2763>.
10. Dusátková P, Průhová S, Sumník Z et al. HNF1A mutation presenting with fetal macrosomia and hypoglycemia in childhood prior to onset of overt diabetes. J Pediatr Endocrinol Metab 2011; 24(5–6): 377–379.
11. Otonkoski T, Näntö-Salonen K, Seppänen M et al. Noninvasive diagnosis of focal hyperinsulinism of infancy with [18F]-DOPA positron emission tomography. Diabetes 2006; 55(1): 13–18.
12. Bax KN, van der Zee DC. The laparoscopic approach toward hyperinsulinism in children. Semin Pediatr Surg 2007; 16(4): 245–251.
13. Fékété CN, de Lonlay P, Jaubert F et al. The surgical management of congenital hyperinsulinemic hypoglycemia in infancy. J Pediatr Surg 2004; 39(3): 267–269.
14. Munns CF, Batch JA. Hyperinsulinism and Beckwith-Wiedemann syndrome. Arch Dis Child Fetal Neonatal Ed 2001; 84(1): 67–69.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2016 Issue Suppl 4-
All articles in this issue
- Adaptace tukové tkáně na redukční nízkoenergetickou dietu u obézních jedinců
- Heterogenita dětského diabetu a její terapeutické implikace
- Historie diagnostiky a léčby diabetické retinopatie
- Metabolický syndrom u nemocných s diabetes mellitus 1. typu, prevalence, vliv na morbiditu a mortalitu, komplexní přístup k nemocnému
- Frekvence a načasování jídel a změny v body mass indexu: analýza dat z Adventist Health Study-2
- Edukace pacienta s diabetem – součást komplexní terapie
- Pregestační diabetes mellitus a gravidita
- Bariatrické operace u nemocných s diabetem
- Duše jako imunomodulátor
- Syndrom diabetické nohy z pohledu internisty podiatra
- Komplex oxLDL/β2-glykoprotein I jako proaterogenní autoantigen. Je ateroskleróza autoimunitní onemocnění?
- Gestační diabetes mellitus
- Růstový hormon, osa GH-IGF1 a metabolizmus glukózy
- Perspektivní molekuly pro léčbu hyperglykemie u pacientů s diabetem 2. typu
- Vrozený hyperinzulinizmus: když B-buňka ztratí sebekontrolu…
- Obstrukční spánková apnoe a diabetes mellitus 2. typu
- Krátkodobá a dlouhodobá glykemická variabilita a její vztah k mikrovaskulárním komplikacím diabetu
- Složení makronutrientů v diabetické dietě
- Je glukóza pouze základní energetický substrát?
- Súčasné trendy v diagnostike a liečbe kongenitálneho hyperinzulinizmu
- Máme uvažovat o nové klasifikaci diabetu ovlivněné terapeutickým rozhodováním?
- Diabetes mellitus ve starším věku z pohledu klinického diabetologa
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Vrozený hyperinzulinizmus: když B-buňka ztratí sebekontrolu…
- Gestační diabetes mellitus
- Růstový hormon, osa GH-IGF1 a metabolizmus glukózy
- Edukace pacienta s diabetem – součást komplexní terapie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

