-
Medical journals
- Career
Nové doporučené postupy ESC pro diagnostiku a léčbu akutní plicní embolie
Authors: Jiří Widimský Sr 1; Michael Aschermann 2
Authors‘ workplace: Klinika kardiologie IKEM Praha, přednosta prof. MUDr. Josef Kautzner, CSc. 1; II. interní klinika – kardiologie a angiologie 1. LF UK a VFN Praha, přednosta prof. MUDr. Aleš Linhart, DrSc., FESC, FCMA 2
Published in: Vnitř Lék 2015; 61(3): 236-243
Category: Guidelines
Úvod
Na kongresu Evropské kardiologické společnosti (ESC) v roce 2014 v Barceloně její předseda Stavros Konstantinides a spolupředseda Adam Torbicki prezentovali guidelines ESC 2014 o diagnostice a léčbě akutní plicní embolie (APE) včetně webové agendy. Tyto doporučené postupy byly současně uveřejněny v European Heart Journal [1]. Nová ESC 2014 guidelines byla také podporována Evropskou respirační společností. ESC guidelines z roku 2014 představují nejúplnější soubor guidelines v problematice plicní embolie. Obsahují 48 stránek, 475 citací, více než tucet tabulek a asi půl tuctu obrázků, a navíc dodatek tabulek přístupný na webové agendě.
VTE (venous thromboembolism – žilní tromboembolie) je 3. nejčastějším kardiovaskulárním onemocněním s celkovou incidencí 100–200 případů na 100 000 obyvatel.
APE provází významná morbidita a mortalita. Až 15 % všech pacientů s APE zmírá během 1. měsíce a u těch, kteří přežijí, dojde ve 30 % k recidivě během dalších 10 let. Ze zemřelých je jen u 7 % správně rozpozná za jejich života.
Predispoziční faktory žilní tromboembolie podle ESC guidelines 2014
Silné rizikové faktory (poměr rizika > 10)
- fraktura dolní končetiny
- hospitalizace pro srdeční selhání nebo fibrilaci síní (v předchozích 3 měsících)
- náhrada kyčelního nebo kolenního kloubu
- větší trauma
- infarkt myokardu (v předcházejících 3 měsících)
- předchozí žilní tromboembolie
- poranění míchy
Střední rizikové faktory (poměr rizika 2–9)
- artroskopická operace kolena
- autoimunitní onemocnění
- krevní transfuze
- centrální žilní linky
- chemoterapie
- srdeční nebo respirační selhání
- látky stimulující tvorbu červených krvinek
- in vitro oplodnění
- infekce (nejvíce pneumonie, infekce močových cest a HIV)
- malignita (největší riziko u metastáz)
- perorální antikoncepce
- paralytická cévní mozková příhoda
- období po porodu
- povrchová žilní trombóza
- trombofilie
Slabé rizikové faktory (poměr rizika < 2)
- klid na lůžku > 3 dny
- diabetes mellitus
- hypertenze
- imobilita vlivem sezení (např. jízda autem, let letadlem)
- zvyšující se věk
- laparoskopické operace (např. cholecystektomie)
- obezita
- těhotenství
- varikózní žíly
VTE v přítomnosti dočasného nebo reverzibilního rizikového faktoru (operace, trauma, imobilizace, těhotenství, perorální antikoncepce nebo hormonální substituce) během posledních 6 týdnů až 3 měsíců před diagnózou považujeme za provokovanou, v jejich nepřítomnosti ji považujeme za neprovokovanou. Plicní embolie (PE) se může vyskytnout i při absenci jakéhokoliv známého rizikového faktoru.
Přítomnost přetrvávajícího – oproti většímu dočasnému rizikovému faktoru – může ovlivnit rozhodnutí o trvání antikoagulační léčby. Silné rizikové faktory představují: větší trauma, operace, fraktury dolních končetin a kloubní náhrady a poranění míchy.
Dobře známým predispozičním faktorem pro žilní tromboembolii je malignita. Riziko tromboembolie kolísá mezi různými druhy malignity; s nejvyšším rizikem jsou spojeny hematologické malignity, rakovina plic, gastrointestinální (GI) malignity, rakovina pankreatu a mozku. Navíc malignita je silným rizikovým faktorem pro celkovou mortalitu po epizodě žilní tromboembolie. Bylo zjištěno, že společný faktor hospitalizace pro tromboembolii představuje infekce.
Diagnóza
APE může uniknout okamžité diagnóze, protože klinické známky a symptomy jsou nespecifické. Autoři ESC guidelines 2014 zdůrazňují nespecificitu následujících symptomů: dušnost, pleurální bolest na hrudi, kašel, bolest na hrudi pod sternem, horečka, hemoptýza, synkopa, známky jednostranné bolesti dolní končetiny. Z těchto symptomů jsou u pacientů s PE poněkud častější pouze pleurální bolest na hrudi, hemoptýza a známky hluboké žilní trombózy (jednostranná bolest dolní končetiny).
Na jiném místě textu lze v nových guidelines nalézt, že podezření na PE vzniká na podkladě dušnosti, bolesti na hrudi, hrozící synkopy nebo synkopy a/nebo hemoptýzy.
Posouzení klinické pravděpodobnosti
Klinická pravděpodobnost v ESC guidelines 2014 zahrnuje Wellsovo skóre i Ženevské skóre. Nové doporučené postupy ESC obsahují také zjednodušené verze obou skóre, což je velmi praktické, a proto je zde prezentujeme (tab. 1).
Table 1. Wellsovo skóre a Ženevské skóre 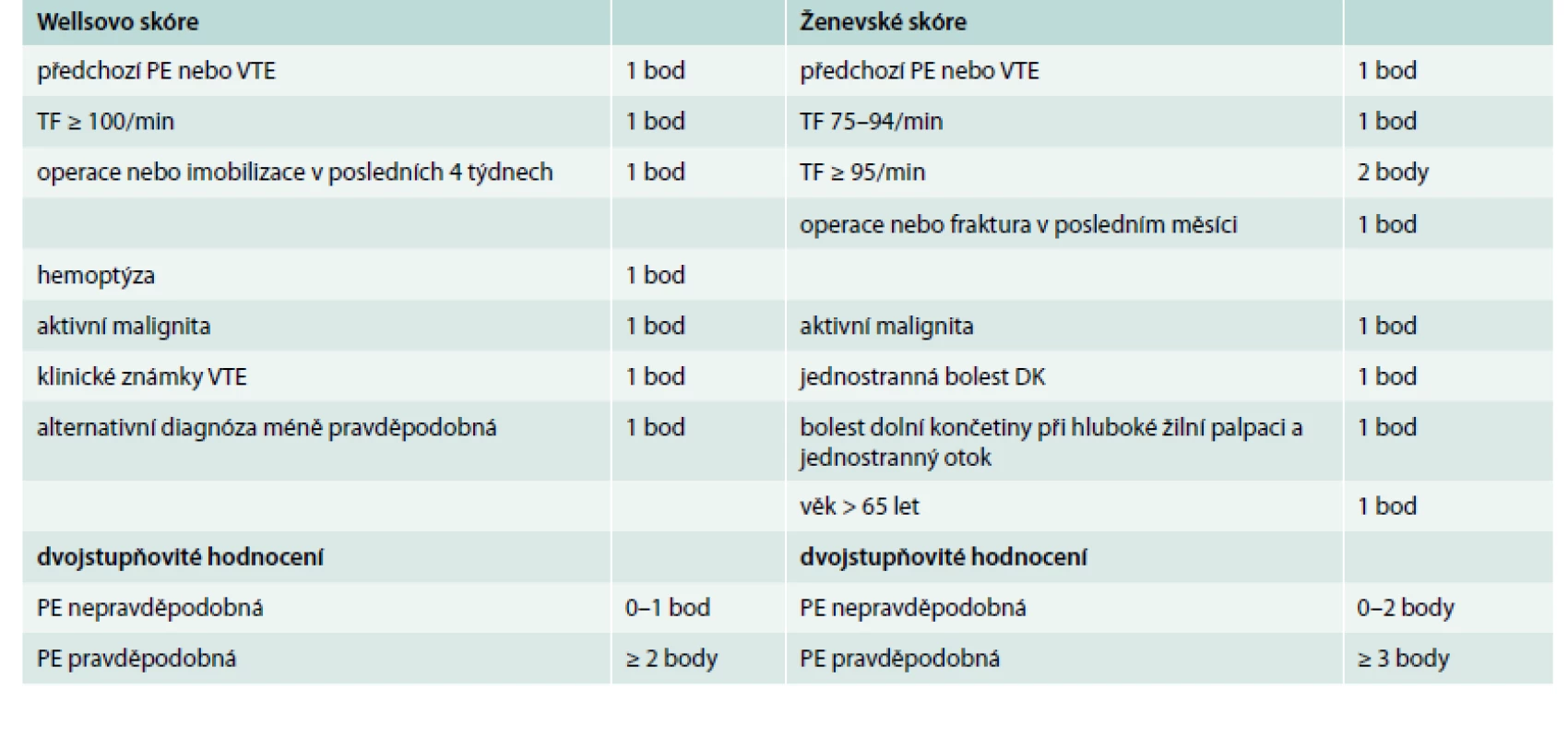
D-dimery
Nové doporučené postupy ESC zdůrazňují u pacientů se suspektní PE specificitu D-dimerů klesající s věkem, takže u pacientů ve věku > 80 let dosahuje jen 10 %. Nedávná metaanalýza ukázala hraniční hodnoty korigované věkem (věk × 10 µg/l nad 50 let). Tato rovnice umožnila zvýšení specificity ze 34 % na 46 %, přičemž si zachovala senzitivitu > 97 %. Multicentrická prospektivní studie léčby hodnotila v kohortě 3 346 pacientů hodnoty D-dimerů korigovaných věkem.
Pacienti s normálními hodnotami D-dimerů korigovanými věkem nebyli indikováni k CT plicní angiografii, nebyli léčeni a byli formálně sledováni po dobu až 3 měsíců. Ze 766 pacientů ve věku ≥ 75 let nemělo 673 pacientů vysokou klinickou pravděpodobnost. Při používání D-dimerů, použití hraničních hodnot korigovaných věkem (místo standardní hodnoty hraniční hodnoty 500 µg/l) zvýšilo počet pacientů, u nichž mohla být PE vyloučena, ze 43 (6,4 %) na 200 (29,7 %), aniž se zvýšil počet falešně negativních nálezů. D-dimery jsou častěji zvýšeny u malignit, u hospitalizovaných pacientů a během těhotenství.
Nové doporučené postupy hodnotí také diagnostický zisk různých metod používaných při vyloučení PE podle výsledků studií a zdůrazňují následující metody: VIDAS Exclusion, SimpliRed a Tinaquant.
Zjednodušená verze PESI – sPESI
Zjednodušená verze PESI (pulmonary embolism severity index) – spesi (simplification of the pulmonary embolism severity index) sestává z následujících parametrů:
- věk: 1 bod (u pacientů > 80 let)
- malignita: 1 bod
- chronické srdeční selhání nebo chronické plicní onemocnění: 1 bod
- TF ≥ 110/min: 1 bod
- systolický tlak < 100 mm Hg: 1 bod
- saturace tepenné krve kyslíkem < 90 %: 1 bod
Rizikové skupiny
0 bod = riziko 30denní mortality 1,0 % (95% CI 0,0–2,1) ≥ 1 bod(y) = riziko 30denní mortality 10,9 % (95% CI 8,5–13,2)
Biomarkery
Nové informace pojednávají o BNP, natriuretických peptidech-BNP, NT-proBNP, hsT (vysoce senzitivním troponinu) a H-FABP (tab. 2).
Table 2. Biomarkery u plicní embolie 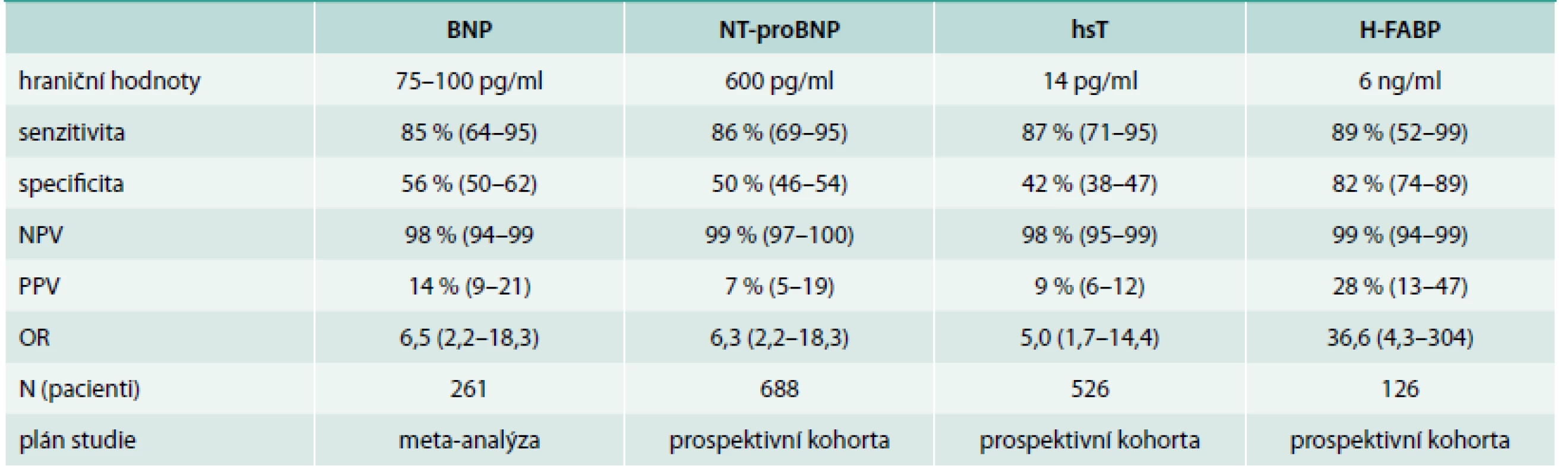
Ze všech uvedených biomarkerů jsou novými biomarkery hs-T a H-FABP. H-FABP – protein vážící se na mastné kyseliny srdečního typu NPV – negativní prognostická hodnota (value) PPV – pozitivní prognostická hodnota (value) Protein vážící se na mastné kyseliny srdečního typu (H-FABP) je časnou známkou poškození myokardu a u akutní PE má prognostickou hodnotu. U normotenzních pacientů mají hodnoty H-FABP ≥ 6 ng/ml, PPV 28 % a NPV 99 % pro negativní 30denní průběh. Jednoduché skóre opírající se o přítomnost tachykardie, synkopy a pozitivní test H-FABP dává podobnou prognostickou hodnotu jako dysfunkce pravé komory na echokardiografii.
Echokardiografie
Akutní PE může vést k přetížení a dysfunkci pravé komory (PK), kterou lze zjistit echokardiografií. Pro zvláštní geometrii PK neexistuje individuální echokardiografický parametr, který by poskytl rychlou a spolehlivou informaci o velikosti a funkci PK. To je důvodem rozdílů echokardiografických kritérií diagnózy PE v jednotlivých studiích. Protože negativní predikční hodnota činí 40–50 %, negativní výsledek nemůže vyloučit PE. Na druhé straně známky přetížení a dysfunkce PK se mohou vyskytnout při chybění akutní PE a mohou být způsobeny průvodní srdeční nebo respirační chorobou.
U pacientů s podezřením na vysoce rizikovou PE chybění echokardiografických známek přetížení nebo dysfunkce PK vylučuje prakticky PE jako příčinu hemodynamické nestability. U těchto pacientů může ale echokardiografie pomoci v diferenciální diagnostice příčiny šoku detekcí perikardiální tamponády, akutní chlopenní dysfunkce, těžké globální nebo regionální dysfunkce LK, disekce aorty nebo hypovolemie.
Na druhé straně u hemodynamicky nestabilního pacienta s podezřením na PE jednoznačné známky přetížení nebo dysfunkce PK opravňují rychlou reperfuzní léčbu PE, pokud není proveditelná okamžitá CT angiografie.
Mobilní tromby v pravém srdci lze zjistit TTE (transthoracic echokardiogram), TEE (transesophageal echocardiogram) nebo CT angiografií. Jejich prevalence může na KJ dosahovat 18 %. Mobilní tromby v pravém srdci potvrzují diagnózu PE a jejich přítomnost je provázena dysfunkcí PK a vysokou časnou mortalitou. O TEE uvažujeme při pátrání po emboliích v hlavních větvích plícnice za specifických klinických situací a u hemodynamicky nestabilních pacientů může mít vzhledem k vysoké prevalenci bilaterálních centrálních plicních embolií u většiny těchto nemocných diagnostickou hodnotu.
Duplexní sonografie dolních končetin
Pokud duplexní sonografie prokáže proximální hlubokou žilní trombózu u pacienta s klinickým podezřením na plicní embolii, potvrzuje tento nález plicní embolii.
Pokud duplexní monografie ukazuje distální hlubokou žilní trombózu, je třeba k potvrzení plicní embolie dalších vyšetření, a i u těchto nemocných je pro nebezpečí proximálního šíření trombu indikována antikoagulační léčba.
Plicní scintigrafie
Používáme trojstupňovitou klasifikaci: normální scan (vylučuje PE), scan vykazující vysokou pravděpodobnost (u většiny pacientů diagnostický) a nediagnostický scan. V/Q scan je radiačně a kontrastní látku šetřící výkon, proto je s výhodou používán u ambulantních nemocných s malou klinickou pravděpodobností a normálním snímkem hrudníku, u mladých pacientů (zvláště žen), v těhotenství, u pacientů s anamnézou anafylaktické reakce na kontrastní látku a silnou alergickou anamnézou, u těžkého ledvinného selhání a u pacientů s myelomem a paraproteinemií.
Nedávné studie naznačují, že data získaná tomografickou metodou při single photon emisní počítačové tomografii (SPECT) s nebo bez nízké dávky CT mohou snížit výskyt nediagnostických scanů. Zobrazovací metoda SPECT může dokonce dovolit použít automatické algoritmy pro PE. Autoři nových guidelines však vyžadují provedení rozsáhlých prospektivních studií ke zjištění správnosti těchto nových přístupů.
Nová 2014 ESC guidelines – klasifikace
Nová klasifikace akutní PE opírající se o riziko časné mortality dělí akutní PE do 4 skupin rizika.
Rizikové parametry a skóre jsou následující:
1. Šok nebo hypotenze – skupina s vysokým rizikem
Hypotenze je definována systolickým TK < 90 mm Hg, nebo poklesem tohoto TK o ≥ 40 mm Hg po dobu > 15 min, pokud není způsoben nově vzniklou arytmií, hypovolemií nebo sepsí.
U těchto pacientů mohou být známky dysfunkce PK zobrazovací metodou cenné při neproveditelnosti spirální CT angiografie.
2. Skupina intermediárního – vysokého rizika bez šoku nebo hypotenze
a) sPESI > 1
b) známky dysfunkce PK na zobrazovacím testu
c) srdeční biomarkery
Jak b), tak c) musí být pozitivní.
Studie PEITHO [2,3] byla provedena u těchto pacientů.
3. Skupina intermediárního – nízkého rizika bez šoku nebo hypotenze
Klasifikována jako sPESI > 1 a k tomu z testů b) a c) jen jeden nebo žádný je pozitivní.
4. Skupina nízkého rizika
Pacienti jsou hemodynamicky stabilní a stanovení parametrů b) a c) není nutné. Pokud je stanovení provedeno, jsou oba parametry negativní.
Echokardiografická kritéria dysfunkce PK zahrnují dilataci PK a/nebo zvýšení enddiastolického diametru PK-LK (ve většině studií, pokud bylo uvedeno, činila hraniční hodnota 0,9 nebo 1,0); hypokinezi volné stěny PK; zvýšení rychlosti trikuspidálního regurgitačního jetu nebo kombinaci uvedených parametrů. Na CT angiografii (4dutinová projekce srdce) je dysfunkce PK definována zvýšením poměru enddiastolického diametru PK/LK (hraniční hodnota 0,9 nebo 1,0).
PE s vysokým rizikem (masivní plicní embolie)
U pacientů s vysokým rizikem PE se má co nejdříve zahájit intravenózní antikoagulační léčba použitím UFH (unfractionated heparin), a poté je indikována trombolytická léčba.
Někteří kriticky nemocní pacienti s PE mohou vyžadovat emergentní venoarteriální extrakorporální membránovou oxygenaci – vaECMO [4].
Trombolytická léčba
V tomto roce byla uveřejněna největší studie trombolytické léčby – studie PEITHO [2]. Studie PEITHO zahrnovala 1 005 pacientů. Porovnala vliv nového trombolytika tenekteplázy, podávaného v bolusové dávce + heparinu u pacientů ve skupině intermediárního – vysokého rizika s heparinem + placebem. Studie nezjistila lepší účinnost trombolytické léčby + heparinu oproti léčbě pouze heparinem.
Trombolytická léčba + heparin snížily sice primární cíl studie – úmrtí nebo hemodynamický kolaps během 7 dní, ale snížení bylo způsobeno sníženým výskytem hemodynamického kolapsu (2,6 % vs 5,6 %; p = 0,015). Příznivý účinek trombolýzy byl tedy vyvolán hlavně významným snížením hemodynamického kolapsu (1,6 % vs 5,0 %; p = 0,002).
Celková mortalita byla však překvapivě nízká: 1,2 % ve skupině léčené tenekteplázou + heparinem a 1,8 % ve skupině léčené heparinem + placebo (p = 0,43).
Nízká mortalita mohla být způsobena skutečností, že do studie byli přijati pacienti s objektivně potvrzenou akutní PE s počátkem symptomů ≤ 15 dní před randomizací. To bylo podle našeho názoru hlavní příčinou negativních výsledků studie [6,7].
Léčba tenekteplázou zvýšila však výskyt hemoragických komplikací včetně krvácení do mozku (6,3 % vs 1,5 %, p < 0,001). Studie PEITHO nepřinesla tedy v této skupině pacientů průkaz přednosti trombolytické léčby.
Výskyt hemoragických komplikací byl méně častý ve věkové skupině ≤ 75 let.
Strategie používající redukovanou dávku rt-PA, tj. poloviční dávku rt-PA, se jevila jako bezpečná u „středně těžké“ PE. Tato studie však zahrnovala jen 121 pacientů.
Alternativní přístup může spočívat v použití lokální, katétrem aplikované a ultrazvukem asistované trombolýzy používající malé dávky trombolytik .
U pacientů s mobilními tromby v pravém srdci zůstává léčebný zisk trombolytické léčby rozporný. Některé zprávy hlásí dobré výsledky, ale v jiných zprávách přesahuje krátkodobá mortalita 20 % i při trombolytické léčbě.
Závěrem lze shrnout, že současná 2014 ESC guidelines doporučují u pacientů ve skupině intermediárního – vysokého rizika zahájit léčbu u všech pacientů antikoagulační léčbou a trombolytika podat jen pacientům, kteří se hemodynamicky horší.
U pacientů s intermediárním – vysokým rizikem je však doporučeno pečlivé monitorování, což dovolí časnou detekci hemodynamické dekompenzace a včasné zahájení „záchranné“ reperfuzní léčby.
Tab. 3 demonstruje trombolytika schválená pro plicní embolii podle ESC guidelines 2014.
Table 3. Trombolytika schválená pro plicní embolii podle ESC guidelines 2014 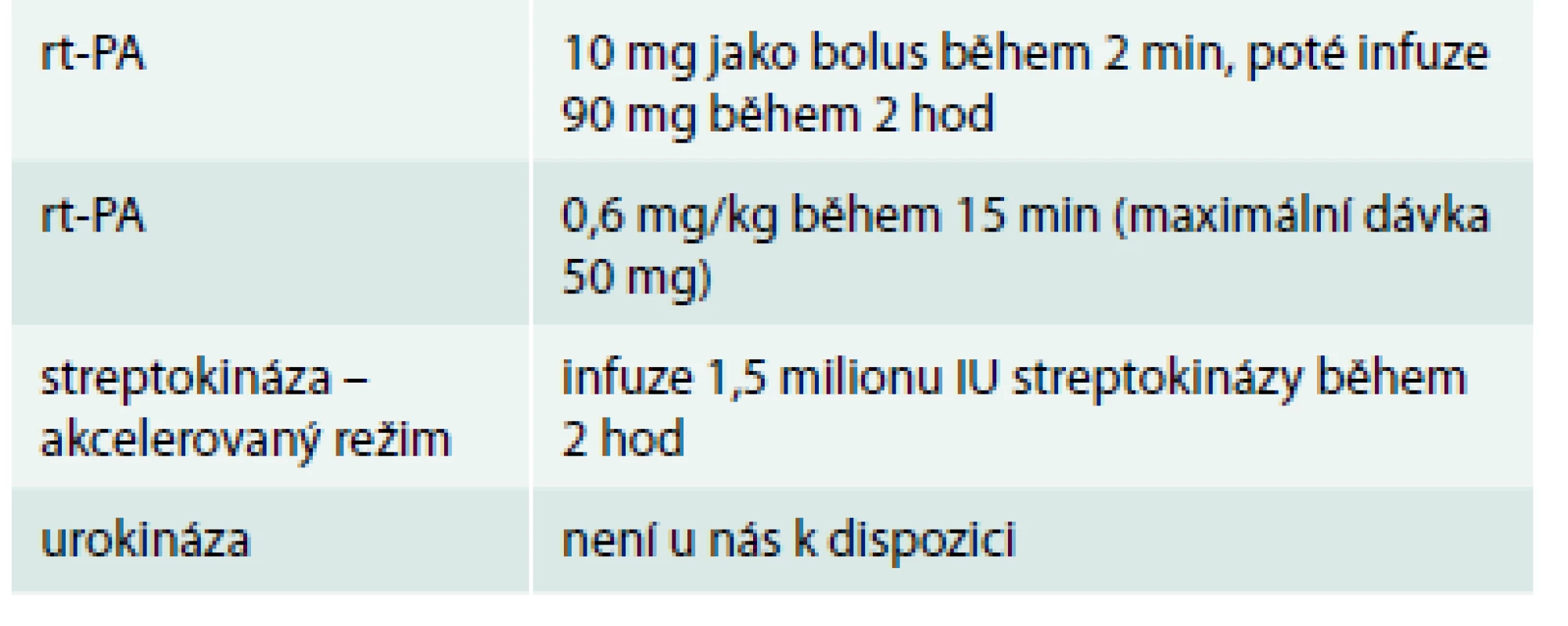
Absolutní kontraindikace trombolytické léčby
- hemoragická cévní mozková příhoda nebo příhoda nejasného původu kdykoliv
- ischemická cévní mozková příhoda v předchozích 6 měsících
- centrální nervové poškození nebo nádor
- nedávné větší trauma/operace/poranění hlavy v předchozích 3 měsících
- gastrointestinální krvácení v posledním měsíci
- známé riziko krvácení
Absolutní kontraindikace trombolýzy se mohou stát relativními u pacientů s vysoce rizikovou PE bezprostředně ohrožující život.
Relativní kontraindikace trombolytické léčby
- TIA v předchozích 6 měsících
- perorální antikoagulační léčba
- těhotenství nebo období po porodu po dobu 1 týdne
- nestlačitelné místo punkce
- traumatická resuscitace
- refrakterní hypertenze (systolický TK >180 mm Hg)
Podle Steina [5] trombolýza u nestabilních pacientů zachraňuje životy, ale je v USA užívána málo. V USA je pouze 30 % nestabilních pacientů s APE léčeno trombolýzou. Úmrtí u léčených 3 105 z celkového počtu 21 390 pacientů činí 15 %. Úmrtí u neléčených 23 820 z celkového počtu 50 640 pacientů činí 42 %. Obrovský to rozdíl.
Jak postupovat při kontraindikaci trombolytické léčby?
Při absolutní kontraindikaci trombolýzy je indikována embolektomie na kardiochirurgickém pracovišti, nebo katetrizační léčba. Evropské směrnice však relativizují i absolutní kontraindikace. Řešením může být podání poloviční dávky alteplázy, tj. 50 mg. Rozhodovat se musíme individuálně a zvážit riziko podání i nepodání.
Chirurgická embolektomie
Indikace: pacienti s kontraindikací trombolýzy pro vysoké riziko krvácení, pacienti v kritickém stavu, při němž není dostatek času na působení trombolýzy, a pacienti, kteří zůstávají nestabilní i po trombolýze.
Katetrizační léčba plicní embolie
Indikace: kontraindikace trombolytické léčby, selhání trombolytické léčby a u pacientů, u nichž je chirurgická embolektomie kontraindikována nebo není dostupná.
Katetrizační léčba zahrnuje fragmentaci trombu pig-tail katétrem, nebo angioplastickým balonkovým katétrem, reolytickou nebo rotační trombektomii nebo sací trombektomii.
Metaanalýza provedená autory Kuo et al (2009) ukázala, že katetrizační léčba byla provedena u 594 pacientů z 35 studií, klinický úspěch činil 86 %, větší komplikace byly pozorovány u 2,4 % a došlo k 5 úmrtím.
Antikoagulační léčba
Nízkomolekulární hepariny a pentasacharid (fondaparinux) jsou schváleny pro léčbu PE.
Nízkomolekulární hepariny zahrnují enoxaparin, tinzaparin, dalteparin, nadroparin. Pentasacharid fondaparinux je rovněž schválen pro léčbu PE.
Fondaparinux je selektivní inhibitor faktoru Xa podávaný jednou denně subkutánně v dávkách korigovaných na váhu, bez nutnosti monitorování.
Antikoagulační léčba za použití UFH nebo LMWH se má podávat nejméně 5 dní a pokud se INR pohybuje mezi 2,0–3,0 po 2 po sobě následující dny. Fondaparinux sledování INR nevyžaduje.
Účinnost a bezpečnost antikoagulační léčby warfarinem
Závisí na procentuálním zachování žádaného INR. To lze podstatně zlepšit vlastní monitorací INR.
Nová perorální antitrombotika nezávislá na vitaminu K (NOAC)
Nová perorální antitrombotika nezávislá na vitaminu K (NOAC – new oral anticoagulants) zahrnují:
- inhibitor faktoru IIa
- dabigatran 150 mg 2krát denně nebo 110 mg 2krát denně. Tyto dávky jsou podávány po léčbě enoxaparinem. Lék je schválen Evropskou unií.
- inhibitory faktoru Xa
- rivaroxaban 15 mg 2krát denně po 3 týdny, poté 20 mg 1krát denně. Lék je schválen Evropskou unií.
- apixaban 10 mg 2krát denně po 7 dní, poté 5 mg 2krát denně. Lék je schválen Evropskou unií.
- edoxaban LMWH/edoxaban 60 mg 1krát denně; 30 mg 1krát denně; pokud má pacient kreatininovou clearance 30–50 ml/min, nebo jeho hmotnost je < 60 kg. Edoxaban není dosud schválen Evropskou Unií.
Inhibitor faktoru IIa
Dabigatran v dávce 150 mg 2krát denně byl porovnán s warfarinem po počáteční léčbě LMWH po 6 měsíců v obou skupinách ve studii RE-COVER. Recidivy byly zjištěny u 2,4 % vs 2,1 %; p < 0,001 pro non-inferioritu. Krvácivé příhody se vyskytovaly častěji ve skupině léčené warfarinem 21,9 % vs 16,1 %; HR 0,71, na druhé straně se větší krvácení vyskytovalo stejně v obou skupinách. Autoři studie uzavřeli shrnutím, že dabigatran je v léčbě žilní tromboembolie stejně účinný jako warfarin.
Inhibitory faktory Xa
Studie EINSTEIN-PE porovnala léčbu rivaroxabanem (15 mg 2krát denně po 3 týdny, poté 20 mg 1krát denně) s enoxaparinem/warfarinem. Recidivy symptomatické plicní embolie/žilní trombózy se vyskytly u 2,1 % skupiny léčené rivaroxabanem a 1,8 % skupiny léčené enoxaparinem/warfarinem (nevýznamné). Primární cíl bezpečnosti větší nebo klinicky významné krvácení se vyskytlo u 10,3 % skupiny léčené rivaroxabanem vs 11,4 % ve skupině léčené warfarinem, ale výskyt těžšího krvácení byl nižší v rivaroxabanem léčené skupině (-1,1 % vs 2.2 %; p = 0,0032).
Apixaban byl zkoušen ve studii AMPLIFY. Tato studie byla randomizovanou, dvojitě slepou, dvojitě maskovanou (double dummy) studií porovnávající apixaban (v dávce 10 mg 2krát denně po prvých 7 dní, poté 5 mg 2krát denně) s enoxaparinem/warfarinem po 6 měsíců u 5 395 pacientů s akutní žilní tromboembolií. V prevenci recidiv žilní tromboembolie neměla fixní dávka apixabanu menší účinnost nežli léčba enoxaparinem/warfarinem (2,3 % v apixabanové skupině vs 2,7 % u nemocných léčených warfarinem), ale byla provázena významně menším výskytem většího krvácení – 0,6 % v apixabanem léčené skupině vs 1,8 % ve skupině léčené warfarinem (RR 0,31; p < 0,001 pro superioritu) v léčbě akutní žilní tromboembolie.
Přímý inhibitor Xa edoxaban byl testován ve dvojitě slepé, dvojitě maskované (double dummy) HOKUSAI-VTE studii oproti enoxaparinu/warfarinu. Recidivy žilní tromboembolie nebo fatální PE se vyskytly ve 3,2 % v edoxabanové skupině vs 3,5 % ve skupině léčené warfarinem. Větší nebo klinicky významné krvácení se vyskytlo méně často ve skupině léčené edoxabanem (HR 0,81; p = 004 pro superioritu).
938 pacientů v této studii mělo akutní PE a zvýšené hodnoty NT-proBNP (≥ 500 pg/ml), výskyt recidiv žilní tromboembolie činil 3,3 % ve skupině léčené edoxabanem a 6,2 % ve skupině léčené warfarinem (HR 0,52; 95% CI 0,28–0,98). Edoxaban však není schválen Evropskou unií.
Výsledky studií s novými perorálními antitrombotiky v léčbě žilní tromboembolie ukazují, že tyto látky nemají horší výsledky v prevenci recidiv a jsou možná bezpečnější, zejména ve výskytu většího krvácení oproti standardní léčbě heparinem/warfarinem. Vysoké hodnoty v léčebném rozmezí byly dosaženy standardní léčbou. Na druhé straně studované populace ve studiích nových antitrombotik zahrnovaly relativně mladé pacienty a velice málo pacientů mělo malignitu.
V současnosti lze považovat nová antitrombotika za alternativu standardní léčby.
Pro a proti užívání nových antitrombotik
Pro jejich použití
Není třeba pravidelných kontrol INR, proto jsou vhodná pro pacienty, kteří bydlí ve větší vzdálenosti od laboratorní kontroly INR, a pro pacienty vykazující velkou variabilitu svých hodnot INR.
Jejich účinky jsou méně ovlivněny dietou a většinou léků.
Pacienti vykazují lepší adherenci k léčbě
Proti jejich použití
Není dosud známo antidotum při krvácení.
Nejsou indikována u pacientů s těžší renální insuficiencí.
Ekonomicky jsou náročnější.
Nejsou indikována u pacientů neschopných přísně pravidelného užívání svých léků.
Trvání antikoagulační léčby
U pacientů s první příhodou PE vyvolanou přechodným rizikovým faktorem by mělo trvání antikoagulační léčby činit nejméně 3 měsíce.
Po vysazení antikoagulační léčby lze očekávat riziko recidiv po 6 nebo 12 měsících podobné jako po 3 měsících.
U recidivy žilní tromboembolie se doporučuje trvalá antikoagulační léčba, protože riziko recidiv se léčbou sníží o 90 %. Tento příznivý účinek je ale provázen 1% nebo vyšším ročním rizikem většího krvácení.
Aktivní malignita představuje větší rizikový faktor pro recidivu žilní tromboembolie, výskyt recidiv činí zhruba 20 % během prvých 12 měsíců. Proto jsou pacienti s maligním onemocněním kandidáty trvalé antikoagulační léčby po zjištění malignity. Doporučuje se LMWH po dobu alespoň 3–6 měsíců u pacientů s žilní tromboembolií a malignitou. Léčbu LMWH nebo antikoagulační léčbu se doporučuje provádět tak dlouho, pokud je malignita považována za aktivní.
Žilní tromboembolie je v přítomnosti dočasného nebo reverzibilního rizikového faktoru (jako operace, trauma, imobilizace, těhotenství, perorální antikoncepce nebo hormonální substituční léčba) v době diagnózy PE považována za provokovanou a za neprovokovanou při jejich chybění. U pacientů s provokovanou PE je upřednostňována 3měsíční antikoagulační léčba. Léčba delší než 3 měsíce se všeobecně nedoporučuje, pokud dočasný rizikový faktor již dále neexistuje.
Posouzení rizika recidivy u pacientů s neprovokovanou PE je komplexnější. Následující rizikové faktory pomáhají identifikovat kandidáty vyššího dlouhodobého rizika recidivy PE:
- jedna nebo více předchozích epizod VTE
- syndrom antifosfolipidových protilátek
- hereditární trombofilie
- reziduální trombóza proximálních žil
Nosiči molekulární trombofilie
- pacienti s lupus antikoagulans
- ti s potvrzeným deficitem proteinu C nebo S a
- pacienti s homozygotním faktorem V Leiden nebo homozygotním protrombinem G20210A (PTG20210A) mohou být kandidáty trvalé antikoagulační léčby po prvém neprovokovaném tromboembolizmu
Neexistují data o klinickém příznivém účinku protrahované léčby pro nositele heterozygotního faktoru V Leiden nebo PTG20210A.
Indikace kaválního filtru v prevenci plicní embolie
- PE + absolutní kontraindikace antikoagulační léčby a vysoké riziko recidivy VTE
- vznik nové tromboembolie při dobře vedené antikoagulační léčbě
Rutinní používání IVC filtrů (inferior vena cava filtr) se u pacientů s PE nedoporučuje. Spornou indikaci představuje stav po akutní masivní PE při nevyloučení žilních trombóz v pánevním řečišti.
Časné propuštění domů a domácí léčba PE
Klíčovou otázku představuje výběr pacientů s nízkým rizikem nežádoucí časné příhody. sPESI vykazuje vysokou senzitivitu pro výběr pacientů s nízkým rizikem, ale jeho hodnota pro výběr pacientů pro časné propuštění nebyla dosud přímo zkoumána.
Chronická tromboembolická plicní hypertenze
Chronická tromboembolická plicní hypertenze (CTEPH) může být dlouhodobou komplikací plicní embolie, s kumulativní incidencí 0,1–9,1 % během prvých 2 let po symptomatické plicní embolii. Rutinní screening CTEPH se nedoporučuje podle běžné praxe; významný počet pacientů s CTEPH vzniká v nepřítomnosti předchozí akutní plicní embolie.
Kromě obstrukce větších plicních cév zahrnuje patofyziologie CTEPH také plicní mikrovaskulární onemocnění, které může být důvodem špatného výsledku u některých pacientů po plicní endarterektomii.
Klinické symptomy a známky jsou u CTEPH nespecifické nebo zcela chybí, známky pravostranného srdečního selhání se zjišťují teprve v pokročilé fázi onemocnění, medián času mezi prvými symptomy a diagnózou v expertních centrech činí 14 měsíců. Diagnóza CTEPH se opírá o nálezy zjištěné po minimálně 3měsíční účinné antikoagulační léčbě.
Zatímco MDCT (multiple detector computed tomography) angiografie je diagnostickou zobrazovací metodou prvé volby u akutní plicní embolie, planární V/Q scan zůstává hlavní zobrazovací metodou u CTEPH; jeho senzitivita a specificita pro diagnózu totiž činí 96–97 % a 90–95 % resp.
Plicní endarterektomie (PEA) je léčbou volby tohoto onemocnění. Hospitalizační mortalita v Evropě v expertních centrech totiž činí jen 4,7 %. Většina pacientů pociťuje význačné zmírnění symptomů a hemodynamicky dochází k téměř normalizaci. Na rozdíl od chirurgické embolektomie při akutní plicní embolii vyžaduje léčba CTEPH skutečnou endarterektomii prováděnou medií plicních tepen, která se provádí za hluboké hypotermie a oběhové zástavy.
Pacienti, kteří nemohou podstoupit chirurgickou léčbu nebo trpí perzistující nebo reziduální plicní hypertenzí po PEA, vykazují špatnou prognózu.
Optimální konzervativní léčba CTEPH sestává z doživotní antikoagulační léčby, podávání diuretik a kyslíku. Plicní mikrovaskulární postižení u CTEPH poskytla rationale pro použití léků schválených pro plicní arteriální hypertenzi. Tyto léky mohou být oprávněny u:
- neoperovatelných pacientů
- u pacientů s perzistující nebo reziduální plicní hypertenzí po PEA nebo v přítomnosti neakceptovatelného chirurgického poměru riziko-benefit.
Riociguat byl schválen pro použití u symptomatických pacientů, kteří byli klasifikováni jako neoperovatelná CTEPH týmem CTEPH zahrnujícím nejméně jednoho chirurga nebo u pacientů, kteří mají perzistující/recidivující CTEPH po chirurgické léčbě.
Plicní embolie v těhotenství
Podezření na plicní embolii v těhotenství opravňuje klinické zhodnocení ověřenými metodami. Stanovení D-dimerů lze provést za účelem vyhnout se zbytečné iradiaci, protože negativní výsledek D-dimerů má stejný význam jako u pacientek bez těhotenství.
Lze také použít žilní kompresivní ultrasonografii ve snaze vyhnout se zbytečné iradiaci, protože diagnóza proximální hluboké žilní trombózy potvrzuje plicní embolii.
O perfuzní scintigrafii uvažujeme za účelem vyloučení suspektní plicní embolie u těhotných žen s normálním nálezem na RTG hrudníku. CT angiografie by měla být zvážena u těhotných žen, u nichž je nález na RTG hrudníku abnormální, nebo pokud není plicní scintigrafie včas k dispozici.
LMWH adjustovaný na hmotnost těhotné představuje doporučenou léčbu těhotných žen, pokud nevykazují šok nebo hypotenzi.
Nová perorální antikoagulancia nejsou v těhotenství indikována.
Shrnutí
Nová doporučení pro diagnostiku a léčbu akutní plicní embolie mají některé důležité aspekty.
Za nejdůležitější je třeba považovat rozdělení akutní plicní embolie do 4 skupin:
- akutní plicní embolie s vysokým rizikem (charakterizována šokem nebo hypotenzí), nazývaná též masivní plicní embolie
- akutní plicní embolie s intermediárním – vysokým rizikem bez šoku nebo hypotenze. U těchto pacientů chceme znát následující parametry: (a) sPESI > 1, (b) známky dysfunkce PK na zobrazovacím testu, (c) srdeční biomarkery. Přítomnost známek dysfunkce PK na zobrazovacím testu a pozitivní srdeční biomarkery jsou pro tuto diagnózu nutné.
- akutní plicní embolie s intermediárním – nízkým rizikem bez šoku nebo hypotenze. Klasifikována jako sPESI > 1 a k tomu z parametrů b) a c) jen jeden nebo žádný je pozitivní.
- akutní plicní embolie s nízkým rizikem
Hlavní změna se dá také charakterizovat tak, že tzv. submasivní plicní embolie byla rozdělena do 2 skupin – více a méně riziková.
Další změny nových Evropských doporučení přinášejí také zjednodušení propočtu klinické pravděpodobnosti PE opírající se o Wellsovo skóre i Ženevské skóre. Nová guidelines obsahují také zjednodušené verze obou skóre. Zjednodušená verze sPESI patří mezi další klady. Propočet D-dimerů na věk je zpřesněn a je nyní velmi užitečný. Změny lze nalézt také v použití biomarkerů, důraz je nyní kladen na nové biomarkery, mezi které patří hs-T a H-FABP.
Nová perorální antitrombotika nejsou sice účinnější oproti heparinu/warfarinu, ale vedou méně často ke krvácení a jejich používání je jednoduché.
Literatura
- Konstantinides SV, Torbicki A, Agnelli G et al. for the Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). Endorsed by the European Respiratory Society (ERS). 2014 Guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J 2014; 35(43): 3033–3069. Dostupné z DOI: <http://doi: 10.1093/eurheartj/ehu283>.
- Meyer G, Vicaut E, Danais R et al for the PEITHO Investigators. Fibrinolysis for patients with intermediate-risk pulmonary embolism. N Engl J Med 2014; 370(15): 1402–1411.
- Elliot CG. Fibrinolysis of Pulmonary Emboli – Steer Closer to Scylla. Editorial. N Engl J Med 2014; 370(15): 1457–1458.
- Bělohlávek J, Dytrych V, Král A et al. Závažná plicní embolie. Intervenční a akutní kardiologie 2011; 10: (Suppl A): 6–13.
- Stein PD, Matta F. Thrombolytic therapy in unstable patients with pulmonary embolism: saves lives but underused. Am J Med 2012; 125(5): 465–475.
- Widimsky J. Thrombolytic treatment in patients with a submassive PE (PE with intermediate risk) the PEITHO study has been published. Cor Vasa 2015; in press
- Widimský J. Diagnostika a léčba akutní plicní embolie. Cor Vasa 2013; 55(6): 643–654.
Addendum 1
Další data o porovnání trombolytické léčby s antikoagulační léčbou u pacientů s plicní embolií s intermediárním rizikem
Po přednesení a uveřejnění 2014 ESC Guidelines byla publikována v říjnu roku 2014 další práce v časopise JAMA [1], která se rovněž zabývala porovnáním trombolytické léčby a antikoagulační v léčbě plicní embolie s intermediárním rizikem.
Jedná se o metaanalýzu zahrnující data 8 studií s celkem 1 775 pacienty s plicní embolií s intermediárním rizikem. U těchto pacientů porovnali autoři trombolytickou a antikoagulační léčbu. Primárním cílem jejich metaanalýzy byly celková mortalita a větší krvácení. V metaanalýze studií léčby plicní embolie s intermediárním rizikem byla trombolytická léčba provázena významně nižší mortalitou (OR 0,48; 95% CI 0,25–0,92), n = 12 vs 26, ale také významně častějším výskytem větších krvácivých příhod (OR 3,19; 95% CI 2,07–4,92). Intrakraniální krvácení se vyskytovalo také častěji u pacientů léčených trombolýzou (n = 15 vs 2; p = 0,002).
Trombolytická léčba vedla také k nižšímu výskytu recidiv plicní embolie (0,40; 95% CI 0,22–0,74), n = 12 vs 31.
Větší krvácení nebylo významně zvýšeno u pacientů 65letých a mladších (OR 1,25; 95% CI 0,50–3,14).
Literatura
1. Chatterjee S, Chakraborty A, Weinberg I et al. Thrombolysis for Pulmonary Embolism and Risk of All-Cause Mortality, Major Bleeding, and Intracranial Hemorrhage. A Meta-analysis. JAMA 2014; 311(23): 2414–2421.
Addendum 2
Je žilní tromboembolie chronický stav?
Současně s prezentací ESC 2014 Guidelines pro plicní embolii v Barceloně byla představena v časopise Circulation dánská epidemiologická studie, která uveřejnila data o 30roční mortalitě po žilní tromboembolii na podkladě kohortové populační studie. V této studii byli po 30 let sledováni pacienti, u nichž vznikla v Dánsku žilní tromboembolie buď ve formě hluboké žilní trombózy (HŽT = DVT) nebo plicní embolie (PE). Ti byli porovnáni s celkovou dánskou populací.
Dosavadní písemnictví se zaměřilo hlavně na krátkodobý osud žilní tromboembolie, ale kritickou nezodpovězenou otázkou zůstávala dlouhodobá mortalita. Byli jsme zvyklí považovat plicní embolii nebo hlubokou žilní trombózu za jednorázové záležitosti, které lze zvládnout 3, 6 nebo 12měsíční antikoagulační léčbou, a poté víceméně se již nestarat o dlouhodobé riziko pacientů.
Dánská epidemiologická studie demonstrovala vysokou 30denní mortalitu pacientů s PE způsobenou buď přímo tromboembolickou příhodou, nebo jejími bezprostředními komplikacemi. Překvapujícím nálezem dánské studie bylo zjištění, že riziko mortality zůstalo zvýšené i po 30 letech, a to jak po počáteční diagnóze hluboké žilní trombózy, tak i PE, při čemž žilní tromboembolie byla důležitou příčinou smrti. Autoři potvrdili zvýšenou celkovou mortalitu u pacientů s maligním onemocněním, chronickým srdečním selháním a dalšími chronickými nebo akutními stavy.
U pacientů s hlubokou žilní trombózou nezjistili autoři studie žádné zlepšení mortality, ale naproti tomu nalezli výrazné snížení 1roční mortality v posledních 3 dekádách, u pacientů s plicní embolií (z 52,99 na 18,81) způsobené zlepšením diagnostiky a léčby.
Dánská studie představuje žilní tromboembolii za závažný, chronický dlouhodobý stav, se kterým se musí vyrovnat pacient, rodina i poskytovatelé zdravotní péče.
Žilní tromboembolie by mohla být chronickým zánětlivým stavem, jako koronární nemoc nebo diabetes a je třeba se na ni dívat jako celoživotní problém.
Shrnutí
Z části addenda považujeme za důležitější práci druhou, ukazující plicní tromboembolii jako závažný, chronický dlouhodobý stav. Riziko mortality PE zůstává totiž zvýšené i po 30 letech. S tím se musí vyrovnat pacient, rodina i poskytovatelé zdravotní péče.
Žilní tromboembolie by mohla být chronickým zánětlivým stavem, jako koronární nemoc nebo diabetes a je třeba se na ni dívat jako na celoživotní problém.
prof. MUDr Jiří Widimský, DrSc., FESC, FAHA, FCMA
widimsky@seznam.cz
Klinika kardiologie IKEM, Praha
www.ikem-kardiologie.cz
Doručeno do redakce 17. 3. 2015
Sources
1. Søgaard KK, Schmidt M, Pedersen L et al. 30year mortality after venous thromboembolism: a population-based cohort study. Circulation
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2015 Issue 3-
All articles in this issue
- Neceliakální glutenová senzitivita – editorial
- Neceliakální glutenová senzitivita – editorial
- Naše zkušenosti s hormonální léčbou transsexuálních pacientů
- Má tělesná výška vliv na závažnost chronického žilního onemocnění na dolních končetinách?
- Zkušenosti s léčbou biosimilárními léky
- Najnovšie aspekty diagnostiky a terapie hyponatriémie
- Neceliakální glutenová senzitivita
- Chronická tromboembolická plicní hypertenze
- Nové doporučené postupy ESC pro diagnostiku a léčbu akutní plicní embolie
-
Syndróm vénovej panvovej kongescie – diagnóza a manažment
Odporúčanie Angiologickej sekcie Slovenskej lekárskej komory (2015) -
PET-CT dokumentovaná remise multicentrické formy Castlemanovy choroby po léčbě rituximabem
Popis případu a přehled literatury - Hypersenzitivní reakce po podání heparinu s aktivací heparinem indukované trombocytopenie po zahájení intermitentní hemodialýzy
- Vybrané právní aspekty povinné mlčenlivosti
-
Lehké hypoglykemie jsou v České republice u pacientů s diabetem 2. typu léčených inzulinovými analogy běžné a jejich výskyt pacienty znepokojuje
Výsledky průzkumu GAPP2TM (Global Attitudes of Patient and Physicians) - Hormonální léčba transsexuálních pacientů – editorial
- Nejnovější aspekty diagnostiky a terapie hyponatremie – editorial
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Naše zkušenosti s hormonální léčbou transsexuálních pacientů
-
Syndróm vénovej panvovej kongescie – diagnóza a manažment
Odporúčanie Angiologickej sekcie Slovenskej lekárskej komory (2015) - Neceliakální glutenová senzitivita
- Najnovšie aspekty diagnostiky a terapie hyponatriémie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

