-
Medical journals
- Career
Mitrální stenóza
Authors: Pavel Gregor; Hana Línková
Authors‘ workplace: III. interní – kardiologická klinika 3. LF UK a FN Královské Vinohrady Praha, přednosta prof. MUDr. Petr Widimský, DrSc., FESC , FACC
Published in: Vnitř Lék 2014; 60(4): 304-309
Category: 60th Birthday - prof. MUDr. Petr Widimský, DrSc., FESC, FACC
Overview
Práce se zabývá problematikou mitrální stenózy ve světle současných poznatků. Vada je dnes ve vyspělých zemích velmi vzácná (asi 10 % vad). Její etiologie se podstatně změnila především díky úbytku revmatické horečky. Sumarizovány jsou klinické, echokardiografické a katetrizační nálezy, dále pak léčba a prognóza.
Klíčová slova:
echokardiografie u mitrální stenózy – mitrální stenóza – náhrada mitrální chlopněÚvod
Mitrální stenóza (MS) je vada, která v současnosti patří ve vyspělých zemích mezi vzácné. Podle nejnovějších evropských dat tvoří něco málo přes 10 % vad u dospělých [1]. V praxi pracovišť v České republice se zdá, že je její výskyt ještě nižší. Při posledním termínu kardiologických atestací v květnu roku 2013 dokonce adept kardiologie, který si tuto otázku vytáhl, se s touto vadou dosud nesetkal ani během studia, ani v dalších několika letech práce v jednom z našich předních kardiocenter (odpovídala tomu i úroveň jeho znalostí). Lze si jistě pak snadno představit, že se v praxi na tuto vadu nemyslí a v krajním případě ani není řádně diagnostikována. Samotný poslechový nález MS totiž patří k těm, které lze při nedostatečné zkušenosti přehlédnout. Proto chceme oživit problematiku této vady, v krátkosti ji připomenout, a to především v kontextu některých novějších a méně známých pohledů na ni.
Etiologie
V etiologii MS drtivě převládá porevmatický původ (obr. 1, 2 a 3) – zde je také příčina jejího nízkého výskytu ve vyspělých zemích, neboť revmatická horečka (rheumatic fever – RF) v těchto zemích prakticky neexistuje. V rozvojových zemích, především v některých asijských a latinsko-amerických, však MS představuje stále významný kardiologický problém [1,2]. MS je častější u žen.
Image 1. Typický obraz porevmaticky změněné mitrální chlopně v 2D-echokardiografii, vydouvání (doming) předního a restrikci zadního cípu znázorňují šipky 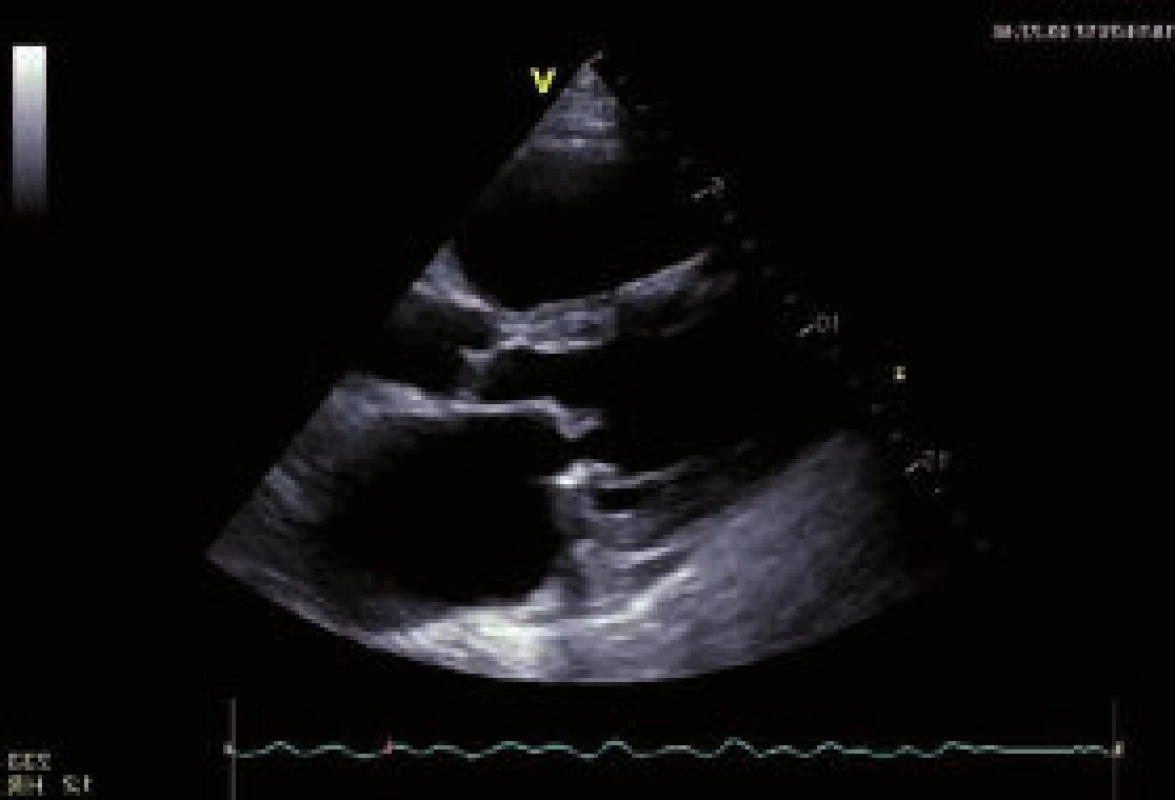
Image 2. Typické M-mode zobrazení mitrální chlopně. Patrná je omezená separace cípů a především dopředný diastolický souhyb zadního cípu a doming předního cípu (označeno šipkami). 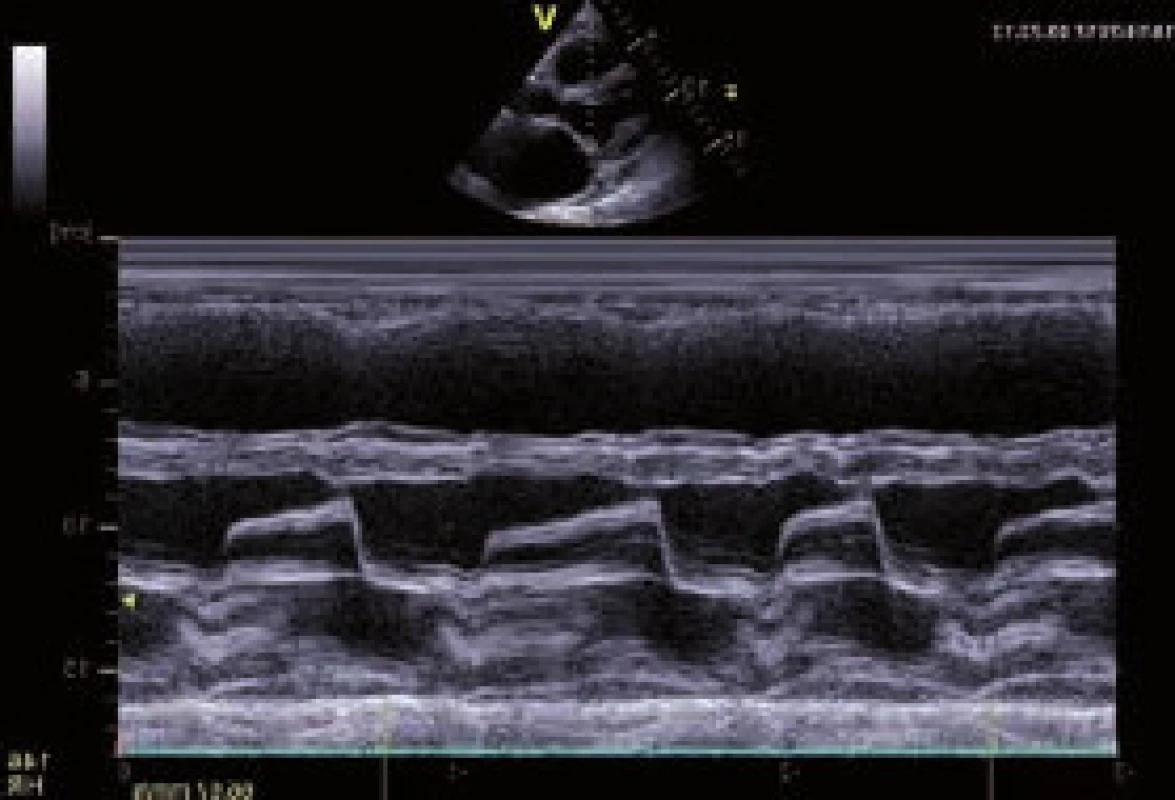
Image 3. Mitrální ústí z parasternální krátké osy v dvourozměrné echokardiografii 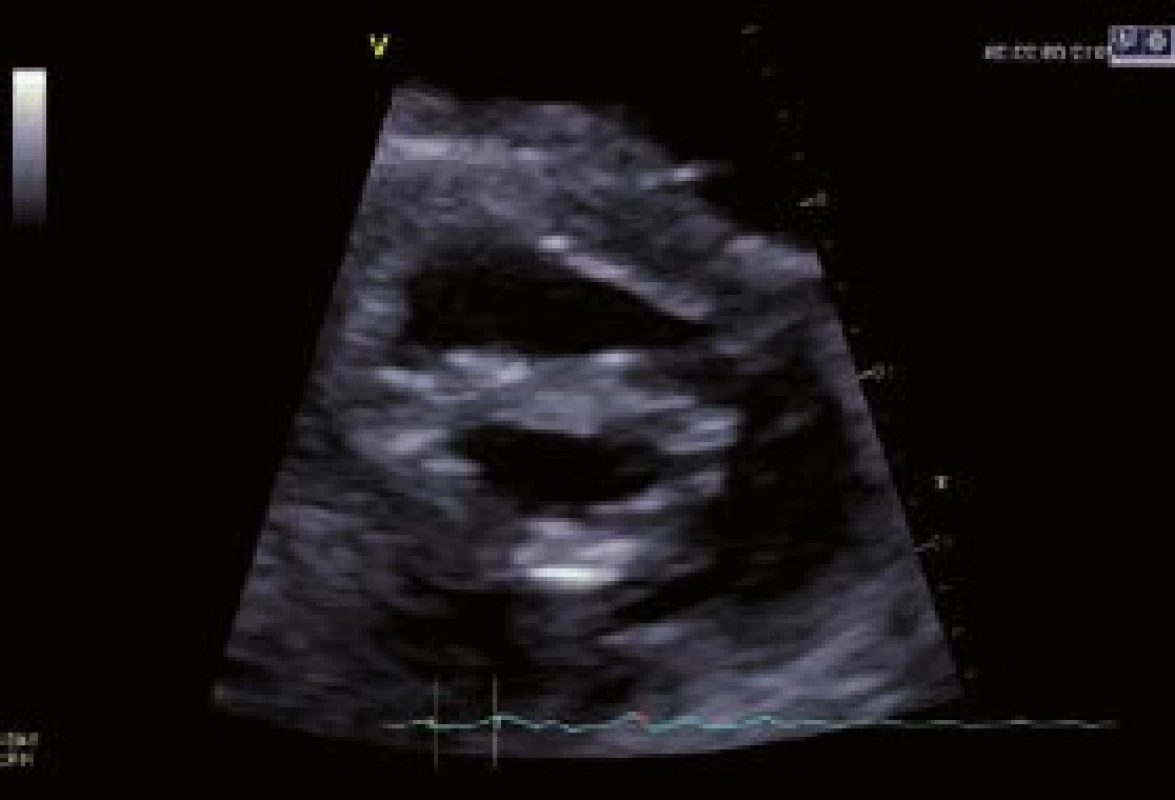
U MS dochází v důsledku RF k srůstu cípů v komisurách, ztluštění cípů, mitrálních šlašinek (rovněž spolu s jejich srůsty) s následným ukládáním vápníku. Výsledkem je zmenšení plochy mitrálního ústí. Často bývají současně postiženy i jiné chlopně (zvláště aortální).
V etiologii MS je však pravděpodobně nejvíce nových poznatků, proto si dovolíme poněkud více se této problematice věnovat.
Vrozený původ je raritou. Lze se s ním setkat u padákovité (tzv. parachut) mitrální chlopně ev. u tzv. Lutenbacherova syndromu (spojení MS a defektu septa síní typu secundum).
Zvláštní je vztah myxomů levé síně a MS (obr. 4). Myxomy mají průměrnou velikost 5 cm a lze si snadno představit, že mohou vést k obstrukci mitrálního ústí. U větších myxomů je i vyšší pravděpodobnost vzniku závažné MS [3]. Kombinace myxomu a mitrální stenózy je však naproti tomu extrémně vzácná – mitrální stenóza může pak působit jako určitý ochranný mechanizmus proti embolizacím větších částí myxomu do velkého oběhu [4]. Výjimečná je MS u jiných benigních srdečních nádorů, např. hemangiomu [5], případně u nádorů maligních [6,7].
Image 4. Myxom levé síně způsobující mitrální pseudostenózu 
Vzácně může mít MS i degenerativní původ. Lze to pozorovat u velmi výrazných kalcifikací mitrálního prstence, které ční do ústí a zužují jej. I když jde o vzácnou situaci, zdá se, že její výskyt narůstá zejména u starších žen – diabetiček a nemocných s renální insuficiencí [8]. MS se může vyskytnout i u některých systémových chorob, nejnověji byla popsána u tuberózní sklerózy [9].
Vznik mitrální stenózy byl popsán také po různých instrumentálních výkonech – např. po suboptimálně provedené transaortální implantaci chlopně (TAVI) nebo zavedení Amplatzerova okludéru k léčbě paravalvulárního leaku [11]. V některých případech zavedení MitraClipu se „sepnutím“ okrajů nedomykavé mitrální chlopně může rovněž docházet k následnému vzniku MS, a to především u pacientů chronicky hemodialyzovaných, u nichž dochází k výraznějšímu a urychlenému vzniku kalcifikací v chlopni [12].
Patofyziologie
Z hlediska patofyziologie dochází u MS ke zvyšování tlaku v levé síni, které nemusí být patrné v klidu, po zátěži se zvýšením srdečního výdeje však obvykle stoupá i u lehčích stenóz s plochou ústí < 1–1,5 cm2. Při ploše ústí < 1 cm2 bývá obvykle zvýšen již v klidu [13]. Dochází postupně k hypertrofii stěny levé síně a zvýšení vlny a křivky plicně kapilárního tlaku, která odpovídá kontrakci levé síně [13]. Systola síní, pochopitelně, mizí při fibrilaci síní, a proto tam dochází k poklesu srdečního výdeje. Městnáním krve před překážkou se rozvíjí plicní hypertenze. Ta odráží tlak v levé síni, nebývá tedy ve většině případů extrémně vysoká (systolický obvykle nepřevyšuje 50 mm Hg) [13]. Vzácně se lze u MS setkat s tzv. reaktivní plicní hypertenzí, při níž nejde jen o pasivní přenos zvýšeného tlaku z levé síně, ale v důsledku vazokonstrikce a později i hypertrofie medie plicních arteriol se tlak v plicnici dále výrazně zvyšuje (může dosáhnout až hodnoty systémového tlaku). To vede k tlakovému přetížení pravé komory, jejímu pozdějšímu selhávání a vzniku tzv. trikuspidalizace vady. Při ní (v důsledku dilatace trikuspidálního anulu) vzniká trikuspidální insuficience. Může být přítomna i pulmonální insuficience s typickým diastolickým šelestem Grahama Steela (viz dále).
Dilatuje levá síň, častá je i fibrilace síní. Při ní se stav nemocných zhoršuje, neboť výrazněji trpí diastolické plnění – jednak pro tachykardii, jednak pro ztrátu síňové kontrakce. Výjimečné nebývají ani nejrůznější embolizace, a to jak do systémového, tak i plicního oběhu s častou hemoptýzou.
Je poněkud zvláštní, že u MS bývá často patrné snížení kontrakcí levé komory (většinou lehký pokles ejekční frakce), týká se to přibližně 30 % nemocných s MS. Mohlo by to souviset s chronicky sníženým plněním levé komory nebo i s prodělanou revmatickou myokarditidou u některých nemocných. Klinicky jde o nevýznamný nález. V poslední době však byla u MS popsána i porucha diastolické funkce [14].
Klinický obraz
Vada může zůstat dlouho asymptomatická, pravidlem je to u nemocných, u nichž je plocha mitrálního ústí > 1,5 cm2. Postupně se objevuje dušnost, zprvu ponámahová, u pokročilejších vad může vzniknout až plicní edém (někdy i u dříve asymtomatických osob). Častý bývá kašel z plicní kongesce. Výjimečná není ani hemoptýza (asi v 10 % MS), jejíž příčinou bývá ruptura dilatovaných bronchiálních žil, chronická bronchitida s edematózní sliznicí, ale i možnost plicní embolizace. Jak bylo výše uvedeno, k symptomatickému zhoršení dochází často po objevení se fibrilace síní.
Při fyzikálním vyšetření lze najít facies mitralis, bývá i periferní cyanóza a další známky insuficience pravé komory. Velmi typický je i poslechový nález. I. ozva je akcentovaná a zvláštním způsobem klapavá (tzv. modifikovaná I. ozva). Po II. ozvě následuje mitrální otevírací zvuk, po němž je patrný v protodiastole nízkofrekvenční hrčivý šelest, který ve střední diastole mizí nebo se zeslabuje, aby se v presystole znovu objevil jako jakési presystolické crescendo. Šelest může být patrný jen v malém okrsku v okolí srdečního hrotu nebo vlevo parasternálně, zvýrazní se v poloze na levém boku. Někdy lze nalézt výše uvedený Graham Steelův, který se zásadně liší od diastolického šelestu MS (lokalizací, ale především svým charakterem, u MS je nízkofrekvenční, u pulmonální insuficience typicky vysokofrekventní a připomíná podobný šelest u aortální insuficience). Mohou být chrůpky na plicích.
Na EKG může být patrné P mitrale – dvojvrcholové P ve svodu II, které však nacházíme i u jiných stavů spojených s výraznější dilatací levé síně. Mohou být přítomny známky hypertrofie pravé komory, sklon elektrické osy srdeční bývá doprava.
Na RTG plic bývají změny až v pozdějších stadiích vady. Jde především o dilataci levé síně, která může tvořit „jádrový stín“, rozšíření pravé komory. Levá komora je malá, může být patrné městnání v plicních žilách s redistribucí krve v horních partiích.
Echokardiografie má u MS zásadní význam. Dvourozměrná echokardiografie umožňuje rozpoznat diastolické vydouvání cípů fibroticky změněných, s častými kalcifikacemi (včetně subvalvulárních struktur). Pravidlem bývá postižení jiných chlopní (zvláště aortální). Při diagnostických rozpacích stran etiologie mitrální vady lze použít jednorozměrné zobrazení, které je pro porevmatickou mitrální stenózu typické (obr. 2).
Levá síň je dilatovaná – při nižší poddajnosti však nemusí být tato dilatace příliš vyjádřena, jindy naopak může dosahovat tato dilatace obrovských rozměrů. O gigantické levé síně se hovoří, pokud je její průměr ≥ 65 mm. Příčinou bývá nejčastěji revmatické postižení stěny levé síně při pankarditidě [15], extrémně dilatovaná síň může vést až k plicní atelaktáze, která po úspěšné operaci ustupuje [16]. V dilatované levé síni bývají obvyklé tromby nebo spontánní echokontrast.
Z dvourozměrné echokardiografie lze přímo planimetrizací zjistit plochu mitrálního ústí (MVA) (obr. 3), dále lze změřit separaci cípů – tato vyšetření však mohou být u těžce kalcifikovaných chlopní nepřesná. Podle závěrů posledních prací se zdá, že planimetricky zjištěná MVA z dvourozměrné echokardiografie má tendenci tuto plochu nadhodnotit, nejpřesnější je MVA získaná z trojrozměrné jícnové echokardiografie [17,18].
Dopplerovské hodnocení hemodynamické významnosti MS se zakládá na měření vrcholové a střední rychlosti proudění stenotickou tryskou s výpočtem příslušných gradientů podle rovnice
PG = 4 × v2
Střední gradient se zjišťuje z plochy pod TVI křivkou.
Pro měření plochy ústí (MVA) je důležité změřit tzv. tlakový poločas, tedy čas poklesu tlakového gradientu na polovinu (PHT) a dále výpočet podle vzorce MVA = 220/PHT (obr. 5). Je nutné si však uvědomit, že zvětšený tlakový poločas neznamená vždy MS, je zde závislost na srdečním výdeji, poddajnosti levé síně i levé komory a dalších vlivech, především srdečním výdeji i samotné srdeční frekvenci. Normální plocha mitrálního ústí je 4–6 cm2.
Image 5. Měření vrcholového a středního gradientu na mitrální chlopni užitím CW dopplerovského vyšetření a stanovení PHT, výpočet plochy mitrálního ústí při užitím vzorce 220/PHT 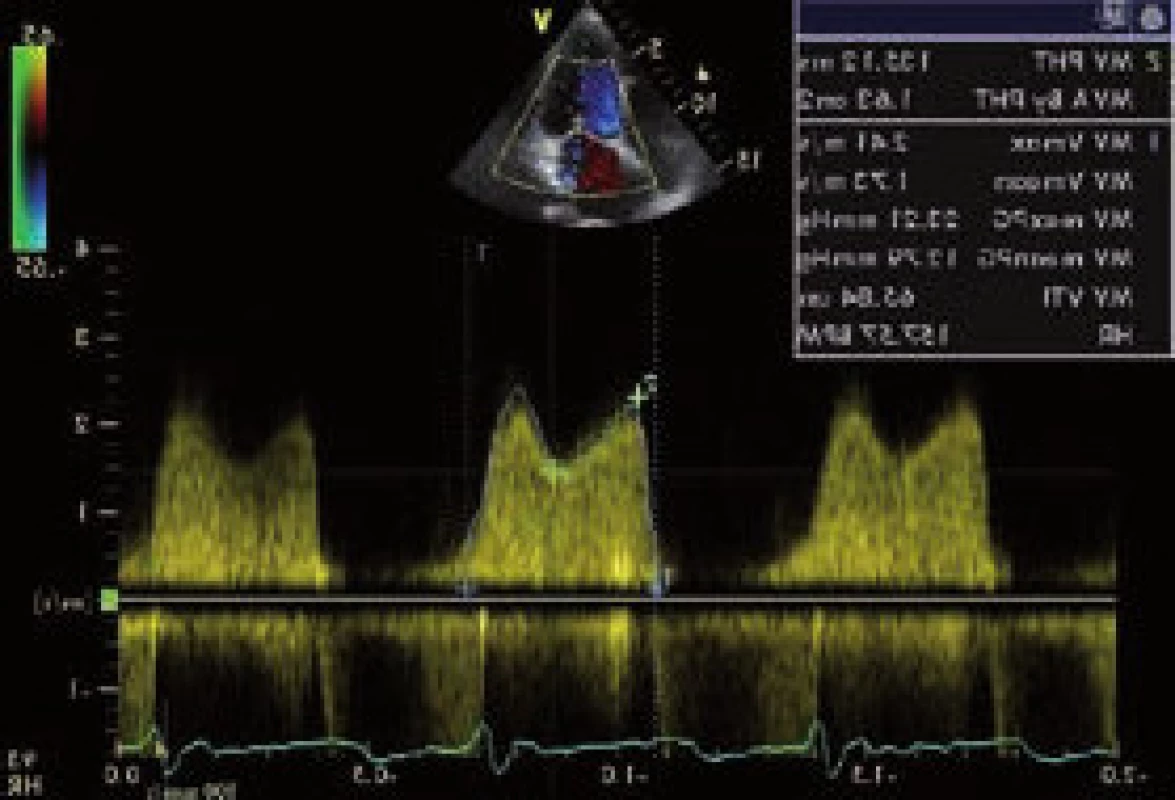
Na rozdíl od aortální stenózy, výpočet MVA z rovnice kontinuity se u MS příliš neosvědčil (častá přítomnost mitrální regurgitace), poněkud výhodnější se zdá přímé měření plochy ústí z dvojrozměrné, nebo lépe z trojrozměrné echokardiografie, optimální je však současné využití dopplerovského stanovení i přímé planimetrizace, které mají komplementární charakter [1]. Nejčastější parametry užívané ke kvantifikaci MS jsou zachyceny v tab. 1.
Table 1. Echokardiografická kvantifikace mitrální stenózy. Upraveno podle [1,2] ![Echokardiografická kvantifikace mitrální stenózy. Upraveno podle [1,2]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/5010807b12df51168dbdbf9f7ad3d4d3.png)
MVA – plocha mitrálního ústí MVAI – plocha mitrálního ústí vztažená k tělesnému povrchu PHT – poločas poklesu tlakové křivky na polovinu AP – systolický tlak v a. pulmonalis z trikuspidálního regurgitačního gradientu Zátěžové testy u mitrální stenózy
U pacientů s významnou symptomatickou mitrální stenózou, kteří jsou indikováni k mitrální balonkové valvuloplastice či náhradě mitrální chlopně, stačí k rozhodnutí o dalším postupu obvykle klidové transtorakální echokardiografické vyšetření. Stejně tak u pacientů s méně či maximálně středně významnou asymptomatickou mitrální stenózou je klidové transtorakální vyšetření postačující. Problém v rozhodnutí o dalším terapeutickém postupu může nastat u těch nemocných, kteří mají asymptomatickou významnou mitrální stenózu nebo u pacientů se symptomy, ale s jen středně významnou mitrální vadou při klidovém echokardiografickém vyšetření. V těchto situacích nám v rozhodovacím procesu pomáhá právě provedení zátěžového testu [1,2,19–21].
Při zhodnocení tíže vady je nutné si ale také uvědomit, že transmitrální gradient je též závislý na aktuální srdeční frekvenci, výši krevního tlaku a dalších aktuálních hemodynamických parametrech.
Práce Reise et al [22] popisuje horší prognózu pacientů s MS, kteří měli na vrcholu zátěžového testu střední gradient na mitrální chlopni (≥ 18 mm Hg), než u nemocných se středním gradientem (≤ 18 mm Hg).
V dalších pracích je pak popisován význam stanovení pulmonálního arteriálního tlaku v průběhu zátěže (odvozuje se od změřeného regurgitačního gradientu na trikuspidální chlopni). Tato hodnota však může být do jisté míry ovlivněna i atrioventrikulární poddajností (při snížené atrioventrikulární komplianci je větší tendence k nárůstu pulmonálního arteriálního tlaku v průběhu zátěže) [23].
Kdy tedy provádět zátěžový test u pacientů s mitrální stenózou?
Dle doporučení ESC ACC/AHA [1,19] u těch nemocných, kteří mají diskrepanci mezi významností vady a symptomy. K intervenci (ať již jde o balónkovou valvuloplastiku či náhradu mitrální chlopně) by pak měli být doporučeni ti, kteří měli v průběhu zátěžového testu střední gradient na mitrální chlopni > 15 mm Hg a nebo rozvoj plicní hypertenze s plicním arteriálním tlakem > 60 mm Hg.
Katetrizace srdeční
Koronarografie je indikována před operací u mužů nad 40 let, u žen nad 45 let [1,2], dále při anamnéze nebo podezření na ICHS nebo jejím vysokém riziku. U těžší plicní hypertenze, dilatace pravostranných srdečních oddílů, současné trikuspidální regurgitace nebo u diskrepance echokardiografického a klinického obrazu by měla být provedena pravostranná katetrizace. Ventrikulografie a přesná invazivní kvantifikace významnosti vady je na místě při nejednoznačném či svou kvalitou nedostatečném výsledku echokardiografie.
Hemodynamická měření se u MS provádějí zcela výjimečně. Týká se to především tlakových gradientů, které lze změřit snadno echokardiograficky. Plochu mitrálního ústí (MVA) lze zjistit pomocí formule Gorlinových podle vzorce:

HR – srdeční frekvence PG<sub>mean</sub> – střední gradient v mm Hg DFP – diastolická plnící perioda v sekundách CO srdeční výdej v ml/min. Lze ji použít i v zjednodušené podobě [4]:
Přirozený vývoj
U plochy mitrálního ústí přesahující 1,5 cm2 většinou nemocní nemají žádné subjektivní obtíže. Obvykle dochází k zmenšování plochy o 0,3 cm2/rok.
10leté přežití u asymptomatických nemocných přesahuje 80 %, při lehkých symptomech se však snižuje na 45 %, u těžkých se pohybuje v rozmezí 0–15 % [1,2]. U významnější plicní hypertenze se přežití snižuje na méně než 3 roky, fibrilace síní vede k poklesu 10letého přežití na 25 % [19].
Léčba
Konzervativní léčba
Podle některých autorů může terapie betablokátory vést k zpomalení progrese degenerativní MS [24]. Betablokátory lze s výhodou podávat i za účelem žádoucího zpomalení srdeční frekvence, a to nejen při tachykardiích. Zejména nemocní s MS vykonávající fyzickou zátěž se pro zkrácení diastolického plnění mohou nepřiměřeně zadýchávat, dochází u nich k vzestupu plicního kapilárního tlaku. Betablokátory tuto symptomatologii zlepšují, zdá se však, že lepší symptomatický efekt má v těchto případech podávání ivabradinu [25].
Všichni nemocní s fibrilací síní musí být antikoagulováni, antikoagulace se navíc vztahuje i na pacienty s anamnézou embolie nebo přítomnosti nitrosrdečního trombu, spontánního echokontrastu, ale podle některých autorů i na případy s výraznější dilatací (> 50 mm) levé síně [1].
Intervenční léčba
Konzervativní terapie má však vysloveně pomocnou úlohu, definitivní řešení představuje u většiny nemocných intervenční léčba [26]. Převažují kardiochirurgické výkony, k nimž patří především náhrada mitrální chlopně ev. mitrální komisurotomie na otevřeném srdci (tzv. uzavřená mitrální komisutoromie se dnes již provádí pouze v některých rozvojových zemích).
Intervenční léčba se až na výjimky neprovádí u nemocných s lehčími vadami (MVA > 1,5 cm2) a u asymptomatických pacientů. V úvahu přichází u některých pacientů provedení perkutánní mitrální komisurotomie. Ta se indikuje obvykle u nemocných kontraindikovaných ke kardiochirurgickému zákroku pro vysoké riziko. Kontraindikace k perkutánní mitrální komisurotomii jsou uvedeny v tab. 2. Některá novější data ukazují, že časně provedená perkutánní mitrální komisurotomie by mohla být pro asymptomatické pacienty se středně významnou MS z hlediska pozdějších komplikací vady výhodnější než konzervativní a vyčkávací postup [27], tato data však bude třeba dále ověřit.
Table 2. Kontraindikace k perkutánní mitrální komisurotomii. Upraveno podle [1]. ![Kontraindikace k perkutánní mitrální komisurotomii. Upraveno podle [1].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/2da03b7c58776a1cdaf3558fa337fd18.png)
Všeobecně se však jednoznačně preferuje náhrada mitrální chlopně, případně otevřená mitrální komisurotomie. Také zde se indikace soustřeďují na nemocné s klinicky významnějšími vadami (MVA ≤ 1,5 cm2), kteří jsou symptomatičtí. Asymptomatické nemocné lze výjimečně operovat, pokud jsou ve vysokém riziku tromboembolie nebo hemodynamické dekompenzace, spíše by se však v těchto případech zvážila perkutánní mitrální komisurotomie, není-li kontraindikována [1].
prof. MUDr. Pavel Gregor, DrSc.
pavel.gregor@fnkv.cz
III. interní-kardiologická klinika 3. LF UK a FN Královské Vinohrady, Praha
www.lf3.cuni.cz/cs/pracoviste/3interni
Doručeno do redakce: 8. 10. 2013
Sources
1. Vahanian A, Alfieri O, Andreotti F et al. Guidelines on the management of valvular heart disesase (Version 2012). The Joint Task Force on the Management of Valvular Heart Disease of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J 2012; 33(19): 2451–2496.
2. Popelová J, Benešová M, Brtko M et al. Doporučené postupy pro diagnostiku a léčbu chlopenních srdečních vad v dospělosti. Guidelines ČKS. Cor et Vasa 2007; 49(7–8): K195-K234.
3. Guler A, Tavlasoglu M, Kurkluoglu M et al. Giant left atrial myxoma moving inside left atrium mimics mitral valve stenosis. Int J Cardiol 2013; 163(3 - Suppl 1): S113.
4. Demers P, Beaulieu N. Left atrial myxoma in association with life-saving mitral stenosis. J Thorac Cardiovasc Surg 2012; 143(2): e9-e10. Dostupné z DOI: <http://doi: 10.1016/j.jtcvs.2011.10.084>.
5. Kirman M, Erdem K, Mercan H et al. Large mobile hemangioma arising from interatrial septum which mimicks mitral stenosis. Turkish Journal of Thoracic and Cardiovascular Surgery 2013; 21(2): 434–436.
6. Auer J, Berent R, Gurtner F. „Malignant“ mitral stenosis. J Cardiothorac Surg 2012; 7 : 19. doi: Dostupné z DOI: <http://doi: 10.1186/1749–8090–7–19>.
7. Wilbring M, Kappert U, Daubner D et al. Metastasizing primary arterial leiomyosarcoma causing a functional high-grade mitral stenosis. Heart Surg Forum 2012; 15(2): E108-E110. Dostupné z DOI: <http://doi: 10.1532/HSF98.20111147>.
8. Pasca I, Tyagi G, Patel R et al. Malignant natural history of patients with degenerative mitral stenosis: biological predictors of survival in a cohort of 1004 patients. J Am Coll Cardiol 2012; 59(13): E1970. Dostupné z DOI: <http://doi: 10.1016/S0735–1097(12)61971–8>.
9. Singla S, Bansal M, Agarwal A Mitral stenosis in tuberous sclerosis: a case of dystrophic calcification. J Postgrad Med 2012; 58(2): 167–170.
10. Franco E, de Agustin JA, Hernandez-Antolin R et al. Acute mitral stenosis after transcatheter aortic valve implantation. J Am Coll Cardiol 2012; 60(20): e35. Dostupné z DOI: <http://doi: 10.1016/j.jacc.2012.05.061>.
11. Kennedy JLW, Jamie LW, Mery CM et al. Mitral stenosis caused by Amplatzer occluder device used to treat a paravalvular leak. Ann Thorac Surg 2012; 93(6): 2058–2060.
12. Pope NH, Lim S, Ailawadi G. Late calcific mitral stenosis after MitraClip procedure in a dialysis-dependent patient. Ann Thorac Surg 2013 : 95(5): e113-e114. Dostupné z DOI: <http://doi: 10.1016/j.athoracsur.2012.10.067>.
13. Veselka J, Honěk T, Špatenka J et al. Získané chlopenní vady srdce. Medcor Europe: Praha 2000. 85–124. ISBN 80–902678–0–7.
14. Eleid MF, Nishimura RA, Lennon RJ et al. Left ventricular diastolic dysfunction in patiens with mitral stenosis undergoing percutaneous mitral baloon valvotomy. Mayo Clin Proc 2013; 88(4): 337–344.
15. Hurst JW. Memories of patients with a giant left atrium. Circulation 2001; 104(22): 885–892.
16. Tanita A, Hosokawa Y, Tomiyama T et al. Giant left atrium due to mitral stenosis with masive atelectasis: a successful case with perioperative approach Int J Cardiol 2013; 163(2): e23-e25. Dostupné z DOI: <http://doi: 10.1016/j.ijcard.2012.08.037>.
17. Min SY, Song JM, Kim YJ et al. Discrepancy between mitral valve areas measured by two-dimensional transoesophageal echocardiography in patients with mitral stenosis. Heart 2013; 99(4): 253–258.
18. Gianstefani S, Monaghan MJ. Accurate assessment of the true mitral valve area in rheumatic mitral stenosis. Heart 2013; 99(4): 219–221.
19. Bonow RO, Carabello BA, Chatterjee K et al. ACC/AHA 2006 guidelines for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (writing Committee to Revise the 1998 guidelines for the management of patients with valvular heart disease) developed in collaboration with the Society of Cardiovascular Anesthesiologists endorsed by the Society for Cardiovascular Angiography and Interventions and the Society of Thoracic Surgeons. J Am Coll Cardiol 2006; 48(3): e1-e148.
20. Wu WC, Aziz GF, Sadaniantz A. The use of stress echocardiography in the assessment of mitral valvular disease. Echocardiography 2004; 21(5): 451–458.
21. Otto CM. Valvular heart disease. 2nd ed. WB Saunders: Philadelphia 2004. ISBN 9780721697871.
22. Reis G, Motta MS, Barbora MM et al. Dobutamine stress echocardiography for noninvasive assessment and risk stratification of patients with rheumatic mitral stenosis. J Am Coll Cardiol 2004; 43(3): 393–401.
23. Schwammental E, Vered Z, Agranat O. Impact of atriventricular compliance on pulmonary artery pressure in mitral stenosis: an exercises echocardiographic study. Circulation 2000; 102(19): 2378–2384.
24. Tyagi G, Dang P, Patel R et al. Rates and correlates of progression of degenerative mitral stenosis: potential beneficial effect of beta blockers. J Am Coll Cardiol 2012; 59(13): E2033.
25. Parakh N, Chaturvedi V, Burian S et al. Effect of ivabradine vs. Atenolol on heart rate and effort tolerance in patients with mild to moderate mitral stenosis and normal sinus rhythm. Journal of J Card Fail 2012; 18(4): 282–288.
26. Čerbák R. Změna indikačních kriterií k operaci. In Čerbák R (ed.) Nejčastější chlopenní vady: aortální stenóza a mitrální insuficience. Galén: Praha 2007, 105–110. ISBN 978–80–7262–523–9.
27. Kang DH, Lee ChH, Kim DH et al. Early percutaneous mitral commissurotomy vs. Conventional management in asymptomatic moderate mitral stenosis. Eur Heart J 2012; 33(12): 1511–1517.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2014 Issue 4-
All articles in this issue
- Prof. MUDr. Petr Widimský, DrSc., FESC, FACC šedesátiletý
- Vývoj klinického zájmu o plicní hypertenzi v České republice
- 30 let programu transplantace srdce v Institutu klinické a experimentální medicíny v Praze
- Medikamentózní léčba plicní arteriální hypertenze v roce 2014
- Neobvyklá intervence na nativní tepně u pacienta po aortokoronárním bypassu
- Optická koherentní tomografie, oddálená implantace stentu a přímá perkutánní koronární intervence u nemocných s infarktem myokardu a elevací ST segmentu
- Pečeň pri srdcovom zlyhávaní
- Mitrální stenóza
- Léčba srdečního selhání u diabetiků
- Vliv zkušenosti na výsledky katetrové implantace aortální chlopně v léčbě významné aortální stenózy
- Plně vstřebatelný lékový koronární stent: kde jsme v roce 2014?
- Význam stanovení galektinu 3 jako ukazatele myokardiální fibrózy v klinické kardiologii
- Místo chirurgické revaskularizace v léčbě akutního infarktu myokardu
- Operace Ebsteinovy anomálie v dospělém věku – naše zkušenosti
- Predklinické kardiovaskulárne ochorenia a tuhosť aorty
- Acute heart failure and cardiogenic shock – trends at the beginning of 21st century
- Může léčba hypertenze ovlivnit výskyt demence?
- Pravá komora pri ťažkej pľúcnej hypertenzii pri vrodených chybách srdca – odlišná a špecifická
- Srovnání amerických a evropských (českých) doporučení pro diagnostiku a léčbu chronického srdečního selhání
- Význam vulnerabilních aterosklerotických plátů a možnosti jejich detekce pomocí intravaskulární spektroskopie
- Katetrizační renální denervace v léčbě rezistentní hypertenze: realita nebo fikce?
- Praktické otázky léčby novými antitrombotiky
- Kombinační léčba hypertenze
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Pečeň pri srdcovom zlyhávaní
- Pravá komora pri ťažkej pľúcnej hypertenzii pri vrodených chybách srdca – odlišná a špecifická
- Operace Ebsteinovy anomálie v dospělém věku – naše zkušenosti
- Mitrální stenóza
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


