-
Medical journals
- Career
Péče o pacienty s hemofilií a jejich rodiny v ÚHKT
Authors: I. Hrachovinová; P. Salaj
Authors‘ workplace: Ústav hematologie a krevní transfuze Praha, ředitel prof. MUDr. Marek Trněný, CSc.
Published in: Vnitř Lék 2012; 58(Suppl 2): 65-69
Category:
Overview
Počátek péče o pacienty s hemofilií v ÚHKT se datuje do 60. let minulého století. Do dnešní doby byla vytvořena komplexní péče od diagnostické po preventivní a terapeutickou. Diagnostika je soustředěna do NRL pro poruchy hemostázy, disponuje všemi dostupnými metodikami proteinovými i molekulárně genetickými. Terapeutická a preventivní péče je soustředěna do Centra pro trombózu a hemostázu ÚHKT a na klinická oddělení ÚHKT. Ve spolupráci s ortopedickými, chirurgickými a jinými klinikami zajišťujeme specializovanou péči při invazivních výkonech. ÚHKT byl ustanoven jako jeden ze dvou CCC (Comprehensive Care Centres) pro diagnostiku a léčbu dospělých pacientů s hemofilií v České republice. V péči ÚHKT je více než 200 pacientů s hemofilií A/B. Jednu třetinu tvoří pacienti s těžkou formou hemofilie. Součástí preventivní péče je aktivní vyhledávání přenašeček hemofilie a spolupráce s centry lékařské genetiky na prenatální diagnostice hemofilie. V centru je dispenzarizována polovina pacientů České republiky s komplikovanou formou hemofilie – s přítomností inhibitoru F VIII/F IX. Centrum se stará také o pacienty se získanou formou hemofilie A.
Klíčová slova:
hemofilie A/B – faktor VIII/IX – inhibitor F VIII – přenašečka hemofilie – mutace v genu pro F VIII/IX – substituční léčbaÚvod
Hemofilie A je vrozené krvácivé koagulační onemocnění, které postihuje přibližně 1 z 10 000 mužů. Vedle hemofilie A, která je 6krát četnější a je způsobena deficitem F VIII v cirkulující krvi, existuje také hemofilie B, která je způsobena deficitem F IX. Stejná klinická manifestace obou onemocnění je způsobena rolí F VIII a F IX v plazmatické koagulaci. Podle hloubky deficitu klasifikujeme hemofilii na těžkou (< 1 %), středně těžkou (1–5 %) a lehkou (5–40 %) formu. Tíže krvácivých projevů většinou koreluje s hloubkou deficitu faktorů. Nemocní s těžkou formou hemofilie zpravidla krvácejí i několikrát do měsíce, většinou do nosných kloubů a do svalů. Nemocní s lehčími formami nadměrně krvácejí při chirurgických a stomatologických výkonech nebo po menším traumatu. Závažným problémem hemofilie je vznik protilátek inhibujících F VIII (F IX). Vyskytuje se u 5–35 % pacientů s těžkou až středně těžkou formou onemocnění. Častěji se objevuje u hemofilie A, což je dáno výraznějšími riziky vzniku inhibitoru u tohoto onemocnění. Lehká až středně těžká forma hemofilie A může být zaměněna za von Willebrandovu chorobu (a naopak). Diferenciální diagnostika obou onemocnění je založena na rozdílném způsobu dědičnosti a specifickém funkčním testu, který hodnotí vazbu F VIII na von Willebrandův faktor (vWF) jakožto nosičovou bílkovinu F VIII.
Historie
Počátky péče o pacienty s hemofilií v ÚHKT se datují do 60. let minulého století a jsou spjaté s vývojem laboratorních metodik, které stanovovaly aktivitu koagulačních faktorů (prof. Pudlák, 1966). Ke specifikaci onemocnění přispěla další vyšetření, která byla v ÚHKT zavedena, např. jednofázová metoda stanovení F VIII a F IX (RNDr. Sikorová, 1976), stanovení antigenu vWF (RNDr. Sikorová, 1981). Na konci 80. let 20. století byla zavedena molekulární genetika hemofilií (MUDr. Křepelová, 1988). V té době byl také ÚHKT pověřen metodickým vedením krajských center pro léčbu poruch hemostázy, centrální evidencí a centrální distribucí speciálních diagnostických a léčebných přípravků (koncentrátů F VIII, F IX a FEIBA). Kliničtí lékaři ÚHKT se podíleli na 1. uceleném Metodickém listu o komplexní péči o nemocné s hemofilií, který je v planosti od 1. 1. 1990.
Současnost
Péče o hemofiliky
V dnešní době je péče o hemofiliky soustředěna do Centra pro trombózu a hemostázu (CTH), které má laboratorní zázemí v NRL (národní referenční laboratoř) pro poruchy hemostázy.
V CTH je dispenzarizováno celkem 204 žijících hemofiliků. Jejich rozdělení mezi hemofilii A a B, těžkou, středně těžkou a lehkou formu je v tab. 1. Víc než 1/3 pacientů má těžkou formu hemofilie. Za poslední 4 roky přibylo do našeho centra 23 pacientů s hemofilií. Část z nich byla předána po dovršení 18–20 let z Kliniky dětské hemato--onkologie v Praze-Motole. Snahou Centra je, aby pacienti měli celoživotní komplexní péči od stanovení diagnózy přes vyšetření členů rodiny u vrozených chorob po všestrannou léčebnou i preventivní podporu. Jako součást klinického úseku ÚHKT má pro to veškeré předpoklady. ÚHKT byl ustanoven jako jeden ze dvou CCC (Comprehensive Care Centres) pro diagnostiku a léčbu dospělých pacientů s hemofilií v České republice. V Centru je sledována a léčena více než 1/2 pacientů ČR s hemofilií a s inhibitorem F VIII/F IX (8 pacientů). CTH se také stará o pacienty se získanou formou inhibitoru F VIII/F IX, v dispenzarizaci má t.č. 10 pacientů. V průměru diagnostikujeme a na klinickém oddělení léčíme 4 pacienty se získaným inhibitorem F VIII ročně.
Table 1. Počet hemofiliků A a B dispenzarizovaných v CTH ÚHKT. 
Spolupráce
S ortopedickou klinikou Nemocnice Na Bulovce (MUDr. R. Kubeš) spolupracujeme na konziliárním zajištění většiny endoprotetických výkonů kloubů u pacientů s hemofilií z celé ČR. V průměru se realizuje 8–15 TEP (totálních endoprotéz) ročně. Od roku 2006 ÚHKT jako jediný v ČR hematologicky zajišťuje i provádění nejrizikovějších elektivních chirurgických a ortopedických výkonů u pacientů s hemofilií a inhibitorem F VIII/F IX. V roce 2009 byla u jednoho z vysoce rizikových pacientů s inhibitorem F VIII provedena ve spolupráci našeho Centra a ortopedické kliniky Nemocnice Na Bulovce unikátní operace – simultánní endoprotéza obou kolenních kloubů. Ve spolupráci s ortopedickou klinikou 2. LF UK a FN Motol-Praha (MUDr. P. Teyssler) se v posledních letech úspěšně rozvíjí program radionuklidové synovektomie kloubů u pacientů s menším kloubním postižením. Od roku 2008 je v ÚHKT pacientům k dispozici i ambulantní rehabilitační program. Kromě ortopedických zákroků se realizuje ročně několik desítek menších i větších chirurgických zákroků, ke kterým je nutné koagulačně připravit pacienty. Jsou prováděny ve spolupráci s VFN Praha, FN Královské Vinohrady Praha nebo IKEM Praha. Dosud nejsložitějším chirurgickým zákrokem byla celosvětově unikátní exstirpace rozsáhlého pseudotumoru v retroperitoneu u pacienta s inhibitorem F VIII (Salaj, 2009). Vlastní chirurgický výkon byl proveden na pracovišti IKEM Praha profesorem MUDr. R. Gürlichem.
Léčba
Základem léčby hemofiliků je v současné době pouze léčba substituční. Spočívá v podávání chybějících/defektních faktorů k dosažení jejich hemostaticky dostatečné hladiny. Cílem je zástava krvácení či prevence jeho vzniku.
Všichni spolupracující pacienti s těžkou a středně těžkou formou hemofilie a s rizikem krvácení jsou léčeni formou domácí terapie, tj. aplikací chybějícího koagulačního faktoru pacientem bezprostředně po zakrvácení.
Dle způsobu zahájení dělíme substituční terapii na léčbu „on demand“, kdy koncentrát F VIII/F IX je podáván až při objevení se krvácení, a na léčbu profylaktickou, která je doporučeným standardem léčby v dětském věku u všech těžších forem hemofilií. Cílem je držet hladiny faktorů minimálně nad 1 %, ideálně nad 2 %. U dospělých hovoříme někdy o krátkodobé profylaxi, což je přechodná profylaktická aplikace koncentrátů F VIII/F IX vyžádaná klinickým stavem (po operaci, po úrazu, při rehabilitaci).
Koncentráty koagulačního F VIII/F IX
V současné době jsou v ČR k dispozici plazmatické, vysoce čištěné a protivirově ošetřené koncentráty F VIII/F IX i rekombinantní koncentráty F VIII. Obecně se předpokládá, že u F VIII zvýší 1 jednotka (j)/kg hladinu v průměru o asi 2 %, zatímco u F IX 1 j/kg asi o 1 %. Plazmatický poločas F VIII je přibližně 8–12 hod, F IX kolem 18 hod. Tyto údaje sice platí pro většinu pacientů, ale reakce na podaný F VIII či F IX je značně individuální a je vhodné mít u každého hemofilika ověřeno alespoň „recovery“ (dochází-li k přiměřenému procentuálnímu vzestupu plazmatické hladiny F VIII/F IX po aplikaci určitého množství koncentrátu udaného v j/kg), zejména před chirurgickým zákrokem či při změně preparátu.
Diagnostika hemofilie
Diagnostika hemofilie je kombinací klinické praxe a laboratorního vyšetření.
Krvácivé projevy hemofilie jsou často první známkou hemofilie u dětí z rodin se sporadickou formou hemofilie (tab. 2). Průkazem přítomnosti hemofilie je snížená aktivita F VIII spolu s normální funkční i antigenní hladinou vWF, respektive sníženou aktivitou F IX u hemofilie B. Správnou diagnostiku hemofilie A komplikuje pouze podobnost laboratorních výsledků u vW choroby, subtyp Normandy, a lehké formy hemofilie A. Diferenciální diagnostika je možná pouze speciální metodikou, která kvantifikuje vazbu F VIII k vWF. Na základě našich zkušeností byl záchyt vW choroby, se subtypem Normandy, přibližně u 1 % pacientů s domnělou lehkou formou hemofilie A. Velmi zajímavé bylo zjištění, že u téměř 70 % žen, které byly považovány za sporadické přenašečky hemofilie A (měly nízkou aktivitu F VIII a normální antigen vWF), byla prokázána vW choroba, subtyp Normandy.
Table 2. Doba objevení hemofilie podle klinických projevů choroby. 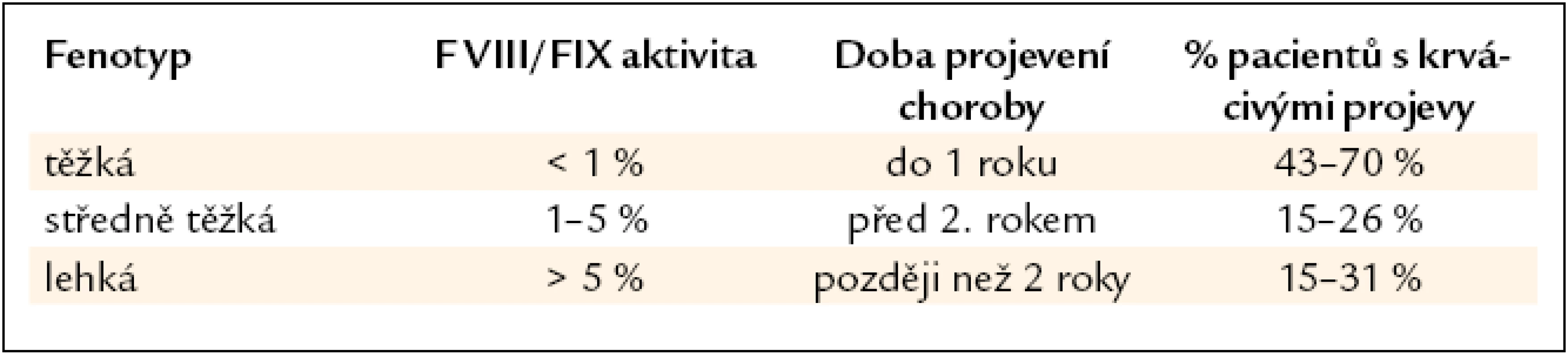
Součástí vyšetření těžké až středně těžké hemofilie je stanovení přítomnosti autoprotilátek proti F VIII nebo F IX. V lékařské veřejnosti se pro tento jev používá výraz „inhibitor“ F VIII/F IX. Průkaz inhibitoru výrazně komplikuje léčbu pacientů. Musí být léčeni přípravky s takzvanou by-passovou aktivitou, jako je rF VIIa, nebo směsí různě aktivovaných faktorů koagulační kaskády (F X, F II, F IX atd.). Sledování léčby těmito přípravky si vyžádalo zavedení nových metodik, jako jsou trombinový generační čas nebo tromboelastografie.
Kompletním průkazem hemofilie je molekulárně genetické nalezení kauzální mutace v genu pro F VIII/F IX. U našich pacientů jsme nalezli kauzální mutaci u 80 % nemocných s hemofilií A a 91 % s hemofilií B. Rozdělení jednotlivých mutací je na obr. 1a, b.
Obr. 1a. Zastoupení kauzálních mutací u hemofilie A v České republice. 
Obr. 1b. Zastoupení kauzálních mutací u hemofilie B v České republice. 
Diagnostika přenašečství hemofilie
Stanovení přenašečství hemofilie u žen v rodinách hemofiliků je důležité pro plánování rodiny, partnerský vztah, prenatální vyšetření a vedení porodu hemofilického dítěte.
Přenašečka hemofilie na rozdíl od hemofilika zpravidla nemá žádné krvácivé příznaky a aktivita F VIII/F IX bývá v normě. Přenašečství lze stanovit z rodokmene. Jistá přenašečka je:
- a) dcera hemofilika,
- b) matka dvou hemofiliků,
- c) matka jednoho hemofilika v rodině s výskytem hemofilie.
Tohoto genetického pravidla lze použít u velmi malého procenta pravděpodobných přenašeček. Rodokmen rodiny je důležitou informací při stanovení přenašečství, protože je jiný postup u sporadické formy hemofilie, kde není možné vyloučit de novo vzniklou mutaci, a u rodinné formy hemofilie, kde je dědičnost prokázána u několika generací. Ke stanovení přenašečství se využívá polymorfních intragenových markerů při nepřímé diagnostice v kombinaci s koagulačním vyšetřením (Sikorová, 1984), nebo přímé diagnostiky tam, kde je již známa kauzální mutace (obr. 2a, b). Nepřímá diagnostika je použitelná pouze u rodin s familiárním výskytem hemofilie a navíc u tzv. „informativních“ rodin, kde je možné u žen odlišit alelu hemofilickou od normální (asi 85 % rodin). Tato metoda je rychlá. Výsledek je znám do týdne až 14 dní, proto se využívá v časovém tlaku (těhotenství). Vyžaduje ale genetický materiál více členů rodiny a zejména genetický materiál hemofilika. Je spojena s 0,01–0,05% rizikem chyby z možné rekombinace genu. Přímá diagnostika je vázaná na průkaz kauzální mutace, její zjištění je technicky a časově náročné. Dovoluje však vyloučit, nebo prokázat přenašečství i u vzdálených příbuzných hemofilika. V rodinách se sporadickým výskytem hemofilie je doporučeno zahájit vyšetření suspektních přenašeček z hemofilických rodin již v 10 letech jejich věku.
Obr. 2a. Stanovení přenašečství – postup vyšetření rodiny s hemofilií A. 
Obr. 2b. Stanovení přenašečství u hemofilie B. 
Prenatální diagnostika
Prenatální vyšetření se provádí u těžké formy hemofilie. Přehled prenatálních vyšetření u hemofilie A v našem Centru je v tab. 3. Standardně se provádí ze vzorku choriové biopsie (CVS) 11.–13. týden gravidity, když pacientka uvažuje o přerušení těhotenství. Je možné provést vyšetření též z amniové tekutiny 15.–16. týden. To je v případě, že se prenatální diagnostika hemofilie provádí jen informativně pro správné vedení porodu a amniocentéza je prováděna ještě z jiné indikace (věk, jiné onemocnění). Rychlou metodou je zjišťována přítomnost chromozomu Y. U plodů mužského pohlaví je stanovována diagnóza hemofilie buď přímým důkazem kauzální mutací, nebo nepřímou diagnostikou polymorfními markery. Většina metod funguje na principu PCR, a proto je výsledek vyšetření do týdne, avšak jen v případě, že přenašečka byla předem vyšetřena a byl připraven postup vyšetření. Prenatální vyšetření je invazivní výkon s rizikem potratu 1–2 % (na expertních pracovištích), proto se nově zavádí vyšetření pohlaví plodu z periferní krve budoucí matky v 10. týdnu těhotenství. Spolehlivost vyšetření dosahuje 99,9 %. Tím se vyloučí zbytečný zákrok u plodů ženského pohlaví. V některých centrech asistované reprodukce se začíná nabízet preimplantační genetická diagnostika (PGD) hemofilie. Je založena na panelu mikrosatelitních markerů pro multiplexní analýzu na jedné buňce. V případě znalosti kauzální mutace je vyšetření doplněno o primer-alelově specifické vyšetření mutace. Vyšetření není dosud dostatečně spolehlivé u velkých delecí nebo inverzí, což vylučuje přibližně 50 % rodin s těžkou hemofilií A.
Table 3. Výsledky prenatálního vyšetření v rodinách s hemofilií A. 
RNDr. Ingrid Hrachovinová, Ph.D.
www.uhkt.cz
e-mail: ingrid.hrachovinova@uhkt.cz
Doručeno do redakce: 31. 5. 2012
Sources
1. Auerswald G, Salek SZ, Benson G et al. Beyond patient benefit: clinical development in hemophilia. Hematology 2012; 17 : 1–8.
2. Habart D, Kalabova D, Hrachovinova I et al. Significant prevalence of the intron 1 factor VIII gene inversion among patients with severe hemophilia A in the Czech Republic. J Thromb Haemost 2003; 1 : 1323–1324.
3. Habart D, Kalabova D, Novotny M et al. Thirty-four novel mutations detected in factor VIII gene by multiplex CSGE: modeling of 13 novel amino acid substitutions. J Thromb Haemost 2003; 1 : 773–781.
4. Habart D, Kleibl Z, Hrachovinová I. Evaluation of DHPLC analysis for mutation detection in haemophilia A. Čas Lék Česk 2006; 145 : 484–487.
5. Hrachovinová I, Vorlová Z. Detection of carriers of hemophilia B. Čas Lék Česk 1992; 131 : 761–763.
6. Hrachovinová I, Vorlová Z. Identification of seven novel factor IX mutations in Czech hemophilia B patients. Blood 1997; 90 : 96.
7. Krepelová A, Vorlová Z, Zavadil J et al. Factor VIII gene deletions in haemophilia A patients in Czechoslovakia. Br J Haematol 1992; 81 : 271–276.
8. Salaj P, Gurlich R, Svorcová V et al. Prophylactic preparation and surgical extirpation of a very large abdominal blood cyst in a severe haemophilia A patient with inhibitors managed by rFVIIa. Haemophilia 2009; 15 : 380–382.
9. Salaj P, Brabec P, Penka M et al. Effect of rFVIIa dose and time to treatment on patients with haemophilia and inhibitors: analysis of HemoRec registry data from the Czech Republic. Haemophilia 2009; 15 : 752–759.
10. Salaj P, Penka M, Smejkal P et al. Economic analysis of recombinant activated factor VII versus plasma-derived activated prothrombin complex concentrate in mild to moderate bleeds: haemophilia registry data from the Czech Republic. Thromb Res 2012; 129: e233–e237.
11. Sikorová J, Zvárová J, Paluska E et al. Processing data for predicting hemophilia transmission. Vnitr Lek 1984; 30 : 764–770.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2012 Issue Suppl 2-
All articles in this issue
- Myelodysplastický syndrom. Pokroky v diagnostice a léčbě během 30 let trvání registru nemocných s myelodysplastickým syndromem v ÚHKT
- Akutní myeloidní leukemie – historický vývoj a současnost léčby ve světě a v ÚHKT
- Akutní lymfoblastová leukemie: historie a současnost
- Chronická myeloidní leukemie – zásadní změna prognózy nemocných po zavedení léčby inhibitory tyrozinových kináz
- Molekulární genetika v diagnostice a léčbě chronické myeloidní leukemie
- Transplantace krvetvorných buněk a její role v léčbě chorob krvetvorby během posledních 25 let
- Prevence a léčba infekčních komplikací v hematoonkologii
- Naléhavé stavy v hematologii
- Péče o pacienty s hemofilií a jejich rodiny v ÚHKT
- Sledování vrozených a získaných, strukturních a funkčních změn fibrinogenu
- Využití „label-free“ proteinových čipů pro proteomiku onkohematologických onemocnění
- Hemaferéza – vysoce účinná technika v terapii nemocných
- Imunohematologie – historie, současný stav poznání a role ÚHKT
- Metabolizmus železa a jeho regulace
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Imunohematologie – historie, současný stav poznání a role ÚHKT
- Naléhavé stavy v hematologii
- Metabolizmus železa a jeho regulace
- Hemaferéza – vysoce účinná technika v terapii nemocných
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

