-
Medical journals
- Career
Dlouhodobé sledování pacientů s diabetes mellitus 1. typu léčených inzulinem glargin
Authors: I. Haladová; S. Lacigová; D. Čechurová; Z. Jankovec; M. Krčma; Z. Rušavý
Authors‘ workplace: Diabetologické centrum I. interní kliniky Lékařské fakulty UK a FN Plzeň, přednosta doc. MU Dr. Martin Matějovič, Ph. D.
Published in: Vnitř Lék 2009; 55(11): 1016-1021
Category: Original Contributions
Overview
Cíl práce:
Zhodnotit dlouhodobý efekt léčby inzulinovým analogem glargin u pacientů s diabetes mellitus 1. typu a sledovat jejich další osud. Soubor nemocných a metodika: Retrospektivní sledování 114 pacientů, u nichž byl od září roku 2004 změněn bazální inzulin z NPH inzulinu na inzulin glargin. U nemocných, kteří ani po roce léčby inzulinem glargin nezlepšili kompenzaci, byla léčba změněna. Původní soubor byl tedy rozdělen na 3 skupiny, jejichž výsledky byly vzájemně porovnávány. Sledovali jsme kompenzaci diabetu (HbA1c) za 1, 2, 3 roky a změny bazální, bolusové denní dávky inzulinu a hmotnosti. Výsledky: Výsledky jsou prezentovány v podobě mediánu a 25. a 75. percentilu. Skupina A – 75 pacientů (65 %) léčených po celé období inzulinem glargin. Počáteční HbA1c byl 7,3 (6,4 – 8,2) %, po roce 6,9 (6 – 8,4) %, po 2 letech 7,1 (5,9 – 7,9) % a po 3 letech 6,6 (5,5 – 7,7) % (p < 0,001). Nedošlo k statisticky významným změnám celkové, bazální a bolusové denní dávky inzulinu ani k nárůstu hmotnosti po sledované období. Skupina B – 19 pacientů (17 %). Převod z inzulinu glargin na detemir v dávkování 2krát denně. Na počátku byl HbA1c 7,3 (6,9 – 8,5) %, po 1 roce na léčbě inzulinem glargin 7,4 (6,8 – 8,7) %, před změnou léčby 7,7 (7,2 – 8,1) % a po 3 letech 7,8 (6,7 – 8,5) % (n.s.). Denní dávka celkového, bazálního a bolusového inzulinu se nezměnila, nedošlo ani k statisticky významné změně hmotnosti. Skupina C – 17 pacientů (15 %). Převod z inzulinu glargin na léčbu inzulinovou pumpou. Tato skupina měla v úvodu lepší kompenzaci s HbA1c 6,7 (5,7 – 8,6) %, po roce 6,2 (5,6 – 8,1) %, před změnou léčby 7 (6 – 7,4) % a po 3 letech 6,3 (5,2 – 7,7) %. Celková denní dávka inzulinu: 48 (34 – 60) – 38 (25 – 49) IU/ den (n.s.). Bazální denní dávka inzulinu: 17,5 (13 – 28) IU/ den – 23 (12 – 32) IU/ den (n.s.). Bolusová denní dávka významně poklesla: z 25,5 (21 – 33) na 15,5 (12 – 22) IU/ den (p < 0,01). Hmotnost: 76 (71 – 97) kg – 73 (72 – 99) kg (n.s.). Jen 3 % pacientů se vrátilo zpět k NPH inzulinu. Závěr: Inzulin glargin vede k zlepšení kompenzace diabetu. Dávka inzulinu glargin se ve srovnání s NPH inzulinem neliší. Nebyl prokázán statisticky významný přírůstek hmotnosti po sledované období.Klíčová slova:
diabetes mellitus 1. typu – kompenzace diabetu – inzulin glarginÚvod
V České republice bylo v roce 2007 dle údajů ÚZIS asi 51 070 pacientů s diabetes mellitus 1. typu. Incidence diabetu trvale stoupá, v současnosti je průměrný nárůst 3,9% za rok [1]. Toto chronické onemocnění ohrožuje nemocného zejména rozvojem pozdních cévních komplikací – mikrovaskulárních a makrovaskulárních. Rozvoj komplikací je dán metabolickými změnami, ale i genetickou dispozicí. Negativní vliv špatné kompenzace diabetu na rozvoj a progresi chronických komplikací byl prokázán v řadě studií [2,3].
V současnosti jedinou možností k oddálení, či resp. zpomalení rozvoje diabetických komplikací je co nejlepší metabolická kompenzace, tedy normoglykemie. Proto se neustále zpřísňují parametry kompenzace diabetu. Dle standardů České diabetologické společnosti jsou cíle léčby hodnoty glykemie nalačno < 6 mmol/l, postprandiálně 5–7,5 mmol/l a HbA1c < 4,5% (dle IFCC) [4]. Zároveň však s těsnou kompenzací diabetu narůstá počet hypoglykemií [5].
Snaha o napodobení fyziologického průběhu sekrece inzulinu a snížení počtu hypoglykemií vedla k vývoji nových inzulinových analog. Inzulin glargin, jako první dlouhodobý analog, dobře napodobuje bazální sekreci. Má stabilní účinek trvající 24 hod, profil účinku je bezvrcholový – podobný křivce jako při léčbě inzulinovou pumpou. Aplikuje se 1krát denně. Ve srovnání s NPH inzulinem má nižší intraindividuální variabilitu inzulinemie, snižuje počet hypoglykemií zejména v nočních hodinách. To vše vede k zlepšení kvality života pacientů [6].
Cílem tohoto sdělení je zhodnotit dlouhodobý efekt inzulinu glargin na kompenzaci diabetu.
Práce hodnotí též změny dávek inzulinu, hmotnosti a důvody k změně léčby.
Soubor nemocných a metodika
Od 1. 9. 2004 do 1. 1. 2008 byli retrospektivně sledováni všichni pacienti s DM 1. typu, u kterých byla během roku 2004 zahájena léčba inzulinem glargin (Lantus) firmy Sanofi-Aventis, Francie, v kombinaci s krátkým analogem aspart (Novorapid) firmy Novo Nordisk, Dánsko.
Sledovali jsme efekt léčby inzulinem glargin na kompenzaci diabetu po dobu tří let, změny celkových, bazálních a bolusových denních dávek inzulinu a hodnotili jsme změny váhy před a po třech letech léčby. Zajímal nás další osud našich pacientů stran léčby diabetu.
Z řady důvodů, nejčastěji z důvodu neuspokojivé kompenzace, došlo během sledovaného období k další změně léčby – 19 pacientů bylo převedeno na inzulin detemir, u 17 pacientů byla zahájena léčba inzulinovou pumpou a 3 pacienti se vrátili k původnímu NPH inzulinu.
Pacienti
Jednalo se o 114 diabetiků (70 žen, 44 mužů), průměrného věku 38 ± 13 let, s průměrnou dobou trvání diabetu 14 ± 10 let. U pacientů byla během roku 2004 zahájena léčba inzulinem glargin. Celkově 65% pacientů zůstalo na této léčbě. U 35% pacientů došlo po roční léčbě inzulinem glargin z různých důvodů k změně léčby, a tedy k rozdělení souboru do skupin podle způsobu léčby. Charakteristika podskupin pacientů je uvedena v tab. 1.
Table 1. Charakteristika souboru. 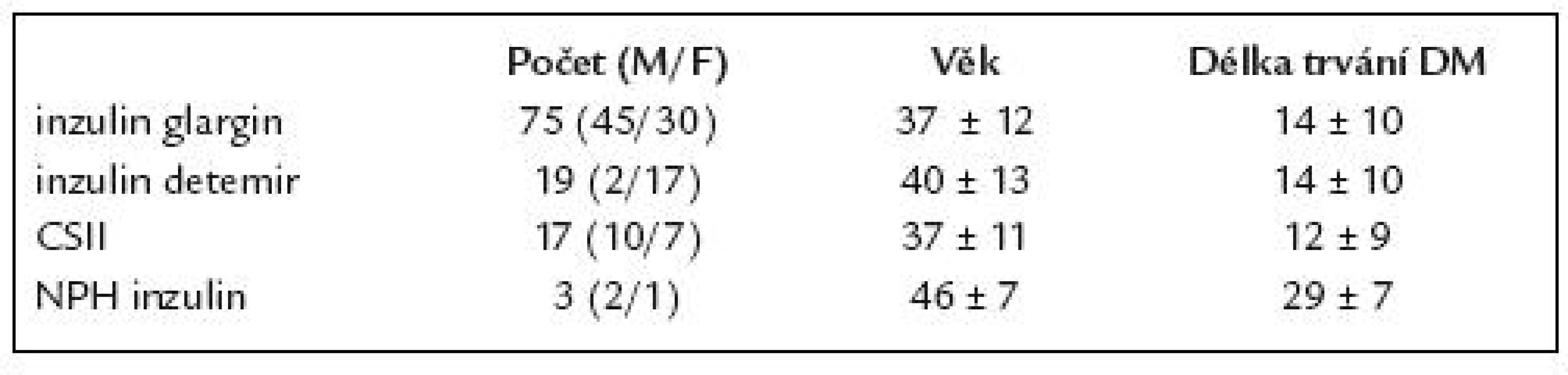
Devatenáct (17%) pacientů jsme převedli na inzulin detemir. Důvodem převodu byla přetrvávající nedostatečná kompenzace diabetu, snaha minimalizovat váhový přírůstek či výhody úprav dávek bazálního inzulinu při podávání 2krát denně.
Sedmnáct (15%) pacientů jsme převedli na léčbu inzulinovou pumpou. Při převedení na inzulinovou pumpu jsme respektovali indikační kritéria [8]. Inzulinová pumpa byla nasazena u jedné pacientky z důvodu prekoncepční přípravy a plánované gravidity, u pěti pacientů z důvodu výrazného fenoménu úsvitu, u pěti pacientů z důvodu mikrovaskulárních komplikací, u dvou pacientů z důvodu těžkých nerozpoznaných hypoglykemií a u čtyř pacientů z důvodu značné lability. Respektovali jsme i přání dobře spolupracujícího pacienta s potřebou flexibility aplikace inzulinu.
Tři (3%) pacienti se navrátili k původní léčbě NPH inzulinem, důvodem byl doplatek za lék.
Sledované parametry
Hlavními sledovanými parametry byla hodnota glykovaného hemoglobinu (HbA1c, IFCC, norma do 4%) před změnou léčby, po 1, 2 a po 3 letech léčby. U skupin, kde došlo po roce léčby inzulinem glargin k další změně léčby, byl hodnocen glykovaný hemoglobin před další změnou a na konci sledovaného období. Byly hodnoceny změny HbA1c proti vstupním hodnotám. Dále byla sledována změna celkové, bazální, bolusové denní dávky inzulinu a změna hmotnosti. Vliv změny inzulinu na výskyt hypoglykemií jsme nehodnotili vzhledem k charakteru retrospektivní studie, který neumožňoval korektní získání dat.
Statistická analýza dat
Vzhledem k tomu, že veličiny nevykazovaly normální rozložení, jsme pro hodnocení výsledků užívaly neparametrické testy. K hodnocení změn HbA1c a změn hmotnosti byl použit Friedmanův test. Změny dávek inzulinu byly testovány párovým Wilcoxonovým testem.
Výsledky
Výsledky jsou uvedeny v tab. 2–4.
Table 2. Přehled HbA<sub>1c</sub> (v % dle IFCC) v defi novaném časovém rozmezí. 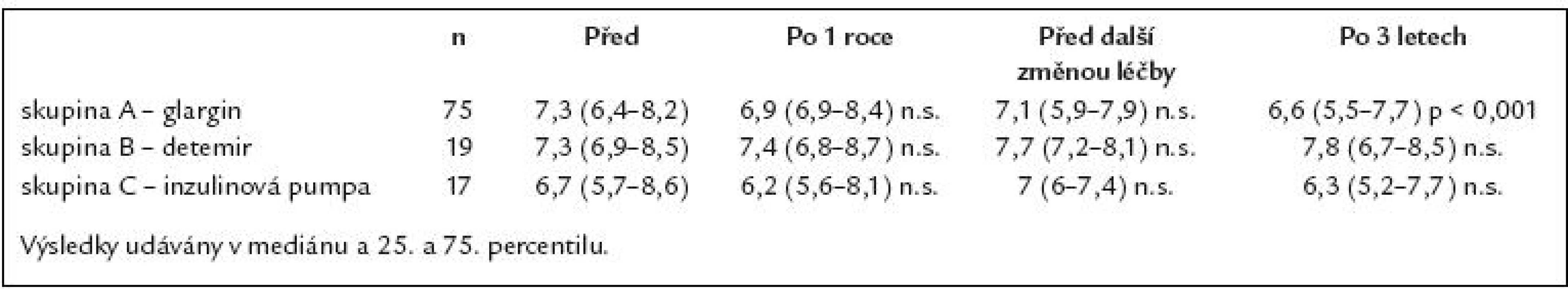
Table 3. Změna denních dávek inzulinu (IU/ 24 hod) na začátku a konci sledovaného období. 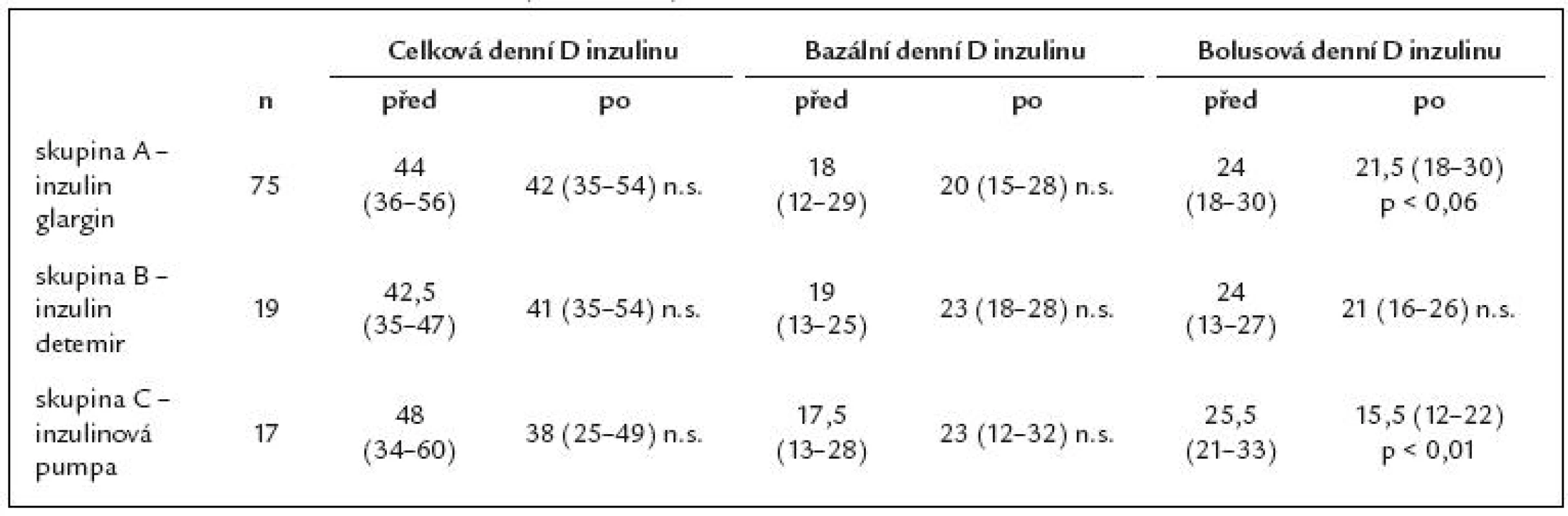
Table 4. Změna hmotnosti (kg) na začátku a konci sledovaného období. 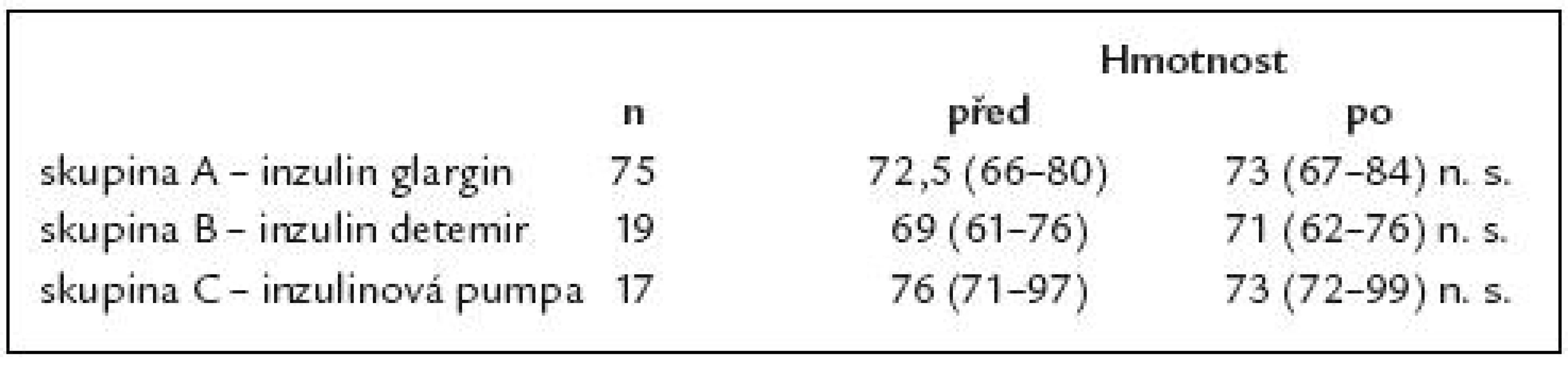
Na grafu 1 je dokumentován vývoj HbA1c u pacientů léčených inzulinem glarginem a graf 2 ukazuje porovnání kompenzace diabetu dle způsobu léčby. Skupina A – glargin (65% pacientů). Skupina B – detemir podávaný 2krát denně (17% pacientů). Tato skupina se statisticky významně lišila od skupiny C v kompenzaci diabetu před změnou léčby na inzulin detemir (p < 0,01) a na konci sledovaného období (p < 0,05). Skupina C – CSII (15% pacientů). Skupina D – návrat k NPH (3% pacientů). Tato skupina vzhledem k malému počtu pacientů nebyla statisticky hodnocena. V celém souboru 114 pacientů DM 1. typu došlo k statisticky významnému zlepšení kompenzace diabetu nezávisle na způsobu léčby s HbA1c 7,3 (6,5–8,2)% na 6,8 (5,6–7,8)% (p < 0,001).
Graph 1. Vývoj HbA<sub>1c</sub> u pacientů léčených inzulinem glargin. 
Graph 2. Kompenzace diabetu dle způsobu léčby. 
Diskuze
V práci jsme si chtěli ověřit, zda výsledky klinických studií platí i v klinické praxi, a zajímal nás osud našich pacientů po 3 letech od změny léčby. V minulosti jsme prokázali významné zlepšení kompenzace diabetu a významný pokles variability glykemií po jednom roce léčby inzulinem glargin [7]. Na význam variability glykemií poukazuje ve své práci Hirsch. Srovnává dvě skupiny pacientů se stejným HbA1c, při léčbě intenzifikovaným nebo konvenčním režimem. Ukazuje na významně vyšší výskyt retinopatie u pacientů na konvenčním režimu. Zvýšený výskyt komplikací vysvětluje právě kolísáním glykemií s indukcí oxidačního stresu, který se spolupodílí na vzniku mikroangiopatie [9].
Nyní nás zajímalo, zda zlepšení kompenzace diabetu přetrvává i po delší dobu léčby.
Mezi nejčastější indikace k zahájení léčby inzulinem glargin patří častý výskyt nočních hypoglykemií, labilita diabetu a neuspokojivá kompenzace. Vzhledem k neuspokojivé kompenzaci našich pacientů na počátku sledovaného období – HbA1c 7,3 (6,5–8,2)% – nás k revizi dosavadní léčby a k její změně vedla převážně neuspokojivá kompenzace. V roce 2007 byla publikována review studií s analogy, tedy i inzulinem glargin, jež u pacientů s DM 1. typu neprokázala žádný nebo jen mírný efekt na HbA1c, který je ale provázen signifikantním snížením hypoglykemií, zejména v nočních hodinách [10]. V naší práci jsme v souladu s některými dříve publikovanými studiemi [11–18] prokázali efekt inzulinu glargin na statisticky významném zlepšení kompenzace diabetu ve srovnání s NPH inzulinem.
75 pacientů (65% z celkového počtu) bylo spokojeno s léčbou inzulinem glargin.
U těchto pacientů docházelo v čase ke zlepšování kompenzace diabetu, s přechodným mírným zhoršením ve 2. roce sledování. V této skupině došlo k statisticky významnému poklesu HbA1c, který byl větší než v publikovaných studiích. To si vysvětlujeme zejména horší vstupní kompenzací našich pacientů a vyřazením 19 pacientů, u kterých došlo z důvodu nedostatečné kompenzace ke změně léčby z inzulinu glargin na inzulin detemir. Pokles HbA1c o 0,7% se nedá vysvětlit navýšením dávek inzulinu ani edukací. Je možné, že na vyšším poklesu glykovaného hemoglobinu se podílí i vysoký vstupní glykovaný hemoglobin. Je známo, že největší pokles glykovaného hemoglobinu vykazují pacienti s úvodní vyšší hodnotou HbA1c [19]. Na zlepšení kompenzace se mohl podílet také zvýšený selfmonitoring pacientů v posledních 3 letech při možnosti zvýšené úhrady proužků do glukometru z dřívějších 400ks na 1 000ks za rok po schválení revizním lékařem.
Zlepšení dlouhodobé kompenzace po zvýšení četnosti selfmonitoringu glykemií u pacientů s diabetes mellitus 1. typu prokázala multicentrická analýza z Německa a Rakouska, která vycházela z databáze počítačové dokumentace. Analyzovala výsledky 19 491 pacientů s diabetes mellitus 1. typu. V průměru se tito pacienti měřili 4,4krát denně. Po korekci na věk, pohlaví, délku trvání diabetu a typu inzulinového režimu při přidání dalšího měření došlo ke snížení HbA1c o 0,32% [20].
Podobné výsledky na HbA1c prokázala též retrospektivní studie německých autorů [21], která sledovala efekt léčby inzulinem glargin v klinické praxi po delší dobu (po 9 a 30 měsících). Ta prokázala zlepšení kompenzace diabetu, které přetrvávalo i po dobu 30 měsíců. Na tomto zlepšení se ale dle autorů mohl také podílet edukační program před změnou léčby. Podobně výrazné zlepšení kompenzace diabetu jako v naší studii bylo zaznamenáno i v práci Perušičové, která hodnotila výsledky léčby inzulinem glargin v 6 dia-betologických ambulancích v ČR. Bylo sledováno celkem 327 pacientů, u kterých byla změněna léčba z NPH inzulinu na inzulin glargin a průměrné snížení glykovaného hemoglobinu po třech měsících bylo 0,95% (ze 7,34 ± 1,17 na 6,39 ± 1,14) [22]. Retrospektivní sledování nám bohužel neumožnilo sledovat výskyt hypoglykemií, kde pokles nočních hypoglykemií je u inzulinu glargin prokázán v řadě studií [23–25] a vede ke zlepšení kvality života pacientů. Pokles nočních hypoglykemií je dán bezvrcholovou, stabilní křivkou inzulinu glarginu během celých 24 hod, která je podobná jako při kontinuálním podávání inzulinu. To bylo potvrzeno ve studii, která srovnávala farmakokinetické a farmakodynamické vlastnosti inzulinu glargin s NPH inzulinem a s kontinuálním subkutánním podáváním inzulinu u DM 1. typu během izoglykemického 24hodinového clampu. Intraindividuální variabilita a inzulinemie byla významně nižší ve srovnání s NPH inzulinem a byla podobná CSII [26].
Naopak výhodou observační studie obecně je, že jde o reálné pacienty, a tudíž nedochází ke zkreslení výsledků vstupními kritériemi či parametry studie ovlivňující lékaře i pacienty (výběr pacientů, compliance pacientů, časová limitace studie, intenzivnější péče).
Skupinu B tvořilo 19 pacientů, kteří byli vstupně stejně kompenzováni jako skupina A, tito pacienti neprofitovali ze změny léčby, a proto po přechodné léčbě inzulinem glargin byli převedeni na inzulin detemir podávaný 2krát denně, s trendem k dalšímu zhoršení kompenzace, který však nebyl statisticky významný. V této skupině bylo větší zastoupení žen – 17, jen 2 muži, délka trvání diabetu a věk pacientů byl srovnatelný s ostatními podskupinami. Jednou z možných příčin selhání inzulinu detemir by mohla být i skutečnost, že bazální denní dávka inzulinu detemir na konci sledovaného období významně nelišila od inzulinu glargin.
Z analýz několika v poslední době uveřejněných studií vyplývá potřeba vyšší dávky inzulinu detemir než inzulinu glargin k dosažení stejného efektu [27,28].
Skupinu C tvořilo 17 pacientů, tato skupina měla na počátku sledování lepší kompenzaci než ostatní skupiny. Ačkoliv se v literatuře někdy udává podobný efekt dlouhodobých analog ve srovnání s CSII na HbA1c – pokles o 0,4 [12] až 0,5% [29], u těchto pacientů došlo i přes léčbu inzulinem glargin k mírnému zhoršení kompenzace, a proto byli převedeni na léčbu inzulinovou pumpou s dobrým efektem na kompenzaci. Došlo k zlepšení glykovaného hemoglobinu o 0,7%.
Metaanalýza studií, která srovnávala léčbu inzulinovou pumpou s intenzifikovaným inzulinovým režimem u dia-betiků 1. typu, prokázala při léčbě inzulinovou pumpou pokles glykovaného hemoglobinu o 0,4%, bez vyššího rizika hypoglykemií, pokles celkové denní dávky inzulinu, který byl signifikantně nižší u adolescentů [30].
Z výsledků dlouhodobého registru inzulinových pump u diabetiků 1. typu v ČR však léčba pumpou vede k mnohem významnější redukci HbA1c (1%) [31,32]. Léčba inzulinovou pumpou však oproti intenzifikované léčbě inzulinem vede ke zlepšení kvality života, která je dána větší flexibilitou, menším strachem z hypoglykemií a lepším léčebným efektem [33].
V naší studii nebyl prokázán statisticky významný rozdíl v hmotnosti v závislosti na způsobu léčby.
Během 3letého sledování došlo v celém souboru k nárůstu hmotnosti o 1kg. Na tomto nárůstu se podíleli pacienti léčení inzulinem glargin, ale i inzulinem detemir. Překvapil nás nárůst hmotnosti u malé skupiny pacientů léčených detemirem, vzhledem k prokázanému efektu nižších přírůstků hmotnosti v řadě studií ve srovnání s NPH inzulinem [34,35]. Naopak nás překvapil statisticky nevýznamný pokles hmotnosti o 3kg u pacientů léčených inzulinovou pumpou, na kterém se mohla podílet i snížení celkové denní dávky inzulinu.
Závěr
Při léčbě inzulinovým analogem glargin jsme prokázali zlepšení kompenzace, které přetrvávalo i po 3 letech léčby. 65% pacientů profitovalo z této léčby, u 35% pacientů došlo během sledovaného období ke změně léčby.
Práce je podporována VZ Univerzity Karlovy MSM 21620814.
MUDr. Jana Haladová
www.fnplzen.cz
e mail: haladova@fnplzen.cz
Sources
1. Green A, Patterson CC. EURODIAB TIGER Study Group. Europe and Diabetes. Trends in the incidence of childhood – onset diabetes in Europe 1989 – 1998. Diabetologia 2001; 44: (Suppl 3): B3 – B8.
2. The Diabetes Control and Complication Trial (DCCT) Research Group. The effect of intensive treatment on the development and progression of long ‑ term comlications in insulin ‑ dependent diabetes mellitus. N Engl J Med 1993; 329 : 977 – 986.
3. Brinchmann ‑ Hansen O, Dahl - Jorgensen K, Sandvik L et al. Blood glucose concentrations and progression of diabetic retinopathy: the seven year results of the Oslo study. BMJ 1992; 304 : 19 – 22.
4. ČDS. Standardy péče o diabetes mellitus 1. typu. DMEV 2007; 10 : 185 – 188.
5. The Diabetes Control and Complication Trial Research Group (1993). The effects of intensive treatment of diabetes on the development and progression of long ‑ term complications in insulin‑dependent diabetes mellitus. N Engl J Med 2006; 329 : 977 – 986.
6. Ashwell SG, Bradley C, Stephens JW et al. Treatment satisfaction and quality of life with insulin glargine plus insulin lispro compared with NPH insulin plus unmodified human insulin in individuals with type 1 diabetes. Diabetes Care 2008; 31 : 1112 – 1117.
7. Haladová I, Lacigová S, Jankovec Z et al. Klinické zkušenosti s léčbou dlouhodobým inzulinovým analogem glargin v diabetologickém centru. Vnitř Lék 2007; 53 : 632 – 636.
8. Brož J, Kožnarová R, Bartášková D et al. Současné možnosti léčby diabetes mellitus pomocí inzulinových pump. DMEV 2006; 9 : 179 – 186.
9. Hirsch IB, Brownlee M. Should minimal blood glucose variability become the gold standard of glycemic control? J Diabetes Complications 2005; 19 : 178 – 181.
10. Gough S A. review of human and analogue insulin trials. Diabetes Res Clin Pract 2007; 77 : 1 – 15.
11. Porcellati F, Rossetti P, Pampanelli S et al. Better long‑term glycaemic control with the basal insulin glargine as compared with NPH in patients with Type 1 diabetes mellitus given meal - time lispro insulin. Diabet Med 2004; 21 : 1213 – 1220.
12. Gallen I, Carter C. Prospective audit of the introduction of insulin glargine (Lantus) into clinical practice in type 1 diabetes. Pract Diab Int 2004; 21 : 110 – 114.
13. Kudva YC, Basu A, Jenkins GD al. Randomized controlled clinical trial of glargin versus ultralente insulin in the fragment of type 1 diabetes. Diabetes Care 2005; 28 : 10 – 14.
14. Hirsch IB. Insulin analogues. N Engl J Med 2005; 352 : 174 – 183.
15. Rosenstock J, Park G, Zimmerman J et al. Basal insulin glargine (HOE 901) versus NPH insulin in patients with type 1 diabetes on multiple daily insulin regimens. Diabetes Care 2000; 23 : 1137 – 1142.
16. Alemzadeh R, Berhe T, Wyatt DT. Flexible insulin therapy with glargine insulin improved glycemic control and reduced severe hypoglycemia among preschool - aged children with type 1 diabetes mellitus. Pediatrics 2005; 115 : 1320 – 1324.
17. Murphy NP, Keane SM, Ong KK et al. Randomized cross - over trial of insulin glargine plus lispro or NPH insulin plus regular human insulin in adolescents with type 1 diabetes on intensive insulin regimens. Diabetes Care 2003; 26 : 799 – 804.
18. Ruhnau KJ, Schneider K, Schweitzer MA. Introduction of insulin glargin to basal - bolus therapy improves metabolic control in patients with type 1 diabetes in every day clinical practice. Diabetologia 2005; 48 (Suppl 1): A303.
19. Chase HP, Arslanian S, White NH et al. Insulin glargine versus intermediate ‑ acting insulin as the basal component of multiple daily injection regimens for adolescents with type 1 diabetes mellitus. J Pediatr 2008; 153 : 547 – 553.
20. Schütt M, Kern W, Krause U et al. Is the freguency of self-monitoring of blood glucose related to long‑term metabolic control? Multicenter analysis including 24,500 patients from 191 centers in Germany and Austria. Exp Clin Endocrinol Diabetes 2006; 114 : 384 – 388.
21. Schreiber SA, Russmann A. Long‑term efficacy of insulin glargine therapy with an educational programme in type 1 diabetes patients in clinical practice. Curr Med Res Opin 2007; 23 : 3131 – 3136.
22. Perušičová J. Statistické zpracování průběhu a výsledků léčby inzulinem glargine v ordinaci šesti českých diabetologů. Medicína po promoci 2004; 10 – 12.
23. Chase HP, Dixon B, Pearson J et al. Reduced hypoglycaemic episodes and improved glycaemic control in children with type 1 diabetes using insulin glargine and neutral protamine Hagedorn insulin. J Pediatr 2003; 143 : 737 – 740.
24. Owens DR, Griffiths S. Insulin glargine (Lantus). Int J Clin Pract 2002; 56 : 460 – 466.
25. Hamann A, Matthaei S, Rosak C et al. A randomized clinical trial comparing breakfast, dinner, or bedtime administration of insulin glargine in patients with type 1 diabetes. Diabetes Care 2003; 6 : 1738 – 1744.
26. Lepore M, Pampanelli S, Fanelli C et al. Pharmacokinetics and pharmacodynamics of subcutaneous injection of long‑acting human insulin analog glargine, NPH insulin and ultralente human insulin and continuous subcutaneous infusion of insulin lispro. Diabetes 2000; 49 : 2142 – 2148.
27. Pieber TR, Treichel HC, Hompesch B et al. Comparison of insulin detemir and insulin glargine in subjects with Type 1 diabetes using intensive insulin therapy. Diabet Med 2007; 24 : 635 – 642.
28. Kabadi UM. Deleterious outcomes after abrupt transition from insulin glargine to insulin detemir in patients with type 1 diabetes mellitus. Clin Drug Investig 2008; 28 : 697 – 701.
29. Pickup J, Mattock M, Kerry S. Glycaemic control with continuous subcutaneous insulin infusion compared with intensive insulin injections in patients with type 1 diabetes: meta‑analysis of randomised controlled trials. Br Med J 2002; 324 : 705.
30. Jeitler K, Horvath K, Berghold A et al. Continuous subcutaneous insulin infusion versus multiple daily insulin injections in patients with diabetes mellitus: systematic review and meta‑analysis. Diabetologia 2008; 51 : 941 – 951.
31. Jankovec Z, Krcma M, Lacigova S et al. National Registry of Patients Treated with Continuous Subcutaneous Insulin Infusion (CSII) in the Czech Republic: Long‑term results. Infusystem International 2005; 4 : 21 – 24.
32. Jankovec Z, Čechurová D, Krčma M et al. Dlouhodobý efekt léčby inzulínovou pumpou (CSII) – výsledky Registru pacientů léčených CSII v České republice. DMEV 2006; 9 (Suppl 2): 26.
33. Nicolucci A, Maione A, Franciosi M et al. EQuality1 Study Group - Evaluation of QUALITY of Life and Costs in Diabetes Type 1. Quality of life and treatment satisfaction in adults with Type 1 diabetes: a comparison between continuous subcutaneous insulin infusion and multiple daily injections. Diabet Med 2008; 25 : 213 – 220.
34. De Leeuw I, Vague P, Selam JL et al. Insulin detemir used in basal - bolus therapy in people with type 1 diabetes is associated with a lower risk of nocturnal hypoglycaemia and less weight gain over 12 months in comparison to NPH insulin. Diabetes Obes Metab 2005; 7 : 73 – 82.
35. Bartley PC, Bogoev M, Larsen J et al. Long‑term efficacy and safety of insulin detemir compared to Neutral Protamine Hagedorn insulin in patients with Type 1 diabetes using a treat - to - target basal-bolus regimen with insulin aspart at meals: a 2‑year, randomized, controlled trial. Diabetic Med 2008; 25 : 442 – 449.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2009 Issue 11-
All articles in this issue
- Dlouhodobé sledování pacientů s diabetes mellitus 1. typu léčených inzulinem glargin
- Idiopatické střevní záněty – familiární a sporadická forma
- Sociální, ekonomické a psychické vlivy jako rizikové faktory kardiovaskulárních chorob
- Porovnání struktury a funkce nazální a bronchiální sliznice u nemocných s CHOPN (pilotní projekt ciliární studie)
- Endoskopická diagnostika a léčba pankreatobiliárních onemocnění u pacientů po resekci žaludku podle Billrotha II
- Neuroendokrinní tumory appendixu
- Karcinoid appendixu s pohárkovými buňkami
- Současné ochlazovací metody pro indukci mírné hypotermie po srdeční zástavě
- Môže tromboelastografia ovplyvniť manažment pacientov v kardiológii a kardiochirurgii?
- High‑sensitivity metody stanovení srdečních troponinů 2009: klinický potenciál, současná praxe a přínos, perspektiva
- Výsledky studie RE- LY slibují účinnější, bezpečnější a jednodušší prevenci embolických komplikací u nemocných s nevalvulární fibrilací síní
- Vymizení nefrotického syndromu a zlepšení funkce ledvin u nemocné s light chain deposition disease po vysokodávkované chemoterapii s autologní transplantací kmenových krvetvorných buněk. Popis případu a přehled literatury
- Rekurentní nesetrvalá komorová tachykardie v těhotenství
- Opakovaná lokální trombolýza u poranění a trombózy axilární a podklíčkové žíly
- Výsledky léčby nemocných s esenciální trombocytemií a dalšími myeloproliferacemi provázenými trombocytemií – zpráva z registru pacientů léčených Thromboreductinem®
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Neuroendokrinní tumory appendixu
- Rekurentní nesetrvalá komorová tachykardie v těhotenství
- Endoskopická diagnostika a léčba pankreatobiliárních onemocnění u pacientů po resekci žaludku podle Billrotha II
- Opakovaná lokální trombolýza u poranění a trombózy axilární a podklíčkové žíly
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

