-
Medical journals
- Career
Tyreoidální autoimunita u dospělých diabetiků 1. typu. Vlastní zkušenosti z 11letého sledování
Authors: K. Vondra; J. Vrbíková; I. Šterzl
Authors‘ workplace: Endokrinologický ústav, Praha, ředitel doc. MUDr. Vojtěch Hainer, CSc.
Published in: Vnitř Lék 2006; 52(10): 864-872
Category: Original Contributions
Overview
Prezentovány výsledky o prevalenci tyreoidální autoimunity a jejím klinickém významu získané při 11letém sledování 47 dospělých diabetiků (DM) 1. typu. Studie ukázala, že jsou postiženy především ženy, protilátky proti štítné žláze (T-Ab) byly u nich zjištěny statisticky častěji ve srovnání s muži (68 % vs 32 %, p < 0,05). Ženy byly častěji (45 % vs 12 % muži, p < 0,01) postiženy závažnějšími formami tyreoidální autoimunity projevujícími se perzistencí obou sledovaných T-Ab, rychlejším vývojem subklinické hypotyreózy (TSH > 4,5 mIU/l ve 100 % do 4 let po prvém záchytu T-Ab, resp. do 8. roku od diagnózy DM) i difuzního hypoechogenního obrazu při ultrazvukovém (USG) vyšetření. U těchto pacientů byla rovněž častěji zjišťována malá žláza (u 77 % nemocných v 11. roce volum < 25 percentil kontrol) a výskyt tyreopatie u příbuzných 1. stupně. Izolovaně perzistující protilátky proti tyreoidální peroxidáze byly prokazovány u žen a mužů bez větších rozdílů (ženy 23 %, muži 20 %), klinický průběh u těchto nemocných byl mírnější (prvý záchyt TSH > 4,5 mIU/l až v 9. roce). Typickým nálezem u těchto pacientů byl pestrý USG obraz fokálně/difuzně hypoecho/nehomogenní štítné žlázy, v 11. roce u 50 % s volumem > 95 percentil kontrol. Skupinu bez prokázané tyreoidální autoimunity tvořili převážně muži (68 % vs 32 % ženy, p < 0,01), i zde USG obraz štítné žlázy v 11. roce byl ve vysokém procentu patologický (volum > 95 % percentil kontrol více než u 60 %, tendence k nodulizaci). S výjimkou 1 nemocného nebyla hladina TSH > 4,5 mIU/l zachycena u žádného nemocného. Uvedené výsledky, získané u české populace, jsou podkladem pro naše doporučení vyšetřovat u diabetiků 1. typu pravidelně markery tyreoidální autoimunity. Nejcitlivější dle našich i literárních zkušeností je USG vyšetření, při kterém lze prokázat projevy imunopatie u vysokého počtu nemocných ještě před záchytem pozitivních T-Ab. Z praktického hlediska lze ale doporučit stanovení TSH alespoň 1krát ročně, u diabetiček ve fertilním období i protilátky proti tyreoidální peroxidáze. Při pozitivitě těchto laboratorních ukazatelů by mělo být provedeno USG vyšetření.
Klíčová slova:
diabetes mellitus 1. typu - tyreoidální autoimunita - protilátky proti štítné žláze - autoimunitní zánět štítné žlázy - funkce štítné žlázy - sonografie štítné žlázyÚvod
Asociace diabetu 1. typu a tyreoidální autoimunity je velmi častá [12,15,22], nicméně přesná data zejména u nemocných s manifestací diabetu po 18. roce věku se objevují v literatuře jenom sporadicky. Téměř všechny publikované údaje pocházejí z průřezových studií v souborech s různě dlouhým trváním diabetu i různou dobou vzniku diabetu. Jen málo autorů se zabývá klinickými důsledky společného autoimunitního postižení Langerhansových ostrůvků a štítné žlázy, to je stavem a funkcí štítné žlázy a vlivem eventuálně přítomné tyreopatie na průběh diabetu u těchto pacientů [23,24]. Prvé vlastní zkušenosti s výskytem protilátek proti štítné žláze a jejich možným klinickým významem u dospělých diabetiků jsme uvedli dříve [2,9,21], v tomto sdělení předkládáme výsledky, které jsme získali při prospektivním sledování dospělých diabetiků 1. typu v průběhu 11 let od stanovení diagnózy diabetu (DM).
Soubor nemocných, metody
Sledovaný soubor tvoří 47 diabetiků 1. typu, u kterých se diabetes manifestoval mezi 18.-35. rokem věku a kteří od stanovení diagnózy DM 1 zůstali v pravidelném sledování v Endokrinologickém ústavu Praha. Základní charakteristiky nemocných v době diagnózy DM 1 jsou uvedeny v tab. 1. Všichni nemocní jsou z Prahy.
Table 1. Základní charakteristiky souboru v době diagnózy DM – uveden průměr (SD). 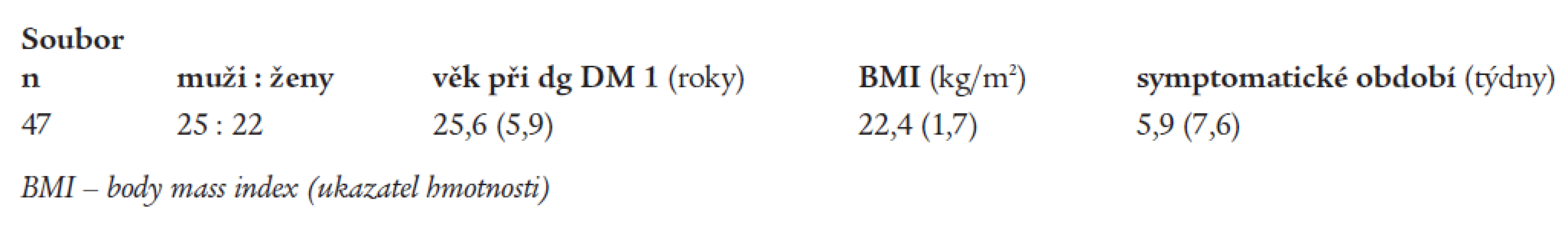
1. Tyreoidální autoimunita byla detekována a dále sledována:
- a) pomocí specifických protilátek proti tyreodální (mikrozomální) peroxidáze (antiTPO) ELISA AUTOSTAT II, fa Cogent Diagnostics Ltd.,UK, a proti tyreoglobulinu (antiTgl), ELISA AUTOSTAT II, fa Cogent Diagnostics Ltd.,UK. Metody použité při stanovení tyreoidálních protilátek (T-Ab) byly podrobně popsány dříve [23,24].
- b) sonografickým vyšetřením štítné žlázy 7,5 MHz sondou.
- c) v nutných případech byla provedena i aspirační biopsie (FNAB, Fine Needle Aspiration Biopsy).
T-Ab byly stanovovány minimálně 2krát ročně. Sonografické vyšetření bylo prováděno v průběhu sledování dle klinické potřeby, v tomto sdělení jsou prezentovány nálezy z období prvého záchytu T-Ab a z 11. roku od stanovení diagnózy DM 1. Z důvodu standardizace metody byla vyšetření prováděna pouze dvěma pracovníky, a hodnocení jedním zkušeným sonografistou. FNAB byla provedena u 3 nemocných z diferenciálně diagnostických důvodů při hodnocení biologické povahy solitárních uzlů.
2. Volumometrické vyšetření štítné žlázy v jednotlivých skupinách bylo provedeno v době prvého záchytu T-Ab a v 11. roce sledování. Výsledky jsme porovnávali s hodnotami zdravých mužů a žen stejné věkové skupiny z Prahy [24]. Volum přesahující 95. percentil kontrolních hodnot (muži 28 ml, ženy 20,5 ml) jsme hodnotili jako strumu. Naopak volum menší než hodnota 25. percentilu kontrolního souboru (muži 12,5 ml, ženy 10,2 ml) jsme hodnotili jako tendenci k atrofii žlázy.
3. Funkce štítné žlázy byla hodnocena podle hladin tyreoidálních hormonů a tyreotropního hormonu hypofýzy (TSH).
V předložené studii uvádíme pouze hodnoty TSH. TSH byl stanovován pravidelně 2krát ročně (imunoluminiscenční analýza v sendvičovém uspořádání s použitím křenové peroxidázy byla prováděná na mikrotitračních destičkách, systém LIANA, fa IMMUNOTECH Beckman-Coulter Company, Česká republika, normální hodnoty 0,17-4,05 mIU/l).
4. Jodurie byla hodnocena ze vzorků ranní moči kolorimetrickou metodou podle Sandell-Kolthoff [14].
5. Pro hodnocení klinického významu zjištěných tyreoidálních protilátek na stav a funkci štítné žlázy jsme soubor rozdělili do tří skupin:
- skupina I: s opakovanou pozitivitou obou sledovaných protilátek (antiTPO, antiTgl),
- skupina II: s opakovanou pozitivitou pouze antiTPO, vyšetření antiTgl bylo negativní,
- skupina III: do této skupiny byli zařazeni nemocní, u kterých T-Ab byly zachyceny jen tranzitorně v klinicky nevýznamných titrech anebo nebyly zachyceny vůbec.
6. Statistické hodnocení bylo provedeno pomocí χ2, Fisherova přesného testu ve 4polních tabulkách, Kruskall-Wallisova testu (ANOVA) a Mann-Whitneyova testu pro kvantitativní údaje. Výpočet kumulativních křivek záchytu subklinické hypotyreózy (metoda Kaplan-Meier) a Mantel-Coxův test byl použit pro srovnání těchto křivek mezi skupinami. Statistické hodnocení zpracovala dr. J. Skibová ze Statistického oddělení IKEM, Praha.
Výsledky
Výskyt protilátek proti štítné žláze (T-Ab) v době manifestace DM a v průběhu 11letého sledování: vztahy k pohlaví a rodinné anamnéze
Tab. 2 uvádí prevalenci antiTgl a antiTPO v sledovaném souboru v době stanovení diagnózy DM 1 a její změnu v průběhu 11letého sledování. Je zřejmé, že během 11letého trvání diabetu došlo k výraznému zvýšení počtu nemocných, u kterých byly T-Ab zachyceny. Počet žen s prokázanými T-Ab byl ve srovnání s muži vyšší již v době diagnózy DM a tento trend se prosazoval po celou dobu dalšího sledování. U obou pohlaví se častěji vyskytovaly antiTPO. AntiTgl se vyskytovaly v průběhu sledování samostatně nejdéle 75 týdnů, v dalším průběhu pouze společně s antiTPO.
Table 2. Prevalence protilátek proti štítné žláze v % při manifestaci DM a v průběhu 11letého sledování. 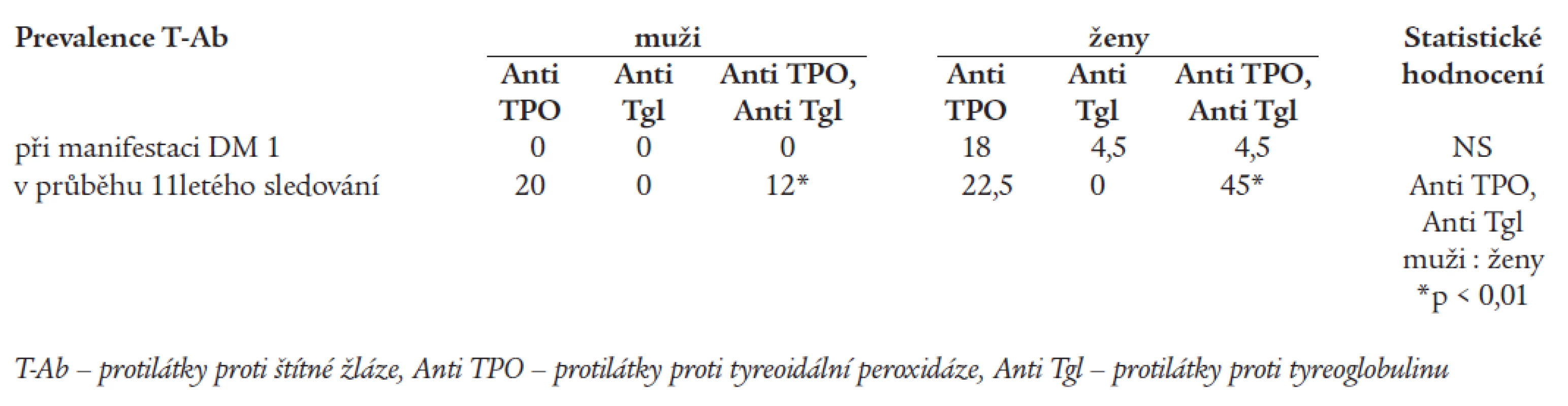
Obr. 1 zobrazuje incidenci nových záchytů antiTPO a antiTgl v jednotlivých letech sledování. Počet nemocných s nově zachycenými antiTPO se každoročně zvyšoval v průměru o 2-13 % až na kumulativní hodnotu 49 % v 9. roce sledování, v 10. a 11. roce jsme nový záchyt nezaznamenali. Nové záchyty antiTgl jsme zjišťovali zejména v prvých 4 letech od stanovení diagnózy DM 1 (85 % záchytů, v průměru 4-9 %/rok), poslední nemocný s pozitivitou antiTgl byl zachycen v 8. roce. V tuto dobu kumulativní incidence antiTgl dosáhla 28 % a dále se již neměnila.
Image 1. Kumulativní incidence nových záchytů T-Ab (v %) v jednotlivých létech po manifestaci diabetu. 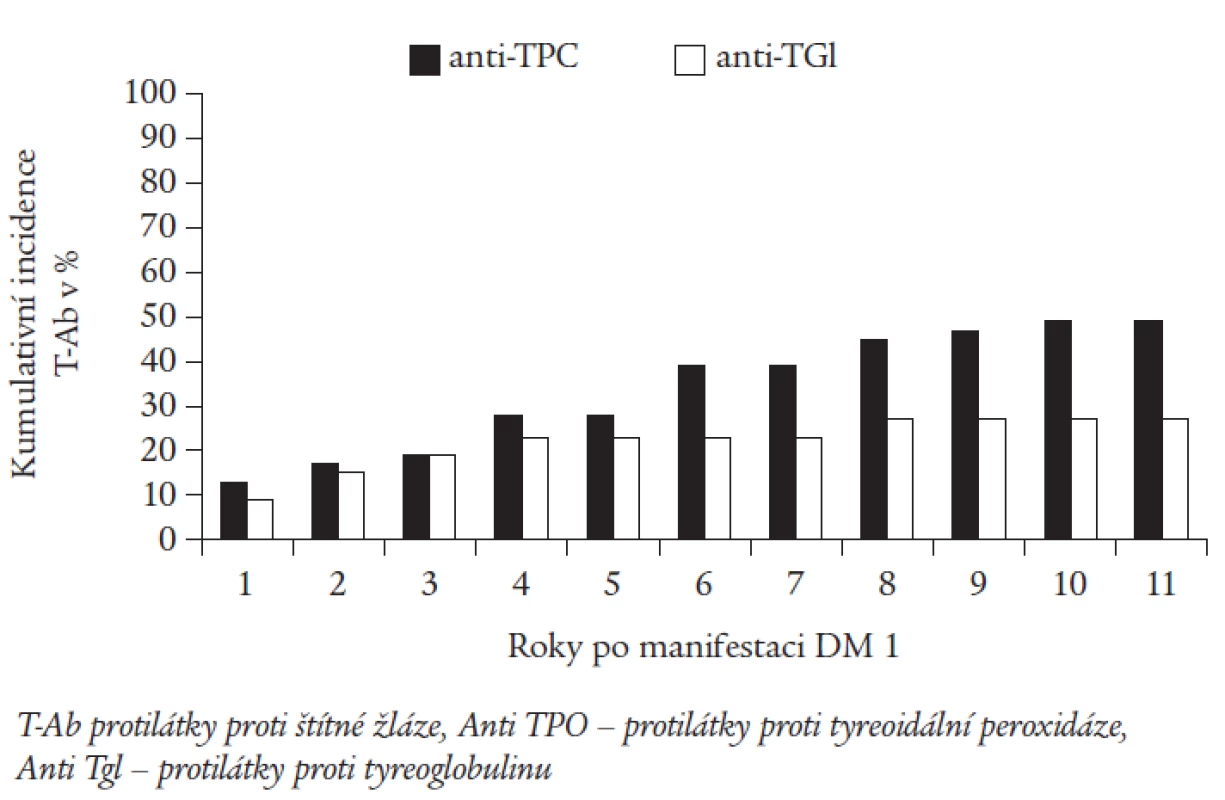
Tab. 3 uvádí zastoupení žen a mužů v jednotlivých skupinách. Je patrné, že ve skupině s výraznou tyreoidální autoimunitou (skupina I) převažují ženy, zatímco ve skupině bez tyreoidální autoimunity (skupina III) mají převahu muži (p < 0,01). Ve skupině II s izolovaným záchytem antiTPO je zastoupení žen a mužů rovnoměrné.
Table 3. Zastoupení mužů a žen v % v jednotlivých skupinách. 
Tab. 4 porovnává výskyt tyreopatie a diabetu u příbuzných 1. a 2. stupně. Tyreopatie byly významně častější v rodinách nemocných ze skupiny I ve srovnání se skupinou III (p < 0,05). Rozdíly ve výskytu diabetu nedosáhly statistické významnosti.
Table 4. Výskyt onemocnění štítné žlázy a diabetu v rodinách nemocných. 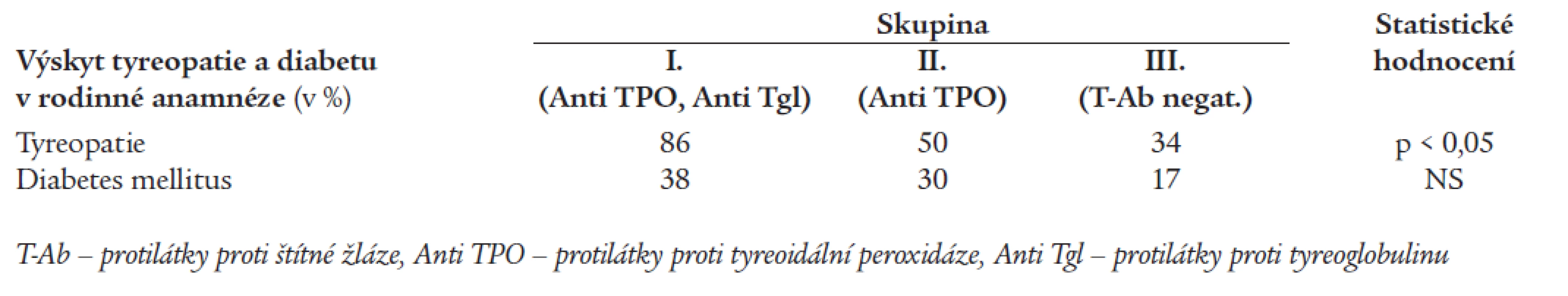
Tab. 5 obsahuje údaje o celkové prevalenci tyreoidální autoimunity během 11letého sledování. Zjištěná prevalence u žen (68 %) je ve srovnání s muži (32 %) signifikantně vyšší (p < 0,05).
Table 5. Celková prevalence tyreoidální autoimunity v průběhu 11 let po manifestaci DM 1. typu. 
Klinický význam opakovaného záchytu protilátek proti štítné žláze (T-Ab)
Tab. 6 srovnává výsledky sonografického a funkčního vyšetření štítné žlázy v době prvého záchytu T-Ab. Z tabulky je zřejmé, že nejvyšší výskyt malých žláz (volum < 25. percentil kontrol) byl ve skupině I. (46 %). U nemocných z druhé skupiny jsme zjišťovali malou žlázu při prvém záchytu T-Ab ve 20 %. Žlázu > 95. percentil kontrol jsme v době záchytu T-Ab zjistili pouze u 20 % nemocných ve skupině II.
Table 6. Stav a funkce štítné žlázy v době prvého záchytu protilátek proti štítné žláze. 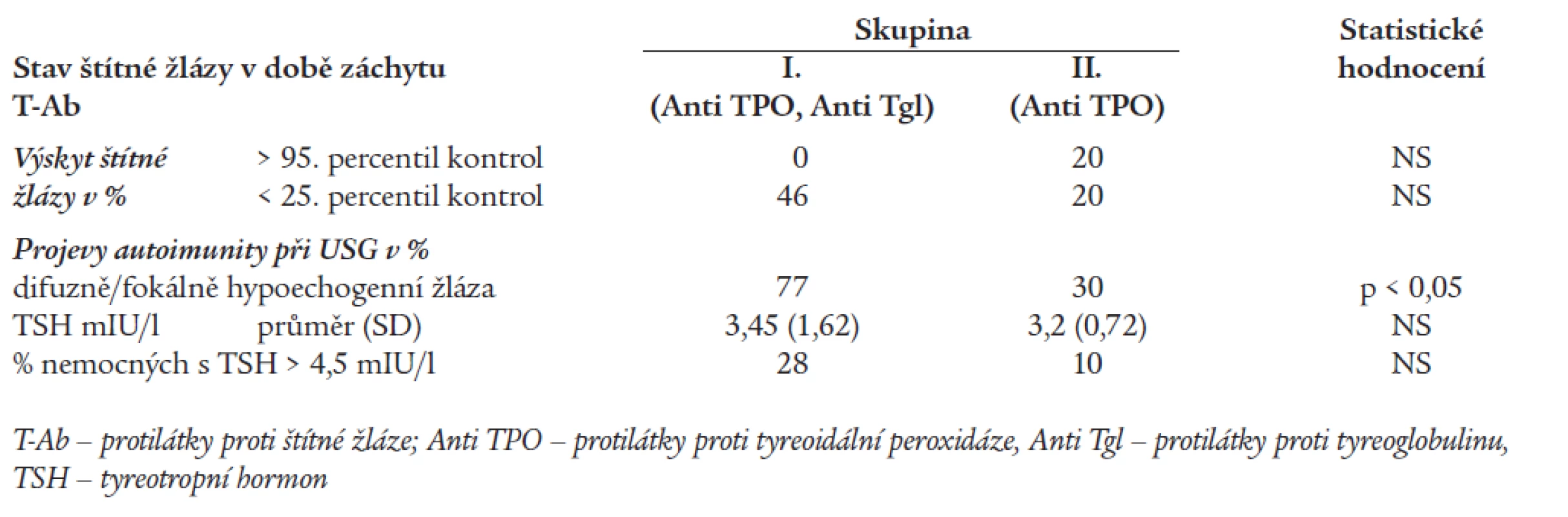
V době prvého záchytu T-Ab byl u 77 % nemocných skupiny I zjišťován sonografický obraz difuzně/fokálně hypoechogenní nehomogenní žlázy. Ve skupině II s izolovanou pozitivitou antiTPO byla zachycena u 30 % nemocných fokální tyreoiditida, patologický USG nález byl tedy signifikantně častější (p < 0,05) ve skupině I. U zbylých nemocných ze skupiny I a II byly sonografické nálezy necharakteristické nebo v mezích normy.
Průměrná hodnota TSH v době prvého záchytu T-Ab byla v prvé skupině 3,45 mIU/l, ve druhé skupině 3,2 mIU/l (rozdíl nevýznamný). Hodnotu TSH > 4,5 mIU/l vykazovalo v době prvého záchytu T-Ab 28 % nemocných ze skupiny I a 10 % ze skupiny II.
Tab. 7 shrnuje hodnocení stavu štítné žlázy 11. rok po manifestaci DM.
Table 7. Stav a funkce štítné žlázy v 11. roce po manifestaci DM. 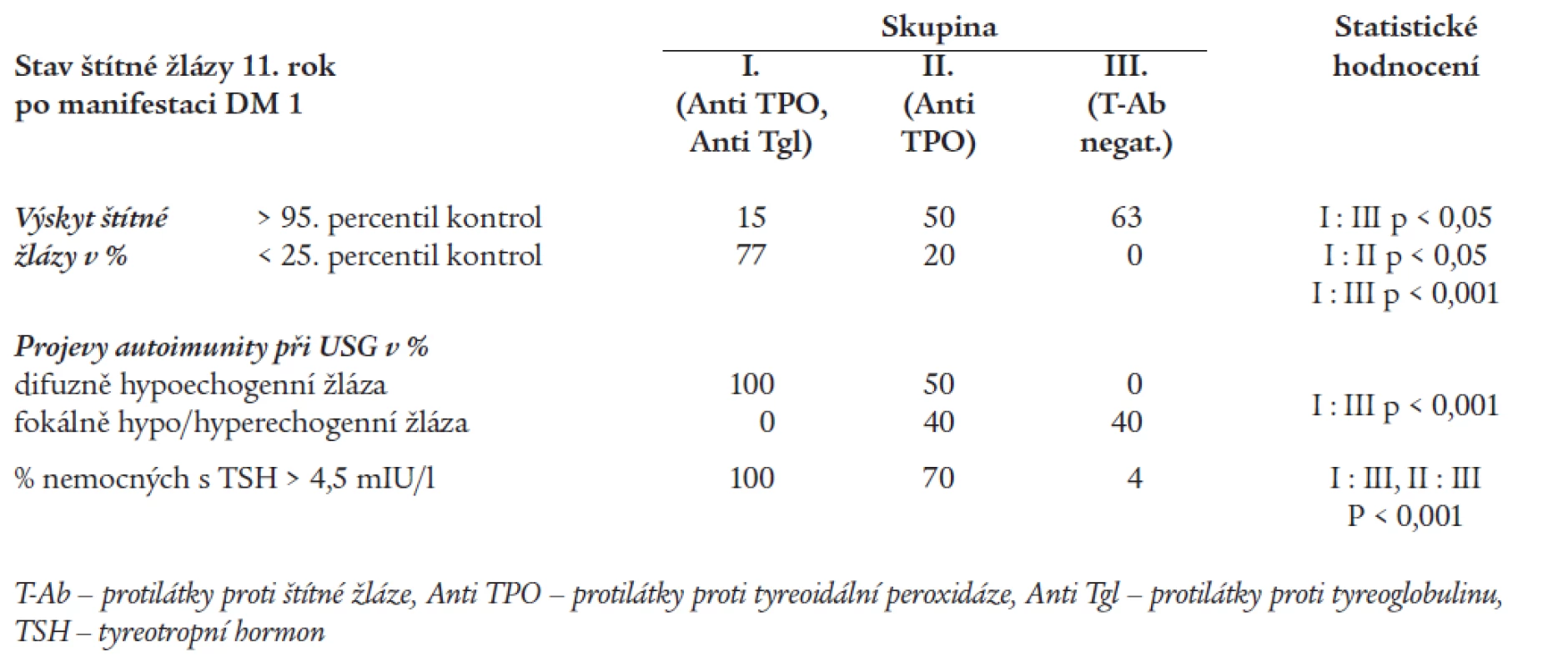
Při kontrolním sonografickém vyšetření po 11 letech jsme ve skupině I s opakovaným záchytem obou T-Ab zjišťovali ve 100 % obraz difuzně hypoechogenní nehomogenní žlázy. U nemocných ze skupiny II s opakovanou izolovanou pozitivitou antiTPO se vyskytovalo celé spektrum sonografických nálezů, od normálního nálezu (u 10 %) přes fokálně nehomogenní a hypoechogenní až po difuzně hypoechogenní obraz, včetně hyperechogenního nehomogenního obrazu fibrózní žlázy. Ve skupině III bez detekované tyreoidální autoimunity byl v 60 % normální sonografický obraz, u zbylých pacientů byla zjišťována nehomogenní hypo/hyperechogenní žláza.
Při volumometrickém hodnocení v skupině I byly žlázy s volumem < 25. percentil kontrol nalezeny v 77 %, ve skupině II ve 20 % (I : II, p < 0,05), ve skupině III jsme žlázy v tomto pásmu vůbec nezastihli (I : III, p < 0,001).
Žlázy s volumem > 95. percentil kontrol byly nalezeny ve skupině I v 15 %, ve skupině II v 50 % a ve skupině III v 63 % (I : III, p < 0,05).
V tab. 7 je uveden i počet zachycených nemocných se zvýšenou hladinou TSH v jednotlivých skupinách v průběhu 11letého sledování. Statisticky významně častěji byla zjišťována hodnota TSH > 4,5 mIU/l u nemocných s prokázanou tyreoidální autoimunitou (skupina I: 100 %, skupina II: 70 %) ve srovnání s nemocnými ve skupině III (4 %) - (I : III, II : III, p < 0,001).
Obr. 2 znázorňuje graficky formou kumulativní incidence záchyt nemocných s TSH > 4,5 mIU/l v jednotlivých letech sledování. 85 % nemocných ze skupiny I dospělo do subklinické hypotyreózy během 5 let od stanovení diagnózy DM, celá skupina do 8. roku. Naopak první nemocní se subklinickou hypotyreózou ve skupině II byli zachyceni až v 9. roce, v 11. roce bylo hypotyreózních v této skupině 70 %. Ve skupině III byla zachycena hypotyreóza během 11 let pouze u jednoho nemocného.
Image 2. Kumulativní incidence nových záchytů TSH > 4,5 mIU/l (v %) v průběhu jednotlivých let po manifestaci diabetu. 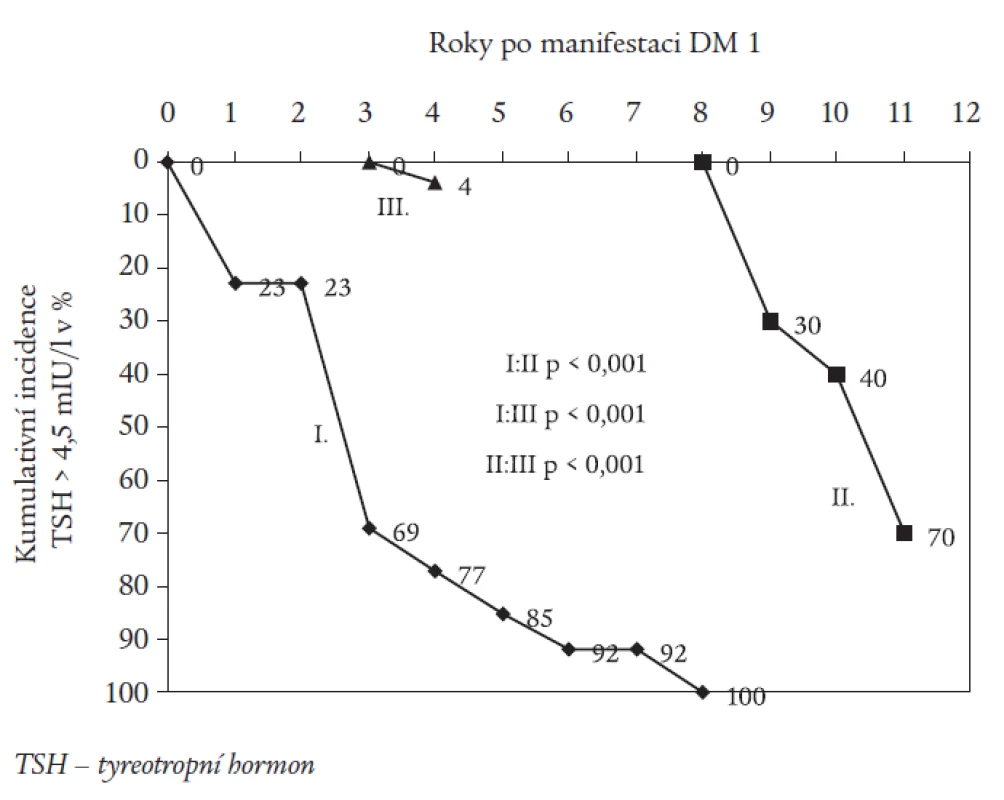
Obr. 3 zobrazuje časové období mezi prvým záchytem T-Ab a vznikem subklinické hypotyreózy. Ve skupině I se u 62 % nemocných rozvinula subklinická hypotyreóza do 1 roku od prvého záchytu T-Ab, nejdelší interval ve skupině byl 4 roky. U nemocných ze skupiny II se rozvinula subklinická hypotyreóza v prvých 4 letech po záchytu antiTPO u 20 %, v následujících 3 letech ale u dalších 50 %. Nejdelší zaznamenaný interval činí zatím 7 let.
Image 3. Kumulativní incidence nových záchytů TSH > 4,5 mIU/l (v %) v jednotlivých letech po záchytu tyreoidálních autoprotilátek (T-Ab). 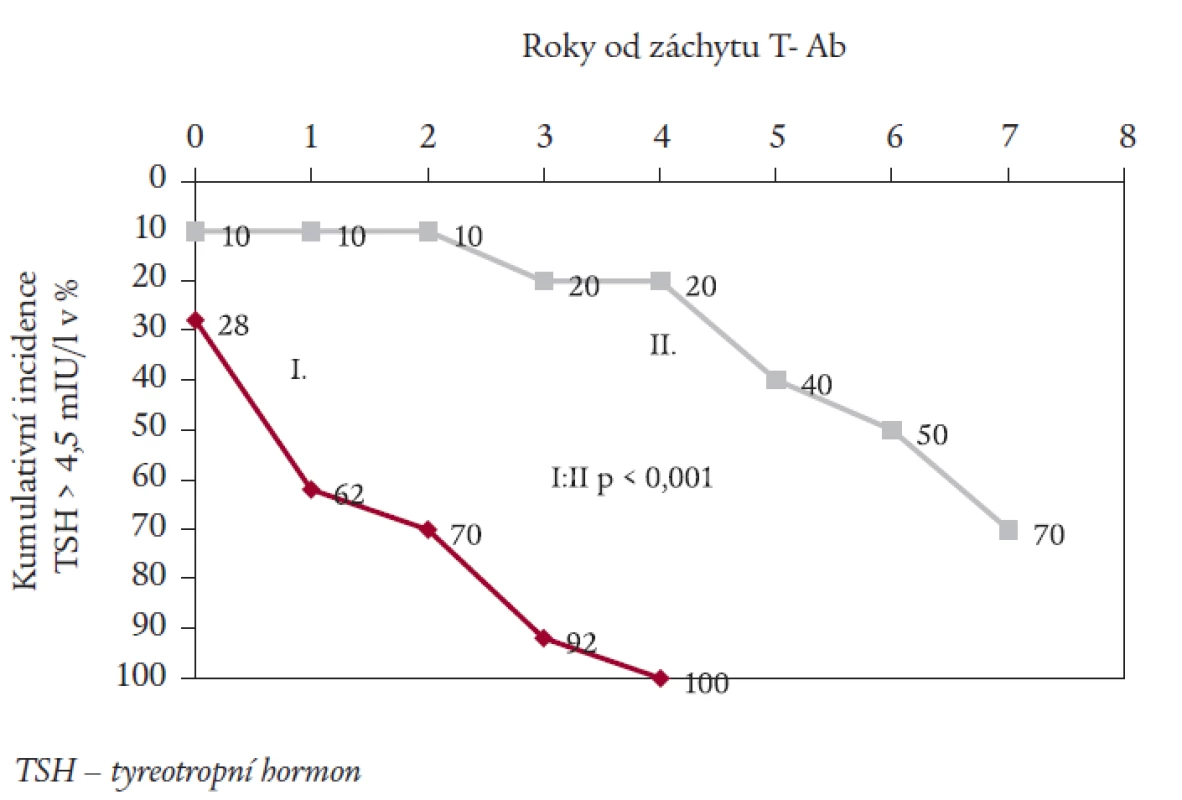
Tab. 8 shrnuje údaje o jodurii v sledovaném souboru. Ve všech 3 skupinách, nezávisle na přítomnosti tyreoidální autoimunity, byly průměrné hodnoty jodurie v pásmu jodového deficitu mírného/středního stupně, krajní hodnoty zasahovaly až do oblasti deficitu těžkého.
Table 8. Hodnoty jodurie v jednotlivých skupinách. 
Diskuse
V době manifestace DM jsme u žádného z mužů neprokázali antiTPO nebo antiTgl, u žen v této době byla prevalence T-Ab v pásmu uváděném literaturou jako rizikové pro vznik a vývoj autoimunitní tyreoiditidy (AIT). Prospektivní charakter studie přinesl nové poznatky o incidenci T-Ab v jednotlivých letech po manifestaci DM i o jejich klinickém významu. Mohli jsme se přesvědčit, že T-Ab zachycené v prvých 5 letech po manifestaci DM 1 mají silnou tendenci ke společnému výskytu v dalších letech. AntiTgl se nikdy nevyskytovala samostatně déle než 75 týdnů, poté vždy společně s antiTPO. Naopak u antiTPO jsme zjišťovali i trvale izolovanou pozitivitu, zvláště pokud byl prvý záchyt až po 5. roce od manifestace DM. Prevalence T-Ab, zejména antiTPO, v průběhu celého období kontinuálně dále narůstala a dosáhla v 10.-11. roce sledování u antiTPO 49 %, u antiTgl 28 %. To odpovídá dosud nemnohým literárním údajům o prevalenci T-Ab u diabetiků 1. typu manifestovaných v dospělém věku. Ve shodě s literaturou je zjištěný signifikantně vyšší výskyt T-Ab u žen [22]. Bližší srovnání s literárními daty je obtížné, většina údajů pochází z průřezových studií a studované soubory bývají zpravidla složeny z nemocných s různě dlouhým trváním diabetu. Z hlediska našich dat, získaných u pacientů se vznikem DM mezi 20.-35. rokem, je zvláště zajímavá populační studie ze Skotska [11], ve které autoři zjišťovali nejvyšší výskyt tyreopatií u diabetiček 1. typu vedle 6. i ve 3. věkové dekádě.
Klinickou závažnost zjišťovaných T-Ab jsme posuzovali podle funkčního a sonografického vyšetření štítné žlázy v jednotlivých skupinách charakterizovaných přítomností T-Ab (skupina I a II), resp. jejich opakovaně negativním nálezem (skupina III).
Ve skupině I s opakovanou pozitivitou antiTPO i antiTgl a tvořené převážně ženami s vysokým výskytem tyreopatie u příbuzných jsme již v době prvého záchytu T-Ab zjišťovali při sonografickém vyšetření u 77 % nemocných difuzně/fokálně hypoechogenní obraz parenchymu charakteristický pro chronickou autoimunitní tyreoiditidu. V 11. roce pak v celé skupině byla prokazována difuzně hypoechogenní žláza. Klinická závažnost této formy AIT byla dána především rychlým vývojem subklinické hypotyreózy (TSH > 4,5 mIU/l), která se u většiny pacientů (62 %) této skupiny rozvinula do 1 roku po prvém záchytu T-Ab, u všech nemocných pak do 4 let. Sonografické vyšetření v době prvého záchytu T-Ab nebylo u žádného nemocného ovlivněno terapií tyreoidálními hormony, tato léčba byla zahajována později až při záchytu hypotyreózních hodnot TSH, a vždy pouze v substitučních dávkách (nikoli supresních). Z těchto důvodu častý nález malé žlázy při volumometrickém vyšetření při prvém záchytu T-Ab (u 46 %) i další zvýšení počtu nemocných s malou žlázou v 11. roce při substituční léčbě (u 77 %) hodnotíme spíše jako důsledek odlišného patogenetického mechanizmu s vývojem atrofické žlázy (ve smyslu Volpeho klasifikace - atrofická forma chronické autoimunitní tyreoiditidy) [20]. Klinický průběh se u většiny pacientů z první skupiny vyznačoval negativním palpačním nálezem na krku a chyběním dalších lokálních symptomů. Lze konstatovat, že bez cíleného vyšetřování zaměřeného na tyreoidální autoimunitní projevy bychom tuto formu AIT včas nediagnostikovali. Vedle rychlého vývoje funkčních i sonografických změn lze považovat za charakteristický rys i časnou manifestaci této formy AIT v prvých 5-6 letech trvání diabetu. Obdobně definovaná skupina nediabetiků sledovaná prospektivně, či verifikovaná histologicky, v literatuře chybí, proto je obtížné naše výsledky blíže porovnávat. Některými anamnestickými údaji a klinickými projevy (převaha žen, vysoký výskyt tyreopatie v rodině, přítomnost dalších autoimunitních onemocnění) se naše nemocné podobají diabetikům ve studii McCanliese s Hashimotovou tyreoiditidou a hypotyreózou [10], a to i přesto, že se v této studii jednalo o diabetiky manifestované v dětském věku a diabetes v době vyšetření trval asi 35 let.
Nemocní s opakovaným izolovaným záchytem antiTPO byli zařazeni do skupiny II. Na rozdíl od skupiny I zde byli zastoupeni rovnoměrně muži i ženy (ženy 23 %, muži 20 %). V této skupině jsme v průběhu sledování zaznamenali vývoj AIT doprovázený postupně až u 50 % nemocných strumou. Při palpačním vyšetření jsme proto nejčastěji nacházeli nebolestivou malou strumu, nezřídka ale jen fokální citlivost až bolestivost v normálně velké žláze. Palpační nález byl ale i negativní. Sonografické vyšetření prokazovalo v době prvého záchytu antiTPO u třetiny nemocných zánětlivé projevy difuzně/fokálního rozsahu. Pro 11. rok bylo typické široké spektrum sonografických nálezů: od normálního nálezu (u 10 %) přes fokálně nehomogenní a hypoechogenní až po difuzně hypoechogenní obraz, včetně hyperechogenního nehomogenního obrazu fibrózní žlázy. Při diferenciálně diagnostických rozpacích o biologické povaze zjištěných ložiskových změn jsme 3krát provedli cytologické vyšetření pomocí FNAB pod sonografickou kontrolou. Vývoj do subklinické hypotyreózy, kterou jsme v druhé skupině v průběhu 11 let zachytili u 70 % nemocných, byl mnohem pozvolnější ve srovnání se skupinou první (prvý záchyt hypotyreózy až 9. rok po manifestaci DM, do 5 let po prvém záchytu antiTPO pouze u 20 %). Dalším rozdílem oproti prvé skupině je i menší závislost manifestace AIT na trvání DM, nové záchyty jsme pozorovali i v 9. a 10. roce po manifestaci DM.
Na základě bioptických a sonografických nálezů publikovaných Marcoccim v roce 1991 [8] u analogické skupiny nediabetických pacientů s perzistující antiTPO můžeme u našich nemocných z druhé skupiny předpokládat nedestruující difuzní zánětlivé postižení, ev. fokální formu AIT. Vývoj do hypotyreózy s vyššími hodnotami TSH pozorovali autoři jen u nemocných s difuzně hypoechogenním sonografickým obrazem. Tento vztah jsme mohli potvrdit i u našich diabetiků ze skupiny I a II. Whickhamská studie [18,19] ukázala, že riziko vývoje manifestní hypotyreózy u nemocných s izolovaným opakovaným záchytem antiTPO je okolo 2,1 %/rok, kumulativní incidence během 20letého sledování u těchto nemocných činila 27 %. Geul [6] během 10letého prospektivního sledování žen středního věku s izolovanou pozitivitou antiTPO zjistil u 24 % vývoj subklinické hypotyreózy (TSH > 4,2 mU/l). Tyto studie u nediabetiků jsou ve shodě s příznivějším klinickým průběhem AIT u diabetiků z naší druhé skupiny. Přesto diabetiky, zejména ženy s izolovanou pozitivitou antiTPO, je třeba systematicky sledovat. Např. data publikovaná v roce 1997 Fernandezem-Sotto [5] ukazují, že prevalence hypotyreózy v graviditě u diabetiček, u kterých byla před otěhotněním zachycena izolovaná antiTPO, je podstatně vyšší ve srovnání s diabetičkami, u kterých antiTPO zachycena nebyla.
Ve skupině III zahrnující 51 % sledovaného souboru a tvořenou převážně muži (muži 68 %, ženy 32 %) jsme neprokázali po celou dobu sledování projevy tyreoidální autoimunity. I v této skupině byl ale stav štítné žlázy posuzovaný sonograficky u vysokého procenta nemocných abnormální ve smyslu zvětšení žlázy se zřetelnou tendencí k nodulizaci. Obdobně např. Bianchi [4] v roce 1995 nachází u více než 30 % dospělých diabetiků 1. typu volum štítné žlázy za 95. percentilem kontrolních nálezů, včetně tendence k výraznější nodulizaci. Steiss [16] referuje 30% prevalenci strumy i u dětských a adolescentních diabetiků. V patogenezi zvýšené prevalence strumy u diabetiků by v českých zemích mohl hrát roli střední až těžký jodový deficit prokazovaný nejen v naší studii (tab. 7), ale i dalšími autory. U diabetiků se vznikem onemocnění > 35 let prokázala jodový deficit nedávno Běhanová [3], u dětských diabetiků již dříve Škvor [17]. Problém strumy u diabetiků by zasloužil systematické studium, aby mohla být prováděna její racionální prevence.
Závěrem lze shrnout, že 11leté sledování dospělých diabetiků 1. typu po stanovení diagnózy prokázalo u 49 % nemocných projevy tyreoidální autoimunity, mezi postiženými výrazně převažovaly ženy (68 % vs 32 % u mužů, p < 0,05) (tab. 5). Tyto výsledky potvrdila i v české populaci literární data o vysoké prevalenci tyreoidální autoimunity u diabetiků s manifestací DM mezi 18. a 35. rokem. Prospektivní charakter studie přinesl některé nové původní poznatky: především se ukázalo, analogicky jako u ostrůvkové autoimunity, že autoimunitní proces projevující se výraznějšími humorálními projevy (perzistence dvou T-Ab) je spojen se závažnějším klinickým průběhem AIT s rychlejším vývojem subklinické hypotyreózy (TSH > 4,5 mIU/l) i časnějšími specifickými sonografickými změnami. Ty u velkého procenta nemocných (77 %) předcházely pozitivitě T-Ab. Tento typ tyreoidální autoimunity jsme typicky zjišťovali u žen s výrazným výskytem tyreopatií u příbuzných 1. a 2. stupně. U nemocných s izolovanou pozitivitou antiTPO klinický průběh i sonografické nálezy dokumentují mírnější průběh AIT, bez výraznější sexuální predispozice. Toto je v souladu se zkušenostmi publikovanými u nediabetiků s izolovaným výskytem antiTPO. Přesto je vhodné připomenout, že v době záchytu antiTPO byly u 30 % nemocných již přítomny sonografické projevy AIT, u 10 % i TSH > 4,5 mIU/l.
V obou skupinách s prokázanou tyreoidální autoimunitou jsme mohli potvrdit význam sonografického vyšetření pro časnou diagnózu tyreoidální autoimunity u dospělých diabetiků, jak na ni upozornila studie Hansena u dětských a adolescentních diabetiků v roce 1999 [7]. V literatuře je u nediabetické populace zmiňován i prediktivní význam sonografického vyšetření pro vývoj hypotyreózy [13]. Podle našich nálezů se zdá možné tuto zkušenost potvrdit i u diabetiků. U diabetiků bez tyreoidální autoimunity, převážně mužů, jsme obdobně jako řada dalších autorů nalezli tendenci ke strumě. Jodový deficit uvažovaný některými autory jako možná příčina vzniku strumy [1] se ale vyskytoval v mírném stupni u všech 3 sledovaných skupin bez statisticky významnějších rozdílů.
doc. MUDr. Karel Vondra, DrSc.
www.endo.cz
e-mail: kvondra@endo.cz
Doručeno do redakce: 14. 6. 2006
Sources
1. Aghini-Lombardi F, Antonangeli L, Martino E et al. The spectrum of thyroid disorders in an iodine-deficient community: the Pescopagano survey. J Clin Endocrionol Metab 1999; 84 : 561-566.
2. Barova H, Perusicova J, Hill M et al. Anti-GAD-positive patients with Type 1 diabetes mellitus have higher prevalence of autoimmune thyroiditis than anti GAD - negative patients with Type 1 and Type 2 diabetes mellitus. Physiol Res 2004; 53 : 279-286.
3. Běhanová M, Zamrazil V, Vondra K et al. Klinická charakteristika tyreopatií u diabetiků středního věku. DMEV 1999; Suppl 1 : 21-22.
4. Bianchi G, Montanari P, Fabbri A et al. Thyroid volume in type 1 diabetes patients without overt thyroid disease. Acta Diabetol 1995; 32 : 49-52.
5. Fernandez-Soto L, Gonzales A, Lobon JA et al. Thyroid peroxidase autoantiboides predict poor metabolic control and need for thyroid treatment in pregnant IDDM women. Diabetes Care 1997; 20 : 1524-1528.
6. Geul KW, van Sluisveld ILL, Grobbee DE et al. The importance of thyroid microsomal antibodies in the development of elevated serum TSH in middle-aged women. Clin Endocrinol 1993; 39 : 275-280.
7. Hansen D, Bennedbaek FN, Hansen LK et al. Thyroid function, morphology and autoimmunity in young patients with insulin-dependent diabetes mellitus. Eur J Endocrinol 1999; 140 : 512-518.
8. Marcocci C, Vitti P, Cetani F. Thyroid ultrasonography helps to identify patients with diffuse lymphocytic thyroiditis who are prone to develop hypothyroidism. J Clin Endocrinol Metab 1991; 72 : 209-213.
9. Matějková-Běhanová M, Zamrazil V, Vondra K et al. Autoimmune thyroiditis in non-obese subjects with initial diagnosis ob Type 2 diabetes mellitus. J Endocrionol Invest 2002; 25 : 779-784.
10. McCanlies E, O´Leary LA, Foley T et al. Hashimoto´s thyroiditis and insulin-dependent diabetes mellitus: differences among individuals with and without abnormal thyroid function. J Clin Endocrinol Metab 1998; 83 : 1548-1551.
11. Perros P, McCrimmon RJ, Shaw G et al. Frequency of thyroid dysfunction in diabetic patients: value of annual screening. Diabetic medicine 1995; 12 : 622-627.
12. Prázný M, Škrha J, Límanová Z et al. Screening for associated autoimmunity in type 1 diabetes mellitus with respect to diabetes control. Physiol Res 2005; 54 : 41-48.
13. Rubello D, Gasparoni P, Rota G et al. Functional meaning of scintigraphic and echographic patterns, and of circulating anti-peroxidase antibodies in asymptomatic chronic thyroiditis. Q J Nucl Med 1996; 40 : 359-364.
14. Sandell EB, Kolthoff IM. Micro determination of iodine by a catalytic method. Mikrochemika Acta 1937 : 19-25.
15. Schroner Z, Lazurova I, Petrovičová J. Autoimunitné tyreopatie u diabetikov. Vnitř Lék 2006; 52 : 137-143.
16. Steiss JO, Otten A, Graef V et al. Thyroid gland ultrasound and urinary iodine excretion in children and adolescents with type I diabetes mellitus. Klin Pediatr 1996; 208 : 327-333.
17. Škvor J. Štítná žláza u 13letých dětí, zdravých, diabetiků a alergiků. Kandidátská disertační práce. Endokrinologický ústav Praha, 1993.
18. Vanderpump MPJ, Tunbridge WMG. The epidemiology of autoimmune thyroid Disease. In: Volpe R. Contemporary Endocrinology: autoimmune endocrinopathies. Totowa (NJ, USA): Humana Press Inc 1999 : 141-162.
19. Vanderpump MPJ, Tunbridge WMG, French JM et al. The incidence of thyroid disorders in the community: a twenty-year follow-up of the Whickham Survey. Clinical Endocrinol 1995; 43 : 55-68.
20. Volpe R. The immunology of human autoimmune thyroid disease. In: Volpe R. Contemporary Endocrinology. Autoimmune Endocrinopathies. Totowa (NJ, USA): Humana Press Inc 1999 : 217-244.
21. Vondra K, Vrbíková J, Ivašková E et al. Výskyt protilátek proti tyreoglobulinu a proti mikrosomům u dospělých diabetiků I. typu a jejich možný klinický význam. Vnitř Lék 1996; 42 : 767-771.
22. Vondra K, Vrbíková J, Dvořáková K. Thyroid gland diseases in adult patients with diabetes mellitus. Minerva endocrinologica 2005; 30 : 217-236.
23. Vondra K, Vrbíková J, Bendlová B et al. Differences in Type I Diabetes Mellitus of Young Adults with and without Thyroid Autoimmunity. Exp Clin Endocrinol Diabetes 2005; 113 : 404-408.
24. Vondra K, Vrbíková J, Šterzl I et al. Thyroid autoantibodies and their clinical relevance in young adults with Type-1 diabetes during the first 12-years after DM 1 onset. J Endocrionol Invest 2004; 27 : 728-732.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2006 Issue 10-
All articles in this issue
-
Změny v zásobení jodem české dospělé populace po eradikaci jodového deficitu a jejich příčiny
Randomizovaná studie dospělé populace dvou regionů České republiky s odstupem 5 let - Tyreoidální autoimunita u dospělých diabetiků 1. typu. Vlastní zkušenosti z 11letého sledování
- Jod a tyreoidální hormony
- Autoimunitní tyreoiditida: vybrané etiopatogenetické mechanizmy
- Mechanizmus vnútrobunkového pôsobenia hormónov štítnej žľazy
- Hormonální poruchy po úrazu mozku
- Hashimotova encefalopatie
- Kongenitální adrenální hyperplazie na podkladě deficitu 3-β-hydroxysteroidní dehydrogenázy
- Subklinické tyreopatie
- Radionuklidové zobrazovací metody používané v endokrinologii
- Přirozené antiglukokortikoidy
- Příspěvek k diskusi o vzájemném vztahu mezi onemocněním mléčné a štítné žlázy
- Testosteron v léčbě svalové slabosti
- Nádory štítné žlázy a Hirschsprungova choroba: desetileté zkušenosti s molekulárně genetickou diagnostikou RET proto-onkogenu
-
Změny v zásobení jodem české dospělé populace po eradikaci jodového deficitu a jejich příčiny
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Hashimotova encefalopatie
- Radionuklidové zobrazovací metody používané v endokrinologii
- Kongenitální adrenální hyperplazie na podkladě deficitu 3-β-hydroxysteroidní dehydrogenázy
- Autoimunitní tyreoiditida: vybrané etiopatogenetické mechanizmy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

